Method Article
الطباعة الحيوية ثلاثية الأبعاد للزراعات المشتركة للخلايا العصبية النجمية المشتقة من iPSC لتطبيقات الفحص
In This Article
Erratum Notice
Summary
هنا ، نقدم بروتوكولا لإنتاج 3D-bioprint cocultures من الخلايا العصبية والخلايا النجمية المشتقة من iPSC. يوضح نموذج الاستزراع المشترك هذا ، الذي تم إنشاؤه داخل سقالة هيدروجيل بتنسيقات 96 أو 384 بئرا ، قابلية عالية للبقاء بعد الطباعة ونمو الخلايا العصبية في غضون 7 أيام ويظهر التعبير عن علامات النضج لكلا النوعين من الخلايا.
Abstract
لكي يكون نموذج الخلية قابلا للتطبيق لفحص الأدوية ، يجب أن يفي النظام بمتطلبات الإنتاجية والتجانس إلى جانب وجود وقت تطوير فعال. ومع ذلك ، فإن العديد من نماذج 3D المنشورة لا تفي بهذه المعايير. هذا بالتالي يحد من فائدتها في تطبيقات اكتشاف الأدوية المبكرة. الطباعة الحيوية ثلاثية الأبعاد (3D) هي تقنية جديدة يمكن تطبيقها على تطوير نماذج ثلاثية الأبعاد لتسريع وقت التطوير وزيادة التوحيد القياسي وزيادة الإنتاجية. هنا ، نقدم بروتوكولا لتطوير نماذج زراعة مشتركة مطبوعة بيولوجيا 3D للخلايا الجذعية متعددة القدرات المستحثة البشرية (iPSC) المشتقة من الخلايا العصبية والخلايا النجمية. يتم تضمين هذه الزراعات المشتركة داخل مصفوفة هيدروجيل من الببتيدات النشطة بيولوجيا ، وبروتينات مصفوفة خارج الخلية كاملة الطول (ECM) ، وبصلابة فسيولوجية تبلغ 1.1 كيلو باسكال. يمكن إنشاء النموذج بسرعة بتنسيقات 96 بئرا و 384 بئرا وينتج متوسط صلاحية ما بعد الطباعة بنسبة 72٪. تظهر نسبة الخلايا النجمية إلى الخلايا العصبية في هذا النموذج على أنها 1: 1.5 ، وهي ضمن النطاق الفسيولوجي للدماغ البشري. تظهر مجموعات الخلايا المطبوعة بيولوجيا 3D هذه أيضا تعبيرا عن علامات نوع الخلايا العصبية الناضجة ونمو إسقاطات الخلايا العصبية والنجمية في غضون 7 أيام من الثقافة. نتيجة لذلك ، هذا النموذج مناسب للتحليل باستخدام أصباغ الخلايا وتقنيات التلوين المناعي جنبا إلى جنب مع مقايسات نمو الخلايا العصبية. إن القدرة على إنتاج هذه النماذج التمثيلية من الناحية الفسيولوجية على نطاق واسع تجعلها مثالية للاستخدام في فحوصات فحص الإنتاجية المتوسطة إلى العالية لأهداف علم الأعصاب.
Introduction
تتوسع الأبحاث في أمراض الجهاز العصبي المركزي (CNS) في صناعة اكتشاف الأدوية1. ومع ذلك ، فإن العديد من أمراض الجهاز العصبي المركزي السائدة مثل الصرع والفصام ومرض الزهايمر لا تزال لا تحتوي على علاجات علاجية2،3،4. يمكن أن يعزى عدم وجود علاجات فعالة عبر أمراض الجهاز العصبي المركزي ، جزئيا على الأقل ، إلى عدم وجود نماذج دقيقة في المختبر للدماغ5. وقد أدى ذلك إلى فجوة انتقالية بين النماذج الحالية في المختبر والبيانات في الجسم الحي وعنق الزجاجة اللاحق في الجهود البحثية.
مدفوعة بهذه الفجوة الانتقالية ، كانت هناك زيادة كبيرة في تطوير نماذج خلايا 3D الجديدة خلال السنوات الأخيرة ، بما في ذلك الكائنات العضوية العصبية ، والكائنات العصبية، والنماذج القائمة على السقالات6. يساعد الهيكل ثلاثي الأبعاد لهذه النماذج في تلخيص البيئة الدقيقة العصبية ، بما في ذلك الضغوط الميكانيكية الحيوية ، والاتصالات بين الخلايا والخلايا ، والمصفوفة خارج الخلية في الدماغ (ECM) 7. ECM في الدماغ هو عنصر ديناميكي في الفيزيولوجيا العصبية يشغل المساحة بين أنواع الخلايا العصبية ، بما في ذلك الخلايا العصبية والخلايا النجمية والخلايا قليلة التغصن والوحدة الوعائية العصبية7. وقد تبين أن تلخيص ECM في الدماغ يؤثر على مورفولوجيا الخلايا العصبية وإطلاق الخلايا العصبية ، وقد أظهرت العديد من نماذج 3D المعقدة للدماغ ترسب بروتينات ECM حسب أنواع الخلايا العصبية8،9،10،11. تتكون النماذج القائمة على السقالات من ثقافات عصبية ناضجة معلقة في مصفوفة هيدروجيل اصطناعية أو بيولوجية مسامية تمثل ECM12 في الدماغ. على عكس الأنظمة العضوية والكروية ، تسمح نماذج 3D القائمة على السقالات بتخصيص بروتينات ECM الموجودة ولها فائدة إضافية تتمثل في قابلية ضبط صلابة الهيدروجيل لتقليد الضغوط الميكانيكية الحيوية13,14.
على الرغم من أن الغالبية العظمى من النماذج العصبية ثلاثية الأبعاد تظهر زيادة تلخيص البيئة المكروية للدماغ ، إلا أن جميع النماذج ليست مناسبة تماما لتنفيذ تطبيقات اكتشاف الأدوية15. لكي يتم تنفيذ نموذج ثلاثي الأبعاد في العمليات الصناعية ، يجب أن يفي النظام بمتطلبات الإنتاجية لفحص التطبيقات وأن يكون له وقت تطوير قصير نسبيا16. 3D Bioprinting هي تقنية جديدة توفر إمكانية إنشاء نماذج عصبية قائمة على سقالات ثلاثية الأبعاد مع وقت تطوير سريع ، وزيادة الإنتاجية ، ومستويات أعلى من التحكم الدقيق ، إلى جانب إزالة التباين الناجم عن الخطأ البشري17. يقدم هذا البروتوكول نموذج 3D للثقافة المشتركة للخلايا العصبية البشرية المشتقة من iPSC والخلايا النجمية في سقالة هيدروجيل. تحتوي سقالة الهيدروجيل هذه على ببتيدات نشطة بيولوجيا ممثلة من الناحية الفسيولوجية (RGD ، IKVAV ، YIGSR) وبروتينات ECM ضمن صلابة ميكانيكية حيوية محاكاة. تشتمل بروتينات ECM كاملة الطول هذه على laminin-211 كامل الطول وحمض الهيالورونيك ، الوفير في القشرة البشرية ، مع صلابة تبلغ 1.1 كيلو باسكال بما يتماشى مع القياسات في الجسم الحي 18. تم تصميم هذا النموذج مع التطبيق العملي لاكتشاف الأدوية ، ويتم إنشاؤه باستخدام طابعة حيوية ثلاثية الأبعاد بتنسيق لوحة 96 بئرا أو 384 بئرا مناسبة لتحليل الفحص باستخدام تقنيات التصوير مع أصباغ الخلايا والأجسام المضادة ، جنبا إلى جنب مع فحوصات نمو الخلايا العصبية. تظهر الخلايا تعبيرا عن علامات نوع الخلايا العصبية ونمو الإسقاطات العصبية والنجمية في غضون 7 أيام من الثقافة. وبالتالي ، سيقدم هذا البروتوكول منهجية لتطوير نموذج زراعة عصبية 3D عالي الإنتاجية للاستخدام في تطبيقات اكتشاف الأدوية.
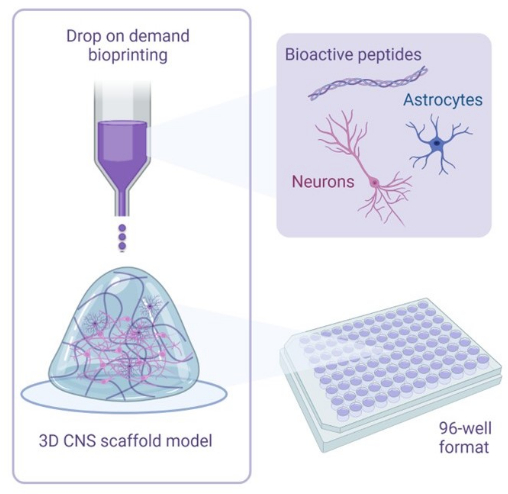
الشكل 1: نظرة عامة توضيحية على المنهجية المستخدمة في الثقافات المشتركة للطباعة الحيوية ثلاثية الأبعاد. يتم دمج الخلايا العصبية والخلايا النجمية البشرية المشتقة من iPSC مع محاليل المنشط والحبر الحيوي التي تحتوي على الببتيدات النشطة بيولوجيا ويتم طباعتها بيولوجيا على سقالات هيدروجيل بتنسيقات 96 بئرا أو 384 بئرا باستخدام تقنية الطباعة الحيوية عند الطلب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. الطباعة الحيوية لنماذج 3D
- إنشاء خريطة لوحة وملف طباعة
- قبل إنشاء النموذج ، قم بإنشاء خريطة لوحة وبروتوكول وملف طباعة باستخدام برنامج خريطة اللوحة. افتح برنامج خريطة اللوحة وحدد خيار خلايا الثقافة في 3D .
- حدد نوع النموذج المراد طباعته بيولوجيا من الخيارات المتاحة في القائمة المنسدلة ؛ تم التحقق من صحة هذا النموذج في تنسيقات نموذج التصوير ونموذج HTP . حدد طراز التصوير لألواح 96 بئرا وHTP لألواح 384 بئرا.
- في نافذة تحديد المصفوفة ، حدد هيدروجيل Px02.53، الذي يحتوي على بروتينات Laminin-211 وحمض الهيالورونيك، مع ببتيدات IKVAV و RGD و YIGSR.
- في النافذة المنبثقة ، أدخل أنواع الخلايا مثل الخلايا العصبية والخلايا النجمية Glutamatergic وأدخل كثافة الخلية على أنها 20 مليون خلية / مل.
- استخدم البرنامج لتصميم خريطة اللوحة المطلوبة من خلال تسليط الضوء على الآبار على اللوحة التي تظهر على الشاشة. تضمين ما لا يقل عن 1 صف من التحكم 2D على البلاستيك في التصميم. يتكون التحكم 2D في الآبار البلاستيكية من خلايا مودعة مباشرة في البئر دون أي سقالة هيدروجيل ؛ قم بتغطية هذه الآبار وفقا للخطوة 1.2.
- تأكد من تغيير نموذج اللوحة المدرج في الجزء العلوي من النافذة إلى نموذج اللوحة المقصود للاستخدام (انظر جدول المواد).
- قم بتنزيل البروتوكول وطباعة الملف لخريطة اللوحة باستخدام أزرار التنزيل واحفظها على الكمبيوتر المرتبط بالطابعة الحيوية.
- طلاء التحكم 2D على الآبار البلاستيكية
- قبل الطباعة ب 24 ساعة على الأقل ، قم بتغطية الآبار لنماذج التحكم ثنائية الأبعاد لالتصاق الخلايا ونموها. لا تتطلب آبار نموذج 3D أي طلاء مسبق. يجب تنفيذ جميع العمليات في خزانة للسلامة الأحيائية ما لم ينص على خلاف ذلك. يمكن طلاء الألواح وإعدادها حتى 7 أيام قبل الطباعة.
- اصنع 50 مل من 1x بورات عازلة عن طريق تخفيف 2.5 مل من محلول مخزون البورات 20x مع 47.5 مل من dH2O. المعقم
- أضف 100 ميكرولتر من 50٪ (وزن / حجم) بولي إيثيلين (PEI) إلى 50 مل من 1x بورات عازلة لإنشاء محلول PEI 0.1٪ (وزن / حجم) ومرشح معقم من خلال مرشح 0.22 ميكرومتر.
- أضف 0.1٪ (w / v) حل PEI لكل بئر تحكم ثنائي الأبعاد ، كما هو موضح في خريطة اللوحة التي تم إنشاؤها في الخطوة 1.1. أضف 100 ميكرولتر / بئر في حالة استخدام صفيحة 96 بئرا أو 25 ميكرولتر / بئر إذا كنت تستخدم صفيحة 384 بئرا.
- احتضان اللوحة لمدة 2 ساعة عند 37 درجة مئوية قبل استنشاق محلول PEI بنسبة 0.1٪ (وزن / حجم) وشطف الآبار 5x باستخدام PBS. دع الآبار تجف تماما في خزانة السلامة الحيوية.
- قم بتخفيف 100 ميكرولتر من محلول اللامينين 1 مجم / مل في 5 مل من الوسط العصبي القاعدي. أضف 100 ميكرولتر إلى كل بئر تحكم ثنائي الأبعاد في حالة استخدام لوحة 96 بئرا أو 25 ميكرولتر في حالة استخدام لوحة 384 بئر. احتضان لمدة 4 ساعات عند 37 درجة مئوية.
- في حالة تخزين الأطباق ، اترك محلول اللامينين في مكانه بعد الحضانة واحفظه في درجة حرارة 4 درجات مئوية. سخن الألواح لمدة 1 ساعة عند 37 درجة مئوية قبل الاستخدام.
- الطباعة الحيوية 3D لنماذج الثقافة المشتركة
- حافظ دائما على تقنية معقمة عند استخدام الطابعة الحيوية ، وامسح القفازات والخراطيش وألواح الثقافة بنسبة 70٪ EtOH قبل وضعها داخل الطابعة. ما لم ينص على خلاف ذلك ، قم بإجراء جميع العمليات خارج الطابعة الحيوية في خزانة السلامة البيولوجية.
- قم بتشغيل الضاغط الخاص بالطابعة الحيوية وقم بتهيئة الطابعة عن طريق تحديد الزر تهيئة في برنامج الطابعة الحيوية. بمجرد بدء تدفق الهواء في الطابعة، امسح الأسطح الموجودة داخل الطابعة باستخدام مسح EtOH بنسبة 70٪.
- في يوم الطباعة، قم بإجراء عملية الإضاءة الخضراء الإرشادية لبدء اليوم لضمان حالة الفوهة الصحيحة لتشغيل الطباعة (الحد الأدنى لحالة الفوهة 2A2B).
- خذ خرطوشة طابعة حيوية من العبوة المعقمة ، وأضف 20 مل من dH2O المعقم في المقصورة A ، وأضف 6 مل من 70٪ EtOH المصفى المعقم إلى المقصورات B1-4. أدخل الخرطوشة في حامل الخرطوشة الأيسر داخل الطابعة الحيوية وضع غطاء اللوحة في حامل الغطاء المخصص.
- حدد زر Greenlighting على الشاشة الرئيسية للبرنامج وتأكد على البرنامج من أن الخرطوشة موجودة في مكانها داخل الطابعة الحيوية وأن الغطاء قد تمت إزالته. ابدأ عملية الإضاءة الخضراء.
- عندما يطلب منك البرنامج ، تأكد من أنه لا يمكن رؤية أي قطرات متسقة من الإبر اليسرى أو اليمنى. بعد ذلك ، عندما يطلب منك البرنامج ، تأكد من وجود الماء في مقصورات B7 و B8.
- بعد أن تكمل الطابعة الحيوية خطوة الإضاءة الخضراء ذاتية التوجيه ، أدخل صفيحة سفلية مسطحة معقمة غير مطلية ب 96 بئرا (منفصلة عن اللوحة المطلية للمزارع المشتركة للطباعة الحيوية) وأدخل هذه اللوحة الجديدة في قسم حامل اللوحة اليمنى من الطابعة الحيوية عندما يطلب منها البرنامج ذلك. تأكد من ضبط حامل اللوحة على لوحة عالية الارتفاع ، وإزالة الغطاء ووضعه في حامل الغطاء المخصص قبل البدء في الخطوة التالية.
- ستقوم الطابعة الحيوية بإيداع قطرات الماء في كل بئر من لوحة 96 بئرا. بمجرد الانتهاء ، ضع اللوحة من الطابعة الحيوية وتأكد من وجود قطرات الماء في كل بئر من اللوحة.
- تخلص من لوحة 96 بئرا المستخدمة للإضاءة الخضراء واسمح للطابعة الحيوية بإنهاء عملية الإضاءة الخضراء. بمجرد اكتماله ، سيوضح البرنامج حالة فوهة الطابعة الحيوية ويؤكد أن الطابعة الحيوية جاهزة لطباعة النماذج. ضع الغطاء على خرطوشة الطباعة وقم بإزالته إلى خزانة السلامة البيولوجية للخطوات التالية.
- باستخدام برنامج الطابعة الحيوية ، قم بتحميل ملف الطباعة (الذي تم إنشاؤه في الخطوة 1.1) في البرنامج باستخدام زر برنامج Print Run وافتح ملف pdf بروتوكول الطباعة.
- استرجع الحبر الحيوي وسوائل المنشط ، كما هو موضح في بروتوكول الطباعة pdf ، من -20 درجة مئوية وقم بالذوبان في درجة حرارة الغرفة (RT) لمدة 40 دقيقة. بالنسبة لمصفوفة هيدروجيل Px02.53 ، سيشمل ذلك: 1x قارورة F32 ، 1xvial F3 ، 1x قارورة F261 ، 1x قارورة F299. لا تذوب الحبر الحيوي والسوائل المنشطة في اليدين أو الحمامات المائية.
- أحضر 50 مل من الوسائط الكاملة مع مثبط الدوكسيسيكلين و ROCK (وسائط كاملة + DOX / ROCKi) (انظر الخطوة 2.2) إلى RT أثناء ذوبان الحبر الحيوي والسوائل المنشطة.
- بمجرد إذابة الأحبار الحيوية والمنشطات ، قم بإعداد خرطوشة الطباعة وفقا للتعليمات الواردة في الصفحتين الأخيرتين من بروتوكول الطباعة الذي تم إنشاؤه pdf. سيتم إعادة استخدام خرطوشة طابعة الإضاءة الخضراء لمراحل طباعة النموذج.
- تأكد من وجود 40 مل من dH2O في الحجرة A1 و 8 مل من 70٪ EtOH في المقصورتين B1 و B2. أضف 1.2 مل من المنشط F32 إلى C1 ، و 1.2 مل من F3 إلى C2 ، و 200 ميكرولتر من F261 إلى C4.
- استرجع PEI واللوحة المطلية باللامينين من الحاضنة وضعها داخل الطابعة في حجرة حامل اللوحة اليمنى. لا تقم بإزالة محلول وسائط laminin من الآبار في هذه المرحلة. تأكد من ضبط حجرة حامل اللوحة على لوحة منخفضة الارتفاع وإزالة الغطاء وفي حامل الغطاء.
- ضع خرطوشة الطباعة في الطابعة الحيوية ، وتأكد من إزالة الغطاء ووضعه في الحامل ، وابدأ تشغيل الطباعة على البرنامج عن طريق تحديد زر Print Inert Base في برنامج bioprinter.
- أثناء طباعة القاعدة الخاملة ، استرجع قوارير الخلايا العصبية والخلايا النجمية من تخزين النيتروجين السائل ، وقم بالذوبان ، وأعد التعليق وفقا للتعليمات الواردة في القسم 2.
- بمجرد إذابة الخلايا ، وإضافة 8 مل من الوسائط الكاملة + DOX / ROCKi إلى كل نوع خلية على حدة (وفقا للقسم 2) ، قم بطرد الخلايا عند 300 × جم لمدة 5 دقائق في RT.
- استنشاق المادة الطافية وإعادة تعليق كلا النوعين من الخلايا بشكل منفصل في 1 مل من الوسائط الكاملة + DOX / ROCKi.
- أضف 20 ميكرولتر من معلق الخلية إلى 20 ميكرولتر من التريبان الأزرق واخلطها قبل عد الخلايا لتحديد تركيز الخلية القابل للحياة لكل مل لكل نوع من أنواع الخلايا.
- الجمع بين ما مجموعه 3 ملايين الخلايا العصبية glutamatergic مع 1 مليون الخلايا النجمية في أنبوب 15 مل. أضف وسائط لإنشاء حجم إجمالي قدره 8 مل.
- أجهزة الطرد المركزي الخلايا في 300 × ز لمدة 5 دقائق في RT.
- نضح أكبر قدر ممكن من المادة الطافية دون إزعاج حبيبات الخلية وإعادة تعليق حبيبات الخلية في 200 ميكرولتر من سائل المنشط F299.
- لاحظ أن السائل المنشط لزج. ماصة صعودا وهبوطا لإعادة تعليق الحبيبات بالكامل. أنواع الخلايا حساسة. قلل القص والفقاعات باستخدام طرف ماصة عريض التجويف وتقنية السحب العكسي. ماصة صعودا وهبوطا بقوة لا يزيد عن 3 مرات لمنع فقدان الخلايا.
- بمجرد الانتهاء من طباعة المرحلة الأساسية الخاملة ، ضع الأغطية على الخرطوشة ولوحة الاستزراع ، وقم بإزالتها من الطابعة الحيوية وضعها في خزانة السلامة الحيوية.
- أضف 200 ميكرولتر من تعليق الخلية في F299 إلى البئر C3 لخرطوشة الطباعة ، وأعد إدخال الخرطوشة في الطابعة الحيوية ، وقم بإزالة الغطاء ، وضعه في حامل الغطاء. لا تقم بإعادة إدخال لوحة الثقافة بعد.
- ابدأ مرحلة نماذج الطباعة من تشغيل الطباعة. أثناء قيام الطابعة الحيوية بتحضير السوائل ، قم بإزالة محلول وسائط laminin من آبار التحكم ثنائية الأبعاد للوحة واستبدلها ب 150 ميكرولتر من الوسائط الكاملة + DOX / ROCKi في كل بئر تحكم ثنائي الأبعاد إذا كنت تستخدم صفيحة 96 بئرا و 50 ميكرولتر من الوسائط الكاملة + DOX / ROCKi في حالة استخدام لوحة 384 بئرا.
- بعد تحضير السوائل ، أدخل لوحة استهداف الطباعة الحيوية في الطابعة الحيوية ، وقم بإزالة الغطاء ، وضعه في حامل الغطاء.
- ابدأ عملية استهداف الطابعة الحيوية.
- عندما يطلب منك برنامج الطباعة الحيوية ، قم بإزالة لوحة الاستهداف من الطابعة الحيوية.
- استخدم الدليل لتحديد المكان الذي يمكن فيه ملاحظة القطرات على اللوحة. أعد إدخال لوحة الاستهداف في الطابعة الحيوية وكرر عملية طباعة القطيرات واختيارها.
- عند المطالبة ، قم بإزالة لوحة الاستهداف مرة أخرى ، ثم استبدلها بلوحة زراعة الخلايا (التي تحتوي على وسائط في آبار التحكم ثنائية الأبعاد وفقا للخطوة 1.3.25). تأكد من إيقاف غطاء لوحة الثقافة ووضعه في الحامل. ستنتهي الطابعة الحيوية من طباعة النموذج.
- بمجرد اكتمال طباعة النموذج ، اتبع طرق زراعة الخلايا في القسم 2 (الخطوة 2.8) لإضافة وسائط إلى الآبار.
- ابدأ عملية تنظيف الطابعة الحيوية ، وبمجرد اكتمالها ، تخلص من الخراطيش والسوائل المتبقية وفقا لبروتوكولات المختبر.
2. ثقافة الخلية
- يتم إنشاء النماذج باستخدام قارورة واحدة من الخلايا العصبية glutamatergic (>5 مليون خلية لكل قارورة) وقارورة واحدة من الخلايا النجمية (>1 مليون خلية لكل قارورة).
- سخني الحمام المائي إلى 37 درجة مئوية.
- نقل كل من قارورة الخلايا إلى المختبر على الثلج الجاف ومغمورة في حمام مائي مباشرة بعد إزالتها من الثلج الجاف. ذوبان كل قارورة في وقت واحد.
- قم بإزالة القوارير من الحمام المائي عندما تبقى بلورة ثلجية صغيرة فقط ؛ سيستغرق هذا حوالي 3 دقائق بعد الغمر. لا تدور أو تخلط الخلايا في حمام مائي.
- رش القوارير بنسبة 70٪ EtOH وانقلها إلى خزانة السلامة الحيوية.
- أضف 500 ميكرولتر من الوسائط الكاملة + DOX / ROCKi بالتنقيط في كل قنينة قبل نقل كل تعليق إلى أنابيب منفصلة سعة 15 مل.
- قم بتعبئة الوسائط في كل أنبوب إلى 8 مل وتابع خطوات الطباعة الحيوية وفقا للخطوة 1.3.
- باتباع نماذج الطباعة الحيوية (الخطوة 1.3) ، أضف على الفور وسائط كاملة + DOX / ROCKi إلى جميع آبار الزراعة المشتركة ثلاثية الأبعاد وضع النماذج في حاضنة عند 37 درجةمئوية و 5٪ CO2. في حالة استخدام لوحة 96 بئرا ، أضف 150 ميكرولتر من الوسائط لكل بئر ؛ في حالة استخدام لوحة 384 بئر ، استخدم 50 ميكرولتر من الوسائط لكل بئر.
- لا يلزم إجراء تغييرات في الوسائط لأول 48 ساعة من الثقافة.
- عند إجراء تغييرات الوسائط على عناصر التحكم والنماذج ثنائية الأبعاد ، يجب توخي الحذر لمنع إحداث إجهاد ميكانيكي ، والذي يمكن أن يفصل ثقافات 2D أو يتسبب في تشوه الهيدروجيل. قم بإجراء شفط الوسائط وإضافتها ببطء باستخدام ماصة دقيقة تشير إلى جانب البئر.
- بعد 48 ساعة ، قم بإجراء تغيير وسائط بنسبة 90٪ على جميع الآبار وإزالة ROCKi من تكوين الوسائط (انظر الخطوة 2.14).
- بعد 96-h ، قم بإجراء تغيير وسائط إضافي بنسبة 90٪ على جميع الآبار لإزالة DOX من تكوين الوسائط (انظر الخطوة 2.14).
- بعد تغييرين بنسبة 90٪ في الوسائط عند 48 ساعة و 96 ساعة ، قم بإجراء تغييرات وسائط بنسبة 50٪ كل 48 ساعة ، حيث يتم استنشاق 50٪ من الوسائط واستبدالها بوسائط كاملة جديدة
- التركيب الإعلامي:
- وسائط كاملة: وسائط عصبية قاعدية مع 1x GlutaMAX ، 1x B27 ، 12.5 نانومتر 2-ميركابتوإيثانول ، 10 نانوغرام / مل NT3 ، 5 نانوغرام / ميكرولتر BDNF.
- الوسائط الكاملة بالإضافة إلى الدوكسيسيكلين (DOX): وسائط عصبية قاعدية مع 1x GlutaMAX ، 1x B27 ، 12.5 نانومتر 2-ميركابتوإيثانول ، 10 نانوغرام / مل نيوروفين -3 (NT3) ، 5 نانوغرام / ميكرولتر عامل التغذية العصبية المشتق من الدماغ (BDNF) ، و 1 ميكروغرام / مل دوكسيسيكلين.
- الوسائط الكاملة بالإضافة إلى مثبط DOX / ROCK (ROCKi): وسائط عصبية قاعدية مع 1x GlutaMAX ، 1x B27 ، 12.5 نانومتر 2-ميركابتوإيثانول ، 10 نانوغرام / مل NT3 ، 5 نانوغرام / ميكرولتر BDNF ، 1 ميكروغرام / مل دوكسيسيكلين ، ومثبط 10 ميكرومتر ROCK.
3. تحليل نمو الخلايا العصبية
- ضع الخلايا في مجهر الخلية الحية لتصوير برايت فيلد مباشرة بعد إضافة الوسائط بعد الطباعة الحيوية.
- استخدم برنامج المجهر لجدولة الخلايا ليتم تصويرها بتكبير 4x في كل بئر ، بما في ذلك عناصر التحكم ثنائية الأبعاد ، كل 12 ساعة لمدة 7 أيام على الأقل.
- قم بإجراء تغييرات الوسائط كل 48 ساعة ، كما هو مفصل في القسم 2 ، مع وضع الخلايا مرة أخرى في المجهر بعد تغيير الوسائط في كل مرة.
- بعد 7 أيام من البيانات ، قم بتصدير الصور من البرنامج بتنسيق .jpg
- استيراد جميع الصور .jpg إلى برنامج ImageJ وتحويل الملفات إلى تنسيق 8 بت. قم بتحميل المكون الإضافي NeuronJ وتتبع نمو الخلايا العصبية في الصور ، بما في ذلك نقاط الفرع ، باستخدام أداة التتبع.
- استخدم بيانات تتبع الخلايا العصبية التي تم إنشاؤها من NeuronJ لرسم نمو الخلايا العصبية بمرور الوقت.
4. تحليل صلاحية الخلية
- في كل نقطة زمنية مدتها 24 ساعة في الاستزراع ، قم بتلطيخ 3 آبار أو أكثر لتحليل صلاحية الخلية باستخدام مجموعة صلاحية حية / ميتة. كرر هذه الخطوة في نقاط زمنية 24 ساعة أو 48 ساعة طوال مدة الدراسة.
- قم بإعداد وسائط الكاشف الحية / الميتة عن طريق تعليق كاشف الخلايا الحية (1x Calcein-AM) وكاشف الخلايا الميتة (1x ethidium homodimer-1) و 1x صبغة نووية للخلية الحية (Hoechst 33342) في 10 مل من وسائط المصل المخفضة بدون الفينول الأحمر (Opti-MEM) قبل 30 دقيقة من التصوير. دع وسائط الكاشف الحية / الميتة تأتي إلى RT. قم بتخزين وسائط الكاشف الحية / الميتة بعيدا عن الضوء المباشر بسبب التبييض الفلوري.
- قم بإزالة الوسائط من 3 آبار تحتوي على نماذج خلايا / عناصر تحكم 2D ، مما يمنع بعناية اضطراب الهلام. اغسل نماذج الخلايا مرة واحدة باستخدام برنامج تلفزيوني معقم RT. أضف 100 ميكرولتر من وسائط الكاشف الحي / الميت إلى كل بئر للحصول على صفيحة 96 بئرا أو 25 ميكرولتر للوحة 384 بئرا.
- احتضان النماذج لمدة 30 دقيقة عند 37 درجة مئوية و 5٪ CO2.
- بعد الحضانة ، تكون النماذج جاهزة للتصوير. قم بإجراء التصوير على أي مجهر قياسي بقنوات إثارة حمراء (647 نانومتر ، خلايا ميتة) وخضراء (488 نانومتر ، خلايا حية) وزرقاء (405 نانومتر ، صبغة نووية). للحصول على أفضل النتائج في نماذج 3D ، نماذج الصور باستخدام مجهر متحد البؤر عالي المحتوى وتنفيذ التصوير باستخدام وظيفة Z-stack عند تكبير 4x أو 10x.
ملاحظة: في هذه الدراسة ، تم تصوير نماذج الخلايا باستخدام INCell Analyzer 6500HS (نظام التصوير عالي المحتوى) ، وتم إجراء التحليل باستخدام Signals Image Artist (منصة تحليل الصور ، انظر الخطوة 4.7). - بعد اكتمال التصوير ، أعد نماذج الخلايا إلى حاضنة زراعة الخلايا عند 37 درجة مئوية و 5٪ CO2. ومع ذلك ، حذف نماذج الخلايا المستخدمة لتحليل الجدوى من مزيد من الدراسات بسبب وسائط الكاشف الحية / الميتة على الجدوى على المدى الطويل.
- تحليل الصور على منصة تحليل الصور
- حدد كل مستوى من صورة Z-stack في البرنامج. ادمج الصور المستوية كصورة إسقاط ذات كثافة قصوى.
- قم بإنشاء تحليل جديد عن طريق تحديد النموذج المطبوع بيولوجيا كمنطقة اهتمام (ROI) عن طريق تحديد التألق من قناة الخلية الحية عند 488 نانومتر (تأكد من اختيار جميع الخلايا ضمن عائد الاستثمار).
- داخل المنطقة محل الاهتمام ، استخدم برنامج التصوير لتحديد عدد الخلايا في عائد الاستثمار من خلال قناة البقع النووية (405 نانومتر) ، وعدد الخلايا الحية في عائد الاستثمار باستخدام قناة 488 نانومتر ، وعدد الخلايا الميتة في عائد الاستثمار باستخدام قناة 647 نانومتر.
- قم بإجراء التحليل على جميع آبار نموذج الخلية المعالجة الحية / الميتة وقم بتصدير جدول البيانات الذي يحتوي على منطقة عائد الاستثمار وإجمالي عدد الخلايا وعدد الخلايا الحية وعدد الخلايا الميتة.
- احسب عدد الخلايا الحية والميتة كنسبة مئوية من إجمالي عدد الخلايا لكل يوم تحليل.
5. التلوين المناعي وتحليل عدد الخلايا
- قبل التثبيت ، قم بإزالة الوسائط من طرز الخلايا واغسل النماذج مرة واحدة في PBS.
- إصلاح الخلايا مع 4٪ (v / v) بارافورمالدهيد في PBS في RT لمدة 20 دقيقة.
تنبيه: يجب تنفيذ جميع الأعمال مع بارافورمالدهيد وفقا لإجراءات المختبر. - نضح محلول بارافورمالدهايد 4٪ (v / v) من النماذج واغسل النماذج أربع مرات في برنامج تلفزيوني لإزالة بارافورمالدهايد تماما.
- قم بتخلل نماذج الخلايا بنسبة 0.2٪ triton-X لمدة 30 دقيقة في RT واغسلها ثلاث مرات باستخدام PBS.
- قم بحظر نماذج الخلايا باستخدام مصل الحمير العادي (NDS) بنسبة 10٪ (v / v) لمدة 3 ساعات في RT.
- قم بإزالة محلول الحظر وإضافة الأجسام المضادة الأولية (المخففة في 1٪ v / v NDS في PBS) إلى النماذج. في حالة إجراء تحليل نسبة عدد الخلايا (انظر الخطوة 5.11) ، تأكد من تضمين نماذج الخلايا الملطخة بشكل مشترك لتوبولين Β-III (مع اقتران AF647 الأحمر) و GFAP (مع اقتران AF488 الأخضر). احتضان النماذج مع الأجسام المضادة الأولية لمدة 24 ساعة عند 4 درجات مئوية.
- بعد الحضانة الأولية ، اغسل النماذج الملطخة بالأجسام المضادة الأولية المترافقة ثلاث مرات في PBS و Counterstain مع 20 ميكرومتر Hoechst لمدة 30 دقيقة. الصورة كما هو مفصل في الخطوة 5.10.
- اغسل النماذج الملطخة بالأجسام المضادة الأولية غير المقترنة ثلاث مرات في PBS وأضف أجساما مضادة ثانوية (مخففة في 1٪ v / v NDS في PBS). احتضان لمدة 24 ساعة عند 4 درجات مئوية.
- قم بإزالة الأجسام المضادة الثانوية عن طريق الغسيل ثلاث مرات في PBS ، ونماذج Counterstain مع 20 ميكرومتر Hoechst لمدة 30 دقيقة قبل التصوير.
- قم بإجراء التصوير على المجاهر القياسية ذات قنوات الإثارة الحمراء (647 نانومتر) والخضراء (488 نانومتر). ومع ذلك ، للحصول على أفضل النتائج في نماذج 3D ، نماذج الصور باستخدام مجهر متحد البؤر عالي المحتوى وتنفيذ التصوير باستخدام وظيفة Z-stack عند تكبير 4x أو 10x.
- تحليل نسب عدد الخلايا على منصة تحليل الصور
- الحصول على تحليل لتجمعات الخلايا باستخدام نماذج ملطخة بشكل مشترك ل GFAP (مع اقتران AF488) وتوبولين Β-III (مع اقتران AF647).
- حدد كل مستوى من صورة Z-stack في البرنامج وادمج صور المستوى كصورة إسقاط قصوى الكثافة.
- قم بإنشاء تحليل جديد عن طريق تحديد النموذج المطبوع بيولوجيا كعائد استثمار عن طريق تحديد التألق من قناة توبولين Β-III عند 647 نانومتر (تأكد من تحديد كل المنطقة التي تحتوي على خلية ضمن عائد الاستثمار).
- ضمن عائد الاستثمار ، استخدم البرنامج لتحديد عدد الخلايا في قناة Hoechst (405 نانومتر) ، وعدد الخلايا النجمية GFAP + في عائد الاستثمار باستخدام قناة 488 نانومتر ، وعدد خلايا Β-III tubulin + في عائد الاستثمار باستخدام قناة 647 نانومتر.
- قم بإجراء التحليل على جميع آبار نموذج الخلية الملطخة وتصدير جدول البيانات الذي يحتوي على منطقة عائد الاستثمار ، وإجمالي عدد الخلايا ، وعدد خلايا GFAP + ، وعدد خلايا Β-III tubulin +.
- احسب عدد خلايا GFAP+ و Β-III tubulin+ كنسبة مئوية من إجمالي عدد الخلايا.
النتائج
تحليل نمو الخلايا العصبية
في هذا البروتوكول ، تم طباعة الخلايا العصبية والخلايا النجمية المشتقة من iPSC بيولوجيا في الزراعة المشتركة في مصفوفة هيدروجيل باستخدام الطابعة الحيوية 3D. خلال أول 7 أيام بعد الطباعة ، تم تصوير الخلايا كل 12 ساعة باستخدام مجهر الخلية الحية. بعد الطباعة الحيوية ، يجب أن يكون للخلايا مورفولوجيا مستديرة ويجب أن تنتشر في جميع أنحاء مصفوفة الهيدروجيل ، وتتغير تدريجيا لتشكيل مجموعات خلايا أصغر مع نتوءات قليلة خلال الأيام القليلة الأولى من المزرعة (انظر الفيديو التكميلي 1 لنمو الخلايا السليمة التمثيلية). بحلول اليوم 4 ، تهاجر الخلايا السليمة في جميع أنحاء الجل لتشكيل مجموعات أكبر ، والتي ترتبط من خلال النواتج العصبية. بحلول اليوم 7 ، يجب ألا تبقى أي خلايا مفردة تقريبا ، ويجب أن تظهر الحزم المترابطة من الخلايا العصبية والإسقاطات النجمية محصنة ، ويمكن رؤية العديد من النتوءات العصبية الأصغر تتشكل من المجموعات (الشكل 2 أ). باستخدام سلسلة من صور برايتفيلد للخلايا الحية التي تم التقاطها خلال فترة النمو التي استمرت 7 أيام ، تم إجراء تحليل لنمو الخلايا العصبية كما هو مفصل في القسم 3. أظهر هذا التحليل أن نمو الخلايا العصبية يزداد بطريقة شبه خطية (قيمة R 2 = 0.84) بين 12 ساعة و 156 ساعة (الشكل 2 ب). خلال هذه الفترة من نمو الخلايا العصبية ، يزداد حجم مجموعات أجسام الخلايا أيضا (انظر الفيديو التكميلي 1) ، مما يدل على هجرة الخلايا في جميع أنحاء الهيدروجيل.
صلاحية الخلية ونسبة السكان
في هذا البروتوكول ، يتم استخدام تركيز 20 مليون خلية / مل ، تضم 15 مليون خلية عصبية / مل و 5 ملايين خلية نجمية / مل ، للطباعة الحيوية لنماذج الخلايا. باستخدام تلطيخ الخلايا الحية مع calcein-AM (الخلايا الحية) ، ethidium homodimer-1 (الخلايا الميتة) وبقعة نووية ، يمكن حساب عدد الخلايا الباقية على قيد الحياة خلال فترة 7 أيام وفقا للقسم 4 (الشكل 3 أ). يتم عرض نتائج صلاحية الخلية للثقافات التمثيلية لليوم الرابع ، حيث 72٪ ± 1٪ (متوسط ± SEM) من إجمالي الخلايا حية وتظهر تلطيخا ل Calcein-AM ، في حين أن 29٪ ± 2٪ (متوسط ± SEM) إجمالي الخلايا ميتة وتظهر تلطيخا بالإيثيديوم هوموديمر-1 (الشكل 3 ب). يمكن رؤية الصور التمثيلية لتلطيخ الخلايا باستخدام Calcein-AM و ethidium homodimer-1 في الشكل التكميلي 1. تجدر الإشارة إلى أن قيم بقاء الخلية لثقافات 3D لا يمكن مقارنتها مباشرة بثقافات 2D ، حيث يتم الاحتفاظ بالخلايا الميتة في الهيدروجيل ولن تتم إزالتها أثناء عمليات تغذية الخلايا.
باستخدام التلوين المناعي للتوبولين Β-III و GFAP ، كما هو موضح في القسم 5 وفي الشكل 4 ، يمكن إجراء تحليل الصور لتحديد نسب عدد الخلايا بين الخلايا العصبية والخلايا النجمية (الشكل 3 أ). من إجمالي الخلايا لكل نموذج في الثقافات التمثيلية ، تمثل الخلايا العصبية الإيجابية للتوبولين Β-III 49٪ ± 3٪ (متوسط ± SEM) ، بينما تمثل الخلايا النجمية الإيجابية GFAP 30٪ ± 4٪ (متوسط ± SEM). هذا يعطي نسبة 1: 1.5 ، الخلايا النجمية إلى الخلايا العصبية ، على التوالي. هذا يترك ما تبقى من 21٪ من إجمالي الخلايا لكل نموذج ، والتي لا تلطخ بأي من علامات الخلية. نظرا لأن تحليل صلاحية الخلية أظهر أن القيمة المتوسطة ل 29٪ من الخلايا غير قابلة للحياة في اليوم 4 ، فمن المحتمل أن تكون هذه الخلايا ميتة داخل الهيدروجيل.
التعبير عن علامات الخلية
تم تقييم مورفولوجيا الخلايا العصبية والخلايا النجمية المطبوعة بيولوجيا من خلال التلوين المناعي لعلامة نوع الخلية العصبية (Β-III tubulin) وعلامة الخلايا النجمية (GFAP). في الثقافات التمثيلية الموضحة ، يتم تحديد موقع التلوين المناعي لأنواع الخلايا الفردية ، مما يدل على مورفولوجيا الخلايا السليمة ، حيث يظهر كلا النوعين من الخلايا نموا للنتوءات الخلوية (الشكل 4 أ ، ب). نظرا لأن هياكل الهيدروجيل والخلية ثلاثية الأبعاد ، فإن كل صورة تمثل شريحة واحدة فقط عبر الهيكل في الشكل 4A ، B. يوضح الشكل 4C مجموعة مدمجة من الصور في جميع أنحاء الهيدروجيل ، مما يوضح مناظر توطين الخلايا في المستويات X و Y و Z. يوضح الشكل 4D تلطيخ المناعة للتوبولين Β-III فقط ؛ تسليط الضوء على النواتج العصبية الدقيقة من مجموعات جسم الخلية. لمزيد من الفحص للنمط الظاهري للخلايا العصبية glutamatergic ، يمكن إجراء تلطيخ مناعي لعلامة المستقبلات الأيونية glutamatergic ، GluR2. ضمن الشكل 4E ، تم تمييز المنطقة 4E.1 (أقحم) لإظهار تلطيخ نقطي عالي الدقة على طول حزم الخلايا العصبية. وهذا يؤكد بالتالي أن الخلايا العصبية في هذه الثقافة المشتركة لها نمط ظاهري غلوتاماترجي. عبر جميع صور التلوين المناعي ، يمكن ملاحظة الهياكل غير الخلوية الملطخة بالفلورسنت المناعي المحيطة بمجموعات الخلايا والخلايا العصبية. من المحتمل أن تمثل هذه الهياكل حطاما محتفظا به داخل الهيدروجيل مع كميات طفيفة من ارتباط الأجسام المضادة غير المحددة بالهيدروجيل. هذا متوقع في الثقافات المطبوعة بيولوجيا ، كما هو الحال في نماذج سقالة 3D ، لا تتم إزالة الخلايا الميتة والحطام أثناء تغذية الخلايا. تظهر صورة تمثيلية للتلطيخ المناعي للتحكم السلبي في الشكل التكميلي 2 لعرض ارتباط هيدروجيل غير محدد للأجسام المضادة الثانوية.
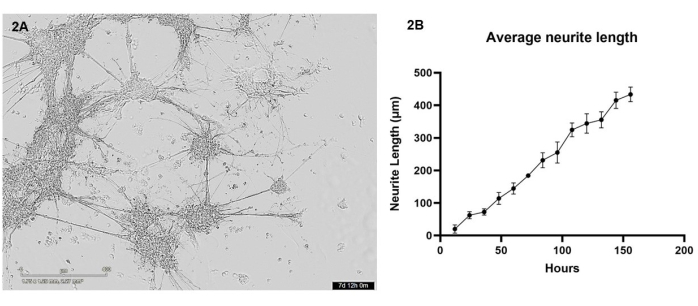
الشكل 2: طبعت الخلايا العصبية والخلايا النجمية الجلوتاماتية بيولوجيا في مصفوفة الهيدروجيل باستخدام الطابعة الحيوية، وصورت كل 12 ساعة باستخدام مجهر برايت فيلد . (أ) مثال على صورة برايت فيلد التقطت لمزارع الخلايا أثناء التحليل. تمثل الصورة النقطة الزمنية 156 h ، ويمثل شريط المقياس 400 μm. (B) متوسط طول النتوءات العصبية (μm) من الثقافات المقاسة باستخدام حزمة NeuronJ ل ImageJ. كل نقطة بيانات هي n = 3 عصبيات ، وتظهر البيانات كمتوسط ± SEM. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
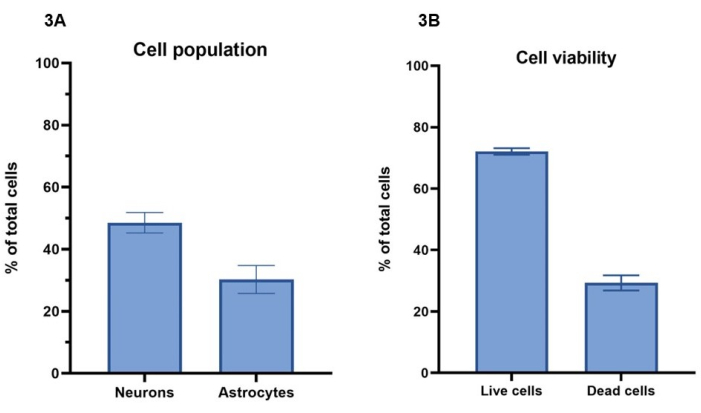
الشكل 3: تم استخدام تركيز 20 مليون خلية / مل من محلول المنشط للطباعة الحيوية لنماذج الخلايا. (أ) حسبت صلاحية الخلية باستخدام أصباغ الخلايا الحية / الميتة (Calcein-AM و ethidium homodimer-1 ، على التوالي). تظهر القيم أن 72٪ ± 1٪ (متوسط ± SEM ، n = 3) من إجمالي الخلايا لكل بئر حية و 29٪ ± 2٪ (متوسط ± SEM ، n = 3) من الخلايا ميتة من إجمالي عدد الخلايا لكل بئر في اليوم الرابع. تمثل القيم الموضحة متوسط ± SEM. (ب) تم حساب النسبة المئوية لمجموعات الخلايا العصبية والخلايا النجمية لكل بئر من خلال تحليل الصور للتلوين الموضح في الشكل 4. تمثل الخلايا العصبية النسبة المئوية للخلايا الملطخة الإيجابية لتوبولين Β-III في اليوم السابع (49٪ ± 3٪ ، متوسط ± SEM ، n = 3) ، بينما تمثل الخلايا النجمية النسبة المئوية للخلايا الملطخة الإيجابية ل GFAP في اليوم السابع (30٪ ± 4٪ ، يعني ± SEM ، n = 3). تمثل القيم المعروضة متوسط ± SEM. تم إجراء جميع عمليات التصوير للحسابات الموضحة في الشكل 3 على نظام تصوير متحد البؤر ، وتم إجراء جميع التحليلات على منصة تحليل الصور و GraphPad Prism وفقا للطرق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
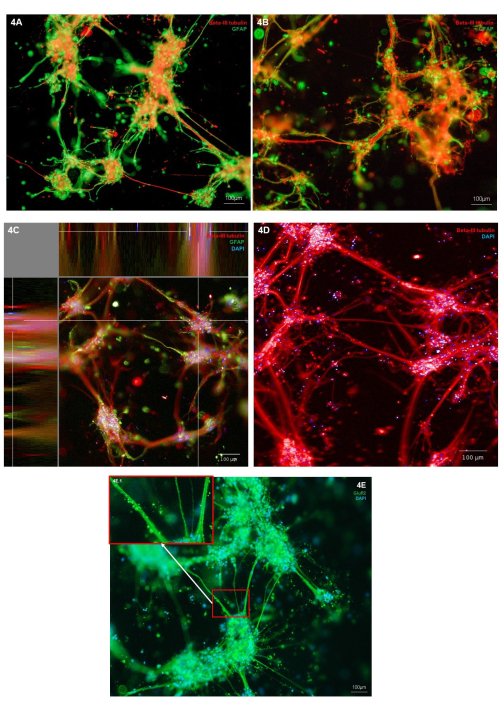
الشكل 4: التعبير عن علامات نوع الخلايا العصبية في الثقافات المشتركة المطبوعة بيولوجيا ثلاثية الأبعاد للخلايا العصبية والخلايا النجمية في اليوم 7 . (أ ، ب) تلطيخ مناعي للعلامة العصبية Β-III tubulin وعلامة الخلايا النجمية GFAP ، تم تصويرها على منصة مجهر مقلوبة بتكبير 10x. تمثل قضبان المقياس 100 ميكرومتر. (ج) تلطيخ مناعي لعلامة الخلايا العصبية β-III توبولين وعلامة الخلايا النجمية GFAP الملطخة بالاشتراك مع Hoechst ، كما هو موضح في عرض المستوى XYZ ، تم تصويره على نظام تصوير متحد البؤر عند تكبير 10x. تم إنشاؤها على منصة تحليل الصور. يمثل شريط المقياس 100 ميكرومتر. (د) تلطيخ مناعي لعلامة الخلايا العصبية β-III توبولين ملطخ بالاشتراك مع Hoechst ، تم تصويره على نظام تصوير متحد البؤر عند تكبير 20x. يمثل شريط المقياس 100 ميكرومتر. (ه) تلطيخ مناعي لعلامة الجلوتاماترجيك GluR2 الملطخة بالاشتراك مع Hoechst ، تم تصويرها على منصة مجهر مقلوبة بتكبير 10x. يوضح المربع 3E.1 المناطق المميزة من تلطيخ GluR2. يمثل شريط المقياس 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
فيديو تكميلي 1: تم طباعة الخلايا العصبية والخلايا النجمية Glutamatergic بيولوجيا في مصفوفة الهيدروجيل باستخدام الطابعة الحيوية وتم تصويرها كل 12 ساعة باستخدام مجهر برايتفيلد. فيديو لصور برايتفيلد الملتقطة لمزارع الخلايا أثناء التحليل ، ويشار إلى النقاط الزمنية في الزاوية اليمنى السفلية ، وتمثل أشرطة المقياس 400 ميكرومتر. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 1: أمثلة على صور للتحليل الحي / الميت للخلايا العصبية والخلايا النجمية المطبوعة بيولوجيا في اليوم 4. تظهر صبغة Calcein-AM باللون الأخضر (488 نانومتر) ، وتظهر صبغة إيثيديوم هوموديمير باللون الأحمر (647 نانومتر). تظهر الصورة في عرض مستوى XYZ ، الذي تم إنشاؤه على منصة تحليل الصور . يمثل شريط المقياس 100 ميكرومتر. (أ) تم إجراء التصوير باستخدام نظام تصوير متحد البؤر عند تكبير 4x. (ب) تم إجراء التصوير باستخدام نظام تصوير متحد البؤر عند تكبير 10x الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي 2: مثال على صورة التحكم السلبية بعد التلوين المناعي. تم حذف الأجسام المضادة الأولية ، وتم استخدام الأجسام المضادة الثانوية الخضراء (488 نانومتر) والأحمر (647 نانومتر) وفقا لبروتوكولات التلوين المناعي. تظهر الصورة في عرض المستوى XYZ ، الذي تم إنشاؤه على منصة تحليل الصور. يمثل شريط المقياس 100 ميكرومتر. تم إجراء التصوير باستخدام نظام تصوير متحد البؤر عند تكبير 10x. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
لم تكن الحاجة إلى نماذج دقيقة للجهاز العصبي المركزي أعلى من أي وقت مضى ، وقد دفعت قيود نماذج زراعة الخلايا التقليدية ثنائية الأبعاد (2D) جيلا من نماذج الجهاز العصبي المركزي المعقدة في السنوات الأخيرة19. ومع ذلك ، فإن العديد من نماذج 3D المعقدة التي تمثل التفاعلات بين أنواع الخلايا العصبية و ECM لها قيود من شأنها أن تمنع تطبيق هذه النماذج في العمليات الصناعية6،20،21. في هذا البروتوكول ، نقوم بتطوير نموذج زراعة مشتركة ثلاثي الأبعاد للخلايا العصبية والخلايا النجمية البشرية المشتقة من iPSC ، والذي يهدف إلى حل بعض هذه القيود باستخدام تقنية الطباعة الحيوية ثلاثية الأبعاد لإنشاء سقالة هيدروجيل نشطة بيولوجيا بتنسيقات 96 بئرا و 384 بئرا.
تم تبسيط منهجية تطوير هذه النماذج من خلال برنامج تصميم خرائط اللوحات ، وبروتوكولات الطباعة التي تم إنشاؤها تلقائيا ، وعملية الطباعة الموجهة من الطابعة الحيوية. ومع ذلك ، نظرا للطبيعة الحساسة لأنواع الخلايا الحساسة المشتقة من iPSC المستخدمة في هذا البروتوكول ، يجب توخي الحذر من خلال الخطوات الحاسمة التالية في الذوبان والثقافة. أولا ، إن إدراج مثبط ROCK (ROCKi) له فوائد عديدة طوال عملية الطباعة الحيوية وأثناء الزراعة المبكرة. ذوبان الخلايا هو نقطة حرجة يمكن أن تواجه فيها الخلايا العصبية استجابة إجهاد ، ويمكن أن تقلل بروتوكولات الذوبان غير الصحيحة من فرص البقاء على قيد الحياة22. يوصى عادة بإذابة الخلايا وإضافة الوسائط ورفع الخلايا إلى درجة حرارة الحاضنة بأكبر قدر ممكنمن الكفاءة 23. ومع ذلك ، أثناء عملية الطباعة الحيوية الموصوفة في هذا البروتوكول ، من الضروري إعادة تعليق الخلايا العصبية والخلايا النجمية في محلول منشط بدلا من الوسائط ، ولن يتم رفع الخلايا فوق درجة حرارة الغرفة حتى نهاية تشغيل الطباعة (حتى 30 دقيقة بعد الذوبان). وبالتالي ، فإن إضافة ROCKi إلى الوسائط مباشرة بعد الذوبان وتضمين ذلك خلال خطوتي الطرد المركزي (الخطوات 2.1--2.7 و 1.3.15-1.3.20) أمر حتمي لتثبيط مسارات إجهاد الخلايا ، مما قد يؤدي إلى انخفاض مستويات الصلاحية24. علاوة على ذلك ، فقد ثبت أن ROCKi يعزز نمو الخلايا العصبية ويحسن نضج الخلايا العصبية25. وبالتالي ، تستمر مكملات ROCKi لمدة 48 ساعة بعد الطباعة الحيوية. ومع ذلك ، من الضروري إزالة مكملات ROCKi بعد 48 ساعة لضمان الغسيل الكامل أثناء تغييرات الوسائط اللاحقة قبل استخدام الخلايا للفحص.
هناك خطوة أخرى تتطلب اهتماما نقديا وهي أثناء إضافة الوسائط بعد الطباعة وتغييرات الوسائط (الخطوات 2.8-2.13). تتميز سقالة الهيدروجيل المطبوعة بيولوجيا بصلابة ميكانيكية حيوية مكافئة تبلغ 1.1 كيلو باسكال فقط ، أي ما يعادل المادة الرمادية. كما هو موضح في الخطوة 2.10 ، من الأهمية بمكان أن يتم وضع الماصة برفق في جانب البئر أثناء إضافة الوسائط والشفط لمنع الاضطراب. هذا له أهمية خاصة لألواح 384 بئرا ، حيث يشغل مستوى الهلام نسبة أعلى من إجمالي حجم البئر. يجب أيضا استخدام هذه الطريقة في آبار التحكم 2D لمنع رفع حواف الخلايا وقص النواتج العصبية. يود المؤلفون أيضا تسليط الضوء على أهمية التقنية المعقمة داخل الطابعة الحيوية ، والتي يجب التعامل معها بحذر مماثل لتلك الخاصة بخزانة السلامة البيولوجية المستخدمة في مزارع الخلايا المشتقة من iPSC. يتضمن ذلك الترشيح المعقم بنسبة 70٪ EtOH و dH2O المستخدمة في إجراءات الإضاءة الخضراء والطباعة ، والحفاظ على الأغطية على الخراطيش والألواح أثناء تحريك اليدين داخل وخارج الطابعة الحيوية ، وإزالة التلوث من الأسطح داخل الطابعة الحيوية باستخدام مناديل الإيثانول بنسبة 70٪ قبل الطباعة وبعدها.
يتم اختيار سقالة الهيدروجيل المطبوعة بيولوجيا ، المكونة من الحبر الحيوي وحلول المنشط ، والتي تم اختيارها لتطوير هذا النموذج من مجموعة من الأحبار الحيوية وحلول المنشطات التي طورتها Inventia Life Science لاستخدامها في طابعة RASTRUM الحيوية. تم تحديد Laminin وحمض الهيالورونيك كجزيئات ذات صلة بالنضج العصبي المشتق من iPSC نظرا لدورهما في التوجيه المحوري ، وتشكيل المشبك العصبي ، وتشكيل الشبكة المحيطة بالخلايا العصبية26,27. علاوة على ذلك ، تم اختيار صلابة ميكانيكية حيوية تبلغ 1.1 كيلو باسكال ، حيث ثبت أن الهلاميات المائية منخفضة الكثافة تمكن من نمو الخلايا العصبية بشكل أفضل من الخلايا العصبية12. إذا تم إجراء تعديلات على البروتوكول باستخدام الخلايا العصبية والخلايا النجمية التي تم تمييزها داخليا أو من مورد تجاري مختلف ، فمن المستحسن إجراء اختبار اختيار المصفوفة لتحديد سقالة هيدروجيلالأكثر دعما 15. علاوة على ذلك ، قد تحتاج أيضا إلى تحسين كثافة الخلايا إذا تم إجراء تغييرات على مصادر الخلايا لضمان الجدوى المثلى ومنع اكتظاظ الهيدروجيل. بالنسبة لجميع التعديلات واستكشاف الأخطاء وإصلاحها المتعلقة بوظيفة bioprinter ، يوصي المؤلفون بالاتصال بالمصنعين والرجوع إلى بروتوكولات الشركة المصنعة.
يحتوي الجهاز العصبي المركزي على مجموعة واسعة من الأنواع الفرعية العصبية والخلايا الدبقية ، وكلها موجودة في منافذ دماغية مختلفة ولها أدوار محددة تساهم في الوظيفة العصبية28. في سياق هذا النطاق الواسع ، يمثل هذا النموذج فقط نوعين من الخلايا الأكثر وفرة (الخلايا النجمية والخلايا العصبية الجلوتاماتية المثيرة). يتم حذف أنواع الخلايا المهمة مثل الخلايا الدبقية الصغيرة ، oligodendrocytes ، والخلايا البطانية المكونة للحاجز الدموي الدماغي من هذا النظام. يمكن أن يكون إدراج الخلايا الدبقية الصغيرة ذا أهمية في التركيز على تفاعلات المناعة العصبية ، ويمكن أن تكون الخلايا قليلة التغصن ذات أهمية في الأمراض التي تؤثر على الميالين المركزي. بالإضافة إلى دورها في علم الأمراض ، تفرز خلايا مثل الخلايا البطانية المكونة للحاجز الدموي الدماغي إنزيمات استقلاب الدواء ، مما قد يؤثر على استخدام هذا النموذج لفحوصات الحرائك الدوائية29. قد يكون هناك قيد آخر للنموذج هو نسبة الخلايا النجمية إلى الخلايا العصبية. تختلف نسبة الخلايا النجمية إلى الخلايا العصبية اختلافا كبيرا بين مناطق الدماغ ، مع قيم مقترحة تتراوح بين 1: 1 و 1: 330,31. يحتوي هذا النموذج على نسبة تقريبية من الخلايا النجمية 1: 1.5 إلى الخلايا العصبية. وبالتالي ، قد لا يكون هذا النموذج ذا صلة بنمذجة مناطق الدماغ حيث تكون الخلايا النجمية أكثر وفرة ، كما هو الحال في مناطق المادة البيضاء30.
تم نشر بروتوكولات أخرى لتطوير نماذج 3D للزراعة المشتركة المطبوعة بيولوجيا في السنوات الأخيرة. قدم منشور صادر عن Sullivan et al. ، 2021 ، نموذجا عصبيا مطبوعا بيولوجيا ثلاثي الأبعاد باستخدام الخلايا السلفية العصبية المشتقة من iPSC ، مما يدل على قابلية عالية للبقاء بعد الطباعة وتعزيز وظيفة الخلايا العصبية مقارنة بالثقافات ثنائية الأبعاد32. ومع ذلك ، في هذا البروتوكول ، تم استخدام الخلايا السلفية العصبية كمصدر للخلايا وتم الحفاظ عليها في الثقافة لمدة 4 أسابيع. في هذا البروتوكول ، تم استخدام الخلايا العصبية والخلايا النجمية المشتقة من iPSC المتاحة تجاريا. وهذا يسمح بإنشاء شبكة 3D من الخلايا المستزرعة المشتركة في أقل من 7 أيام. كما يتضح من تحليل نمو الخلايا العصبية ، يبدأ نمو الخلايا العصبية في غضون 24 ساعة ويستمر بطريقة خطية طوال فترة 156 ساعة التي تمت مراقبة نمو الخلايا فيها. يمكن أن يعزى الإنشاء السريع لهذه الشبكات جزئيا إلى استخدام الخلايا العصبية glutamatergic التي تستخدم التعبير الجيني المحسن المحرض بالدوكسيسيكلين ل NGN2 ، والذي يظهر تعبيرا عن علامات النوع الفرعي العصبية الناضجة في غضون 7 أيام ، حتى في ثقافة 2D33. يعد تقصير فترة النمو هذه باستخدام هذه التقنية أمرا مهما لتنفيذ النماذج في صناعة المستحضرات الصيدلانية الحيوية ، حيث يتطلب تطوير الفحص تحولا سريعا وتطوير نماذج الخلايا15.
في الختام ، يظهر هذا النموذج إمكانية وجود نموذج 3D للخلايا العصبية والخلايا النجمية ، والذي يتم إنشاؤه بسرعة وسهولة لأغراض الفحص. يمكن أن تكون التطبيقات المستقبلية لهذا النوع من النماذج لجهود اكتشاف الأدوية عبر أمراض الجهاز العصبي المركزي المختلفة ، مع فرصة للتوسع في أمراض مختلفة باستخدام خطوط iPSC للمريض أو المرض المحرر جينيا. علاوة على ذلك ، فإن استخدام تعبير NGN2 المستحث بالدوكسيسيكلين iPSC المشتق من الخلايا العصبية glutamatergic يسمح للخلايا بالوصول إلى مرحلة النضج في وقت أقل ، والذي يمكن استخدامه لتطوير نماذج لشيخوخة الدماغ لأبحاث التنكس العصبي. يمكن أيضا توسيع هذا النظام من خلال استخدام أنواع إضافية من الخلايا في الزراعة المشتركة ، بما في ذلك الخلايا الدبقية الصغيرة والخلايا قليلة التغصن.
Disclosures
CW و NC و JB هم موظفون في Merck Sharp and Dohme (UK) Limited ، لندن ، المملكة المتحدة. YH هو موظف في شركة Merck Sharp and Dohme LLC ، وهي شركة تابعة لشركة Merck and Co.، Inc. ، Rahway ، NJ ، الولايات المتحدة الأمريكية.
تم إنشاء الشكل الأول باستخدام Biorender.com.
Acknowledgements
يود المؤلفون أن يشكروا أليكس فولكيرلينج ومارتن إنجل وراشيل بليتش على مساعدتهم في تطوير البروتوكول وتعليقاتهم على المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Thermofisher | 31350010 | |
| 384-well plate | PerkinElmer | 6057300 | |
| 96-well plate | PerkinElmer | 6055300 | |
| Activator fluid F299 | Inventia Life Science | N/A | |
| Activator fluid F3 | Inventia Life Science | N/A | |
| B27 (50x) minus Vit A | Thermofisher | 12587010 | |
| Bioink fluid F261 | Inventia Life Science | N/A | |
| Bioink fluid F32 | Inventia Life Science | N/A | |
| Doxycycline hyclate | Sigma Aldrich | D5207 | |
| GlutaMAX (100x) | Thermofisher | 35050061 | |
| Goat anti-mouse IgG H&L Alexa Fluor 647 | Abcam | ab150115 | |
| Goat anti-rabbit IgG H&L Alexa Fluor 488 | Abcam | ab150077 | |
| Hoechst | Abcam | ab228551 | |
| Human BDNF Recombinant Protein | Thermofisher | PHC7074 | |
| Human NT3 Recombinant Protein | Thermofisher | PHC7036 | |
| iCell Astrocytes | Fujifilm CDI | 1434 | |
| INCell Analyser 6500HS | Molecular Devices | N/A | high content imaging system |
| Incucyte S3 | Sartorius | N/A | |
| ioGlutamatergic Neurons (Large vial) | Bit.bio | e001 | |
| Laminin (1 mg/mL) | Sigma Aldrich | L2020 | |
| Live/dead kit (Calcein-AM, Ethidium homo-dimer-1) | Invitrogen | L3224 | |
| Mouse anti-BIII tubulin NL637 conjugated | R&D systems | SC024 | |
| Neurobasal media | Thermofisher | 21103049 | |
| Normal Donkey Serum | Abcam | ab7475 | |
| NucBlue Live (Hoechst 33342) | Thermofisher | R37605 | |
| Opti-MEM | Thermofisher | 11058021 | |
| Paraformaldehyde | Sigma Aldrich | P6148 | |
| PEI 50% in H2O | Sigma Aldrich | 181978 | |
| Pierce Borate Buffer 20x | Thermofisher | 28341 | |
| Prism | GraphPad | Data analysis software | |
| Rabbit anti-ionotropic glutamatre receptor 2 (GluR2) | Abcam | ab206293 | |
| RASTRUM(TM) Bioprinter | Inventia Life Science | N/A | Bioprinter |
| RASTRUM(TM) Bioprinter Cartridges | Inventia Life Science | N/A | Bioprinter Cartridges |
| RASTRUM(TM) Targeting plate | Inventia Life Science | N/A | Targeting plate |
| Rho kinase (ROCK) inhibitor | Abcam | ab120129 | |
| Sheep anti-GFAP NL493 conjugated | R&D systems | SC024 | |
| Signals Image Artist | PerkinElmer | N/A | Image analysis platform |
| Triton X-100 | Thermofisher | HFH10 | |
| Zeiss Axio Observer | Zeiss | N/A | Inverted microscope platform |
References
- Jung, Y. L., Hwang, J., Yoo, H. S. Disease burden metrics the innovations of leading pharmaceutical companies: a global and regional comparative study. Globalization and Health. 16 (1), 80-80 (2020).
- Potkin, S. G., et al. The neurobiology of treatment-resistant schizophrenia: paths to antipsychotic resistance and a roadmap for future research. npj Schizophrenia. 6, 1(2020).
- Keswani, C., et al. The Global Economic Impact of Neurodegenerative Diseases: Opportunities and Challenges. Bioeconomy for Sustainable Development. , Springer, Singapore. (2019).
- Perucca, E. The pharmacological treatment of epilepsy: recent advances and future perspectives. Acta Epileptologica. 3 (1), 22(2021).
- Nikolakopoulou, P., et al. Recent progress in translational engineered in vitro models of the central nervous system. Brain. 143 (11), 3181-3213 (2020).
- Whitehouse, C., Corbett, N., Brownlees, J. 3D models of neurodegeneration: implementation in drug discovery. Trends in Pharmacological Sciences. 44 (4), 208-221 (2023).
- Rauti, R., Renous, N., Maoz, B. M. Mimicking the brain extracellular matrix in vitro: A review of current methodologies and challenges. Israel Journal of Chemistry. 60 (12), 1141-1151 (2020).
- Fawcett, J. W., Oohashi, T., Pizzorusso, T. The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature Reviews Neuroscience. 20 (8), 451-465 (2019).
- Lam, D., et al. Tissue-specific extracellular matrix accelerates the formation of neural networks and communities in a neuron-glia co-culture on a multi-electrode array. Scientific Reports. 9, 4159(2019).
- Roll, L., Lessmann, K., Brüstle, O., Faissner, A. Cerebral organoids maintain the expression of neural stem cell-associated glycoepitopes and extracellular matrix. Cells. 11 (5), 760(2022).
- Yan, Y., Bejoy, J., Marzano, M., Li, Y. The use of pluripotent stem cell-derived organoids to study extracellular matrix development during neural degeneration. Cells. 8 (3), 242(2019).
- Ma, L., et al. 3D bioprinted hyaluronic acid-based cell-laden scaffold for brain microenvironment simulation. Bio-Design and Manufacturing. 3 (3), 164-174 (2020).
- Liaw, C. -Y., Ji, S., Guvendiren, M. Engineering 3D hydrogels for personalized in vitro human tissue models. Advanced Healthcare Materials. 7 (4), 1701165(2018).
- Ma, J., Huang, C. Composition and mechanism of three-dimensional hydrogel system in regulating stem cell fate. Tissue Engineering Part B: Reviews. 26 (6), 498-518 (2020).
- Belfiore, L., et al. Generation and analysis of 3D cell culture models for drug discovery. European Journal of Pharmaceutical Sciences. 163, 105876(2021).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Engel, M., Belfiore, L., Aghaei, B., Sutija, M. Enabling high throughput drug discovery in 3D cell cultures through a novel bioprinting workflow. SLAS Technology. 27 (1), 32-38 (2022).
- Takamura, T., et al. Influence of age on global and regional brain stiffness in young and middle-aged adults. Journal of Magnetic Resonance Imaging. 51 (3), 727-733 (2020).
- Slanzi, A., Iannoto, G., Rossi, B., Zenaro, E., Constantin, G. In vitro models of neurodegenerative diseases. Frontiers in Cell and Developmental Biology. 8, 328(2020).
- de Souza, N. Organoid variability examined. Nature Methods. 14 (7), 655-655 (2017).
- Hernández, D., et al. Culture variabilities of human iPSC-derived cerebral organoids are a major issue for the modelling of phenotypes observed in Alzheimer's disease. Stem Cell Review and Reports. 18 (2), 718-731 (2022).
- Li, R., et al. Differentiation of human iPS cells into sensory neurons exhibits developmental stage-specific cryopreservation challenges. Frontiers in Cell and Developmental Biology. 9, 796960(2021).
- Nishiyama, Y., et al. Safe and efficient method for cryopreservation of human induced pluripotent stem cell-derived neural stem and progenitor cells by a programmed freezer with a magnetic field. Neuroscience Research. 107, 20-29 (2016).
- Uhrig, M., Ezquer, F., Ezquer, M. Improving cell recovery: Freezing and thawing optimization of induced pluripotent stem cells. Cells. 11 (5), 799(2022).
- Harbom, L. J., et al. The effect of rho kinase inhibition on morphological and electrophysiological maturity in iPSC-derived neurons. Cell and Tissue Research. 375 (3), 641-654 (2019).
- Koh, H. S., Yong, T., Chan, C. K., Ramakrishna, S. Enhancement of neurite outgrowth using nano-structured scaffolds coupled with laminin. Biomaterials. 29 (26), 3574-3582 (2008).
- Tarus, D., et al. Design of hyaluronic acid hydrogels to promote neurite outgrowth in three dimensions. ACS Applied Materials & Interfaces. 8 (38), 25051-25059 (2016).
- Brain Initiative Cell Census Network (BICCN). Initiative Cell Census Network (BICCN). A multimodal cell census and atlas of the mammalian primary motor cortex. Nature. 598 (7879), 86-102 (2021).
- Dauchy, S., et al. Expression and transcriptional regulation of ABC transporters and cytochromes P450 in hCMEC/D3 human cerebral microvascular endothelial cells. Biochemical Pharmacology. 77 (5), 897-909 (2009).
- Herculano-Houzel, S. The glia/neuron ratio: How it varies uniformly across brain structures and species and what that means for brain physiology and evolution. Glia. 62 (9), 1377-1391 (2014).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Sullivan, M. A., et al. 3D bioprinting of stem cell-derived central nervous system cells enables astrocyte growth, vasculogenesis and enhances neural differentiation/function. bioRxiv. , (2022).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).
Erratum
Formal Correction: Erratum: Three-Dimensional Bioprinting of Human iPSC-Derived Neuron-Astrocyte Cocultures for Screening Applications
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for: Three-Dimensional Bioprinting of Human iPSC-Derived Neuron-Astrocyte Cocultures for Screening Applications. The Authors section was updated from:
Chloe Ann Whitehouse1
Yufang He2
Janet Brownlees1
Nicola Corbett1
1MSD R&D Innovation Centre Ltd
2Merck & Co., Inc.
to:
Chloe Ann Whitehouse1
Yufang He2
Janet Brownlees1
Nicola Corbett1
1MSD Research Laboratories, London, UK
2Merck & Co., Inc., Rahway, NJ, USA
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved