Method Article
Bioimpresión tridimensional de cocultivos de neuronas-astrocitos derivados de iPSC humanos para aplicaciones de cribado
En este artículo
Erratum Notice
Resumen
Aquí, presentamos un protocolo para producir cocultivos bioimpresos en 3D de neuronas y astrocitos derivados de iPSC. Este modelo de cocultivo, generado dentro de un andamio de hidrogel en formatos de 96 o 384 pocillos, demuestra una alta viabilidad post-impresión y crecimiento de neuritas en 7 días y muestra la expresión de marcadores de madurez para ambos tipos de células.
Resumen
Para que un modelo celular sea viable para el cribado de fármacos, el sistema debe cumplir los requisitos de rendimiento y homogeneidad, además de tener un tiempo de desarrollo eficiente. Sin embargo, muchos modelos 3D publicados no satisfacen estos criterios. Esto, por lo tanto, limita su utilidad en las primeras aplicaciones de descubrimiento de fármacos. La bioimpresión tridimensional (3D) es una tecnología novedosa que se puede aplicar al desarrollo de modelos 3D para acelerar el tiempo de desarrollo, aumentar la estandarización y aumentar el rendimiento. Aquí, presentamos un protocolo para desarrollar modelos de cocultivo bioimpresos en 3D de neuronas glutamatérgicas y astrocitos derivados de células madre pluripotentes inducidas humanas (iPSC). Estos cocultivos están incrustados dentro de una matriz de hidrogel de péptidos bioactivos, proteínas de matriz extracelular (MEC) de longitud completa y con una rigidez fisiológica de 1,1 kPa. El modelo se puede establecer rápidamente en formatos de 96 y 384 pocillos y produce una viabilidad media posterior a la impresión del 72%. Se muestra que la relación astrocito-neurona en este modelo es de 1:1,5, que está dentro del rango fisiológico del cerebro humano. Estas poblaciones de células bioimpresas en 3D también muestran la expresión de marcadores de tipo de células neurales maduras y el crecimiento de proyecciones de neuritas y astrocitos dentro de los 7 días posteriores al cultivo. Como resultado, este modelo es adecuado para el análisis mediante colorantes celulares y técnicas de inmunotinción junto con ensayos de crecimiento de neuritas. La capacidad de producir estos modelos fisiológicamente representativos a escala los hace ideales para su uso en ensayos de cribado de rendimiento medio a alto para objetivos neurocientíficos.
Introducción
La investigación sobre las enfermedades del sistema nervioso central (SNC) en la industria del descubrimiento de fármacos se está expandiendo1. Sin embargo, muchas enfermedades prevalentes del SNC, como la epilepsia, la esquizofrenia y la enfermedad de Alzheimer, aún no tienen tratamientos curativos 2,3,4. La falta de terapias efectivas en las enfermedades del SNC puede, al menos en parte, atribuirse a la falta de modelos in vitro precisos del cerebro5. Esto ha dado lugar a una brecha traslacional entre los modelos in vitro actuales y los datos in vivo, y un consiguiente cuello de botella en los esfuerzos de investigación.
Impulsado por esta brecha traslacional, en los últimos años se ha producido un aumento significativo en el desarrollo de nuevos modelos celulares en 3D, incluidos organoides neuronales, neurosferoides y modelos basados en andamios6. La estructura 3D de estos modelos ayuda a recapitular el microambiente neuronal, incluidas las tensiones biomecánicas, los contactos célula-célula y la matriz extracelular cerebral (MEC)7. La MEC cerebral es un elemento dinámico de la neurofisiología que ocupa el espacio entre los tipos de células neuronales, incluidas las neuronas, los astrocitos, los oligodendrocitos y la unidad neurovascular7. Se ha demostrado que la recapitulación de la MEC cerebral afecta a la morfología neuronal y a la activación neuronal, y muchos modelos 3D complejos del cerebro han demostrado la deposición de proteínas de la MEC por parte de los tipos de células neuronales 8,9,10,11. Los modelos basados en andamios consisten en cocultivos neurales maduros suspendidos en una matriz porosa de hidrogel sintético o biológico que representa la ECM12 del cerebro. A diferencia de los sistemas organoides y esferoides, los modelos 3D basados en andamios permiten la personalización de las proteínas de la MEC presentes y tienen el beneficio adicional de la capacidad de ajuste de la rigidez del hidrogel para imitar las tensiones biomecánicas13,14.
Aunque una abrumadora mayoría de los modelos neuronales 3D demuestran una mayor recapitulación del microambiente cerebral, no todos los modelos son adecuados para implementar aplicaciones de descubrimiento de fármacos15. Para que un modelo 3D se implemente en procesos industriales, el sistema debe cumplir con los requisitos de rendimiento para aplicaciones de cribado y tener un tiempo de desarrollo relativamente corto16. La bioimpresión 3D es una tecnología novedosa que ofrece el potencial de crear modelos neuronales basados en andamios 3D con un tiempo de desarrollo rápido, un mayor rendimiento y mayores niveles de control de precisión, junto con la eliminación de la variabilidad causada por el error humano17. Este protocolo presenta un modelo de cocultivo 3D de neuronas glutamatérgicas y astrocitos humanos derivados de iPSC en un andamio de hidrogel. Este andamio de hidrogel contiene péptidos bioactivos fisiológicamente representativos (RGD, IKVAV, YIGSR) y proteínas ECM dentro de una rigidez biomecánica mimética. Estas proteínas de MEC de longitud completa incluyen la laminina-211 de longitud completa y el ácido hialurónico, abundantes en la corteza humana, con una rigidez de 1,1 kPa en línea con las mediciones in vivo 18. Este modelo está diseñado con practicidad para el descubrimiento de fármacos, y se crea utilizando una bioimpresora 3D en un formato de placa de 96 o 384 pocillos adecuado para el análisis de cribado mediante técnicas de imagen con colorantes celulares y anticuerpos, junto con ensayos de crecimiento de neuritas. Las células muestran expresión de marcadores de tipo de células neurales y crecimiento de proyecciones de neuritas y astrocíticas dentro de los 7 días posteriores al cultivo. Por lo tanto, este protocolo presentará la metodología para desarrollar un modelo de cocultivo neuronal 3D de alto rendimiento para su uso en aplicaciones de descubrimiento de fármacos.
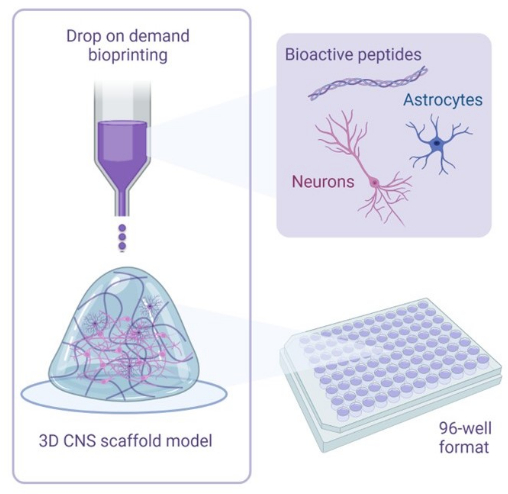
Figura 1: Resumen ilustrativo de la metodología utilizada para la bioimpresión 3D de cocultivos. Las neuronas y astrocitos derivados de iPSC humanas se combinan con soluciones activadoras y de biotinta que contienen péptidos bioactivos y se bioimprimen en andamios de hidrogel en formatos de 96 o 384 pocillos utilizando la tecnología de bioimpresión bajo demanda. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. Bioimpresión de modelos 3D
- Generación de mapa de placas y archivo de impresión
- Antes de generar el modelo, genere un mapa de placas, un protocolo y un archivo de impresión con el software de mapas de placas. Abra el software de mapa de placas y seleccione la opción Cultivar celdas en 3D .
- Seleccione el tipo de modelo que desea bioimprimir entre las opciones disponibles en el menú desplegable; este modelo ha sido validado en los formatos Imaging Model y HTP model. Seleccione el modelo de imagen para placas de 96 pocillos y HTP para placas de 384 pocillos.
- En la ventana Selección de matriz , seleccione Hidrogel Px02.53, que contiene laminina-211 y proteínas de ácido hialurónico, con péptidos IKVAV, RGD y YIGSR.
- En la ventana emergente, ingrese los tipos de células como neuronas glutamatérgicas y astrocitos e ingrese la densidad celular como 20 millones de células/mL.
- Utilice el software para diseñar el mapa de placas deseado resaltando los pocillos en la placa en pantalla. Incluya al menos 1 fila de control 2D en plástico en el diseño. El control 2D en pozos de plástico consiste en celdas depositadas directamente en el pocillo sin ningún andamio de hidrogel; Cubra estos pocillos según el paso 1.2.
- Asegúrese de que el modelo de placa que aparece en la parte superior de la ventana se cambie al modelo de placa previsto para su uso (consulte la Tabla de materiales).
- Descargue el protocolo e imprima el archivo para el mapa de placas usando los botones de descarga y guárdelos en la computadora conectada a la bioimpresora.
- Recubrimiento de control 2D en pocillos de plástico
- Al menos 24 h antes de la impresión, recubra los pocillos para los modelos de control 2D para la adherencia y el crecimiento celular. Los pozos de modelos 3D no requieren ningún recubrimiento previo. Todos los procesos deben llevarse a cabo en una cabina de bioseguridad, a menos que se indique lo contrario. Las planchas se pueden recubrir y preparar hasta 7 días antes de la impresión.
- Prepare 50 ml de tampón de borato 1x diluyendo 2,5 ml de solución madre de borato 20x con 47,5 ml de dH2O. estéril.
- Añadir 100 μL de polietileneimina (PEI) al 50% (p/v) a 50 ml de tampón borato 1x para crear una solución de PEI al 0,1% (p/v) y un filtro estéril a través de un filtro de 0,22 μm.
- Agregue una solución de PEI al 0,1 % (p/v) a cada pocillo de control 2D, como lo indica el mapa de placas generado en el paso 1.1. Agregue 100 μL/pocillo si usa una placa de 96 pocillos o 25 μL/pocillo si usa una placa de 384 pocillos.
- Incubar la placa durante 2 h a 37 °C antes de aspirar la solución de PEI al 0,1% (p/v) y enjuagar los pocillos 5 veces con PBS. Deje que los pocillos se sequen completamente en el gabinete de bioseguridad.
- Diluir 100 μL de solución de laminina de 1 mg/mL en 5 mL de medio neurobasal. Agregue 100 μL a cada pocillo de control 2D si usa una placa de 96 pocillos o 25 μL si usa una placa de 384 pocillos. Incubar durante 4 h a 37 °C.
- Si almacena placas, deje la solución de laminina en su lugar después de la incubación y guárdela a 4 °C. Precalentar las placas durante 1 h a 37 °C antes de su uso.
- Bioimpresión 3D de modelos de cocultivo
- Mantenga siempre una técnica estéril cuando utilice la bioimpresora, y limpie los guantes, los cartuchos y las placas de cultivo con EtOH al 70 % antes de colocarlos dentro de la impresora. A menos que se indique lo contrario, realice todos los procesos fuera de la bioimpresora en un gabinete de bioseguridad.
- Encienda el compresor de la bioimpresora e inicialice la impresora seleccionando el botón Inicializar en el software de la bioimpresora. Una vez que se haya iniciado el flujo de aire en la impresora, limpie las superficies dentro de la impresora con una toallita de EtOH al 70%.
- El día de la impresión, realice el proceso guiado de luz verde al inicio del día para garantizar el estado correcto de los inyectores para la tirada de impresión (estado mínimo de los inyectores 2A2B).
- Tome un cartucho de bioimpresora del envase estéril, añada 20 ml de dH2O estéril en el compartimento A y añada 6 ml de EtOH al 70 % con filtro estéril en los compartimentos B1-4. Inserte el cartucho en el soporte del cartucho izquierdo dentro de la bioimpresora y coloque la tapa de la placa en el soporte de tapa dedicado.
- Seleccione el botón Luz verde en la pantalla de inicio del software y confirme en el software que el cartucho está en su lugar dentro de la bioimpresora y que se ha quitado la tapa. Inicia el proceso de dar luz verde.
- Cuando el software se lo solicite, confirme que no se pueden ver goteos consistentes en las agujas izquierda o derecha. Posteriormente, cuando el software se lo solicite, confirme que hay agua en los compartimentos B7 y B8.
- Una vez que la bioimpresora haya completado el paso de luz verde autoguiado, inserte una placa de fondo plano estéril de 96 pocillos sin recubrimiento (separada de la placa recubierta para cocultivos de bioimpresión) e inserte esta nueva placa en la sección derecha del soporte de la placa de la bioimpresora cuando el software se lo solicite. Asegúrese de que el soporte de la placa esté configurado en Placa de perfil alto, y que la tapa se retire y se coloque en el soporte de la tapa dedicado antes de comenzar el siguiente paso.
- La bioimpresora depositará gotas de agua en cada pocillo de la placa de 96 pocillos. Una vez completado, coloque la placa de la bioimpresora y confirme que hay gotas de agua presentes en cada pocillo de la placa.
- Deseche la placa de 96 pocillos utilizada para la luz verde y deje que la bioimpresora finalice el proceso de luz verde. Una vez completado, el software indicará el estado de la boquilla de la bioimpresora y confirmará que la bioimpresora está lista para imprimir modelos. Coloque la tapa en el cartucho de impresión y retírela al gabinete de bioseguridad para los siguientes pasos.
- Con el software de la bioimpresora, cargue el archivo de impresión (generado en el paso 1.1) en el software utilizando el botón del software Print Run y abra el pdf del protocolo de impresión.
- Recupere la biotinta y los fluidos activadores, como se indica en el protocolo de impresión pdf, de -20 °C y descongele a temperatura ambiente (RT) durante 40 min. Para la matriz de hidrogel Px02.53 esto incluirá: 1x vial F32, 1xvial F3, 1x vial F261, 1x vial F299. No descongele la biotinta ni los líquidos activadores en las manos ni en baños de agua.
- Lleve 50 ml de medio completo con doxiciclina e inhibidor de ROCK (medio completo +DOX/ROCKi) (consulte el paso 2.2) a RT mientras se descongelan la biotinta y los fluidos activadores.
- Una vez descongeladas las biotintas y los activadores, prepare el cartucho de impresión como se indica en las dos últimas páginas del pdf del protocolo de impresión generado. El cartucho de impresora de luz verde se reutilizará para las etapas de impresión del modelo.
- Asegúrese de que haya 40 ml de dH2 O en el compartimento A1 y 8 ml de EtOH al 70% en los compartimentos B1 yB2. Añadir 1,2 ml de activador F32 a C1, 1,2 ml de F3 a C2 y 200 μl de F261 a C4.
- Recupere el PEI y la placa recubierta de laminina de la incubadora y colóquela dentro de la impresora en el compartimento derecho del soporte de la placa. No retire la solución de laminina-medio de los pocillos en este punto. Asegúrese de que el compartimiento del soporte de la placa esté configurado en Placa de perfil bajo y que la tapa esté quitada y en el soporte de la tapa.
- Coloque el cartucho de impresión en la bioimpresora, asegurándose de que la tapa se haya retirado y colocado en el soporte, e inicie la tirada de impresión en el software seleccionando el botón Print Inert Base en el software de la bioimpresora.
- Mientras se imprime la base inerte, recupere los viales de neuronas glutamatérgicas y astrocitos del almacenamiento de nitrógeno líquido, descongele y vuelva a suspender según las instrucciones de la sección 2.
- Una vez que las células se hayan descongelado y se hayan añadido 8 ml de medio completo +DOX/ROCKi a cada tipo de célula por separado (como se indica en la sección 2), centrifugar las células a 300 x g durante 5 min a RT.
- Aspirar el sobrenadante y resuspender ambos tipos de células por separado en 1 mL de medio completo +DOX/ROCKi.
- Agregue 20 μL de suspensión celular a 20 μL de azul de tripano y mezcle antes de contar las células para determinar la concentración de células viables por ml para cada tipo de célula.
- Combina un total de 3 millones de neuronas glutamatérgicas con 1 millón de astrocitos en un tubo de 15 ml. Agregue medios para crear un volumen total de 8 ml.
- Centrifugar las células a 300 x g durante 5 min a RT.
- Aspirar la mayor cantidad posible de sobrenadante sin alterar el gránulo celular y volver a suspender el gránulo celular en 200 μL de líquido activador F299.
- Tenga en cuenta que el líquido activador es viscoso; Pipetear hacia arriba y hacia abajo para resuspender completamente el gránulo. Los tipos de células son delicados; Minimice el cizallamiento y las burbujas mediante el uso de una punta de pipeta de diámetro ancho y la técnica de pipeteo inverso. Pipetear hacia arriba y hacia abajo firmemente no más de 3 veces para evitar la pérdida de células.
- Una vez terminada la impresión de la etapa base inerte, coloque las tapas sobre el cartucho y la placa de cultivo, retire ambas de la bioimpresora y colóquelas en el armario de bioseguridad.
- Agregue los 200 μL de suspensión celular en F299 al pocillo C3 del cartucho de impresión, vuelva a insertar el cartucho en la bioimpresora, retire la tapa y colóquelo en el soporte de la tapa. Todavía no vuelva a insertar la placa de cultivo.
- Inicie la etapa Modelos de impresión de la tirada. Mientras la bioimpresora ceba los fluidos, retire la solución de laminina-medio de los pocillos de control 2D de la placa y reemplácela con 150 μl de medio completo +DOX/ROCKi en cada pocillo de control 2D si usa una placa de 96 pocillos y 50 μl de medio completo +DOX/ROCKi si usa una placa de 384 pocillos.
- Una vez que se hayan cebado los líquidos, inserte la placa de orientación de bioimpresión en la bioimpresora, retire la tapa y colóquela en el soporte de la tapa.
- Comience el proceso de segmentación de la bioimpresora.
- Cuando se lo solicite el software de bioimpresión, retire la placa de orientación de la bioimpresora.
- Utilice la guía para seleccionar dónde se pueden observar las gotas en la placa. Vuelva a insertar la placa de orientación en la bioimpresora y repita el proceso de impresión y selección de gotas.
- Cuando se le solicite, vuelva a retirar la placa de orientación y, a continuación, reemplácela por la placa de cultivo celular (que contiene medios en los pocillos de control 2D según el paso 1.3.25). Asegúrese de que la tapa de la placa de cultivo esté desmontada y colocada en el soporte. La bioimpresora terminará de imprimir el modelo.
- Una vez completada la impresión del modelo, siga los métodos de cultivo celular de la sección 2 (paso 2.8) para añadir medios a los pocillos.
- Comience el proceso de limpieza de la bioimpresora y, una vez completado, deseche los cartuchos y los líquidos restantes de acuerdo con los protocolos del laboratorio.
2. Cultivo celular
- Los modelos se generan utilizando 1 vial de neuronas glutamatérgicas (>5 millones de células por vial) y 1 vial de astrocitos (>1 millón de células por vial).
- Precalentar el baño maría a 37 °C.
- Transportar ambos viales de células al laboratorio en hielo seco y sumergirlos en un baño de agua inmediatamente después de retirarlos del hielo seco. Descongele ambos viales simultáneamente.
- Retire los viales del baño de agua cuando solo quede un pequeño cristal de hielo; Esto tomará aproximadamente 3 minutos después de la inmersión. No agite ni mezcle las celdas en el baño de agua.
- Rocíe los viales con EtOH al 70% y transfiéralos a la cabina de bioseguridad.
- Agregue 500 μL de medio completo +DOX/ROCKi gota a gota en cada vial antes de transferir cada suspensión a tubos separados de 15 mL.
- Rellene el medio en cada tubo a 8 ml y continúe con los pasos de bioimpresión como se indica en el paso 1.3.
- Después de los modelos de bioimpresión (paso 1.3), añadir inmediatamente el medio completo +DOX/ROCKi a todos los pocillos de cocultivo 3D y colocar los modelos en una incubadora a 37 °C y 5% deCO2. Si usa una placa de 96 pocillos, agregue 150 μL de medio por pocillo; si usa una placa de 384 pocillos, use 50 μL de medio por pocillo.
- No se requieren cambios de medios durante las primeras 48 h de cultivo.
- Al realizar cambios de medios en controles y modelos 2D, se debe tener cuidado para evitar inducir estrés mecánico, que podría desprender cultivos 2D o causar la deformación del hidrogel. Realice la aspiración y la adición de medios lentamente con una micropipeta apuntando hacia el costado del pocillo.
- Después de 48 h, realice un cambio de medio del 90% en todos los pocillos y elimine ROCKi de la composición del medio (consulte el paso 2.14).
- Después de 96 h, realice un cambio de medio adicional del 90% en todos los pocillos para eliminar DOX de la composición del medio (consulte el paso 2.14).
- Después de los dos cambios de medios del 90% a las 48 h y 96 h, realice cambios de medios del 50% cada 48 h, donde el 50% de los medios se aspiran y se reemplazan con medios completos nuevos
- Composición de los medios:
- Medios completos: Medios neurobasales con 1x GlutaMAX, 1x B27, 12,5 nM 2-mercaptoetanol, 10 ng/mL NT3, 5 ng/μL BDNF.
- Medios completos más doxiciclina (DOX): medios neurobasales con 1x GlutaMAX, 1x B27, 12,5 nM 2-mercaptoetanol, 10 ng/ml de neurotrofina-3 (NT3), 5 ng/μl de factor neurotrófico derivado del cerebro (BDNF) y 1 μg/ml de doxiciclina.
- Medio completo más inhibidor de DOX/ROCK (ROCKi): Medio neurobasal con 1x GlutaMAX, 1x B27, 12,5 nM de 2-mercaptoetanol, 10 ng/ml de NT3, 5 ng/μl de BDNF, 1 μg/ml de doxiciclina y 10 μM de inhibidor de ROCK.
3. Análisis del crecimiento de las neuritas
- Coloque las células en un microscopio de células vivas para obtener imágenes de campo claro inmediatamente después de la adición de medios después de la bioimpresión.
- Utilice el software de microscopio para programar las imágenes de las células con un aumento de 4x en cada pocillo, incluidos los controles 2D, cada 12 h durante al menos 7 días.
- Realice cambios de medio cada 48 h, como se detalla en la sección 2, colocando las células de nuevo en el microscopio después de que el medio cambie cada vez.
- Después de 7 días de datos, exporte las imágenes del software en formato .jpg
- Importe todas las imágenes .jpg al software ImageJ y convierta los archivos a formato de 8 bits. Cargue el complemento NeuronJ y trace el crecimiento de neuritas en imágenes, incluidos los puntos de bifurcación, utilizando la herramienta de trazado.
- Utilice los datos de rastreo de neuritas generados a partir de NeuronJ para trazar el crecimiento de neuritas a lo largo del tiempo.
4. Análisis de viabilidad celular
- En cada punto de tiempo de 24 horas en el cultivo, tiñir 3 o más pocillos para el análisis de viabilidad celular utilizando un kit de viabilidad vivo/muerto. Repita este paso a las 24 h o 48 h durante la duración del estudio.
- Prepare el medio reactivo vivo/muerto suspendiendo el reactivo de células vivas (1x Calcein-AM) y el reactivo de células muertas (1x homodímero de etidio-1) y 1x tinción nuclear de células vivas (Hoechst 33342) en 10 ml de medio sérico reducido sin rojo de fenol (Opti-MEM) 30 min antes de la obtención de imágenes. Deje que los medios reactivos vivos/muertos lleguen a RT. Almacene los medios reactivos vivos/muertos fuera de la luz directa debido al blanqueamiento por fluorescencia.
- Retire los medios de 3 pocillos que contienen modelos de celdas/controles 2D, evitando cuidadosamente la alteración del gel. Lave los modelos celulares una vez con PBS estéril RT. Agregue 100 μL de medio reactivo vivo/muerto a cada pocillo para una placa de 96 pocillos o 25 μL para una placa de 384 pocillos.
- Incubar los modelos durante 30 min a 37 °C y 5% de CO2.
- Después de la incubación, los modelos están listos para la obtención de imágenes. Realice la obtención de imágenes en cualquier microscopio estándar con canales de excitación rojo (647 nm, células muertas), verde (488 nm, células vivas) y azul (405 nm, tinción nuclear). Para obtener los mejores resultados en los modelos 3D, tome imágenes con un microscopio confocal de alto contenido y realice la obtención de imágenes con una función de pila Z con un aumento de 4x o 10x.
NOTA: En este estudio, se obtuvieron imágenes de modelos celulares utilizando el INCell Analyzer 6500HS (sistema de imágenes de alto contenido) y el análisis se llevó a cabo utilizando Signals Image Artist (plataforma de análisis de imágenes, ver paso 4.7). - Una vez completadas las imágenes, devuelva los modelos celulares a la incubadora de cultivo celular a 37 °C y 5 % de CO2. Sin embargo, omita los modelos celulares utilizados para el análisis de viabilidad de estudios posteriores debido a los medios reactivos vivos/muertos sobre la viabilidad a largo plazo.
- Análisis de imágenes en la plataforma de análisis de imágenes
- Seleccione cada plano de la imagen de la pila Z en el software. Combine imágenes planas como una imagen de proyección de máxima intensidad.
- Cree un nuevo análisis seleccionando el modelo bioimpreso como región de interés (ROI) identificando la fluorescencia del canal de células vivas a 488 nm (asegúrese de que todas las células estén seleccionadas en ROI).
- Dentro de la región de interés, utilice el software de imágenes para identificar el número de células en el ROI a través del canal de tinción nuclear (405 nm), el número de células vivas en el ROI utilizando el canal de 488 nm y el número de células muertas en el ROI utilizando el canal de 647 nm.
- Ejecute el análisis en todos los pocillos del modelo de celda tratada viva/muerta y exporte la tabla de datos que contiene el área de ROI, el número total de celdas, el número de celdas vivas y el número de celdas muertas.
- Calcule el número de células vivas y muertas como porcentaje del número total de células por día de análisis.
5. Inmunotinción y análisis de poblaciones celulares
- Antes de la fijación, retire el medio de los modelos de celda y lave los modelos una vez en PBS.
- Fije las células con paraformaldehído al 4% (v/v) en PBS a RT durante 20 min.
PRECAUCIÓN: Todos los trabajos con paraformaldehído deben realizarse de acuerdo con los procedimientos de laboratorio. - Aspire la solución de paraformaldehído al 4% (v/v) de los modelos y lávelos cuatro veces en PBS para eliminar completamente el paraformaldehído.
- Permeabilizar los modelos celulares con triton-X al 0,2% durante 30 min a RT y lavar tres veces con PBS.
- Bloquee los modelos celulares utilizando suero de burro normal (NDS) al 10% (v/v) durante 3 h en RT.
- Retire la solución de bloqueo y agregue anticuerpos primarios (diluidos en NDS v/v al 1% en PBS) a los modelos. Si realiza un análisis de proporción de poblaciones celulares (consulte el paso 5.11), asegúrese de incluir modelos celulares que estén teñidos conjuntamente para la tubulina Β-III (con conjugación AF647 roja) y GFAP (con conjugación AF488 verde). Incubar modelos con anticuerpos primarios durante 24 h a 4 °C.
- Después de la incubación primaria, lavar los modelos teñidos con anticuerpos primarios conjugados tres veces en PBS y contratinción con 20 μM de Hoechst durante 30 min. Imagen como se detalla en el paso 5.10.
- Lavar los modelos teñidos con anticuerpos primarios no conjugados tres veces en PBS y añadir anticuerpos secundarios (diluidos en NDS al 1% v/v en PBS). Incubar durante 24 h a 4 °C.
- Eliminar los anticuerpos secundarios lavando tres veces en PBS y contratiñir los modelos con 20 μM de Hoechst durante 30 minutos antes de la obtención de imágenes.
- Realice la obtención de imágenes en microscopios estándar con canales de excitación rojo (647 nm) y verde (488 nm). Sin embargo, para obtener los mejores resultados en los modelos 3D, tome imágenes con un microscopio confocal de alto contenido y realice la obtención de imágenes con una función de pila Z con un aumento de 4x o 10x.
- Análisis de ratios de población celular en la plataforma de análisis de imágenes
- Obtener un análisis de poblaciones celulares utilizando modelos co-teñidos para GFAP (con conjugación AF488) y tubulina Β-III (con conjugación AF647).
- Seleccione cada plano de la imagen de la pila Z en el software y combine las imágenes del plano como una imagen de proyección de máxima intensidad.
- Cree un nuevo análisis seleccionando el modelo bioimpreso como ROI mediante la identificación de la fluorescencia del canal de tubulina Β-III a 647 nm (asegúrese de que toda el área que contiene células esté seleccionada en ROI).
- Dentro del ROI, utilice el software para identificar el número de células en el canal de Hoechst (405 nm), el número de astrocitos GFAP+ en el ROI utilizando el canal de 488 nm y el número de células de tubulina+ Β-III en el ROI utilizando el canal de 647 nm.
- Ejecute el análisis en todos los pocillos del modelo de celda co-teñidos y exporte la tabla de datos que contiene el área de ROI, el número total de celdas, el número de celdas GFAP+ y el número de celdas de tubulina+ Β-III.
- Calcule el número de células GFAP+ y Β-III tubulina+ como porcentaje del número total de células.
Resultados
Análisis del crecimiento de neuritas
En este protocolo, las neuronas glutamatérgicas y los astrocitos derivados de iPSC se bioimprimieron en cocultivo en una matriz de hidrogel utilizando la bioimpresora 3D. Durante los primeros 7 días después de la impresión, se obtuvieron imágenes de las células cada 12 h utilizando un microscopio de células vivas. Después de la bioimpresión, las células deben tener una morfología redondeada y deben dispersarse por toda la matriz de hidrogel, cambiando gradualmente para formar grupos celulares más pequeños con pocas protuberancias durante los primeros días de cultivo (consulte el video complementario 1 para ver el crecimiento celular saludable representativo). Para el día 4, las células sanas migrarán a través del gel para formar grupos más grandes, que están conectados a través de excrecencias de neuritas. Para el día 7, casi no deberían quedar células individuales, los haces interconectados de neuritas y proyecciones astrocíticas deberían aparecer fortificados, y se pueden ver muchas excrecencias de neuritas más pequeñas formándose a partir de los grupos (Figura 2A). Utilizando una serie de imágenes de campo claro de células vivas tomadas durante el período de crecimiento de 7 días, se realizó un análisis del crecimiento de neuritas como se detalla en la sección 3. Este análisis demostró que el crecimiento de neuritas aumenta de manera casi lineal (valor R2 = 0,84) entre 12 h y 156 h (Figura 2B). Durante este período de crecimiento de las neuritas, los grupos de cuerpos celulares también aumentan de tamaño (ver Video Suplementario 1), lo que es indicativo de la migración celular a través del hidrogel.
Viabilidad celular y relación poblacional
En este protocolo, se utiliza una concentración de 20 millones de células/mL, que comprende 15 millones de neuronas/mL y 5 millones de astrocitos/mL, para bioimprimir los modelos celulares. Utilizando la tinción de células vivas con calceína-AM (células vivas), homodímero-1 de etidio (células muertas) y una tinción nuclear, el número de células que sobreviven durante un período de 7 días puede calcularse según la sección 4 (Figura 3A). Los resultados de viabilidad celular para cultivos representativos se muestran para el día 4, donde el 72% ± el 1% (media ± SEM) del total de células están vivas y muestran tinción para Calceína-AM, mientras que el 29% ± 2% (media ± SEM) células totales están muertas y muestran tinción con homodímero-1 de etidio (Figura 3B). En la Figura suplementaria 1 se pueden ver imágenes representativas de la tinción celular con Calceína-AM y homodímero-1 de etidio. Hay que tener en cuenta que los valores de supervivencia celular de los cultivos 3D no se pueden comparar directamente con los cultivos 2D, ya que las células muertas quedan retenidas en el hidrogel y no se eliminan durante los procesos de alimentación celular.
Utilizando la tinción inmunofluorescente para la tubulina Β-III y GFAP, como se describe en la sección 5 y en la Figura 4, se puede llevar a cabo el análisis de imágenes para determinar las proporciones de población celular entre neuronas y astrocitos (Figura 3A). Del total de células por modelo en cultivos representativos, las neuronas positivas para tubulina Β-III representan el 49% ± el 3% (media ± SEM), mientras que los astrocitos GFAP positivos representan el 30% ± el 4% (media ± SEM). Esto da una proporción de 1:1,5, astrocitos a neuronas, respectivamente. Esto deja un remanente del 21% de células totales por modelo, que no se tiñen para ninguno de los marcadores celulares. Como el análisis de viabilidad celular demostró que un valor medio del 29% de las células no son viables en el día 4, es probable que estas células estén muertas dentro del hidrogel.
Expresión de marcadores celulares
La morfología de las neuronas y astrocitos bioimpresos se evaluó mediante inmunotinción para el marcador de tipo de célula neuronal (tubulina Β-III) y el marcador astrocítico (GFAP). En los cultivos representativos mostrados, la inmunotinción se localiza en tipos celulares individuales, mostrando una morfología celular sana, y ambos tipos celulares exhiben el crecimiento de protuberancias celulares (Figura 4A, B). Como las estructuras del hidrogel y de la célula son tridimensionales, cada imagen representa solo un corte a través de la estructura de la Figura 4A, B. La Figura 4C muestra una pila de imágenes fusionadas a lo largo del hidrogel, lo que demuestra vistas de la localización celular en los planos X, Y y Z. La Figura 4D muestra la inmunotinción para la tubulina Β-III solamente; resaltando las excrecencias de neuritas más finas de los grupos del cuerpo celular. Para examinar más a fondo el fenotipo de las neuronas glutamatérgicas, se puede llevar a cabo la inmunotinción del marcador del receptor iónico glutamatérgico, GluR2. Dentro de la Figura 4E, el área 4E.1 (recuadro) se ha resaltado para mostrar una tinción punteada de mayor resolución a lo largo de los haces de neuritas. Esto, por lo tanto, confirma que las neuronas de este cocultivo tienen un fenotipo glutamatérgico. En todas las imágenes de inmunotinción, se pueden observar estructuras no celulares teñidas con inmunofluorescencia alrededor de los grupos celulares y las neuritas. Es probable que estas estructuras representen desechos retenidos dentro del hidrogel en combinación con cantidades menores de anticuerpos no específicos que se unen al hidrogel. Esto es lo que se espera en los cultivos bioimpresos, ya que dentro de los modelos de andamios 3D, las células muertas y los desechos no se eliminan durante la alimentación celular. En la Figura complementaria 2 se muestra una imagen representativa de inmunotinción de control negativo para una demostración de la unión inespecífica de hidrogel de anticuerpos secundarios.
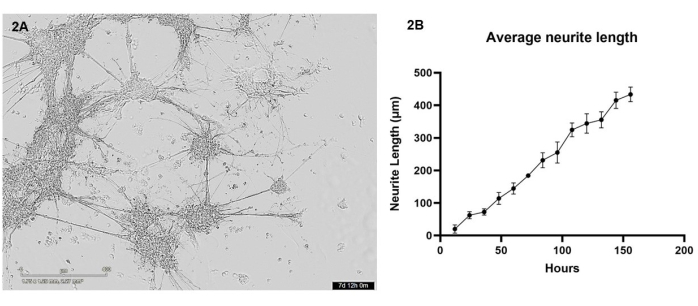
Figura 2: Las neuronas glutamatérgicas y los astrocitos se bioimprimieron en la matriz de hidrogel utilizando la bioimpresora y se obtuvieron imágenes cada 12 h utilizando un microscopio de campo claro. (A) Un ejemplo de imagen de campo claro tomada de cultivos celulares durante el análisis. La imagen representa el punto de tiempo 156 h y la barra de escala representa 400 μm. (B) La longitud media de las excrecencias de neuritas (μm) de los cultivos medidos con el paquete NeuronJ para ImageJ. Cada punto de datos es n = 3 neuritas, y los datos se muestran como media ± SEM. Haga clic aquí para ver una versión más grande de esta figura.
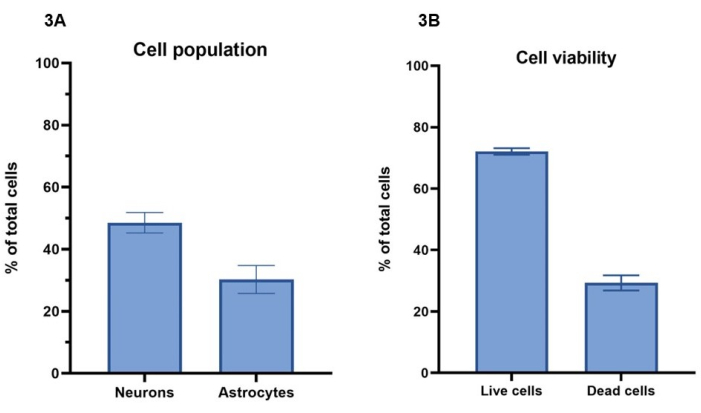
Figura 3: Se utilizó una concentración de 20 millones de células/mL de solución activadora para la bioimpresión de los modelos celulares. (A) La viabilidad celular se calculó utilizando colorantes de células vivas/muertas (Calceína-AM y etidio homodímero-1, respectivamente). Los valores muestran que el 72% ± el 1% (media ± SEM, n = 3) del total de células por pocillo están vivas y el 29% ± 2% (media ± SEM, n = 3) de las células están muertas de la población total de células por pocillo en el día 4. Los valores mostrados representan la media ± SEM. (B) Las poblaciones celulares, el porcentaje de neuronas y astrocitos por pocillo se calcularon mediante el análisis de imágenes de la tinción que se muestra en la Figura 4. Las neuronas representan el porcentaje de células que se tiñen positivas para la tubulina Β-III en el día 7 (49% ± 3%, media ± SEM, n = 3), mientras que los astrocitos representan el porcentaje de células que se tiñen positivas para GFAP en el día 7 (30% ± 4%, media ± SEM, n = 3). Los valores mostrados representan la media ± SEM. Todas las imágenes para los cálculos que se muestran en la Figura 3 se realizaron en un sistema de imágenes confocal, y todos los análisis se realizaron en la plataforma de análisis de imágenes y GraphPad Prism según los métodos. Haga clic aquí para ver una versión más grande de esta figura.
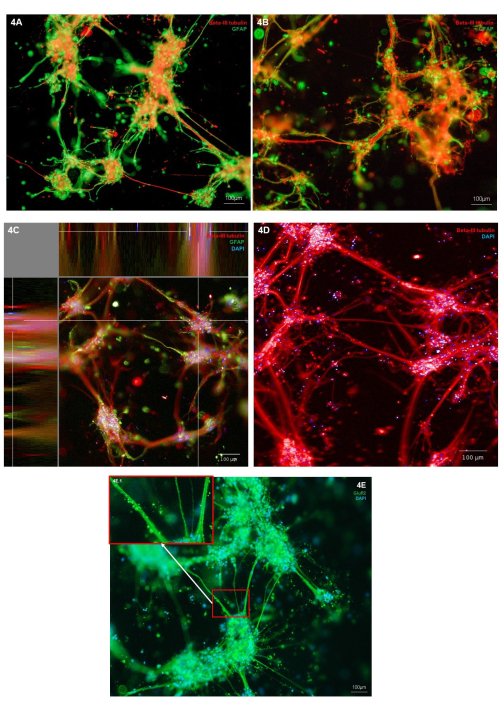
Figura 4: Expresión de marcadores de tipo de células neurales en cocultivos bioimpresos en 3D de neuronas glutamatérgicas y astrocitos en el día 7 . (A,B) Tinción inmunofluorescente del marcador neuronal Β-III tubulina y del marcador de astrocitos GFAP, obtenido en una plataforma de microscopio invertido con un aumento de 10x. Las barras de escala representan 100 μm. (C) Tinción inmunofluorescente del marcador neuronal β-III de tubulina y marcador de astrocitos GFAP co-teñido con Hoechst, mostrado en vista de plano XYZ, obtenido en un sistema de imágenes confocal con un aumento de 10x. Creado en la plataforma de análisis de imágenes. La barra de escala representa 100 μm. (D) Tinción inmunofluorescente del marcador neuronal β-III tubulina co-teñida con Hoechst, obtenida en un sistema de imágenes confocal con un aumento de 20x. La barra de escala representa 100 μm. (E) Tinción inmunofluorescente del marcador glutamatérgico GluR2 teñido conjuntamente con Hoechst, obtenido en una plataforma de microscopio invertido con un aumento de 10x. El recuadro 3E.1 muestra las áreas resaltadas de tinción de GluR2. La barra de escala representa 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
Video complementario 1: Las neuronas glutamatérgicas y los astrocitos se bioimprimieron en la matriz de hidrogel utilizando la bioimpresora y se obtuvieron imágenes cada 12 h con un microscopio de campo claro. Vídeo de las imágenes de campo claro tomadas de cultivos celulares durante el análisis, los puntos de tiempo se indican en la esquina inferior derecha y las barras de escala representan 400 μm. Haga clic aquí para descargar este archivo.
Figura complementaria 1: Imágenes de ejemplo de análisis vivo/muerto de neuronas y astrocitos bioimpresos en el día 4. La tinción de calceína-AM se muestra en verde (488 nm) y la tinción de homodímero de etidio se muestra en rojo (647 nm). La imagen se muestra en la vista de plano XYZ, creada en la plataforma de análisis de imágenes. La barra de escala representa 100 μm. (A) Las imágenes se llevaron a cabo utilizando un sistema de imágenes confocales con un aumento de 4x. (B) La obtención de imágenes se llevó a cabo utilizando un sistema de imágenes confocal con un aumento de 10x Haga clic aquí para descargar este archivo.
Figura complementaria 2: Ejemplo de imagen de control negativo después de la tinción inmunofluorescente. Se omitieron los anticuerpos primarios y se utilizaron anticuerpos secundarios verdes (488 nm) y rojos (647 nm) según los protocolos de inmunotinción. La imagen se muestra en la vista de plano XYZ, creada en la plataforma de análisis de imágenes. La barra de escala representa 100 μm. Las imágenes se llevaron a cabo utilizando un sistema de imágenes confocales con un aumento de 10x. Haga clic aquí para descargar este archivo.
Discusión
La necesidad de modelos precisos del SNC nunca ha sido mayor, y las limitaciones de los modelos de cultivo celular tradicionales bidimensionales (2D) han impulsado una generación de modelos complejos del SNC en los últimos años19. Sin embargo, muchos modelos 3D complejos que representan interacciones entre los tipos de células neuronales y la MEC tienen limitaciones que impedirían la aplicación de estos modelos en procesos industriales 6,20,21. En este protocolo, desarrollamos un modelo de cocultivo 3D de neuronas y astrocitos humanos derivados de iPSC, que tiene como objetivo resolver algunas de estas limitaciones utilizando la tecnología de bioimpresión 3D para crear un andamio de hidrogel bioactivo en formatos de 96 y 384 pocillos.
La metodología para el desarrollo de estos modelos se ha simplificado a través del software de diseño de mapas de placas, protocolos de impresión autogenerados y el proceso de impresión guiado desde la bioimpresora. Sin embargo, debido a la naturaleza sensible de los tipos de células sensibles derivadas de iPSC utilizados en este protocolo, se debe tener cuidado con los siguientes pasos críticos en la descongelación y el cultivo. En primer lugar, la inclusión del inhibidor de ROCK (ROCKi) tiene varios beneficios a lo largo del proceso de bioimpresión y durante el cultivo temprano. La descongelación celular es un punto crítico en el que las neuronas pueden experimentar una respuesta de estrés, y los protocolos de descongelación inadecuados pueden disminuir las posibilidades de supervivencia22. Por lo general, se recomienda descongelar las células, agregar medios y elevarlas a la temperatura de la incubadora de la manera más eficiente posible23. Sin embargo, durante el proceso de bioimpresión descrito en este protocolo, es necesario que las neuronas y los astrocitos se resuspendan en una solución activadora en lugar de en un medio, y las células no se elevarán por encima de la temperatura ambiente hasta el final de la tirada de impresión (hasta 30 minutos después de la descongelación). Por lo tanto, la adición de ROCKi al medio inmediatamente después de la descongelación e incluirlo durante los dos pasos de centrifugación (pasos 2.1-2.7 y 1.3.15-1.3.20) es imprescindible para inhibir las vías de estrés celular, lo que daría lugar a niveles de viabilidad más bajos24. Además, se ha demostrado que ROCKi promueve el crecimiento de neuritas y mejora la maduración neuronal25. Por lo tanto, la suplementación con ROCKi se continúa durante 48 h después de la bioimpresión. Sin embargo, es imperativo eliminar la suplementación con ROCKi después de 48 h para garantizar un lavado completo durante los cambios de medios posteriores antes de que las células se utilicen para el ensayo.
Un paso adicional que requiere una atención crítica es durante la adición de medios post-impresión y los cambios de medios (pasos 2.8-2.13). El andamio de hidrogel bioimpreso tiene una rigidez biomecánica equivalente de solo 1,1 kPa, equivalente a la materia gris. Como se describe en el paso 2.10, es fundamental pipetear suavemente en el costado del pocillo durante la adición y aspiración de medios para evitar perturbaciones. Esto es de particular relevancia para las placas de 384 pocillos, donde el nivel de gel ocupa una mayor proporción del volumen total del pocillo. Este método también debe utilizarse en pozos de control 2D para evitar el levantamiento de los bordes de las células y el cizallamiento de las excrecencias de las neuritas. Los autores también quieren destacar la importancia de la técnica estéril dentro de la bioimpresora, que debe tratarse con una precaución equivalente a la de una cabina de bioseguridad utilizada para cultivos celulares derivados de iPSC. Esto incluye el filtrado estéril al 70% de EtOH y dH2O utilizado en los procedimientos de impresión y luz verde, el mantenimiento de las tapas en los cartuchos y placas mientras se mueven las manos dentro y fuera de la bioimpresora, y la descontaminación de las superficies dentro de la bioimpresora con toallitas de etanol al 70% antes y después de la impresión.
El andamio de hidrogel bioimpreso, formado a partir de soluciones de biotinta y activador, seleccionado para desarrollar este modelo se selecciona entre una gama de biotintas y soluciones activadoras desarrolladas por Inventia Life Science para su uso dentro de la bioimpresora RASTRUM. La laminina y el ácido hialurónico fueron identificados como moléculas relevantes para la maduración neuronal derivada de iPSC debido a su papel en la guía axonal, la formación de sinapsis y la formación de la red perineuronal26,27. Además, se seleccionó una rigidez biomecánica de 1,1 kPa, ya que se ha demostrado que los hidrogeles de menor densidad permiten un mejor crecimiento de neuritas de las neuronas12. Si se realizan modificaciones en el protocolo mediante el uso de neuronas y astrocitos que han sido diferenciados internamente o de un proveedor comercial diferente, se recomendaría realizar una prueba de selección de matriz para determinar el andamio de hidrogel de mayor apoyo15. Además, es posible que también sea necesario optimizar la densidad celular si se realizan cambios en las fuentes celulares para garantizar una viabilidad óptima y evitar el hacinamiento de hidrogeles. Para todas las modificaciones y la resolución de problemas relacionados con la función de la bioimpresora, los autores recomiendan ponerse en contacto con los fabricantes y hacer referencia a los protocolos de los fabricantes.
El SNC contiene una amplia gama de subtipos neuronales y células gliales, todas las cuales existen en diferentes nichos cerebrales y tienen funciones específicas que contribuyen a la función neuronal28. En el contexto de este amplio alcance, este modelo representa solo los dos tipos celulares más abundantes (astrocitos y neuronas glutamatérgicas excitatorias). Los tipos de células importantes, como la microglía, los oligodendrocitos y las células endoteliales formadoras de la barrera hematoencefálica, se omiten de este sistema. La inclusión de la microglía podría ser relevante en el enfoque de las interacciones neuroinmunes, y los oligodendrocitos podrían ser de interés en las enfermedades que afectan a la mielinización central. Además de su papel en la patología, células como las células endoteliales formadoras de la barrera hematoencefálica excretan enzimas metabolizadoras de fármacos, lo que podría afectar al uso de este modelo para ensayos farmacocinéticos29. Otra limitación del modelo puede ser la relación entre astrocitos y neuronas; La relación entre astrocitos y neuronas varía mucho entre regiones cerebrales, con valores sugeridos entre 1:1 y 1:330,31. Este modelo tiene una relación aproximada de 1:1,5 astrocitos por neuronas; Por lo tanto, este modelo podría no ser relevante para modelar áreas cerebrales donde los astrocitos son más abundantes, como en las áreas de sustancia blanca30.
En los últimos años se han publicado otros protocolos para desarrollar modelos de cocultivo bioimpresos en 3D. Una publicación de Sullivan et al., 2021, presentó un modelo neuronal bioimpreso en 3D utilizando células progenitoras neurales derivadas de iPSC, que demuestra una alta viabilidad posterior a la impresión y una mejora de la función neuronal en comparación con los cultivos 2D32. Sin embargo, en este protocolo se utilizaron células progenitoras neurales como fuente celular y se mantuvieron en cultivo durante 4 semanas. En este protocolo, se utilizaron neuronas glutamatérgicas y astrocitos derivados de iPSC disponibles comercialmente. Esto permite establecer una red 3D de células cocultivadas en tan solo 7 días; Como se demostró mediante el análisis del crecimiento de las neuritas, el crecimiento de las neuritas comienza dentro de las 24 h y continúa de manera lineal durante el período de 156 h durante el cual se monitoreó el crecimiento celular. El rápido establecimiento de estas redes puede atribuirse en parte al uso de neuronas glutamatérgicas que utilizan la expresión génica optimizada inducible por doxiciclina de NGN2, que muestra la expresión de marcadores de subtipos neuronales maduros en 7 días, incluso en cultivo 2D33. El acortamiento de este período de crecimiento mediante esta técnica es importante para la implementación de modelos dentro de la industria biofarmacéutica, ya que el desarrollo de ensayos requiere una rápida respuesta y el desarrollo de modelos celulares15.
En conclusión, este modelo muestra potencial para un modelo 3D de neuronas y astrocitos, que se establece de forma rápida y cómoda para fines de cribado. Las aplicaciones futuras de este tipo de modelo podrían ser para los esfuerzos de descubrimiento de fármacos en diferentes enfermedades del SNC, con la oportunidad de expandirse a diferentes enfermedades utilizando líneas de iPSC de pacientes o enfermedades editadas genéticamente. Además, el uso de neuronas glutamatérgicas derivadas de iPSC derivadas de la expresión de NGN2 inducible por doxiciclina permite que las células alcancen la madurez en menos tiempo, lo que puede utilizarse para desarrollar modelos del cerebro envejecido para la investigación de la neurodegeneración. Este sistema también podría ampliarse mediante el uso de otros tipos de células en el cocultivo, como la microglía y los oligodendrocitos.
Divulgaciones
CW, NC y JB son empleados de Merck Sharp & Dohme (UK) Limited, Londres, Reino Unido. YH es un empleado de Merck Sharp & Dohme LLC, una subsidiaria de Merck & Co., Inc., Rahway, NJ, USA.
La figura uno se creó con Biorender.com.
Agradecimientos
Los autores desean agradecer a Alex Volkerling, Martin Engel y Rachel Bleach por su ayuda en el desarrollo del protocolo y los comentarios sobre el manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Thermofisher | 31350010 | |
| 384-well plate | PerkinElmer | 6057300 | |
| 96-well plate | PerkinElmer | 6055300 | |
| Activator fluid F299 | Inventia Life Science | N/A | |
| Activator fluid F3 | Inventia Life Science | N/A | |
| B27 (50x) minus Vit A | Thermofisher | 12587010 | |
| Bioink fluid F261 | Inventia Life Science | N/A | |
| Bioink fluid F32 | Inventia Life Science | N/A | |
| Doxycycline hyclate | Sigma Aldrich | D5207 | |
| GlutaMAX (100x) | Thermofisher | 35050061 | |
| Goat anti-mouse IgG H&L Alexa Fluor 647 | Abcam | ab150115 | |
| Goat anti-rabbit IgG H&L Alexa Fluor 488 | Abcam | ab150077 | |
| Hoechst | Abcam | ab228551 | |
| Human BDNF Recombinant Protein | Thermofisher | PHC7074 | |
| Human NT3 Recombinant Protein | Thermofisher | PHC7036 | |
| iCell Astrocytes | Fujifilm CDI | 1434 | |
| INCell Analyser 6500HS | Molecular Devices | N/A | high content imaging system |
| Incucyte S3 | Sartorius | N/A | |
| ioGlutamatergic Neurons (Large vial) | Bit.bio | e001 | |
| Laminin (1 mg/mL) | Sigma Aldrich | L2020 | |
| Live/dead kit (Calcein-AM, Ethidium homo-dimer-1) | Invitrogen | L3224 | |
| Mouse anti-BIII tubulin NL637 conjugated | R&D systems | SC024 | |
| Neurobasal media | Thermofisher | 21103049 | |
| Normal Donkey Serum | Abcam | ab7475 | |
| NucBlue Live (Hoechst 33342) | Thermofisher | R37605 | |
| Opti-MEM | Thermofisher | 11058021 | |
| Paraformaldehyde | Sigma Aldrich | P6148 | |
| PEI 50% in H2O | Sigma Aldrich | 181978 | |
| Pierce Borate Buffer 20x | Thermofisher | 28341 | |
| Prism | GraphPad | Data analysis software | |
| Rabbit anti-ionotropic glutamatre receptor 2 (GluR2) | Abcam | ab206293 | |
| RASTRUM(TM) Bioprinter | Inventia Life Science | N/A | Bioprinter |
| RASTRUM(TM) Bioprinter Cartridges | Inventia Life Science | N/A | Bioprinter Cartridges |
| RASTRUM(TM) Targeting plate | Inventia Life Science | N/A | Targeting plate |
| Rho kinase (ROCK) inhibitor | Abcam | ab120129 | |
| Sheep anti-GFAP NL493 conjugated | R&D systems | SC024 | |
| Signals Image Artist | PerkinElmer | N/A | Image analysis platform |
| Triton X-100 | Thermofisher | HFH10 | |
| Zeiss Axio Observer | Zeiss | N/A | Inverted microscope platform |
Referencias
- Jung, Y. L., Hwang, J., Yoo, H. S. Disease burden metrics the innovations of leading pharmaceutical companies: a global and regional comparative study. Globalization and Health. 16 (1), 80-80 (2020).
- Potkin, S. G., et al. The neurobiology of treatment-resistant schizophrenia: paths to antipsychotic resistance and a roadmap for future research. npj Schizophrenia. 6, 1(2020).
- Keswani, C., et al. The Global Economic Impact of Neurodegenerative Diseases: Opportunities and Challenges. Bioeconomy for Sustainable Development. , Springer, Singapore. (2019).
- Perucca, E. The pharmacological treatment of epilepsy: recent advances and future perspectives. Acta Epileptologica. 3 (1), 22(2021).
- Nikolakopoulou, P., et al. Recent progress in translational engineered in vitro models of the central nervous system. Brain. 143 (11), 3181-3213 (2020).
- Whitehouse, C., Corbett, N., Brownlees, J. 3D models of neurodegeneration: implementation in drug discovery. Trends in Pharmacological Sciences. 44 (4), 208-221 (2023).
- Rauti, R., Renous, N., Maoz, B. M. Mimicking the brain extracellular matrix in vitro: A review of current methodologies and challenges. Israel Journal of Chemistry. 60 (12), 1141-1151 (2020).
- Fawcett, J. W., Oohashi, T., Pizzorusso, T. The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature Reviews Neuroscience. 20 (8), 451-465 (2019).
- Lam, D., et al. Tissue-specific extracellular matrix accelerates the formation of neural networks and communities in a neuron-glia co-culture on a multi-electrode array. Scientific Reports. 9, 4159(2019).
- Roll, L., Lessmann, K., Brüstle, O., Faissner, A. Cerebral organoids maintain the expression of neural stem cell-associated glycoepitopes and extracellular matrix. Cells. 11 (5), 760(2022).
- Yan, Y., Bejoy, J., Marzano, M., Li, Y. The use of pluripotent stem cell-derived organoids to study extracellular matrix development during neural degeneration. Cells. 8 (3), 242(2019).
- Ma, L., et al. 3D bioprinted hyaluronic acid-based cell-laden scaffold for brain microenvironment simulation. Bio-Design and Manufacturing. 3 (3), 164-174 (2020).
- Liaw, C. -Y., Ji, S., Guvendiren, M. Engineering 3D hydrogels for personalized in vitro human tissue models. Advanced Healthcare Materials. 7 (4), 1701165(2018).
- Ma, J., Huang, C. Composition and mechanism of three-dimensional hydrogel system in regulating stem cell fate. Tissue Engineering Part B: Reviews. 26 (6), 498-518 (2020).
- Belfiore, L., et al. Generation and analysis of 3D cell culture models for drug discovery. European Journal of Pharmaceutical Sciences. 163, 105876(2021).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Engel, M., Belfiore, L., Aghaei, B., Sutija, M. Enabling high throughput drug discovery in 3D cell cultures through a novel bioprinting workflow. SLAS Technology. 27 (1), 32-38 (2022).
- Takamura, T., et al. Influence of age on global and regional brain stiffness in young and middle-aged adults. Journal of Magnetic Resonance Imaging. 51 (3), 727-733 (2020).
- Slanzi, A., Iannoto, G., Rossi, B., Zenaro, E., Constantin, G. In vitro models of neurodegenerative diseases. Frontiers in Cell and Developmental Biology. 8, 328(2020).
- de Souza, N. Organoid variability examined. Nature Methods. 14 (7), 655-655 (2017).
- Hernández, D., et al. Culture variabilities of human iPSC-derived cerebral organoids are a major issue for the modelling of phenotypes observed in Alzheimer's disease. Stem Cell Review and Reports. 18 (2), 718-731 (2022).
- Li, R., et al. Differentiation of human iPS cells into sensory neurons exhibits developmental stage-specific cryopreservation challenges. Frontiers in Cell and Developmental Biology. 9, 796960(2021).
- Nishiyama, Y., et al. Safe and efficient method for cryopreservation of human induced pluripotent stem cell-derived neural stem and progenitor cells by a programmed freezer with a magnetic field. Neuroscience Research. 107, 20-29 (2016).
- Uhrig, M., Ezquer, F., Ezquer, M. Improving cell recovery: Freezing and thawing optimization of induced pluripotent stem cells. Cells. 11 (5), 799(2022).
- Harbom, L. J., et al. The effect of rho kinase inhibition on morphological and electrophysiological maturity in iPSC-derived neurons. Cell and Tissue Research. 375 (3), 641-654 (2019).
- Koh, H. S., Yong, T., Chan, C. K., Ramakrishna, S. Enhancement of neurite outgrowth using nano-structured scaffolds coupled with laminin. Biomaterials. 29 (26), 3574-3582 (2008).
- Tarus, D., et al. Design of hyaluronic acid hydrogels to promote neurite outgrowth in three dimensions. ACS Applied Materials & Interfaces. 8 (38), 25051-25059 (2016).
- Brain Initiative Cell Census Network (BICCN). Initiative Cell Census Network (BICCN). A multimodal cell census and atlas of the mammalian primary motor cortex. Nature. 598 (7879), 86-102 (2021).
- Dauchy, S., et al. Expression and transcriptional regulation of ABC transporters and cytochromes P450 in hCMEC/D3 human cerebral microvascular endothelial cells. Biochemical Pharmacology. 77 (5), 897-909 (2009).
- Herculano-Houzel, S. The glia/neuron ratio: How it varies uniformly across brain structures and species and what that means for brain physiology and evolution. Glia. 62 (9), 1377-1391 (2014).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Sullivan, M. A., et al. 3D bioprinting of stem cell-derived central nervous system cells enables astrocyte growth, vasculogenesis and enhances neural differentiation/function. bioRxiv. , (2022).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).
Erratum
Formal Correction: Erratum: Three-Dimensional Bioprinting of Human iPSC-Derived Neuron-Astrocyte Cocultures for Screening Applications
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for: Three-Dimensional Bioprinting of Human iPSC-Derived Neuron-Astrocyte Cocultures for Screening Applications. The Authors section was updated from:
Chloe Ann Whitehouse1
Yufang He2
Janet Brownlees1
Nicola Corbett1
1MSD R&D Innovation Centre Ltd
2Merck & Co., Inc.
to:
Chloe Ann Whitehouse1
Yufang He2
Janet Brownlees1
Nicola Corbett1
1MSD Research Laboratories, London, UK
2Merck & Co., Inc., Rahway, NJ, USA
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados