Method Article
Трехмерная биопечать кокультур нейронов и астроцитов человека, полученных из ИПСК человека, для скрининговых применений
В этой статье
Erratum Notice
Резюме
Здесь мы представляем протокол для получения 3D-биопечатных кокультур нейронов и астроцитов, полученных из ИПСК. Эта модель кокультуры, созданная в гидрогелевом каркасе в 96- или 384-луночном формате, демонстрирует высокую постпечатную жизнеспособность и рост нейрита в течение 7 дней и показывает экспрессию маркеров зрелости для обоих типов клеток.
Аннотация
Для того, чтобы клеточная модель была жизнеспособной для скрининга лекарственных препаратов, система должна соответствовать требованиям к пропускной способности и однородности, а также иметь эффективное время разработки. Однако многие опубликованные 3D-модели не удовлетворяют этим критериям. Таким образом, это ограничивает их полезность в ранних приложениях для разработки лекарств. Трехмерная (3D) биопечать — это новая технология, которая может быть применена для разработки 3D-моделей для ускорения разработки, повышения стандартизации и увеличения производительности. В данной статье мы представляем протокол для разработки 3D-биопечатных моделей кокультур глутаматергических нейронов и астроцитов, полученных из индуцированных плюрипотентных стволовых клеток человека (ИПСК). Эти кокультуры встроены в гидрогелевую матрицу, состоящую из биоактивных пептидов, белков полноразмерного внеклеточного матрикса (ECM) и имеют физиологическую жесткость 1,1 кПа. Модель может быть быстро установлена в 96-луночном и 384-луночном форматах, а средняя послепечатная жизнеспособность составляет 72%. Показано, что соотношение астроцитов и нейронов в этой модели составляет 1:1,5, что находится в пределах физиологического диапазона для человеческого мозга. Эти 3D-биопечатные клеточные популяции также показывают экспрессию маркеров типа зрелых нейральных клеток и рост проекций нейритов и астроцитов в течение 7 дней после культивирования. В результате эта модель пригодна для анализа с использованием клеточных красителей и методов иммуноокрашивания наряду с анализом роста нейритов. Возможность создавать эти физиологически репрезентативные модели в большом масштабе делает их идеальными для использования в скрининговых анализах со средней и высокой пропускной способностью для целей нейробиологии.
Введение
Исследования заболеваний центральной нервной системы (ЦНС) в индустрии разработки лекарств расширяются1. Тем не менее, многие распространенные заболевания ЦНС, такие как эпилепсия, шизофрения и болезнь Альцгеймера, до сих пор не поддаются лечению 2,3,4. Отсутствие эффективных методов лечения заболеваний ЦНС может, по крайней мере частично, объяснить отсутствием точныхмоделей головного мозга in vitro. Это привело к трансляционному разрыву между текущими моделями in vitro и данными in vivo и, как следствие, к узкому месту в исследовательских усилиях.
В связи с этим трансляционным разрывом в последние годы наблюдается значительный рост разработки новых 3D-моделей клеток, включая нейронные органоиды, нейросфероидыи модели на основе скаффолдов. 3D-структура этих моделей помогает рекапитулировать нейронное микроокружение, включая биомеханические стрессы, межклеточные контакты и внеклеточный матрикс мозга (ECM)7. ВКМ головного мозга является динамическим элементом нейрофизиологии, который занимает пространство между типами нервных клеток, включая нейроны, астроциты, олигодендроциты и нервно-сосудистый блок7. Было показано, что рекапитуляция ВКМ мозга влияет на морфологию нейронов и возбуждение нейронов, и многие сложные 3D-модели мозга продемонстрировали отложение белков ВКМ нервными клеткамитипов 8,9,10,11. Модели, основанные на скаффолдах, состоят из зрелых нейронных кокультур, подвешенных в пористой синтетической или биологической гидрогелевой матрице, которая представляет собой ECM12 мозга. В отличие от органоидных и сфероидных систем, 3D-модели на основе скаффолдов позволяют настраивать присутствующие белки ECM и имеют дополнительное преимущество в виде настраиваемости жесткости гидрогеля для имитации биомеханических напряжений13,14.
Несмотря на то, что подавляющее большинство 3D-нейронных моделей демонстрируют повышенную рекапитуляцию микроокружения мозга, не все модели хорошо подходят дляреализации приложений для разработки лекарств. Для того чтобы 3D-модель могла быть внедрена в промышленные процессы, система должна соответствовать требованиям к пропускной способности для применения в области скрининга и иметь относительно короткое время разработки16. 3D-биопечать — это новая технология, которая предлагает потенциал для создания нейронных моделей на основе 3D-каркасов с быстрым временем разработки, повышенной производительностью и более высоким уровнем точности контроля, наряду с устранением вариативности, вызваннойчеловеческой ошибкой. Этот протокол представляет собой 3D-модель кокультуры глутаматергических нейронов и астроцитов человека, полученных из ИПСК, в гидрогелевом каркасе. Этот гидрогелевый каркас содержит физиологически репрезентативные биоактивные пептиды (RGD, IKVAV, YIGSR) и белки ECM в миметической биомеханической жесткости. Эти полноразмерные белки ECM включают полноразмерный ламинин-211 и гиалуроновую кислоту, в изобилии присутствующие в коре головного мозга человека, с жесткостью 1,1 кПа, что соответствует измерениям in vivo 18. Эта модель разработана с практичностью для разработки лекарств и создается с помощью 3D-биопринтера в формате 96-луночной или 384-луночной пластины, подходящей для скринингового анализа с использованием методов визуализации с клеточными красителями и антителами, а также анализов роста нейритов. Клетки демонстрируют экспрессию маркеров типа нейральных клеток и рост нейритовых и астроцитарных проекций в течение 7 дней после культивирования. Таким образом, в этом протоколе будет представлена методология разработки высокопроизводительной 3D-модели нейронной кокультуры для использования в приложениях для разработки лекарств.
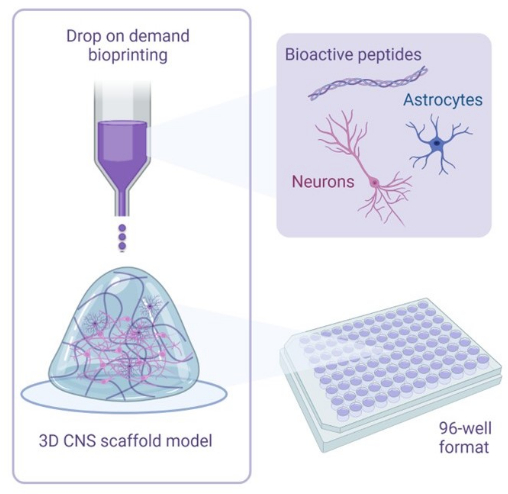
Рисунок 1: Иллюстративный обзор методологии, используемой для 3D-биопечати кокультур. Нейроны и астроциты, полученные из ИПСК человека, комбинируются с растворами активаторов и биочернил, содержащими биоактивные пептиды, и биопечатаются на гидрогелевые каркасы в 96-луночном или 384-луночном форматах с использованием технологии биопечати «капля по требованию». Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
протокол
1. Биопечать 3D-моделей
- Создание карты пластин и файла печати
- Перед созданием модели сгенерируйте карту пластин, протокол и файл печати с помощью программного обеспечения для карт пластин. Откройте программное обеспечение для создания карт пластин и выберите опцию Culture Cells in 3D .
- Выберите тип модели для биопечати из доступных вариантов в выпадающем меню; Эта модель была проверена в форматах Imaging Model и HTP . Выберите модель визуализации для 96-луночных планшетов и HTP для 384-луночных планшетов.
- В окне «Выбор матрицы » выберите гидрогель Px02.53, содержащий ламинин-211 и белки гиалуроновой кислоты, с пептидами IKVAV, RGD и YIGSR.
- Во всплывающем окне введите типы клеток как Глутаматергические нейроны и Астроциты , а плотность клеток введите 20 миллионов клеток/мл.
- Используйте программное обеспечение для создания желаемой карты пластин, выделяя лунки на экранной пластине. Включите в конструкцию не менее 1 строки 2D-контроля на пластике . 2D-контроль на пластиковых скважинах состоит из ячеек, закладываемых непосредственно в скважину без какого-либо гидрогелевого каркаса; Покройте эти лунки в соответствии с шагом 1.2.
- Убедитесь, что модель пластины, указанная в верхней части окна, изменена на предполагаемую модель пластины для использования (см. Таблицу материалов).
- Загрузите протокол и распечатайте файл для карты пластин с помощью кнопок загрузки и сохраните их на компьютере, подключенном к биопринтеру.
- Нанесение покрытий 2D контроля на пластиковые скважины
- По крайней мере, за 24 часа до печати покройте лунки для 2D-моделей контроля адгезии и роста клеток. Скважины с 3D-моделями не требуют предварительного покрытия. Все процессы должны выполняться в шкафу биобезопасности, если не указано иное. Пластины могут быть покрыты и подготовлены за 7 дней до печати.
- Приготовьте 50 мл 1x боратного буфера, разбавив 2,5 мл 20x боратного исходного раствора 47,5 мл стерильного dH2O.
- Добавьте 100 мкл 50%-ного (w/v) полиэтиленимина (PEI) к 50 мл 1x боратного буфера для создания 0,1% (w/v) раствора PEI и стерильного фильтра через фильтр 0,22 мкм.
- Добавьте 0,1% (по массе) раствора PEI в каждую 2D-контрольную скважину, как показано на карте пластин, созданной на шаге 1.1. Добавьте 100 мкл/лунку при использовании 96-луночного планшета или 25 мкл/лунку при использовании 384-луночного планшета.
- Инкубируйте планшет в течение 2 ч при 37 °C, прежде чем отсасывать 0,1% (массовый) раствор PEI и промывать лунки 5 раз PBS. Дайте лункам полностью высохнуть в шкафу биобезопасности.
- Разводят 100 мкл 1 мг/мл раствора ламинина в 5 мл нейробазальной среды. Добавьте 100 мкл в каждую 2D-контрольную лунку при использовании 96-луночного планшета или 25 мкл при использовании 384-луночного планшета. Выдерживают 4 ч при 37 °C.
- При хранении планшетов оставьте раствор ламинина на месте после инкубации и храните при температуре 4 °C. Перед использованием пластины разогреть в течение 1 ч при температуре 37 °C.
- 3D-биопечать моделей кокультур
- Всегда соблюдайте стерильную технику при использовании биопринтера и протирайте перчатки, картриджи и культуральные планшеты 70% EtOH перед тем, как поместить их внутрь принтера. Если не указано иное, выполняйте все процессы вне биопринтера в шкафу биобезопасности.
- Включите компрессор биопринтера и инициализируйте принтер, нажав кнопку «Инициализировать » в программном обеспечении биопринтера. Как только начнется поток воздуха в принтере, протрите поверхности внутри принтера салфеткой с содержанием этиленоксида 70%.
- В день печати выполните управляемый процесс «зеленого света» в начале дня , чтобы убедиться в правильном состоянии сопла для тиража (минимальное состояние сопла 2A2B).
- Возьмите картридж биопринтера из стерильной упаковки, добавьте 20 мл стерильного dH2O в отсек А и добавьте 6 мл стерильно отфильтрованного 70% EtOH в отсеки B1-4. Вставьте картридж в левый держатель картриджа внутри биопринтера и поместите крышку пластины в специальный держатель крышки.
- Нажмите кнопку Greenlighting (Зеленый свет) на главном экране программного обеспечения и убедитесь в программном обеспечении, что картридж находится на месте в биопринтере и что крышка снята. Инициируйте процесс получения зеленого света.
- По запросу программного обеспечения убедитесь, что ни с левой, ни с правой иглы не видно постоянных капель. Впоследствии, по запросу программного обеспечения, убедитесь, что в отсеках B7 и B8 присутствует вода.
- После того, как биопринтер завершит этап самостоятельного получения зеленого света, вставьте стерильную 96-луночную плоскую нижнюю пластину без покрытия (отдельную от пластины с покрытием для биопечатных кокультур) и вставьте эту новую пластину в правую секцию держателя пластины биопринтера по запросу программного обеспечения. Прежде чем приступать к следующему шагу, убедитесь, что держатель пластины установлен на пластину высокого профиля, а крышка снята и помещена в специальный держатель крышки.
- Биопринтер помещает капли воды в каждую лунку 96-луночной пластины. После завершения поместите пластину из биопринтера и убедитесь, что капли воды присутствуют в каждой лунке планшета.
- Утилизируйте 96-луночную пластину, используемую для зеленого света, и дайте биопринтеру завершить процесс зеленого света. После завершения программное обеспечение сообщит состояние сопла биопринтера и подтвердит, что биопринтер готов к печати моделей. Накройте картридж крышкой и снимите его в шкаф биобезопасности для следующих действий.
- Используя программное обеспечение биопринтера, загрузите файл печати (сгенерированный на шаге 1.1) в программное обеспечение с помощью кнопки программного обеспечения Print Run и откройте протокол печати в формате pdf.
- Извлеките биочернила и жидкости-активаторы, как указано в протоколе печати pdf, при температуре -20 °C и разморозьте при комнатной температуре (RT) в течение 40 минут. Для гидрогелевой матрицы Px02.53 это будет включать: 1 флакон F32, 1 флакон F3, 1 флакон F261, 1 флакон F299. Не размораживайте биочернила и жидкости-активаторы в руках или на водяных банях.
- Поднесите 50 мл полной среды с доксициклином и ингибитором ROCK (полная среда +DOX/ROCKi) (см. шаг 2.2) в RT, пока биочернила и жидкости-активаторы оттаивают.
- После размораживания биочернил и активаторов подготовьте картридж в соответствии с инструкциями на последних двух страницах созданного протокола печати pdf. Картридж принтера будет повторно использован для этапов печати модели.
- Убедитесь, что в отсеке A1 содержится 40 млdH2O, а в отсеках B1 и B2 — 8 мл 70% EtOH. Добавьте 1,2 мл активатора F32 в C1, 1,2 мл F3 в C2 и 200 мкл F261 в C4.
- Извлеките из инкубатора пластину PEI и пластину с ламининовым покрытием и поместите ее внутрь принтера в правый отсек держателя пластин. На этом этапе не удаляйте раствор ламининовой среды из лунок. Убедитесь, что отсек держателя пластины установлен на низкопрофильную пластину , а крышка снята и находится в держателе крышки.
- Поместите картридж в биопринтер, убедившись, что крышка снята и помещена в держатель, и запустите тираж в программном обеспечении, нажав кнопку Print Inert Base в программном обеспечении биопринтера.
- Пока печатается инертное основание, извлеките пробирки с глутаматергическими нейронами и астроцитами из хранилища жидкого азота, разморозьте и снова взвесьте в соответствии с инструкциями в разделе 2.
- После размораживания клеток и добавления 8 мл полной среды +DOX/ROCKi к каждому типу ячеек отдельно (в соответствии с разделом 2) центрифугируют ячейки при 300 x g в течение 5 мин при RT.
- Аспирируют надосадочную жидкость и ресуспендируют оба типа клеток по отдельности в 1 мл полной среды +DOX/ROCKi.
- Добавьте 20 мкл клеточной суспензии к 20 мкл трипанового синего и перемешайте перед подсчетом клеток, чтобы определить концентрацию жизнеспособных клеток на мл для каждого типа клеток.
- Объедините в общей сложности 3 миллиона глутаматергических нейронов с 1 миллионом астроцитов в пробирке объемом 15 мл. Добавьте среду, чтобы создать общий объем 8 мл.
- Центрифугируют клетки при 300 x g в течение 5 мин при RT.
- Отсасывайте как можно больше надосадочной жидкости, не повреждая клеточную гранулу, и ресуспендируйте клеточную гранулу в 200 мкл жидкости-активатора F299.
- Обратите внимание, что жидкость-активатор вязкая; Поднимите и опустите пипетку, чтобы полностью ресуспендировать гранулу. Типы клеток деликатны; Сведите к минимуму сдвиг и пузырьки с помощью наконечника дозатора с широким отверстием и техники обратного пипетирования. Сильно поднимите и опустите пипетку вверх и вниз не более 3 раз, чтобы предотвратить потерю клеток.
- После того, как инертная базовая ступень будет завершена, поместите крышки на картридж и культуральную пластину, извлеките их из биопринтера и поместите в шкаф биобезопасности.
- Добавьте 200 мкл клеточной суспензии в F299 в лунку C3 картриджа, снова вставьте картридж в биопринтер, снимите крышку и поместите его в держатель крышки. Пока не вставляйте культуральную прокладку обратно.
- Запустите этап Print Models (Модели печати ) тиража. Пока биопринтер заполняет жидкости, удалите раствор ламининовой среды из 2D-контрольных лунок планшета и замените его 150 мкл полной среды +DOX/ROCKi в каждую 2D-контрольную лунку при использовании 96-луночной пластины и 50 мкл полной среды +DOX/ROCKi при использовании 384-луночной пластины.
- После того, как жидкости будут загрунтованы, вставьте пластину для биопечати в биопринтер, снимите крышку и поместите ее в держатель крышки.
- Начните процесс нацеливания биопринтера.
- По запросу программного обеспечения для биопечати извлеките нацеливающую пластину из биопринтера.
- Используйте направляющую, чтобы выбрать, где можно наблюдать капли на пластине. Вставьте целевую пластину в биопринтер и повторите процесс печати и выбора капель.
- При появлении запроса снова снимите таргетную пластину, затем замените ее планшетом для клеточных культур (содержащим среду в 2D-контрольных лунках в соответствии с шагом 1.3.25). Убедитесь, что крышка планшета для культуры снята и помещена в держатель. Биопринтер завершит печать модели.
- После завершения печати модели следуйте методам культивирования клеток, описанным в разделе 2 (шаг 2.8), чтобы добавить среду в лунки.
- Начните процесс очистки биопринтера и после его завершения утилизируйте картриджи и оставшиеся жидкости в соответствии с лабораторными протоколами.
2. Клеточная культура
- Модели генерируются с использованием 1 флакона глутаматергических нейронов (>5 миллионов клеток в пробирке) и 1 флакона астроцитов (>1 миллион клеток во флаконе).
- Разогрейте водяную баню до 37 °C.
- Транспортируют оба флакона с клетками в лабораторию на сухом льду и погружают в водяную баню сразу после извлечения из сухого льда. Разморозьте оба флакона одновременно.
- Снимите флаконы с водяной бани, когда останется только небольшой кристалл льда; Это займет примерно 3 минуты после погружения. Не перемешивайте и не перемешивайте клетки на водяной бане.
- Опрыскайте флаконы 70% EtOH и перенесите их в шкаф биобезопасности.
- Добавьте 500 мкл полной среды +DOX/ROCKi по каплям в каждый флакон перед переносом каждой суспензии в отдельные пробирки по 15 мл.
- Долейте носитель в каждую пробирку до 8 мл и приступайте к этапам биопечати, как описано в шаге 1.3.
- После биопечати моделей (шаг 1.3) немедленно добавьте полный носитель +DOX/ROCKi во все лунки для 3D-кокультур и поместите модели в инкубатор при температуре 37 °C и 5%CO2. При использовании 96-луночного планшета добавьте 150 мкл среды на лунку; при использовании 384-луночной планшетной пластины используйте 50 мкл среды на лунку.
- В течение первых 48 часов культивирования не требуется смена среды.
- При смене среды на 2D-элементах управления и моделях следует соблюдать осторожность, чтобы не вызвать механическое напряжение, которое может отслоить 2D-культуры или вызвать деформацию гидрогеля. Медленно выполняйте аспирацию и добавление среды с помощью микропипетки, направленной вниз по краю лунки.
- Через 48 ч выполните 90%-ную замену среды на всех лунках и удалите ROCKi из состава среды (см. шаг 2.14).
- После 96-ч выполните дополнительную замену среды на 90% во всех лунках, чтобы удалить DOX из состава среды (см. шаг 2.14).
- После двух 90-процентных смен фильтрующего материала через 48 ч и 96 ч выполняйте 50-процентную замену фильтрующего материала каждые 48 ч, при этом 50% фильтрующего материала отсасывается и заменяется свежим полным фильтрующим материалом
- Состав носителя:
- Полная среда: нейробазальная среда с 1x GlutaMAX, 1x B27, 12,5 нМ 2-меркаптоэтанол, 10 нг/мл NT3, 5 нг/мкл BDNF.
- Полная среда плюс доксициклин (DOX): нейробазальная среда с 1x GlutaMAX, 1x B27, 12,5 нМ 2-меркаптоэтанола, 10 нг/мл нейротрофина-3 (NT3), 5 нг/мкл нейротрофического фактора головного мозга (BDNF) и 1 мкг/мл доксициклина.
- Полная среда плюс ингибитор DOX/ROCK (ROCKi): нейробазальная среда с 1x GlutaMAX, 1x B27, 12,5 нМ 2-меркаптоэтанол, 10 нг/мл NT3, 5 нг/мкл BDNF, 1 мкг/мл доксициклина и 10 мкМ ингибитора ROCK.
3. Анализ роста нейритов
- Поместите клетки в микроскоп с живыми клетками для получения яркопольной визуализации сразу после добавления носителя после биопечати.
- Используйте программное обеспечение микроскопа, чтобы запланировать получение изображений клеток с 4-кратным увеличением в каждой лунке, включая 2D-контроль, каждые 12 часов в течение не менее 7 дней.
- Выполняйте смену среды каждые 48 ч, как описано в разделе 2, каждый раз помещая клетки обратно в микроскоп после смены среды.
- После 7 дней сбора данных экспортируйте изображения из программного обеспечения в .jpg формате
- Импортируйте все .jpg изображения в программное обеспечение ImageJ и конвертируйте файлы в 8-битный формат. Загрузите плагин NeuronJ и отслеживайте рост нейрита на изображениях, включая точки ветвления, с помощью инструмента трассировки.
- Используйте данные трассировки нейритов, полученные с помощью NeuronJ, чтобы построить график роста нейрита с течением времени.
4. Анализ жизнеспособности клеток
- Через каждые 24 часа в культуре окрашивайте 3 или более лунок для анализа жизнеспособности клеток с помощью набора для определения жизнеспособности клеток. Повторите этот шаг через 24 часа или 48 часов в течение всего исследования.
- За 30 мин до визуализации приготовьте живую/мертвую среду реагента, суспендировав живой клеточный реагент (1x кальцеин-AM) и реагент мертвых клеток (1x этидий гомодимер-1) и 1x краситель ядра живых клеток (Hoechst 33342) в 10 мл восстановленной сывороточной среды без фенолового красного (Opti-MEM). Пусть живые/мертвые среды с реагентами поступают в RT. Храните живые/мертвые среды реагентов вдали от прямых солнечных лучей из-за флуоресцентного отбеливания.
- Удалите среду из 3 лунок, содержащих модели ячеек / 2D-элементы управления, тщательно предотвращая повреждение геля. Промойте модели клеток один раз стерильным PBS RT. Добавьте 100 мкл живой/мертвой среды реагента в каждую лунку для 96-луночного планшета или 25 мкл для 384-луночного планшета.
- Инкубируют модели в течение 30 мин при 37 °C и 5% CO2.
- После инкубации модели готовы к визуализации. Визуализация на любом стандартном микроскопе с красным (647 нм, мертвые клетки), зеленым (488 нм, живые клетки) и синим (405 нм, ядерное окрашивание) каналами возбуждения. Для достижения наилучших результатов в 3D-моделях используйте конфокальный микроскоп с высоким содержанием и выполняйте визуализацию с помощью функции Z-stack при 4-кратном или 10-кратном увеличении.
ПРИМЕЧАНИЕ: В этом исследовании клеточные модели были визуализированы с помощью INCell Analyzer 6500HS (система визуализации с высоким содержанием), а анализ был проведен с помощью Signals Image Artist (платформа анализа изображений, см. шаг 4.7). - После завершения визуализации верните клеточные модели в инкубатор клеточных культур при температуре 37 °C и 5%CO2. Тем не менее, клеточные модели, используемые для анализа жизнеспособности, исключаются из дальнейших исследований из-за того, что живые/мертвые среды реагентов влияют на долгосрочную жизнеспособность.
- Анализ изображений на платформе анализа изображений
- Выделите каждую плоскость изображения Z-стека в программном обеспечении. Объединяйте плоские изображения в проекционное изображение максимальной интенсивности.
- Создайте новый анализ, выбрав биопечатную модель в качестве области интереса (ROI), определив флуоресценцию из канала живой клетки на длине волны 488 нм (убедитесь, что все клетки выбраны в соответствии с ROI).
- В пределах интересующей области используйте программное обеспечение для визуализации для определения количества клеток в ROI через канал ядерного окрашивания (405 нм), количество живых клеток в ROI по каналу 488 нм и количество мертвых клеток в ROI по каналу 647 нм.
- Запустите анализ для всех лунок модели работающих/мертвых клеток и экспортируйте таблицу данных, содержащую площадь ROI, общее количество клеток, количество живых клеток и количество мертвых клеток.
- Вычислите количество живых и мертвых клеток в процентах от общего количества клеток за день анализа.
5. Иммуноокрашивание и популяционный анализ клеток
- Перед фиксацией удалите носитель с моделей ячеек и промойте модели один раз в PBS.
- Фиксируют клетки с 4% (v/v) параформальдегидом в PBS при РТ в течение 20 мин.
ВНИМАНИЕ: Все работы с параформальдегидом должны проводиться в соответствии с лабораторными процедурами. - Аспирируйте 4%-ный (v/v) раствор параформальдегида из моделей и промойте модели четыре раза в PBS, чтобы полностью удалить параформальдегид.
- Пермеабилизацию моделей ячеек 0,2% тритоном-Х в течение 30 мин при RT и трижды промыть PBS.
- Блокируйте клеточные модели с помощью 10% (v/v) нормальной ослиной сыворотки (NDS) в течение 3 ч при RT.
- Удаляют блокирующий раствор и добавляют к моделям первичные антитела (разведенные в 1% v/v NDS в PBS). При выполнении анализа соотношения популяций клеток (см. шаг 5.11) обязательно включайте клеточные модели, которые совместно окрашены для Β-III тубулина (с красной конъюгацией AF647) и GFAP (с зеленой конъюгацией AF488). Инкубируют модели с первичными антителами в течение 24 ч при 4 °C.
- После первичной инкубации модели, окрашенные конъюгированными первичными антителами, трижды промывают в PBS и контрокрашивают 20 мкМ Hoechst в течение 30 мин. Изображение, как описано в шаге 5.10.
- Модели, окрашенные неконъюгированными первичными антителами, трижды промывают в PBS и добавляют вторичные антитела (разбавленные в 1% v/v NDS в PBS). Инкубируют в течение 24 ч при 4 °C.
- Удалите вторичные антитела, промыв три раза в PBS, и окрасьте модели 20 мкМ Hoechst в течение 30 минут перед визуализацией.
- Выполнение визуализации на стандартных микроскопах с красным (647 нм) и зеленым (488 нм) каналами возбуждения. Тем не менее, для достижения наилучших результатов в 3D-моделях необходимо получать изображения с помощью конфокального микроскопа с высоким содержанием и выполнять визуализацию с помощью функции Z-стека при 4-кратном или 10-кратном увеличении.
- Анализ соотношений популяций клеток на платформе анализа изображений
- Получить анализ клеточных популяций с использованием моделей, окрашенных совместно для GFAP (с конъюгацией AF488) и Β-III тубулина (с конъюгацией AF647).
- Выделите каждую плоскость изображения Z-стека в программном обеспечении и объедините плоские изображения в проекционное изображение максимальной интенсивности.
- Создайте новый анализ, выбрав биопечатную модель в качестве ROI, определив флуоресценцию из канала Β-III тубулина на длине волны 647 нм (убедитесь, что вся область, содержащая клетку, выбрана в разделе ROI).
- В рамках ROI используйте программное обеспечение для определения количества клеток в канале Хёхста (405 нм), количества астроцитов GFAP+ в ROI по каналу 488 нм и количества клеток Β-III тубулина+ в ROI по каналу 647 нм.
- Запустите анализ на всех лунках модели с совместным окрашиванием клеток и экспортируйте таблицу данных, содержащую площадь ROI, общее количество клеток, количество клеток GFAP+ и количество клеток Β-III тубулина+.
- Вычислите количество клеток GFAP+ и Β-III тубулина+ в процентах от общего числа клеток.
Результаты
Анализ роста нейритов
В этом протоколе глутаматергические нейроны и астроциты, полученные из ИПСК, были биопечатаны в кокультуре в гидрогелевую матрицу с помощью 3D-биопринтера. В течение первых 7 дней после печати клетки визуализировались каждые 12 часов с помощью микроскопа живых клеток. После биопечати клетки должны иметь округлую морфологию и должны быть рассредоточены по всему гидрогелевому матриксу, постепенно изменяясь, образуя более мелкие клеточные кластеры с небольшим выпячиванием в течение первых нескольких дней культивирования (см. Дополнительное видео 1 для репрезентативного роста здоровых клеток). К 4-му дню здоровые клетки мигрируют по всему гелю, образуя более крупные кластеры, которые соединены через нейритовые выросты. К 7-му дню не должно остаться почти ни одной клетки, соединяющиеся пучки нейритов и астроцитарные проекции должны казаться укрепленными, и из скоплений можно увидеть множество более мелких нейритовых выростов (рис. 2А). Используя серию изображений ярких полей живых клеток, сделанных в течение 7-дневного периода роста, был проведен анализ роста нейритов, как подробно описано в разделе 3. Этот анализ показал, что рост нейрита увеличивается почти линейно (значение R2 = 0,84) в период от 12 ч до 156 ч (рис. 2B). В этот период роста нейрита скопления клеток также увеличиваются в размерах (см. Дополнительное видео 1), что свидетельствует о миграции клеток по всему гидрогелю.
Жизнеспособность клеток и соотношение популяций
В этом протоколе концентрация 20 миллионов клеток/мл, включающая 15 миллионов нейронов/мл и 5 миллионов астроцитов/мл, используется для биопечати клеточных моделей. Используя окрашивание живых клеток кальцеином-AM (живые клетки), этидийным гомодимером-1 (мертвые клетки) и ядерным красителем, количество клеток, выживших в течение 7-дневного периода, может быть рассчитано в соответствии с разделом 4 (рис. 3A). Результаты жизнеспособности клеток для репрезентативных культур показаны на 4-й день, когда 72% ± 1% (среднее ± SEM) общего количества клеток являются живыми и показывают окрашивание на Calcein-AM, в то время как 29% ± 2% (среднее ± SEM) общее количество клеток мертвы и показывают окрашивание гомодимером этидия-1 (рисунок 3B). Репрезентативные изображения окрашивания клеток кальцеином-AM и гомодимером этидия-1 можно увидеть на дополнительном рисунке 1. Следует отметить, что значения выживаемости клеток для 3D-культур нельзя напрямую сравнивать с 2D-культурами, так как мертвые клетки удерживаются в гидрогеле и не удаляются в процессе питания клеток.
Используя иммунофлуоресцентное окрашивание для Β-III тубулина и GFAP, как описано в разделе 5 и на рисунке 4, можно провести анализ изображений для определения соотношения популяций клеток между нейронами и астроцитами (рис. 3A). Из общего числа клеток на модель в репрезентативных культурах Β-III тубулин-позитивные нейроны составляют 49% ± 3% (в среднем ± SEM), в то время как GFAP-положительные астроциты составляют 30% ± 4% (в среднем ± SEM). Это дает соотношение 1:1,5, астроциты к нейронам соответственно. Таким образом, остается 21% от общего количества клеток на модель, которые не окрашиваются ни по одному из клеточных маркеров. Поскольку анализ жизнеспособности клеток показал, что среднее значение 29% клеток нежизнеспособны на 4-й день, вполне вероятно, что эти клетки мертвы в гидрогеле.
Экспрессия клеточных маркеров
Морфологию биопечатных нейронов и астроцитов оценивали с помощью иммуноокрашивания на маркер типа нейрональных клеток (Β-III тубулин) и астроцитарный маркер (GFAP). В представленных репрезентативных культурах иммуноокрашивание локализуется на отдельных типах клеток, демонстрируя здоровую морфологию клеток, при этом оба типа клеток демонстрируют рост клеточных выпячиваний (рис. 4A, B). Поскольку гидрогелевая и клеточная структуры являются трехмерными, каждое изображение представляет собой только один срез структуры на рисунке 4A, B. На рисунке 4C показан объединенный стек изображений по всему гидрогелю, демонстрирующий виды локализации клеток в плоскостях X, Y и Z. На рисунке 4D показано иммуноокрашивание только для Β-III тубулина; выделение более мелких нейритовых выростов из скоплений клеточного тела. Для дальнейшего изучения фенотипа глутаматергических нейронов может быть проведено иммуноокрашивание на маркер глутаматергического ионного рецептора GluR2. На рисунке 4E область 4E.1 (врезка) была выделена, чтобы показать точечное окрашивание с более высоким разрешением вдоль пучков нейритов. Таким образом, это подтверждает, что нейроны в этой кокультуре имеют глутаматергический фенотип. На всех иммуноокрашивающих изображениях можно наблюдать иммунофлуоресцентно окрашенные неклеточные структуры, окружающие клеточные кластеры и нейриты. Вполне вероятно, что эти структуры представляют собой обломки, удерживаемые внутри гидрогеля в сочетании с незначительными количествами неспецифических антител, связывающихся с гидрогелем. Это ожидаемо в биопечатных культурах, так как в 3D-моделях каркаса мертвые клетки и мусор не удаляются во время питания клеток. На дополнительном рисунке 2 показано репрезентативное изображение иммуноокрашивания с отрицательным контролем, демонстрирующее неспецифическое связывание вторичных антител гидрогелем.
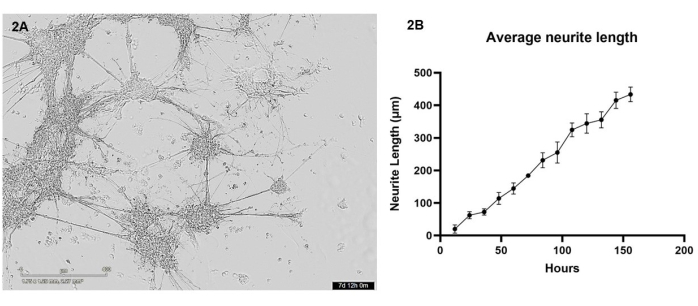
Рисунок 2: Глутаматергические нейроны и астроциты были биопечатаны в гидрогелевую матрицу с помощью биопринтера и визуализировались каждые 12 часов с помощью светлопольного микроскопа . (A) Пример светлопольного изображения клеточных культур, полученного во время анализа. На рисунке представлена точка времени 156 ч, а масштабная линейка — 400 мкм. (B) Средняя длина нейритовых выростов (мкм) из культур, измеренных с помощью пакета NeuronJ для ImageJ. Каждая точка данных равна n = 3 нейритам, и данные отображаются как среднее значение ± SEM. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
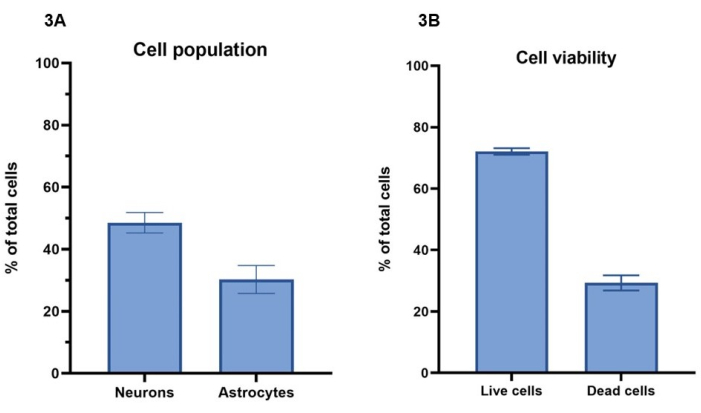
Рисунок 3: Концентрация 20 миллионов клеток/мл раствора активатора была использована для биопечати клеточных моделей. (A) Жизнеспособность клеток рассчитывали с использованием красителей живых/мертвых клеток (кальцеин-AM и этидийный гомодимер-1, соответственно). Значения показывают, что 72% ± 1% (среднее значение ± SEM, n = 3) от общего количества клеток на лунку находятся под напряжением, а 29% ± 2% (среднее значение ± SEM, n = 3) клеток мертвы от общей популяции клеток на лунку на 4-й день. Показанные значения представляют собой среднее значение ± SEM. (B) Процентное соотношение нейронов и астроцитов в клеточных популяциях на лунку было рассчитано с помощью анализа изображений окрашивания, показанного на рисунке 4. Нейроны представляют собой процент клеток, окрашенных положительно на Β-III тубулин на 7-й день (49% ± 3%, среднее ± SEM, n = 3), в то время как астроциты представляют процент клеток, окрашенных положительно на GFAP на 7-й день (30% ± 4%, среднее ± SEM, n = 3). Показанные значения представляют собой среднее значение ± SEM. Все изображения для расчетов, показанные на рисунке 3 , были выполнены на конфокальной системе визуализации, а все анализы были выполнены на платформе анализа изображений и GraphPad Prism в соответствии с методами. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
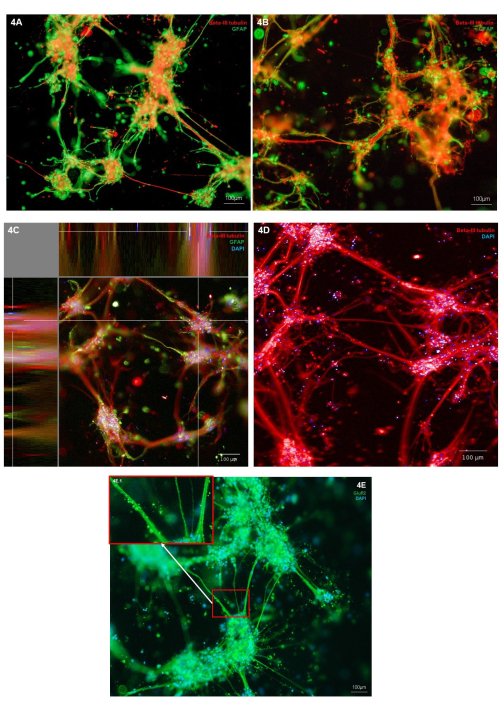
Рисунок 4: Экспрессия маркеров типа нервных клеток в 3D-биопечатных кокультурах глутаматергических нейронов и астроцитов на 7-е сутки . (A,B) Иммунофлуоресцентное окрашивание нейронального маркера Β-III тубулина и маркера астроцитов GFAP, визуализированных на платформе инвертированного микроскопа при 10-кратном увеличении. Масштабные линейки обозначают 100 мкм. (C) Иммунофлуоресцентное окрашивание нейронального маркера β-III тубулина и маркера астроцитов GFAP, окрашенного совместно с маркером Хёхста, показано в виде плоскости XYZ, изображено на системе конфокальной визуализации при 10-кратном увеличении. Создан на платформе анализа изображений. Масштабная линейка представляет 100 мкм. (D) Иммунофлуоресцентное окрашивание нейронального маркера β-III тубулина, окрашенного совместно с Хёхстом, на конфокальной системе визуализации при 20-кратном увеличении. Масштабная линейка представляет собой 100 мкм. (E) Иммунофлуоресцентное окрашивание глутаматергическим маркером GluR2, окрашенным совместно с Хёхстом, изображение на инвертированной платформе микроскопа при 10-кратном увеличении. Во врезке 3E.1 показаны выделенные участки окрашивания GluR2. Масштабная линейка представляет 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительное видео 1: Глутаматергические нейроны и астроциты биопечатали в гидрогелевом матриксе с помощью биопринтера и визуализировали каждые 12 ч с помощью светлопольного микроскопа. Видео светлопольных изображений клеточных культур, сделанных во время анализа, временные точки указаны в правом нижнем углу, а масштабные линейки представляют 400 мкм. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный рисунок 1: Примеры изображений анализа живых/мертвых биопечатных нейронов и астроцитов на 4-й день. Краситель Calcein-AM показан зеленым цветом (488 нм), а гомодимер этидия показан красным цветом (647 нм). Изображение отображается в виде плоскости XYZ, созданном на платформе анализа изображений. Масштабная линейка представляет 100 мкм. (A) Визуализация проводилась с использованием системы конфокальной визуализации при 4-кратном увеличении. (B) Визуализация проводилась с использованием системы конфокальной визуализации с 10-кратным увеличением Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Пример отрицательного контрольного изображения после иммунофлуоресцентного окрашивания. Первичные антитела были опущены, а вторичные антитела зеленого (488 нм) и красного (647 нм) были использованы в соответствии с протоколами иммуноокрашивания. Изображение отображается в виде плоскости XYZ, созданном на платформе анализа изображений. Масштабная линейка представляет 100 мкм. Визуализацию проводили с помощью системы конфокальной визуализации при 10-кратном увеличении. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Потребность в точных моделях ЦНС никогда не была столь высокой, а ограничения двумерных (2D) традиционных моделей клеточных культур привели к появлению впоследние годы поколения сложных моделей ЦНС. Однако многие сложные 3D-модели, представляющие взаимодействия между типами нервных клеток и ECM, имеют ограничения, которые препятствуют применению этих моделей в промышленных процессах 6,20,21. В рамках этого протокола мы разрабатываем 3D-модель кокультуры нейронов и астроцитов, полученных из ИПСК человека, которая направлена на устранение некоторых из этих ограничений с помощью технологии 3D-биопечати для создания биоактивного гидрогелевого каркаса в 96-луночном и 384-луночном форматах.
Методология разработки этих моделей была упрощена благодаря программному обеспечению для проектирования карт пластин, автоматически генерируемым протоколам печати и управляемому процессу печати с биопринтера. Тем не менее, из-за чувствительного характера чувствительных типов клеток, полученных из ИПСК, используемых в этом протоколе, следует соблюдать следующие критические меры по размораживанию и культивированию. Во-первых, включение ингибитора ROCK (ROCKi) имеет ряд преимуществ на протяжении всего процесса биопечати и во время раннего культивирования. Оттаивание клеток является критической точкой, в которой нейроны могут испытывать стрессовую реакцию, а неправильные протоколы размораживания могут снизить шансы навыживание. Как правило, рекомендуется как можно эффективнее размораживать клетки, добавлять среду и поднимать клетки до температуры инкубатора23. Однако во время процесса биопечати, описанного в этом протоколе, необходимо, чтобы нейроны и астроциты ресуспендировали в растворе активатора, а не в среде, и клетки не поднимались выше комнатной температуры до конца печатного тиража (до 30 минут после оттаивания). Таким образом, добавление ROCKi в среду сразу после размораживания и включение его в течение двух стадий центрифугирования (этапы 2.1--2.7 и 1.3.15-1.3.20) является обязательным для ингибирования путей клеточного стресса, что приведет к снижению уровня жизнеспособности24. Кроме того, было показано, что ROCKi способствует росту нейритов и улучшает созревание нейронов25. Таким образом, прием добавок ROCKi продолжается в течение 48 ч после биопечати. Тем не менее, необходимо удалить добавку ROCKi через 48 ч, чтобы обеспечить полное смывание при последующей смене среды перед использованием клеток для анализа.
Следующим этапом, требующим критического внимания, является добавление и смена носителей после печати (шаги 2.8-2.13). Биопечатный гидрогелевый каркас имеет эквивалентную биомеханическую жесткость всего 1,1 кПа, что эквивалентно серому веществу. Как описано на шаге 2.10, во время добавления и аспирации среды очень важно осторожно вводить пипетку в стенку лунки, чтобы предотвратить нарушение. Это особенно актуально для 384-луночных планшетов, где уровень геля занимает большую долю от общего объема лунки. Этот метод также следует использовать в 2D-контрольных скважинах для предотвращения подъема краев клеток и сдвига нейритовых выростов. Авторы также хотели бы подчеркнуть важность стерильной техники в биопринтере, к которой следует относиться с такой же осторожностью, как и к шкафу биобезопасности, используемому для клеточных культур, полученных из ИПСК. Это включает в себя стерильную фильтрацию 70% EtOH и dH2O, используемую в процедурах «зеленого света» и печати, сохранение крышек на картриджах и пластинах при перемещении рук внутрь и из биопринтера, а также обеззараживание поверхностей внутри биопринтера салфетками с 70% этанолом до и после печати.
Биопечатный гидрогелевый каркас, сформированный из биочернил и растворов активаторов, выбранный для разработки этой модели, выбран из ряда биочернил и растворов-активаторов, разработанных Inventia Life Science для использования в биопринтере RASTRUM. Ламинин и гиалуроновая кислота были идентифицированы как молекулы, имеющие отношение к созреванию нейронов, полученных из ИПСК, из-за их роли в аксональном направлении, образовании синапсов и формировании перинейрональной сети26,27. Кроме того, была выбрана биомеханическая жесткость 1,1 кПа, поскольку было показано, что гидрогели с более низкой плотностью обеспечивают лучший рост нейритов из нейронов12. Если в протокол вносятся изменения с использованием нейронов и астроцитов, которые были дифференцированы собственными силами или от другого коммерческого поставщика, рекомендуется провести тест выбора матрицы для определения наиболее благоприятного гидрогелевого каркаса15. Кроме того, может потребоваться оптимизация плотности клеток, если вносятся изменения в источники клеток для обеспечения оптимальной жизнеспособности и предотвращения переполнения гидрогеля. По всем вопросам модификации и устранения неполадок, связанных с работой биопринтера, авторы рекомендуют обращаться к производителям и ссылаться на протоколы производителей.
ЦНС содержит широкий спектр подтипов нейронов и глиальных клеток, все из которых существуют в различных нишах мозга и играют специфическую роль, внося свой вклад в нейронную функцию28. В контексте этого широкого охвата эта модель представляет только два наиболее распространенных типа клеток (астроциты и возбуждающие глутаматергические нейроны). Важные типы клеток, такие как микроглия, олигодендроциты и эндотелиальные клетки, формирующие гематоэнцефалический барьер, исключены из этой системы. Включение микроглии может иметь значение при изучении нейроиммунных взаимодействий, а олигодендроциты могут представлять интерес при заболеваниях, влияющих на центральную миелинизацию. В дополнение к своей роли в патологии, такие клетки, как эндотелиальные клетки, образующие гематоэнцефалический барьер, выделяют ферменты, метаболизирующие лекарственные средства, что может повлиять на использование этой модели для фармакокинетических анализов29. Дальнейшим ограничением модели может быть соотношение астроцитов и нейронов; Соотношение астроцитов и нейронов сильно варьируется между областями мозга, с рекомендуемыми значениями от 1:1 до 1:330,31. Эта модель имеет приблизительное соотношение астроцитов к нейронам 1:1,5; Таким образом, эта модель может не иметь отношения к моделированию областей мозга, где астроцитов больше, например, в областях белого вещества30.
В последние годы были опубликованы и другие протоколы для разработки 3D-моделей кокультур с биопечатью. В публикации Sullivan et al., 2021, была представлена 3D-биопечатная нейронная модель с использованием нейральных клеток-предшественников, полученных из ИПСК, которая демонстрирует высокую постпечатную жизнеспособность и усиление функции нейронов по сравнению с 2D-культурами32. Однако в этом протоколе нейральные клетки-предшественники использовались в качестве клеточного источника и поддерживались в культуре в течение 4 недель. В этом протоколе использовались коммерчески доступные глутаматергические нейроны и астроциты, полученные из ИПСК. Это позволяет создать 3D-сеть совместно культивируемых клеток всего за 7 дней; Как показал анализ роста нейритов, рост нейрита начинается в течение 24 ч и продолжается линейно в течение 156 ч, в течение которых наблюдался рост клеток. Быстрое установление этих сетей может быть частично связано с использованием глутаматергических нейронов, которые используют оптимизированную индуцируемую доксициклином экспрессию гена NGN2, которая показывает экспрессию маркеров зрелого подтипа нейронов в течение 7 дней, даже в 2D-культуре33. Сокращение этого периода роста с помощью этого метода имеет важное значение для внедрения моделей в биофармацевтической промышленности, поскольку разработка тестов требует быстрого оборота и разработки клеточных моделей15.
В заключение, эта модель демонстрирует потенциал для 3D-модели нейронов и астроцитов, которая быстро и удобно устанавливается для целей скрининга. В будущем этот тип модели может быть применен для разработки лекарств для различных заболеваний ЦНС, с возможностью расширения для различных заболеваний с использованием линий ИПСК пациента или отредактированного гена. Кроме того, использование индуцируемых доксициклинами NGN2 экспрессии NGN2 на основе глутаматергических нейронов позволяет клеткам достигать зрелости за меньшее время, что может быть использовано для разработки моделей старения мозга для исследований нейродегенерации. Эта система также может быть расширена за счет использования дополнительных типов клеток в кокультуре, включая микроглию и олигодендроциты.
Раскрытие информации
CW, NC и JB являются сотрудниками компании Merck Sharp & Dohme (UK) Limited, Лондон, Великобритания. YH является сотрудником Merck Sharp & Dohme LLC, дочерней компании Merck & Co., Inc., Рауэй, штат Нью-Джерси, США.
Первый рисунок был создан с помощью Biorender.com.
Благодарности
Авторы выражают благодарность Алексу Фолькерлингу, Мартину Энгелю и Рэйчел Блич за помощь в разработке протокола и отзывы о рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Thermofisher | 31350010 | |
| 384-well plate | PerkinElmer | 6057300 | |
| 96-well plate | PerkinElmer | 6055300 | |
| Activator fluid F299 | Inventia Life Science | N/A | |
| Activator fluid F3 | Inventia Life Science | N/A | |
| B27 (50x) minus Vit A | Thermofisher | 12587010 | |
| Bioink fluid F261 | Inventia Life Science | N/A | |
| Bioink fluid F32 | Inventia Life Science | N/A | |
| Doxycycline hyclate | Sigma Aldrich | D5207 | |
| GlutaMAX (100x) | Thermofisher | 35050061 | |
| Goat anti-mouse IgG H&L Alexa Fluor 647 | Abcam | ab150115 | |
| Goat anti-rabbit IgG H&L Alexa Fluor 488 | Abcam | ab150077 | |
| Hoechst | Abcam | ab228551 | |
| Human BDNF Recombinant Protein | Thermofisher | PHC7074 | |
| Human NT3 Recombinant Protein | Thermofisher | PHC7036 | |
| iCell Astrocytes | Fujifilm CDI | 1434 | |
| INCell Analyser 6500HS | Molecular Devices | N/A | high content imaging system |
| Incucyte S3 | Sartorius | N/A | |
| ioGlutamatergic Neurons (Large vial) | Bit.bio | e001 | |
| Laminin (1 mg/mL) | Sigma Aldrich | L2020 | |
| Live/dead kit (Calcein-AM, Ethidium homo-dimer-1) | Invitrogen | L3224 | |
| Mouse anti-BIII tubulin NL637 conjugated | R&D systems | SC024 | |
| Neurobasal media | Thermofisher | 21103049 | |
| Normal Donkey Serum | Abcam | ab7475 | |
| NucBlue Live (Hoechst 33342) | Thermofisher | R37605 | |
| Opti-MEM | Thermofisher | 11058021 | |
| Paraformaldehyde | Sigma Aldrich | P6148 | |
| PEI 50% in H2O | Sigma Aldrich | 181978 | |
| Pierce Borate Buffer 20x | Thermofisher | 28341 | |
| Prism | GraphPad | Data analysis software | |
| Rabbit anti-ionotropic glutamatre receptor 2 (GluR2) | Abcam | ab206293 | |
| RASTRUM(TM) Bioprinter | Inventia Life Science | N/A | Bioprinter |
| RASTRUM(TM) Bioprinter Cartridges | Inventia Life Science | N/A | Bioprinter Cartridges |
| RASTRUM(TM) Targeting plate | Inventia Life Science | N/A | Targeting plate |
| Rho kinase (ROCK) inhibitor | Abcam | ab120129 | |
| Sheep anti-GFAP NL493 conjugated | R&D systems | SC024 | |
| Signals Image Artist | PerkinElmer | N/A | Image analysis platform |
| Triton X-100 | Thermofisher | HFH10 | |
| Zeiss Axio Observer | Zeiss | N/A | Inverted microscope platform |
Ссылки
- Jung, Y. L., Hwang, J., Yoo, H. S. Disease burden metrics the innovations of leading pharmaceutical companies: a global and regional comparative study. Globalization and Health. 16 (1), 80-80 (2020).
- Potkin, S. G., et al. The neurobiology of treatment-resistant schizophrenia: paths to antipsychotic resistance and a roadmap for future research. npj Schizophrenia. 6, 1(2020).
- Keswani, C., et al. The Global Economic Impact of Neurodegenerative Diseases: Opportunities and Challenges. Bioeconomy for Sustainable Development. , Springer, Singapore. (2019).
- Perucca, E. The pharmacological treatment of epilepsy: recent advances and future perspectives. Acta Epileptologica. 3 (1), 22(2021).
- Nikolakopoulou, P., et al. Recent progress in translational engineered in vitro models of the central nervous system. Brain. 143 (11), 3181-3213 (2020).
- Whitehouse, C., Corbett, N., Brownlees, J. 3D models of neurodegeneration: implementation in drug discovery. Trends in Pharmacological Sciences. 44 (4), 208-221 (2023).
- Rauti, R., Renous, N., Maoz, B. M. Mimicking the brain extracellular matrix in vitro: A review of current methodologies and challenges. Israel Journal of Chemistry. 60 (12), 1141-1151 (2020).
- Fawcett, J. W., Oohashi, T., Pizzorusso, T. The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature Reviews Neuroscience. 20 (8), 451-465 (2019).
- Lam, D., et al. Tissue-specific extracellular matrix accelerates the formation of neural networks and communities in a neuron-glia co-culture on a multi-electrode array. Scientific Reports. 9, 4159(2019).
- Roll, L., Lessmann, K., Brüstle, O., Faissner, A. Cerebral organoids maintain the expression of neural stem cell-associated glycoepitopes and extracellular matrix. Cells. 11 (5), 760(2022).
- Yan, Y., Bejoy, J., Marzano, M., Li, Y. The use of pluripotent stem cell-derived organoids to study extracellular matrix development during neural degeneration. Cells. 8 (3), 242(2019).
- Ma, L., et al. 3D bioprinted hyaluronic acid-based cell-laden scaffold for brain microenvironment simulation. Bio-Design and Manufacturing. 3 (3), 164-174 (2020).
- Liaw, C. -Y., Ji, S., Guvendiren, M. Engineering 3D hydrogels for personalized in vitro human tissue models. Advanced Healthcare Materials. 7 (4), 1701165(2018).
- Ma, J., Huang, C. Composition and mechanism of three-dimensional hydrogel system in regulating stem cell fate. Tissue Engineering Part B: Reviews. 26 (6), 498-518 (2020).
- Belfiore, L., et al. Generation and analysis of 3D cell culture models for drug discovery. European Journal of Pharmaceutical Sciences. 163, 105876(2021).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Engel, M., Belfiore, L., Aghaei, B., Sutija, M. Enabling high throughput drug discovery in 3D cell cultures through a novel bioprinting workflow. SLAS Technology. 27 (1), 32-38 (2022).
- Takamura, T., et al. Influence of age on global and regional brain stiffness in young and middle-aged adults. Journal of Magnetic Resonance Imaging. 51 (3), 727-733 (2020).
- Slanzi, A., Iannoto, G., Rossi, B., Zenaro, E., Constantin, G. In vitro models of neurodegenerative diseases. Frontiers in Cell and Developmental Biology. 8, 328(2020).
- de Souza, N. Organoid variability examined. Nature Methods. 14 (7), 655-655 (2017).
- Hernández, D., et al. Culture variabilities of human iPSC-derived cerebral organoids are a major issue for the modelling of phenotypes observed in Alzheimer's disease. Stem Cell Review and Reports. 18 (2), 718-731 (2022).
- Li, R., et al. Differentiation of human iPS cells into sensory neurons exhibits developmental stage-specific cryopreservation challenges. Frontiers in Cell and Developmental Biology. 9, 796960(2021).
- Nishiyama, Y., et al. Safe and efficient method for cryopreservation of human induced pluripotent stem cell-derived neural stem and progenitor cells by a programmed freezer with a magnetic field. Neuroscience Research. 107, 20-29 (2016).
- Uhrig, M., Ezquer, F., Ezquer, M. Improving cell recovery: Freezing and thawing optimization of induced pluripotent stem cells. Cells. 11 (5), 799(2022).
- Harbom, L. J., et al. The effect of rho kinase inhibition on morphological and electrophysiological maturity in iPSC-derived neurons. Cell and Tissue Research. 375 (3), 641-654 (2019).
- Koh, H. S., Yong, T., Chan, C. K., Ramakrishna, S. Enhancement of neurite outgrowth using nano-structured scaffolds coupled with laminin. Biomaterials. 29 (26), 3574-3582 (2008).
- Tarus, D., et al. Design of hyaluronic acid hydrogels to promote neurite outgrowth in three dimensions. ACS Applied Materials & Interfaces. 8 (38), 25051-25059 (2016).
- Brain Initiative Cell Census Network (BICCN). Initiative Cell Census Network (BICCN). A multimodal cell census and atlas of the mammalian primary motor cortex. Nature. 598 (7879), 86-102 (2021).
- Dauchy, S., et al. Expression and transcriptional regulation of ABC transporters and cytochromes P450 in hCMEC/D3 human cerebral microvascular endothelial cells. Biochemical Pharmacology. 77 (5), 897-909 (2009).
- Herculano-Houzel, S. The glia/neuron ratio: How it varies uniformly across brain structures and species and what that means for brain physiology and evolution. Glia. 62 (9), 1377-1391 (2014).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Sullivan, M. A., et al. 3D bioprinting of stem cell-derived central nervous system cells enables astrocyte growth, vasculogenesis and enhances neural differentiation/function. bioRxiv. , (2022).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).
Erratum
Formal Correction: Erratum: Three-Dimensional Bioprinting of Human iPSC-Derived Neuron-Astrocyte Cocultures for Screening Applications
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for: Three-Dimensional Bioprinting of Human iPSC-Derived Neuron-Astrocyte Cocultures for Screening Applications. The Authors section was updated from:
Chloe Ann Whitehouse1
Yufang He2
Janet Brownlees1
Nicola Corbett1
1MSD R&D Innovation Centre Ltd
2Merck & Co., Inc.
to:
Chloe Ann Whitehouse1
Yufang He2
Janet Brownlees1
Nicola Corbett1
1MSD Research Laboratories, London, UK
2Merck & Co., Inc., Rahway, NJ, USA
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены