Method Article
Tarama Uygulamaları için İnsan iPSC'den Elde Edilen Nöron-Astrosit Kokültürlerinin Üç Boyutlu Biyobaskısı
Bu Makalede
Erratum Notice
Özet
Burada, iPSC'den türetilen nöronların ve astrositlerin 3D biyobaskılı kokültürlerini üretmek için bir protokol sunuyoruz. 96 veya 384 oyuklu formatlarda bir hidrojel iskele içinde üretilen bu kokültür modeli, 7 gün içinde yüksek baskı sonrası canlılık ve nörit büyümesi gösterir ve her iki hücre tipi için olgunluk belirteçlerinin ekspresyonunu gösterir.
Özet
Bir hücre modelinin ilaç taraması için uygun olması için, sistemin verimli bir geliştirme süresine sahip olmasının yanı sıra verim ve homojenlik gereksinimlerini karşılaması gerekir. Ancak, yayınlanan birçok 3B model bu kriterleri karşılamamaktadır. Bu nedenle, erken ilaç keşif uygulamalarında kullanışlılıklarını sınırlar. Üç boyutlu (3D) biyo-baskı, geliştirme süresini hızlandırmak, standardizasyonu artırmak ve verimi artırmak için 3D modellerin geliştirilmesine uygulanabilen yeni bir teknolojidir. Burada, insan kaynaklı pluripotent kök hücre (iPSC) kaynaklı glutamaterjik nöronların ve astrositlerin 3D biyobaskılı kokültür modellerini geliştirmek için bir protokol sunuyoruz. Bu kokültürler, biyoaktif peptitler, tam uzunlukta hücre dışı matris (ECM) proteinlerinden oluşan bir hidrojel matrisi içine ve 1.1 kPa'lık bir fizyolojik sertliğe sahiptir. Model, 96 kuyucuklu ve 384 kuyucuklu formatlarda hızlı bir şekilde kurulabilir ve ortalama %72'lik bir baskı sonrası canlılık sağlar. Bu modeldeki astrosit-nöron oranının, insan beyni için fizyolojik aralık içinde olan 1: 1.5 olduğu gösterilmiştir. Bu 3D biyobaskılı hücre popülasyonları ayrıca olgun nöral hücre tipi belirteçlerinin ekspresyonunu ve kültürden sonraki 7 gün içinde nörit ve astrosit projeksiyonlarının büyümesini gösterir. Sonuç olarak, bu model, nörit büyüme testlerinin yanı sıra hücre boyaları ve immün boyama teknikleri kullanılarak analiz için uygundur. Bu fizyolojik olarak temsili modelleri geniş ölçekte üretme yeteneği, onları sinirbilim hedefleri için orta ila yüksek verimli tarama testlerinde kullanım için ideal hale getirir.
Giriş
İlaç keşif endüstrisinde merkezi sinir sistemi (CNS) hastalıklarına yönelik araştırmalar genişliyor1. Bununla birlikte, epilepsi, şizofreni ve Alzheimer hastalığı gibi birçok yaygın CNS hastalığının hala iyileştirici tedavileri yoktur 2,3,4. CNS hastalıklarında etkili terapötiklerin eksikliği, en azından kısmen, beynin doğru in vitro modellerinin eksikliğine bağlanabilir5. Bu, mevcut in vitro modeller ile in vivo veriler arasında bir translasyon boşluğuna ve ardından araştırma çabalarında bir darboğaza neden oldu.
Bu translasyonel boşluktan hareketle, son yıllarda nöral organoidler, nörosferoidler ve iskele tabanlı modeller dahil olmak üzere yeni 3D hücre modellerinin geliştirilmesinde önemli bir artış olmuştur6. Bu modellerin 3B yapısı, biyomekanik stresler, hücre-hücre temasları ve beyin hücre dışı matrisi (ECM) dahil olmak üzere nöral mikro çevrenin özetlenmesine yardımcı olur7. Beyin ECM'si, nöronlar, astrositler, oligodendrositler ve nörovasküler ünite7 dahil olmak üzere nöral hücre tipleri arasındaki boşluğu kaplayan nörofizyolojinin dinamik bir unsurudur. Beyin ECM'sinin rekapitülasyonunun nöronal morfolojiyi ve nöronal ateşlemeyi etkilediği gösterilmiştir ve beynin birçok karmaşık 3D modeli, ECM proteinlerinin nöral hücre tipleri 8,9,10,11 tarafından biriktirildiğini göstermiştir. İskele tabanlı modeller, beyin ECM12'yi temsil eden gözenekli bir sentetik veya biyolojik hidrojel matrisi içinde süspanse edilmiş olgun nöral kokültürlerden oluşur. Organoid ve sferoid sistemlerden farklı olarak, iskele tabanlı 3D modeller, mevcut ECM proteinlerinin özelleştirilmesine izin verir ve biyomekanik stresleri taklit etmek için hidrojel sertliğinin ayarlanabilirliği avantajına sahiptir13,14.
3D nöral modellerin ezici bir çoğunluğu beyin mikroçevresinin artan bir özetini gösterse de, tüm modeller ilaç keşif uygulamalarını uygulamak için uygun değildir15. Bir 3D modelin endüstriyel süreçlere uygulanabilmesi için, sistemin tarama uygulamaları için verim gereksinimlerini karşılaması ve nispeten kısa bir geliştirme süresinesahip olması gerekir 16. 3D Biyobaskı, insan hatasının neden olduğu değişkenliğin ortadan kaldırılmasının yanı sıra hızlı geliştirme süresi, artan verim ve daha yüksek düzeyde hassas kontrol ile 3D iskele tabanlı nöral modeller oluşturma potansiyeli sunan yeni bir teknolojidir17. Bu protokol, bir hidrojel iskelesinde insan iPSC'den türetilmiş glutamaterjik nöronların ve astrositlerin 3 boyutlu bir kokültür modelini sunar. Bu hidrojel iskelesi, mimetik bir biyomekanik sertlik içinde fizyolojik olarak temsili biyoaktif peptitler (RGD, IKVAV, YIGSR) ve ECM proteinleri içerir. Bu tam uzunluktaki ECM proteinleri, insan korteksinde bol miktarda bulunan tam uzunlukta laminin-211 ve hyaluronik asidi içerir ve in vivo ölçümlere göre 1.1 kPa sertliğesahiptir 18. Bu model, ilaç keşfi için pratiklik ile tasarlanmıştır ve nörit büyüme tahlillerinin yanı sıra hücre boyaları ve antikorlarla görüntüleme teknikleri kullanılarak tarama analizine uygun 96 oyuklu veya 384 oyuklu plaka formatında bir 3D biyoyazıcı kullanılarak oluşturulmuştur. Hücreler, kültürden sonraki 7 gün içinde nöral hücre tipi belirteçlerinin ekspresyonunu ve nörit ve astrositik projeksiyonların büyümesini gösterir. Bu nedenle, bu protokol, ilaç keşif uygulamalarında kullanılmak üzere yüksek verimli bir 3D nöral kokültür modeli geliştirme metodolojisini sunacaktır.
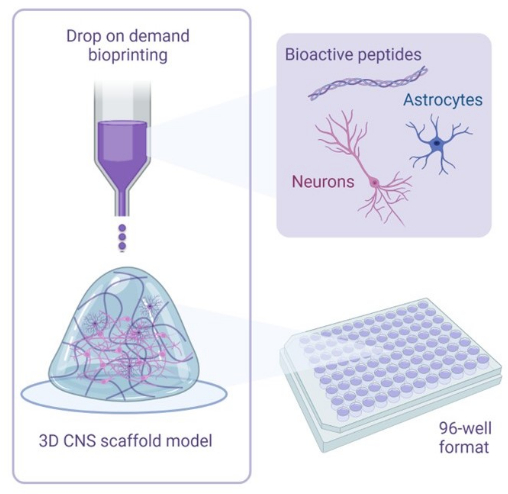
Şekil 1: 3D biyobaskı kokültürleri için kullanılan metodolojiye açıklayıcı bir genel bakış. İnsan iPSC'den türetilen nöronlar ve astrositler, biyoaktif peptitler içeren aktivatör ve biyomürekkep çözeltileri ile birleştirilir ve isteğe bağlı biyo-baskı teknolojisi kullanılarak 96 kuyucuklu veya 384 oyuklu formatlarda hidrojel iskelelere biyolojik olarak basılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
1. 3D modellerin biyobaskısı
- Plaka haritası ve baskı dosyası oluşturma
- Model oluşturmadan önce, plaka haritası yazılımını kullanarak bir plaka haritası, protokol ve baskı dosyası oluşturun. Plaka haritası yazılımını açın ve 3D Kültür Hücreleri seçeneğini seçin.
- Açılır menüdeki mevcut seçeneklerden biyo-yazdırılacak model tipini seçin; bu model, Görüntüleme Modeli ve HTP model formatlarında doğrulanmıştır. 96 oyuklu plakalar için Görüntüleme Modeli'ni ve 384 oyuklu plakalar için HTP'yi seçin.
- Matris Seçimi penceresinde, IKVAV, RGD ve YIGSR peptitleri ile Laminin-211 ve hyaluronik asit proteinleri içeren Hidrojel Px02.53'ü seçin.
- Açılan pencerede hücre tiplerini Glutamaterjik Nöronlar ve Astrositler olarak girin ve hücre yoğunluğunu 20 milyon hücre/mL olarak girin.
- Ekrandaki plakadaki kuyuları vurgulayarak istenen plaka haritasını tasarlamak için yazılımı kullanın. Tasarıma plastik üzerinde en az 1 sıra 2D kontrol ekleyin. Plastik kuyularda 2D kontrol , herhangi bir hidrojel iskelesi olmadan doğrudan kuyuya bırakılan hücrelerden oluşur; Bu kuyuları adım 1.2'ye göre kaplayın.
- Pencerenin üst kısmında listelenen plaka modelinin, kullanım için amaçlanan plaka modeliyle değiştirildiğinden emin olun (bkz.
- İndirme düğmelerini kullanarak plaka haritası için protokolü ve yazdır dosyasını indirin ve bunları biyoyazıcı bağlantılı bilgisayara kaydedin.
- Plastik kuyularda 2D kontrolün kaplanması
- Yazdırmadan en az 24 saat önce, hücre yapışması ve büyümesi için 2D kontrol modelleri için kuyucukları kaplayın. 3D model kuyuları herhangi bir ön kaplama gerektirmez. Aksi belirtilmedikçe tüm işlemler bir biyogüvenlik kabininde gerçekleştirilmelidir. Plakalar baskıdan 7 gün öncesine kadar kaplanabilir ve hazırlanabilir.
- 2.5 mL 20x borat stok çözeltisini 47.5 mL sterildH2Oile seyrelterek 50 mL 1x borat tamponu yapın.
- 0.1 μm'lik bir filtreden %0.1 (a/h) PEI çözeltisi ve steril filtre oluşturmak için 50 mL 1x borat tamponuna 100 μL %50 (a/h) polietilenimin (PEI) ekleyin.
- Adım 1.1'de oluşturulan plaka haritasında gösterildiği gibi, her 2D kontrol kuyusuna %0,1 (a/h) PEI çözeltisi ekleyin. 96 oyuklu bir plaka kullanılıyorsa 100 μL/kuyucuk veya 384 oyuklu bir plaka kullanılıyorsa 25 μL/kuyucuk ekleyin.
- % 0.1 (a / h) PEI çözeltisini aspire etmeden ve kuyucukları 5x PBS ile durulamadan önce plakayı 37 ° C'de 2 saat inkübe edin. Kuyuların biyogüvenlik kabininde tamamen kurumasını bekleyin.
- 100 μL 1 mg / mL laminin çözeltisini 5 mL nörobazal ortamda seyreltin. 96 oyuklu bir plaka kullanılıyorsa her 2D kontrol kuyusuna 100 μL veya 384 oyuklu bir plaka kullanılıyorsa 25 μL ekleyin. 37 °C'de 4 saat inkübe edin.
- Plakaları saklıyorsanız, inkübasyondan sonra laminin solüsyonunu yerinde bırakın ve 4 °C'de saklayın. Kullanmadan önce plakaları 37 °C'de 1 saat önceden ısıtın.
- Kokültür modellerinin 3D biyobaskısı
- Biyoyazıcıyı kullanırken her zaman steril bir teknik uygulayın ve yazıcının içine koymadan önce eldivenleri, kartuşları ve kültür plakalarını %70 EtOH ile silin. Aksi belirtilmedikçe, biyoyazıcı dışındaki tüm işlemleri bir biyogüvenlik kabininde gerçekleştirin.
- Biyoyazıcı için kompresörü açın ve biyoyazıcı yazılımındaki Initialize (Başlat ) düğmesini seçerek yazıcıyı başlatın. Yazıcıdaki hava akışı başladığında, yazıcının içindeki yüzeyleri %70 EtOH mendille silin.
- Baskı gününde, baskı çalışması için doğru püskürtme ucu durumunu sağlamak için kılavuzlu Gün Başlangıcı Yeşil Aydınlatma işlemini gerçekleştirin (minimum püskürtme ucu durumu 2A2B).
- Steril ambalajından bir biyoyazıcı kartuşu alın, A bölmesine 20 mL steril dH2O ekleyin ve B1-4 bölmelerine 6 mL steril filtrelenmiş %70 EtOH ekleyin. Kartuşu biyoyazıcının içindeki sol kartuş tutucuya yerleştirin ve plaka kapağını özel kapak tutucusuna yerleştirin.
- Yazılım ana ekranında Yeşil Aydınlatma düğmesini seçin ve yazılımda kartuşun biyoyazıcı içinde yerinde olduğunu ve kapağın çıkarıldığını onaylayın. Yeşil ışık yakma işlemini başlatın.
- Yazılım tarafından istendiğinde, sol veya sağ iğnelerden tutarlı damlamaların görülmediğini onaylayın. Ardından, yazılım tarafından istendiğinde, B7 ve B8 bölmelerinde su bulunduğunu onaylayın.
- Biyoyazıcı kendinden kılavuzlu yeşil ışık yakma adımını tamamladıktan sonra, kaplanmamış steril 96 oyuklu düz tabanlı bir plaka (biyo-baskı kokültürleri için kaplanmış plakadan ayrı) yerleştirin ve yazılım tarafından istendiğinde bu yeni plakayı biyoyazıcının sağ plaka tutucu bölümüne yerleştirin. Bir sonraki adıma başlamadan önce plaka tutucunun Yüksek Profile Plaka olarak ayarlandığından ve kapağın çıkarılıp özel kapak tutucuya yerleştirildiğinden emin olun.
- Biyoyazıcı, 96 oyuklu plakanın her bir kuyucuğuna su damlacıkları bırakacaktır. Tamamlandığında, plakayı biyoyazıcıdan yerleştirin ve plakanın her bir kuyucuğunda su damlacıklarının bulunduğunu onaylayın.
- Yeşil aydınlatma için kullanılan 96 oyuklu plakayı atın ve biyoyazıcının yeşil ışık yakma işlemini bitirmesine izin verin. Tamamlandığında, yazılım biyoyazıcının nozül durumunu belirtecek ve biyoyazıcının modelleri yazdırmaya hazır olduğunu onaylayacaktır. Kapağı yazıcı kartuşunun üzerine yerleştirin ve sonraki adımlar için biyogüvenlik kabinine çıkarın.
- Biyoyazıcı yazılımını kullanarak, yazdırma dosyasını (adım 1.1'de oluşturulan) Print Run yazılım düğmesini kullanarak yazılıma yükleyin ve yazdırma protokolü pdf'sini açın.
- Biyomürekkep ve aktivatör sıvılarını, baskı protokolü pdf'sinde belirtildiği gibi, -20 °C'den alın ve oda sıcaklığında (RT) 40 dakika çözdürün. Hidrojel matris Px02.53 için bu şunları içerecektir: 1x flakon F32, 1xflakon F3, 1x flakon F261, 1x flakon F299. Biyomürekkep ve aktivatör sıvılarını ellerde veya su banyolarında çözmeyin.
- Biyomürekkep ve aktivatör sıvıları çözülürken RT'ye doksisiklin ve ROCK inhibitörü (tam ortam +DOX/ROCKi) (bkz. adım 2.2) içeren 50 mL tam ortam getirin.
- Biyomürekkepler ve aktivatörler çözüldükten sonra, oluşturulan baskı protokolü pdf'sinin son iki sayfasında belirtildiği gibi baskı kartuşunu hazırlayın. Yeşil ışık yakan yazıcı kartuşu, model baskı aşamaları için yeniden kullanılacaktır.
- A1 bölmesinde 40 mL dH2O ve B1 ve B2 bölmelerinde 8 mL %70 EtOH olduğundan emin olun. C1'e 1.2 mL aktivatör F32, C2'ye 1.2 mL F3 ve C4'e 200 μL F261 ekleyin.
- PEI ve laminin kaplı plakayı inkübatörden alın ve yazıcının içine, sağ plaka tutucu bölmesine yerleştirin. Bu noktada laminin-media solüsyonunu kuyulardan çıkarmayın. Plaka tutucu bölmesinin Düşük Profile Plaka olarak ayarlandığından ve kapağın çıkarılıp kapak tutucusuna yerleştirildiğinden emin olun.
- Yazıcı kartuşunu biyoyazıcıya yerleştirin, kapağın çıkarıldığından ve tutucuya yerleştirildiğinden emin olun ve biyoyazıcı yazılımındaki Print Inert Base düğmesini seçerek yazılımda yazdırma işlemini başlatın.
- İnert baz yazdırılırken, glutamaterjik nöronların ve astrositlerin şişelerini sıvı nitrojen deposundan alın, çözdürün ve bölüm 2'deki talimatlara göre yeniden süspanse edin.
- Hücreler çözüldükten ve her hücre tipine ayrı ayrı 8 mL tam ortam +DOX/ROCKi eklendikten sonra (bölüm 2'ye göre), hücreleri RT'de 5 dakika boyunca 300 x g'da santrifüjleyin.
- Süpernatanı aspire edin ve her iki hücre tipini 1 mL tam ortam + DOX / ROCKi'de ayrı ayrı yeniden süspanse edin.
- 20 μL tripan mavisine 20 μL hücre süspansiyonu ekleyin ve her hücre tipi için mL başına canlı hücre konsantrasyonunu belirlemek için hücreleri saymadan önce karıştırın.
- 15 mL'lik bir tüpte toplam 3 milyon glutamaterjik nöronu 1 milyon astrosit ile birleştirin. Toplam 8 mL'lik bir hacim oluşturmak için medya ekleyin.
- Hücreleri RT'de 5 dakika boyunca 300 x g'da santrifüjleyin.
- Hücre peletini bozmadan mümkün olduğunca fazla süpernatanı aspire edin ve hücre peletini 200 μL aktivatör sıvısı F299 içinde yeniden süspanse edin.
- Aktivatör sıvısının viskoz olduğuna dikkat edin; Peleti tamamen yeniden süspanse etmek için yukarı ve aşağı pipetleyin. Hücre tipleri hassastır; Geniş delikli pipet ucu ve ters pipetleme tekniği kullanarak kaymayı ve kabarcıkları en aza indirin. Hücre kaybını önlemek için en fazla 3 kez yukarı ve aşağı pipetleyin.
- İnert taban aşaması baskıyı bitirdiğinde, kapakları kartuş ve kültür plakasına yerleştirin, her ikisini de biyoyazıcıdan çıkarın ve biyogüvenlik kabinine yerleştirin.
- F299'daki 200 μL hücre süspansiyonunu yazıcı kartuşunun C3 kuyusuna ekleyin, kartuşu biyoyazıcıya yeniden takın, kapağı çıkarın ve kapak tutucuya yerleştirin. Kültür plakasını henüz yeniden takmayın.
- Yazdırma çalışmasının Yazdırma Modelleri aşamasını başlatın. Biyoyazıcı sıvıları hazırlarken, laminin-medya solüsyonunu plakanın 2D kontrol kuyularından çıkarın ve 96 oyuklu bir plaka kullanılıyorsa her 2D kontrol kuyusunda 150 μL tam ortam +DOX/ROCKi ve 384 oyuklu bir plaka kullanılıyorsa 50 μL tam ortam +DOX/ROCKi ile değiştirin.
- Sıvılar astarlandıktan sonra, biyo-baskı hedefleme plakasını biyoyazıcıya yerleştirin, kapağı çıkarın ve kapak tutucuya yerleştirin.
- Biyoyazıcı hedefleme işlemine başlayın.
- Biyo-baskı yazılımı tarafından istendiğinde, hedefleme plakasını biyoyazıcıdan çıkarın.
- Damlacıkların plaka üzerinde nerede görülebileceğini seçmek için kılavuzu kullanın. Hedefleme plakasını biyoyazıcıya yeniden takın ve damlacık yazdırma ve seçim işlemini tekrarlayın.
- İstendiğinde, hedefleme plakasını tekrar çıkarın, ardından hücre kültürü plakasıyla değiştirin (adım 1.3.25'e göre 2D kontrol kuyucuklarında ortam içerir). Kültür plakası kapağının kapalı olduğundan ve tutucuya yerleştirildiğinden emin olun. Biyoyazıcı model baskısını bitirecektir.
- Model yazdırma işlemi tamamlandıktan sonra, kuyucuklara ortam eklemek için bölüm 2'deki (adım 2.8) hücre kültürü yöntemlerini izleyin.
- Biyoyazıcı temizleme işlemini başlatın ve tamamlandıktan sonra kartuşları ve kalan sıvıları laboratuvar protokollerine göre atın.
2. Hücre kültürü
- Modeller, 1x flakon glutamaterjik nöron (flakon başına >5 milyon hücre) ve 1x flakon astrosit (flakon başına >1 milyon hücre) kullanılarak üretilir.
- Su banyosunu önceden 37 °C'ye ısıtın.
- Her iki hücre şişesini de kuru buz üzerinde laboratuvara taşıyın ve kuru buzdan çıkarıldıktan hemen sonra bir su banyosuna daldırın. Her iki şişeyi aynı anda çözdürün.
- Sadece küçük bir buz kristali kaldığında şişeleri su banyosundan çıkarın; Bu, daldırmadan sonra yaklaşık 3 dakika sürecektir. Hücreleri su banyosunda döndürmeyin veya karıştırmayın.
- Şişelere %70 EtOH püskürtün ve biyogüvenlik kabinine aktarın.
- Her bir süspansiyonu ayrı 15 mL'lik tüplere aktarmadan önce her bir şişeye damla damla 500 μL tam ortam +DOX/ROCKi ekleyin.
- Her tüpteki ortamı 8 mL'ye kadar doldurun ve adım 1.3'e göre biyo-baskı adımlarına geçin.
- Biyo-baskı modellerini takiben (adım 1.3), hemen tüm 3D kokültür kuyularına komple medya +DOX/ROCKi ekleyin ve modelleri 37 oC ve %5CO2'de bir inkübatöre yerleştirin. 96 oyuklu bir plaka kullanılıyorsa, oyuk başına 150 μL ortam ekleyin; 384 oyuklu bir plaka kullanıyorsanız, oyuk başına 50 μL ortam kullanın.
- Kültürün ilk 48 saati için herhangi bir medya değişikliğine gerek yoktur.
- 2D kontroller ve modeller üzerinde ortam değişiklikleri yaparken, 2D kültürleri ayırabilecek veya hidrojelin deformasyonuna neden olabilecek mekanik stresin indüklenmesini önlemek için özen gösterilmelidir. Kuyu kenarını gösteren bir mikropipet kullanarak ortam aspirasyonunu ve eklemesini yavaşça gerçekleştirin.
- 48 saat sonra, tüm kuyucuklarda %90'lık bir medya değişimi gerçekleştirin ve ROCKi'yi medya bileşiminden çıkarın (bkz. adım 2.14).
- 96 saatten sonra, DOX'u ortam bileşiminden çıkarmak için tüm kuyucuklarda %90'lık bir ortam değişikliği daha gerçekleştirin (bkz. adım 2.14).
- 48 saat ve 96 saatte iki %90 medya değişikliğinin ardından, her 48 saatte bir %50 medya değişikliği gerçekleştirin, burada medyanın %50'si aspire edilir ve yeni komple medya ile değiştirilir
- Medya kompozisyonu:
- Komple besiyeri: 1x GlutaMAX, 1x B27, 12.5 nM 2-merkaptoetanol, 10 ng/mL NT3, 5 ng/μL BDNF içeren nörobazal besiyeri.
- Komple besiyeri artı doksisiklin (DOX): 1x GlutaMAX, 1x B27, 12.5 nM 2-merkaptoetanol, 10 ng/mL nörotrofin-3 (NT3), 5 ng/μL beyin kaynaklı nörotrofik faktör (BDNF) ve 1 μg/mL doksisiklin içeren nörobazal ortam.
- Komple ortam artı DOX/ROCK inhibitörü (ROCKi): 1x GlutaMAX, 1x B27, 12.5 nM 2-merkaptoetanol, 10 ng/mL NT3, 5 ng/μL BDNF, 1 μg/mL doksisiklin ve 10 μM ROCK inhibitörü içeren nörobazal ortam.
3. Nörit büyüme analizi
- Biyo-baskı sonrası medyanın eklenmesinden hemen sonra parlak alan görüntüleme için hücreleri canlı hücre mikroskobuna yerleştirin.
- En az 7 gün boyunca her 12 saatte bir, 2D kontroller de dahil olmak üzere her kuyucukta 4x büyütmede görüntülenecek hücreleri programlamak için mikroskop yazılımı kullanın.
- Bölüm 2'de ayrıntılı olarak açıklandığı gibi her 48 saatte bir ortam değişiklikleri gerçekleştirin ve her seferinde ortam değiştikten sonra hücreleri mikroskoba geri yerleştirin.
- 7 günlük verilerden sonra, görüntüleri yazılımdan .jpg formatında dışa aktarın
- Tüm .jpg görüntüleri ImageJ yazılımına aktarın ve dosyaları 8 bit formatına dönüştürün. NeuronJ eklentisini yükleyin ve izleme aracını kullanarak dal noktaları da dahil olmak üzere görüntülerdeki nörit büyümesini izleyin.
- Zaman içinde nörit büyümesini çizmek için NeuronJ'den üretilen nörit izleme verilerini kullanın.
4. Hücre canlılığı analizi
- Kültürdeki her 24 saatlik zaman noktasında, bir canlı / ölü canlılık kiti kullanarak hücre canlılığı analizi için 3 veya daha fazla kuyucuğu boyayın. Bu adımı, çalışma süresince 24 saat veya 48 saat zaman noktalarında tekrarlayın.
- Canlı hücre reaktifini (1x Calcein-) ve ölü hücre reaktifini (1x etidyum homodimer-1) ve 1x canlı hücre nükleer boyasını (Hoechst 33342) fenol kırmızısı (Opti-MEM) olmadan 10 mL indirgenmiş serum ortamında askıya alarak canlı / ölü reaktif ortamını hazırlayın görüntülemeden 30 dakika önce. Canlı/ölü reaktif ortamının RT'ye gelmesine izin verin. Floresan ağartma nedeniyle canlı/ölü reaktif ortamını doğrudan ışıktan uzak tutun.
- Jel bozulmasını dikkatlice önleyerek hücre modelleri/2D kontroller içeren 3 kuyudan ortamı çıkarın. Hücre modellerini RT steril PBS ile bir kez yıkayın. 96 oyuklu bir plaka için her bir oyuğa 100 μL canlı/ölü reaktif ortamı veya 384 oyuklu bir plaka için 25 μL ekleyin.
- Modelleri 37 °C ve %5 CO'da 30 dakika inkübe edin2.
- Kuluçkadan sonra modeller görüntüleme için hazırdır. Kırmızı (647 nm, ölü hücreler), yeşil (488 nm, canlı hücreler) ve mavi (405 nm, nükleer leke) uyarma kanalları ile herhangi bir standart mikroskopta görüntüleme yapın. 3D modellerde en iyi sonuçları elde etmek için, yüksek içerikli bir konfokal mikroskop kullanarak görüntüleri görüntüleyin ve 4x veya 10x büyütmede bir Z-yığını işlevi kullanarak görüntüleme gerçekleştirin.
NOT: Bu çalışmada, hücre modelleri INCell Analyzer 6500HS (yüksek içerikli görüntüleme sistemi) kullanılarak görüntülendi ve analiz Signals Image Artist (görüntü analiz platformu, bkz. adım 4.7) kullanılarak gerçekleştirildi. - Görüntüleme tamamlandıktan sonra, hücre modellerini 37 °C ve% 5 CO 2'de hücre kültürü inkübatörüne geri döndürün. Bununla birlikte, uzun vadeli canlılık üzerindeki canlı/ölü reaktif ortamı nedeniyle canlılık analizi için kullanılan hücre modellerini daha ileri çalışmalardan çıkarın.
- Görüntü analiz platformunda görüntülerin analizi
- Yazılımda Z yığını görüntüsünün her bir düzlemini seçin. Düzlem görüntülerini maksimum yoğunlukta projeksiyon görüntüsü olarak birleştirin.
- 488 nm'de canlı hücre kanalından floresanı tanımlayarak biyobaskılı modeli ilgi alanı (ROI) olarak seçerek yeni bir analiz oluşturun (tüm hücrelerin ROI altında seçildiğinden emin olun).
- İlgilenilen bölgede, nükleer leke kanalı (405 nm) aracılığıyla ROI'deki hücre sayısını, 488 nm kanalını kullanarak ROI'deki canlı hücre sayısını ve 647 nm kanalını kullanarak ROI'deki ölü hücre sayısını belirlemek için görüntüleme yazılımını kullanın.
- Analizi tüm canlı/ölü işlem görmüş hücre modeli kuyucuklarında çalıştırın ve ROI alanını, toplam hücre sayısını, canlı hücre sayısını ve ölü hücre sayısını içeren veri tablosunu dışa aktarın.
- Canlı ve ölü hücrelerin sayısını, analiz günü başına toplam hücre sayısının yüzdesi olarak hesaplayın.
5. İmmün boyama ve hücre popülasyonu analizi
- Sabitlemeden önce, hücre modellerinden ortamı çıkarın ve modelleri PBS'de bir kez yıkayın.
- PBS'de %4 (h/h) paraformaldehit içeren hücreleri RT'de 20 dakika sabitleyin.
DİKKAT: Paraformaldehit ile yapılan tüm çalışmalar laboratuvar prosedürlerine göre yapılmalıdır. - Modellerden %4 (h/h) paraformaldehit solüsyonu aspire edin ve paraformaldehiti tamamen uzaklaştırmak için modelleri PBS'de dört kez yıkayın.
- Hücre modellerini RT'de 30 dakika boyunca% 0.2 triton-X ile geçirgen hale getirin ve PBS ile üç kez yıkayın.
- RT'de 3 saat boyunca% 10 (h / h) normal eşek serumu (NDS) kullanarak hücre modellerini bloke edin.
- Bloke edici çözeltiyi çıkarın ve modellere primer antikorlar (PBS'de% 1 v / v NDS ile seyreltilmiş) ekleyin. Hücre popülasyon oranı analizi yapıyorsanız (bkz. adım 5.11), Β-III tübülin (kırmızı AF647 konjugasyonu ile) ve GFAP (yeşil AF488 konjugasyonu ile) için birlikte boyanmış hücre modellerini dahil ettiğinizden emin olun. Modelleri 4 ° C'de 24 saat boyunca birincil antikorlarla inkübe edin.
- Birincil inkübasyondan sonra, konjuge primer antikorlarla boyanmış modelleri PBS'de üç kez yıkayın ve 30 dakika boyunca 20 μM Hoechst ile karşı boyayın. Adım 5.10'da ayrıntılı olarak açıklandığı gibi görüntü.
- Konjuge olmayan primer antikorlarla boyanmış modelleri PBS'de üç kez yıkayın ve ikincil antikorlar ekleyin (PBS'de %1 v/v NDS'de seyreltilmiş). 4 °C'de 24 saat inkübe edin.
- PBS'de üç kez yıkayarak ikincil antikorları çıkarın ve görüntülemeden önce 30 dakika boyunca 20 μM Hoechst ile modelleri karşı boyayın.
- Kırmızı (647 nm) ve yeşil (488 nm) uyarma kanallarına sahip standart mikroskoplarda görüntüleme yapın. Bununla birlikte, 3B modellerde en iyi sonuçları elde etmek için, yüksek içerikli bir konfokal mikroskop kullanarak görüntüleri görüntüleyin ve 4x veya 10x büyütmede bir Z-yığını işlevi kullanarak görüntüleme gerçekleştirin.
- Görüntü analiz platformunda hücre popülasyon oranlarının analizi
- GFAP (AF488 konjugasyonu ile) ve Β-III tübülin (AF647 konjugasyonu ile) için birlikte boyanmış modelleri kullanarak hücre popülasyonlarının bir analizini elde edin.
- Yazılımda Z yığını görüntüsünün her bir düzlemini seçin ve düzlem görüntülerini maksimum yoğunluklu bir projeksiyon görüntüsü olarak birleştirin.
- 647 nm'de Β-III tübülin kanalından floresansı tanımlayarak biyobaskılı modeli ROI olarak seçerek yeni bir analiz oluşturun (tüm hücre içeren alanın ROI altında seçildiğinden emin olun).
- ROI içinde, Hoechst kanalındaki hücre sayısını (405 nm), 488 nm kanalını kullanarak ROI'deki GFAP + astrosit sayısını ve 647 nm kanalını kullanarak ROI'deki Β-III tubulin + hücrelerinin sayısını belirlemek için yazılımı kullanın.
- Analizi tüm birlikte boyanmış hücre modeli kuyucuklarında çalıştırın ve ROI alanını, toplam hücre sayısını, GFAP + hücre sayısını ve Β-III tübülin + hücre sayısını içeren veri tablosunu dışa aktarın.
- GFAP+ ve Β-III tübülin+ hücrelerinin sayısını toplam hücre sayısının yüzdesi olarak hesaplayın.
Sonuçlar
Nörit büyüme analizi
Bu protokolde, iPSC'den türetilen glutamaterjik nöronlar ve astrositler, 3D biyoyazıcı kullanılarak bir hidrojel matrisine kokültürde biyo-basıldı. Baskıdan sonraki ilk 7 gün boyunca, hücreler her 12 saatte bir canlı hücre mikroskobu kullanılarak görüntülendi. Biyo-baskı sonrası, hücreler yuvarlak bir morfolojiye sahip olmalı ve hidrojel matrisi boyunca dağılmalı, kültürün ilk birkaç günü boyunca birkaç çıkıntı ile daha küçük hücre kümeleri oluşturmak üzere kademeli olarak değişmelidir (temsili sağlıklı hücre büyümesi için Ek Video 1'e bakın). 4. günde, sağlıklı hücreler, nörit çıkıntıları ile birbirine bağlanan daha büyük kümeler oluşturmak için jel boyunca göç edecektir. 7. günde, neredeyse hiç tek hücre kalmamalı, birbirine bağlanan nörit demetleri ve astrositik çıkıntılar güçlendirilmiş görünmelidir ve kümelerden birçok küçük nörit çıkıntısı görülebilir (Şekil 2A). 7 günlük büyüme periyodu boyunca alınan bir dizi canlı hücre parlak alan görüntüsü kullanılarak, bölüm 3'te ayrıntılı olarak açıklandığı gibi nörit büyümesinin bir analizi yapıldı. Bu analiz, nörit büyümesinin 12 saat ile 156 saat arasında neredeyse doğrusal bir şekilde (R2 değeri = 0.84) arttığını göstermiştir (Şekil 2B). Bu nörit büyümesi döneminde, hücre gövdesi kümeleri de boyut olarak artar (bkz. Ek Video 1), bu da hidrojel boyunca hücre göçünün göstergesidir.
Hücre canlılığı ve popülasyon oranı
Bu protokolde, hücre modellerinin biyo-baskısı için 15 milyon nöron/mL ve 5 milyon astrosit/mL'den oluşan 20 milyon hücre/mL konsantrasyon kullanılır. Kalsein-(canlı hücreler), etidyum homodimer-1 (ölü hücreler) ve bir nükleer boyama ile canlı hücre boyama kullanılarak, 7 günlük bir süre boyunca hayatta kalan hücre sayısı bölüm 4'e göre hesaplanabilir (Şekil 3A). Temsili kültürler için hücre canlılığı sonuçları, toplam hücrelerin %72 ± %1'inin (ortalama ± SEM) canlı olduğu ve Calcein-için boyanma gösterdiği, %29 ± %2'sinin (ortalama ± SEM) toplam hücrelerin öldüğü ve etidyum homodimer-1 ile boyanma gösterdiği 4. gün için gösterilmiştir (Şekil 3B). Calcein-ve etidyum homodimer-1 ile hücre boyamanın temsili görüntüleri Ek Şekil 1'de görülebilir. Ölü hücreler hidrojelde tutulduğundan ve hücre besleme işlemleri sırasında uzaklaştırılmayacağından, 3D kültürler için hücre sağkalım değerlerinin doğrudan 2D kültürlerle karşılaştırılamayacağına dikkat edilmelidir.
Bölüm 5 ve Şekil 4'te açıklandığı gibi Β-III tübülin ve GFAP için immünofloresan boyama kullanılarak, nöronlar ve astrositler arasındaki hücre popülasyon oranlarını belirlemek için görüntü analizi yapılabilir (Şekil 3A). Temsili kültürlerde model başına toplam hücrelerin Β-III tübülin pozitif nöronları %49 ± %3'ünü (ortalama ± SEM) temsil ederken, GFAP pozitif astrositler %30 ± %4'ü (ortalama ± SEM) temsil eder. Bu, sırasıyla 1: 1.5, astrositlerin nöronlara oranını verir. Bu, model başına toplam %21'lik bir hücre kalanı bırakır ve bu da her iki hücre işaretleyicisi için de lekelenmez. Hücre canlılığı analizi, hücrelerin ortalama %29'unun 4. günde canlı olmadığını gösterdiğinden, bu hücrelerin hidrojel içinde ölü olması muhtemeldir.
Hücre işaretleyicilerinin ifadesi
Biyobaskılı nöronların ve astrositlerin morfolojisi, nöronal hücre tipi belirteci (Β-III tubulin) ve astrositik belirteç (GFAP) için immün boyama yoluyla değerlendirildi. Gösterilen temsili kültürlerde, immün boyama, sağlıklı hücre morfolojisi gösteren, her iki hücre tipinin de hücresel çıkıntıların büyümesini sergilediği bireysel hücre tiplerine lokalizedir (Şekil 4A, B). Hidrojel ve hücre yapıları üç boyutlu olduğundan, her görüntü Şekil 4A,B'deki yapı boyunca yalnızca bir dilimi temsil eder. Şekil 4C, X, Y ve Z düzlemlerinde hücre lokalizasyonunun görünümlerini gösteren, hidrojel boyunca birleştirilmiş bir görüntü yığınını göstermektedir. Şekil 4D, sadece Β-III tübülin için immün boyamayı göstermektedir; hücre gövdesi kümelerinden daha ince nörit büyümelerini vurgulamak. Glutamaterjik nöronların fenotipini daha fazla incelemek için, glutamaterjik iyonik reseptör belirteci GluR2 için immün boyama gerçekleştirilebilir. Şekil 4E'de, nörit demetleri boyunca daha yüksek çözünürlüklü noktasal lekelenme göstermek için alan 4E.1 (iç) vurgulanmıştır. Bu nedenle, bu kokültürdeki nöronların glutamaterjik bir fenotipe sahip olduğunu doğrular. Tüm immün boyama görüntülerinde, hücre kümelerini ve nöritleri çevreleyen immünofloresan boyalı hücre dışı yapılar gözlemlenebilir. Bu yapıların, hidrojele bağlanan az miktarda spesifik olmayan antikor ile kombinasyon halinde hidrojel içinde tutulan kalıntıları temsil etmesi muhtemeldir. Bu, 3D iskele modellerinde olduğu gibi, hücre beslemesi sırasında ölü hücreler ve döküntüler uzaklaştırılmadığı için biyobaskılı kültürlerde beklenir. İkincil antikorların hidrojel spesifik olmayan bağlanmasının bir gösterimi için Ek Şekil 2'de temsili bir negatif kontrol immün boyama görüntüsü gösterilmektedir.
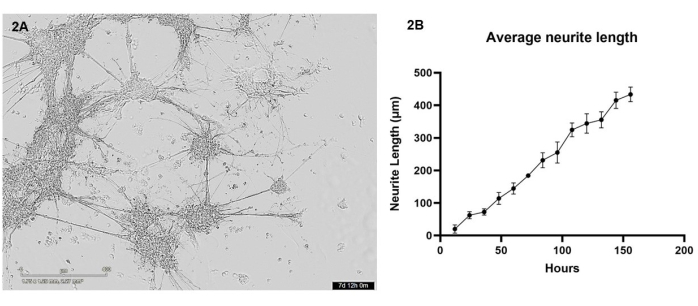
Şekil 2: Glutamaterjik nöronlar ve astrositler, biyoyazıcı kullanılarak hidrojel matrisine biyo-basıldı ve her 12 saatte bir parlak alan mikroskobu kullanılarak görüntülendi . (A) Analiz sırasında hücre kültürlerinden alınan örnek bir parlak alan görüntüsü. Görüntü 156 saatlik zaman noktasını temsil eder ve ölçek çubuğu 400 μm'yi temsil eder. (B) ImageJ için NeuronJ paketi kullanılarak ölçülen kültürlerden nörit büyümelerinin ortalama uzunluğu (μm). Her veri noktası n = 3 nörittir ve veriler ortalama ± SEM olarak gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
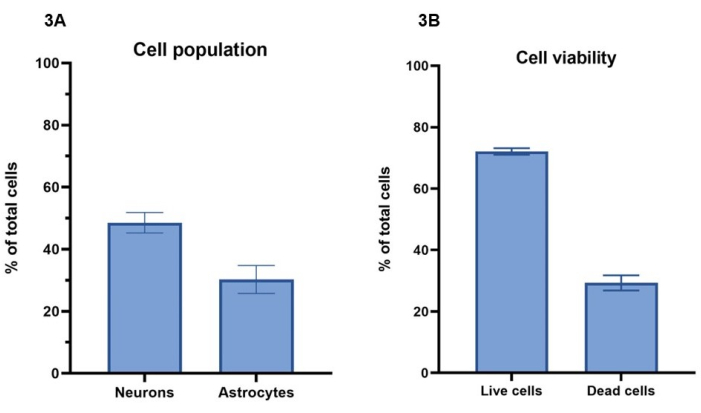
Şekil 3: Hücre modellerinin biyo-baskısı için 20 milyon hücre/mL aktivatör çözeltisi konsantrasyonu kullanıldı . (A) Hücre canlılığı, canlı/ölü hücre boyaları (sırasıyla Calcein-ve etidyum homodimer-1) kullanılarak hesaplandı. Değerler, oyuk başına toplam hücrelerin %72 ± %1'inin (ortalama ± SEM, n = 3) canlı olduğunu ve hücrelerin %29'unun ± %2'sinin (ortalama ± SEM, n = 3) 4. günde kuyucuk başına toplam hücre popülasyonunun öldüğünü göstermektedir. Gösterilen değerler ortalama ± SEM'i temsil eder. (B) Hücre popülasyonlarının oyuk başına nöron ve astrosit yüzdesi, Şekil 4'te gösterilen boyamanın görüntü analizi ile hesaplanmıştır. Nöronlar, 7. günde Β-III tübülin için pozitif boyanan hücrelerin yüzdesini temsil eder (%49 ± %3, ortalama ± SEM, n = 3), astrositler ise 7. günde GFAP için pozitif boyanan hücrelerin yüzdesini temsil eder (%30 ± %4, ortalama ± SEM, n = 3). Gösterilen değerler ortalama ± SEM'i temsil eder. Şekil 3'te gösterilen hesaplamalar için tüm görüntülemeler konfokal görüntüleme sisteminde, tüm analizler görüntü analiz platformunda ve GraphPad Prizma'da yöntemlere göre gerçekleştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
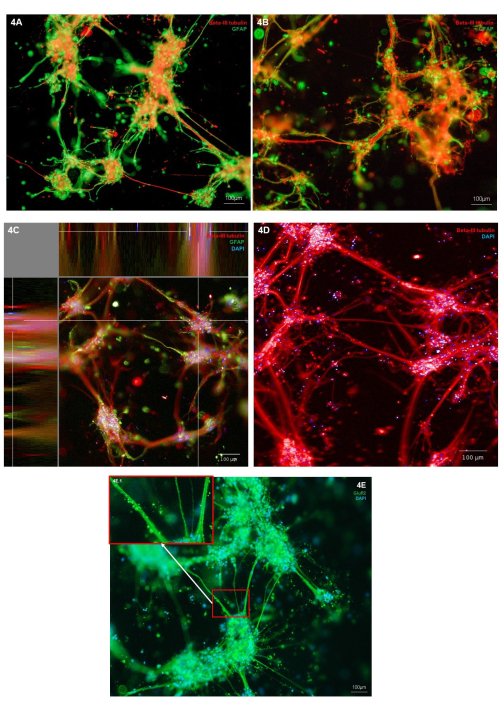
Şekil 4: 7. günde glutamaterjik nöronların ve astrositlerin 3D biyobaskılı kokültürlerinde nöral hücre tipi belirteçlerinin ekspresyonu . (A,B) Nöronal belirteç Β-III tübülin ve astrosit işaretleyici GFAP'nin immünofloresan boyama, 10x büyütmede ters mikroskop platformunda görüntülendi. Ölçek çubukları 100 μm'yi temsil eder. (C) Nöronal belirteç β-III tübülin ve astrosit belirteci GFAP'nin Hoechst ile birlikte boyanmış immünofloresan boyaması, XYZ düzlem görünümünde gösterilen, 10x büyütmede bir konfokal görüntüleme sisteminde görüntülendi. Görüntü analiz platformunda oluşturuldu. Ölçek çubuğu 100 μm'yi temsil eder. (D) Hoechst ile birlikte boyanmış nöronal belirteç β-III tübülinin immünofloresan boyama, 20x büyütmede konfokal görüntüleme sisteminde görüntülendi. Ölçek çubuğu 100 μm'yi temsil eder. (E) Hoechst ile birlikte boyanmış glutamaterjik belirteç GluR2'nin immünofloresan boyama, 10x büyütmede ters mikroskop platformunda görüntülendi. Kutu 3E.1, GluR2 boyamanın vurgulanan alanlarını gösterir. Ölçek çubuğu 100 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Video 1: Glutamaterjik nöronlar ve astrositler, biyoyazıcı kullanılarak hidrojel matrisine biyo-basıldı ve her 12 saatte bir parlak alan mikroskobu kullanılarak görüntülendi. Analiz sırasında hücre kültürlerinden alınan parlak alan görüntülerinin videosu, zaman noktaları sağ alt köşede gösterilir ve ölçek çubukları 400 μm'yi temsil eder. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 1: 4. Günde biyo-baskılı nöronların ve astrositlerin canlı/ölü analizinin örnek görüntüleri. Calcein-boyası yeşil (488 nm) ve etidyum homodimer boyası kırmızı (647 nm) ile gösterilmiştir. Görüntü, görüntü analiz platformunda oluşturulan XYZ düzlem görünümünde gösterilir. Ölçek çubuğu 100 μm'yi temsil eder. (A) Görüntüleme, 4x büyütmede konfokal görüntüleme sistemi kullanılarak gerçekleştirildi. (B) Görüntüleme, 10x büyütmede konfokal görüntüleme sistemi kullanılarak gerçekleştirilmiştir Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: İmmünofloresan boyama sonrası negatif kontrol görüntüsü örneği. Primer antikorlar ihmal edildi ve immün boyama protokollerine göre yeşil (488 nm) ve kırmızı (647 nm) sekonder antikorlar kullanıldı. Görüntü, görüntü analiz platformunda oluşturulan XYZ düzlem görünümünde gösterilir. Ölçek çubuğu 100 μm'yi temsil eder. Görüntüleme, 10x büyütmede konfokal görüntüleme sistemi kullanılarak gerçekleştirildi. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
CNS'nin doğru modellerine duyulan ihtiyaç hiç bu kadar yüksek olmamıştı ve iki boyutlu (2D) geleneksel hücre kültürü modellerinin sınırlamaları, son yıllarda bir nesil karmaşık CNS modelini yönlendirdi19. Bununla birlikte, nöral hücre tipleri ve ECM arasındaki etkileşimleri temsil eden birçok karmaşık 3B model, bu modellerin endüstriyel süreçlerde uygulanmasını engelleyecek sınırlamalara sahiptir 6,20,21. Bu protokolde, 96 kuyucuklu ve 384 kuyucuklu formatlarda biyoaktif bir hidrojel iskelesi oluşturmak için 3D biyobaskı teknolojisini kullanarak bu sınırlamaların bazılarını çözmeyi amaçlayan, insan iPSC'den türetilmiş nöronların ve astrositlerin bir 3D kokültür modelini geliştiriyoruz.
Bu modelleri geliştirme metodolojisi, plaka haritası tasarım yazılımı, otomatik olarak oluşturulan baskı protokolleri ve biyoyazıcıdan yönlendirilen baskı süreci aracılığıyla basitleştirilmiştir. Bununla birlikte, bu protokolde kullanılan hassas iPSC türevi hücre tiplerinin hassas doğası nedeniyle, çözdürme ve kültürde aşağıdaki kritik adımlara dikkat edilmelidir. İlk olarak, ROCK inhibitörünün (ROCKi) dahil edilmesi, biyo-baskı işlemi boyunca ve erken kültür sırasında çeşitli faydalara sahiptir. Hücre çözülmesi, nöronların stres tepkisi yaşayabileceği kritik bir noktadır ve uygun olmayan çözülme protokolleri hayatta kalma şansını azaltabilir22. Tipik olarak hücrelerin çözülmesi, ortam eklenmesi ve hücrelerin inkübatör sıcaklığına mümkün olduğunca verimli bir şekilde yükseltilmesi önerilir23. Bununla birlikte, bu protokolde açıklanan biyo-baskı işlemi sırasında, nöronların ve astrositlerin ortam yerine bir aktivatör çözeltisinde yeniden süspanse edilmesi gerekir ve hücreler, baskı çalışmasının sonuna kadar (çözülme sonrası 30 dakikaya kadar) oda sıcaklığının üzerine çıkarılmayacaktır. Bu nedenle, çözüldükten hemen sonra ROCKi'nin ortama eklenmesi ve bunun iki santrifüj adımı sırasında (2.1--2.7 ve 1.3.15-1.3.20 adımları) dahil edilmesi, hücre stres yollarını inhibe etmek için zorunludur, bu da daha düşük canlılık seviyelerine neden olur24. Ayrıca, ROCKi'nin nörit büyümesini teşvik ettiği ve nöronal olgunlaşmayı iyileştirdiği gösterilmiştir25. Bu nedenle, biyobaskı sonrası 48 saat boyunca ROCKi takviyesine devam edilir. Bununla birlikte, hücreler tahlil için kullanılmadan önce sonraki ortam değişiklikleri sırasında tam yıkamayı sağlamak için 48 saat sonra ROCKi takviyesinin çıkarılması zorunludur.
Kritik dikkat gerektiren bir diğer adım, baskı sonrası medya ekleme ve medya değişiklikleri sırasındadır (adım 2.8-2.13). Biyobaskılı hidrojel iskele, gri maddeye eşdeğer, yalnızca 1,1 kPa'lık eşdeğer bir biyomekanik sertliğe sahiptir. Adım 2.10'da açıklandığı gibi, rahatsızlığı önlemek için ortam ekleme ve aspirasyon sırasında kuyunun kenarına nazikçe pipetlemek çok önemlidir. Bu, jel seviyesinin toplam kuyu hacminin daha yüksek bir oranını kapladığı 384 oyuklu plakalar için özellikle önemlidir. Bu yöntem, hücrelerin kenar kaldırmasını ve nörit büyümelerinin kesilmesini önlemek için 2D kontrol kuyularında da kullanılmalıdır. Yazarlar ayrıca, iPSC'den türetilmiş hücre kültürleri için kullanılan bir biyogüvenlik kabinininkine eşdeğer bir dikkatle ele alınması gereken biyo-yazıcı içindeki steril tekniğin önemini vurgulamak istemektedir. Bu, yeşil ışık yakma ve baskı prosedürlerinde kullanılan %70 EtOH ve dH2O'nun steril filtrelenmesini, elleri biyoyazıcının içine ve dışına hareket ettirirken kartuşların ve plakaların kapaklarının tutulmasını ve baskıdan önce ve sonra biyoyazıcının içindeki yüzeylerin %70 etanol mendille dekontamine edilmesini içerir.
Bu modeli geliştirmek için seçilen biyomürekkep ve aktivatör solüsyonlarından oluşan biyo-baskılı hidrojel iskelesi, RASTRUM biyoyazıcısında kullanılmak üzere Inventia Life Science tarafından geliştirilen bir dizi biyomürekkep ve aktivatör solüsyonundan seçilmiştir. Laminin ve hyaluronik asit, aksonal rehberlik, sinaps oluşumu ve perinöronal ağın oluşumundaki rolleri nedeniyle iPSC kaynaklı nöronal olgunlaşma ile ilgili moleküller olarak tanımlanmıştır26,27. Ayrıca, daha düşük yoğunluklu hidrojellerin nöronlardan12 daha iyi nörit büyümesi sağladığı gösterildiğinden, 1.1 kPa'lık bir biyomekanik sertlik seçilmiştir. Şirket içinde veya farklı bir ticari tedarikçiden farklılaştırılan nöronlar ve astrositler kullanılarak protokolde değişiklikler yapılırsa, en destekleyici hidrojel iskelesini belirlemek için bir matris seçim testi yapılması önerilir15. Ayrıca, optimum canlılığı sağlamak ve hidrojel aşırı kalabalıklaşmasını önlemek için hücre kaynaklarında değişiklikler yapılırsa hücre yoğunluğunun da optimize edilmesi gerekebilir. Biyoyazıcı işleviyle ilgili tüm değişiklikler ve sorun giderme için yazarlar, üreticilerle iletişime geçmenizi ve üretici protokollerine başvurmanızı önerir.
CNS, hepsi farklı beyin nişlerinde bulunan ve nöral fonksiyona katkıda bulunan belirli rollere sahip çok çeşitli nöronal alt tipler ve glial hücreler içerir28. Bu geniş kapsam bağlamında, bu model yalnızca en bol bulunan iki hücre tipini (astrositler ve uyarıcı glutamaterjik nöronlar) temsil eder. Mikroglia, oligodendrositler ve kan-beyin bariyeri oluşturan endotel hücreleri gibi önemli hücre tipleri bu sistemden çıkarılır. Mikroglia'nın dahil edilmesi, nöroimmün etkileşimlere odaklanmada önemli olabilir ve oligodendrositler, merkezi miyelinasyonu etkileyen hastalıklarda ilgi çekici olabilir. Patolojideki rollerine ek olarak, kan-beyin bariyeri oluşturan endotel hücreleri gibi hücreler, bu modelin farmakokinetik tahliller için kullanımını etkileyebilecek ilaç metabolize edici enzimler salgılar29. Modelin bir başka sınırlaması, astrositlerin nöronlara oranı olabilir; Astrositlerin nöronlara oranı, beyin bölgeleri arasında büyük farklılıklar gösterir ve önerilen değerler 1:1 ile 1:330,31 arasındadır. Bu model, nöronlara yaklaşık 1:1.5 astrosit oranına sahiptir; Bu nedenle, bu model, beyaz cevher alanları30 gibi astrositlerin daha bol olduğu beyin bölgelerini modellemekle ilgili olmayabilir.
Son yıllarda 3D biyo-baskılı kokültür modelleri geliştirmek için başka protokoller de yayınlanmıştır. Sullivan ve ark., 2021 tarafından yayınlanan bir yayın, 2D kültürlere kıyasla yüksek baskı sonrası canlılık ve nöronal fonksiyonun iyileştirildiğini gösteren, iPSC'den türetilmiş nöral progenitör hücreleri kullanan bir 3D biyobaskılı nöral model sundu32. Ancak bu protokolde hücre kaynağı olarak nöral progenitör hücreler kullanılmış ve 4 hafta kültürde tutulmuştur. Bu protokolde, ticari olarak temin edilebilen iPSC türevi glutamaterjik nöronlar ve astrositler kullanıldı. Bu, 7 gün gibi kısa bir sürede birlikte kültürlenmiş hücrelerden oluşan bir 3D ağın kurulmasına izin verir; Nörit büyüme analizinin gösterdiği gibi, nörit büyümesi 24 saat içinde başlar ve hücre büyümesinin izlendiği 156 saatlik periyot boyunca doğrusal bir şekilde devam eder. Bu ağların hızlı bir şekilde kurulması kısmen, 2D kültürde bile 7 gün içinde olgun nöronal alt tip belirteçlerinin ekspresyonunu gösteren NGN2'nin optimize edilmiş doksisiklin ile indüklenebilir gen ekspresyonunu kullanan glutamaterjik nöronların kullanımına bağlanabilir33. Bu tekniği kullanarak bu büyüme periyodunun kısaltılması, biyofarmasötik endüstrisinde modellerin uygulanması için önemlidir, çünkü tahlil geliştirme, hücre modellerinin hızlı bir şekilde geri dönüşünü ve geliştirilmesini gerektirir15.
Sonuç olarak, bu model, tarama amacıyla hızlı ve uygun bir şekilde kurulan bir 3D nöron ve astrosit modeli için potansiyel göstermektedir. Bu model türü için gelecekteki uygulamalar, hasta veya gen düzenlenmiş hastalık iPSC hatlarını kullanarak farklı hastalıklara genişleme fırsatı ile farklı CNS hastalıklarında ilaç keşif çabaları için olabilir. Ayrıca, doksisiklin ile indüklenebilir NGN2 ekspresyonu iPSC'den türetilen glutamaterjik nöronların kullanımı, hücrelerin daha kısa sürede olgunluğa ulaşmasını sağlar ve bu, nörodejenerasyon araştırmaları için yaşlanan beynin modellerini geliştirmek için kullanılabilir. Bu sistem, mikroglia ve oligodendrositler dahil olmak üzere kokültürde ek hücre tiplerinin kullanılmasıyla da genişletilebilir.
Açıklamalar
CW, NC ve JB, Merck Sharp & Dohme (UK) Limited, Londra, Birleşik Krallık'ın çalışanlarıdır. YH, Merck & Co., Inc., Rahway, NJ, ABD'nin bir yan kuruluşu olan Merck Sharp & Dohme LLC'nin bir çalışanıdır.
Şekil bir, Biorender.com kullanılarak oluşturulmuştur.
Teşekkürler
Yazarlar, Alex Volkerling, Martin Engel ve Rachel Bleach'e protokolün geliştirilmesindeki yardımları ve makaleyle ilgili geri bildirimleri için teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Thermofisher | 31350010 | |
| 384-well plate | PerkinElmer | 6057300 | |
| 96-well plate | PerkinElmer | 6055300 | |
| Activator fluid F299 | Inventia Life Science | N/A | |
| Activator fluid F3 | Inventia Life Science | N/A | |
| B27 (50x) minus Vit A | Thermofisher | 12587010 | |
| Bioink fluid F261 | Inventia Life Science | N/A | |
| Bioink fluid F32 | Inventia Life Science | N/A | |
| Doxycycline hyclate | Sigma Aldrich | D5207 | |
| GlutaMAX (100x) | Thermofisher | 35050061 | |
| Goat anti-mouse IgG H&L Alexa Fluor 647 | Abcam | ab150115 | |
| Goat anti-rabbit IgG H&L Alexa Fluor 488 | Abcam | ab150077 | |
| Hoechst | Abcam | ab228551 | |
| Human BDNF Recombinant Protein | Thermofisher | PHC7074 | |
| Human NT3 Recombinant Protein | Thermofisher | PHC7036 | |
| iCell Astrocytes | Fujifilm CDI | 1434 | |
| INCell Analyser 6500HS | Molecular Devices | N/A | high content imaging system |
| Incucyte S3 | Sartorius | N/A | |
| ioGlutamatergic Neurons (Large vial) | Bit.bio | e001 | |
| Laminin (1 mg/mL) | Sigma Aldrich | L2020 | |
| Live/dead kit (Calcein-AM, Ethidium homo-dimer-1) | Invitrogen | L3224 | |
| Mouse anti-BIII tubulin NL637 conjugated | R&D systems | SC024 | |
| Neurobasal media | Thermofisher | 21103049 | |
| Normal Donkey Serum | Abcam | ab7475 | |
| NucBlue Live (Hoechst 33342) | Thermofisher | R37605 | |
| Opti-MEM | Thermofisher | 11058021 | |
| Paraformaldehyde | Sigma Aldrich | P6148 | |
| PEI 50% in H2O | Sigma Aldrich | 181978 | |
| Pierce Borate Buffer 20x | Thermofisher | 28341 | |
| Prism | GraphPad | Data analysis software | |
| Rabbit anti-ionotropic glutamatre receptor 2 (GluR2) | Abcam | ab206293 | |
| RASTRUM(TM) Bioprinter | Inventia Life Science | N/A | Bioprinter |
| RASTRUM(TM) Bioprinter Cartridges | Inventia Life Science | N/A | Bioprinter Cartridges |
| RASTRUM(TM) Targeting plate | Inventia Life Science | N/A | Targeting plate |
| Rho kinase (ROCK) inhibitor | Abcam | ab120129 | |
| Sheep anti-GFAP NL493 conjugated | R&D systems | SC024 | |
| Signals Image Artist | PerkinElmer | N/A | Image analysis platform |
| Triton X-100 | Thermofisher | HFH10 | |
| Zeiss Axio Observer | Zeiss | N/A | Inverted microscope platform |
Referanslar
- Jung, Y. L., Hwang, J., Yoo, H. S. Disease burden metrics the innovations of leading pharmaceutical companies: a global and regional comparative study. Globalization and Health. 16 (1), 80-80 (2020).
- Potkin, S. G., et al. The neurobiology of treatment-resistant schizophrenia: paths to antipsychotic resistance and a roadmap for future research. npj Schizophrenia. 6, 1(2020).
- Keswani, C., et al. The Global Economic Impact of Neurodegenerative Diseases: Opportunities and Challenges. Bioeconomy for Sustainable Development. , Springer, Singapore. (2019).
- Perucca, E. The pharmacological treatment of epilepsy: recent advances and future perspectives. Acta Epileptologica. 3 (1), 22(2021).
- Nikolakopoulou, P., et al. Recent progress in translational engineered in vitro models of the central nervous system. Brain. 143 (11), 3181-3213 (2020).
- Whitehouse, C., Corbett, N., Brownlees, J. 3D models of neurodegeneration: implementation in drug discovery. Trends in Pharmacological Sciences. 44 (4), 208-221 (2023).
- Rauti, R., Renous, N., Maoz, B. M. Mimicking the brain extracellular matrix in vitro: A review of current methodologies and challenges. Israel Journal of Chemistry. 60 (12), 1141-1151 (2020).
- Fawcett, J. W., Oohashi, T., Pizzorusso, T. The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature Reviews Neuroscience. 20 (8), 451-465 (2019).
- Lam, D., et al. Tissue-specific extracellular matrix accelerates the formation of neural networks and communities in a neuron-glia co-culture on a multi-electrode array. Scientific Reports. 9, 4159(2019).
- Roll, L., Lessmann, K., Brüstle, O., Faissner, A. Cerebral organoids maintain the expression of neural stem cell-associated glycoepitopes and extracellular matrix. Cells. 11 (5), 760(2022).
- Yan, Y., Bejoy, J., Marzano, M., Li, Y. The use of pluripotent stem cell-derived organoids to study extracellular matrix development during neural degeneration. Cells. 8 (3), 242(2019).
- Ma, L., et al. 3D bioprinted hyaluronic acid-based cell-laden scaffold for brain microenvironment simulation. Bio-Design and Manufacturing. 3 (3), 164-174 (2020).
- Liaw, C. -Y., Ji, S., Guvendiren, M. Engineering 3D hydrogels for personalized in vitro human tissue models. Advanced Healthcare Materials. 7 (4), 1701165(2018).
- Ma, J., Huang, C. Composition and mechanism of three-dimensional hydrogel system in regulating stem cell fate. Tissue Engineering Part B: Reviews. 26 (6), 498-518 (2020).
- Belfiore, L., et al. Generation and analysis of 3D cell culture models for drug discovery. European Journal of Pharmaceutical Sciences. 163, 105876(2021).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Engel, M., Belfiore, L., Aghaei, B., Sutija, M. Enabling high throughput drug discovery in 3D cell cultures through a novel bioprinting workflow. SLAS Technology. 27 (1), 32-38 (2022).
- Takamura, T., et al. Influence of age on global and regional brain stiffness in young and middle-aged adults. Journal of Magnetic Resonance Imaging. 51 (3), 727-733 (2020).
- Slanzi, A., Iannoto, G., Rossi, B., Zenaro, E., Constantin, G. In vitro models of neurodegenerative diseases. Frontiers in Cell and Developmental Biology. 8, 328(2020).
- de Souza, N. Organoid variability examined. Nature Methods. 14 (7), 655-655 (2017).
- Hernández, D., et al. Culture variabilities of human iPSC-derived cerebral organoids are a major issue for the modelling of phenotypes observed in Alzheimer's disease. Stem Cell Review and Reports. 18 (2), 718-731 (2022).
- Li, R., et al. Differentiation of human iPS cells into sensory neurons exhibits developmental stage-specific cryopreservation challenges. Frontiers in Cell and Developmental Biology. 9, 796960(2021).
- Nishiyama, Y., et al. Safe and efficient method for cryopreservation of human induced pluripotent stem cell-derived neural stem and progenitor cells by a programmed freezer with a magnetic field. Neuroscience Research. 107, 20-29 (2016).
- Uhrig, M., Ezquer, F., Ezquer, M. Improving cell recovery: Freezing and thawing optimization of induced pluripotent stem cells. Cells. 11 (5), 799(2022).
- Harbom, L. J., et al. The effect of rho kinase inhibition on morphological and electrophysiological maturity in iPSC-derived neurons. Cell and Tissue Research. 375 (3), 641-654 (2019).
- Koh, H. S., Yong, T., Chan, C. K., Ramakrishna, S. Enhancement of neurite outgrowth using nano-structured scaffolds coupled with laminin. Biomaterials. 29 (26), 3574-3582 (2008).
- Tarus, D., et al. Design of hyaluronic acid hydrogels to promote neurite outgrowth in three dimensions. ACS Applied Materials & Interfaces. 8 (38), 25051-25059 (2016).
- Brain Initiative Cell Census Network (BICCN). Initiative Cell Census Network (BICCN). A multimodal cell census and atlas of the mammalian primary motor cortex. Nature. 598 (7879), 86-102 (2021).
- Dauchy, S., et al. Expression and transcriptional regulation of ABC transporters and cytochromes P450 in hCMEC/D3 human cerebral microvascular endothelial cells. Biochemical Pharmacology. 77 (5), 897-909 (2009).
- Herculano-Houzel, S. The glia/neuron ratio: How it varies uniformly across brain structures and species and what that means for brain physiology and evolution. Glia. 62 (9), 1377-1391 (2014).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Sullivan, M. A., et al. 3D bioprinting of stem cell-derived central nervous system cells enables astrocyte growth, vasculogenesis and enhances neural differentiation/function. bioRxiv. , (2022).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).
Erratum
Formal Correction: Erratum: Three-Dimensional Bioprinting of Human iPSC-Derived Neuron-Astrocyte Cocultures for Screening Applications
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for: Three-Dimensional Bioprinting of Human iPSC-Derived Neuron-Astrocyte Cocultures for Screening Applications. The Authors section was updated from:
Chloe Ann Whitehouse1
Yufang He2
Janet Brownlees1
Nicola Corbett1
1MSD R&D Innovation Centre Ltd
2Merck & Co., Inc.
to:
Chloe Ann Whitehouse1
Yufang He2
Janet Brownlees1
Nicola Corbett1
1MSD Research Laboratories, London, UK
2Merck & Co., Inc., Rahway, NJ, USA
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır