Method Article
人 iPSC 衍生的神经元-星形胶质细胞共培养物的三维生物打印用于筛选应用
Erratum Notice
摘要
在这里,我们提出了一种方案,用于生产iPSC衍生的神经元和星形胶质细胞的3D生物打印共培养物。这种共培养模型在水凝胶支架内以 96 孔或 384 孔形式生成,在 7 天内表现出高印后活力和神经突生长,并显示两种细胞类型成熟标记物的表达。
摘要
为了使细胞模型可用于药物筛选,系统必须满足通量和均一性要求,同时具有高效的开发时间。但是,许多已发布的 3D 模型不满足这些标准。因此,这限制了它们在早期药物发现应用中的实用性。三维(3D)生物打印是一种新技术,可应用于3D模型的开发,以加快开发时间,提高标准化并提高产量。在这里,我们提出了一种协议,用于开发人类诱导多能干细胞 (iPSC) 衍生的谷氨酸能神经元和星形胶质细胞的 3D 生物打印共培养模型。这些共培养物嵌入生物活性肽、全长细胞外基质 (ECM) 蛋白的水凝胶基质中,生理刚度为 1.1 kPa。该模型可以快速建立 96 孔和 384 孔格式,平均印后活力为 72%。该模型中的星形胶质细胞与神经元的比例为1:1.5,在人脑的生理范围内。这些 3D 生物打印细胞群在培养后 7 天内还显示出成熟神经细胞类型标志物的表达以及神经突和星形胶质细胞突起的生长。因此,该模型适用于使用细胞染料和免疫染色技术以及神经突生长测定进行分析。大规模生产这些生理代表性模型的能力使它们非常适合用于神经科学靶标的中高通量筛选分析。
引言
药物发现行业对中枢神经系统 (CNS) 疾病的研究正在扩大1.然而,许多流行的中枢神经系统疾病,如癫痫、精神分裂症和阿尔茨海默病,仍然没有治愈的治疗方法2,3,4。中枢神经系统疾病缺乏有效的治疗方法,至少在一定程度上可以归因于缺乏准确的大脑体外模型5。这导致了当前体外模型和体内数据之间的转化差距,以及随后研究工作的瓶颈。
在这种转化差距的推动下,近年来新型 3D 细胞模型的开发显着增加,包括神经类器官、神经球体和基于支架的模型6。这些模型的 3D 结构有助于概括神经微环境,包括生物力学应力、细胞间接触和大脑细胞外基质 (ECM)7。脑 ECM 是神经生理学的动态元件,它占据了神经细胞类型之间的空间,包括神经元、星形胶质细胞、少突胶质细胞和神经血管单元7。大脑 ECM 的概括已被证明会影响神经元形态和神经元放电,许多复杂的大脑 3D 模型已经证明了神经细胞类型8、9、10、11 对 ECM 蛋白的沉积。基于支架的模型由悬浮在多孔合成或生物水凝胶基质中的成熟神经共培养物组成,该基质代表大脑ECM12。与类器官和球状体系统不同,基于支架的 3D 模型允许定制存在的 ECM 蛋白,并具有水凝胶刚度可调性以模拟生物力学应力的额外好处13,14。
尽管绝大多数 3D 神经模型都表明大脑微环境的概括性增加,但并非所有模型都非常适合实现药物发现应用15。为了在工业流程中实现 3D 模型,系统必须满足筛选应用的吞吐量要求,并且开发时间相对较短16。3D 生物打印是一种新技术,它提供了创建基于 3D 支架的神经模型的潜力,具有快速的开发时间、更高的吞吐量和更高水平的精度控制,同时消除了人为错误引起的可变性17。该协议在水凝胶支架中呈现了人iPSC衍生的谷氨酸能神经元和星形胶质细胞的3D共培养模型。该水凝胶支架含有具有生理代表性的生物活性肽(RGD、IKVAV、YIGSR)和ECM蛋白,具有模拟的生物力学刚度。这些全长 ECM 蛋白包括全长层粘连蛋白-211 和透明质酸,在人体皮层中含量丰富,刚度为 1.1 kPa,符合 体内 测量值18。该模型专为药物发现而设计,使用96孔或384孔板格式的3D生物打印机创建,适用于使用细胞染料和抗体成像技术以及神经突生长测定进行筛选分析。细胞在培养后 7 天内显示神经细胞类型标志物的表达以及神经突和星形胶质细胞投射的生长。因此,该协议将介绍开发用于药物发现应用的高通量3D神经共培养模型的方法。
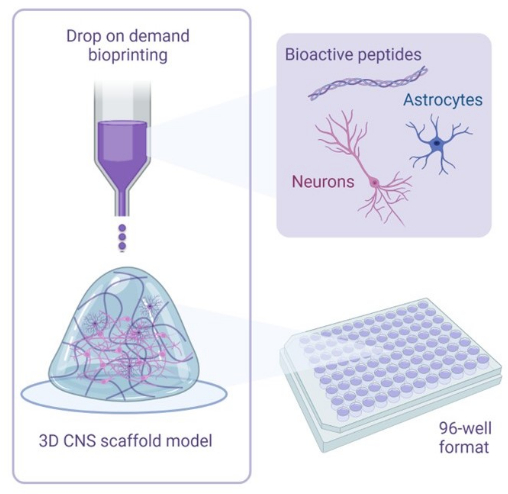
图 1:用于 3D 生物打印共培养的方法的说明性概述。 人 iPSC 衍生的神经元和星形胶质细胞与含有生物活性肽的激活剂和生物墨水溶液结合,并使用按需滴生物打印技术以 96 孔或 384 孔形式生物打印到水凝胶支架上。 请点击这里查看此图的较大版本.
研究方案
1. 3D模型的生物打印
- 生成板图和打印文件
- 在模型生成之前,使用板图软件生成板图、协议和打印文件。打开孔板图软件,然后选择 "3D 培养细胞 "选项。
- 从下拉菜单的可用选项中选择要生物打印的模型类型;该模型已在 成像模型 和 HTP 模型格式中进行了验证。为 96 孔板选择 成像模型 ,为 384 孔板选择 HTP 。
- 在" 基 质选择"窗口中,选择含有层粘连蛋白-211 和透明质酸蛋白的水 凝胶 Px02.53,以及 IKVAV、RGD 和 YIGSR 肽。
- 在弹出窗口中,输入细胞类型为 谷氨酸能神经元和星形胶 质细胞,并将细胞密度输入为 2000 万个细胞/mL。
- 使用该软件通过突出显示屏幕上的孔来设计所需的孔图。在设计中至少包括 1 行 塑料上的 2D 控制 。 塑料孔的 2D 控制 由直接沉积到孔中的细胞组成,没有任何水凝胶支架;按照步骤 1.2 涂覆这些孔。
- 确保将窗口顶部列出的板模型更改为预期的板模型以供使用(请参阅 材料表)。
- 使用下载按钮下载板图的方案和打印文件,并将其保存到生物打印机链接的计算机中。
- 在塑料孔上涂覆 2D 控制
- 打印前至少 24 小时,涂覆用于细胞粘附和生长的 2D 对照模型的孔。3D模型孔不需要任何预涂层。除非另有说明,否则所有过程均应在生物安全柜中进行。印版可以在印刷前 7 天进行涂布和制备。
- 用 47.5 mL 无菌 dH 2 O 稀释2.5mL 20x 硼酸盐储备溶液,制备 50 mL 1x 硼酸盐缓冲液。
- 将 100 μL 50% (w/v) 聚乙烯亚胺 (PEI) 加入 50 mL 1x 硼酸盐缓冲液中,以制备 0.1% (w/v) PEI 溶液,并通过 0.22 μm 过滤器进行无菌过滤器。
- 向每个 2D 对照孔中加入 0.1% (w/v) PEI 溶液,如步骤 1.1 中生成的板图所示。如果使用 96 孔板,则添加 100 μL/孔,如果使用 384 孔板,则添加 25 μL/孔。
- 在吸出0.1%(w / v)PEI溶液并用PBS冲洗孔5次之前,将板在37°C下孵育2小时。让孔在生物安全柜中完全干燥。
- 在 5 mL 神经基础培养基中稀释 100 μL 1 mg/mL 层粘连蛋白溶液。如果使用 96 孔板,则向每个 2D 对照孔中加入 100 μL,如果使用 384 孔板,则向每个 2D 对照孔中加入 25 μL。在37°C孵育4小时。
- 如果储存板,孵育后将层粘连蛋白溶液留在原位并储存在4°C。 使用前将板在37°C下预热1小时。
- 共培养模型的3D生物打印
- 使用生物打印机时,请始终保持无菌技术,并在放入打印机之前用 70% EtOH 擦拭手套、墨盒和培养板。除非另有说明,否则请在生物安全柜中执行生物打印机以外的所有过程。
- 打开生物打印机的压缩机,并通过选择生物打印机软件上的初始化按钮来 初始化 打印机。打印机中的气流开始后,用 70% EtOH 擦拭器擦拭打印机内部的表面。
- 在打印当天,进行引导 式"开始日绿灯 "流程,以确保打印运行的喷嘴状态正确(最小喷嘴状态 2A2B)。
- 从无菌包装中取出生物打印机墨盒,在隔室 A 中加入 20 mL 无菌 dH2O,并向隔室 B1-4 中加入 6 mL 无菌过滤的 70% EtOH。将墨盒插入生物打印机内的左侧墨盒支架中,然后将板盖放入专用的盖子支架中。
- 选择软件主屏幕上的 绿灯 按钮,并在软件上确认墨盒已在生物打印机内就位并且盖子已被取下。启动绿灯程序。
- 当软件提示时,确认左针或右针都看不到一致的滴水。随后,当软件提示时,确认 B7 和 B8 隔间中存在水。
- 在生物打印机完成自导绿灯步骤后,插入一个未包被的无菌 96 孔平底板(与用于生物打印共培养的包被板分开),并在软件提示时将该新板插入生物打印机的右侧板架部分。确保板架设置为 High Profile 板,并在开始下一步之前取下盖子并放入专用盖架中。
- 生物打印机将水滴沉积到96孔板的每个孔中。完成后,从生物打印机中放置板,并确认板的每个孔中都存在水滴。
- 处理用于绿灯的 96 孔板,并让生物打印机完成绿灯过程。完成后,软件将说明生物打印机的喷嘴状态,并确认生物打印机已准备好打印模型。将盖子放在打印墨盒上,然后将其取到生物安全柜中,以便进行后续步骤。
- 使用生物打印机软件,使用 Print Run 软件按钮将打印文件(在步骤1.1中生成)加载到软件中,然后打开打印方案pdf。
- 从-20°C检索生物墨水和活化剂液体,如打印方案pdf所示,并在室温(RT)下解冻40分钟。对于水凝胶基质 Px02.53,这将包括:1x 小瓶 F32、1x 小瓶 F3、1x 小瓶 F261、1x 小瓶 F299。不要在手或水浴中解冻生物墨水和活化剂液体。
- 将含有多西环素和 ROCK 抑制剂(完整培养基 + DOX/ROCKi)(参见步骤 2.2)的 50 mL 完全培养基置于室温中,同时将生物墨水和活化剂液解冻。
- 一旦生物墨水和活化剂解冻,按照生成的打印方案pdf的最后两页上的说明准备打印墨盒。绿灯打印机墨盒将重复用于模型打印阶段。
- 确保隔室 A1 中有 40 mL 的 dH2O,隔室 B1 和 B2 中有 8 mL 的 70% EtOH。向 C1 中加入 1.2 mL 活化剂 F32,向 C2 中加入 1.2 mL F3,向 C4 中加入 200 μL F261。
- 从培养箱中取出PEI和层压涂层板,并将其放入打印机内右侧板架隔间中。此时不要从孔中取出层粘连蛋白培养基溶液。确保板架隔间设置为 低调 Profile 板,并且盖子已取下并放入盖板架中。
- 将打印墨盒放入生物打印机中,确保盖子取下并放入支架中,然后通过选择生物打印机软件上的 "打印惰性底座 "按钮在软件上开始打印运行。
- 在惰性基座打印时,按照第 2 节中的说明从液氮储存中取出谷氨酸能神经元和星形胶质细胞的小瓶,解冻并重悬。
- 一旦细胞解冻,并将 8 mL 完全培养基 + DOX/ROCKi 分别添加到每种细胞类型中(如第 2 节),在室温下以 300 x g 离心细胞 5 分钟。
- 吸出上清液,并将两种细胞类型分别重悬于1 mL完全培养基+DOX / ROCKi中。
- 将 20 μL 细胞悬液加入 20 μL 台盼蓝中,并在计数细胞之前混合,以确定每种细胞类型每 mL 的活细胞浓度。
- 将总共 300 万个谷氨酸能神经元与 100 万个星形胶质细胞结合在一个 15 mL 的试管中。添加培养基,总体积为 8 mL。
- 在室温下以300× g 离心细胞5分钟。
- 在不干扰细胞沉淀的情况下吸出尽可能多的上清液,并将细胞沉淀重悬于200μL活化液F299中。
- 请注意,活化剂液是粘稠的;上下移液以完全重悬沉淀。细胞类型很脆弱;通过使用宽口径移液器吸头和反向移液技术,最大限度地减少剪切和气泡。用力上下移液不超过 3 次,以防止细胞丢失。
- 惰性基础载物台完成打印后,将盖子放在墨盒和培养板上,从生物打印机中取出并放入生物安全柜中。
- 将 F299 中的 200 μL 细胞悬浮液加入打印墨盒的孔 C3 中,将墨盒重新插入生物打印机,取下盖子,然后将其放入盖架中。不要重新插入培养板。
- 启动打印运行的 "打印模型 "阶段。当生物打印机启动流体时,从板的 2D 对照孔中取出层粘连蛋白培养基溶液,如果使用 96 孔板,则在每个 2D 对照孔中用 150 μL 完全培养基 +DOX/ROCKi 替换,如果使用 384 孔板,则用 50 μL 完全培养基 +DOX/ROCKi 替换。
- 液体灌注后,将生物打印靶向板插入生物打印机,取下盖子,然后将其放入盖架中。
- 开始生物打印机靶向过程。
- 当生物打印软件提示时,从生物打印机上取下靶向板。
- 使用指南选择可以在板上观察到液滴的位置。将靶向板重新插入生物打印机中,并重复液滴打印和选择过程。
- 出现提示时,再次取下靶向板,然后用细胞培养板(根据步骤1.3.25在2D对照孔中含有培养基)替换。确保培养板盖已关闭并放入支架中。生物打印机将完成模型打印。
- 模型打印完成后,按照第 2 节(步骤 2.8)中的细胞培养方法将培养基添加到孔中。
- 开始生物打印机清洁过程,完成后,根据实验室方案处理墨盒和剩余液体。
2. 细胞培养
- 使用 1x 小瓶谷氨酸能神经元(每瓶 >500 万个细胞)和 1x 小瓶星形胶质细胞(每小瓶 >100 万个细胞)生成模型。
- 将水浴预热至37°C。
- 将两瓶细胞在干冰上运送到实验室,并在从干冰中取出后立即浸入水浴中。同时解冻两个小瓶。
- 当只剩下小冰晶时,从水浴中取出小瓶;浸泡后大约需要 3 分钟。不要在水浴中旋转或混合细胞。
- 用 70% EtOH 喷洒小瓶并将它们转移到生物安全柜中。
- 将 500 μL 完全培养基 +DOX/ROCKi 滴加到每个小瓶中,然后将每个悬浮液转移到单独的 15 mL 管中。
- 将每个试管中的培养基加满至 8 mL,并按照步骤 1.3 进行生物打印步骤。
- 按照生物打印模型(步骤1.3),立即将完整的培养基+ DOX / ROCKi添加到所有3D共培养孔中,并将模型置于37 °C和5%CO2的培养箱中。如果使用 96 孔板,则每孔加入 150 μL 培养基;如果使用 384 孔板,则每孔使用 50 μL 培养基。
- 培养的前 48 小时不需要更换培养基。
- 在对 2D 对照和模型进行培养基更换时,应注意防止引起机械应力,这可能会使 2D 培养物分离或导致水凝胶变形。使用指向孔侧的微量移液管缓慢进行培养基抽吸和添加。
- 48小时后,对所有孔进行90%的培养基更换,并从培养基组合物中除去ROCKi(参见步骤2.14)。
- 96小时后,在所有孔上再进行90%的培养基更换,以从培养基组合物中去除DOX(参见步骤2.14)。
- 在 48 小时和 96 小时两次 90% 介质更换后,每 48 小时进行一次 50% 的介质更换,其中 50% 的介质被吸出并更换为新鲜的完整介质
- 媒体组成:
- 完整培养基:含有 1x GlutaMAX、1x B27、12.5 nM 2-巯基乙醇、10 ng/mL NT3、5 ng/μL BDNF 的 Neurobasal 培养基。
- 完整培养基加多西环素 (DOX):含有 1x GlutaMAX、1x B27、12.5 nM 2-巯基乙醇、10 ng/mL 神经营养因子-3 (NT3)、5 ng/μL 脑源性神经营养因子 (BDNF) 和 1 μg/mL 多西环素的神经基础培养基。
- 完整培养基加 DOX/ROCK 抑制剂 (ROCKi):含有 1x GlutaMAX、1x B27、12.5 nM 2-巯基乙醇、10 ng/mL NT3、5 ng/μL BDNF、1 μg/mL 多西环素和 10 μM ROCK 抑制剂的神经基础培养基。
3. 神经突生长分析
- 在生物打印后立即将细胞置于活细胞显微镜中进行明场成像。
- 使用显微镜软件安排每 12 小时在每个孔中以 4 倍放大倍率成像的细胞,包括 2D 对照,至少持续 7 天。
- 如第2节所述,每48小时更换一次培养基,每次更换培养基后将细胞放回显微镜中。
- 数据 7 天后,以.jpg格式从软件中导出图像
- 将所有.jpg图像导入 ImageJ 软件并将文件转换为 8 位格式。加载 NeuronJ 插件并使用跟踪工具跟踪图像(包括分支点)中的神经突生长。
- 使用从 NeuronJ 生成的神经突追踪数据绘制神经突随时间推移的生长情况。
4. 细胞活力分析
- 在培养的每个 24 小时时间点,使用活/死活力试剂盒对 3 个或更多孔进行染色以进行细胞活力分析。在研究期间在24小时或48小时时间点重复此步骤。
- 通过在成像前 30 分钟将活细胞试剂 (1x 钙黄绿素-AM) 和死细胞试剂 (1x 乙锭同型二聚体-1) 和 1x 活细胞核染色剂 (Hoechst 33342) 悬浮在 10 mL 不含酚红的还原血清培养基 (Opti-MEM) 中来制备活/死试剂培养基。让活/死试剂培养基进入室温。 由于荧光漂白,将活/死试剂培养基储存在避光直射的地方。
- 从含有细胞模型/2D 对照的 3 个孔中取出培养基,小心防止凝胶干扰。用RT无菌PBS洗涤细胞模型一次。对于96孔板,向每个孔中加入100 μL活/死试剂培养基,对于384孔板,向每个孔中加入25 μL。
- 将模型在37°C和5%CO 2下孵育30分钟。
- 孵育后,模型即可进行成像。在任何具有红色(647 nm,死细胞)、绿色(488 nm,活细胞)和蓝色(405 nm,核染色)激发通道的标准显微镜上进行成像。为了在3D模型中获得最佳效果,请使用高内涵共聚焦显微镜对模型进行成像,并使用Z-stack功能以4倍或10倍放大倍率进行成像。
注:在本研究中,使用 INCell Analyzer 6500HS(高内涵成像系统)对细胞模型进行成像,并使用 Signals Image Artist(图像分析平台,参见步骤 4.7)进行分析。 - 成像完成后,将细胞模型返回到37°C和5%CO 2的细胞培养箱中。 然而,由于活/死试剂培养基对长期活力的影响,因此在进一步研究中省略了用于活力分析的细胞模型。
- 在图像分析平台上分析图像
- 在软件中选择 Z-stack 映像的每个平面。将平面图像合并为最大强度投影图像。
- 通过识别 488 nm 处活细胞通道的荧光,选择生物打印模型作为感兴趣区域 (ROI) 来创建新的分析(确保在 ROI 下选择所有细胞)。
- 在感兴趣的区域内,使用成像软件通过核染色通道 (405 nm) 识别 ROI 中的细胞数量,使用 488 nm 通道识别 ROI 中的活细胞数量,以及使用 647 nm 通道识别 ROI 中的死细胞数量。
- 对所有活/死处理的细胞模型孔运行分析,并导出包含 ROI 面积、总细胞数、活细胞数和死细胞数的数据表。
- 计算活细胞和死细胞的数量占每个分析日细胞总数的百分比。
5. 免疫染色和细胞群分析
- 固定前,从细胞模型中取出培养基,并在PBS中洗涤模型一次。
- 在室温下用4%(v / v)多聚甲醛在PBS中固定细胞20分钟。
注意:所有使用多聚甲醛的工作都必须按照实验室程序进行。 - 从模型中吸出4%(v / v)多聚甲醛溶液,并在PBS中洗涤模型四次,以完全去除多聚甲醛。
- 在室温下用0.2%triton-X透化细胞模型30分钟,并用PBS洗涤3次。
- 在室温下使用10%(v / v)正常驴血清(NDS)封闭细胞模型3小时。
- 取出封闭溶液,并向模型中加入一抗(在PBS中以1%v / v NDS稀释)。如果进行细胞群比分析(参见步骤5.11),请确保包括对Β-III微管蛋白(具有红色AF647偶联物)和GFAP(具有绿色AF488偶联物)进行共染色的细胞模型。将模型与一抗在4°C下孵育24小时。
- 初次孵育后,在PBS中洗涤用偶联的一抗染色的模型3次,并用20μMHoechst复染30分钟。如步骤 5.10 中详述的图像。
- 在PBS中洗涤用非偶联一抗染色的模型三次,并加入二抗(在PBS中用1%v / v NDS稀释)。在4°C孵育24小时。
- 通过在PBS中洗涤三次除去二抗,并在成像前用20μM Hoechst对模型进行复染30分钟。
- 在具有红色 (647 nm) 和绿色 (488 nm) 激发通道的标准显微镜上进行成像。然而,为了在3D模型中获得最佳效果,请使用高内涵共聚焦显微镜对模型进行成像,并使用Z-stack功能以4倍或10倍放大倍率进行成像。
- 在图像分析平台上分析细胞群比率
- 使用GFAP(AF488偶联)和Β-III微管蛋白(AF647偶联)共染色的模型对细胞群进行分析。
- 在软件中选择Z-stack图像的每个平面,并将平面图像组合为最大强度投影图像。
- 通过识别 647 nm 处 Β-III 微管蛋白通道的荧光,选择生物打印模型作为 ROI(确保在 ROI 下选择所有含有细胞的区域),从而创建新的分析。
- 在 ROI 中,使用软件识别 Hoechst 通道 (405 nm) 中的细胞数量、使用 488 nm 通道的 ROI 中 GFAP+ 星形胶质细胞的数量,以及使用 647 nm 通道识别 ROI 中 Β-III 微管蛋白+ 细胞的数量。
- 在所有共染色的细胞模型孔上运行分析,并导出包含 ROI 面积、总细胞数、GFAP+ 细胞数和 Β-III 微管蛋白+ 细胞数的数据表。
- 计算GFAP +和Β-III微管蛋白+细胞的数量占总细胞数的百分比。
结果
神经突生长分析
在该协议中,使用3D生物打印机将iPSC衍生的谷氨酸能神经元和星形胶质细胞在共培养物中生物打印到水凝胶基质中。在打印后的前 7 天内,使用活细胞显微镜每 12 小时对细胞进行一次成像。生物打印后,细胞应具有圆形形态,并应分散在整个水凝胶基质中,在培养的最初几天逐渐改变以形成较小的细胞簇,几乎没有突起(参见 补充视频1 ,了解具有代表性的健康细胞生长)。到第 4 天,健康细胞将在整个凝胶中迁移以形成更大的簇,这些簇通过神经突生长连接。到第 7 天,几乎没有单个细胞应保留,神经突和星形胶质细胞突起的互连束应显得强化,并且可以看到从簇中形成许多较小的神经突生长(图 2A)。使用在 7 天生长期拍摄的一系列活细胞明场图像,对神经突生长进行分析,详见第 3 节。该分析表明,神经突生长在 12 小时和 156 小时之间以近乎线性的方式增加(R2 值 = 0.84)(图 2B)。在神经突生长的这段时间里,细胞体簇的大小也会增加(见 补充视频1),这表明细胞在整个水凝胶中迁移。
细胞活力和群体比率
在该协议中,浓度为2000万个细胞/ mL,包括1500万个神经元/ mL和500万个星形胶质细胞/ mL,用于细胞模型的生物打印。使用钙黄绿素-AM(活细胞)、乙锭同型二聚体-1(死细胞)和核染色剂进行活细胞染色,可以根据第4节计算7天内存活的细胞数(图3A)。第 4 天显示了代表性培养物的细胞活力结果,其中 72% ± 1%(平均 ± SEM)的总细胞是活的,并显示钙黄绿素-AM 染色,而 29% ± 2%(平均 ± SEM)的总细胞死亡并显示用乙锭同型二聚体-1 染色(图 3B)。钙黄绿素-AM和乙锭同源二聚体-1细胞染色的代表性图像可在 补充图1中看到。 应该注意的是,3D培养物的细胞存活值不能直接与2D培养物进行比较,因为死细胞保留在水凝胶中,在细胞喂养过程中不会被去除。
如第5节和图 4所述,使用β-III微管蛋白和GFAP的免疫荧光染色,可以进行图像分析以确定神经元和星形胶质细胞之间的细胞群比率(图3A)。在代表性培养物中每个模型的总细胞中,β-III 微管蛋白阳性神经元占 49% ± 3%(平均 ± SEM),而 GFAP 阳性星形胶质细胞占 30% ± 4%(平均 ± SEM)。这给出了星形胶质细胞与神经元的比例分别为 1:1.5。这样,每个模型还剩下 21% 的总细胞,这些细胞不会对任何细胞标志物进行染色。由于细胞活力分析表明,平均值为 29% 的细胞在第 4 天无法存活,因此这些细胞很可能在水凝胶内死亡。
细胞标志物的表达
通过神经元细胞类型标志物(Β-III微管蛋白)和星形胶质细胞标志物(GFAP)的免疫染色来评估生物打印神经元和星形胶质细胞的形态。在所示的代表性培养物中,免疫染色定位于单个细胞类型,显示出健康的细胞形态,两种细胞类型都表现出细胞突起的生长(图4A,B)。由于水凝胶和细胞结构是三维的,因此每个图像仅代表图4A,B中结构的一个切片。图 4C 显示了整个水凝胶中合并的图像堆栈,展示了 X、Y 和 Z 平面中细胞定位的视图。图4D仅显示β-III微管蛋白的免疫染色;突出显示细胞体簇中更精细的神经突生长。为了进一步检查谷氨酸能神经元的表型,可以对谷氨酸能离子受体标志物 GluR2 进行免疫染色。在图 4E 中,区域 4E.1(插图)被突出显示,以显示沿神经突束的更高分辨率点状染色。因此,这证实了这种共培养物中的神经元具有谷氨酸能表型。在所有免疫染色图像中,可以在细胞簇和神经突周围观察到免疫荧光染色的非细胞结构。这些结构很可能代表保留在水凝胶内的碎片,以及与水凝胶结合的少量非特异性抗体。这在生物打印培养物中是预期的,因为在 3D 支架模型中,死细胞和碎片在细胞喂养过程中不会被去除。补充图2显示了具有代表性的阴性对照免疫染色图像,用于证明二抗的水凝胶非特异性结合。
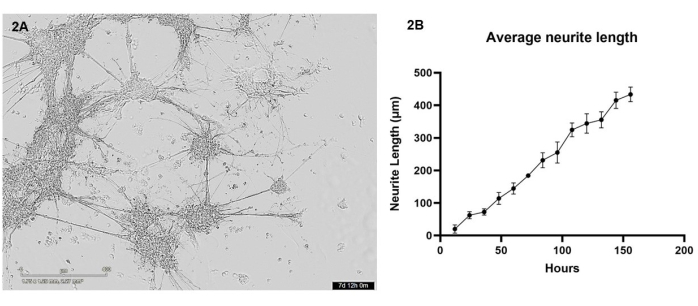
图 2:使用生物打印机将谷氨酸能神经元和星形胶质细胞生物打印到水凝胶基质中,并使用明场显微镜每 12 小时成像一次 。 (A) 分析过程中拍摄的细胞培养物明场图像示例。图像表示时间点 156 h,比例尺表示 400 μm。 (B) 使用 ImageJ 的 NeuronJ 包测量的培养物中神经突生长的平均长度 (μm)。每个数据点是 n = 3 个神经突,数据显示为平均值± SEM。 请点击这里查看此图的较大版本.
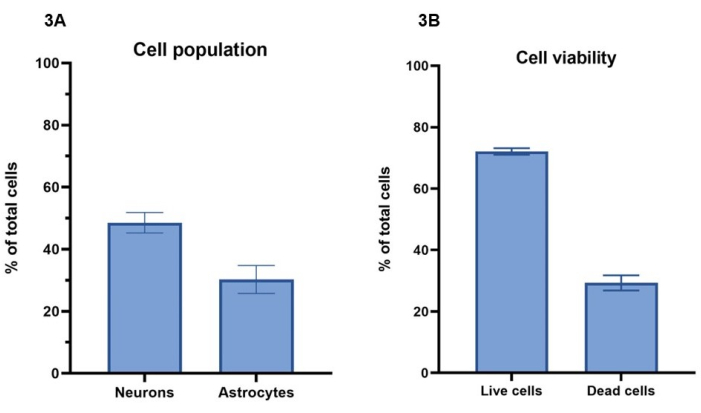
图 3:使用 2000 万个细胞/mL 浓度的活化剂溶液对细胞模型进行生物打印 。 (A) 使用活/死细胞染料(分别为 Calcein-AM 和 ethylidium homodimer-1)计算细胞活力。值显示,在第 4 天,每孔总细胞群的 72% ± 1%(平均 ± SEM,n = 3)是活的,29% ± 2%(平均 ± SEM,n = 3)的细胞是死亡的。所示值代表平均± SEM。 (B) 通过 图 4 所示的染色图像分析计算每孔神经元和星形胶质细胞的细胞群百分比。神经元代表第 7 天 β-III 微管蛋白染色阳性的细胞百分比(49% ± 3%,SEM ±平均值,n = 3),而星形胶质细胞代表第 7 天 GFAP 染色阳性的细胞百分比(30% ± 4%,SEM ±平均值,n = 3)。所示值代表 SEM 的平均值±。 图3 所示的所有成像都是在共聚焦成像系统上进行的,所有分析都是在图像分析平台和GraphPad Prism上进行的。 请点击这里查看此图的较大版本.
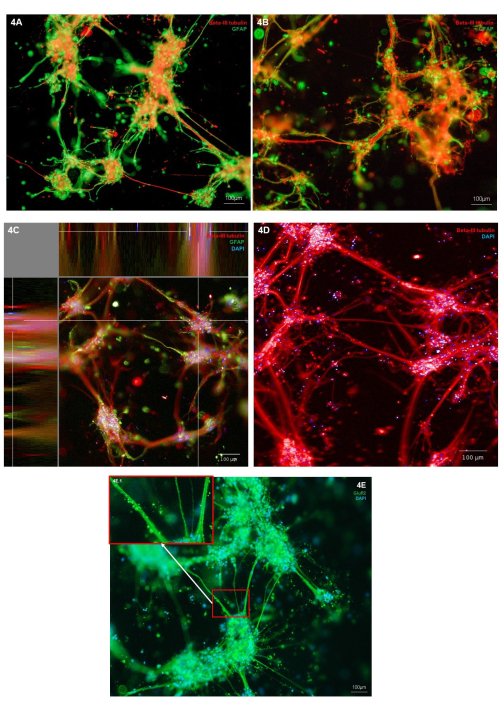
图 4:第 7 天谷氨酸能神经元和星形胶质细胞的 3D 生物打印共培养物中神经细胞类型标记 物的表达。 (A,B) 神经元标志物 β-III 微管蛋白和星形胶质细胞标志物 GFAP 的免疫荧光染色,在倒置显微镜平台上以 10 倍放大倍率成像。比例尺代表 100 μm。 (C) 与 Hoechst 共染的神经元标志物 β-III 微管蛋白和星形胶质细胞标志物 GFAP 的免疫荧光染色,显示在 XYZ 平面图中,在共聚焦成像系统上以 10 倍放大倍率成像。在图像分析平台上创建。比例尺代表 100 μm。 (D) 与 Hoechst 共染色的神经元标志物 β-III 微管蛋白的免疫荧光染色,在共聚焦成像系统上以 20 倍放大倍率成像。比例尺代表 100 μm。 (E) 与 Hoechst 共染色的谷氨酸能标志物 GluR2 的免疫荧光染色,在倒置显微镜平台上以 10 倍放大倍率成像。方框 3E.1 显示了 GluR2 染色的突出区域。比例尺表示 100 μm。 请点击这里查看此图的较大版本.
补充视频1: 使用生物打印机将谷氨酸能神经元和星形胶质细胞生物打印到水凝胶基质中,并使用明场显微镜每 12 小时成像一次。分析过程中拍摄的细胞培养物明场图像视频,时间点表示在右下角,比例尺表示 400 μm。 请点击这里下载此文件。
补充图1:第4天生物打印神经元和星形胶质细胞的活/死分析示例图像。 钙黄绿素-AM染料以绿色(488 nm)显示,乙锭同型二聚体染色以红色(647 nm)显示。图像以 XYZ 平面视图显示,在图像分析平台上创建。比例尺代表 100 μm。 (A) 使用共聚焦成像系统在 4 倍放大倍率下进行成像。(B) 使用共聚焦成像系统以 10 倍放大倍率进行成像 请点击这里下载此文件。
补充图2:免疫荧光染色后的阴性对照图像示例。 省略一抗,按照免疫染色方案使用绿色 (488 nm) 和红色 (647 nm) 二抗。图像以 XYZ 平面视图显示,该视图是在图像分析平台上创建的。比例尺代表 100 μm。使用共聚焦成像系统在 10 倍放大倍率下进行成像。 请点击这里下载此文件。
讨论
对中枢神经系统准确模型的需求从未如此之高,而二维(2D)传统细胞培养模型的局限性近年来推动了一代复杂的中枢神经系统模型的出现19。然而,许多代表神经细胞类型和 ECM 之间相互作用的复杂 3D 模型具有局限性,这些模型会阻止这些模型在工业过程中的应用 6,20,21。在该协议中,我们开发了人类 iPSC 衍生神经元和星形胶质细胞的 3D 共培养模型,旨在使用 3D 生物打印技术解决其中一些限制,以创建 96 孔和 384 孔格式的生物活性水凝胶支架。
通过板图设计软件、自动生成的打印方案和生物打印机的引导打印过程,简化了开发这些模型的方法。然而,由于本方案中使用的敏感iPSC衍生细胞类型的敏感性,在解冻和培养时应注意以下关键步骤。首先,ROCK抑制剂(ROCKi)的加入在整个生物打印过程和早期培养过程中有几个好处。细胞解冻是神经元可能经历应激反应的关键点,不当的解冻方案会降低生存的机会22.通常建议尽可能高效地解冻细胞、添加培养基并将细胞升温至培养箱温度23。然而,在本协议中描述的生物打印过程中,有必要将神经元和星形胶质细胞重悬于激活剂溶液而不是培养基中,并且细胞不会升至室温以上,直到打印运行结束(解冻后最多30分钟)。因此,在解冻后立即将ROCKi添加到培养基中,并在两个离心步骤(步骤2.1--2.7和1.3.15-1.3.20)中加入ROCKi对于抑制细胞应激途径是必不可少的,这将导致较低的活力水平24。此外,ROCKi 已被证明可以促进神经突生长并改善神经元成熟25。因此,ROCKi补充剂在生物打印后持续48小时。然而,必须在 48 小时后去除 ROCKi 补充剂,以确保在细胞用于测定之前在随后的培养基更换期间完全洗掉。
需要重点关注的下一个步骤是在印后介质添加和介质更换期间(步骤 2.8-2.13)。生物打印水凝胶支架的等效生物力学刚度仅为 1.1 kPa,相当于灰质。如步骤2.10所述,在添加培养基和抽吸过程中,必须轻轻地将移液液管移入孔的侧面,以防止干扰。这与 384 孔板特别相关,其中凝胶水平在总孔体积中占较高比例。这种方法也应用于 2D 对照孔,以防止细胞的边缘抬起和神经突生长的剪切。作者还想强调生物打印机中无菌技术的重要性,应与用于iPSC来源的细胞培养的生物安全柜一样谨慎对待。这包括对绿灯和打印程序中使用的 70% EtOH 和 dH2O 进行无菌过滤,在将手移入和移出生物打印机时将盖子放在墨盒和印版上,以及在打印前后用 70% 乙醇湿巾对生物打印机内部的表面进行净化。
选择用于开发该模型的生物打印水凝胶支架由生物墨水和活化剂溶液组成,选自Inventia Life Science开发的一系列生物墨水和活化剂溶液,用于RASTRUM生物打印机。层粘连蛋白和透明质酸被确定为与 iPSC 衍生的神经元成熟相关的分子,因为它们在轴突引导、突触形成和神经元周围网络的形成中起作用26,27。此外,选择了 1.1 kPa 的生物力学刚度,因为低密度水凝胶已被证明能够更好地从神经元中生长神经突12。如果通过使用内部或从其他商业供应商处分化的神经元和星形胶质细胞对方案进行修改,则建议进行基质选择测试以确定最具支持性的水凝胶支架15。此外,如果改变细胞来源以确保最佳活力并防止水凝胶过度拥挤,则可能还需要优化细胞密度。对于与生物打印机功能相关的所有修改和故障排除,作者建议联系制造商并参考制造商协议。
中枢神经系统包含广泛的神经元亚型和神经胶质细胞,所有这些亚型和神经胶质细胞都存在于不同的大脑生态位中,并具有促进神经功能的特定作用28。在这个广泛范围的背景下,该模型仅代表两种最丰富的细胞类型(星形胶质细胞和兴奋性谷氨酸能神经元)。重要的细胞类型,如小胶质细胞、少突胶质细胞和血脑屏障形成的内皮细胞,从该系统中被省略。小胶质细胞的纳入可能与神经免疫相互作用有关,而少突胶质细胞可能与影响中枢髓鞘形成的疾病有关。除了它们在病理学中的作用外,血脑屏障形成内皮细胞等细胞还排泄药物代谢酶,这可能会影响该模型在药代动力学测定中的使用29。该模型的另一个局限性可能是星形胶质细胞与神经元的比例;星形胶质细胞与神经元的比例在大脑区域之间差异很大,建议值在 1:1 和 1:3 之间30,31。该模型的星形胶质细胞与神经元的比例约为 1:1.5;因此,该模型可能与星形胶质细胞更丰富的大脑区域(例如白质区域30)的模型无关。
近年来,已经发表了开发3D生物打印共培养模型的其他协议。Sullivan 等人于 2021 年发表的一篇论文介绍了使用 iPSC 衍生的神经祖细胞的 3D 生物打印神经模型,与 2D 培养相比,该模型表现出高打印后活力和神经元功能增强32。然而,在该方案中,神经祖细胞被用作细胞来源,并在培养物中维持4周。在该方案中,使用了市售的iPSC衍生的谷氨酸能神经元和星形胶质细胞。这允许在短短 7 天内建立共培养细胞的 3D 网络;正如神经突生长分析所证明的那样,神经突生长在 24 小时内开始,并在监测细胞生长的 156 小时内以线性方式继续。这些网络的快速建立可以部分归因于谷氨酸能神经元的使用,这些神经元使用优化的多西环素诱导的 NGN2 基因表达,即使在 2D 培养中,其在 7 天内也显示出成熟神经元亚型标志物的表达33。使用该技术缩短该生长期对于在生物制药行业内实施模型非常重要,因为检测开发需要快速周转和细胞模型的开发15。
总之,该模型显示了神经元和星形胶质细胞的 3D 模型的潜力,该模型可以快速方便地建立用于筛选目的。这种模型类型的未来应用可能是针对不同中枢神经系统疾病的药物发现工作,并有机会使用患者或基因编辑的疾病iPSC系扩展到不同的疾病。此外,使用多西环素诱导的 NGN2 表达 iPSC 衍生的谷氨酸能神经元可使细胞在更短的时间内达到成熟,这可用于开发用于神经退行性疾病研究的衰老大脑模型。该系统还可以通过在共培养中使用其他细胞类型来扩增,包括小胶质细胞和少突胶质细胞。
披露声明
CW、NC 和 JB 是位于英国伦敦的 Merck Sharp & Dohme (UK) Limited 的员工。YH是Merck Sharp & Dohme LLC的员工,该公司是Merck & Co., Inc.的子公司,位于美国新泽西州拉威。
图 1 是使用 Biorender.com 创建的。
致谢
作者感谢 Alex Volkerling、Martin Engel 和 Rachel Bleach 在制定协议和对手稿的反馈方面提供的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Thermofisher | 31350010 | |
| 384-well plate | PerkinElmer | 6057300 | |
| 96-well plate | PerkinElmer | 6055300 | |
| Activator fluid F299 | Inventia Life Science | N/A | |
| Activator fluid F3 | Inventia Life Science | N/A | |
| B27 (50x) minus Vit A | Thermofisher | 12587010 | |
| Bioink fluid F261 | Inventia Life Science | N/A | |
| Bioink fluid F32 | Inventia Life Science | N/A | |
| Doxycycline hyclate | Sigma Aldrich | D5207 | |
| GlutaMAX (100x) | Thermofisher | 35050061 | |
| Goat anti-mouse IgG H&L Alexa Fluor 647 | Abcam | ab150115 | |
| Goat anti-rabbit IgG H&L Alexa Fluor 488 | Abcam | ab150077 | |
| Hoechst | Abcam | ab228551 | |
| Human BDNF Recombinant Protein | Thermofisher | PHC7074 | |
| Human NT3 Recombinant Protein | Thermofisher | PHC7036 | |
| iCell Astrocytes | Fujifilm CDI | 1434 | |
| INCell Analyser 6500HS | Molecular Devices | N/A | high content imaging system |
| Incucyte S3 | Sartorius | N/A | |
| ioGlutamatergic Neurons (Large vial) | Bit.bio | e001 | |
| Laminin (1 mg/mL) | Sigma Aldrich | L2020 | |
| Live/dead kit (Calcein-AM, Ethidium homo-dimer-1) | Invitrogen | L3224 | |
| Mouse anti-BIII tubulin NL637 conjugated | R&D systems | SC024 | |
| Neurobasal media | Thermofisher | 21103049 | |
| Normal Donkey Serum | Abcam | ab7475 | |
| NucBlue Live (Hoechst 33342) | Thermofisher | R37605 | |
| Opti-MEM | Thermofisher | 11058021 | |
| Paraformaldehyde | Sigma Aldrich | P6148 | |
| PEI 50% in H2O | Sigma Aldrich | 181978 | |
| Pierce Borate Buffer 20x | Thermofisher | 28341 | |
| Prism | GraphPad | Data analysis software | |
| Rabbit anti-ionotropic glutamatre receptor 2 (GluR2) | Abcam | ab206293 | |
| RASTRUM(TM) Bioprinter | Inventia Life Science | N/A | Bioprinter |
| RASTRUM(TM) Bioprinter Cartridges | Inventia Life Science | N/A | Bioprinter Cartridges |
| RASTRUM(TM) Targeting plate | Inventia Life Science | N/A | Targeting plate |
| Rho kinase (ROCK) inhibitor | Abcam | ab120129 | |
| Sheep anti-GFAP NL493 conjugated | R&D systems | SC024 | |
| Signals Image Artist | PerkinElmer | N/A | Image analysis platform |
| Triton X-100 | Thermofisher | HFH10 | |
| Zeiss Axio Observer | Zeiss | N/A | Inverted microscope platform |
参考文献
- Jung, Y. L., Hwang, J., Yoo, H. S. Disease burden metrics the innovations of leading pharmaceutical companies: a global and regional comparative study. Globalization and Health. 16 (1), 80-80 (2020).
- Potkin, S. G., et al. The neurobiology of treatment-resistant schizophrenia: paths to antipsychotic resistance and a roadmap for future research. npj Schizophrenia. 6, 1(2020).
- Keswani, C., et al. The Global Economic Impact of Neurodegenerative Diseases: Opportunities and Challenges. Bioeconomy for Sustainable Development. , Springer, Singapore. (2019).
- Perucca, E. The pharmacological treatment of epilepsy: recent advances and future perspectives. Acta Epileptologica. 3 (1), 22(2021).
- Nikolakopoulou, P., et al. Recent progress in translational engineered in vitro models of the central nervous system. Brain. 143 (11), 3181-3213 (2020).
- Whitehouse, C., Corbett, N., Brownlees, J. 3D models of neurodegeneration: implementation in drug discovery. Trends in Pharmacological Sciences. 44 (4), 208-221 (2023).
- Rauti, R., Renous, N., Maoz, B. M. Mimicking the brain extracellular matrix in vitro: A review of current methodologies and challenges. Israel Journal of Chemistry. 60 (12), 1141-1151 (2020).
- Fawcett, J. W., Oohashi, T., Pizzorusso, T. The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature Reviews Neuroscience. 20 (8), 451-465 (2019).
- Lam, D., et al. Tissue-specific extracellular matrix accelerates the formation of neural networks and communities in a neuron-glia co-culture on a multi-electrode array. Scientific Reports. 9, 4159(2019).
- Roll, L., Lessmann, K., Brüstle, O., Faissner, A. Cerebral organoids maintain the expression of neural stem cell-associated glycoepitopes and extracellular matrix. Cells. 11 (5), 760(2022).
- Yan, Y., Bejoy, J., Marzano, M., Li, Y. The use of pluripotent stem cell-derived organoids to study extracellular matrix development during neural degeneration. Cells. 8 (3), 242(2019).
- Ma, L., et al. 3D bioprinted hyaluronic acid-based cell-laden scaffold for brain microenvironment simulation. Bio-Design and Manufacturing. 3 (3), 164-174 (2020).
- Liaw, C. -Y., Ji, S., Guvendiren, M. Engineering 3D hydrogels for personalized in vitro human tissue models. Advanced Healthcare Materials. 7 (4), 1701165(2018).
- Ma, J., Huang, C. Composition and mechanism of three-dimensional hydrogel system in regulating stem cell fate. Tissue Engineering Part B: Reviews. 26 (6), 498-518 (2020).
- Belfiore, L., et al. Generation and analysis of 3D cell culture models for drug discovery. European Journal of Pharmaceutical Sciences. 163, 105876(2021).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Engel, M., Belfiore, L., Aghaei, B., Sutija, M. Enabling high throughput drug discovery in 3D cell cultures through a novel bioprinting workflow. SLAS Technology. 27 (1), 32-38 (2022).
- Takamura, T., et al. Influence of age on global and regional brain stiffness in young and middle-aged adults. Journal of Magnetic Resonance Imaging. 51 (3), 727-733 (2020).
- Slanzi, A., Iannoto, G., Rossi, B., Zenaro, E., Constantin, G. In vitro models of neurodegenerative diseases. Frontiers in Cell and Developmental Biology. 8, 328(2020).
- de Souza, N. Organoid variability examined. Nature Methods. 14 (7), 655-655 (2017).
- Hernández, D., et al. Culture variabilities of human iPSC-derived cerebral organoids are a major issue for the modelling of phenotypes observed in Alzheimer's disease. Stem Cell Review and Reports. 18 (2), 718-731 (2022).
- Li, R., et al. Differentiation of human iPS cells into sensory neurons exhibits developmental stage-specific cryopreservation challenges. Frontiers in Cell and Developmental Biology. 9, 796960(2021).
- Nishiyama, Y., et al. Safe and efficient method for cryopreservation of human induced pluripotent stem cell-derived neural stem and progenitor cells by a programmed freezer with a magnetic field. Neuroscience Research. 107, 20-29 (2016).
- Uhrig, M., Ezquer, F., Ezquer, M. Improving cell recovery: Freezing and thawing optimization of induced pluripotent stem cells. Cells. 11 (5), 799(2022).
- Harbom, L. J., et al. The effect of rho kinase inhibition on morphological and electrophysiological maturity in iPSC-derived neurons. Cell and Tissue Research. 375 (3), 641-654 (2019).
- Koh, H. S., Yong, T., Chan, C. K., Ramakrishna, S. Enhancement of neurite outgrowth using nano-structured scaffolds coupled with laminin. Biomaterials. 29 (26), 3574-3582 (2008).
- Tarus, D., et al. Design of hyaluronic acid hydrogels to promote neurite outgrowth in three dimensions. ACS Applied Materials & Interfaces. 8 (38), 25051-25059 (2016).
- Brain Initiative Cell Census Network (BICCN). Initiative Cell Census Network (BICCN). A multimodal cell census and atlas of the mammalian primary motor cortex. Nature. 598 (7879), 86-102 (2021).
- Dauchy, S., et al. Expression and transcriptional regulation of ABC transporters and cytochromes P450 in hCMEC/D3 human cerebral microvascular endothelial cells. Biochemical Pharmacology. 77 (5), 897-909 (2009).
- Herculano-Houzel, S. The glia/neuron ratio: How it varies uniformly across brain structures and species and what that means for brain physiology and evolution. Glia. 62 (9), 1377-1391 (2014).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Sullivan, M. A., et al. 3D bioprinting of stem cell-derived central nervous system cells enables astrocyte growth, vasculogenesis and enhances neural differentiation/function. bioRxiv. , (2022).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).
Erratum
Formal Correction: Erratum: Three-Dimensional Bioprinting of Human iPSC-Derived Neuron-Astrocyte Cocultures for Screening Applications
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for: Three-Dimensional Bioprinting of Human iPSC-Derived Neuron-Astrocyte Cocultures for Screening Applications. The Authors section was updated from:
Chloe Ann Whitehouse1
Yufang He2
Janet Brownlees1
Nicola Corbett1
1MSD R&D Innovation Centre Ltd
2Merck & Co., Inc.
to:
Chloe Ann Whitehouse1
Yufang He2
Janet Brownlees1
Nicola Corbett1
1MSD Research Laboratories, London, UK
2Merck & Co., Inc., Rahway, NJ, USA
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。