Method Article
스크리닝 응용 분야를 위한 인간 iPSC 유래 뉴런-성상세포 공동 배양의 3차원 바이오프린팅
Erratum Notice
요약
여기서는 iPSC 유래 뉴런 및 성상세포의 3D 바이오프린팅 공동 배양을 생산하기 위한 프로토콜을 제시합니다. 하이드로겔 스캐폴드 내에서 96웰 또는 384웰 형식으로 생성된 이 공동 배양 모델은 7일 이내에 높은 인쇄 후 생존율과 신경돌기 성장을 입증하고 두 세포 유형 모두에 대한 성숙 마커의 발현을 보여줍니다.
초록
세포 모델이 약물 스크리닝에 적합하려면 시스템이 효율적인 개발 시간과 함께 처리량 및 균질성 요구 사항을 충족해야 합니다. 그러나 게시된 많은 3D 모델은 이러한 기준을 충족하지 않습니다. 따라서 이는 초기 약물 발견 응용 분야에서 유용성을 제한합니다. 3차원(3D) 바이오프린팅은 3D 모델 개발에 적용하여 개발 시간을 단축하고 표준화를 높이며 처리량을 늘릴 수 있는 새로운 기술입니다. 여기에서는 인간 유도 만능 줄기 세포(iPSC) 유래 글루타마테르성 뉴런 및 성상교세포의 3D 바이오프린팅 공동 배양 모델을 개발하기 위한 프로토콜을 제시합니다. 이러한 공동 배양은 생체 활성 펩타이드, 전장 세포외 기질(ECM) 단백질의 하이드로겔 매트릭스 내에 내장되어 있으며 생리학적 강성은 1.1kPa입니다. 이 모델은 96웰 및 384웰 형식으로 신속하게 확립할 수 있으며 평균 72%의 인쇄 후 생존율을 생성합니다. 이 모델에서 성상세포(astrocyte) 대 뉴런(neuron)의 비율은 1:1.5로 나타났으며, 이는 인간 뇌의 생리학적 범위 내에 있습니다. 이러한 3D 바이오프린팅 세포 집단은 또한 배양 후 7일 이내에 성숙한 신경 세포 유형 마커의 발현과 신경돌기 및 성상세포 돌기의 성장을 보여줍니다. 결과적으로 이 모델은 신경돌기 성장 분석과 함께 세포 염료 및 면역염색 기법을 사용한 분석에 적합합니다. 이러한 생리학적으로 대표되는 모델을 대규모로 생성할 수 있는 능력은 신경 과학 표적에 대한 중간에서 높은 처리량의 스크리닝 분석에 사용하기에 이상적입니다.
서문
신약 개발 산업에서 중추신경계(CNS) 질환에 대한 연구가 확대되고 있습니다1. 그러나 간질, 정신분열증, 알츠하이머병과 같은 많은 중추신경계 질환은 여전히 완치법이 없다 2,3,4. 중추신경계 질환 전반에 걸쳐 효과적인 치료법이 부족한 것은 적어도 부분적으로는 정확한 뇌 체외 모델이 부족하기 때문이라고 할 수 있다5. 이로 인해 현재 in vitro 모델과 in vivo 데이터 간의 중개 격차가 발생하고 연구 노력에 병목 현상이 발생했습니다.
이러한 중개 격차로 인해 최근 몇 년 동안 신경 오가노이드, 신경 스페로이드 및 스캐폴드 기반 모델을 포함한 새로운 3D 세포 모델의 개발이 크게 증가했습니다6. 이러한 모델의 3D 구조는 생체역학적 스트레스, 세포 간 접촉 및 뇌 세포외 기질(ECM)을 포함한 신경 미세환경을 재현하는 데 도움이 됩니다7. 뇌 ECM은 신경 세포, 성상 교세포, 희소돌기아교세포 및 신경 혈관 단위7을 포함한 신경 세포 유형 사이의 공간을 차지하는 신경 생리학의 동적 요소입니다. 뇌 ECM의 재현은 신경 형태 및 신경 세포 발화에 영향을 미치는 것으로 나타났으며, 뇌의 많은 복잡한 3D 모델은 신경 세포 유형 8,9,10,11에 의한 ECM 단백질의 침착을 입증했습니다. 스캐폴드 기반 모델은 뇌 ECM(12)을 나타내는 다공성 합성 또는 생물학적 하이드로겔 매트릭스에 현탁된 성숙한 신경 공배양으로 구성됩니다. 오가노이드 및 스페로이드 시스템과 달리 스캐폴드 기반 3D 모델을 사용하면 존재하는 ECM 단백질을 맞춤화할 수 있으며 생체역학적 응력을 모방하기 위해 하이드로겔 강성을 조정할 수 있는 추가 이점이 있습니다13,14.
압도적 다수의 3D 신경 모델이 뇌 미세환경의 재현이 증가했음을 보여주지만, 모든 모델이 신약 개발 애플리케이션을 구현하는 데 적합한 것은 아니다15. 3D 모델이 산업 공정에 구현되려면 시스템이 스크리닝 응용 분야에 대한 처리량 요구 사항을 충족하고 개발 시간이 비교적 짧아야 합니다16. 3D 바이오프린팅은 인적 오류로 인한 변동성 제거와 함께 빠른 개발 시간, 처리량 증가, 더 높은 수준의 정밀 제어를 통해 3D 스캐폴드 기반 신경 모델을 생성할 수 있는 잠재력을 제공하는 새로운 기술입니다17. 이 프로토콜은 하이드로겔 스캐폴드에서 인간 iPSC 유래 글루타민성 뉴런 및 성상세포의 3D 공동 배양 모델을 제시합니다. 이 하이드로겔 스캐폴드는 생리학적으로 대표적인 생체 활성 펩타이드(RGD, IKVAV, YIGSR)와 ECM 단백질을 모방 생체역학적 강성 내에 함유하고 있습니다. 이러한 전장 ECM 단백질은 전장 라미닌-211과 히알루론산을 포함하며, 이는 인간 피질에 풍부하며, 생체 내 측정치에 따라 1.1kPa의 강성을 갖는다18. 이 모델은 신약 개발을 위해 실용적으로 설계되었으며, 신경돌기 돌출 분석과 함께 세포 염료 및 항체와 함께 이미징 기술을 사용한 스크리닝 분석에 적합한 96웰 또는 384웰 플레이트 형식의 3D 바이오프린터를 사용하여 생성됩니다. 세포는 배양 후 7일 이내에 신경 세포 유형 마커의 발현과 신경돌기 및 성상세포 돌기의 성장을 보여줍니다. 따라서 이 프로토콜은 약물 발견 응용 분야에 사용하기 위한 고처리량 3D 신경 공동 배양 모델을 개발하는 방법론을 제시합니다.
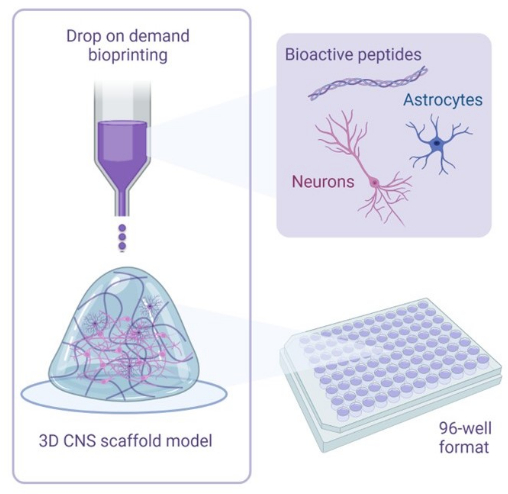
그림 1: 3D 바이오프린팅 공동 배양에 사용되는 방법론의 예시적 개요. 인간 iPSC 유래 뉴런 및 성상세포는 생체 활성 펩타이드를 함유한 활성제 및 바이오잉크 용액과 결합되며 드롭온디맨드 바이오프린팅 기술을 사용하여 96웰 또는 384웰 형식으로 하이드로겔 스캐폴드에 바이오프린팅됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 3D 모델의 바이오프린팅
- 플레이트 맵 및 인쇄 파일 생성
- 모델을 생성하기 전에 플레이트 맵 소프트웨어를 사용하여 플레이트 맵, 프로토콜 및 인쇄 파일을 생성합니다. 플레이트 맵 소프트웨어를 열고 Culture Cells in 3D 옵션을 선택합니다.
- 드롭다운 메뉴에서 사용 가능한 옵션에서 바이오프린팅할 모델 유형을 선택합니다. 이 모델은 이미징 모델 및 HTP 모델 형식에서 검증되었습니다. 96웰 플레이트의 경우 이미징 모델을, 384웰 플레이트의 경우 HTP를 선택합니다.
- 매트릭스 선택 창에서 IKVAV, RGD 및 YIGSR 펩타이드와 함께 라미닌-211 및 히알루론산 단백질을 포함하는 하이드로겔 Px02.53을 선택합니다.
- 팝업 창에서 세포 유형을 Glutamatergic Neurons and Astrocytes 로 입력하고 세포 밀도를 2000만 cells/mL로 입력합니다.
- 소프트웨어를 사용하여 화면상의 플레이트에서 웰을 강조 표시하여 원하는 플레이트 맵을 설계할 수 있습니다. 설계에 플라스틱에 대한 2D 제어 행을 1개 이상 포함합니다. 플라스틱 웰의 2D 제어 는 하이드로겔 스캐폴드 없이 웰에 직접 증착된 셀로 구성됩니다. 1.2 단계에 따라 이 우물을 코팅합니다.
- 창 상단에 나열된 플레이트 모델이 사용할 플레이트 모델로 변경되었는지 확인합니다( 재료 표 참조).
- 다운로드 버튼을 사용하여 플레이트 맵에 대한 프로토콜 및 인쇄 파일을 다운로드하고 바이오프린터에 연결된 컴퓨터에 저장합니다.
- 플라스틱 웰의 2D 제어 코팅
- 프린팅하기 최소 24시간 전에 세포 부착 및 성장을 위해 2D 제어 모델용 웰을 코팅합니다. 3D 모델 웰은 사전 코팅이 필요하지 않습니다. 모든 과정은 달리 명시되지 않는 한 생물 안전 작업대에서 수행되어야 합니다. 플레이트는 인쇄 전 최대 7일까지 코팅 및 준비할 수 있습니다.
- 2.5mL의 20x 붕산염 원액 47.5mL를 멸균 dH2O로 희석하여 50mL의 1x 붕산염 완충액을 만듭니다.
- 100μL의 50%(w/v) 폴리에틸렌이민(PEI)을 50mL의 1x 붕산염 완충액에 첨가하여 0.22μm 필터를 통해 0.1%(w/v) PEI 용액과 제균 필터를 만듭니다.
- 1.1단계에서 생성된 플레이트 맵에 표시된 대로 각 2D 제어 웰에 0.1%(w/v) PEI 용액을 추가합니다. 96웰 플레이트를 사용하는 경우 100μL/웰을 추가하고, 384웰 플레이트를 사용하는 경우 25μL/웰을 추가합니다.
- 37°C에서 2시간 동안 플레이트를 배양한 후 0.1%(w/v) PEI 용액을 흡입하고 PBS로 웰을 5배 헹굽니다. 생물 안전 캐비닛에서 우물을 완전히 건조시키십시오.
- 100μL의 1mg/mL 라미닌 용액을 5mL의 신경기저 배지에 희석합니다. 96웰 플레이트를 사용하는 경우 각 2D 대조군 웰에 100μL를 추가하고, 384웰 플레이트를 사용하는 경우 25μL를 추가합니다. 37°C에서 4시간 동안 배양합니다.
- 플레이트를 보관하는 경우 배양 후 라미닌 용액을 제자리에 두고 4°C에서 보관하십시오. 사용하기 전에 플레이트를 1°C에서 37시간 동안 예열하십시오.
- 공동 배양 모델의 3D 바이오프린팅
- 바이오프린터를 사용할 때는 항상 멸균 기술을 유지하고, 장갑, 카트리지 및 배양 플레이트를 70% EtOH로 닦은 후 프린터에 넣으십시오. 달리 명시되지 않는 한, 바이오 프린터 외부의 생물 안전 캐비닛에서 모든 프로세스를 수행하십시오.
- 바이오프린터용 압축기를 켜고 바이오프린터 소프트웨어에서 초기화 버튼을 선택하여 프린터를 초기화 합니다. 프린터의 공기 흐름이 시작되면 70% EtOH 와이프로 프린터 내부 표면을 닦습니다.
- 인쇄 당일, 안내된 하루 시작 그린라이팅 프로세스를 수행하여 인쇄 실행에 대한 올바른 노즐 상태(최소 노즐 상태 2A2B)를 확인합니다.
- 멸균 포장에서 바이오프린터 카트리지를 꺼내 구획 A에 멸균 dH2O 20mL를 추가하고 구획 B1-4에 멸균 여과된 70% EtOH 6mL를 추가합니다. 카트리지를 바이오프린터 내부의 왼쪽 카트리지 홀더에 삽입하고 플레이트 뚜껑을 전용 뚜껑 홀더에 넣습니다.
- 소프트웨어 홈 화면에서 Greenlighting 버튼을 선택하고 소프트웨어에서 카트리지가 바이오프린터 내의 제자리에 있고 덮개가 제거되었는지 확인합니다. 그린라이팅 프로세스를 시작합니다.
- 소프트웨어에서 메시지가 표시되면 왼쪽 또는 오른쪽 바늘에서 일관된 물방울이 보이지 않는지 확인합니다. 그런 다음 소프트웨어에서 메시지가 표시되면 B7 및 B8 구획에 물이 있는지 확인합니다.
- 바이오프린터가 셀프 가이드 그린라이팅 단계를 완료한 후, 코팅되지 않은 멸균 96웰 플랫 바닥 플레이트(바이오프린팅 공동 배양을 위한 코팅 플레이트와 별도)를 삽입하고 소프트웨어에서 메시지가 표시되면 이 새 플레이트를 바이오프린터의 오른쪽 플레이트 홀더 섹션에 삽입합니다. 플레이트 홀더가 High Profile Plate로 설정되어 있는지 확인하고 다음 단계를 시작하기 전에 뚜껑을 제거하고 전용 뚜껑 홀더에 넣습니다.
- 바이오프린터는 96웰 플레이트의 각 웰에 물방울을 증착합니다. 완료되면 바이오프린터에서 플레이트를 놓고 플레이트의 각 웰에 물방울이 있는지 확인합니다.
- 그린라이트에 사용된 96웰 플레이트를 폐기하고 바이오프린터가 그린라이팅 프로세스를 완료할 수 있도록 합니다. 완료되면 소프트웨어는 바이오프린터의 노즐 상태를 표시하고 바이오프린터가 모델을 프린팅할 준비가 되었는지 확인합니다. 잉크 카트리지에 뚜껑을 덮고 다음 단계를 위해 생물 안전 캐비닛으로 옮깁니다.
- 바이오프린터 소프트웨어를 사용하여 인쇄 실행 소프트웨어 버튼을 사용하여 인쇄 파일(1.1단계에서 생성됨)을 소프트웨어에 로드하고 인쇄 프로토콜 pdf를 엽니다.
- 인쇄 프로토콜 pdf에 표시된 대로 바이오잉크 및 활성제 유체를 -20°C에서 회수하고 실온(RT)에서 40분 동안 해동합니다. 하이드로겔 매트릭스 Px02.53의 경우 다음이 포함됩니다: 1x 바이알 F32, 1x 바이알 F3, 1x 바이알 F261, 1x 바이알 F299. 바이오잉크와 액티베이터 액을 손이나 수조에서 해동하지 마십시오.
- 바이오잉크 및 활성제 유체가 해동되는 동안 독시사이클린과 ROCK 억제제(complete media +DOX/ROCKi)(2.2단계 참조)가 포함된 complete 배지 50mL를 RT로 가져옵니다.
- 바이오잉크와 활성제가 해동되면 생성된 인쇄 프로토콜 pdf의 마지막 두 페이지에 설명된 대로 인쇄 카트리지를 준비합니다. greenlighting 프린터 카트리지는 모델 인쇄 단계에 재사용됩니다.
- 구획 A1에 40mL의 dH2O가 있고 구획 B1 및 B2에 8mL의 70% EtOH가 있는지 확인합니다. C1에 활성제 F32 1.2mL, C2에 F3 1.2mL, C4에 F261 200μL를 추가합니다.
- 인큐베이터에서 PEI 및 라미닌 코팅 플레이트를 꺼내 프린터 내부의 오른쪽 플레이트 홀더 구획에 놓습니다. 이 시점에서 웰에서 라미닌 매체 용액을 제거하지 마십시오. 플레이트 홀더 구획이 Low Profile 플레이트 로 설정되어 있고 뚜껑이 제거되어 뚜껑 홀더에 있습니다.
- 잉크 카트리지를 바이오프린터에 넣고 뚜껑이 제거되어 홀더에 끼워졌는지 확인한 다음, 바이오프린터 소프트웨어에서 Print Inert Base 버튼을 선택하여 소프트웨어에서 인쇄 실행을 시작합니다.
- 불활성 염기가 인쇄되는 동안 액체 질소 저장에서 글루타민성 뉴런 및 성상교세포의 바이알을 회수하고 섹션 2의 지침에 따라 해동 및 재현탁합니다.
- 세포가 해동되고 8mL의 완전한 배지 +DOX/ROCKi가 각 세포 유형에 개별적으로 추가되면(섹션 2에 따라) 세포를 300 x g 에서 RT에서 5분 동안 원심분리합니다.
- 상층액을 흡인하고 두 세포 유형을 1mL의 완전한 배지 +DOX/ROCKi에 개별적으로 재현탁시킵니다.
- 20μL의 세포 현탁액을 20μL의 트리판 블루에 추가하고 세포를 계수하기 전에 혼합하여 각 세포 유형에 대한 mL당 생존 가능한 세포 농도를 결정합니다.
- 총 300만 개의 글루타민성 뉴런과 100만 개의 성상교세포를 15mL 튜브에 결합합니다. 배지를 추가하여 총 8mL 부피를 만듭니다.
- RT에서 5분 동안 300 x g 에서 세포를 원심분리합니다.
- 세포 펠릿을 방해하지 않고 가능한 한 많은 상층액을 흡인하고 세포 펠릿을 200μL의 활성제 유체 F299에 재현탁시킵니다.
- 활성제 유체는 점성이 있습니다. 펠릿을 완전히 재현탁하기 위해 위아래로 피펫을 만듭니다. 세포 유형은 섬세합니다. 넓은 구경의 피펫 팁과 역 피펫팅 기법을 사용하여 전단과 기포를 최소화합니다. 세포 손실을 방지하기 위해 피펫을 3회 이상 위아래로 단단히 고정하지 마십시오.
- 불활성 베이스 스테이지의 인쇄가 완료되면 카트리지와 배양 플레이트에 뚜껑을 놓고 바이오프린터에서 둘 다 제거하고 생물 안전 캐비닛에 넣습니다.
- F299의 200μL 셀 현탁액을 잉크 카트리지의 웰 C3에 추가하고, 카트리지를 바이오프린터에 다시 삽입하고, 뚜껑을 제거한 다음 뚜껑 홀더에 넣습니다. 아직 문화판을 다시 삽입하지 마십시오.
- 인쇄 실행의 인쇄 모델 단계를 시작합니다. 바이오프린터가 유체를 프라이밍하는 동안 플레이트의 2D 대조군 웰에서 라미닌 배지 용액을 제거하고 96웰 플레이트를 사용하는 경우 각 2D 대조군 웰에서 150μL의 전체 배지 +DOX/ROCKi로 교체하고 384웰 플레이트를 사용하는 경우 50μL의 전체 배지 +DOX/ROCKi로 교체합니다.
- 액체를 프라이밍한 후 바이오프린팅 타겟팅 플레이트를 바이오프린터에 삽입하고 뚜껑을 제거한 후 뚜껑 홀더에 넣습니다.
- 바이오프린터 표적화 프로세스를 시작합니다.
- 바이오프린팅 소프트웨어에서 메시지가 표시되면 바이오프린터에서 표적 플레이트를 제거합니다.
- 가이드를 사용하여 플레이트에서 물방울을 관찰할 수 있는 위치를 선택합니다. 표적 플레이트를 바이오프린터에 다시 삽입하고 액적 인쇄 및 선택 과정을 반복합니다.
- 메시지가 표시되면 표적 플레이트를 다시 제거한 다음 세포 배양 플레이트(1.3.25단계에 따라 2D 대조군 웰에 배지 포함)로 교체합니다. 배양 플레이트 뚜껑이 열려 있고 홀더에 있는지 확인합니다. 바이오프린터가 모델 인쇄를 마칩니다.
- 모델 프린팅이 완료되면 섹션 2(2.8단계)의 세포 배양 방법에 따라 웰에 배지를 추가합니다.
- 바이오프린터 세척 프로세스를 시작하고 완료되면 실험실 프로토콜에 따라 카트리지와 남은 액체를 폐기합니다.
2. 세포 배양
- 글루타마테르성 뉴런 1x 바이알(바이알당 >500만 개 세포)과 성상교세포 1x 바이알(바이알당 >100만 개 세포)을 사용하여 모델을 생성합니다.
- 수조를 37°C로 예열합니다.
- 두 세포 바이알을 모두 드라이아이스에 담아 실험실로 운반하고 드라이아이스에서 꺼낸 직후 수조에 담그십시오. 두 바이알을 동시에 해동합니다.
- 작은 얼음 결정만 남을 때 수조에서 바이알을 제거합니다. 담근 후 약 3분이 소요됩니다. 수조에서 세포를 휘젓거나 섞지 마십시오.
- 바이알에 70% EtOH를 분사하고 생물안전 작업대로 옮깁니다.
- 각 현탁액을 별도의 15mL 튜브로 옮기기 전에 500μL의 complete 배지 +DOX/ROCKi를 각 바이알에 적하합니다.
- 각 튜브의 배지를 8mL까지 채우고 1.3단계에 따라 바이오프린팅 단계를 진행합니다.
- 바이오프린팅 모델(1.3단계)에 따라 즉시 모든 3D 공동 배양 웰에 완전한 배지 +DOX/ROCKi를 추가하고 모델을 37 oC 및 5%CO2의 인큐베이터에 넣습니다. 96웰 플레이트를 사용하는 경우 웰당 150μL의 매체를 추가합니다. 384웰 플레이트를 사용하는 경우 웰당 50μL의 배지를 사용합니다.
- 배양의 처음 48시간 동안은 배지 교체가 필요하지 않습니다.
- 2D 대조군 및 모델에서 배지 교체를 수행할 때 2D 배양물을 분리하거나 하이드로겔의 변형을 유발할 수 있는 기계적 응력을 유발하지 않도록 주의해야 합니다. 우물 측면을 가리키는 마이크로피펫을 사용하여 배지 흡인 및 추가를 천천히 수행합니다.
- 48시간 후 모든 웰에서 90% 매체 교체를 수행하고 매체 조성에서 ROCKi를 제거합니다(2.14단계 참조).
- 96시간 후 모든 웰에서 추가로 90% 매체 교체를 수행하여 매체 조성에서 DOX를 제거합니다(2.14단계 참조).
- 48시간 및 96시간에 90% 미디어를 두 번 교체한 후 48시간마다 50% 미디어를 교체하여 미디어의 50%를 흡입하고 새로운 완전한 미디어로 교체합니다.
- 미디어 구성:
- 전체 배지: 1x GlutaMAX, 1x B27, 12.5 nM 2-mercaptoethanol, 10 ng/mL NT3, 5 ng/μL BDNF가 포함된 신경기초 배지.
- 완전한 배지와 독시사이클린(DOX): 1x GlutaMAX, 1x B27, 12.5nM 2-메르캅토에탄올, 10ng/mL 뉴로트로핀-3(NT3), 5ng/μL 뇌 유래 신경 영양 인자(BDNF) 및 1μg/mL 독시사이클린이 함유된 신경기저 배지.
- 완전한 배지와 DOX/ROCK 억제제(ROCKi): 1x GlutaMAX, 1x B27, 12.5nM 2-메르캅토에탄올, 10ng/mL NT3, 5ng/μL BDNF, 1μg/mL 독시사이클린 및 10μM ROCK 억제제가 포함된 신경기저 배지.
3. 신경돌기 성장 분석
- 바이오프린팅 후 배지를 추가한 직후 명시야 이미징을 위해 살아있는 세포 현미경에 세포를 배치합니다.
- 현미경 소프트웨어를 사용하여 최소 7일 동안 12시간마다 2D 대조군을 포함한 모든 웰에서 세포를 4배 배율로 이미징하도록 예약합니다.
- 섹션 48에 설명된 대로 2시간마다 매체 교체를 수행하고 매번 매체를 교체한 후 세포를 현미경에 다시 넣습니다.
- 7일 간의 데이터 후 소프트웨어에서 이미지를 .jpg 형식으로 내보냅니다.
- 모든 .jpg 이미지를 ImageJ 소프트웨어로 가져오고 파일을 8비트 형식으로 변환합니다. NeuronJ 플러그인을 불러오고 추적 툴을 사용하여 가지점을 포함한 영상의 신경돌기 성장을 추적합니다.
- NeuronJ에서 생성된 신경돌기 추적 데이터를 사용하여 시간 경과에 따른 신경돌기 성장을 플로팅합니다.
4. 세포 생존율 분석
- 배양 시 24시간마다 살아있는/죽은 생존도 키트를 사용하여 세포 생존율 분석을 위해 3개 이상의 웰을 염색합니다. 연구 기간 동안 24시간 또는 48시간 시점에서 이 단계를 반복합니다.
- 이미징 30분 전에 페놀 레드(Opti-MEM)가 없는 환원 혈청 배지 10mL에 살아있는 세포 시약(1x Calcein-AM) 및 죽은 세포 시약(1x ethidium homodimer-1) 및 1x 살아있는 세포 핵 염색(Hoechst 33342)을 현탁하여 살아있는/죽은 시약 배지를 준비합니다. 살아있는/죽은 시약 배지를 RT로 가져오십시오. 형광 표백으로 인해 살아있는/죽은 시약 배지를 직사광선을 피해 보관하십시오.
- 세포 모델/2D 대조군이 들어 있는 3개의 웰에서 배지를 제거하고 겔 교란을 조심스럽게 방지합니다. RT 멸균 PBS로 세포 모델을 한 번 세척합니다. 96웰 플레이트의 경우 각 웰에 100μL의 살아있는/죽은 시약 배지를 추가하고, 384웰 플레이트의 경우 25μL를 추가합니다.
- 모델을 37 ° C 및 5 % CO 2에서 30 분 동안 배양합니다.
- 배양 후 모델은 이미징할 준비가 됩니다. 적색(647nm, 죽은 세포), 녹색(488nm, 살아있는 세포) 및 청색(405nm, 핵 염색) 여기 채널이 있는 모든 표준 현미경에서 이미징을 수행합니다. 3D 모델에서 최상의 결과를 얻으려면 High-Content 컨포칼 현미경을 사용하여 이미지를 모델링하고 4x 또는 10x 배율에서 Z-stack 기능을 사용하여 이미징을 수행합니다.
참고: 이 연구에서 세포 모델은 INCell Analyzer 6500HS(high-content imaging system)를 사용하여 이미지화되었으며 분석은 Signals Image Artist(이미지 분석 플랫폼, 4.7단계 참조)를 사용하여 수행되었습니다. - 이미징이 완료되면 세포 모델을 37°C 및 5%CO2 의 세포 배양 인큐베이터로 되돌립니다.그러나 생존도 분석에 사용되는 세포 모델은 장기 생존력에 대한 살아있는/죽은 시약 배지 때문에 추가 연구에서 제외됩니다.
- 이미지 분석 플랫폼에서의 이미지 분석
- 소프트웨어에서 Z 스택 이미지의 각 평면을 선택합니다. 평면 영상을 최대 강도 투영 영상으로 결합합니다.
- 488nm의 살아있는 세포 채널에서 형광을 식별하여 관심 영역(ROI)으로 바이오프린팅 모델을 선택하여 새로운 분석을 생성합니다(모든 세포가 ROI에서 선택되었는지 확인).
- 관심 영역 내에서 이미징 소프트웨어를 사용하여 핵 염색 채널(405nm)을 통한 ROI의 세포 수, 488nm 채널을 사용한 ROI의 살아있는 세포 수, 647nm 채널을 사용한 ROI의 죽은 세포 수를 식별합니다.
- 모든 살아있는/죽은 세포 처리 세포 모델 웰에 대한 분석을 실행하고 ROI 영역, 총 세포 수, 살아있는 세포 수 및 죽은 세포 수가 포함된 데이터 테이블을 내보냅니다.
- 살아있는 세포와 죽은 세포의 수를 분석일당 총 세포 수의 백분율로 계산합니다.
5. 면역염색 및 세포집단 분석
- 고정하기 전에 셀 모델에서 배지를 제거하고 PBS에서 모델을 한 번 세척하십시오.
- RT에서 20분 동안 PBS에 4%(v/v) 파라포름알데히드로 세포를 고정합니다.
주의 : 파라포름알데히드를 사용한 모든 작업은 실험실 절차에 따라 수행해야 합니다. - 모델에서 4%(v/v) 파라포름알데히드 용액을 흡입하고 PBS에서 모델을 4번 세척하여 파라포름알데히드를 완전히 제거합니다.
- RT에서 30분 동안 0.2% 트리톤-X로 세포 모델을 투과시키고 PBS로 세 번 세척합니다.
- RT에서 3시간 동안 10%(v/v) 정상 당나귀 혈청(NDS)을 사용하여 세포 모델을 차단합니다.
- 차단 용액을 제거하고 1차 항체(PBS의 1% v/v NDS로 희석)를 모델에 추가합니다. 세포 집단 비율 분석을 수행하는 경우(5.11단계 참조) Β-III 튜불린(빨간색 AF647 접합 포함) 및 GFAP(녹색 AF488 접합 포함)에 대해 공동 염색된 세포 모델을 포함해야 합니다. 1차 항체가 있는 모델을 4°C에서 24시간 동안 배양합니다.
- 1차 배양 후 접합 1차 항체로 염색한 모델을 PBS에서 3회 세척하고 20μM Hoechst로 30분 동안 역염색합니다. 5.10단계에서 자세히 설명한 이미지입니다.
- 비접합 1차 항체로 염색된 모델을 PBS에서 3회 세척하고 2차 항체(PBS에서 1% v/v NDS로 희석)를 추가합니다. 4 °C에서 24 시간 동안 배양합니다.
- PBS에서 3회 세척하여 2차 항체를 제거하고 이미징 전에 30분 동안 20μM Hoechst로 모델을 대조염색합니다.
- 적색(647nm) 및 녹색(488nm) 여기 채널이 있는 표준 현미경에서 이미징을 수행합니다. 그러나 3D 모델에서 최상의 결과를 얻으려면 high-content 컨포칼 현미경을 사용하여 이미지를 모델링하고 4x 또는 10x 배율에서 Z 스택 기능을 사용하여 이미징을 수행합니다.
- 이미지 분석 플랫폼에서의 세포 집단 비율 분석
- GFAP(AF488 접합 포함) 및 Β-III 튜불린(AF647 접합 포함)에 대해 동시 염색된 모델을 사용하여 세포 집단을 분석합니다.
- 소프트웨어에서 Z 스택 영상의 각 평면을 선택하고 평면 영상을 최대 강도 투영 영상으로 결합합니다.
- 647nm의 Β-III 튜불린 채널에서 형광을 식별하여 바이오프린팅 모델을 ROI로 선택하여 새로운 분석을 생성합니다(ROI에서 모든 세포 함유 영역이 선택되었는지 확인).
- ROI 내에서 소프트웨어를 사용하여 Hoechst 채널(405nm)의 세포 수, 488nm 채널을 사용하는 ROI의 GFAP+ 성상세포 수, 647nm 채널을 사용하는 ROI의 Β-III tubulin+ 세포 수를 식별합니다.
- 모든 동시 염색된 세포 모델 웰에 대해 분석을 실행하고 ROI 영역, 총 세포 수, GFAP+ 세포 수 및 Β-III tubulin+ 세포 수가 포함된 데이터 테이블을 내보냅니다.
- GFAP+ 및 Β-III 튜불린+ 세포의 수를 총 세포 수에 대한 백분율로 계산합니다.
결과
신경돌기 성장 분석
이 프로토콜에서는 iPSC 유래 글루타마테르성 뉴런과 성상세포를 3D 바이오프린터를 사용하여 하이드로겔 매트릭스로 공동 배양하여 바이오프린팅했습니다. 프린팅 후 처음 7일 동안 살아있는 세포 현미경을 사용하여 12시간마다 세포를 이미지화했습니다. 바이오프린팅 후, 세포는 둥근 형태를 가져야 하며 하이드로겔 매트릭스 전체에 분산되어야 하며, 배양 후 처음 며칠 동안 돌출부가 거의 없는 더 작은 세포 클러스터를 형성하도록 점진적으로 변화해야 합니다(대표적인 건강한 세포 성장에 대해서는 보충 비디오 1 참조). 4일째가 되면 건강한 세포가 겔 전체로 이동하여 신경돌기 돌출물을 통해 연결된 더 큰 클러스터를 형성합니다. 7일째가 되면 단일 세포가 거의 남지 않고, 신경돌기와 성상세포돌기의 상호 연결된 다발이 강화된 것처럼 보이며, 클러스터에서 형성되는 많은 작은 신경돌기 돌출물을 볼 수 있습니다(그림 2A). 7일간의 성장 기간 동안 촬영한 일련의 살아있는 세포 명시야 이미지를 사용하여 섹션 3에 자세히 설명된 대로 신경돌기 돌출 분석을 수행했습니다. 이 분석은 신경돌기 성장이 12시간에서 156시간 사이에 거의 선형적인 방식(R2 값 = 0.84)으로 증가한다는 것을 보여주었습니다(그림 2B). 이 신경돌기 돌출 기간 동안 세포체 클러스터도 크기가 증가하며( 보충 비디오 1 참조), 이는 하이드로겔 전체의 세포 이동을 나타냅니다.
세포 생존율 및 개체군 비율
이 프로토콜에서는 1,500만 개의 뉴런/mL 및 500만 개의 성상교세포/mL로 구성된 2,000만 개의 세포/mL 농도가 세포 모델의 바이오프린팅에 사용됩니다. calcein-AM(살아있는 세포), ethidium homodimer-1(죽은 세포) 및 핵 염색을 사용한 살아있는 세포 염색을 사용하여 섹션 4(그림 3A)에 따라 7일 동안 생존한 세포 수를 계산할 수 있습니다. 대표 배양에 대한 세포 생존율 결과는 4일차에 나타나며, 전체 세포의 72% ± 1%(평균 ± SEM)가 살아 있고 Calcein-AM에 대한 염색을 보이는 반면, 29% ± 2%(평균 ± SEM) 총 세포는 죽었고 ethidium homodimer-1로 염색되었습니다(그림 3B). Calcein-AM 및 ethidium homodimer-1을 사용한 세포 염색의 대표 이미지는 보충 그림 1 에서 볼 수 있습니다. 죽은 세포는 하이드로겔에 남아 있고 세포 공급 과정에서 제거되지 않기 때문에 3D 배양에 대한 세포 생존 값은 2D 배양과 직접 비교할 수 없습니다.
섹션 5 및 그림 4에 설명된 대로 Β-III 튜불린 및 GFAP에 대한 면역형광 염색을 사용하여 이미지 분석을 수행하여 뉴런과 성상세포 사이의 세포 집단 비율을 결정할 수 있습니다(그림 3A). 대표 배양에서 모델당 총 세포 중 Β-III 튜불린 양성 뉴런은 49% ± 3%(평균 ± SEM)를 나타내는 반면, GFAP 양성 성상교세포는 30% ± 4%(평균 ± SEM)를 나타냅니다. 이것은 각각 1:1.5, 성상교세포(astrocyte)와 뉴런(neuron)의 비율을 제공합니다. 이렇게 하면 모델당 나머지 21%의 총 세포가 남게 되며, 이는 두 세포 마커 모두에 대해 염색되지 않습니다. 세포 생존율 분석 결과 4일째에 세포의 29%의 평균값이 생존할 수 없는 것으로 나타났기 때문에 이러한 세포는 하이드로겔 내에서 죽었을 가능성이 높습니다.
세포 마커의 발현
바이오프린팅된 뉴런 및 성상세포의 형태는 뉴런 세포 유형 마커(Β-III 튜불린) 및 성상세포 마커(GFAP)에 대한 면역염색을 통해 평가되었습니다. 표시된 대표적인 배양에서 면역염색은 개별 세포 유형에 국한되어 건강한 세포 형태를 보여주며, 두 세포 유형 모두 세포 돌출부의 파생물을 나타냅니다(그림 4A,B). 하이드로겔과 세포 구조는 3차원이므로 각 이미지는 그림 4A,B의 구조를 통해 하나의 절편만 나타냅니다. 그림 4C는 하이드로겔 전체에 걸쳐 병합된 이미지 스택을 보여주며, X, Y 및 Z 평면에서 세포 국소화를 보여줍니다. 그림 4D는 Β-III 튜불린에 대한 면역염색만을 보여줍니다. 세포체 클러스터에서 더 미세한 신경돌기 돌출물을 강조합니다. 글루타민성 뉴런의 표현형을 추가로 검사하기 위해 글루타민성 이온 수용체 마커인 GluR2에 대한 면역염색을 수행할 수 있습니다. 그림 4E 내에서 영역 4E.1(삽입)은 신경돌기 다발을 따라 더 높은 분해능의 반점 염색을 보여주기 위해 강조 표시되었습니다. 따라서 이것은 이 공동 배양의 뉴런이 글루타마테르성 표현형을 가지고 있음을 확인합니다. 모든 면역염색 이미지에서 세포 클러스터와 신경돌기 주변에서 면역형광 염색된 비세포 구조를 관찰할 수 있습니다. 이러한 구조는 하이드로겔에 결합하는 소량의 비특이적 항체와 함께 하이드로겔 내에 잔류된 파편을 나타낼 가능성이 높습니다. 이는 바이오프린팅 배양에서 예상되는데, 3D 스캐폴드 모델 내에서 세포 공급 중에 죽은 세포와 파편이 제거되지 않기 때문입니다. 대표적인 음성 대조군 면역염색 이미지는 2차 항체의 하이드로겔 비특이적 결합을 설명하기 위해 보충 그림 2에 나와 있습니다.
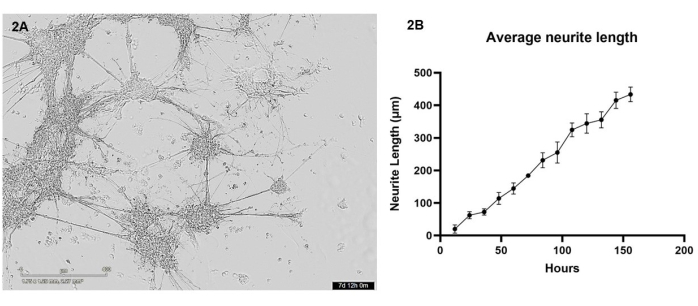
그림 2: Glutamatergic 뉴런과 성상세포는 바이오프린터를 사용하여 하이드로겔 매트릭스에 바이오프린팅되었으며 명시야 현미경을 사용하여 12시간마다 이미지화되었습니다 . (A) 분석 중 세포 배양에서 촬영한 명시야 이미지의 예. 이미지는 156시간 시점을 나타내고 눈금 막대는 400μm를 나타냅니다. (B) ImageJ용 NeuronJ 패키지를 사용하여 측정한 배양물에서 신경 돌기 돌출물의 평균 길이(μm). 각 데이터 포인트는 n = 3개의 신경돌기이며 데이터는 SEM± 평균으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
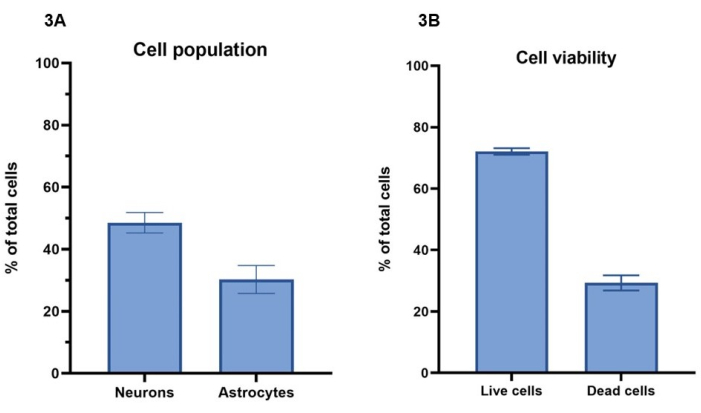
그림 3: 2,000만 cells/mL의 활성제 용액 농도가 세포 모델의 바이오프린팅에 사용되었습니다 . (A) 세포 생존율은 살아있는/죽은 세포 염료(각각 Calcein-AM 및 ethidium homodimer-1)를 사용하여 계산되었습니다. 값은 웰당 총 세포의 72% ± 1%(평균 ± SEM, n = 3)가 살아 있고 세포의 29%± 2%(평균 ± SEM, n = 3)가 4일째에 웰당 총 세포 개체군에서 죽었음을 보여줍니다. 표시된 값은 평균 ± SEM을 나타냅니다. (B) 웰당 뉴런 및 성상세포의 세포 집단 비율은 그림 4에 표시된 염색의 이미지 분석을 통해 계산되었습니다. 뉴런은 7일째에 Β-III 튜불린에 대해 양성으로 염색된 세포의 비율(49% ± 3%, 평균 ± SEM, n = 3)을 나타내는 반면, 성상교세포는 7일째에 GFAP에 대해 양성으로 염색된 세포의 비율을 나타냅니다(30% ± 4%, 평균 ± SEM, n = 3). 표시된 값은 SEM± 평균을 나타냅니다. 그림 3 에 표시된 계산을 위한 모든 이미징은 컨포칼 이미징 시스템에서 수행되었으며 모든 분석은 방법에 따라 이미지 분석 플랫폼과 GraphPad Prism에서 수행되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
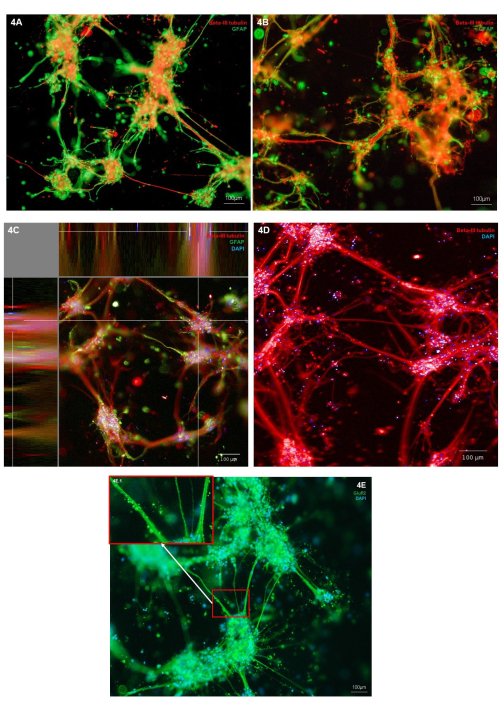
그림 4: 7일째 glutamatergic 뉴런 및 성상교세포의 3D 바이오프린팅 공동 배양에서 신경 세포 유형 마커의 발현. (A,B) 도립 현미경 플랫폼에서 10배 배율로 이미지화한 신경 마커 Β-III 튜불린 및 성상세포 마커 GFAP의 면역형광 염색. 스케일 바는 100μm를 나타냅니다. (C) Hoechst와 함께 염색된 신경 마커 β-III 튜불린 및 성상세포 마커 GFAP의 면역형광 염색(XYZ 평면도에 표시됨, 10배 배율로 컨포칼 이미징 시스템에서 이미지화). 이미지 분석 플랫폼에서 생성됩니다. 눈금 막대는 100μm를 나타냅니다. (D) Hoechst와 함께 염색된 신경 마커 β-III 튜불린의 면역형광 염색, 20배 배율로 컨포칼 이미징 시스템에서 이미지화. 눈금 막대는 100μm를 나타냅니다. (E) Hoechst와 함께 염색된 글루타마테르성 마커 GluR2의 면역형광 염색, 도립 현미경 플랫폼에서 10배 배율로 이미지화. 상자 3E.1은 GluR2 염색의 강조 표시된 영역을 보여줍니다. 눈금 막대는 100μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 동영상 1: Glutamatergic 뉴런 및 성상세포는 바이오프린터를 사용하여 하이드로겔 매트릭스에 바이오프린팅되었으며 명시야 현미경을 사용하여 12시간마다 이미징되었습니다. 분석 중 세포 배양에서 촬영한 명시야 이미지 비디오, 오른쪽 하단 모서리에 시점이 표시되며 스케일 막대는 400μm를 나타냅니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 1: 4일차에 바이오프린팅된 뉴런 및 성상세포의 살아있는/죽은 분석의 예 이미지. Calcein-AM 염색은 녹색(488nm)으로 표시되고 ethidium homodimer 염색은 빨간색(647nm)으로 표시됩니다. 이미지는 이미지 분석 플랫폼에서 생성된 XYZ 평면 뷰에 표시됩니다 . 눈금 막대는 100μm를 나타냅니다. (A) 이미징은 4배 배율의 컨포칼 이미징 시스템을 사용하여 수행되었습니다. (B) 이미징은 10x 배율에서 컨포칼 이미징 시스템을 사용하여 수행되었습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 면역형광 염색 후 음성 대조군 이미지의 예. 1차 항체는 생략하고, 면역염색 프로토콜에 따라 녹색(488nm) 및 적색(647nm) 2차 항체를 사용하였다. 이미지는 이미지 분석 플랫폼에서 생성된 XYZ 평면 뷰에 표시됩니다. 눈금 막대는 100μm를 나타냅니다. 이미징은 10x 배율의 컨포칼 이미징 시스템을 사용하여 수행되었습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
CNS의 정확한 모델에 대한 필요성이 그 어느 때보다 높아졌으며, 2차원(2D) 기존 세포 배양 모델의 한계로 인해 최근 몇 년 동안 복잡한 CNS 모델이 생성되었습니다19. 그러나 신경 세포 유형과 ECM 간의 상호 작용을 나타내는 많은 복잡한 3D 모델은 산업 공정에서 이러한 모델의 적용을 방해하는 한계가 있습니다 6,20,21. 이 프로토콜에서는 인간 iPSC 유래 뉴런 및 성상교세포의 3D 공동 배양 모델을 개발하며, 3D 바이오프린팅 기술을 사용하여 96웰 및 384웰 형식의 생체 활성 하이드로겔 스캐폴드를 만드는 것을 목표로 이러한 한계 중 일부를 해결하는 것을 목표로 합니다.
이러한 모델을 개발하기 위한 방법론은 플레이트 맵 설계 소프트웨어, 자동 생성된 인쇄 프로토콜 및 바이오프린터의 안내된 인쇄 프로세스를 통해 단순화되었습니다. 그러나 이 프로토콜에 사용된 민감한 iPSC 유래 세포 유형의 민감한 특성으로 인해 해동 및 배양에서 다음과 같은 중요한 단계를 거쳐야 합니다. 첫째, ROCK 억제제(ROCKi)의 포함은 바이오프린팅 과정과 초기 배양 전반에 걸쳐 여러 가지 이점이 있습니다. 세포 해동은 뉴런이 스트레스 반응을 경험할 수 있는 임계점이며, 부적절한 해동 프로토콜은 생존 가능성을 낮출 수 있다22. 일반적으로 세포를 해동하고, 배지를 추가하고, 세포를 가능한 한 효율적으로 인큐베이터 온도로 올리는 것이 좋습니다23. 그러나, 본 프로토콜에 기술된 바이오프린팅 공정 동안, 뉴런 및 성상교세포는 배지가 아닌 활성제 용액에 재현탁될 필요가 있으며, 세포는 프린트 실행이 끝날 때까지(해동 후 최대 30분까지) 실온 이상으로 상승되지 않을 것이다. 따라서, 해동 직후 배지에 ROCKi를 첨가하고 두 개의 원심분리 단계(단계 2.1--2.7 및 1.3.15-1.3.20 단계) 동안 이를 포함하는 것은 세포 스트레스 경로를 억제하는 데 필수적이며, 이는 생존도 수준을 낮추는 결과를 초래할 것이다24. 또한, ROCKi는 신경돌기 성장을 촉진하고 신경 세포 성숙을 개선하는 것으로 나타났습니다25. 따라서 ROCKi 보충은 바이오프린팅 후 48시간 동안 계속됩니다. 그러나 세포를 분석에 사용하기 전에 후속 배지 교체 중에 완전히 씻어낼 수 있도록 48시간 후에 ROCKi 보충제를 제거하는 것이 필수적입니다.
중요한 주의가 필요한 추가 단계는 인쇄 후 미디어 추가 및 미디어 변경 중입니다(2.8-2.13단계). 바이오프린팅된 하이드로겔 스캐폴드는 회백질에 해당하는 1.1kPa에 불과한 생체역학적 강성을 가지고 있습니다. 2.10단계에서 설명한 바와 같이, 교란을 방지하기 위해 배지 추가 및 흡인 중에 웰 측면에 피펫팅을 부드럽게 하는 것이 중요합니다. 이는 겔 레벨이 전체 웰 부피에서 더 높은 비율을 차지하는 384웰 플레이트와 특히 관련이 있습니다. 이 방법은 세포의 가장자리 리프팅 및 신경돌기 돌출물의 전단을 방지하기 위해 2D 제어 웰에서도 사용해야 합니다. 저자는 또한 iPSC 유래 세포 배양에 사용되는 생물 안전 캐비닛과 동등한 주의를 기울여 취급해야 하는 바이오프린터 내 멸균 기술의 중요성을 강조하고자 합니다. 여기에는 그린라이팅 및 인쇄 절차에 사용되는 70% EtOH 및 dH2O의 멸균 필터링, 바이오프린터 안팎으로 손을 움직이는 동안 카트리지 및 플레이트의 뚜껑 유지, 인쇄 전후에 70% 에탄올 와이프로 바이오프린터 내부 표면의 오염 제거가 포함됩니다.
이 모델을 개발하기 위해 선택된 바이오잉크 및 활성제 용액으로 형성된 바이오프린팅 하이드로겔 스캐폴드는 RASTRUM 바이오프린터 내에서 사용하기 위해 Inventia Life Science에서 개발한 다양한 바이오잉크 및 활성제 솔루션 중에서 선택됩니다. 라미닌과 히알루론산은 축삭 유도, 시냅스 형성 및 신경 주위 그물 형성에 대한 역할로 인해 iPSC 유래 신경 세포 성숙과 관련된 분자로 확인되었습니다26,27. 또한, 1.1kPa의 생체역학적 강성이 선택되었는데, 이는 저밀도 하이드로겔이 뉴런12로부터 더 나은 신경돌기 성장을 가능하게 하는 것으로 나타났기 때문이다. 사내에서 또는 다른 상업적 공급자로부터 분화된 뉴런 및 성상교세포를 사용하여 프로토콜을 수정하는 경우, 가장 지지력이 높은 하이드로겔 스캐폴드(15)를 결정하기 위해 매트릭스 선택 테스트를 수행하는 것이 권장될 것이다. 또한, 최적의 생존력을 보장하고 하이드로겔 과밀화를 방지하기 위해 세포 공급원을 변경하는 경우 세포 밀도를 최적화해야 할 수도 있습니다. 바이오프린터 기능과 관련된 모든 수정 및 문제 해결에 대해 저자는 제조업체에 문의하고 제조업체 프로토콜을 참조할 것을 권장합니다.
중추신경계(CNS)는 광범위한 신경 아형(neuronal subtype)과 신경교세포(glial cell)를 포함하고 있으며, 이들 모두는 서로 다른 뇌 틈새에 존재하며 신경 기능에 기여하는 특정한 역할을 한다28. 이 광범위한 범위의 맥락에서 이 모델은 가장 풍부한 두 가지 세포 유형(성상교세포와 흥분성 글루타민성 뉴런)만을 나타냅니다. 미세아교세포(microglia), 희소돌기아교세포(oligodendrocyte) 및 혈액뇌장벽(blood-brain barrier-form) 내피세포와 같은 중요한 세포 유형은 이 시스템에서 생략됩니다. 미세아교세포의 포함은 신경면역 상호작용에 초점을 맞추는 것과 관련이 있을 수 있으며, 희소돌기아교세포는 중추 수초화에 영향을 미치는 질병에 관심이 있을 수 있습니다. 병리학에서의 역할 외에도 혈액-뇌 장벽 형성 내피 세포와 같은 세포는 약물 대사 효소를 분비하며, 이는 약동학 분석을 위한 이 모델의 사용에 영향을 미칠 수 있습니다29. 모델의 또 다른 한계는 성상교세포(astrocyte)와 뉴런(neuron)의 비율일 수 있다. 성상교세포(astrocyte)와 뉴런(neuron)의 비율은 뇌 부위에 따라 크게 다르며, 1:1에서 1:3 사이의 값이 제안된다30,31. 이 모델은 대략 1:1.5 성상교세포와 뉴런의 비율을 가지고 있습니다. 따라서, 이 모델은 성상교세포(astrocyte)가 더 풍부한 뇌 영역(예: 백질 영역(30))을 모델링하는 것과는 관련이 없을 수 있다.
최근 몇 년 동안 3D 바이오프린팅 공동 배양 모델을 개발하기 위한 다른 프로토콜이 발표되었습니다. Sullivan et al., 2021의 간행물에서는 iPSC 유래 신경 전구 세포를 사용하여 3D 바이오프린팅 신경 모델을 제시했으며, 이는 2D 배양에 비해 높은 인쇄 후 생존력과 신경 기능 향상을 보여줍니다32. 그러나, 이 프로토콜에서는 신경 전구 세포를 세포 공급원으로 사용하였고 4주 동안 배양하였다. 이 프로토콜에서는 상업적으로 이용 가능한 iPSC 유래 글루타민성 뉴런 및 성상세포를 사용했습니다. 이를 통해 공동 배양 세포의 3D 네트워크를 7일 이내에 구축할 수 있습니다. 신경돌기 성장 분석에서 입증된 바와 같이, 신경돌기 성장은 24시간 이내에 시작되어 세포 성장을 모니터링한 156시간 동안 선형 방식으로 계속됩니다. 이러한 네트워크의 빠른 구축은 부분적으로 NGN2의 최적화된 독시사이클린 유도 유전자 발현을 사용하는 글루타민성 뉴런의 사용에 기인할 수 있으며, 이는 2D 배양에서도 7일 이내에 성숙한 뉴런 아형 마커의 발현을 보여줍니다33. 이 기술을 사용하여 이러한 성장 기간을 단축하는 것은 분석 개발이 세포 모델15의 신속한 턴어라운드와 개발을 필요로 하기 때문에 바이오 제약 산업 내에서 모델을 구현하는 데 중요합니다.
결론적으로, 이 모델은 스크리닝 목적으로 빠르고 편리하게 확립된 뉴런 및 성상교세포의 3D 모델에 대한 가능성을 보여줍니다. 이 모델 유형의 향후 응용 분야는 환자 또는 유전자 편집 질환 iPSC 라인을 사용하여 다양한 질병으로 확장할 수 있는 기회와 함께 다양한 CNS 질환에 대한 약물 발견 노력에 사용될 수 있습니다. 또한, 독시사이클린 유도 NGN2 발현 iPSC 유래 글루타마테르성 뉴런을 사용하면 세포가 더 짧은 시간에 성숙할 수 있으며, 이는 신경 퇴행 연구를 위한 노화 뇌 모델 개발에 활용될 수 있습니다. 이 시스템은 또한 미세아교세포(microglia)와 희소돌기아교세포(oligodendrocyte)를 포함한 공동 배양에서 추가 세포 유형을 사용하여 확장될 수 있습니다.
공개
CW, NC 및 JB는 영국 런던에 소재한 Merck Sharp & Dohme (UK) Limited의 직원입니다. YH는 Merck & Co., Inc., Rahway, NJ, USA의 자회사 인 Merck Sharp & Dohme LLC의 직원입니다.
그림 1은 Biorender.com 를 사용하여 만든 것입니다.
감사의 말
저자는 프로토콜 개발과 원고에 대한 피드백에 도움을 준 Alex Volkerling, Martin Engel 및 Rachel Bleach에게 감사의 뜻을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Thermofisher | 31350010 | |
| 384-well plate | PerkinElmer | 6057300 | |
| 96-well plate | PerkinElmer | 6055300 | |
| Activator fluid F299 | Inventia Life Science | N/A | |
| Activator fluid F3 | Inventia Life Science | N/A | |
| B27 (50x) minus Vit A | Thermofisher | 12587010 | |
| Bioink fluid F261 | Inventia Life Science | N/A | |
| Bioink fluid F32 | Inventia Life Science | N/A | |
| Doxycycline hyclate | Sigma Aldrich | D5207 | |
| GlutaMAX (100x) | Thermofisher | 35050061 | |
| Goat anti-mouse IgG H&L Alexa Fluor 647 | Abcam | ab150115 | |
| Goat anti-rabbit IgG H&L Alexa Fluor 488 | Abcam | ab150077 | |
| Hoechst | Abcam | ab228551 | |
| Human BDNF Recombinant Protein | Thermofisher | PHC7074 | |
| Human NT3 Recombinant Protein | Thermofisher | PHC7036 | |
| iCell Astrocytes | Fujifilm CDI | 1434 | |
| INCell Analyser 6500HS | Molecular Devices | N/A | high content imaging system |
| Incucyte S3 | Sartorius | N/A | |
| ioGlutamatergic Neurons (Large vial) | Bit.bio | e001 | |
| Laminin (1 mg/mL) | Sigma Aldrich | L2020 | |
| Live/dead kit (Calcein-AM, Ethidium homo-dimer-1) | Invitrogen | L3224 | |
| Mouse anti-BIII tubulin NL637 conjugated | R&D systems | SC024 | |
| Neurobasal media | Thermofisher | 21103049 | |
| Normal Donkey Serum | Abcam | ab7475 | |
| NucBlue Live (Hoechst 33342) | Thermofisher | R37605 | |
| Opti-MEM | Thermofisher | 11058021 | |
| Paraformaldehyde | Sigma Aldrich | P6148 | |
| PEI 50% in H2O | Sigma Aldrich | 181978 | |
| Pierce Borate Buffer 20x | Thermofisher | 28341 | |
| Prism | GraphPad | Data analysis software | |
| Rabbit anti-ionotropic glutamatre receptor 2 (GluR2) | Abcam | ab206293 | |
| RASTRUM(TM) Bioprinter | Inventia Life Science | N/A | Bioprinter |
| RASTRUM(TM) Bioprinter Cartridges | Inventia Life Science | N/A | Bioprinter Cartridges |
| RASTRUM(TM) Targeting plate | Inventia Life Science | N/A | Targeting plate |
| Rho kinase (ROCK) inhibitor | Abcam | ab120129 | |
| Sheep anti-GFAP NL493 conjugated | R&D systems | SC024 | |
| Signals Image Artist | PerkinElmer | N/A | Image analysis platform |
| Triton X-100 | Thermofisher | HFH10 | |
| Zeiss Axio Observer | Zeiss | N/A | Inverted microscope platform |
참고문헌
- Jung, Y. L., Hwang, J., Yoo, H. S. Disease burden metrics the innovations of leading pharmaceutical companies: a global and regional comparative study. Globalization and Health. 16 (1), 80-80 (2020).
- Potkin, S. G., et al. The neurobiology of treatment-resistant schizophrenia: paths to antipsychotic resistance and a roadmap for future research. npj Schizophrenia. 6, 1(2020).
- Keswani, C., et al. The Global Economic Impact of Neurodegenerative Diseases: Opportunities and Challenges. Bioeconomy for Sustainable Development. , Springer, Singapore. (2019).
- Perucca, E. The pharmacological treatment of epilepsy: recent advances and future perspectives. Acta Epileptologica. 3 (1), 22(2021).
- Nikolakopoulou, P., et al. Recent progress in translational engineered in vitro models of the central nervous system. Brain. 143 (11), 3181-3213 (2020).
- Whitehouse, C., Corbett, N., Brownlees, J. 3D models of neurodegeneration: implementation in drug discovery. Trends in Pharmacological Sciences. 44 (4), 208-221 (2023).
- Rauti, R., Renous, N., Maoz, B. M. Mimicking the brain extracellular matrix in vitro: A review of current methodologies and challenges. Israel Journal of Chemistry. 60 (12), 1141-1151 (2020).
- Fawcett, J. W., Oohashi, T., Pizzorusso, T. The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature Reviews Neuroscience. 20 (8), 451-465 (2019).
- Lam, D., et al. Tissue-specific extracellular matrix accelerates the formation of neural networks and communities in a neuron-glia co-culture on a multi-electrode array. Scientific Reports. 9, 4159(2019).
- Roll, L., Lessmann, K., Brüstle, O., Faissner, A. Cerebral organoids maintain the expression of neural stem cell-associated glycoepitopes and extracellular matrix. Cells. 11 (5), 760(2022).
- Yan, Y., Bejoy, J., Marzano, M., Li, Y. The use of pluripotent stem cell-derived organoids to study extracellular matrix development during neural degeneration. Cells. 8 (3), 242(2019).
- Ma, L., et al. 3D bioprinted hyaluronic acid-based cell-laden scaffold for brain microenvironment simulation. Bio-Design and Manufacturing. 3 (3), 164-174 (2020).
- Liaw, C. -Y., Ji, S., Guvendiren, M. Engineering 3D hydrogels for personalized in vitro human tissue models. Advanced Healthcare Materials. 7 (4), 1701165(2018).
- Ma, J., Huang, C. Composition and mechanism of three-dimensional hydrogel system in regulating stem cell fate. Tissue Engineering Part B: Reviews. 26 (6), 498-518 (2020).
- Belfiore, L., et al. Generation and analysis of 3D cell culture models for drug discovery. European Journal of Pharmaceutical Sciences. 163, 105876(2021).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Engel, M., Belfiore, L., Aghaei, B., Sutija, M. Enabling high throughput drug discovery in 3D cell cultures through a novel bioprinting workflow. SLAS Technology. 27 (1), 32-38 (2022).
- Takamura, T., et al. Influence of age on global and regional brain stiffness in young and middle-aged adults. Journal of Magnetic Resonance Imaging. 51 (3), 727-733 (2020).
- Slanzi, A., Iannoto, G., Rossi, B., Zenaro, E., Constantin, G. In vitro models of neurodegenerative diseases. Frontiers in Cell and Developmental Biology. 8, 328(2020).
- de Souza, N. Organoid variability examined. Nature Methods. 14 (7), 655-655 (2017).
- Hernández, D., et al. Culture variabilities of human iPSC-derived cerebral organoids are a major issue for the modelling of phenotypes observed in Alzheimer's disease. Stem Cell Review and Reports. 18 (2), 718-731 (2022).
- Li, R., et al. Differentiation of human iPS cells into sensory neurons exhibits developmental stage-specific cryopreservation challenges. Frontiers in Cell and Developmental Biology. 9, 796960(2021).
- Nishiyama, Y., et al. Safe and efficient method for cryopreservation of human induced pluripotent stem cell-derived neural stem and progenitor cells by a programmed freezer with a magnetic field. Neuroscience Research. 107, 20-29 (2016).
- Uhrig, M., Ezquer, F., Ezquer, M. Improving cell recovery: Freezing and thawing optimization of induced pluripotent stem cells. Cells. 11 (5), 799(2022).
- Harbom, L. J., et al. The effect of rho kinase inhibition on morphological and electrophysiological maturity in iPSC-derived neurons. Cell and Tissue Research. 375 (3), 641-654 (2019).
- Koh, H. S., Yong, T., Chan, C. K., Ramakrishna, S. Enhancement of neurite outgrowth using nano-structured scaffolds coupled with laminin. Biomaterials. 29 (26), 3574-3582 (2008).
- Tarus, D., et al. Design of hyaluronic acid hydrogels to promote neurite outgrowth in three dimensions. ACS Applied Materials & Interfaces. 8 (38), 25051-25059 (2016).
- Brain Initiative Cell Census Network (BICCN). Initiative Cell Census Network (BICCN). A multimodal cell census and atlas of the mammalian primary motor cortex. Nature. 598 (7879), 86-102 (2021).
- Dauchy, S., et al. Expression and transcriptional regulation of ABC transporters and cytochromes P450 in hCMEC/D3 human cerebral microvascular endothelial cells. Biochemical Pharmacology. 77 (5), 897-909 (2009).
- Herculano-Houzel, S. The glia/neuron ratio: How it varies uniformly across brain structures and species and what that means for brain physiology and evolution. Glia. 62 (9), 1377-1391 (2014).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Sullivan, M. A., et al. 3D bioprinting of stem cell-derived central nervous system cells enables astrocyte growth, vasculogenesis and enhances neural differentiation/function. bioRxiv. , (2022).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).
Erratum
Formal Correction: Erratum: Three-Dimensional Bioprinting of Human iPSC-Derived Neuron-Astrocyte Cocultures for Screening Applications
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for: Three-Dimensional Bioprinting of Human iPSC-Derived Neuron-Astrocyte Cocultures for Screening Applications. The Authors section was updated from:
Chloe Ann Whitehouse1
Yufang He2
Janet Brownlees1
Nicola Corbett1
1MSD R&D Innovation Centre Ltd
2Merck & Co., Inc.
to:
Chloe Ann Whitehouse1
Yufang He2
Janet Brownlees1
Nicola Corbett1
1MSD Research Laboratories, London, UK
2Merck & Co., Inc., Rahway, NJ, USA
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유