A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تسريب عديد السكاريد الشحمي كنموذج صدمة للسموم الداخلية للخنزير
In This Article
Summary
نحن نقدم بروتوكولا لنموذج صدمة التسمم الداخلي التجريبي في الخنازير عن طريق ضخ عديد السكاريد الدهني.
Abstract
كثيرا ما تصادف الإنتان والصدمة الإنتانية في المرضى الذين يعالجون في وحدات العناية المركزة (ICUs) وهي من بين الأسباب الرئيسية للوفاة لدى هؤلاء المرضى. وهو ناتج عن استجابة مناعية غير منظمة للعدوى. حتى مع العلاج الأمثل ، تظل معدلات الوفيات مرتفعة ، مما يجعل المزيد من الأفكار حول الفيزيولوجيا المرضية وخيارات العلاج الجديدة ضرورية. عديد السكاريد الشحمي (LPS) هو أحد مكونات غشاء الخلية للبكتيريا سالبة الجرام ، والتي غالبا ما تكون مسؤولة عن العدوى التي تسبب الإنتان والصدمة الإنتانية.
إن شدة الإنتان والصدمة الإنتانية وارتفاع معدل الوفيات فيها تجعل الدراسات التجريبية الموحدة في البشر مستحيلة. وبالتالي ، هناك حاجة إلى نموذج حيواني لمزيد من الدراسات. الخنزير مناسب بشكل خاص لهذا الغرض لأنه يشبه البشر إلى حد كبير في علم التشريح وعلم وظائف الأعضاء والحجم.
يوفر هذا البروتوكول نموذجا تجريبيا لصدمة التسمم الداخلي في الخنازير عن طريق ضخ LPS. تمكنا من إحداث تغييرات موثوقة لوحظت بشكل متكرر في مرضى الصدمة الإنتانية ، بما في ذلك عدم استقرار الدورة الدموية وفشل الجهاز التنفسي والحماض. سيسمح ذلك للباحثين باكتساب نظرة ثاقبة قيمة حول هذه الحالة ذات الصلة للغاية وتقييم الأساليب العلاجية الجديدة في بيئة تجريبية.
Introduction
يصنف الإنتان والصدمة الإنتانية من بين الأسباب الرئيسية للوفيات في المرضى الذين يتلقون علاج العناية المركزة1،2،3. ينشأ الإنتان عندما تؤدي العدوى إلى استجابة مناعية غير منظمة مما يؤدي إلى فشل متعدد الأعضاء. يتميز بأعراض تهدد الحياة ، بما في ذلك عدم استقرار الدورة الدموية ، وضيق التنفس ، والفشل الكبدي والكلوي ، وكذلك الضعف الإدراكي 4,5. تمثل الصدمة الإنتانية مجموعة فرعية من الإنتان مع أعراض حادة بشكل خاص تزيد بشكل كبير من معدل الوفيات. تشمل هذه الأعراض انخفاض ضغط الدم المستمر الذي يتطلب علاجا بخافض للأوعية ومستوى لاكتات المصل يتجاوز 2 مليمول ∙L-1 4,5. قدرت معدلات الوفيات في المرضى الذين يعانون من الصدمة الإنتانية بنسبة تصل إلى 40٪ ، حتى مع العلاج في المستشفى1،3،5.
غالبا ما تسبب البكتيريا سالبة الجرام ، مثل Pseudomonas و Escherichia coli ، التهابات تؤدي إلى هذه الاستجابة المناعية غير المنظمة4. الآليات الفيزيولوجية المرضية الأساسية معقدة وغير مفهومة تماما بعد. يتضمن أحد الجوانب الموصوفة جيدا تنشيط المستقبلات الشبيهة بالحصيلة على الخلايا المناعية بواسطة الأنماط الجزيئية المرتبطة بمسببات الأمراض (PAMPs) ، مما يؤدي إلى إطلاق السيتوكينات مثل عامل نخر الورم ألفا (TNFα) أو Interleukin 1 (IL 1) 4. أحد هذه PAMPs هو عديد السكاريد الدهني (LPS) ، والذي يشكل مكونا من غشاء الخلية في البكتيريا سالبةالجرام 6. تم استخدام LPS في النماذج الحيوانية للحث على التسمم الداخلي وصدمة التسمم الداخلي 7,8.
توفر النماذج الحيوانية بيئة خاضعة للرقابة وموحدة لتطوير استراتيجيات العلاج الجديدة والتحقيق فيها. نظرا لتشريحه المماثل ، وعلم وظائف الأعضاء المناعي ، ومعلمات الدورة الدموية المماثلة ، فإن نموذج الخنزير مناسب بشكل خاص لدراسة آثار صدمة التسمم الداخلي 9,10. علاوة على ذلك ، يمكن تطبيق المعدات الطبية القياسية المستخدمة بشكل شائع في المرضى من البشر بسهولة في الخنازير نظرا لالحجم المماثل للممرات الهوائية والأوعية الدموية ، مما يسهل الأجهزة ومراقبة الدورة الدموية.
باستخدام هذا البروتوكول ، نقدم نموذجا تجريبيا لصدمة التسمم الداخلي في الخنازير عن طريق حقن LPS المشتق من الإشريكية القولونية عن طريق الوريد. لمراقبة الآثار ، قمنا بقياس المعلمات الديناميكية الدموية والرئوية ، بما في ذلك ضغط الدم الشرياني ومعدل ضربات القلب وتشبع الأكسجين المحيطي والضغط الشرياني الرئوي وضغط مجرى الهواء. لتقييم تأثير التسمم الداخلي على إمدادات الأكسجين الدماغي ، استخدمنا قياس الطيف القريب من الأشعة تحت الحمراء (NIRS). باستخدام هذه الطريقة ، يمكن تقييم تشبع الأكسجين الدماغي عبر قطب كهربائي لاصق مطبق على الجبهة11.
Protocol
تمت الموافقة على التجارب في هذا البروتوكول من قبل لجنة رعاية الحكومية والمؤسسية (Landesuntersuchungsamt Rheinland-Pfalz ، كوبلنز ، ألمانيا ، TVA G21-1-080). أجريت التجارب وفقا لإرشادات ARRIVE. في هذه الدراسة ، تم استخدام ستة خنازير ألمانية سليمة تتراوح أعمارهم بين 2-3 أشهر ووزنها 30-35 كجم. يلخص الشكل 1 الجدول الزمني التجريبي . التفاصيل المتعلقة بجميع المواد والأدوات المستخدمة في هذا البروتوكول مدرجة في جدول المواد.
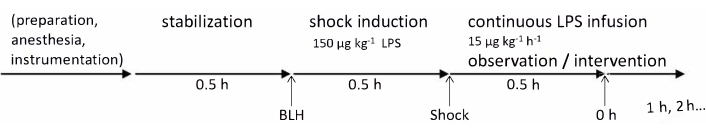
الشكل 1: الجدول الزمني التجريبي. تم أخذ القياسات الصحية الأساسية بعد تحضير وفترة استقرار مدتها 30 دقيقة. تم إحداث التسمم الداخلي عن طريق حقن LPS على مدى 30 دقيقة وتم أخذ قياسات 0 ساعة بعد 30 دقيقة أخرى. بعد ذلك ، استمرت القياسات بالساعة لمدة 4 ساعات. الاختصارات: BLH = خط الأساس صحي. LPS = عديد السكاريد الشحمي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. إعداد
- احتفظ بالحيوانات في بيئتها المعتادة لأطول فترة ممكنة لتقليل التوتر. حجب الطعام لمدة 6 ساعات قبل إعطاء التخدير ، مع السماح بحرية الوصول إلى الماء.
- قم بتخدير بالحقن العضلي للأزابيرون (3 مجم -1) والميدازولام (0.5 مجم كجم -1) بينما لا تزال في بيئتها الطبيعية.
- بمجرد أن يصبح التخدير ساري المفعول ، والذي يحدث عادة في غضون 15-20 دقيقة تقريبا بعد تناوله ، انقل الخنازير إلى المختبر.
ملاحظة: من الأهمية بمكان ضمان الحفاظ على التخدير المستمر طوال فترة النقل. اعتمادا على الهيئة التشريعية الإقليمية ، قد يتطلب ذلك الإشراف الدائم على طبيب بيطري. - انتبه جيدا للحفاظ على درجة حرارة الجسم الطبيعية للخنازير (~ 38 درجة مئوية) أثناء النقل. على سبيل المثال ، ضع في اعتبارك تغطية ببطانية لمنع انخفاض حرارة الجسم.
ملاحظة: من المهم تحديد وقت النقل بحيث لا يتجاوز مدة التخدير ، والتي تتراوح عادة من 30 دقيقة إلى 60 دقيقة. - بعد التطهير ، قم بإنشاء مدخل عن طريق الوريد عن طريق إدخال قسطرة 22 G في الوريد الأذني. قبل الشروع في أي حركة أخرى للخنزير أو تحريض التخدير ، تأكد من تثبيت القسطرة بإحكام لمنع الخلع بسبب أي حركات مفاجئة.
- راقب باستمرار تشبع الأكسجين المحيطي باستخدام مستشعر مثبت على الذيل أو الأذن.
2. التخدير والتهوية الميكانيكية
- تطبيق الفنتانيل الوريدي (4 ميكروغرام كغ-1) والبروبوفول (3 ملغ كغ-1) للحث على التخدير.
- ضع الخنزير في وضع ضعيف.
- تطبيق الأتراكوريوم (0.5 ملغ كجم -1) كمرخي للعضلات والبدء فورا في التهوية غير الغازية باستخدام قناع تهوية للكلاب. ضع القناع فوق الخطم واضغط بقوة بالإبهام أثناء سحب الفك السفلي للأمام باستخدام الإصبع الأوسط / البنصر. اضبط جهاز التنفس الصناعي على المعلمات التالية: جزء الأكسجين الشهيقي (FiO2 ) = 100٪ ، حجم المد والجزر = 6-8 مل كجم -1 ، ضغط الزفير الإيجابي (PEEP) = 5 ملي بار ، ذروة ضغط الشهيق ≤ 20 ملي بار ، معدل التنفس = 18-20 دقيقة -1.
- الحفاظ على التخدير عن طريق الشروع في التسريب المستمر لمحلول إلكتروليت متوازن (5 مل كجم -1 ح-1) ، فنتانيل (10 ميكروغرام كجم -1 ح-1) ، وبروبوفول (6 ملغ كجم -1 ح-1).
- إجراء التنبيب الرغامي باستخدام أنبوب القصبة الهوائية القياسي (ID 6-7 مم) ، وسلك توجيه ، ومنظار الحنجرة المجهز بشفرة Macintosh (الحجم 4).
- اطلب من مساعد فتح الفم وأمسك اللسان على الجانب الأيسر.
- أدخل شفرة ماكنتوش حتى يصبح لسان المزمار مرئيا. ثم ارفع منظار الحنجرة لأعلى لتحريك لسان المزمار بطنيا وتصور الحبال الصوتية. في بعض الأحيان ، قد يلتصق لسان المزمار بالحنك الرخو. في هذه الحالة ، قم بتعبئتها عن طريق التمرير برفق جانبيا باستخدام الأنبوب أو البوجي.
- أدخل بعناية أنبوب القصبة الهوائية من خلال الحبال الصوتية وإزالة المحفز. إذا واجهت صعوبة ، فحاول تدوير الأنبوب دون استخدام القوة المفرطة. إذا لزم الأمر ، استخدم أنبوبا أصغر. بمجرد وضع الأنبوب في مكانه ، قم بنفخ الكفة ب 10 مل من الهواء.
- قم بتوصيل الأنبوب الرغامي بجهاز التنفس الصناعي وابدأ التهوية. تأكد من وضع الأنبوب المناسب عن طريق الكشف عن ثاني أكسيد الكربون2 الزفيري النهائي وإجراء التسمع الثنائي. استخدم إعدادات التهوية التالية: FiO2 = 40٪ ، حجم المد والجزر = 6-8 مل كجم -1 ، PEEP = 5 ملي بار ، نسبة الإلهام إلى انتهاء الصلاحية = 1: 2 ، معدل التنفس = معدل المعدل لتحقيق مستوى CO2 في نهاية المد والجزر من <45 مم زئبق ، عادة 30-40 دقيقة -1 .
ملاحظة: إذا تم وضع الأنبوب بشكل غير صحيح في المريء ، فسوف ينفخ الهواء المعدة ، مما يتسبب في انتفاخ مرئي. في مثل هذه الحالات ، قم بإزالة الأنبوب على الفور ، وإدارة التهوية غير الغازية لمدة 1-2 دقيقة ، وإعادة وضع الأنبوب بشكل صحيح. - أدخل أنبوبا معديا لمنع الارتجاع أو القيء. إذا ثبت أن الإدخال يمثل تحديا، فاستخدم منظار الحنجرة للحصول على رؤية أفضل لمدخل المريء.
3. الأجهزة
- ضع خطا شريانيا ووريديا مركزيا في الشريان الفخذي والوريد ، على التوالي ، لمراقبة الدورة الدموية والعلاج بالحجم الوريدي.
- استخدم الضمادات لسحب وتأمين الساقين الخلفيتين ، مما يوفر وصولا أفضل إلى الأوعية الفخذية.
- قم بإعداد جميع المواد اللازمة قبل الأجهزة. املأ جميع القسطرة بمحلول ملحي وتأكد من سهولة الوصول إلى الأسلاك والقسطرة لتقليل الحاجة إلى محاولات قسطرة متعددة وفقدان الدم غير الضروري.
- ضع مطهرا كحوليا على المنطقة الأربية وامسحها بمسحة معقمة. كرر هذه العملية مرتين. ضع المطهر مرة أخرى دون مسح وانتظر لمدة 3 دقائق. ضع ثنى معقم على المنطقة الأربية.
- استخدم الموجات فوق الصوتية لتحديد الأوعية الدموية الفخذية. استخدم تقنية Seldinger الموجهة بالموجات فوق الصوتية داخل الطائرة للقسطرة لتقليل تلف الأنسجة وفقدان الدم.
- تصور الشريان الفخذي طوليا. ثقب الشريان مع حقنة تعلق على الإبرة للطموح المستمر. أحمر مشرق ، الدم النابض يؤكد ثقب الشرايين. أخرج المحقنة وأدخل السلك المحضر. قم بإزالة الإبرة مع ترك السلك في مكانه.
- كرر نفس الإجراء للوريد الفخذي. يتم تأكيد البزل الوريدي عن طريق الدم الأحمر الداكن بطيء التدفق.
- تأكد من الموضع الصحيح لكلا السلكين من خلال تصور كلا الأوعية الفخذية باستخدام الموجات فوق الصوتية.
- استخدم تقنية Seldinger لإدخال غمد المدخل الشرياني أولا ، متبوعا بغمد الإدخال الوريدي. تأكيد الوضع المناسب من خلال تحليل غازات الدم لعينات الدم المسحوبة من الخطين.
- تأكد من إمكانية استنشاق الدم من جميع الخطوط. اغسل جميع الخطوط بمحلول ملحي لمنع تكوين الجلطة.
- ثبت الخطوط على الجلد بإحكام باستخدام الغرز الجراحية لمنع الخلع.
- قم بتوصيل الخطوط الوريدية الشريانية والمركزية بمحولات الطاقة لقياس معلمات الدورة الدموية.
- أدخل قسطرة نبض القلب (PiCCO) في غلاف الإدخال الشرياني وقم بتوصيله بمحول الضغط الشرياني وكابل واجهة درجة الحرارة لجهاز PiCCO.
- قم بتوصيل قسطرة Swan-Ganz بمحول الطاقة.
- أثناء قياس الضغط باستمرار ، أدخل القسطرة في غلاف الإدخال الوريدي المركزي. نفخ البالون بعد حوالي 30 سم ، عندما يصبح منحنى الضغط الوريدي المركزي مرئيا.
- تقدم القسطرة ببطء أثناء مراقبة منحنى الضغط. عندما تدخل القسطرة إلى البطين الأيمن ، ابحث عن منحنى نبضي ذو قيمة انقباضية عالية ومنخفضة الانبساطي. سيؤدي المزيد من التقدم في القسطرة إلى قيمة انقباضية ثابتة وزيادة القيمة الانبساطية ، مما يشير إلى وضعها في الشريان الرئوي.
- ثبت القسطرة في هذا الوضع (عادة بين 50 و 70 سم). قم بتوصيل مستشعر درجة حرارة الحقن لنظام PiCCO بالتجويف القريب لقسطرة Swan-Ganz.
- احلق جبين الخنزير وضع قطب المستشعر اللاصق لقياس تشبع الأكسجين الإقليمي الدماغي.
- بعد تحريض التخدير والأجهزة ، اسمح للحيوان بالاستقرار لمدة 30 دقيقة أو حتى تستقر معلمات الدورة الدموية قبل إجراء قياسات خط الأساس وإحداث صدمة التسمم الداخلي.
4. صدمة التعريفي
ملاحظة: عند العمل مع LPS ، ارتد دائما قفازات ونظارات واقية وقناعا ومعطفا للمختبر. تجنب الاتصال المباشر مع LPS.
- تحضير محلول LPS بتركيز 100 ميكروغرام mL-1 عن طريق إذابة 5 ملغ من LPS في 50 مل من 0.9 ٪ كلوريد الصوديوم.
- احصل على قياسات الدورة الدموية الأساسية مباشرة قبل بدء ضخ LPS.
- تطبيق جرعة 150 ميكروغرام كغ-1 من LPS خلال 30 دقيقة (أي ما يعادل معدل تسريب مستمر يبلغ 300 ميكروغرام كغ-1∙h-1 لمدة 30 دقيقة).
- بعد 30 دقيقة ، قلل معدل التسريب إلى 15 ميكروغرام ∙ كجم -1∙ ساعة -1 لبقية التجربة.
- مراقبة المعلمات الدورة الدموية باستمرار ، بما في ذلك ضغط الدم الشرياني الشرياني والرئوي ، ومعدل ضربات القلب ، ومعلمات التهوية. مراقبة درجة حرارة الجسم باستمرار للحفاظ على الحرارة الطبيعية.
5. علاج عدم استقرار الدورة الدموية
- عندما ينخفض متوسط ضغط الدم الشرياني إلى أقل من 60 مم زئبق ، استخدم PiCCO لقياس مؤشر القلب (CI) ، ومؤشر الحجم الانبساطي العالمي (GEDI) ، ومؤشر ماء الرئة خارج الأوعية الدموية (ELWI). عالج انخفاض ضغط الدم وفقا للتوصيات الواردة في مخطط التدفق في الشكل 2.
- على شاشة PiCCO ، اضغط على زر التخفيف الحراري (TD).
- اضغط على زر إدخال الضغط الوريدي المركزي (CVP) وأدخل قيمة CVP الحالية.
- اضغط على زر البدء .
- عند طلب منك القيام بذلك ، قم بحقن 10 مل من محلول ملحي بارد في مستشعر درجة حرارة الحقن المتصل بقسطرة Swan-Ganz.
ملاحظة: لا تحقن أي شيء آخر مباشرة قبل أو أثناء قياس PiCCO لأن هذا من شأنه أن يضر بالقياس.
- بعد الحصول على قياسات CI و GEDI و ELWI ، عالج عدم استقرار الدورة الدموية وفقا لمخطط التدفق في الشكل 2. إذا كان يوصى بتحميل الحجم ، فقم بضخ 200 مل من محلول الإلكتروليت المتوازن بسرعة. إذا كان العلاج بالكاتيكولامين موصى به ، فقم بزيادة معدل ضخ النورإبينفرين بمقدار 1 ميكروغرام كجم -1 ساعة -1.
- كرر هذه العملية كلما انخفض متوسط ضغط الدم الشرياني إلى أقل من 60 مم زئبق. في حالة عدم استقرار الدورة الدموية الشديد ، اختر التصعيد السريع للعلاج.
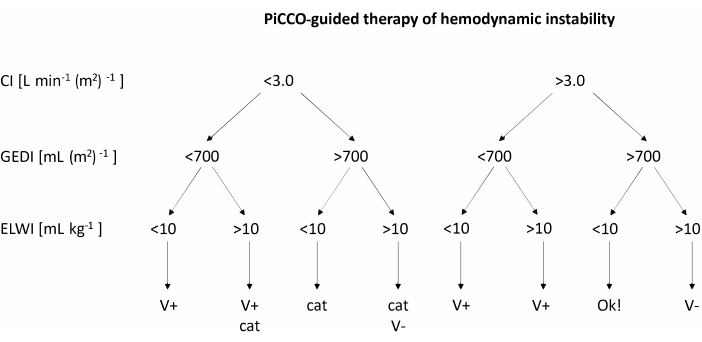
الشكل 2: العلاج الموجه ب PiCCO لعدم استقرار الدورة الدموية. بعد الحصول على قياسات CI و GEDI و ELWI ، قم بتطبيق العلاج وفقا للرسم البياني. تم تكييف هذا الرقم من دليل مستخدم PiCCO12. الاختصارات: PiCCO = نبض كفاف النتاج القلبي. V + = تحميل الحجم ؛ القط = العلاج الكاتيكولامين. V- = تخفيض الحجم ؛ CI = مؤشر القلب. GEDI = مؤشر حجم نهاية الانبساطي العالمي ؛ ELWI = مؤشر مياه الرئة خارج الأوعية الدموية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. نهاية التجربة والقتل الرحيم
- حقن 0.5 ملغ من الفنتانيل عن طريق الوريد. انتظر 5 دقائق. حقن 200 ملغ من البروبوفول.
- القتل الرحيم للخنزير بحقن سريع قدره 40 مل من كلوريد البوتاسيوم 1 متر عبر الخط الوريدي المركزي.
النتائج
في هذه الدراسة ، تم تخدير ستة خنازير ذكور سليمة تتراوح أعمارهم بين 2-3 أشهر ووزنها 30-35 كجم وتلقوا ضخ عديد السكاريد الدهني (LPS) للحث على تسمم الدم الداخلي. لتحديد الجرعة المناسبة من LPS المطلوبة للحث باستمرار على أعراض الصدمة ، تم إعطاء الخنازير جرعات تحريضية مختلفة من LPS تتراوح من 100 ميكروغرام
Discussion
نقدم بروتوكولا لإحداث تسمم داخلي تجريبي في الخنازير من خلال ضخ LPS ، بهدف إحداث تغييرات موثوقة شائعة في الإنتان والصدمة الإنتانية. يجب النظر في العديد من الخطوات الحاسمة في هذا البروتوكول. يعد التخدير الكافي للخنازير قبل النقل أمرا بالغ الأهمية لمنع ارتفاع مستويات الكاتيكولامين الناجم عن ...
Disclosures
تم توفير جهاز NIRS دون قيد أو شرط من قبل Medtronic PLC ، الولايات المتحدة الأمريكية ، لأغراض البحث التجريبي. تلقى ألكسندر زيبارت رسوم محاضرة من شركة ميدترونيك PLC. لم يبلغ أي من المؤلفين عن أي تضارب في المصالح المالية أو غيرها. تم تدقيق المخطوطة وتحريرها بواسطة ChatGPT® (برنامج Python ، الإصدار: 24 مايو 2023).
Acknowledgements
يود المؤلفون أن يشكروا داغمار ديرفونسكيس على دعمها الفني الممتاز.
Materials
| Name | Company | Catalog Number | Comments |
| Atracurium Hikma 50 mg/5mL | Hikma Pharma GmbH, Martinsried | ||
| Azaperone (Stresnil) 40 mg/mL | Lilly Deutschland GmbH, Bad Homburg, Germany | ||
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy, AB Helsingborg, Schweden | 3-way-stopcock | |
| Curafix i.v. classics | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Cannula retention dressing | |
| Datex Ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | hemodynamic monitor | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland, GmbH | perfusor line | |
| Intrafix Primeline | B. Braun Melsungen AG, Melsungen, Germany | Infusion line | |
| Introducer sheath 5 Fr. | Terumo Healthcare | arterial introducer | |
| INVOS | Medtronic, Dublin, Ireland | near infrared spectrometry | |
| JOZA Einmal Nitril Untersuchungshandschuhe | JOZA, München, Germany | disposable gloves | |
| Laryngoscope, 45.48.50, KL 2000 | Medicon | Laryngoscope handle | |
| Littmann Classic III Stethoscope | 3M Deutschland GmbH, Neuss, Germany | stethoscope | |
| LPS (E. coli; Serotype O111:B4) | Sigma-Aldrich, Switzerland | ||
| MAC Two-Lumen Central venous access set | Arrow international inc. Reading, PA, USA | venous introducer | |
| Maimed Vlieskompresse | Maimed GmbH, Neuenkirchen, Germany | Fleece compress to fix the tongue | |
| Masimo LNCS Adtx SpO2 sensor | Masimo Corporation Irvine, Ca 92618 USA | saturation clip for the tail | |
| Masimo LNCS TC-I SpO2 ear clip sensor | Masimo Corporation Irvine, Ca 92618 USA | Saturation clip for the ear | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Midazolam 15 mg/3 mL | B.Braun Melsungen AG, Germany | ||
| Midmark Canine Mask Small Plastic with Diaphragm FRSCM-0005 | Midmark Corp., Dayton, Ohio, USA | dog ventilation mask | |
| Monocryl surgical suture | Johnson & Johnson, Belgium | ||
| B.Braun Melsungen AG, Germany | saline solution | ||
| NaCl 0.9 % | Sanofi- Aventis, Seutschland GmbH | ||
| Octeniderm farblos | Schülke & Mayr GmbH, Nordenstedt, Germany | Alcoholic disinfectant | |
| Original Perfusor syringe 50 mL | B.Braun Melsungen AG, Germany | perfusor syringe | |
| PA-Katheter Swan Ganz 7.5 Fr 110 cm | Edwards Lifesciences LLC, Irvine CA, USA | Swan-Ganz catheter | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| PiCCO catheter | PULSION Medical Systems SE, Feldkirchen, DE | ||
| Potassium chloride 1 M | Fresenius, Kabi Germany GmbH | ||
| Propofol 2% 20 mg/mL (50 mL flasks) | Fresenius, Kabi Deutschland, GmbH | ||
| Pulse-contour continous cardiac output System PiCCO2 | PULSION Medical Systems SE, Feldkirchen, DE | ||
| Rüschelit Super Safety Clear >ID 6/6.5 /7.0 mm | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Sonosite Micromaxx Ultrasoundsystem | Sonosite Bothell, WA, USA | ultrasound | |
| Stainless Macintosh Größe 4 | Welch Allyn69604 | blade for laryngoscope | |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | Balanced electrolyte solution | |
| Vasco OP sensitive | B.Braun Melsungen AG, Germany | sterile gloves | |
| Vasofix Safety 22 G-16 G | B.Braun Melsungen AG, Germany | venous catheter | |
| VBM Cuff Manometer | VBM Medizintechnik GmbH, Sulz a.N., Germany | cuff pressure gauge |
References
- Vincent, J. -. L., Jones, G., David, S., Olariu, E., Cadwell, K. K. Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis. Critical Care. 23 (1), 196 (2019).
- Reinhart, K., et al. Recognizing sepsis as a Global Health Priority - A WHO Resolution. New England Journal of Medicine. 377 (5), 414-417 (2017).
- Cecconi, M., Evans, L., Levy, M., Rhodes, A. Sepsis and septic shock. The Lancet. 392 (10141), 75-87 (2018).
- Font, M. D., Thyagarajan, B., Khanna, A. K. Sepsis and septic shock - basics of diagnosis, pathophysiology and clinical decision making. Medical Clinics of North America. 104 (4), 573-585 (2020).
- Singer, M., et al. The Third International Consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 315 (8), 801 (2016).
- Jerala, R. Structural biology of the LPS recognition. International Journal of Medical Microbiology. 297 (5), 353-363 (2007).
- Copeland, S., Warren, H. S., Lowry, S. F., Calvano, S. E., Remick, D. Inflammation and the host response to injury investigators acute inflammatory response to endotoxin in mice and humans. Clinical and Diagnostic Laboratory Immunology. 12 (1), 60-67 (2005).
- Dickson, K., Lehmann, C. Inflammatory response to different toxins in experimental sepsis models. International Journal of Molecular Sciences. 20 (18), 4341 (2019).
- Bassols, A., Costa, C., Eckersall, P. D., Osada, J., Sabrià, J., Tibau, J. The pig as an animal model for human pathologies: A proteomics perspective. PROTEOMICS - Clinical Applications. 8 (9-10), 715-731 (2014).
- Meurens, F., Summerfield, A., Nauwynck, H., Saif, L., Gerdts, V. The pig: a model for human infectious diseases. Trends in Microbiology. 20 (1), 50-57 (2012).
- Ali, J., Cody, J., Maldonado, Y., Ramakrishna, H. Near-infrared spectroscopy (NIRS) for cerebral and tissue oximetry: analysis of evolving applications. Journal of Cardiothoracic and Vascular Anesthesia. 36, 2758-2766 (2022).
- . Getinge Deutschland GmbH PiCCO Technologie Erweitertes hämodynamisches Monitoring auf höchstem Niveau Available from: https://www.getinge.com/dam/hospital/documents/german/picco_haemodynamisches_monitoring_broschuere-de-non_us.pdf (2023)
- Breslow, M. J., Miller, C. F., Parker, S. D., Walman, A. T., Traystman, R. J. Effect of vasopressors on organ blood flow during endotoxin shock in pigs. American Journal of Physiology-Heart and Circulatory Physiology. 252 (2), H291-H300 (1987).
- Fink, M. P., et al. Systemic and mesenteric O2 metabolism in endotoxic pigs: effect of ibuprofen and meclofenamate. Journal of Applied Physiology. 67 (5), 1950-1957 (1989).
- Lado-Abeal, J., et al. Lipopolysaccharide (LPS)-induced septic shock causes profound changes in myocardial energy metabolites in pigs. Metabolomics. 14 (10), 131 (2018).
- Park, I., et al. Characterization of fecal peritonitis-induced sepsis in a porcine model. The Journal of Surgical Research. 244, 492-501 (2019).
- Jarkovska, D., et al. Heart rate variability in porcine progressive peritonitis-induced sepsis. Frontiers in Physiology. 6, 412 (2015).
- Kohoutova, M., et al. Vagus nerve stimulation attenuates multiple organ dysfunction in resuscitated porcine progressive sepsis. Critical Care Medicine. 47 (6), e461-e469 (2019).
- Vintrych, P., et al. Modeling sepsis, with a special focus on large animal models of porcine peritonitis and bacteremia. Frontiers in Physiology. 13, 1094199 (2022).
- Stengl, M., et al. Reduced L-type calcium current in ventricular myocytes from pigs with hyperdynamic septic shock. Critical Care Medicine. 38 (2), 579-587 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved