Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Domuz Endotoksemik Şok Modeli Olarak Lipopolisakkarit İnfüzyonu
Bu Makalede
Özet
Lipopolisakkarit infüzyonu ile domuzlarda deneysel bir endotoksemik şok modeli için bir protokol sunuyoruz.
Özet
Sepsis ve septik şok, yoğun bakım ünitelerinde (YBÜ) tedavi gören hastalarda sıklıkla karşılaşılır ve bu hastalarda önde gelen ölüm nedenleri arasındadır. Bir enfeksiyona karşı düzensiz bir bağışıklık tepkisinden kaynaklanır. Optimize edilmiş tedavi ile bile, mortalite oranları yüksek kalmaktadır, bu da patofizyoloji ve yeni tedavi seçenekleri hakkında daha fazla bilgi sahibi olmayı gerekli kılmaktadır. Lipopolisakkarit (LPS), genellikle sepsis ve septik şoka neden olan enfeksiyonlardan sorumlu olan gram negatif bakterilerin hücre zarının bir bileşenidir.
Sepsis ve septik şokun şiddeti ve yüksek mortalitesi, insanlarda standardize edilmiş deneysel çalışmaları imkansız kılmaktadır. Bu nedenle, daha ileri çalışmalar için bir hayvan modeline ihtiyaç vardır. Domuz, anatomi, fizyoloji ve boyut olarak insanlara çok benzediği için bu amaç için özellikle uygundur.
Bu protokol, LPS infüzyonu ile domuzlarda endotoksemik şok için deneysel bir model sağlar. Hemodinamik instabilite, solunum yetmezliği ve asidoz dahil olmak üzere septik şok hastalarında sıklıkla gözlenen değişiklikleri güvenilir bir şekilde indükleyebildik. Bu, araştırmacıların bu son derece ilgili durum hakkında değerli bilgiler edinmelerini ve deneysel bir ortamda yeni terapötik yaklaşımları değerlendirmelerini sağlayacaktır.
Giriş
Sepsis ve septik şok, yoğun bakım tedavisi alan hastalarda önde gelen mortalite nedenleri arasında yer almaktadır 1,2,3. Sepsis, bir enfeksiyon düzensiz bir bağışıklık tepkisini tetiklediğinde ortaya çıkar ve bu da çoklu organ yetmezliği ile sonuçlanır. Hemodinamik instabilite, solunum sıkıntısı, karaciğer ve böbrek yetmezliği ve bilişsel bozuklukdahil olmak üzere hayatı tehdit eden semptomlarla karakterizedir 4,5. Septik şok, mortaliteyi önemli ölçüde artıran özellikle şiddetli semptomları olan bir sepsis alt kümesini temsil eder. Bu semptomlar arasında vazopresör tedavisi gerektiren kalıcı hipotansiyon ve 2 mmol∙L-1 4,5'i aşan bir serum laktat seviyesi bulunur. Septik şoklu hastalarda mortalite oranları, hastanede tedavi ile bile% 40 gibi yüksek bir orana ulaşmıştır 1,3,5.
Pseudomonas ve Escherichia coli gibi gram negatif bakteriler genellikle bu düzensiz bağışıklık tepkisini tetikleyen enfeksiyonlara neden olur4. Altta yatan patofizyolojik mekanizmalar karmaşıktır ve henüz tam olarak anlaşılamamıştır. İyi tanımlanmış bir yön, tümör nekroz faktörü-alfa (TNFa) veya İnterlökin 1 (IL 1) gibi sitokinlerin salınmasına yol açan patojenle ilişkili moleküler modeller (PAMP'ler) tarafından bağışıklık hücreleri üzerindeki Toll benzeri reseptörlerin aktivasyonunu içerir4. Bu PAMP'lardan biri, gram negatif bakterilerde hücre zarının bir bileşenini oluşturan lipopolisakkarittir (LPS)6. LPS, hayvan modellerinde endotoksemi ve endotoksemik şoku indüklemek için kullanılmıştır 7,8.
Hayvan modelleri, yeni tedavi stratejileri geliştirmek ve araştırmak için kontrollü ve standartlaştırılmış bir ortam sağlar. Benzer anatomisi, immünolojik fizyolojisi ve karşılaştırılabilir hemodinamik parametreleri nedeniyle, domuz modeli özellikle endotoksemik şokun etkilerini incelemek için çok uygundur 9,10. Ayrıca, insan hastalarda yaygın olarak kullanılan standart tıbbi ekipman, solunum yollarının ve kan damarlarının benzer boyutta olması, enstrümantasyon ve hemodinamik izlemeyi kolaylaştırması nedeniyle domuzlarda kolayca uygulanabilir.
Bu protokolle, E. coli'den türetilen LPS'yi intravenöz olarak infüze ederek domuzlarda endotoksemik şok için deneysel bir model sunuyoruz. Etkileri izlemek için arteriyel kan basıncı, kalp atış hızı, periferik oksijen satürasyonu, pulmoner arter basıncı ve hava yolu basıncı dahil olmak üzere hemodinamik ve pulmoner parametreleri ölçtük. Endotokseminin serebral oksijen kaynağı üzerindeki etkisini değerlendirmek için yakın kızılötesi spektrometri (NIRS) kullandık. Bu yöntemle, serebral oksijen satürasyonu, alnına uygulanan bir yapışkan elektrot aracılığıyla değerlendirilebilir11.
Protokol
Bu protokoldeki deneyler Devlet ve Kurumsal Hayvan Bakım Komitesi (Landesuntersuchungsamt Rheinland-Pfalz, Koblenz, Almanya, TVA G21-1-080) tarafından onaylanmıştır. Deneyler ARRIVE yönergelerine uygun olarak gerçekleştirilmiştir. Bu çalışma için yaşları 2-3 ay arasında ve 30-35 kg ağırlığında altı sağlıklı erkek Alman Landrace domuzu kullanıldı. Deneysel zaman çizelgesi Şekil 1'de özetlenmiştir. Bu protokolde kullanılan tüm malzeme ve aletler ile ilgili detaylar Malzeme Tablosunda listelenmiştir.
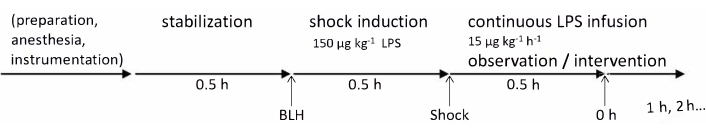
Şekil 1: Deneysel zaman çizelgesi. Temel sağlık ölçümleri, hayvanın hazırlanmasından ve 30 dakikalık bir stabilizasyon süresinden sonra alındı. Endotoksemi, 30 dakika boyunca LPS enjeksiyonu ile indüklendi ve 30 dakika sonra 0 saatlik ölçümler alındı; Bundan sonra, saatlik ölçümler 4 saat boyunca devam etti. Kısaltmalar: BLH = başlangıç sağlıklı; LPS = lipopolisakkarit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Hayvan hazırlama
- Stresi en aza indirmek için hayvanları mümkün olduğunca uzun süre normal ortamlarında tutun. Anestezi uygulanmadan önce 6 saat boyunca yiyecekleri saklayın ve suya serbest erişime izin verin.
- Hayvanları normal ortamlarındayken kas içi azaperon (3 mg∙kg-1) ve midazolam (0.5 mg kg-1) enjeksiyonu ile sakinleştirin.
- Tipik olarak uygulamadan yaklaşık 15-20 dakika sonra meydana gelen sedasyon etkili olduğunda, domuzları laboratuvara taşıyın.
NOT: Transfer boyunca sürekli sedasyonun sürdürülmesini sağlamak çok önemlidir; Bölgesel yasama organına bağlı olarak, bu bir veterinerin kalıcı denetimini gerektirebilir. - Taşıma sırasında domuzların normal vücut ısısını (~38 °C) korumaya çok dikkat edin. Örneğin, hipotermiyi önlemek için hayvanı bir battaniyeyle örtmeyi düşünün.
NOT: Taşıma süresini, genellikle 30 dakika ile 60 dakika arasında değişen sedasyon süresini aşmayacak şekilde sınırlamak önemlidir. - Dezenfeksiyonu takiben, kulak damarına 22 G'lik bir kateter yerleştirerek intravenöz erişim sağlayın. Domuzun daha fazla hareketine veya anestezi indüksiyonuna geçmeden önce, herhangi bir ani hareketle çıkığı önlemek için kateterin güvenli bir şekilde sabitlendiğinden emin olun.
- Kuyruğa veya kulağa takılan bir sensör kullanarak periferik oksijen doygunluğunu sürekli olarak izleyin.
2. Anestezi ve mekanik ventilasyon
- Anesteziyi indüklemek için intravenöz fentanil (4 μg kg-1) ve propofol (3 mg kg-1) uygulayın.
- Domuzu sırtüstü pozisyona getirin.
- Atrakuryumu (0.5 mg kg-1) kas gevşetici olarak uygulayın ve hemen bir köpek ventilasyon maskesi kullanarak non-invaziv ventilasyonu başlatın. Maskeyi burnun üzerine yerleştirin ve orta/yüzük parmağını kullanarak alt çeneyi öne doğru çekerken başparmaklarınızla sıkı bir baskı uygulayın. Ventilatörü aşağıdaki parametrelere ayarlayın: inspiratuar oksijen fraksiyonu (FiO2 ) =% 100, tidal hacim = 6-8 mL kg-1, Pozitif Uç Ekspiratuar Basınç (PEEP) = 5 mbar, tepe inspiratuar basınç ≤ 20 mbar, solunum hızı = 18-20 dak-1.
- Dengeli bir elektrolit çözeltisi (5 mL kg-1 sa-1), fentanil (10 μg kg-1 sa-1) ve propofol (6 mg kg-1 sa-1) sürekli infüzyonunu başlatarak anesteziyi sürdürün.
- Standart bir endotrakeal tüp (ID 6-7 mm), bir kılavuz tel ve bir Macintosh Blade (boyut 4) ile donatılmış bir laringoskop kullanarak endotrakeal entübasyon gerçekleştirin.
- Bir asistanın ağzını açmasını ve dilini sol tarafa tutmasını sağlayın.
- Macintosh Blade'i epiglot görünene kadar sokun. Ardından, epiglotu ventral olarak hareket ettirmek ve ses tellerini görselleştirmek için laringoskopu yukarı doğru kaldırın. Bazen, epiglot yumuşak damağa yapışabilir; Bu durumda, tüp veya bir buji ile hafifçe yana doğru kaydırarak harekete geçirin.
- Endotrakeal tüpü ses tellerinden dikkatlice yerleştirin ve indükleyiciyi çıkarın. Zorlukla karşılaşırsanız, tüpü aşırı kuvvet uygulamadan döndürmeyi deneyin. Gerekirse, daha küçük bir tüp kullanın. Tüp yerleştirildikten sonra, manşeti 10 mL hava ile şişirin.
- Endotrakeal tüpü ventilatöre bağlayın ve ventilasyonu başlatın. Ekspirasyon sonu CO2'yi tespit ederek ve bilateral oskültasyon gerçekleştirerek uygun tüp konumlandırmasını onaylayın. Aşağıdaki ventilasyon ayarlarını kullanın: FiO2 =% 40, gelgit hacmi = 6-8 mL kg-1, PEEP = 5 mbar, inspirasyon-ekspirasyon oranı = 1: 2, solunum hızı = <45 mmHg'lik bir gelgit sonu CO2 seviyesi elde etmek için ayarlanır, tipik olarak 30-40 dak-1 .
NOT: Tüp yemek borusuna yanlış yerleştirilmişse, hava mideyi şişirerek gözle görülür bir şişkinliğe neden olur. Bu gibi durumlarda, tüpü hemen çıkarın, 1-2 dakika boyunca non-invaziv ventilasyon uygulayın ve tüpü doğru şekilde yeniden konumlandırın. - Reflü veya kusmayı önlemek için bir mide tüpü yerleştirin. Yerleştirme zor olursa, özofagus girişini daha iyi görmek için laringoskop kullanın.
3. Enstrümantasyon
- Hemodinamik izleme ve intravenöz hacim tedavisi için sırasıyla femoral arter ve ven içine bir arteriyel ve bir merkezi venöz hat yerleştirin.
- Arka bacakları geri çekmek ve sabitlemek için bandaj kullanın, femoral damarlara daha iyi erişim sağlayın.
- Enstrümantasyondan önce gerekli tüm malzemeleri hazırlayın. Birden fazla kateterizasyon girişimi ve gereksiz kan kaybı ihtiyacını en aza indirmek için tüm kateterleri salin solüsyonu ile doldurun ve tellere ve kateterlere kolay erişim sağlayın.
- Kasık bölgesine alkollü bir dezenfektan uygulayın ve steril bir bezle silin. Bu işlemi iki kez tekrarlayın. Dezenfektanı silmeden tekrar uygulayın ve 3 dk bekleyin. Kasık bölgesinin üzerine steril bir fenestre örtü yerleştirin.
- Femur kan damarlarını tanımlamak için ultrason kullanın. Doku hasarını ve kan kaybını en aza indirmek için kateterizasyon için düzlem içi ultrason kılavuzluğunda Seldinger tekniği kullanın.
- Femoral arteri uzunlamasına görselleştirin. Sürekli aspirasyon için iğneye bağlı bir şırınga ile arteri delin. Parlak kırmızı, nabız atan kan, arteriyel ponksiyonu doğrular. Şırıngayı çıkarın ve hazırlanan teli yerleştirin. Teli yerinde bırakırken iğneyi çıkarın.
- Femoral ven için aynı işlemi tekrarlayın. Venöz ponksiyon yavaş akan, koyu kırmızı kan ile doğrulanır.
- Ultrason kullanarak her iki femoral damarı görselleştirerek her iki telin doğru konumlandırıldığını onaylayın.
- Önce arteriyel introdüser kılıfını, ardından venöz introdüser kılıfını yerleştirmek için Seldinger'in tekniğini kullanın. İki hattan alınan kan örneklerinin kan gazı analizi yoluyla doğru konumlandırmayı onaylayın.
- Kanın tüm hatlardan aspire edilebildiğinden emin olun. Pıhtı oluşumunu önlemek için tüm hatları tuzlu su çözeltisiyle yıkayın.
- Çıkığı önlemek için cerrahi dikişler kullanarak çizgileri cilde güvenli bir şekilde sabitleyin.
- Hemodinamik parametrelerin ölçümü için arteriyel ve santral venöz hatları transdüserlere bağlayın.
- Arteriyel introdüser kılıfına bir nabız kontur kardiyak çıkış (PiCCO) kateteri yerleştirin ve bunu PiCCO monitörünün arteriyel basınç dönüştürücüsüne ve sıcaklık arayüz kablosuna bağlayın.
- Bir Swan-Ganz kateterini bir dönüştürücüye bağlayın.
- Basıncı sürekli ölçerken, kateteri merkezi venöz giriş kılıfına yerleştirin. Yaklaşık 30 cm sonra, merkezi venöz basınç eğrisi görünür hale geldiğinde balonu şişirin.
- Basınç eğrisini izlerken kateteri yavaşça ilerletin. Kateter sağ ventriküle girerken, yüksek sistolik ve düşük diyastolik değere sahip bir nabız eğrisi arayın. Kateterin daha da ilerlemesi, tutarlı bir sistolik değer ve pulmoner arterdeki yerleşimi gösteren artmış bir diyastolik değer ile sonuçlanacaktır.
- Kateteri bu pozisyonda sabitleyin (genellikle 50 ila 70 cm arasında). PiCCO sisteminin enjeksiyon sıcaklık sensörünü Swan-Ganz kateterinin proksimal lümenine bağlayın.
- Domuzun alnını tıraş edin ve Serebral Bölgesel Oksijen Doygunluğunu ölçmek için yapışkan sensör elektrodunu uygulayın.
- Anestezi indüksiyonu ve enstrümantasyondan sonra, temel ölçümler yapmadan ve endotoksemik şoku indüklemeden önce hayvanın 30 dakika veya hemodinamik parametreler stabilize olana kadar stabilize olmasına izin verin.
4. Şok indüksiyonu
NOT: LPS ile çalışırken daima eldiven, koruyucu gözlük, maske ve laboratuvar önlüğü giyin. LPS ile doğrudan temastan kaçının.
- 5 mg LPS'yi 50 mL% 0.9 NaCl içinde çözerek 100 μg mL-1 konsantrasyonlu bir LPS çözeltisi hazırlayın.
- LPS infüzyonuna başlamadan hemen önce başlangıç hemodinamik ölçümlerini alın.
- 30 dakika boyunca 150 μg kg-1 doz LPS uygulayın (30 dakika boyunca 300 μg kg-1∙h-1 sürekli infüzyon hızına eşdeğer).
- 30 dakika sonra, deneyin geri kalanı için infüzyon hızını 15 μg∙kg-1∙h-1'e düşürün.
- Arteriyel ve pulmoner arteriyel kan basıncı, kalp atış hızı ve ventilasyon parametreleri dahil olmak üzere hemodinamik parametreleri sürekli olarak izleyin. Normotermiyi korumak için vücut ısısını sürekli izleyin.
5. Hemodinamik instabilitenin tedavisi
- Ortalama arteriyel kan basıncı 60 mmHg'nin altına düştüğünde, kardiyak indeks (CI), Global Diyastolik Sonu Hacim İndeksi (GEDI) ve Ekstravasküler Akciğer Su İndeksini (ELWI) ölçmek için PiCCO'yu kullanın. Düşük tansiyonu Şekil 2'deki akış şemasındaki önerilere göre tedavi edin.
- PiCCO monitöründe termodilüsyon düğmesine (TD) basın.
- Merkezi venöz basınç (CVP) girişi için düğmeye basın ve mevcut CVP değerini girin.
- Başlat düğmesine basın.
- Talimat verildiğinde, Swan-Ganz kateterine bağlı enjeksiyon sıcaklık sensörüne 10 mL soğuk salin solüsyonu enjekte edin.
NOT: PiCCO ölçümünden önce veya ölçüm sırasında doğrudan başka bir şey enjekte etmeyin, çünkü bu ölçümü tehlikeye atar.
- CI, GEDI ve ELWI için ölçümler aldıktan sonra, Şekil 2'deki akış şemasına göre hemodinamik instabiliteyi tedavi edin. Hacim yüklemesi önerilirse, 200 mL dengeli elektrolit çözeltisini hızla demleyin. Katekolamin tedavisi öneriliyorsa, norepinefrin infüzyon oranını 1 μg kg-1 h-1 arttırın.
- Ortalama arteriyel kan basıncı 60 mmHg'nin altına düştüğünde bu işlemi tekrarlayın. Şiddetli hemodinamik instabilite durumunda, tedavinin hızlı bir şekilde arttırılmasını tercih edin.
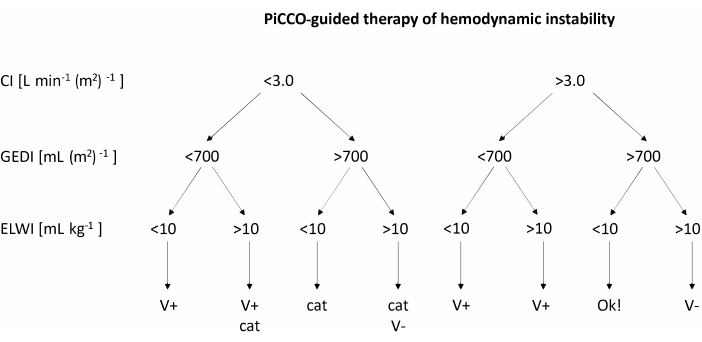
Şekil 2: Hemodinamik instabilitenin PiCCO kılavuzluğunda tedavisi. CI, GEDI ve ELWI için ölçümler alındıktan sonra tabloya göre tedavi uygulayın. Bu rakam PiCCO kullanım kılavuzu12'den uyarlanmıştır. Kısaltmalar: PiCCO = nabız kontur kardiyak debisi; V+ = hacim yükleme; kedi = katekolamin tedavisi; V- = hacim azaltma; CI = kardiyak indeks; GEDI = küresel diyastol sonu hacim indeksi; ELWI = ekstravasküler akciğer su indeksi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
6. Deneyin sonu ve ötenazi
- İntravenöz olarak 0.5 mg fentanil enjekte edin. 5 dakika bekleyin. 200 mg propofol enjekte edin.
- Merkezi venöz hat üzerinden 40 mL 1 M potasyum klorür enjeksiyonu ile domuzu ötenazi yapın.
Sonuçlar
Bu çalışma için, 2-3 aylık ve 30-35 kg ağırlığındaki altı sağlıklı erkek domuz anestezi altına alındı ve endotoksemiyi indüklemek için bir lipopolisakkarit (LPS) infüzyonu aldı. Şok semptomlarını tutarlı bir şekilde indüklemek için gereken uygun LPS dozajını belirlemek için, domuzlara 30 dakikalık bir süre boyunca 100 μg kg-1 ila 200 μg kg-1 arasında değişen çeşitli LPS indüksiyon dozları uygulandı, ardından deneyin geri kalanı için saatte başlangıç d...
Tartışmalar
Sepsis ve septik şokta yaygın olarak gözlenen değişiklikleri güvenilir bir şekilde indüklemeyi amaçlayan, LPS infüzyonu yoluyla domuzlarda deneysel endotoksemiyi indüklemek için bir protokol sunuyoruz. Bu protokolde birkaç kritik adımın dikkate alınması gerekir. Taşımadan önce domuzların yeterli sedasyonu, sonuçları potansiyel olarak tehlikeye atabilecek katekolamin seviyelerinin strese bağlı yükselmesini önlemek için çok önemlidir. Domuzların entübasyonu, uzun burunlarının anatomik öze...
Açıklamalar
NIRS cihazı, deneysel araştırma amacıyla ABD'deki Medtronic PLC tarafından koşulsuz olarak sağlanmıştır. Alexander Ziebart, Medtronic PLC'den ders ücreti aldı. Yazarların hiçbiri herhangi bir finansal veya diğer çıkar çatışması bildirmemektedir. Makale, ChatGPT® tarafından kontrol edildi ve düzenlendi (Python Yazılımı, Sürüm: 24 Mayıs 2023).
Teşekkürler
Yazarlar, mükemmel teknik desteği için Dagmar Dirvonskis'e teşekkür etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Atracurium Hikma 50 mg/5mL | Hikma Pharma GmbH, Martinsried | ||
| Azaperone (Stresnil) 40 mg/mL | Lilly Deutschland GmbH, Bad Homburg, Germany | ||
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy, AB Helsingborg, Schweden | 3-way-stopcock | |
| Curafix i.v. classics | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Cannula retention dressing | |
| Datex Ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | hemodynamic monitor | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland, GmbH | perfusor line | |
| Intrafix Primeline | B. Braun Melsungen AG, Melsungen, Germany | Infusion line | |
| Introducer sheath 5 Fr. | Terumo Healthcare | arterial introducer | |
| INVOS | Medtronic, Dublin, Ireland | near infrared spectrometry | |
| JOZA Einmal Nitril Untersuchungshandschuhe | JOZA, München, Germany | disposable gloves | |
| Laryngoscope, 45.48.50, KL 2000 | Medicon | Laryngoscope handle | |
| Littmann Classic III Stethoscope | 3M Deutschland GmbH, Neuss, Germany | stethoscope | |
| LPS (E. coli; Serotype O111:B4) | Sigma-Aldrich, Switzerland | ||
| MAC Two-Lumen Central venous access set | Arrow international inc. Reading, PA, USA | venous introducer | |
| Maimed Vlieskompresse | Maimed GmbH, Neuenkirchen, Germany | Fleece compress to fix the tongue | |
| Masimo LNCS Adtx SpO2 sensor | Masimo Corporation Irvine, Ca 92618 USA | saturation clip for the tail | |
| Masimo LNCS TC-I SpO2 ear clip sensor | Masimo Corporation Irvine, Ca 92618 USA | Saturation clip for the ear | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Midazolam 15 mg/3 mL | B.Braun Melsungen AG, Germany | ||
| Midmark Canine Mask Small Plastic with Diaphragm FRSCM-0005 | Midmark Corp., Dayton, Ohio, USA | dog ventilation mask | |
| Monocryl surgical suture | Johnson & Johnson, Belgium | ||
| B.Braun Melsungen AG, Germany | saline solution | ||
| NaCl 0.9 % | Sanofi- Aventis, Seutschland GmbH | ||
| Octeniderm farblos | Schülke & Mayr GmbH, Nordenstedt, Germany | Alcoholic disinfectant | |
| Original Perfusor syringe 50 mL | B.Braun Melsungen AG, Germany | perfusor syringe | |
| PA-Katheter Swan Ganz 7.5 Fr 110 cm | Edwards Lifesciences LLC, Irvine CA, USA | Swan-Ganz catheter | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| PiCCO catheter | PULSION Medical Systems SE, Feldkirchen, DE | ||
| Potassium chloride 1 M | Fresenius, Kabi Germany GmbH | ||
| Propofol 2% 20 mg/mL (50 mL flasks) | Fresenius, Kabi Deutschland, GmbH | ||
| Pulse-contour continous cardiac output System PiCCO2 | PULSION Medical Systems SE, Feldkirchen, DE | ||
| Rüschelit Super Safety Clear >ID 6/6.5 /7.0 mm | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Sonosite Micromaxx Ultrasoundsystem | Sonosite Bothell, WA, USA | ultrasound | |
| Stainless Macintosh Größe 4 | Welch Allyn69604 | blade for laryngoscope | |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | Balanced electrolyte solution | |
| Vasco OP sensitive | B.Braun Melsungen AG, Germany | sterile gloves | |
| Vasofix Safety 22 G-16 G | B.Braun Melsungen AG, Germany | venous catheter | |
| VBM Cuff Manometer | VBM Medizintechnik GmbH, Sulz a.N., Germany | cuff pressure gauge |
Referanslar
- Vincent, J. -. L., Jones, G., David, S., Olariu, E., Cadwell, K. K. Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis. Critical Care. 23 (1), 196 (2019).
- Reinhart, K., et al. Recognizing sepsis as a Global Health Priority - A WHO Resolution. New England Journal of Medicine. 377 (5), 414-417 (2017).
- Cecconi, M., Evans, L., Levy, M., Rhodes, A. Sepsis and septic shock. The Lancet. 392 (10141), 75-87 (2018).
- Font, M. D., Thyagarajan, B., Khanna, A. K. Sepsis and septic shock - basics of diagnosis, pathophysiology and clinical decision making. Medical Clinics of North America. 104 (4), 573-585 (2020).
- Singer, M., et al. The Third International Consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 315 (8), 801 (2016).
- Jerala, R. Structural biology of the LPS recognition. International Journal of Medical Microbiology. 297 (5), 353-363 (2007).
- Copeland, S., Warren, H. S., Lowry, S. F., Calvano, S. E., Remick, D. Inflammation and the host response to injury investigators acute inflammatory response to endotoxin in mice and humans. Clinical and Diagnostic Laboratory Immunology. 12 (1), 60-67 (2005).
- Dickson, K., Lehmann, C. Inflammatory response to different toxins in experimental sepsis models. International Journal of Molecular Sciences. 20 (18), 4341 (2019).
- Bassols, A., Costa, C., Eckersall, P. D., Osada, J., Sabrià, J., Tibau, J. The pig as an animal model for human pathologies: A proteomics perspective. PROTEOMICS - Clinical Applications. 8 (9-10), 715-731 (2014).
- Meurens, F., Summerfield, A., Nauwynck, H., Saif, L., Gerdts, V. The pig: a model for human infectious diseases. Trends in Microbiology. 20 (1), 50-57 (2012).
- Ali, J., Cody, J., Maldonado, Y., Ramakrishna, H. Near-infrared spectroscopy (NIRS) for cerebral and tissue oximetry: analysis of evolving applications. Journal of Cardiothoracic and Vascular Anesthesia. 36, 2758-2766 (2022).
- . Getinge Deutschland GmbH PiCCO Technologie Erweitertes hämodynamisches Monitoring auf höchstem Niveau Available from: https://www.getinge.com/dam/hospital/documents/german/picco_haemodynamisches_monitoring_broschuere-de-non_us.pdf (2023)
- Breslow, M. J., Miller, C. F., Parker, S. D., Walman, A. T., Traystman, R. J. Effect of vasopressors on organ blood flow during endotoxin shock in pigs. American Journal of Physiology-Heart and Circulatory Physiology. 252 (2), H291-H300 (1987).
- Fink, M. P., et al. Systemic and mesenteric O2 metabolism in endotoxic pigs: effect of ibuprofen and meclofenamate. Journal of Applied Physiology. 67 (5), 1950-1957 (1989).
- Lado-Abeal, J., et al. Lipopolysaccharide (LPS)-induced septic shock causes profound changes in myocardial energy metabolites in pigs. Metabolomics. 14 (10), 131 (2018).
- Park, I., et al. Characterization of fecal peritonitis-induced sepsis in a porcine model. The Journal of Surgical Research. 244, 492-501 (2019).
- Jarkovska, D., et al. Heart rate variability in porcine progressive peritonitis-induced sepsis. Frontiers in Physiology. 6, 412 (2015).
- Kohoutova, M., et al. Vagus nerve stimulation attenuates multiple organ dysfunction in resuscitated porcine progressive sepsis. Critical Care Medicine. 47 (6), e461-e469 (2019).
- Vintrych, P., et al. Modeling sepsis, with a special focus on large animal models of porcine peritonitis and bacteremia. Frontiers in Physiology. 13, 1094199 (2022).
- Stengl, M., et al. Reduced L-type calcium current in ventricular myocytes from pigs with hyperdynamic septic shock. Critical Care Medicine. 38 (2), 579-587 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır