É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Infusão de lipopolissacarídeo como modelo de choque endotoxêmico suíno
Neste Artigo
Resumo
Nós fornecemos um protocolo para um modelo experimental de choque endotoxêmico em porcos por infusão de lipopolissacarídeo.
Resumo
A sepse e o choque séptico são frequentemente encontrados em pacientes tratados em unidades de terapia intensiva (UTIs) e estão entre as principais causas de morte nesses pacientes. É causada por uma resposta imune desregulada a uma infecção. Mesmo com o tratamento otimizado, as taxas de mortalidade permanecem altas, o que torna necessário um maior conhecimento da fisiopatologia e novas opções de tratamento. O lipopolissacarídeo (LPS) é um componente da membrana celular de bactérias gram-negativas, que muitas vezes são responsáveis por infecções que causam sepse e choque séptico.
A gravidade e a alta mortalidade da sepse e do choque séptico impossibilitam estudos experimentais padronizados em humanos. Assim, um modelo animal é necessário para novos estudos. O porco é especialmente adequado para este fim, pois se assemelha muito aos humanos em anatomia, fisiologia e tamanho.
Este protocolo fornece um modelo experimental para choque endotoxêmico em porcos por infusão de LPS. Conseguimos induzir de forma confiável as alterações frequentemente observadas em pacientes com choque séptico, incluindo instabilidade hemodinâmica, insuficiência respiratória e acidose. Isso permitirá que os pesquisadores obtenham informações valiosas sobre essa condição altamente relevante e avaliem novas abordagens terapêuticas em um ambiente experimental.
Introdução
A sepse e o choque séptico estão entre as principais causas de mortalidade em pacientes em tratamento intensivo 1,2,3. A sepse surge quando uma infecção desencadeia uma resposta imune desregulada, resultando em falência de múltiplos órgãos. Caracteriza-se por sintomas potencialmente fatais, incluindo instabilidade hemodinâmica, desconforto respiratório, insuficiência hepática e renal, além de comprometimento cognitivo 4,5. O choque séptico representa um subgrupo da sepse com sintomas particularmente graves que aumentam significativamente a mortalidade. Esses sintomas incluem hipotensão persistente que requer terapia vasopressora e lactato sérico superior a 2 mmol∙L-1 4,5. As taxas de mortalidade em pacientes com choque séptico têm sido estimadas em até 40%, mesmo com tratamento hospitalar 1,3,5.
Bactérias gram-negativas, como Pseudomonas e Escherichia coli, frequentemente causam infecções desencadeando essa resposta imune desregulada4. Os mecanismos fisiopatológicos subjacentes são complexos e ainda não totalmente compreendidos. Um aspecto bem descrito envolve a ativação de receptores Toll-like em células imunes por padrões moleculares associados a patógenos (PAMPs), levando à liberação de citocinas como o fator de necrose tumoral alfa (TNFα) ou a interleucina 1 (IL 1)4. Um desses PAMPs é o lipopolissacarídeo (LPS), que constitui um componente da membrana celular em bactérias gram-negativas6. LPS tem sido empregado em modelos animais para induzir endotoxemia e choque endotoxêmico 7,8.
Modelos animais fornecem um ambiente controlado e padronizado para desenvolver e investigar novas estratégias de tratamento. Devido à sua anatomia semelhante, fisiologia imunológica e parâmetros hemodinâmicos comparáveis, o modelo suíno é particularmente adequado para estudar os efeitos do choque endotoxêmico 9,10. Além disso, o equipamento médico padrão comumente usado em pacientes humanos pode ser prontamente aplicado em porcos devido ao tamanho semelhante de suas vias aéreas e vasos sanguíneos, facilitando a instrumentação e a monitorização hemodinâmica.
Com este protocolo, fornecemos um modelo experimental para choque endotoxêmico em suínos por infusão intravenosa de LPS derivado de E. coli. Para monitorar os efeitos, medimos parâmetros hemodinâmicos e pulmonares, incluindo pressão arterial, frequência cardíaca, saturação periférica de oxigênio, pressão arterial pulmonar e pressão de vias aéreas. Para avaliar a influência da endotoxemia na oferta de oxigênio cerebral, foi utilizada a espectrometria no infravermelho próximo (NIRS). Com esse método, a saturação cerebral de oxigênio pode ser avaliada por meio de um eletrodo adesivo aplicado nafronte11.
Protocolo
Os experimentos deste protocolo foram aprovados pelo Comitê Estadual e Institucional de Cuidados com Animais (Landesuntersuchungsamt Rheinland-Pfalz, Koblenz, Alemanha, TVA G21-1-080). Os experimentos foram conduzidos de acordo com as diretrizes do ARRIVE. Para este estudo, foram utilizados seis suínos machos sadios da raça alemã Landrace, com idade entre 2-3 meses e peso entre 30-35 kg. A linha do tempo experimental está resumida na Figura 1. Os detalhes relacionados a todos os materiais e instrumentos utilizados neste protocolo estão listados na Tabela de Materiais.
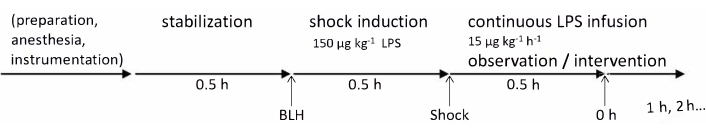
Figura 1: Linha do tempo experimental. As medidas de saúde basais foram tomadas após o preparo do animal e um período de estabilização de 30 min. A endotoxemia foi induzida pela injeção de LPS durante 30 min e as medidas de 0 h foram realizadas após mais 30 min; Em seguida, as medições horárias foram continuadas por 4 h. Abreviações: BLH = baseline healthy; LPS = lipopolissacarídeo. Clique aqui para ver uma versão maior desta figura.
1. Preparo dos animais
- Mantenha os animais em seu ambiente habitual pelo maior tempo possível para minimizar o estresse. Suspender os alimentos por 6 h antes da administração da anestesia, permitindo o livre acesso à água.
- Sedar os animais com uma injeção intramuscular de azaperone (3 mg∙kg-1) e midazolam (0,5 mg kg-1) ainda em seu ambiente normal.
- Uma vez que a sedação faz efeito, o que normalmente ocorre dentro de aproximadamente 15-20 minutos após a administração, transporte os porcos para o laboratório.
NOTA: É fundamental garantir que a sedação contínua seja mantida durante toda a transferência; Dependendo do legislador regional, isso pode exigir a supervisão permanente de um veterinário. - Preste muita atenção à manutenção da temperatura corporal normal dos porcos (~38 °C) durante o transporte. Por exemplo, considere cobrir o animal com um cobertor para evitar a hipotermia.
NOTA: É importante limitar o tempo de transporte para não exceder a duração da sedação, que geralmente varia de 30 min a 60 min. - Após a desinfecção, estabelecer um acesso intravenoso inserindo um cateter 22 G na veia auricular. Antes de prosseguir com qualquer movimento adicional do porco ou indução de anestesia, certifique-se de que o cateter esteja firmemente fixado para evitar deslocamento por qualquer movimento repentino.
- Monitore continuamente a saturação periférica de oxigênio usando um sensor preso à cauda ou orelha.
2. Anestesia e ventilação mecânica
- Administrar fentanil (4 μg kg-1) e propofol (3 mg kg-1) por via venosa para induzir anestesia.
- Coloque o porco em decúbito dorsal.
- Administrar atracúrio (0,5 mg kg-1) como relaxante muscular e iniciar imediatamente a ventilação não invasiva usando uma máscara de ventilação para cães. Coloque a máscara sobre o focinho e aplique pressão firme com os polegares enquanto puxa a mandíbula inferior para frente usando o dedo médio/anelar. Ajuste o ventilador para os seguintes parâmetros: fração inspiratória de oxigênio (FiO2 ) = 100%, volume corrente = 6-8 mL kg-1, Pressão Expiratória Final Positiva (PEEP) = 5 mbar, pressão inspiratória de pico ≤ 20 mbar, frequência respiratória = 18-20 min-1.
- Manter a anestesia iniciando uma infusão contínua de solução eletrolítica balanceada (5 mL kg-1 h-1), fentanil (10 μg kg-1 h-1) e propofol (6 mg kg-1 h-1).
- Realizar intubação endotraqueal utilizando um tubo endotraqueal padrão (ID 6-7 mm), um fio-guia e um laringoscópio equipado com uma lâmina Macintosh (tamanho 4).
- Peça a um assistente que abra a boca e segure a língua para o lado esquerdo.
- Insira a lâmina do Macintosh até que a epiglote esteja visível. Em seguida, levante o laringoscópio para cima para mover a epiglote ventralmente e visualizar as cordas vocais. Ocasionalmente, a epiglote pode aderir-se ao palato mole; Neste caso, mobilize-o deslizando suavemente para os lados com o tubo ou um bougie.
- Inserir cuidadosamente o tubo endotraqueal através das cordas vocais e remover o indutor. Se encontrar dificuldade, tente girar o tubo sem aplicar força excessiva. Se necessário, use um tubo menor. Uma vez que o tubo esteja no lugar, inflar o balonete com 10 mL de ar.
- Conecte o tubo endotraqueal ao ventilador e inicie a ventilação. Confirmar o posicionamento adequado do tubo detectando CO2 expiratório final e realizando ausculta bilateral. Use as seguintes configurações de ventilação: FiO2 = 40%, volume corrente = 6-8 mL kg-1, PEEP = 5 mbar, relação inspiração/expiração = 1:2, frequência respiratória = ajustada para atingir um nível expirado final de CO2 de <45 mmHg, tipicamente 30-40 min-1 .
NOTA: Se o tubo foi colocado incorretamente no esôfago, o ar irá inflar o estômago, causando uma protuberância visível. Nesses casos, remover imediatamente o tubo, administrar ventilação não invasiva por 1-2 min e reposicioná-lo corretamente. - Insira uma sonda gástrica para evitar refluxo ou vômitos. Se a inserção for desafiadora, utilizar o laringoscópio para melhor visualização da entrada esofágica.
3. Instrumentação
- Colocar uma linha arterial e uma venosa central na artéria e veia femoral, respectivamente, para monitorização hemodinâmica e terapia de volume intravenoso.
- Utilizar ataduras para retrair e fixar as patas traseiras, proporcionando melhor acesso aos vasos femorais.
- Prepare todos os materiais necessários antes da instrumentação. Preencher todos os cateteres com soro fisiológico e garantir fácil acesso aos fios e cateteres para minimizar a necessidade de múltiplas tentativas de cateterismo e perda de sangue desnecessária.
- Aplique um desinfetante alcoólico na área inguinal e limpe-a com um cotonete estéril. Repita esse processo duas vezes. Aplique o desinfetante novamente sem limpar e aguarde 3 min. Coloque um pano fenestrado estéril sobre a área inguinal.
- Use a ultrassonografia para identificar os vasos sanguíneos femorais. Use uma técnica de Seldinger guiada por ultrassom no plano para cateterismo para minimizar o dano tecidual e a perda de sangue.
- Visualize a artéria femoral longitudinalmente. Puncione a artéria com uma seringa presa à agulha para aspiração contínua. Vermelho vivo, sangue pulsante confirma a punção arterial. Retire a seringa e insira o fio preparado. Retire a agulha deixando o fio no lugar.
- Repita o mesmo procedimento para a veia femoral. A punção venosa é confirmada por sangue vermelho escuro de fluxo lento.
- Confirme o posicionamento correto de ambos os fios visualizando ambos os vasos femorais por meio de ultrassom.
- Utilizar a técnica de Seldinger para inserir primeiro a bainha introdutor arterial, seguida da bainha introdutora venosa. Confirme o posicionamento adequado através da gasometria de amostras de sangue colhidas das duas linhas.
- Certifique-se de que o sangue pode ser aspirado de todas as linhas. Lave todas as linhas com solução salina para evitar a formação de coágulos.
- Fixe com segurança as linhas na pele usando suturas cirúrgicas para evitar luxação.
- Conectar as linhas arteriais e venosas centrais aos transdutores para a mensuração dos parâmetros hemodinâmicos.
- Insira um cateter de débito cardíaco de contorno de pulso (PiCCO) na bainha do introdutor arterial e conecte-o ao transdutor de pressão arterial e ao cabo de interface de temperatura do monitor PiCCO.
- Conecte um cateter de Swan-Ganz a um transdutor.
- Durante a medição contínua da pressão, insira o cateter na bainha do introdutor venoso central. Inflar o balão após aproximadamente 30 cm, quando uma curva de pressão venosa central se torna visível.
- Avançar lentamente o cateter enquanto monitora a curva de pressão. Ao entrar no ventrículo direito, procure uma curva de pulso com alto valor sistólico e diastólico baixo. O avanço adicional do cateter resultará em um valor sistólico consistente e um valor diastólico aumentado, indicando posicionamento na artéria pulmonar.
- Fixar o cateter nessa posição (geralmente entre 50 e 70 cm). Conecte o sensor de temperatura injetado do sistema PiCCO ao lúmen proximal do cateter de Swan-Ganz.
- Faça a barba na testa do porco e aplique o eletrodo sensor adesivo para medir a Saturação Regional de Oxigênio Cerebral.
- Após a indução anestésica e instrumentação, permitir que o animal estabilize por 30 min ou até que os parâmetros hemodinâmicos tenham se estabilizado antes de realizar as medidas basais e induzir o choque endotoxêmico.
4. Indução de choque
OBS: Ao trabalhar com LPS, use sempre luvas, óculos de proteção, máscara e jaleco. Evite o contato direto com o LPS.
- Preparar uma solução de LPS com uma concentração de 100 μg mL-1 dissolvendo 5 mg de LPS em 50 mL de NaCl a 0,9%.
- Obter medidas hemodinâmicas basais imediatamente antes de iniciar a infusão de LPS.
- Administrar uma dose de 150 μg kg-1 de LPS durante 30 min (equivalente a uma taxa de perfusão contínua de 300 μg kg-1∙h-1 durante 30 min).
- Após 30 min, reduzir a velocidade de infusão para 15 μg∙kg-1∙h-1 pelo restante do experimento.
- Monitorar continuamente os parâmetros hemodinâmicos, incluindo pressão arterial arterial e pulmonar, frequência cardíaca e parâmetros de ventilação. Monitorar a temperatura corporal continuamente para manter a normotermia.
5. Tratamento da instabilidade hemodinâmica
- Quando a pressão arterial média cair abaixo de 60 mmHg, use PiCCO para medir o índice cardíaco (IC), o Índice de Volume Diastólico Final Global (GEDI) e o Índice de Água Pulmonar Extravascular (ELWI). Tratar a pressão arterial baixa de acordo com as recomendações do fluxograma da Figura 2.
- No monitor PiCCO, pressione o botão de termodiluição (TD).
- Pressione o botão para entrada de pressão venosa central (PVC) e insira o valor atual da PVC .
- Pressione o botão Iniciar .
- Quando instruído a fazê-lo, injetar 10 mL de solução salina gelada no sensor de temperatura injetado conectado ao cateter de Swan-Ganz.
NOTA: Não injete mais nada diretamente antes ou durante a medição do PiCCO, pois isso comprometeria a medição.
- Após a obtenção das medidas para IC, GEDI e ELWI, tratar a instabilidade hemodinâmica de acordo com o fluxograma da Figura 2. Se a carga de volume for recomendada, infundir rapidamente 200 mL de solução eletrolítica balanceada. Se a terapia com catecolaminas for recomendada, aumentar a taxa de infusão de noradrenalina em 1 μg kg-1 h-1.
- Repita esse processo sempre que a pressão arterial média cair abaixo de 60 mmHg. Em caso de instabilidade hemodinâmica grave, opte pelo escalonamento rápido da terapia.
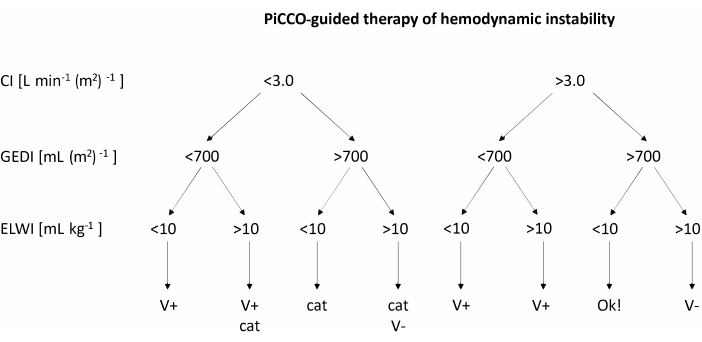
Figura 2: Terapia de instabilidade hemodinâmica guiada por PiCCO. Após a obtenção das medidas para IC, GEDI e ELWI, aplicar o tratamento de acordo com o prontuário. Esta figura foi adaptada do guia do usuário do PiCCO12. Abreviações: PiCCO = débito cardíaco de contorno de pulso; V+ = carga volumétrica; gato = terapia com catecolaminas; V- = redução de volume; IC = índice cardíaco; GEDI = índice de volume diastólico final global; ELWI = índice de água extravascular pulmonar. Clique aqui para ver uma versão maior desta figura.
6. Fim da experiência e eutanásia
- Injetar 0,5 mg de fentanil por via intravenosa. Aguarde 5 min. Injetar 200 mg de propofol.
- Eutanasiar o suíno com uma injeção rápida de 40 mL de cloreto de potássio 1 M através da linha venosa central.
Resultados
Para este estudo, seis suínos machos hígidos com idade entre 2-3 meses e peso 30-35 kg foram anestesiados e receberam uma infusão de lipopolissacarídeo (LPS) para induzir endotoxemia. Para determinar a dosagem apropriada de LPS necessária para induzir consistentemente sintomas de choque, os suínos receberam várias doses de indução de LPS variando de 100 μg kg-1 a 200 μg kg-1 durante um período de 30 min, seguido por uma dose de manutenção de 1/10 da dose inicial por hora para o restant...
Discussão
Apresentamos um protocolo para indução de endotoxemia experimental em suínos através da infusão de LPS, com o objetivo de induzir de forma confiável as alterações comumente observadas na sepse e choque séptico. Várias etapas críticas precisam ser consideradas neste protocolo. A sedação adequada dos suínos antes do transporte é crucial para evitar a elevação dos níveis de catecolaminas induzida pelo estresse, o que poderia comprometer os resultados. A intubação de suínos pode representar desafios em c...
Divulgações
O dispositivo NIRS foi fornecido incondicionalmente pela Medtronic PLC, EUA, para fins de pesquisa experimental. Alexander Ziebart recebeu uma taxa de palestra da Medtronic PLC. Nenhum dos autores relata qualquer conflito de interesse financeiro ou de outra natureza. O manuscrito foi revisado e editado pelo ChatGPT® (Python Software, Versão: 24 de maio de 2023).
Agradecimentos
Os autores agradecem a Dagmar Dirvonskis pelo excelente suporte técnico.
Materiais
| Name | Company | Catalog Number | Comments |
| Atracurium Hikma 50 mg/5mL | Hikma Pharma GmbH, Martinsried | ||
| Azaperone (Stresnil) 40 mg/mL | Lilly Deutschland GmbH, Bad Homburg, Germany | ||
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy, AB Helsingborg, Schweden | 3-way-stopcock | |
| Curafix i.v. classics | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Cannula retention dressing | |
| Datex Ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | hemodynamic monitor | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland, GmbH | perfusor line | |
| Intrafix Primeline | B. Braun Melsungen AG, Melsungen, Germany | Infusion line | |
| Introducer sheath 5 Fr. | Terumo Healthcare | arterial introducer | |
| INVOS | Medtronic, Dublin, Ireland | near infrared spectrometry | |
| JOZA Einmal Nitril Untersuchungshandschuhe | JOZA, München, Germany | disposable gloves | |
| Laryngoscope, 45.48.50, KL 2000 | Medicon | Laryngoscope handle | |
| Littmann Classic III Stethoscope | 3M Deutschland GmbH, Neuss, Germany | stethoscope | |
| LPS (E. coli; Serotype O111:B4) | Sigma-Aldrich, Switzerland | ||
| MAC Two-Lumen Central venous access set | Arrow international inc. Reading, PA, USA | venous introducer | |
| Maimed Vlieskompresse | Maimed GmbH, Neuenkirchen, Germany | Fleece compress to fix the tongue | |
| Masimo LNCS Adtx SpO2 sensor | Masimo Corporation Irvine, Ca 92618 USA | saturation clip for the tail | |
| Masimo LNCS TC-I SpO2 ear clip sensor | Masimo Corporation Irvine, Ca 92618 USA | Saturation clip for the ear | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Midazolam 15 mg/3 mL | B.Braun Melsungen AG, Germany | ||
| Midmark Canine Mask Small Plastic with Diaphragm FRSCM-0005 | Midmark Corp., Dayton, Ohio, USA | dog ventilation mask | |
| Monocryl surgical suture | Johnson & Johnson, Belgium | ||
| B.Braun Melsungen AG, Germany | saline solution | ||
| NaCl 0.9 % | Sanofi- Aventis, Seutschland GmbH | ||
| Octeniderm farblos | Schülke & Mayr GmbH, Nordenstedt, Germany | Alcoholic disinfectant | |
| Original Perfusor syringe 50 mL | B.Braun Melsungen AG, Germany | perfusor syringe | |
| PA-Katheter Swan Ganz 7.5 Fr 110 cm | Edwards Lifesciences LLC, Irvine CA, USA | Swan-Ganz catheter | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| PiCCO catheter | PULSION Medical Systems SE, Feldkirchen, DE | ||
| Potassium chloride 1 M | Fresenius, Kabi Germany GmbH | ||
| Propofol 2% 20 mg/mL (50 mL flasks) | Fresenius, Kabi Deutschland, GmbH | ||
| Pulse-contour continous cardiac output System PiCCO2 | PULSION Medical Systems SE, Feldkirchen, DE | ||
| Rüschelit Super Safety Clear >ID 6/6.5 /7.0 mm | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Sonosite Micromaxx Ultrasoundsystem | Sonosite Bothell, WA, USA | ultrasound | |
| Stainless Macintosh Größe 4 | Welch Allyn69604 | blade for laryngoscope | |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | Balanced electrolyte solution | |
| Vasco OP sensitive | B.Braun Melsungen AG, Germany | sterile gloves | |
| Vasofix Safety 22 G-16 G | B.Braun Melsungen AG, Germany | venous catheter | |
| VBM Cuff Manometer | VBM Medizintechnik GmbH, Sulz a.N., Germany | cuff pressure gauge |
Referências
- Vincent, J. -. L., Jones, G., David, S., Olariu, E., Cadwell, K. K. Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis. Critical Care. 23 (1), 196 (2019).
- Reinhart, K., et al. Recognizing sepsis as a Global Health Priority - A WHO Resolution. New England Journal of Medicine. 377 (5), 414-417 (2017).
- Cecconi, M., Evans, L., Levy, M., Rhodes, A. Sepsis and septic shock. The Lancet. 392 (10141), 75-87 (2018).
- Font, M. D., Thyagarajan, B., Khanna, A. K. Sepsis and septic shock - basics of diagnosis, pathophysiology and clinical decision making. Medical Clinics of North America. 104 (4), 573-585 (2020).
- Singer, M., et al. The Third International Consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 315 (8), 801 (2016).
- Jerala, R. Structural biology of the LPS recognition. International Journal of Medical Microbiology. 297 (5), 353-363 (2007).
- Copeland, S., Warren, H. S., Lowry, S. F., Calvano, S. E., Remick, D. Inflammation and the host response to injury investigators acute inflammatory response to endotoxin in mice and humans. Clinical and Diagnostic Laboratory Immunology. 12 (1), 60-67 (2005).
- Dickson, K., Lehmann, C. Inflammatory response to different toxins in experimental sepsis models. International Journal of Molecular Sciences. 20 (18), 4341 (2019).
- Bassols, A., Costa, C., Eckersall, P. D., Osada, J., Sabrià, J., Tibau, J. The pig as an animal model for human pathologies: A proteomics perspective. PROTEOMICS - Clinical Applications. 8 (9-10), 715-731 (2014).
- Meurens, F., Summerfield, A., Nauwynck, H., Saif, L., Gerdts, V. The pig: a model for human infectious diseases. Trends in Microbiology. 20 (1), 50-57 (2012).
- Ali, J., Cody, J., Maldonado, Y., Ramakrishna, H. Near-infrared spectroscopy (NIRS) for cerebral and tissue oximetry: analysis of evolving applications. Journal of Cardiothoracic and Vascular Anesthesia. 36, 2758-2766 (2022).
- . Getinge Deutschland GmbH PiCCO Technologie Erweitertes hämodynamisches Monitoring auf höchstem Niveau Available from: https://www.getinge.com/dam/hospital/documents/german/picco_haemodynamisches_monitoring_broschuere-de-non_us.pdf (2023)
- Breslow, M. J., Miller, C. F., Parker, S. D., Walman, A. T., Traystman, R. J. Effect of vasopressors on organ blood flow during endotoxin shock in pigs. American Journal of Physiology-Heart and Circulatory Physiology. 252 (2), H291-H300 (1987).
- Fink, M. P., et al. Systemic and mesenteric O2 metabolism in endotoxic pigs: effect of ibuprofen and meclofenamate. Journal of Applied Physiology. 67 (5), 1950-1957 (1989).
- Lado-Abeal, J., et al. Lipopolysaccharide (LPS)-induced septic shock causes profound changes in myocardial energy metabolites in pigs. Metabolomics. 14 (10), 131 (2018).
- Park, I., et al. Characterization of fecal peritonitis-induced sepsis in a porcine model. The Journal of Surgical Research. 244, 492-501 (2019).
- Jarkovska, D., et al. Heart rate variability in porcine progressive peritonitis-induced sepsis. Frontiers in Physiology. 6, 412 (2015).
- Kohoutova, M., et al. Vagus nerve stimulation attenuates multiple organ dysfunction in resuscitated porcine progressive sepsis. Critical Care Medicine. 47 (6), e461-e469 (2019).
- Vintrych, P., et al. Modeling sepsis, with a special focus on large animal models of porcine peritonitis and bacteremia. Frontiers in Physiology. 13, 1094199 (2022).
- Stengl, M., et al. Reduced L-type calcium current in ventricular myocytes from pigs with hyperdynamic septic shock. Critical Care Medicine. 38 (2), 579-587 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados