Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Инфузия липополисахаридов как модель эндотоксемического шока свиней
В этой статье
Резюме
Приведен протокол экспериментальной модели эндотоксемического шока у свиней путем инфузии липополисахарида.
Аннотация
Сепсис и септический шок часто встречаются у пациентов, получающих лечение в отделениях интенсивной терапии (ОИТ), и являются одной из основных причин смерти этих пациентов. Это вызвано нерегулируемым иммунным ответом на инфекцию. Даже при оптимизированном лечении показатели смертности остаются высокими, что требует дальнейшего изучения патофизиологии и новых вариантов лечения. Липополисахарид (ЛПС) является компонентом клеточной мембраны грамотрицательных бактерий, которые часто ответственны за инфекции, вызывающие сепсис и септический шок.
Тяжесть и высокая смертность от сепсиса и септического шока делают невозможным проведение стандартизированных экспериментальных исследований на людях. Таким образом, для дальнейших исследований необходима животная модель. Свинья особенно хорошо подходит для этой цели, так как она очень похожа на человека по анатомии, физиологии и размерам.
Данный протокол представляет собой экспериментальную модель эндотоксемического шока у свиней путем инфузии ЛПС. Нам удалось достоверно индуцировать изменения, часто наблюдаемые у пациентов с септическим шоком, включая гемодинамическую нестабильность, дыхательную недостаточность и ацидоз. Это позволит исследователям получить ценную информацию об этом весьма актуальном состоянии и оценить новые терапевтические подходы в экспериментальных условиях.
Введение
Сепсис и септический шок входят в число ведущих причин смертности у пациентов, получающих интенсивную терапию 1,2,3. Сепсис возникает, когда инфекция вызывает нерегулируемый иммунный ответ, приводящий к полиорганной недостаточности. Характеризуется угрожающими жизни симптомами, включая гемодинамическую нестабильность, дыхательную недостаточность, печеночную и почечную недостаточность, а также когнитивные нарушения 4,5. Септический шок представляет собой разновидность сепсиса с особенно тяжелыми симптомами, которые значительно увеличивают смертность. Эти симптомы включают стойкую гипотензию, требующую вазопрессорной терапии, и уровень лактата в сыворотке крови, превышающий 2 ммоль∙л-1,4,5. Смертность у пациентов с септическим шоком оценивается в 40%, даже при стационарном лечении 1,3,5.
Грамотрицательные бактерии, такие как синегнойная палочка и кишечная палочка, часто вызывают инфекции, вызывающие этот нерегулируемый иммунныйответ. Лежащие в их основе патофизиологические механизмы сложны и еще не до конца изучены. Один из хорошо описанных аспектов включает активацию Toll-подобных рецепторов на иммунных клетках с помощью патоген-ассоциированных молекулярных паттернов (PAMP), что приводит к высвобождению цитокинов, таких как фактор некроза опухоли-альфа (TNFα) или интерлейкин 1 (IL 1)4. Одним из таких ПАМП является липополисахарид (ЛПС), который представляет собой компонент клеточной мембраны у грамотрицательных бактерий6. ЛПС применялся на животных моделях для индуцирования эндотоксикоза и эндотоксемического шока 7,8.
Животные модели обеспечивают контролируемые и стандартизированные условия для разработки и исследования новых стратегий лечения. Благодаря схожей анатомии, иммунологической физиологии и сопоставимым параметрам гемодинамики, модель свиньи особенно хорошо подходит для изучения эффектов эндотоксемического шока 9,10. Кроме того, стандартное медицинское оборудование, обычно используемое для лечения пациентов-людей, может быть легко применено к свиньям из-за схожего размера их дыхательных путей и кровеносных сосудов, что облегчает инструментальный и гемодинамический мониторинг.
С помощью этого протокола мы предоставляем экспериментальную модель эндотоксемического шока у свиней путем внутривенной инфузии ЛПС, полученной из кишечной палочки. Для мониторинга эффектов мы измеряли гемодинамические и легочные параметры, включая артериальное давление, частоту сердечных сокращений, периферическую насыщенность кислородом, давление в легочной артерии и давление в дыхательных путях. Для оценки влияния эндотоксикоза на снабжение головного мозга кислородом использовали спектрометрию ближнего инфракрасного диапазона (NIRS). С помощью этого метода насыщение головного мозга кислородом может быть оценено с помощью адгезивного электрода, прикладываемого ко лбу11.
протокол
Эксперименты в этом протоколе были одобрены Государственным и институциональным комитетом по уходу за животными (Landesuntersuchungsamt Rheinland-Pfalz, Koblenz, Germany, TVA G21-1-080). Эксперименты проводились в соответствии с рекомендациями ARRIVE. Для данного исследования были использованы шесть здоровых свиней-самцов немецкой породы ландрас в возрасте 2-3 месяцев и весом 30-35 кг. Хронология эксперимента представлена на рисунке 1. Подробная информация обо всех материалах и инструментах, используемых в настоящем протоколе, приведена в Таблице материалов.
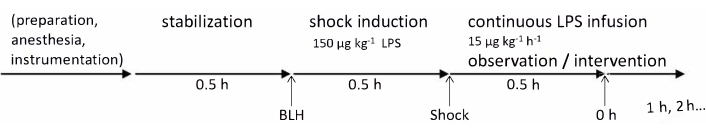
Рисунок 1: Хронология экспериментов. Исходные измерения состояния здоровья проводились после подготовки животного и 30-минутного периода стабилизации. Эндотоксикоз индуцировали инъекцией ЛПС в течение 30 мин, а через 30 мин проводили измерения через 0 ч; После этого почасовые измерения продолжали в течение 4 ч. Сокращения: BLH = базовый уровень работоспособный; ЛПС = липополисахарид. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
1. Подготовка животных
- Держите животных в привычной среде как можно дольше, чтобы свести к минимуму стресс. Воздержитесь от приема пищи в течение 6 ч до введения анестезии, при этом обеспечьте свободный доступ к воде.
- Усыпляйте животных внутримышечными инъекциями азаперона (3 мг∙кг-1) и мидазолама (0,5 мг-кг-1), пока они еще находятся в обычной среде.
- Как только седативный препарат подействует, что обычно происходит в течение примерно 15-20 минут после введения, свиней транспортируют в лабораторию.
ПРИМЕЧАНИЕ: Крайне важно обеспечить непрерывную седацию на протяжении всего периода переноса; В зависимости от регионального законодательства для этого может потребоваться постоянное наблюдение ветеринара. - Обратите особое внимание на поддержание нормальной температуры тела свиней (~38 °C) во время транспортировки. Например, подумайте о том, чтобы накрыть животное одеялом, чтобы предотвратить переохлаждение.
ПРИМЕЧАНИЕ: Важно ограничить время транспортировки, чтобы не превышать продолжительность седации, которая обычно составляет от 30 до 60 минут. - После дезинфекции установить внутривенный доступ, введя катетер 22 G в ушную вену. Прежде чем приступать к дальнейшим перемещениям свиньи или индукции анестезии, убедитесь, что катетер надежно закреплен, чтобы предотвратить вывих от резких движений.
- Непрерывно контролируйте периферическое насыщение кислородом с помощью датчика, прикрепленного к хвосту или уху.
2. Анестезия и искусственная вентиляция легких
- Внутривенно вводят фентанил (4 мкг кг-1) и пропофол (3 мг кг-1) для индуцирования анестезии.
- Поместите свинью в положение лежа на спине.
- Введите атракурий (0,5 мг кг-1) в качестве миорелаксанта и немедленно начните неинвазивную вентиляцию легких, используя респиратор для собаки. Наденьте маску на морду и сильно надавите большими пальцами, одновременно вытягивая нижнюю челюсть вперед с помощью среднего/безымянного пальца. Настройте аппарат ИВЛ на следующие параметры: фракция кислорода на вдохе (FiO2 ) = 100%, дыхательный объем = 6-8 мл кг-1, положительное давление в конце выдоха (PEEP) = 5 мбар, пиковое давление на вдохе ≤ 20 мбар, частота дыхания = 18-20 мин-1.
- Поддерживайте анестезию, инициируя непрерывную инфузию сбалансированного раствора электролитов (5 мл кг-1 ч-1), фентанила (10 мкг кг-1 ч-1) и пропофола (6 мг кг-1 ч-1).
- Выполните эндотрахеальную интубацию с помощью стандартной эндотрахеальной трубки (внутренний диаметр 6-7 мм), проводника и ларингоскопа, оснащенного лезвием Macintosh Blade (размер 4).
- Попросите помощника открыть рот и прижать язык к левой стороне.
- Вставьте лезвие Macintosh до тех пор, пока надгортанник не станет виден. Затем поднимите ларингоскоп вверх, чтобы вентрально переместить надгортанник и визуализировать голосовые связки. Иногда надгортанник может прилипать к мягкому нёбу; В этом случае мобилизуйте его, аккуратно проведя трубкой или бужом вбок.
- Осторожно введите эндотрахеальную трубку через голосовые связки и удалите индуктор. Если возникнут трудности, попробуйте повернуть трубку, не прилагая чрезмерных усилий. При необходимости используйте тюбик меньшего размера. Как только трубка будет на месте, надуйте манжету 10 мл воздуха.
- Подключите эндотрахеальную трубку к аппарату искусственной вентиляции легких и начните вентиляцию легких. Убедитесь в правильном положении трубки, обнаружив CO2 в конце выдоха и выполнив двустороннюю аускультацию. Используйте следующие настройки вентиляции: FiO2 = 40%, дыхательный объем = 6-8 мл кг-1, PEEP = 5 мбар, отношение вдоха к выдоху = 1:2, частота дыхания = скорректирована для достижения уровня CO2 в конце выдоха <45 мм рт.ст., обычно 30-40 мин-1 .
ПРИМЕЧАНИЕ: Если трубка была неправильно установлена в пищеводе, воздух будет раздувать желудок, вызывая видимое выпячивание. В таких случаях немедленно извлеките трубку, обеспечьте неинвазивную вентиляцию легких в течение 1-2 минут и правильно переместите трубку. - Вставьте желудочный зонд, чтобы предотвратить рефлюкс или рвоту. Если введение оказалось затруднительным, используйте ларингоскоп, чтобы лучше рассмотреть вход в пищевод.
3. Контрольно-измерительные приборы
- Установите артериальный и центральный венозный катетеры в бедренную артерию и вену соответственно для мониторинга гемодинамики и внутривенной объемной терапии.
- Используйте бинты, чтобы втянуть и зафиксировать задние лапы, обеспечивая лучший доступ к бедренным сосудам.
- Подготовьте все необходимые материалы перед установкой контрольно-измерительных приборов. Заполните все катетеры физиологическим раствором и обеспечьте легкий доступ к проводам и катетерам, чтобы свести к минимуму необходимость многократных попыток катетеризации и ненужной кровопотери.
- Нанесите спиртовое дезинфицирующее средство на паховую область и протрите ее стерильным тампоном. Повторите этот процесс дважды. Нанесите дезинфицирующее средство еще раз, не вытирая, и подождите 3 минуты. Наложите стерильную фенестрированную простыню на паховую область.
- Используйте УЗИ для выявления бедренных кровеносных сосудов. Используйте технику Зельдингера под контролем УЗИ для катетеризации, чтобы свести к минимуму повреждение тканей и кровопотерю.
- Визуализируйте бедренную артерию в продольном направлении. Проколите артерию шприцем, прикрепленным к игле для непрерывной аспирации. Ярко-красная, пульсирующая кровь подтверждает артериальную пункцию. Извлеките шприц и вставьте подготовленную проволоку. Извлеките иглу, оставив проволоку на месте.
- Повторите ту же процедуру для бедренной вены. Пункция вен подтверждается медленно текущей темно-красной кровью.
- Подтвердите правильное положение обоих спиц, визуализировав оба бедренных сосуда с помощью ультразвука.
- Используйте технику Зельдингера, чтобы сначала ввести артериальную интродьюсерную оболочку, а затем венозную интродьюсерную оболочку. Убедитесь в правильном позиционировании с помощью анализа газов крови образцов крови, взятых из двух линий.
- Убедитесь, что кровь может быть аспирирована из всех капель. Промойте все линии солевым раствором, чтобы предотвратить образование тромбов.
- Надежно зафиксируйте линии на коже с помощью хирургических швов, чтобы предотвратить вывих.
- Подключают артериальные и центральные венозные катетеры к датчикам для измерения гемодинамических параметров.
- Вставьте катетер импульсного контурного сердечного выброса (PiCCO) в оболочку артериального интродьюсера и подключите его к датчику артериального давления и интерфейсному кабелю температуры монитора PiCCO.
- Подключите катетер Свона-Ганца к датчику.
- Непрерывно измеряя давление, введите катетер в центральную оболочку венозного проводника. Надуйте баллон примерно через 30 см, когда станет видна центральная кривая венозного давления.
- Медленно продвигайте катетер, контролируя кривую давления. При входе катетера в правый желудочек ищите пульсовую кривую с высоким систолическим и низким диастолическим значением. Дальнейшее продвижение катетера приведет к постоянному систолическому значению и увеличению диастолического значения, что указывает на размещение в легочной артерии.
- Зафиксируйте катетер в таком положении (обычно на расстоянии от 50 до 70 см). Подключите инжекционный датчик температуры системы PiCCO к проксимальному просвету катетера Свона-Ганца.
- Побрейте лоб свиньи и приложите электрод адгезивного датчика для измерения регионарного насыщения головного мозга кислородом.
- После индукции анестезии и инструментария дайте животному стабилизироваться в течение 30 минут или до тех пор, пока не стабилизируются параметры гемодинамики, прежде чем проводить исходные измерения и вызывать эндотоксикемический шок.
4. Индукция удара
ПРИМЕЧАНИЕ: При работе с ЛПС всегда надевайте перчатки, защитные очки, маску и лабораторный халат. Избегайте прямого контакта с ЛПС.
- Готовят раствор ЛПС с концентрацией 100 мкг мл-1 , растворяя 5 мг ЛПС в 50 мл 0,9% NaCl.
- Проведите исходные измерения гемодинамики непосредственно перед началом инфузии ЛПС.
- Вводят дозу 150 мкг кг-1 ЛПС в течение 30 мин (эквивалентно скорости непрерывной инфузии 300 мкг кг-1∙ч-1 в течение 30 мин).
- Через 30 мин уменьшите скорость инфузии до 15 мкг∙кг-1∙ч-1 до конца эксперимента.
- Непрерывный мониторинг гемодинамических параметров, включая артериальное и легочное артериальное давление, частоту сердечных сокращений и вентиляцию легких. Постоянно контролируйте температуру тела для поддержания нормотермии.
5. Лечение гемодинамической нестабильности
- Когда среднее артериальное давление падает ниже 60 мм рт.ст., используйте PiCCO для измерения сердечного индекса (ДИ), глобального индекса конечного диастолического объема (GEDI) и внесосудистого индекса воды в легких (ELWI). Лечите пониженное артериальное давление в соответствии с рекомендациями, приведенными в блок-схеме на рисунке 2.
- На мониторе PiCCO нажмите кнопку терморазбавления (TD).
- Нажмите кнопку ввода центрального венозного давления (ЦВД) и введите текущее значение ЦВД .
- Нажмите кнопку Пуск .
- В соответствии с указаниями введите 10 мл физиологического раствора в датчик температуры инжекции, подключенный к катетеру Swan-Ganz.
ПРИМЕЧАНИЕ: Не вводите ничего другого непосредственно до или во время измерения PiCCO, так как это может поставить под угрозу измерение.
- После получения измерений для CI, GEDI и ELWI лечат гемодинамическую нестабильность в соответствии с блок-схемой на рисунке 2. Если рекомендуется объемная загрузка, быстро влейте 200 мл сбалансированного раствора электролита. Если рекомендована катехоламиновая терапия, увеличьте скорость инфузии норадреналина на 1 мкг кг-1 ч-1.
- Повторяйте этот процесс всякий раз, когда среднее артериальное давление падает ниже 60 мм рт.ст. В случае выраженной гемодинамической нестабильности следует прибегнуть к быстрой эскалации терапии.
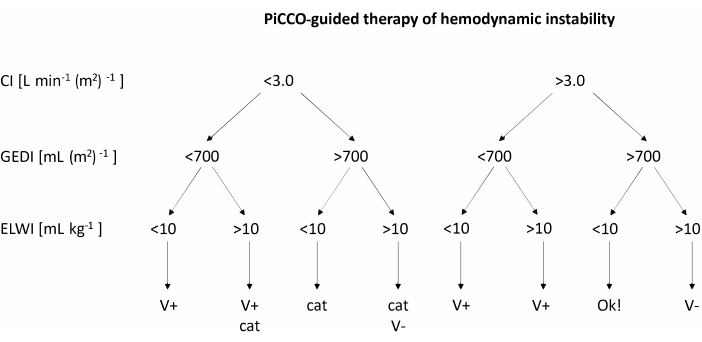
Рисунок 2: Терапия гемодинамической нестабильности под контролем PiCCO. После получения измерений для CI, GEDI и ELWI применяют лечение в соответствии с таблицей. Этот рисунок был адаптирован из руководства пользователя PiCCO12. Сокращения: PiCCO = пульсовый контурный сердечный выброс; V+ = загрузка объема; КОТ = катехоламиновая терапия; V- = уменьшение объема; CI = сердечный индекс; GEDI = глобальный индекс конечного диастолического объема; ELWI = внесосудисто-водный индекс легких. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
6. Окончание эксперимента и эвтаназия
- Внутривенно вводят 0,5 мг фентанила. Подождите 5 минут. Вводят 200 мг пропофола.
- Усыпьте свинью с помощью быстрой инъекции 40 мл 1 М хлорида калия через центральную венозную линию.
Результаты
В этом исследовании шесть здоровых свиней-самцов в возрасте 2-3 месяцев и весом 30-35 кг были обезболены и получили инфузию липополисахарида (ЛПС) для индуцирования эндотоксикозов. Чтобы определить надлежащую дозу ЛПС, необходимую для последовательного индуцирования симптомов шока, свин?...
Обсуждение
Мы представляем протокол индуцирования экспериментальной эндотоксисемии у свиней с помощью инфузии ЛПС, направленный на надежную индуцацию изменений, обычно наблюдаемых при сепсисе и септическом шоке. В этом протоколе необходимо учесть несколько важных шагов. Адекватная седация сви...
Раскрытие информации
Прибор NIRS был безоговорочно предоставлен компанией Medtronic PLC, США, для экспериментальных исследовательских целей. Александр Зибарт получил гонорар за лекцию от компании Medtronic PLC. Ни один из авторов не сообщает о каких-либо финансовых или иных конфликтах интересов. Рукопись была вычитана и отредактирована ChatGPT® (Python Software, версия: 24 мая 2023 г.).
Благодарности
Авторы благодарят Дагмар Дирвонскис за отличную техническую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| Atracurium Hikma 50 mg/5mL | Hikma Pharma GmbH, Martinsried | ||
| Azaperone (Stresnil) 40 mg/mL | Lilly Deutschland GmbH, Bad Homburg, Germany | ||
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy, AB Helsingborg, Schweden | 3-way-stopcock | |
| Curafix i.v. classics | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Cannula retention dressing | |
| Datex Ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | hemodynamic monitor | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland, GmbH | perfusor line | |
| Intrafix Primeline | B. Braun Melsungen AG, Melsungen, Germany | Infusion line | |
| Introducer sheath 5 Fr. | Terumo Healthcare | arterial introducer | |
| INVOS | Medtronic, Dublin, Ireland | near infrared spectrometry | |
| JOZA Einmal Nitril Untersuchungshandschuhe | JOZA, München, Germany | disposable gloves | |
| Laryngoscope, 45.48.50, KL 2000 | Medicon | Laryngoscope handle | |
| Littmann Classic III Stethoscope | 3M Deutschland GmbH, Neuss, Germany | stethoscope | |
| LPS (E. coli; Serotype O111:B4) | Sigma-Aldrich, Switzerland | ||
| MAC Two-Lumen Central venous access set | Arrow international inc. Reading, PA, USA | venous introducer | |
| Maimed Vlieskompresse | Maimed GmbH, Neuenkirchen, Germany | Fleece compress to fix the tongue | |
| Masimo LNCS Adtx SpO2 sensor | Masimo Corporation Irvine, Ca 92618 USA | saturation clip for the tail | |
| Masimo LNCS TC-I SpO2 ear clip sensor | Masimo Corporation Irvine, Ca 92618 USA | Saturation clip for the ear | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Midazolam 15 mg/3 mL | B.Braun Melsungen AG, Germany | ||
| Midmark Canine Mask Small Plastic with Diaphragm FRSCM-0005 | Midmark Corp., Dayton, Ohio, USA | dog ventilation mask | |
| Monocryl surgical suture | Johnson & Johnson, Belgium | ||
| B.Braun Melsungen AG, Germany | saline solution | ||
| NaCl 0.9 % | Sanofi- Aventis, Seutschland GmbH | ||
| Octeniderm farblos | Schülke & Mayr GmbH, Nordenstedt, Germany | Alcoholic disinfectant | |
| Original Perfusor syringe 50 mL | B.Braun Melsungen AG, Germany | perfusor syringe | |
| PA-Katheter Swan Ganz 7.5 Fr 110 cm | Edwards Lifesciences LLC, Irvine CA, USA | Swan-Ganz catheter | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| PiCCO catheter | PULSION Medical Systems SE, Feldkirchen, DE | ||
| Potassium chloride 1 M | Fresenius, Kabi Germany GmbH | ||
| Propofol 2% 20 mg/mL (50 mL flasks) | Fresenius, Kabi Deutschland, GmbH | ||
| Pulse-contour continous cardiac output System PiCCO2 | PULSION Medical Systems SE, Feldkirchen, DE | ||
| Rüschelit Super Safety Clear >ID 6/6.5 /7.0 mm | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Sonosite Micromaxx Ultrasoundsystem | Sonosite Bothell, WA, USA | ultrasound | |
| Stainless Macintosh Größe 4 | Welch Allyn69604 | blade for laryngoscope | |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | Balanced electrolyte solution | |
| Vasco OP sensitive | B.Braun Melsungen AG, Germany | sterile gloves | |
| Vasofix Safety 22 G-16 G | B.Braun Melsungen AG, Germany | venous catheter | |
| VBM Cuff Manometer | VBM Medizintechnik GmbH, Sulz a.N., Germany | cuff pressure gauge |
Ссылки
- Vincent, J. -. L., Jones, G., David, S., Olariu, E., Cadwell, K. K. Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis. Critical Care. 23 (1), 196 (2019).
- Reinhart, K., et al. Recognizing sepsis as a Global Health Priority - A WHO Resolution. New England Journal of Medicine. 377 (5), 414-417 (2017).
- Cecconi, M., Evans, L., Levy, M., Rhodes, A. Sepsis and septic shock. The Lancet. 392 (10141), 75-87 (2018).
- Font, M. D., Thyagarajan, B., Khanna, A. K. Sepsis and septic shock - basics of diagnosis, pathophysiology and clinical decision making. Medical Clinics of North America. 104 (4), 573-585 (2020).
- Singer, M., et al. The Third International Consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 315 (8), 801 (2016).
- Jerala, R. Structural biology of the LPS recognition. International Journal of Medical Microbiology. 297 (5), 353-363 (2007).
- Copeland, S., Warren, H. S., Lowry, S. F., Calvano, S. E., Remick, D. Inflammation and the host response to injury investigators acute inflammatory response to endotoxin in mice and humans. Clinical and Diagnostic Laboratory Immunology. 12 (1), 60-67 (2005).
- Dickson, K., Lehmann, C. Inflammatory response to different toxins in experimental sepsis models. International Journal of Molecular Sciences. 20 (18), 4341 (2019).
- Bassols, A., Costa, C., Eckersall, P. D., Osada, J., Sabrià, J., Tibau, J. The pig as an animal model for human pathologies: A proteomics perspective. PROTEOMICS - Clinical Applications. 8 (9-10), 715-731 (2014).
- Meurens, F., Summerfield, A., Nauwynck, H., Saif, L., Gerdts, V. The pig: a model for human infectious diseases. Trends in Microbiology. 20 (1), 50-57 (2012).
- Ali, J., Cody, J., Maldonado, Y., Ramakrishna, H. Near-infrared spectroscopy (NIRS) for cerebral and tissue oximetry: analysis of evolving applications. Journal of Cardiothoracic and Vascular Anesthesia. 36, 2758-2766 (2022).
- . Getinge Deutschland GmbH PiCCO Technologie Erweitertes hämodynamisches Monitoring auf höchstem Niveau Available from: https://www.getinge.com/dam/hospital/documents/german/picco_haemodynamisches_monitoring_broschuere-de-non_us.pdf (2023)
- Breslow, M. J., Miller, C. F., Parker, S. D., Walman, A. T., Traystman, R. J. Effect of vasopressors on organ blood flow during endotoxin shock in pigs. American Journal of Physiology-Heart and Circulatory Physiology. 252 (2), H291-H300 (1987).
- Fink, M. P., et al. Systemic and mesenteric O2 metabolism in endotoxic pigs: effect of ibuprofen and meclofenamate. Journal of Applied Physiology. 67 (5), 1950-1957 (1989).
- Lado-Abeal, J., et al. Lipopolysaccharide (LPS)-induced septic shock causes profound changes in myocardial energy metabolites in pigs. Metabolomics. 14 (10), 131 (2018).
- Park, I., et al. Characterization of fecal peritonitis-induced sepsis in a porcine model. The Journal of Surgical Research. 244, 492-501 (2019).
- Jarkovska, D., et al. Heart rate variability in porcine progressive peritonitis-induced sepsis. Frontiers in Physiology. 6, 412 (2015).
- Kohoutova, M., et al. Vagus nerve stimulation attenuates multiple organ dysfunction in resuscitated porcine progressive sepsis. Critical Care Medicine. 47 (6), e461-e469 (2019).
- Vintrych, P., et al. Modeling sepsis, with a special focus on large animal models of porcine peritonitis and bacteremia. Frontiers in Physiology. 13, 1094199 (2022).
- Stengl, M., et al. Reduced L-type calcium current in ventricular myocytes from pigs with hyperdynamic septic shock. Critical Care Medicine. 38 (2), 579-587 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены