Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Lipopolysaccharid-Infusion als endotoxämisches Schockmodell für Schweine
In diesem Artikel
Zusammenfassung
Wir stellen ein Protokoll für ein experimentelles endotoxämisches Schockmodell bei Schweinen durch Infusion von Lipopolysaccharid zur Verfügung.
Zusammenfassung
Sepsis und septischer Schock treten häufig bei Patienten auf, die auf Intensivstationen behandelt werden, und gehören zu den häufigsten Todesursachen bei diesen Patienten. Es wird durch eine fehlregulierte Immunantwort auf eine Infektion verursacht. Auch bei optimierter Behandlung bleiben die Sterblichkeitsraten hoch, was weitere Einblicke in die Pathophysiologie und neue Behandlungsmöglichkeiten notwendig macht. Lipopolysaccharid (LPS) ist ein Bestandteil der Zellmembran gramnegativer Bakterien, die häufig für Infektionen verantwortlich sind, die Sepsis und septischen Schock verursachen.
Der Schweregrad und die hohe Mortalität von Sepsis und septischem Schock machen standardisierte experimentelle Studien am Menschen unmöglich. Daher wird ein Tiermodell für weitere Studien benötigt. Das Schwein ist für diesen Zweck besonders gut geeignet, da es dem Menschen in Anatomie, Physiologie und Größe sehr ähnlich ist.
Dieses Protokoll bietet ein experimentelles Modell für den endotoxämischen Schock bei Schweinen durch LPS-Infusion. Wir konnten zuverlässig Veränderungen induzieren, die häufig bei Patienten mit septischem Schock beobachtet werden, einschließlich hämodynamischer Instabilität, Atemversagen und Azidose. So können Forschende wertvolle Erkenntnisse über diese hochrelevante Erkrankung gewinnen und neue Therapieansätze in einem experimentellen Setting evaluieren.
Einleitung
Sepsis und septischer Schock gehören zu den häufigsten Todesursachen bei Patienten, die intensivmedizinisch behandelt werden 1,2,3. Sepsis entsteht, wenn eine Infektion eine fehlregulierte Immunantwort auslöst, die zu einem Multiorganversagen führt. Sie ist gekennzeichnet durch lebensbedrohliche Symptome, einschließlich hämodynamischer Instabilität, Atemnot, Leber- und Nierenversagen sowie kognitiver Beeinträchtigung 4,5. Der septische Schock stellt eine Untergruppe der Sepsis mit besonders schweren Symptomen dar, die die Mortalität signifikant erhöhen. Zu diesen Symptomen gehören eine anhaltende Hypotonie, die eine Vasopressortherapie erfordert, und ein Serumlaktatspiegel von mehr als 2 mmol∙L-1 4,5. Die Mortalitätsraten bei Patienten mit septischem Schock wurden auf bis zu 40 % geschätzt, selbst bei Krankenhausbehandlung 1,3,5.
Gramnegative Bakterien wie Pseudomonas und Escherichia coli verursachen häufig Infektionen, die diese fehlregulierte Immunantwort auslösen4. Die zugrundeliegenden pathophysiologischen Mechanismen sind komplex und noch nicht vollständig verstanden. Ein gut beschriebener Aspekt ist die Aktivierung von Toll-like-Rezeptoren auf Immunzellen durch pathogen-assoziierte molekulare Muster (PAMPs), die zur Freisetzung von Zytokinen wie Tumornekrosefaktor-alpha (TNFα) oder Interleukin 1 (IL 1)4 führen. Eines dieser PAMPs ist das Lipopolysaccharid (LPS), das einen Bestandteil der Zellmembran in gramnegativen Bakterien darstellt6. LPS wurde in Tiermodellen eingesetzt, um Endotoxämie und endotoxämischen Schockzu induzieren 7,8.
Tiermodelle bieten ein kontrolliertes und standardisiertes Umfeld, um neuartige Behandlungsstrategien zu entwickeln und zu untersuchen. Aufgrund seiner ähnlichen Anatomie, immunologischen Physiologie und vergleichbaren hämodynamischen Parameter eignet sich das Schweinemodell besonders gut für die Untersuchung der Auswirkungen eines endotoxämischen Schocks 9,10. Darüber hinaus können medizinische Standardgeräte, die üblicherweise bei menschlichen Patienten verwendet werden, aufgrund der ähnlichen Größe ihrer Atemwege und Blutgefäße problemlos bei Schweinen eingesetzt werden, was die Instrumentierung und hämodynamische Überwachung erleichtert.
Mit diesem Protokoll stellen wir ein experimentelles Modell für den endotoxämischen Schock bei Schweinen durch intravenöse Infusion von LPS aus E. coli zur Verfügung. Um die Auswirkungen zu überwachen, maßen wir hämodynamische und pulmonale Parameter, einschließlich arteriellen Blutdrucks, Herzfrequenz, periphere Sauerstoffsättigung, pulmonalarterieller Druck und Atemwegsdruck. Um den Einfluss der Endotoxämie auf die zerebrale Sauerstoffversorgung zu bewerten, verwendeten wir Nahinfrarotspektrometrie (NIRS). Bei diesem Verfahren kann die zerebrale Sauerstoffsättigung über eine auf die Stirn applizierte Klebeelektrode11 ausgewertet werden.
Protokoll
Die Versuche in diesem Protokoll wurden vom Landesuntersuchungsamt Rheinland-Pfalz, Koblenz, Deutschland, TVA G21-1-080 genehmigt. Die Experimente wurden nach den ARRIVE-Richtlinien durchgeführt. Für diese Studie wurden sechs gesunde männliche deutsche Landrasseschweine im Alter von 2-3 Monaten und einem Gewicht von 30-35 kg verwendet. Der experimentelle Zeitplan ist in Abbildung 1 zusammengefasst. Die Details zu allen in diesem Protokoll verwendeten Materialien und Instrumenten sind in der Materialtabelle aufgeführt.
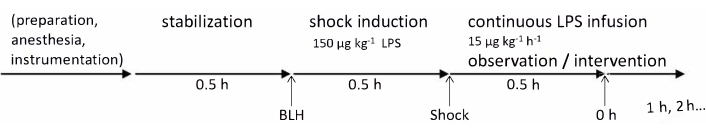
Abbildung 1: Experimenteller Zeitplan. Nach der Vorbereitung des Tieres und einer 30-minütigen Stabilisierungsphase wurden grundlegende Gesundheitsmessungen durchgeführt. Die Endotoxämie wurde durch LPS-Injektion über 30 Minuten induziert und nach weiteren 30 Minuten wurden 0-h-Messungen durchgeführt; Danach wurden die stündlichen Messungen 4 h lang fortgesetzt. Abkürzungen: BLH = Baseline healthy; LPS = Lipopolysaccharid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Tierische Vorbereitung
- Halten Sie die Tiere so lange wie möglich in ihrer gewohnten Umgebung, um Stress zu minimieren. Halten Sie die Nahrung vor der Verabreichung der Anästhesie 6 Stunden lang zurück und lassen Sie gleichzeitig freien Zugang zu Wasser.
- Sedieren Sie die Tiere mit einer intramuskulären Injektion von Azaperon (3 mg∙kg-1) und Midazolam (0,5 mg kg-1), während sie sich noch in ihrer normalen Umgebung befinden.
- Sobald die Sedierung wirksam wird, was in der Regel innerhalb von etwa 15-20 Minuten nach der Verabreichung der Fall ist, transportieren Sie die Schweine ins Labor.
HINWEIS: Es ist wichtig sicherzustellen, dass die kontinuierliche Sedierung während des gesamten Transfers aufrechterhalten wird. Je nach Landesgesetzgebung kann dies die ständige Überwachung durch einen Tierarzt erfordern. - Achten Sie genau darauf, die normale Körpertemperatur der Schweine (~38 °C) während des Transports aufrechtzuerhalten. Erwägen Sie zum Beispiel, das Tier mit einer Decke zu bedecken, um Unterkühlung zu vermeiden.
HINWEIS: Es ist wichtig, die Transportzeit so zu begrenzen, dass die Dauer der Sedierung, die normalerweise zwischen 30 Minuten und 60 Minuten liegt, nicht überschritten wird. - Stellen Sie nach der Desinfektion einen intravenösen Zugang her, indem Sie einen 22-G-Katheter in die Ohrvene einführen. Bevor Sie mit einer weiteren Bewegung des Schweins oder der Einleitung einer Anästhesie fortfahren, stellen Sie sicher, dass der Katheter sicher fixiert ist, um eine Luxation durch plötzliche Bewegungen zu verhindern.
- Überwachen Sie kontinuierlich die periphere Sauerstoffsättigung mit einem Sensor, der am Schwanz oder Ohr befestigt ist.
2. Anästhesie und mechanische Beatmung
- Verabreichen Sie intravenös Fentanyl (4 μg kg-1) und Propofol (3 mg kg-1), um eine Anästhesie einzuleiten.
- Bringen Sie das Schwein in Rückenlage.
- Verabreichen Sie Atracurium (0,5 mg kg-1) als Muskelrelaxans und leiten Sie sofort die nicht-invasive Beatmung mit einer Hundebeatmungsmaske ein. Legen Sie die Maske über die Schnauze und üben Sie mit den Daumen festen Druck aus, während Sie den Unterkiefer mit dem Mittel-/Ringfinger nach vorne ziehen. Stellen Sie das Beatmungsgerät auf die folgenden Parameter ein: inspiratorischer Sauerstoffanteil (FiO2 ) = 100 %, Atemzugvolumen = 6-8 ml kg-1, Exspirationsdruck am positiven Ende (PEEP) = 5 mbar, inspiratorischer Spitzendruck ≤ 20 mbar, Atemfrequenz = 18-20 min-1.
- Halten Sie die Anästhesie aufrecht, indem Sie eine kontinuierliche Infusion einer ausgewogenen Elektrolytlösung (5 ml kg-1 h-1), Fentanyl (10 μg kg-1 h-1) und Propofol (6 mg kg-1 h-1) einleiten.
- Führen Sie die endotracheale Intubation mit einem Standard-Endotrachealtubus (ID 6-7 mm), einem Führungsdraht und einem Laryngoskop mit einer Macintosh-Klinge (Größe 4) durch.
- Lassen Sie einen Assistenten den Mund öffnen und halten Sie die Zunge auf die linke Seite.
- Setzen Sie die Macintosh-Klinge ein, bis die Epiglottis sichtbar ist. Heben Sie dann das Laryngoskop nach oben, um die Epiglottis ventral zu bewegen und die Stimmbänder sichtbar zu machen. Gelegentlich kann die Epiglottis am weichen Gaumen kleben; Mobilisieren Sie es in diesem Fall, indem Sie mit der Tube oder einer Bougie sanft zur Seite wischen.
- Führen Sie den Endotrachealtubus vorsichtig durch die Stimmbänder und entfernen Sie den Induktor. Wenn Sie auf Schwierigkeiten stoßen, versuchen Sie, das Rohr ohne übermäßige Kraft zu drehen. Verwenden Sie bei Bedarf ein kleineres Rohr. Sobald der Schlauch angebracht ist, blasen Sie die Manschette mit 10 ml Luft auf.
- Schließen Sie den Endotrachealtubus an das Beatmungsgerät an und leiten Sie die Beatmung ein. Bestätigen Sie die korrekte Positionierung des Röhrchens, indem Sie endexspiratorisches CO2 erkennen und eine bilaterale Auskultation durchführen. Verwenden Sie die folgenden Beatmungseinstellungen: FiO2 = 40 %, Tidalvolumen = 6-8 ml kg-1, PEEP = 5 mbar, Einatmungs- zu Exspirationsverhältnis = 1:2, Atemfrequenz = angepasst, um einen endtidalen CO2 -Gehalt von <45 mmHg zu erreichen, typischerweise 30-40 min-1 .
HINWEIS: Wenn der Schlauch falsch in die Speiseröhre eingeführt wurde, bläst Luft den Magen auf und verursacht eine sichtbare Ausbuchtung. Entfernen Sie in solchen Fällen sofort den Schlauch, führen Sie eine nicht-invasive Beatmung für 1-2 Minuten durch und positionieren Sie den Schlauch richtig. - Führen Sie eine Magensonde ein, um Reflux oder Erbrechen zu verhindern. Wenn sich das Einführen als schwierig erweist, verwenden Sie das Laryngoskop, um eine bessere Sicht auf den Speiseröhreneingang zu erhalten.
3. Instrumentierung
- Legen Sie eine arterielle und eine zentrale Venenleitung in die Oberschenkelarterie bzw. -vene zur hämodynamischen Überwachung und intravenösen Volumentherapie.
- Verwenden Sie Bandagen, um die Hinterbeine zurückzuziehen und zu sichern, um einen besseren Zugang zu den Oberschenkelgefäßen zu erhalten.
- Bereiten Sie alle notwendigen Materialien vor der Instrumentierung vor. Füllen Sie alle Katheter mit Kochsalzlösung und sorgen Sie für einen einfachen Zugang zu Drähten und Kathetern, um die Notwendigkeit mehrerer Katheterisierungsversuche und unnötigen Blutverlust zu minimieren.
- Tragen Sie ein alkoholisches Desinfektionsmittel auf die Leistengegend auf und wischen Sie es mit einem sterilen Tupfer ab. Wiederholen Sie diesen Vorgang zweimal. Tragen Sie das Desinfektionsmittel erneut auf, ohne es abzuwischen, und warten Sie 3 Minuten. Legen Sie ein steriles Fenstertuch über den Leistenbereich.
- Verwenden Sie Ultraschall, um die femoralen Blutgefäße zu identifizieren. Verwenden Sie eine ultraschallgesteuerte Seldinger-Technik zur Katheterisierung, um Gewebeschäden und Blutverlust zu minimieren.
- Visualisieren Sie die Oberschenkelarterie in Längsrichtung. Punktieren Sie die Arterie mit einer Spritze, die an der Nadel befestigt ist, um eine kontinuierliche Aspiration zu erzielen. Hellrotes, pulsierendes Blut bestätigt die arterielle Punktion. Entfernen Sie die Spritze und führen Sie den vorbereiteten Draht ein. Entfernen Sie die Nadel, während Sie den Draht an Ort und Stelle lassen.
- Wiederholen Sie den gleichen Vorgang für die Oberschenkelvene. Die Venenpunktion wird durch langsam fließendes, dunkelrotes Blut bestätigt.
- Bestätigen Sie die korrekte Positionierung beider Drähte, indem Sie beide Oberschenkelgefäße mit Ultraschall sichtbar machen.
- Verwenden Sie die Seldinger-Technik, um zuerst die arterielle Einführschleuse einzuführen, gefolgt von der venösen Einführschleuse. Bestätigen Sie die korrekte Positionierung durch Blutgasanalyse von Blutproben, die aus den beiden Linien entnommen wurden.
- Stellen Sie sicher, dass Blut aus allen Leitungen abgesaugt werden kann. Spülen Sie alle Leitungen mit Kochsalzlösung, um die Bildung von Gerinnseln zu verhindern.
- Fixieren Sie die Linien sicher mit chirurgischen Nähten auf der Haut, um eine Luxation zu vermeiden.
- Verbinden Sie die arteriellen und zentralen Venenleitungen mit Schallköpfen zur Messung hämodynamischer Parameter.
- Führen Sie einen Pulskontur-Herzzeitvolumen-Katheter (PiCCO) in die arterielle Einführschleuse ein und verbinden Sie ihn mit dem arteriellen Druckwandler und dem Temperaturschnittstellenkabel des PiCCO-Monitors.
- Schließen Sie einen Swan-Ganz-Katheter an einen Schallkopf an.
- Führen Sie den Katheter während der kontinuierlichen Druckmessung in die zentrale Venenschleuse ein. Blasen Sie den Ballon nach ca. 30 cm auf, wenn eine zentrale venöse Druckkurve sichtbar wird.
- Schieben Sie den Katheter langsam vor, während Sie den Druckverlauf überwachen. Wenn der Katheter in den rechten Ventrikel eintritt, suchen Sie nach einer Pulskurve mit einem hohen systolischen und einem niedrigen diastolischen Wert. Ein weiteres Vorschieben des Katheters führt zu einem konsistenten systolischen Wert und einem erhöhten diastolischen Wert, was auf eine Platzierung in der Lungenarterie hinweist.
- Befestigen Sie den Katheter in dieser Position (normalerweise zwischen 50 und 70 cm). Verbinden Sie den Injektattemperatursensor des PiCCO-Systems mit dem proximalen Lumen des Swan-Ganz-Katheters.
- Rasieren Sie die Stirn des Schweins und bringen Sie die selbstklebende Sensorelektrode an, um die zerebrale regionale Sauerstoffsättigung zu messen.
- Lassen Sie das Tier nach der Anästhesieeinleitung und Instrumentierung 30 Minuten lang stabilisieren oder bis sich die hämodynamischen Parameter stabilisiert haben, bevor Sie Basismessungen durchführen und einen endotoxämischen Schock auslösen.
4. Schock-Induktion
HINWEIS: Tragen Sie bei der Arbeit mit LPS immer Handschuhe, Schutzbrille, eine Maske und einen Laborkittel. Vermeiden Sie den direkten Kontakt mit LPS.
- Bereiten Sie eine LPS-Lösung mit einer Konzentration von 100 μg ml-1 vor, indem Sie 5 mg LPS in 50 ml 0,9 % NaCl lösen.
- Erhalten Sie unmittelbar vor Beginn der LPS-Infusion hämodynamische Basismessungen.
- Verabreichen Sie eine Dosis von 150 μg kg-1 LPS über 30 min (entspricht einer kontinuierlichen Infusionsrate von 300 μg kg-1∙h-1 für 30 min).
- Nach 30 min die Infusionsrate für den Rest des Experiments auf 15 μg∙kg-1∙h-1 reduzieren.
- Kontinuierliche Überwachung hämodynamischer Parameter, einschließlich arterieller und pulmonaler arterieller Blutdruck, Herzfrequenz und Beatmungsparameter. Überwachen Sie die Körpertemperatur kontinuierlich, um die Normothermie aufrechtzuerhalten.
5. Behandlung der hämodynamischen Instabilität
- Wenn der mittlere arterielle Blutdruck unter 60 mmHg fällt, verwenden Sie PiCCO, um den Herzindex (CI), den globalen enddiastolischen Volumenindex (GEDI) und den extravaskulären Lungenwasserindex (ELWI) zu messen. Behandeln Sie den niedrigen Blutdruck gemäß den Empfehlungen im Flussdiagramm in Abbildung 2.
- Drücken Sie auf dem PiCCO-Monitor die Thermodilutionstaste (TD).
- Drücken Sie die Taste für die Eingabe des zentralvenösen Drucks (CVP) und geben Sie den aktuellen CVP-Wert ein.
- Drücken Sie die Start-Taste.
- Wenn Sie dazu aufgefordert werden, injizieren Sie 10 ml kalte Kochsalzlösung in den Injekttemperatursensor, der an den Swan-Ganz-Katheter angeschlossen ist.
HINWEIS: Injizieren Sie nichts anderes direkt vor oder während der PiCCO-Messung, da dies die Messung beeinträchtigen würde.
- Nach Messungen für CI, GEDI und ELWI wird die hämodynamische Instabilität gemäß dem Flussdiagramm in Abbildung 2 behandelt. Wenn eine Volumenbeladung empfohlen wird, schnell 200 ml ausgewogene Elektrolytlösung infundieren. Wenn eine Katecholamintherapie empfohlen wird, erhöhen Sie die Rate der Noradrenalininfusion um 1 μg kg-1 h-1.
- Wiederholen Sie diesen Vorgang, wenn der mittlere arterielle Blutdruck unter 60 mmHg fällt. Entscheiden Sie sich bei schwerer hämodynamischer Instabilität für eine schnelle Eskalation der Therapie.
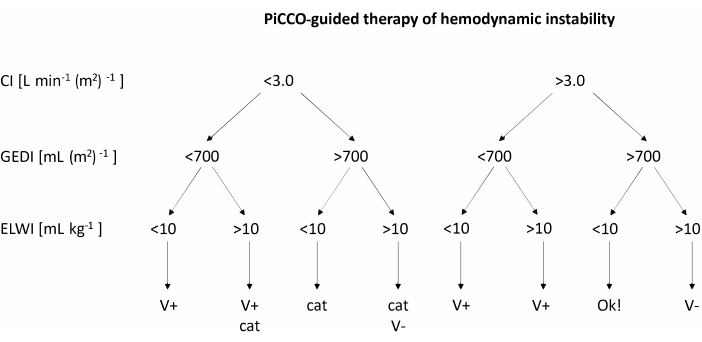
Abbildung 2: PiCCO-gesteuerte Therapie der hämodynamischen Instabilität. Nachdem Sie Messungen für CI, GEDI und ELWI erhalten haben, wenden Sie die Behandlung gemäß der Tabelle an. Diese Abbildung wurde aus dem PiCCO-Benutzerhandbuch12 übernommen. Abkürzungen: PiCCO = Pulskontur Herzzeitvolumen; V+ = Volumenbelastung; Katze = Katecholamin-Therapie; V- = Volumenreduzierung; CI = Herzindex; GEDI = globaler enddiastolischer Volumenindex; ELWI = extravaskulärer Lungenwasserindex. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
6. Ende des Versuchs und Euthanasie
- Injizieren Sie 0,5 mg Fentanyl intravenös. Warten Sie 5 Minuten. Injizieren Sie 200 mg Propofol.
- Euthanasieren Sie das Schwein mit einer schnellen Injektion von 40 ml 1 M Kaliumchlorid über den zentralen Venenzugang.
Ergebnisse
Für diese Studie wurden sechs gesunde männliche Schweine im Alter von 2-3 Monaten und einem Gewicht von 30-35 kg betäubt und erhielten eine Infusion von Lipopolysaccharid (LPS), um eine Endotoxämie zu induzieren. Um die geeignete LPS-Dosis zu bestimmen, die erforderlich ist, um konsistent Schocksymptome auszulösen, wurden den Schweinen über einen Zeitraum von 30 Minuten verschiedene Induktionsdosen von LPS verabreicht, die von 100 μg kg-1 bis 200 μg kg-1 reichten, gefolgt von einer Erhaltung...
Diskussion
Wir stellen ein Protokoll zur Induktion experimenteller Endotoxämie bei Schweinen durch LPS-Infusion vor, das darauf abzielt, Veränderungen, die häufig bei Sepsis und septischem Schock beobachtet werden, zuverlässig zu induzieren. In diesem Protokoll müssen mehrere kritische Schritte berücksichtigt werden. Eine ausreichende Sedierung der Schweine vor dem Transport ist entscheidend, um eine stressbedingte Erhöhung der Katecholaminspiegel zu verhindern, die die Ergebnisse beeinträchtigen könnte. Die Intubation von...
Offenlegungen
Das NIRS-Gerät wurde von Medtronic PLC, USA, bedingungslos für experimentelle Forschungszwecke zur Verfügung gestellt. Alexander Ziebart erhielt ein Vortragshonorar von Medtronic PLC. Keiner der Autoren berichtet über finanzielle oder andere Interessenkonflikte. Das Manuskript wurde von ChatGPT® (Python Software, Version: 24. Mai 2023) Korrektur gelesen und bearbeitet.
Danksagungen
Die Autoren danken Dagmar Dirvonskis für ihre hervorragende technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Atracurium Hikma 50 mg/5mL | Hikma Pharma GmbH, Martinsried | ||
| Azaperone (Stresnil) 40 mg/mL | Lilly Deutschland GmbH, Bad Homburg, Germany | ||
| BD Discardit II Spritze 2, 5, 10, 20 mL | Becton Dickinson S.A. Carretera, Mequinenza Fraga, Spain | syringe | |
| BD Luer Connecta | Becton Dickinson Infusion Therapy, AB Helsingborg, Schweden | 3-way-stopcock | |
| Curafix i.v. classics | Lohmann & Rauscher International GmbH & Co. KG, Rengsdorf, Germany | Cannula retention dressing | |
| Datex Ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | hemodynamic monitor | |
| Engström Carestation | GE Heathcare, Madison USA | ventilator | |
| Fentanyl-Janssen 0.05 mg/mL | Janssen-Cilag GmbH, Neuss | fentanyl | |
| Führungsstab, Durchmesser 4.3 | Rüsch | endotracheal tube introducer | |
| Incetomat-line 150 cm | Fresenius, Kabi Deutschland, GmbH | perfusor line | |
| Intrafix Primeline | B. Braun Melsungen AG, Melsungen, Germany | Infusion line | |
| Introducer sheath 5 Fr. | Terumo Healthcare | arterial introducer | |
| INVOS | Medtronic, Dublin, Ireland | near infrared spectrometry | |
| JOZA Einmal Nitril Untersuchungshandschuhe | JOZA, München, Germany | disposable gloves | |
| Laryngoscope, 45.48.50, KL 2000 | Medicon | Laryngoscope handle | |
| Littmann Classic III Stethoscope | 3M Deutschland GmbH, Neuss, Germany | stethoscope | |
| LPS (E. coli; Serotype O111:B4) | Sigma-Aldrich, Switzerland | ||
| MAC Two-Lumen Central venous access set | Arrow international inc. Reading, PA, USA | venous introducer | |
| Maimed Vlieskompresse | Maimed GmbH, Neuenkirchen, Germany | Fleece compress to fix the tongue | |
| Masimo LNCS Adtx SpO2 sensor | Masimo Corporation Irvine, Ca 92618 USA | saturation clip for the tail | |
| Masimo LNCS TC-I SpO2 ear clip sensor | Masimo Corporation Irvine, Ca 92618 USA | Saturation clip for the ear | |
| Masimo Radical 7 | Masimo Corporation Irvine, Ca 92618 USA | periphereal oxygen saturation | |
| Midazolam 15 mg/3 mL | B.Braun Melsungen AG, Germany | ||
| Midmark Canine Mask Small Plastic with Diaphragm FRSCM-0005 | Midmark Corp., Dayton, Ohio, USA | dog ventilation mask | |
| Monocryl surgical suture | Johnson & Johnson, Belgium | ||
| B.Braun Melsungen AG, Germany | saline solution | ||
| NaCl 0.9 % | Sanofi- Aventis, Seutschland GmbH | ||
| Octeniderm farblos | Schülke & Mayr GmbH, Nordenstedt, Germany | Alcoholic disinfectant | |
| Original Perfusor syringe 50 mL | B.Braun Melsungen AG, Germany | perfusor syringe | |
| PA-Katheter Swan Ganz 7.5 Fr 110 cm | Edwards Lifesciences LLC, Irvine CA, USA | Swan-Ganz catheter | |
| Perfusor FM Braun | B.Braun Melsungen AG, Germany | syringe pump | |
| PiCCO catheter | PULSION Medical Systems SE, Feldkirchen, DE | ||
| Potassium chloride 1 M | Fresenius, Kabi Germany GmbH | ||
| Propofol 2% 20 mg/mL (50 mL flasks) | Fresenius, Kabi Deutschland, GmbH | ||
| Pulse-contour continous cardiac output System PiCCO2 | PULSION Medical Systems SE, Feldkirchen, DE | ||
| Rüschelit Super Safety Clear >ID 6/6.5 /7.0 mm | Teleflex Medical Sdn. Bhd, Malaysia | endotracheal tube | |
| Sonosite Micromaxx Ultrasoundsystem | Sonosite Bothell, WA, USA | ultrasound | |
| Stainless Macintosh Größe 4 | Welch Allyn69604 | blade for laryngoscope | |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | Balanced electrolyte solution | |
| Vasco OP sensitive | B.Braun Melsungen AG, Germany | sterile gloves | |
| Vasofix Safety 22 G-16 G | B.Braun Melsungen AG, Germany | venous catheter | |
| VBM Cuff Manometer | VBM Medizintechnik GmbH, Sulz a.N., Germany | cuff pressure gauge |
Referenzen
- Vincent, J. -. L., Jones, G., David, S., Olariu, E., Cadwell, K. K. Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis. Critical Care. 23 (1), 196 (2019).
- Reinhart, K., et al. Recognizing sepsis as a Global Health Priority - A WHO Resolution. New England Journal of Medicine. 377 (5), 414-417 (2017).
- Cecconi, M., Evans, L., Levy, M., Rhodes, A. Sepsis and septic shock. The Lancet. 392 (10141), 75-87 (2018).
- Font, M. D., Thyagarajan, B., Khanna, A. K. Sepsis and septic shock - basics of diagnosis, pathophysiology and clinical decision making. Medical Clinics of North America. 104 (4), 573-585 (2020).
- Singer, M., et al. The Third International Consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 315 (8), 801 (2016).
- Jerala, R. Structural biology of the LPS recognition. International Journal of Medical Microbiology. 297 (5), 353-363 (2007).
- Copeland, S., Warren, H. S., Lowry, S. F., Calvano, S. E., Remick, D. Inflammation and the host response to injury investigators acute inflammatory response to endotoxin in mice and humans. Clinical and Diagnostic Laboratory Immunology. 12 (1), 60-67 (2005).
- Dickson, K., Lehmann, C. Inflammatory response to different toxins in experimental sepsis models. International Journal of Molecular Sciences. 20 (18), 4341 (2019).
- Bassols, A., Costa, C., Eckersall, P. D., Osada, J., Sabrià, J., Tibau, J. The pig as an animal model for human pathologies: A proteomics perspective. PROTEOMICS - Clinical Applications. 8 (9-10), 715-731 (2014).
- Meurens, F., Summerfield, A., Nauwynck, H., Saif, L., Gerdts, V. The pig: a model for human infectious diseases. Trends in Microbiology. 20 (1), 50-57 (2012).
- Ali, J., Cody, J., Maldonado, Y., Ramakrishna, H. Near-infrared spectroscopy (NIRS) for cerebral and tissue oximetry: analysis of evolving applications. Journal of Cardiothoracic and Vascular Anesthesia. 36, 2758-2766 (2022).
- . Getinge Deutschland GmbH PiCCO Technologie Erweitertes hämodynamisches Monitoring auf höchstem Niveau Available from: https://www.getinge.com/dam/hospital/documents/german/picco_haemodynamisches_monitoring_broschuere-de-non_us.pdf (2023)
- Breslow, M. J., Miller, C. F., Parker, S. D., Walman, A. T., Traystman, R. J. Effect of vasopressors on organ blood flow during endotoxin shock in pigs. American Journal of Physiology-Heart and Circulatory Physiology. 252 (2), H291-H300 (1987).
- Fink, M. P., et al. Systemic and mesenteric O2 metabolism in endotoxic pigs: effect of ibuprofen and meclofenamate. Journal of Applied Physiology. 67 (5), 1950-1957 (1989).
- Lado-Abeal, J., et al. Lipopolysaccharide (LPS)-induced septic shock causes profound changes in myocardial energy metabolites in pigs. Metabolomics. 14 (10), 131 (2018).
- Park, I., et al. Characterization of fecal peritonitis-induced sepsis in a porcine model. The Journal of Surgical Research. 244, 492-501 (2019).
- Jarkovska, D., et al. Heart rate variability in porcine progressive peritonitis-induced sepsis. Frontiers in Physiology. 6, 412 (2015).
- Kohoutova, M., et al. Vagus nerve stimulation attenuates multiple organ dysfunction in resuscitated porcine progressive sepsis. Critical Care Medicine. 47 (6), e461-e469 (2019).
- Vintrych, P., et al. Modeling sepsis, with a special focus on large animal models of porcine peritonitis and bacteremia. Frontiers in Physiology. 13, 1094199 (2022).
- Stengl, M., et al. Reduced L-type calcium current in ventricular myocytes from pigs with hyperdynamic septic shock. Critical Care Medicine. 38 (2), 579-587 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten