A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصوير الكالسيوم الحي للطبقات العضوية المعوية البشرية المصابة بالفيروس باستخدام مؤشرات الكالسيوم المشفرة وراثيا
In This Article
Summary
يصف هذا البروتوكول نهجا لإجراء تصوير الكالسيوم في العضويات المعوية البشرية المصابة بالفيروس ويقدم نهجا للتحليل.
Abstract
إشارات الكالسيوم هي منظم متكامل لكل الأنسجة تقريبا. داخل ظهارة الأمعاء ، يشارك الكالسيوم في تنظيم النشاط الإفرازي ، وديناميات الأكتين ، والاستجابات الالتهابية ، وتكاثر الخلايا الجذعية ، والعديد من الوظائف الخلوية الأخرى غير المميزة. على هذا النحو ، يمكن أن يوفر رسم خرائط ديناميكيات إشارات الكالسيوم داخل ظهارة الأمعاء نظرة ثاقبة للعمليات الخلوية الاستتبابية ويكشف النقاب عن استجابات فريدة لمختلف المحفزات. الكائنات العضوية المعوية البشرية (HIOs) هي نموذج عالي الإنتاجية مشتق من الإنسان لدراسة ظهارة الأمعاء ، وبالتالي تمثل نظاما مفيدا للتحقيق في ديناميكيات الكالسيوم. تصف هذه الورقة بروتوكولا لتحويل HIOs بثبات باستخدام مؤشرات الكالسيوم المشفرة وراثيا (GECIs) ، وإجراء الفحص المجهري الفلوري الحي ، وتحليل بيانات التصوير لتوصيف إشارات الكالسيوم بشكل هادف. كمثال تمثيلي ، تم تحويل HIOs ثلاثية الأبعاد مع فيروس lentivirus للتعبير بثبات عن GCaMP6s ، وهو GECI خلوي أخضر قائم على البروتين الفلوري. ثم تم تشتيت HIOs المصممة هندسيا في تعليق أحادي الخلية وبذرها كطبقة أحادية. بعد التمايز ، أصيبت أحاديات HIO بفيروس الروتا و / أو عولجت بالأدوية المعروفة بتحفيز استجابة الكالسيوم. سمح مجهر التألق الفائق المزود بغرفة تصوير حية مرطبة يتم التحكم في درجة حرارتها بالتصوير طويل الأمد للطبقات الأحادية المصابة أو المعالجة بالأدوية. بعد التصوير ، تم تحليل الصور المكتسبة باستخدام برنامج التحليل المتاح مجانا ، ImageJ. بشكل عام ، ينشئ هذا العمل خط أنابيب قابل للتكيف لتوصيف الإشارات الخلوية في HIOs.
Introduction
الكالسيوم هو رسول ثان محفوظ على نطاق واسع يلعب دورا مهما في تنظيم علم وظائف الأعضاء الخلوية1. نظرا لشحنته القوية وصغر حجمه وقابليته العالية للذوبان في الظروف الفسيولوجية ، فإن الكالسيوم هو مناور مثالي لتشكل البروتين. هذا يجعل الكالسيوم وسيلة قوية لتحويل الإشارات الكهروكيميائية إلى تعديلات إنزيمية أو نسخية أو ما بعد النسخ. تخلق تدرجات تركيز الكالسيوم الصارمة عبر الشبكة الإندوبلازمية (ER) وأغشية البلازما قوة دافعة عالية تسمح بتغيرات سريعة في تركيز الكالسيوم الخلوي. آليات متعددة ، بما في ذلك كل من التخزين المؤقت والنقل النشط ، تحافظ بإحكام على هذا التدرج. في حين أن هذه الصيانة ضرورية للوظائف الخلوية العادية ، إلا أنها مكلفة للغاية ، مما يجعلها عرضة بشكل خاص في حالات الإجهاد 2.
على هذا النحو ، فإن عدم تنظيم الكالسيوم داخل السيتوسول هو إشارة شبه عالمية لأنواع كثيرة من الإجهاد الخلوي. يمكن أن تؤدي الاضطرابات الأيضية والسموم ومسببات الأمراض والأضرار الميكانيكية والاضطرابات الوراثية إلى تعطيل إشارات الكالسيوم. بغض النظر عن التحفيز ، على مستوى الخلية الكاملة ، يمكن أن تؤدي الارتفاعات المستمرة وغير المنضبطة في الكالسيوم الخلوي إلى تعزيز موت الخلايا المبرمج وفي النهاية نخر 3,4. ومع ذلك ، فإن التغيرات في مستويات الكالسيوم الخلوية ذات السعة المنخفضة أو التردد الأعلى لها تأثيرات متفاوتة2. وبالمثل ، قد تختلف نتائج تقلبات الكالسيوم بناء على المجال الدقيق المكاني الذي تحدث فيه5. وبالتالي ، يمكن أن توفر مراقبة مستويات الكالسيوم نظرة ثاقبة لعمليات الإشارات الديناميكية ، ولكن هذا يتطلب أخذ عينات بدقة زمنية ومكانية عالية نسبيا.
مؤشرات الكالسيوم المشفرة وراثيا (GECIs) هي أدوات قوية لأخذ العينات المستمرة في أنظمة الخلايا الحية6. بعض GECIs الأكثر استخداما هي بروتينات الفلورسنت المستجيبة للكالسيوم القائمة على GFP والمعروفة باسم GCaMPs7. GCaMP المتعارف عليه هو مزيج من ثلاثة مجالات بروتينية متميزة: GFP متغير دائريا (cpGFP) ، كالمودولين ، و M136. يخضع مجال الكالمودولين لتغيير التشكل عند ربط الكالسيوم ، مما يسمح بتفاعله مع M13. يؤدي تفاعل الكالمودولين-M13 إلى حدوث تغيير توافقي في cpGFP يزيد من انبعاث الفلورسنت عند الإثارة. على هذا النحو ، ترتبط الزيادة في تركيز الكالسيوم بزيادة شدة مضان GCaMP. يمكن أن تكون هذه المستشعرات خلوية أو تستهدف عضيات معينة8.
على غرار معظم الأنسجة ، ينظم الكالسيوم مجموعة متنوعة من الوظائف داخل ظهارة الجهاز الهضمي. تعتبر ظهارة الأمعاء جزءا لا يتجزأ من امتصاص المغذيات والسوائل ولكن يجب أيضا أن تشكل حاجزا ضيقا وواجهة مناعية لتجنب غزو مسببات الأمراض أو الإهانات السامة. تؤثر المسارات المعتمدة على الكالسيوم على جميع هذه الوظائف الحيوية تقريبا9،10،11. ومع ذلك ، لا تزال إشارات الكالسيوم داخل ظهارة الأمعاء حدودا غير مستكشفة مع إمكانات واعدة كهدف علاجي. بينما تستمر مراقبة ديناميكيات الكالسيوم داخل ظهارة الأمعاء في الجسم الحي في تقديم تحديات ، تقدم الكائنات العضوية المعوية البشرية (HIOs) نظاما قابلا للتكيف خارج الجسم الحي للتجريب12. HIOs هي كرويات ثلاثية الأبعاد (3D) مشتقة من الخلايا الجذعية المعوية البشرية ، وعند التمايز ، تلخص الكثير من التنوع الخلوي لظهارة الأمعاء الأصلية12.
يصف هذا البروتوكول طرقا شاملة لهندسة HIOs التي تعبر عن GECIs ثم إعداد HIOs المهندسة كطبقة أحادية لتصوير الكالسيوم بالخلايا الحية. يقدم العدوى الفيروسية كمثال على التلاعب المرضي الذي يعطل إشارات الكالسيوم ويوفر نهجا تحليليا لتحديد هذه التغييرات.
Protocol
تم اشتقاق جميع الكائنات العضوية المعوية البشرية (HIOs) المستخدمة في هذا البروتوكول والتجارب التمثيلية من الأنسجة البشرية التي تم الحصول عليها وصيانتها بواسطة مركز تكساس الطبي للأمراض الهضمية المعوية. تم جمع جميع العينات وفقا لبروتوكول وافق عليه مجلس المراجعة المؤسسية في كلية بايلور للطب.
1. تحضير المواد والكواشف
- لصيانة المواد العضوية ، اجمع ألواح 24 بئرا المعالجة بزراعة الخلايا ، ومصفوفة الغشاء القاعدي (BMM) ، والأنابيب المخروطية سعة 15 مل ، والأنابيب المخروطية سعة 1.5 مل.
- لتحضير وسائط كاملة بدون عوامل نمو (CMGF-) ، إلى 500 مل من DMEM F12 المتقدم ، أضف 5 مل من 1M HEPES ، 5 مل من 100x مضاد حيوي مضاد حيوي ، 5 مل من 100x مكمل الجلوتامين.
- لتحضير الوسائط المحتوية على Wnt- و R-spondin- و Noggin (WRNE) ، امزج أجزاء متساوية من الوسائط المكيفة CMGF و Wnt ، أضف وسيطا مكيف Noggin ، 10٪ من حيث الحجم ، وسط R-spondin مكيف ، 20٪ من حيث الحجم ، 50 نانوغرام / مل عامل نمو البشرة البشري ، 10 mM نيكوتيناميد ، 10 نانومتر [Leu15] - Gastrin I ، 500 نانومتر A-83-01 ، 10 ميكرومتر SB202190 ، 1x B27 ملحق ، 1x N2 ملحق ، و 1 mM N-acetylcysteine.
- لنقل الفيروسات العدسية ، تحضير مصل الجنين البقري (FBS) ، 0.05٪ Trypsin-EDTA في 1x محلول ملحي مخزن بالفوسفات (PBS) ، CMGF- مع 10٪ FBS ، معقم 1x PBS ، بوليبرين ، 10 ميكرومتر Y-27632 ، فيروس Lentivirus ، Wnt WRNE عالي + 10 ميكرومتر Y-27632
- لتوليد طبقة أحادية العضوية ، قم بإعداد شريحة زراعة الخلايا ذات 10 آبار ذات القاع الزجاجي ، FBS ، الكولاجين الرابع (1 مجم / مل في غير المتأين (di) H2O) ، مصفوفة الغشاء القاعدي ، 0.5 mM EDTA في 1x PBS ، 5 mM EDTA في 1x PBS ، المخزن المؤقت للتفكك الأنزيمي ، CMGF- مع 10٪ FBS ، WRNE + 10 ميكرومتر Y-27632.
- للعدوى الفيروسية للطبقات العضوية الأحادية ، قم بإعداد التربسين ، مخزون فيروس الروتا ، CMGF- ، إبرة 25G ، معقمة 1x PBS ، ووسائط تمايز خالية من الفينول الأحمر.
- لتحضير وسائط تمايز خالية من الفينول الأحمر ، خذ 500 مل من وسائط زراعة الخلايا الخالية من الفينول الأحمر ، وأضف 5 مل من الأحماض الأمينية غير الأساسية 100x MEM ، و 5 مل من 100x L-Glutamine ، و 5 مل من 100 nM بيروفات الصوديوم ، و 7.5 مل من 1M HEPES.
- لتلطيخ التألق المناعي للعضويات ، قم بإعداد 4٪ فورمالديهايد (16٪ فورمالديهايد مخفف في 1x PBS) ، Triton X-100 (0.1٪ Triton X-100 في 1x PBS) ، ألبومين مصل الأبقار (3٪ ألبومين مصل بقري في 1x PBS) ، محلول NH4Cl (50 mM) ، DAPI (1 ميكروغرام / مل محلول DAPI في 1x PBS).
2. هندسة المواد العضوية للتعبير عن مستشعرات الكالسيوم المشفرة وراثيا
ملاحظة: يصف هذا البروتوكول خطوات تحويل بئر واحد من عضويات معوية بشرية ثلاثية الأبعاد مطلية ب 30 ميكرولتر من مصفوفة الغشاء القاعدي (BMM) على لوحة 24 بئر13. ستحتوي معظم الخطوط على حوالي 400000 خلية لكل بئر. يجب تضمين بئر ثان غير محول كعنصر تحكم. احتفظ بجميع الكواشف ومعلقات الخلايا على الجليد.
- بعد 2-5 أيام من الممر الأخير ، قم بإزالة وسيط WRNE للصيانة من بئرين من HIOs. استبدل ب 300 ميكرولتر من 0.05٪ Trypsin-EDTA لكل بئر وماصة برفق لأعلى ولأسفل 5x لفصل BMM عن اللوحة. ضعيها في حاضنة 37 درجة مئوية لمدة 4 دقائق.
- أضف 500 ميكرولتر من CMGF- + 10٪ FBS لكل بئر. قم بطلاء طرف ماصة منخفض الربط سعة 1 مل مسبقا باستخدام FBS عن طريق سحب 1 مل من FBS لأعلى ولأسفل 2x. يمكن إعادة استخدام FBS على نصائح متعددة. مع الطرف المطلي مسبقا ، ماصة HIOs لأعلى ولأسفل 10x.
- انقل محتويات كل بئر إلى أنبوب الطرد المركزي الدقيق المطلي مسبقا سعة 1.5 مل. اشطف كل بئر ب 500 ميكرولتر إضافية من CMGF - وأضف الغسيل إلى الأنبوب المعني.
- أجهزة الطرد المركزي الأنابيب عند 100 × جم في جهاز طرد مركزي دلو متأرجح لمدة 5 دقائق عند 4 درجات مئوية. إزالة طاف وأي BMM المتبقية.
- إعادة التعليق في 1 مل من 1x PBS. قسم كل أنبوب إلى أنبوبي طرد مركزي دقيقين ل 4 أنابيب إجمالية. أجهزة الطرد المركزي الأنابيب في 100 × غرام لمدة 5 دقائق عند 4 درجات مئوية. إزالة طاف.
- أعد تعليق كل أنبوب مرة إضافية واحدة في 1x PBS وأجهزة الطرد المركزي عند 100 × g لمدة 5 دقائق عند 4 درجات مئوية.
- تحضير 400 ميكرولتر من وسط التنبيغ ووسط التحكم (الجدول 1). إعادة تعليق أنبوبين في 200 ميكرولتر من وسط التحكم وأنبوبين في 200 ميكرولتر من وسط النقل.
- احتضان في حاضنة زراعة الخلايا 37 درجة مئوية لمدة 24 ساعة. أعد التعليق عن طريق السحب لأعلى ولأسفل بطرف مطلي بشكل دوري (على سبيل المثال ، 2 ساعة بعد النقل (hpt) ، 12 hpt ، 18 hpt) لتشجيع النقل المنتظم.
- بعد 24 ساعة ، أنابيب الطرد المركزي عند 100 × جم لمدة 5 دقائق عند 4 درجات مئوية. إزالة طاف.
- أعد تعليق الحبيبات في 500 ميكرولتر من 1x PBS لغسلها. أجهزة الطرد المركزي عند 100 × جم لمدة 5 دقائق عند 4 درجات مئوية. إزالة طاف.
- باستخدام طرف ماصة بارد 200 ميكرولتر ، أعد تعليق كل من الكريات ال 4 في 30 ميكرولتر من BMM. ماصة بلطف لأعلى ولأسفل لتفريق بالتساوي.
- ضع محتويات كل أنبوب في بئره الخاص على لوحة 24 بئرا. احتضان لمدة 10 دقائق عند 37 درجة مئوية للسماح ل BMM بالتصلب قبل إضافة 500 ميكرولتر من HighWnt WRNE + 10μM Y-27632.
- اسمح ل HIOs المحولة بالنمو لمدة أسبوع واحد ، وتحديث الوسائط (HighWnt WRNE + 10 μM Y-27632) كل يوم. بعد 1 أسبوع ، تحقق من التعبير عن مؤشر الفلورسنت عن طريق الفحص المجهري. إذا كانت الإشارة قوية ، ابدأ في اختيار الدواء. إذا كانت الإشارة ضعيفة ، كرر التحويل كما هو موضح أعلاه.
- بمجرد إنشاء الخط ، تحقق من وظيفة مؤشر التألق عن طريق العلاج الناهض. 100nM ADP هو ناهض موثوق به للتحقق من صحة GCaMP. اختبار المواد العضوية 3D للتحقق الأولي كما هو موضح أدناه.
- بعد المرور ، قم بلوحة بئر (أو متعددة) من المواد العضوية في BMM على لوحة تصوير سفلية منفصلة. قم بطلاء المواد العضوية عند حوالي 1/3 من الكثافة الطبيعية لتجنب التداخل الزائد عند التصوير. لا تستمر في تمرير هذه HIOs بعد العلاج الناهض ، لأنه من الصعب ضمان العقم.
- انتظر 2-3 أيام حتى يتعافى HIOs بعد المرور. قبل التصوير ، قم بتبديل الوسائط إلى وسائط التمايز الخالية من الفينول الأحمر.
- باستخدام مجهر الفلورسنت ، قم بإعداد تشغيل لمدة 3 دقائق مع الصور التي تم الحصول عليها كل 5 ثوان باستخدام إثارة 488 نانومتر ومجموعة مرشح FITC / GFP. بعد 30 ثانية من التصوير ، أضف 100 نانومتر ADP أو التحكم في السيارة. استمر في التصوير حتى تعود الإشارة إلى خط الأساس القريب ، ~ 2 دقيقة. تشير الزيادة العابرة ~ 2 أضعاف في مضان GCaMP مع علاج ADP إلى نجاح وظيفة النقل والمستشعر الحيوي. للحصول على تقدير أكثر دقة لكفاءة النقل ، كرر اختبار ناهض مع التصوير باستخدام أحادي الطبقات المتولدة عبر العملية الموضحة في الجزء 3.
3. تحضير أحاديات الطبقات HIO للتصوير الفلوري الحي
- قم بتغطية جميع آبار شريحة الغرفة السفلية للتصوير المكونة من 10 آبار بالكولاجين الرابع. للقيام بذلك ، امزج 34 ميكرولتر من 1 مجم / مل من الكولاجين الوريدي مع 960 ميكرولتر من الماء منزوع الأيونات المعقم. أضف 95 ميكرولتر من محلول الكولاجين الوريدي المخفف إلى كل بئر واحتضانه عند 37 درجة مئوية لمدة 0.5-2 ساعة.
- قم بإزالة وسيط صيانة WRNE من 4 آبار من 3D HIOs. يجب أن تكون HIOs 5-7 أيام من آخر مرور لها.
ملاحظة: تتطلب لوحة 1 10 بئر عادة ~ 1.25 × 106 خلايا. يتطلب هذا عادة 2-4 آبار من 3D HIOs مطلية ب 30 ميكرولتر من BMM لكل منها ، ولكنها ستختلف بناء على الكثافة. - أضف 500 ميكرولتر من 1x PBS + 0.5 mM EDTA لكل بئر. مع طرف مطلي مسبقا سعة 1 مل ، ماصة لأعلى ولأسفل برفق لفصل BMM عن اللوحة. انقل التعليق إلى أنبوب مخروطي مطلي مسبقا سعة 15 مل ، مع الجمع بين الآبار المتشابهة في نفس الأنبوب.
- شطف كل بئر مع 500 ميكرولتر إضافية من PBS + 0.5 mM EDTA. جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية. إزالة BMM الطافية والمتبقية.
- باستخدام طرف مطلي مسبقا ، أعد تعليق الحبيبات المتبقية في 3 مل من PBS + 5 mM EDTA (لاحظ أن هذا هو 10x EDTA أكثر من الغسيل الأول).
- جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية. إزالة BMM الطافية والمتبقية. أعد تعليق الحبيبات في 2 مل من المخزن المؤقت للتفكك الأنزيمي.
- احتضن في حمام مائي بحبة 37 درجة مئوية لمدة 5 دقائق. أضف 3 مل من CMGF- + 10٪ FBS والماصة برفق للخلط.
- جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية. إزالة الطاف. أضف 1 مل من CMGF-.
- ماصة قوية لأعلى ولأسفل مع طرف مطلي مسبقا 80x-100x لتقسيم HIOs ميكانيكيا إلى خلايا مفردة. جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية. إزالة طاف.
- أعد التعليق في 1 مل من WRNE + 10 ميكرومتر Y-27632. احصل على عدد الخلايا للتعليق 1 مل.
- قم بتخفيف تعليق الخلية باستخدام WRNE + 10μM Y-27632 لتحقيق تركيز 1.25 × 105 خلايا / 100 ميكرولتر (1.25 × 106 خلايا / مل).
- باستخدام ماصة سعة 200 ميكرولتر ، قم بإزالة محلول الكولاجين من اللوحة المحضرة في الخطوة 1 ، حيث استقر الكولاجين الآن في قاع البئر. تجنب لمس قاع البئر بطرف الماصة.
- باستخدام طرف ماصة 200 ميكرولتر مطلي مسبقا ، أضف 100 ميكرولتر من محلول الخلية من الخطوة 3.11 (1.25 × 105 خلايا) لكل بئر.
- احتضان لمدة 24 ساعة في حاضنة زراعة الخلايا 37 درجة مئوية. بعد 24 ساعة ، قم بإزالة وسط الاستزراع من جميع الآبار واستبدله ب 100 ميكرولتر من وسط التمايز لكل بئر.
ملاحظة: عند هذه النقطة ، يجب أن تلتصق الخلايا باللوحة. لاحظ أن الطبقة الأحادية من المحتمل ألا تكون متقاربة أو مستوية بالكامل. - ضع الشريحة مرة أخرى في حاضنة زراعة الخلايا 37 درجة مئوية. قم بتحديث وسط التمايز كل 24 ساعة حتى تتلاقى الطبقة الأحادية. هذا يتطلب عادة 3-5 أيام من الطلاء. بعد هذه النقطة ، تكون الطبقات الأحادية جاهزة للتطبيقات النهائية.
4. العدوى الفيروسية من أحاديات الطبقات HIO
- تحضير لقاح الفيروس. إذا لزم الأمر ، يقوم التربسين بتنشيط مخزون الفيروسات. بالنسبة لفيروس الروتا ، أضف 10 ميكروغرام / مل من Worthington's Trypsin إلى مخزون الفيروس واحتضانه عند 37 درجة مئوية لمدة 1 ساعة.
- قم بتخفيف مخزون الفيروسات المنشط باستخدام إحدى الطريقتين التاليتين.
- إذا كنت تهدف إلى الحد الأقصى لعدد الخلايا المصابة باستخدام سلالة فيروسية واحدة فقط ، امزج 50 ميكرولتر من المخزون الفيروسي المنشط مع 50 ميكرولتر CMGF-.
- في حالة مقارنة سلالات متعددة ، قم بإعداد اللقاحات لتحقيق مضاعفات مكافئة للعدوى (MOIs). استخدم الصيغة التالية لتحديد حجم مخزون الفيروسات لكل بئر ضروري ل MOI المطلوب. أضف CMGF- إلى حجم مخزون الفيروسات المحسوب لتحقيق حجم نهائي قدره 100 ميكرولتر لكل بئر.
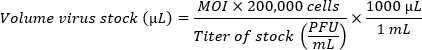
ملاحظة: تحتوي طبقة أحادية الطبقة واحدة من HIO مطلية في بئر بقطر 5.46 مم (لوحة 96 بئرا) على حوالي 200000 خلية. بسبب ضعف كفاءة العدوى في الطبقة الأحادية ، يفضل وجود MOI مرتفع (100-1 مليون جسيم فيروسي لكل خلية). يجب تحديد وزارة الداخلية المثلى تجريبيا.
- تصيب الطبقة الأحادية عن طريق إزالة الوسائط برفق من الطبقة الأحادية HIO باستخدام ماصة سعة 200 مل. استبدل ب 100 مل من لقاح الفيروس أو اللقاح الوهمي.
- نظرا لأن معظم مخزونات الفيروسات العجلية تنتشر في خلايا MA104 ، استخدم محللة خلية MA104 غير المصابة لللقاح الوهمي. استخدم حجما مكافئا لحجم مخزون الفيروسات المستخدم في الآبار المصابة وأضف CMGF- لحجم نهائي قدره 100 مل لكل بئر.
- بالنسبة للفيروسات التي تصيب الخلايا القاعدية ، مثل فيروس الروتا14 ، استخدم إبرة 25G لتسجيل الطبقة الأحادية. من الأسهل عمل درجة واحدة عبر طول الطبقة الأحادية ، من أسفل إلى أعلى البئر. اضغط برفق على الإبرة في الطبقة الأحادية بزاوية بحيث يكون الجانب المائل لأعلى ، عكس اتجاه الحركة ، واسحبه عبر طول الطبقة الأحادية لإنشاء ندبة (الشكل 2 أ).
- احتضان في حاضنة 37 درجة مئوية لمدة 2 ساعة. إزالة الفيروس ووهمية اللقاح. اغسل أحادي الطبقة مرة واحدة باستخدام 1x PBS.
- أضف 100 ميكرولتر من وسائط التمايز الخالية من الفينول الأحمر. ضع الشريحة في حاضنة 37 درجة مئوية حتى تصبح جاهزة للتصوير. ستختلف نافذة التصوير المثلى بناء على حركية العدوى الفيروسية. بالنسبة لفيروس الروتا ، ابدأ التصوير في 6-8 ساعات بعد الإصابة.
- قم بتخفيف مخزون الفيروسات المنشط باستخدام إحدى الطريقتين التاليتين.
5. Ca2+ تصوير أحاديات الطبقات المصابة
- سخني حاضنة المسرح مسبقا إلى 37 درجة مئوية. قم بتشغيل CO 2 المرطبعند 0.02 لتر / دقيقة. ضع الشريحة مع أحاديات الطبقات المصابة في غرفة الحاضنة وأغلق الغطاء.
- باستخدام إضاءة برايتفيلد (BF) وهدف 20x ، حدد إحداثيات X و Y لحقول الرؤية داخل الطبقة الأحادية التي سيتم تصويرها. من الأفضل تحديد النقاط مع عرض المنطقة المسجلة ، حيث ستكون معظم الخلايا المصابة بالقرب من نقطة الصفر.
- تحسين معلمات التصوير والحصول على صورة باستخدام إثارة 488 نانومتر. لتقليل السمية الضوئية ، اضبط مصدر الضوء على 50٪ من الطاقة مع وقت تعرض يبلغ 50 مللي ثانية. قد تختلف معلمات الاستحواذ المناسبة ويجب تحسينها من خلال الحصول على عمليات استحواذ متعددة. تأكد من عدم تشبع وحدات البكسل. اضبط وقت التعرض والطاقة الضوئية حسب الحاجة لضمان إمكانية اكتشاف النطاق الديناميكي الكامل لمستشعر الكالسيوم الفلوري.
- في حالة استخدام فلوروفورات أخرى (على سبيل المثال ، الفيروسات الموسومة بالفلورسنت) ، كرر التحسين على هذه القنوات. قم بإعداد حلقة التصوير والحصول على صورة 488 نانومتر في كل إحداثيات X و Y محددة في حلقة 1 دقيقة. تخيل هذه الحلقة باستمرار. عند استخدام فيروس موسوم بالفلورسنت ، احصل على صورة على القناة المناسبةكل حلقة 10 (أي صورة واحدة / 10 دقائق).
- جمع الصور ل ~ 18 ساعة. في حالة استخدام الفيروسات بدون علامات الفلورسنت ، قم بإصلاح الطبقات الأحادية وإجراء تلطيخ المناعي لتحديد الخلايا المصابة. قم بإجراء ذلك بعد إكمال تشغيل التصوير كما هو موضح أدناه.
- قم بإزالة وسائط التصوير واستبدلها ب 100 ميكرولتر من 4٪ فورمالديهايد في 1x PBS. احتضان في درجة حرارة الغرفة لمدة 30 دقيقة.
- قم بإزالة المثبت والتبريد ب 100 ميكرولتر من 50mM NH4Cl لمدة 10 دقائق. قم بإزالة NH4Cl. قم بتخلل الطبقات الأحادية ب 100 ميكرولتر من 0.1٪ Triton X-100 في 1x PBS لمدة 1 ساعة في درجة حرارة الغرفة أو طوال الليل عند 4 درجات مئوية.
- إزالة المخزن المؤقت للنفاذية. كتلة مع 100 ميكرولتر من 3 ٪ ألبومين مصل البقر في 1x PBS لمدة 1 ساعة.
- قم بإزالة حل الحظر. أضف الأجسام المضادة الأولية المخففة إلى التركيز الموصى به / الأمثل في 1x PBS. أضف 100 ميكرولتر من محلول الأجسام المضادة لكل بئر.
- احتضان المبيت على حرارة 4 درجات مئوية مع هزاز لطيف. إزالة الأجسام المضادة الأولية. اغسل 3x مع 1x PBS.
- أضف الأجسام المضادة الثانوية المترافقة الفلورية المخففة إلى التركيز الموصى به / الأمثل في 1x PBS. أضف 100 ميكرولتر لكل بئر. احتضان لمدة 2 ساعة في درجة حرارة الغرفة.
ملاحظة: FPBase15 هو مورد رائع للمساعدة في اختيار العناصر الثانوية التي ستتجنب النزيف عند تعدد الإرسال. معظم الثانويات فعالة عند تخفيف 1: 1000 في 1x PBS. - إزالة الأجسام المضادة الثانوية. اصنع محلول DAPI 1 ميكروغرام / مل في 1x PBS وأضف 100 ميكرولتر لكل بئر. احتضان لمدة 20 دقيقة إزالة DAPI. اغسل 3x مع 1x PBS.
- احتفظ بطبقات أحادية ثابتة في 100 ميكرولتر من 1x PBS للتصوير. ضع الشريحة مرة أخرى على مرحلة المجهر ، وأعد تحميل إحداثيات X و Y من تشغيل التصوير المباشر ، وقم بتصوير كل نقطة متعددة على القناة تتوافق مع الجسم المضاد الثانوي الذي تم استخدامه للتلطيخ. قم بالرجوع إلى الصور من تشغيل التصوير المباشر لضمان التقاط نفس النقاط.
6. تحديد كمية موجات الكالسيوم بين الخلايا
- تأكد من أن فيجي هي مجرد تثبيت ImageJ (فيجي) مع المكونات الإضافية التالية: التنسيقات الحيوية (يجب أن تكون مثبتة مسبقا في فيجي ولكنها لن تكون في ImageJ) ؛ كتاب الطبخ: للتثبيت، من قائمة فيجي، انتقل إلى المساعدة > التحديثات > إدارة مواقع التحديث. تحقق من كتاب الطبخ. أعد تشغيل فيجي.
- قم بتقسيم ملف البيانات من تشغيل التصوير المباشر إلى ملفات متعددة ، مع فصل كل إحداثيات X و Y. في عناصر NES، حدد ملف > استيراد/تصدير > تقسيم النقاط المتعددة. حدد مجلدا للتصدير وبادئة مناسبة.
- افتح فيجي. قم بتحميل ملف واحد من النقاط المتعددة المنقسمة. إذا كنت تستخدم صورة متعددة القنوات ، فقم بتقسيم القنوات. حدد النافذة التي تحتوي على الصور من قناة 488 نانومتر (GCaMP).
- قم بتشغيل وظيفة DeltaF Up لتحديد التغيير في كل قيمة بكسل من نقطة زمنية إلى أخرى. للقيام بذلك ، حدد كتاب الطبخ > وظائف T > Delta F Up.
- قم بالتمرير خلال المكدس حتى يتم العثور على صورة بها موجة الكالسيوم. مع عرض موجة الكالسيوم ، قم بتعيين عتبة بالنقر فوق صورة > ضبط > العتبة. اضبط الحد الأدنى لتقليل مقدار الإشارة التي ليست جزءا من الموجة التي تجعلها تتجاوز العتبة. بالنسبة للصور ذات 16 بت التي تم الحصول عليها باستخدام المعلمات الموضحة أعلاه ، ابدأ بحد أدنى 600 واضبطه حسب الحاجة.
- قم بتشغيل محلل الجسيمات لتقسيم الموجات بالنقر فوق تحليل > تحليل الجسيمات. اضبط الحد الأدنى لحجم الموجة في ميكرومتر2 عن طريق ضبط النطاق. يتم ضبطه على 0-اللانهاية عند خط الأساس. بالنسبة لصور خلايا MA104 التي تم الحصول عليها باستخدام هدف 20x ، ابدأ بزيادة الحد الأدنى إلى 10000 ميكرومتر2 واضبطها حسب الاقتضاء.
- حدد مربعي عرض النتائج ومحو النتائج. من القائمة المنسدلة "إظهار"، حدد الخطوط العريضة، ثم انقر على موافق. يجب أن ينتج عن هذا 2 مخرجات: نافذة واحدة ، النتائج ، ستسرد كل موجة تم اكتشافها ، ومنطقة الموجة ، وقيم الشدة المتوسطة ، والحد الأدنى ، والحد الأقصى (بناء على دلتا F). ستتضمن النافذة الأخرى ، بعنوان رسم [اسم الملف] ، مكدسا جديدا مع الخطوط العريضة للموجات المجزأة. استخدم هذا للتحقق من اكتشاف الموجة. اضبط قيم العتبة ونطاق الحجم إذا لزم الأمر ، وأعد التحقق من مكالمات الموجة.
- لمعالجة الدفعات ، استخدم البرنامج النصي للماكرو المضمن (ملف الترميز التكميلي 1). للاستفادة من هذا ، اتبع الخطوات الموضحة أدناه.
- تقسيم النقاط المتعددة إلى ملفات مفردة كما هو موضح في الخطوة 6.2. افتح فيجي. حدد معالجة > دفعة > ماكرو. في مربع "الإدخال" ، قم بتوفير الخريطة للمجلد الذي يحتوي على الملفات متعددة النقاط المنقسمة. اترك مربع "الإخراج" فارغا.
- الصق البرنامج النصي من ملف الترميز التكميلي 1 في المربع. اضبط عتبة الكثافة وعتبة الحجم في البرنامج النصي لتعكس المعلمات المحسنة من الخطوتين 6.5 و6.6.
- انقر فوق معالجة. اعتمادا على عدد النقاط المتعددة وسرعة معالجة الكمبيوتر ، قد تستغرق معالجة جميع الصور 30 دقيقة أو أكثر. بمجرد الانتهاء ، ستتم كتابة البيانات في ملف جدول بيانات جديد باسم "إعادة تسميته بعد الكتابة" على سطح المكتب. يجب أن يحتوي ملف الإخراج ، لكل نقطة متعددة ، على عدد الموجات ومقاييس الموجة (المساحة ، متوسط الكثافة ، الحد الأدنى والحد الأقصى للكثافة ، وكثافة الكثافة).
النتائج
يوضح الشكل 1 أ قبة BMM تحتوي على عضويات معوية بشرية ثلاثية الأبعاد تم تحويلها للتعبير بثبات عن GCaMP6s. يوضح الشكل 1B نفس خط العضو المعاد طلاؤه كطبقة أحادية عند 24 و 48 و 72 ساعة بعد البذر. للتحقق من صحة وظيفة GCaMP6s ، تم تصوير الطبقة الأحادية بواسطة المجهر الفلوري كل 2 ثا...
Discussion
يمكن أن تكون التغيرات في مستويات Ca2+ الخلوية سببا ونتيجة للأمراض داخل الظهارة10،16،17. يمكن أن تؤدي الزيادات في الكالسيوم الخلوي إلى زيادة الإفراز مباشرة عن طريق تنشيط قناة الكلوريد المعتمدة على الكالسيوم TMEM16A18,19
Disclosures
وليس للمؤلفين مصالح مالية متنافسة يكشفون عنها.
Acknowledgements
تم دعم هذا العمل من خلال منح R01DK115507 و R01AI158683 (PI: J. M. Hyser) من المعاهد الوطنية للصحة (NIH). تم تقديم دعم المتدربين من قبل منح المعاهد الوطنية للصحة F30DK131828 (PI: J.T. Gebert) و F31DK132942 (PI: F. J. Scribano) و F32DK130288 (PI: K.A. Engevik). نود أن نشكر مركز تكساس الطبي لأمراض الجهاز الهضمي Enteroid Core لتوفير وسائط الصيانة العضوية.
Materials
| Name | Company | Catalog Number | Comments |
| Advanced DMEM F12 | Gibco | 12634028 | |
| [Leu15]-Gastrin I | Sigma-Aldrich | G9145 | |
| 0.05% Trypsin EDTA | Gibco | 25300054 | |
| 0.05% Trypsin EDTA | Gibco | 25300054 | |
| 1.5mL microcentrifuge tubes | Fisherbrand | 5408137 | |
| 15mL conical tubes | Thermofisher Scientific | 0553859A | |
| 16% formaldehyde | Thermofisher Scientific | 28906 | |
| 1M HEPES | Gibco | 15630080 | |
| 1M HEPES | Gibco | 15630080 | |
| 1X PBS | Corning | 21-040-CV | |
| 25 gauge needle | Thermofisher Scientific | 1482113D | |
| A-83-01 | Tocris | 2939 | |
| ADP | Sigma-Aldrich | A2754 | |
| Advanced DMEM F12 | Gibco | 12634028 | |
| Antibiotic-antimycocytic | Gibco | 15240062 | |
| Antibiotic-antimycotic | Gibco | 15240062 | |
| B27 Supplement | Gibco | 17504-044 | |
| Bovine serum albumin | FisherScientific | BP1600100 | |
| CellView Cell Culture Slide, PS, 75/25 MM, Glass Bottom, 10 compartments | Greiner | 543979 | |
| Collagen IV | Sigma Aldrich | C5533 | |
| DAPI | Thermofisher Scientific | D1306 | |
| EDTA | Corning | 46-034-CI | |
| Fetal bovine serum | Corning | 35010CV | |
| Fetal bovine serum | Corning | 35010CV | |
| Fluorobrite | Gibco | A1896701 | |
| GlutaMAX | Gibco | 35050079 | |
| GlutaMAX | Gibco | 35050079 | |
| Human epidermal growth factor | ProteinTech | HZ-1326 | |
| Lentivirus | VectorBuilder | (variable) | |
| Matrigel | BD Biosceicen | 356231/CB40230C | |
| N2 Supplement | Gibco | 17502-048 | |
| N-acetylcysteine | Sigma-Aldrich | A9165-5G | |
| NH4Cl | Sigma-Aldrich | A9434 | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| Nunc Cell Culture Treated 24-well Plates | Thermofisher Scientific | 142475 | |
| Polybrene | MilliporeSigma | TR1003G | |
| SB202190 | Sigma-Aldrich | S70767 | |
| Triton X-100 | Fisher BioReagents | BP151100 | |
| TrypLE Express Enzyme, no phenol red | Thermofisher Scientific | 12604013 | |
| Trypsin | Worthington Biochemical | NC9811754 | |
| Y-27632 | Tocris | 1254 |
References
- Bootman, M. D., Bultynck, G. Fundamentals of cellular calcium signaling: A primer. Cold Spring Harb Perspect Biol. 12 (1), a038802 (2020).
- Clapham, D. E. Calcium signaling. Cell. 131 (6), 1047-1058 (2007).
- Danese, A., et al. Cell death as a result of calcium signaling modulation: A cancer-centric prospective. Biochim Biophys Acta Mol Cell Res. 1868 (8), 119061 (2021).
- Harr, M. W., Distelhorst, C. W. Apoptosis and autophagy: Decoding calcium signals that mediate life or death. Cold Spring Harb Perspect Biol. 2 (10), a005579 (2010).
- Barak, P., Parekh, A. B. Signaling through Ca2+ microdomains from store-operated CRAC channels. Cold Spring Harb Perspect Biol. 12 (7), a035097 (2020).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nat Biotechnol. 19 (2), 137-141 (2001).
- Erofeev, A. I., Vinokurov, E. K., Vlasova, O. L., Bezprozvanny, I. B. GCaMP, a family of single-fluorophore genetically encoded calcium indicators. J Evol Biochem Phys. 59 (4), 1195-1214 (2023).
- Suzuki, J., Kanemaru, K., Iino, M. Genetically encoded fluorescent indicators for organellar calcium imaging. Biophys J. 111 (6), 1119-1131 (2016).
- Nászai, M., Cordero, J. B. Intestinal stem cells: Got calcium. Curr Biol. 26 (3), R117-R119 (2016).
- Barrett, K. E. Calcium-mediated chloride secretion in the intestinal epithelium: Significance and regulation. Curr Top Membr. 53, 257-282 (2002).
- Xu, J., et al. Calcium-sensing receptor regulates intestinal dipeptide absorption via Ca2+ signaling and IKCa activation. Physiol Rep. 8 (1), e14337 (2020).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Lin, S. C., Haga, K., Zeng, X. L., Estes, M. K. Generation of CRISPR–Cas9-mediated genetic knockout human intestinal tissue–derived enteroid lines by lentivirus transduction and single-cell cloning. Nat Protoc. 17 (4), 1004-127 (2022).
- Crawford, S. E., Ramani, S., Blutt, S. E., Estes, M. K. Organoids to dissect gastrointestinal virus-host interactions: What have we learned. Viruses. 13 (6), 999 (2021).
- Lambert, T. J. FPbase: a community-editable fluorescent protein database. Nat Methods. 16 (4), 277-278 (2019).
- Lai, Y., et al. Inhibition of calcium-triggered secretion by hydrocarbon-stapled peptides. Nature. 603 (7903), 949-956 (2022).
- Chang-Graham, A. L., et al. Rotavirus induces intercellular calcium waves through ADP signaling. Science. 370 (6519), eabc3621 (2020).
- Lee, B., et al. Anoctamin 1/TMEM16A controls intestinal Cl− secretion induced by carbachol and cholera toxin. Exp Mol Med. 51 (8), 1-14 (2019).
- Saha, T., et al. Intestinal TMEM16A control luminal chloride secretion in a NHERF1 dependent manner. Biochem Biophys Rep. 25, 100912 (2021).
- Mroz, M. S., Keely, S. J. Epidermal growth factor chronically upregulates Ca2+-dependent Cl− conductance and TMEM16A expression in intestinal epithelial cells. J Physiol. 590 (8), 1907-1920 (2012).
- Sui, J., et al. Dual role of Ca2+-activated Cl− channel transmembrane member 16A in lipopolysaccharide-induced intestinal epithelial barrier dysfunction in vitro. Cell Death Dis. 11 (5), 404 (2020).
- Bellono, N. W., et al. Enterochromaffin cells are gut chemosensors that couple to sensory neural pathways. Cell. 170 (1), 185-198.e16 (2017).
- Paradis, T., Bègue, H., Basmaciyan, L., Dalle, F., Bon, F. Tight junctions as a key for pathogens invasion in intestinal epithelial cells. Int J Mol Sci. 22 (5), 2506 (2021).
- Samak, G., et al. Calcium/Ask1/MKK7/JNK2/c-Src signalling cascade mediates disruption of intestinal epithelial tight junctions by dextran sulfate sodium. Biochem J. 465 (3), 503-515 (2015).
- Deng, H., Gerencser, A. A., Jasper, H. Signal integration by Ca2+ regulates intestinal stem cell activity. Nature. 528 (7581), 212-217 (2015).
- Saurav, S., Tanwar, J., Ahuja, K., Motiani, R. K. Dysregulation of host cell calcium signaling during viral infections: Emerging paradigm with high clinical relevance. Mol Aspects Med. 81, 101004 (2021).
- Chang-Graham, A. L., et al. Rotavirus calcium dysregulation manifests as dynamic calcium signaling in the cytoplasm and endoplasmic reticulum. Sci Rep. 9 (1), 10822 (2019).
- Hyser, J. M., Collinson-Pautz, M. R., Utama, B., Estes, M. K. Rotavirus disrupts calcium homeostasis by NSP4 viroporin activity. mBio. 1 (5), e00265-e00310 (2010).
- Pham, T., Perry, J. L., Dosey, T. L., Delcour, A. H., Hyser, J. M. The Rotavirus NSP4 viroporin domain is a calcium-conducting ion channel. Sci Rep. 7, 43487 (2017).
- Crawford, S. E., Hyser, J. M., Utama, B., Estes, M. K. Autophagy hijacked through viroporin-activated calcium/calmodulin-dependent kinase kinase-β signaling is required for rotavirus replication. Proc Natl Acad Sci U S A. 109 (50), E3405-E3413 (2012).
- Crawford, S. E., Criglar, J. M., Liu, Z., Broughman, J. R., Estes, M. K. COPII vesicle transport is required for Rotavirus NSP4 interaction with the autophagy protein LC3 II and trafficking to viroplasms. J Virol. 94 (1), e01341 (2019).
- Pando, V., Iša, P., Arias, C. F., Ló Pez, S. Influence of calcium on the early steps of Rotavirus infection. Virology. 295 (1), 190-200 (2002).
- Hyser, J. M., Estes, M. K. Pathophysiological consequences of calcium-conducting viroporins. Annu Rev Virol. 2 (1), 473-496 (2015).
- Strtak, A. C., et al. Recovirus NS1-2 has viroporin activity that induces aberrant cellular calcium signaling to facilitate virus replication. mSphere. 4 (5), e00506-e00519 (2019).
- In, J. G., Foulke-Abel, J., Clarke, E., Kovbasnjuk, O. Human colonoid monolayers to study interactions between pathogens, commensals, and host intestinal epithelium. J Vis Exp. (146), 59357 (2019).
- Hirota, A., AlMusawi, S., Nateri, A. S., Ordóñez-Morán, P., Imajo, M. Biomaterials for intestinal organoid technology and personalized disease modeling. Acta Biomater. 132, 272-287 (2021).
- Cevallos Porta, D., López, S., Arias, C. F., Isa, P. Polarized rotavirus entry and release from differentiated small intestinal cells. Virology. 499, 65-71 (2016).
- Mirabelli, C., et al. Human Norovirus efficiently replicates in differentiated 3D-human intestinal enteroids. J Virol. 96 (22), e0085522 (2022).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. Bioessays. 39 (8), 28749075 (2017).
- Li, J., et al. Engineering of NEMO as calcium indicators with large dynamics and high sensitivity. Nat Methods. 20 (6), 918-924 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved