Method Article
أنماط البروتين الديناميكية المستحثة بالضوء في الأغشية النموذجية
In This Article
Summary
هنا ، يتم وصف بروتوكول لتوليد أنماط بروتين منظمة بالضوء وقابلة للانعكاس بدقة زمانية مكانية عالية في الأغشية الدهنية الاصطناعية. تتكون الطريقة من التنشيط الضوئي الموضعي للبروتين iLID (dimer المحسن المحرض للضوء) الذي يجمد على أغشية نموذجية ترتبط ، تحت الضوء الأزرق ، ببروتين شريكها Nano (SspB من النوع البري).
Abstract
يؤدي التوطين الدقيق وتنشيط البروتينات في غشاء الخلية في وقت معين إلى ظهور العديد من العمليات الخلوية ، بما في ذلك استقطاب الخلية والهجرة والانقسام. وبالتالي ، فإن طرق تجنيد البروتينات لنمذجة الأغشية ذات الدقة تحت الخلوية والتحكم الزمني العالي ضرورية عند إعادة إنتاج هذه العمليات والتحكم فيها في الخلايا الاصطناعية. هنا ، يتم وصف طريقة لتصنيع أنماط البروتين القابلة للانعكاس المنظمة بالضوء في الأغشية الدهنية بدقة مكانية زمانية عالية. لهذا الغرض ، نقوم بشل حركة البروتين القابل للتبديل الضوئي iLID (دايمر محسن مستحث للضوء) على طبقات الدهون المزدوجة المدعومة (SLBs) وعلى الغشاء الخارجي للحويصلات أحادية الصفيحة العملاقة (GUVs). عند إضاءة الضوء الأزرق المحلي ، يرتبط iLID بشريكه Nano (SspB من النوع البري) ويسمح بتوظيف أي بروتين مهم (POI) مدمج في Nano من المحلول إلى المنطقة المضيئة على الغشاء. هذا الربط قابل للعكس في الظلام ، مما يوفر ربطا ديناميكيا وإطلاق POI. بشكل عام ، هذه طريقة مرنة ومتعددة الاستخدامات لتنظيم توطين البروتينات بدقة عالية في المكان والزمان باستخدام الضوء الأزرق.
Introduction
يؤدي تكوين أنماط البروتين على أغشية الخلايا داخل المناطق دون الخلوية إلى العديد من العمليات البيولوجية ، بما في ذلك الهجرة والانقسام والاتصال الموضعي من خلية إلى خلية 1,2. يتم تنظيم أنماط البروتين هذه في المكان والزمان ، وهي ديناميكية للغاية. يعد تكرار أنماط البروتين هذه في الخلايا الاصطناعية أمرا ضروريا لمحاكاة العمليات الخلوية التي تنشأ عنها ولاكتساب فهم أفضل لكيفية عمل هذا التنظيم على المستوى الجزيئي. على غرار ما لوحظ للأغشية في الخلايا الحية ، يجب أن تلتقط طرق توليد أنماط البروتين على الأغشية الاصطناعية ديناميكياتها وتوفر تحكما زمانيا مكانيا دقيقا.
من بين المحفزات المختلفة ، يبرز الضوء لتوفير أعلى تحكم زماني مكاني والعديد من المزايا الإضافية3. من خلال التنظيم بالضوء ، من السهل إضاءة المنطقة المرغوبة في أي وقت مرغوب فيه بدقة لا مثيل لها. بالإضافة إلى ذلك ، يوفر الضوء قابلية ضبط عالية حيث يمكن تعديل كل من شدة الضوء وفترات النبض. علاوة على ذلك ، فإن الضوء المرئي غير ضار بالجزيئات الحيوية ، بما في ذلك البروتينات ، ومن الممكن حتى معالجة وظائف متعددة بأطوال موجية مختلفة. ومن ثم ، فإن الأساليب المستجيبة للضوء القائمة على الضوء المرئي تظهر كطرق واعدة للتنظيم الخاضع للرقابة والتعامد لأنماط البروتين في المكان والزمان4،5،6. يوفر استخدام أزواج البروتين القابلة للتبديل الضوئي من علم البصريات الوراثي ، والتي تعمل كثنائي مستحث للضوء ، طريقة مباشرة لتجنيد بروتينات معينة إلى الأغشية. على وجه الخصوص ، تم تشكيل أنماط البروتين بنجاح على الأغشية الاصطناعية باستخدام التفاعل الناجم عن الضوء الأزرق بين iLID (دايمر محسن مستحث للضوء ، استنادا إلى مجال LOV2 القابل للتبديل الضوئي من Avena sativa) و Nano (SspB من النوع البري) 7,8 ، ونظام SpyTag المستحث للضوء الأزرق (BLISS) 9 ، ورباعي البروتين المستجيب للضوء الأخضر CarH10 والتفاعل المستحث للضوء الأحمر بين PhyB و PIF611.
لقد ثبت أن التفاعل الضوئي بين iLID و Nano5 يمكن استخدامه لبروتينات النمط الضوئي على الأغشية النموذجية باستخدام الضوءالأزرق 7. تفاعل iLID / Nano قابل للعكس في الظلام ، ومحدد للغاية ، ويعمل في ظل ظروف فسيولوجية. يتيح تثبيت iLID على نماذج الأغشية الدهنية ، مثل الحويصلات أحادية الصفيحة العملاقة (GUVs) أو طبقات الدهون المزدوجة المدعومة (SLBs) ، تجنيد النانو المنظم بالضوء لهذه الأغشية ، والذي يمكن عكسه في الظلام. والجدير بالذكر أننا لاحظنا أن إدخال مجال مضطرب إلى N-terminus من iLID (مما ينتج عنه بروتين يسمى disiLID) كحبل لغشاء دهني نموذجي يعزز كفاءة توظيف النانو وديناميكيات الارتداد8.
من خلال استخدام تفاعل disiLID / Nano ، قمنا بتطوير طريقة لتوليد أنماط عالية التباين من البروتينات ذات الأهمية النانوية (POI) على SLBs والأغشية الخارجية ل GUVs. تسمح هذه الطريقة بإنشاء أنماط بروتين بدقة مكانية وزمانية ملحوظة وقابلية انعكاس عالية في غضون دقائق. يحدد البروتوكول التفصيلي عملية تجنيد البروتينات محليا على الأغشية الاصطناعية. على وجه التحديد ، يتم تحقيق ذلك عن طريق تجميد نسخة بيوتينيل من disiLID على SLBs و GUVs من خلال تفاعل البيوتين والستربتافيدين (SAv). بعد ذلك ، يتم تجنيد نانو المسمى بالفلورسنت (mOrange-Nano) لهذه الأغشية الوظيفية disiLID تحت إضاءة الضوء الأزرق. يقدم بروتوكولنا التجريبي نهجا مباشرا وقابلا للتكيف لتحقيق توظيف البروتين الموضعي في الأغشية. والأهم من ذلك أن هذه المنهجية لا تقتصر على السطوح البينية SLB و GUV المبلغ عنها أو mOrange-Nano. يمكن أن يمتد إلى مواد وبروتينات أخرى تعمل بنظام disiLID تنصهر في Nano.
Protocol
1. التحضير التجريبي
- قم بشفط وتنقية البيوتينيلاتيد-ديسيليد (b-disiLID) و mOrange-Nano (انظر جدول المواد) باتباع الإجراءاتالمبلغ عنها سابقا 7,8.
- تحضير مخاليط الدهون في قوارير زجاجية مع تكوين الدهون المحددة والتركيزات. أولا ، قم بإذابة الليبيدات في الكلوروفورم للحصول على محلول دهني نهائي بتركيز 1 مجم / مل.
- خلط الدهون من أجل الحصول على تكوين 94.9 مول٪ 2-ديوليويل-سن-غليسيرو-3-فوسفوكولين (DOPC)، 5 مول٪ 1،2-ديوليويل-سن-غليسيرو-3-فوسفوإيثانولامينN- (غطاء بيوتينيل) ملح الصوديوم (DOPE-بيوتين) و 0.1 مول٪ 1،1'-ديوكتاديسيل-3،3،3'، 3'-رباعي ميثيل إندوديكاربوسيانين (DiD) (انظر جدول المواد).
ملاحظة: يمكن تعديل خليط الدهون بنسب متفاوتة وتركيز DOPE-biotin و / أو أصباغ غشاء مختلفة. يسمح تركيز DOPE-biotin الموصى به (5٪) بتكوين طبقة Streptavidin عالية الكثافة (SAv) في الخطوات التالية.
- خلط الدهون من أجل الحصول على تكوين 94.9 مول٪ 2-ديوليويل-سن-غليسيرو-3-فوسفوكولين (DOPC)، 5 مول٪ 1،2-ديوليويل-سن-غليسيرو-3-فوسفوإيثانولامينN- (غطاء بيوتينيل) ملح الصوديوم (DOPE-بيوتين) و 0.1 مول٪ 1،1'-ديوكتاديسيل-3،3،3'، 3'-رباعي ميثيل إندوديكاربوسيانين (DiD) (انظر جدول المواد).
- قم بإعداد حويصلات صغيرة أحادية الصفيحة (SUVs) باتباع الطرق المبلغ عنها سابقا7،8،12. في هذه الخطوة ، يوصى بإعداد سيارات الدفع الرباعي بقطر ≤100 نانومتر.
- لهذه الدراسة ، يتم استخدام طريقة صوتنة. أولا ، تبخر محلول الكلوروفورم في القارورة الزجاجية بتيار نيتروجين أثناء تدوير القوارير لتشكيل طبقة دهنية رقيقة. بعد ذلك ، قم بإزالة الكلوروفورم المتبقي لمدة 1 ساعة على الأقل تحت الفراغ.
- أعد ترطيب الطبقة المجففة في ماء فائق النقاء بتركيز نهائي قدره 1 مجم / مل من الدهون عن طريق الدوامة. أخيرا ، صوتنة الحل الذي تم الحصول عليه لمدة 10 دقائق حتى يصبح الحل غير الشفاف واضحا.
ملاحظة: تخزين خليط الدهون في أنبوب الطرد المركزي الدقيق في الثلاجة لمدة أقصاها 2 أسابيع. يمكن أيضا استخدام طرق تحضير سيارات الدفع الرباعي المختلفة (على سبيل المثال ، طريقة البثق) طالما أن حجم سيارات الدفع الرباعي النهائية ≤ 100 نانومتر.
- أعد ترطيب الطبقة المجففة في ماء فائق النقاء بتركيز نهائي قدره 1 مجم / مل من الدهون عن طريق الدوامة. أخيرا ، صوتنة الحل الذي تم الحصول عليه لمدة 10 دقائق حتى يصبح الحل غير الشفاف واضحا.
2. توظيف mOrange-Nano في SLBs وظيفية disiLID
- أضف 150 ميكرولتر من 2 M NaOH في كل بئر من غرفة القاع الزجاجي ذات القاع الزجاجي μ منزلق 18 (انظر جدول المواد) واحتضانها لمدة 1 ساعة في درجة حرارة الغرفة. بعد ذلك ، قم بإزالة هيدروكسيد الصوديوم وغسل الآبار 3-5 مرات أولا بمياه فائقة النقاء 150 ميكرولتر ، ثم 3 مرات باستخدام مخزن مؤقت 150 ميكرولتر (10 مللي متر Tris pH 7.4 ، 100 mM NaCl) يحتوي على 10 mM CaCl2.
- أضف 15 ميكرولتر من سيارات الدفع الرباعي الطازجة (تركيز المخزون 1 مجم / مل في الماء) إلى الآبار التي تحتوي على 150 ميكرولتر عازلة مع 10 مللي متر CaCl2 من أجل الحصول على ما يقرب من عامل 10 تخفيف من سيارات الدفع الرباعي في المخزن المؤقت. دع سيارات الدفع الرباعي تحتضن لمدة 30 دقيقة في درجة حرارة الغرفة. بعد وقت الحضانة ، سيتم تشكيل البيوتينيل-SLBs.
- اغسل SLBs 7 مرات على الأقل باستخدام المخزن المؤقت (10 mM Tris pH 7.4 ، 100 mM NaCl) بدون CaCl2 عن طريق إزالة المحلول أولا ثم إضافة مخزن مؤقت جديد في كل خطوة. يوصى باستخدام 80 ميكرولتر من المخزن المؤقت لكل خطوة غسيل.
ملاحظة: يتم الحصول على الغسيل الأمثل ل SLBs عن طريق سحب محلول جديد لأعلى ولأسفل عدة مرات دون لمس السطح. يجب أن يكون سحب المحلول في الآبار التي تحتوي على SLBs المشكلة حديثا لطيفا من أجل تقليل تكوين فقاعات الهواء الصغيرة التي من شأنها أن تلحق الضرر ب SLBs المشكلة. من هذه اللحظة فصاعدا ، يجب أن تحتوي الآبار على حجم كاف من المخزن المؤقت لمنع SLBs من الجفاف. - لمزيد من الأداء الوظيفي ل SLBs biotinylated مع SAv ، أضف محلول SAv إلى تركيز نهائي يبلغ 250 نانومتر واحتضانه لمدة 30 دقيقة في درجة حرارة الغرفة. بعد ذلك ، قم بإزالة فائض SAv عن طريق غسله بمخزن مؤقت (10 mM Tris pH 7.4 ، 100 mM NaCl) 5 مرات على الأقل.
- من هذه اللحظة فصاعدا ، احتفظ بالعينات تحت ضوء أحمر واقي لتجنب التنشيط الضوئي غير المرغوب فيه للبروتينات القابلة للتبديل الضوئي. أضف b-disiILD (انظر جدول المواد) إلى تركيز نهائي قدره 1 ميكرومتر في البئر. بعد 30 دقيقة من الحضانة في درجة حرارة الغرفة ، قم بإزالة البروتين الزائد عن طريق الغسيل باستخدام المخزن المؤقت 5 مرات على الأقل.
- أضف mOrange-Nano (انظر جدول المواد) إلى تركيز نهائي يبلغ 200 نانومتر واحتفظ بالعينة في الظلام عن طريق تغطيتها بورق الألمنيوم.
- ضع الشريحة μ تحت المجهر الفلوري واضبط إعدادات التصوير. اضبط ليزر 552 نانومتر لإثارة mOrange-Nano. اضبط نطاق الانبعاثات لتحسين إشارة mOrange. يتم تحقيق التنشيط الضوئي ل disiLID باستخدام ليزر 488 نانومتر ، باستخدام نبضات ضوئية بفواصل زمنية 2.58 ثانية.
3. إعداد GUVs
- تحضير محلول 5٪ (وزن / حجم) من كحول البولي فينيل (PVA ، انظر جدول المواد) (MW: 145000 جم / مول) مع سكروز 100 mM في ماء عالي النقاء ، مع الخلط طوال الليل عند 80 درجة مئوية عند 400 دورة في الدقيقة.
- تحضير محلول دهني في الكلوروفورم مع التركيبة المرغوبة (التركيز النهائي 10 ملغ / مل). لهذه الطريقة ، يوصى بتركيبة تتكون من 10 مجم / مل POPC ، 10 mol٪ 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho- (1'-rac-glycerol) (POPG) ، 2 mol٪ DOPE-biotin و 1 mol٪ DiD (انظر جدول المواد).
- تحضير GUVs بتقنية الترطيب 7,8. أولا ، انشر 40 ميكرولتر من محلول PVA المحضر كطبقة رقيقة متجانسة فوق شريحة زجاجية مقاس 60 مم × 24 مم ، ويفضل أن يكون ذلك بطرف ماصة. بعد ذلك ، جفف الطبقة الرقيقة على حرارة 50 درجة مئوية لمدة 30 دقيقة.
- انشر 5 ميكرولتر من محلول الدهون بإبرة على طبقة PVA واتركها تجف عند 30 درجة مئوية لمدة 1 ساعة.
- قم بتجميع حجرة على الشريحة الزجاجية الوظيفية باستخدام فاصل (~ 40 مم × 24 مم × 2 مم ، انظر جدول المواد) وشريحة زجاجية ثانية.
- أضف 1 مل من محلول الإماهة (10 مللي متر Tris pH 7.4 ، 100 mM NaCl) إلى الغرفة لمدة 1 ساعة في درجة حرارة الغرفة لتشكيل GUVs. بعد 1 ساعة ، اقلب الحجرة واضغط برفق على الأسطح الزجاجية بطرف ماصة.
- قم بإزالة الشريحة الزجاجية بعناية على جانب واحد لفتح الغرفة المبنية وحصاد GUVs باستخدام ماصة.
- ضع المحلول في أنبوب بلاستيكي واترك GUVs يستقر لمدة 2 ساعة.
4. mOrange-Nano Recruitment إلى GUVs وظيفية disiLID
- أضف محلول SAv إلى GUVs التي تم حصادها حديثا واتركها لمدة 30 دقيقة في درجة حرارة الغرفة.
ملاحظة: يجب تنفيذ الخطوات التالية بضوء أحمر واقي لتجنب التنشيط الضوئي ل disiLID. - أضف 1 ميكرومتر من b-disiLID إلى محلول GUVs وضع العينة لمدة 30 دقيقة في الظلام ، وقم بتغطيتها بورق الألمنيوم.
- قم بمعالجة حجرة سفلية زجاجية ذات 18 بئرا ذات μ منزلقة بمحلول BSA سعة 150 ميكرولتر (3٪ وزن / وزن في الماء) لمدة 10 دقائق. بعد ذلك ، قم بإزالة محلول BSA وغسل الآبار بمياه فائقة النقاء 150 ميكرولتر 3 مرات.
- أضف 145 ميكرولتر من 200 نانومتر mOrange-Nano في المخزن المؤقت (10 mM Tris pH 7.4 ، 100 mM NaCl) إلى البئر.
- بعد ذلك ، أضف 5 ميكرولتر من GUVs المزينة ب b-disiLID إلى المحلول وانتظر ~ 15 دقيقة حتى تستقر GUVs.
- ضع الشريحة μ تحت المجهر متحد البؤر. قم بإثارة العينة عند 552 نانومتر لتصور مضان mOrange (λex = 557 نانومتر ؛ λem = 576 نانومتر) وعند 638 نانومتر لتصور DiD (λex = 644 نانومتر ؛ λem = 665 نانومتر) في أغشية GUV. يتم تشغيل تجنيد mOrange-Nano بنبضات الضوء الأزرق (488 نانومتر ، شدة 1٪) كل 5.3 ثانية من أجل تقليل تأثيرات التبييض الضوئي غير المرغوب فيها.
ملاحظة: يمكن تكييف الأطوال الموجية للإثارة بناء على نوع المجهر المستخدم. الأطوال الموجية الشائعة الأخرى المتاحة للمجاهر هي أيضا ليزر 532 نانومتر أو 561 نانومتر و 633 نانومتر أو 647 نانومتر أو 639 نانومتر أو 640 نانومتر.
النتائج
تسمح الإجراءات الموصوفة بتكوين SLBs لتجنيد mOrange-Nano على الأغشية الاصطناعية. يظهر الشكل 1 أ تكوين mOrange-Nano المحدد المنقوش على SLBs التي تعمل مع b-disiLID. نظرا لأن منطقة الاهتمام (24 ميكرومتر × 24 ميكرومتر) (ROI) على SLB مضاءة بضوء أزرق 488 نانومتر ، لوحظت زيادة سريعة في إشارة التألق في قناة mOrange (كما هو موضح باللون الأحمر) في عائد الاستثمار في غضون 200 ثانية. يظهر النموذج حواف محددة وحادة للغاية (الشكل 1 ب) ، مما يشير إلى تحكم مكاني عالي في المنطقة المنشطة ضوئيا. التفاعل سريع وقابل للعكس تماما حيث تنقطع الإضاءة بالضوء الأزرق. تسمح هذه الطريقة أيضا بتكوين أنماط على مدار عدة دورات إضاءة (الشكل 2). تؤدي الدورات البديلة ~ 200 ثانية من الضوء الأزرق و 200 ثانية من الظلام إلى توظيف عكسي ل mOrange-Nano في المنطقة المحددة لعدة مرات مع قيم مماثلة لشدة Δ من التألق في الأنماط.
يوضح الشكل 3 التمثيل التخطيطي لإعداد GUVs. لوحظ أيضا تجنيد mOrange-Nano على GUVs. يتبين أن GUVs الموضوعة في الظلام لا تظهر مضان mOrange (الشكل 4A). نظرا لأن GUVs مضاءة عالميا بالضوء الأزرق ، لوحظ مضان mOrange ، بالتزامن مع صبغة غشاء GUV (DiD). التفاعل قابل للعكس بشكل كبير حيث يتم إنهاء الإضاءة. يظهر القياس الكمي لكثافة mOrange في غشاء GUV بمرور الوقت التوظيف السريع والفعال للبروتينات بالإضافة إلى قابلية الانعكاس الكاملة (الشكل 4B).
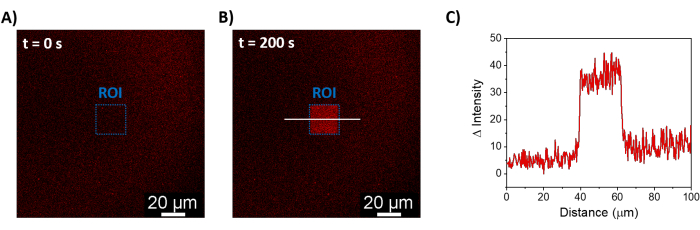
الشكل 1: صور مجهرية مضان ل SLBs تعمل مع b-disiLID. صور التألق في وجود mOrange-Nano قبل (A) وأثناء (B) إضاءة الضوء الأزرق المحلي (488 نانومتر) في عائد الاستثمار. شريط المقياس = 20 ميكرومتر. (C) شدة مضان mOrange مقاسة في عائد الاستثمار ل SLBs التي تعمل مع b-disiLID (عند = 200 ثانية). الشكل مقتبس من Di Iorio et al.8. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
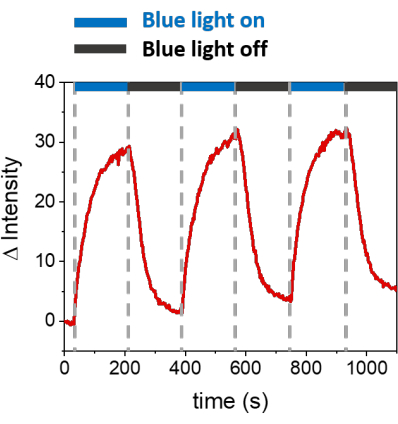
الشكل 2: كثافة مضان mOrange المعينين في عائد الاستثمار على SLBs المزينة ب b-disiLID خلال ثلاث دورات توظيف. بعد كل خطوة تنشيط ضوئي ، زاد مضان mOrange-Nano ضمن عائد الاستثمار. يصل النمط إلى التشبع في غضون 120 ثانية ، وينخفض التألق في غضون 120 ثانية ، تقريبا إلى مستويات الخلفية. لم يلاحظ أي فقدان لجودة النمط عبر دورات الضوء الأزرق / الظلام المختلفة. الشكل مقتبس من Di Iorio et al.8. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
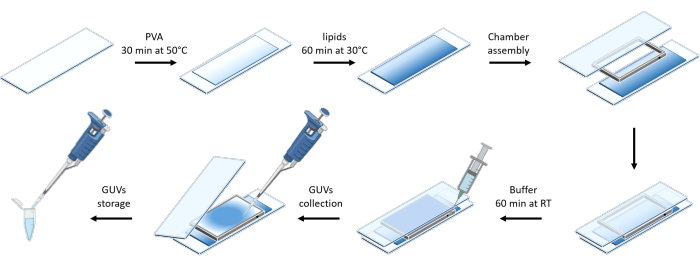
الشكل 3: تمثيل تخطيطي لإعداد GUVs باستخدام طريقة الترطيب اللطيف. يقدم المخطط تمثيلا مرئيا للخطوات العديدة والغرفة التي تم بناؤها باستخدام شريحتين زجاجيتين ومباعد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
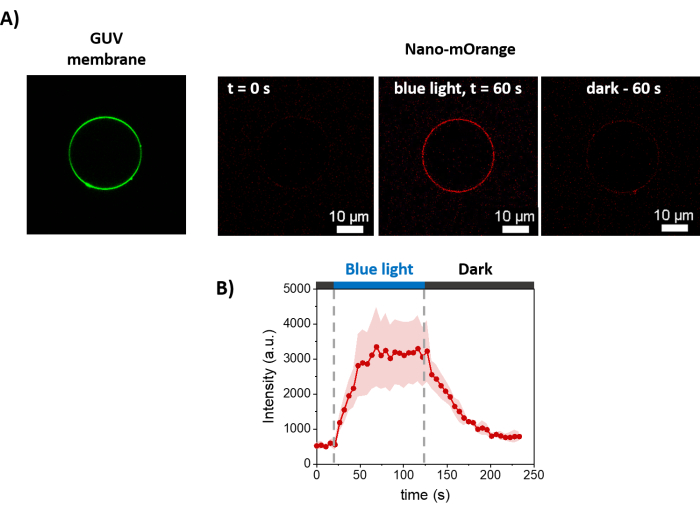
الشكل 4: قياسات الفحص المجهري الفلوري للتوظيف المعتمد على الضوء ل mOrange-Nano على أغشية GUVs. (أ) صور مضان ل GUV يعمل ب disiLID في وجود mOrange-Nano. باللون الأخضر توجد صبغة غشاء GUVs ، وباللون الأحمر هو مضان mOrange قبل وأثناء وبعد إضاءة الضوء الأزرق. قضبان المقياس = 10 ميكرومتر. (ب) شدة مضان mOrange المترجمة على GUV بمرور الوقت. عند الإضاءة ، يصل مضان mOrange (الموضح باللون الأحمر) على الغشاء الدهني إلى أقصى كثافة في غضون 60 ثانية ، مع زيادة شدة مضان بمقدار 5.9 أضعاف. مع توقف الإضاءة ، ينخفض مضان mOrange إلى قيم ما قبل الإضاءة تقريبا في غضون 60 ثانية (مع استرداد 90٪). الشكل مقتبس من Di Iorio et al.8. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
لقد وصفنا طريقة للتجنيد الموضعي لبروتينات mOrange-Nano على الأغشية النموذجية ، مثل طبقة الدهون المزدوجة المدعومة والحويصلات أحادية الصفيحة العملاقة باستخدام البروتين القابل للتبديل الضوئي disiLID8. تشمل الجوانب التي تساهم في جودة النمط جودة البروتينات بالإضافة إلى الجودة الجيدة ل SLBs و GUVs.
لضمان جودة بروتين جيدة بعد التعبير والتنقية ، من المهم أولا تقييم الخصائص القابلة للتبديل الضوئي ل disiLID. لهذا الغرض ، يجب قياس امتصاص العامل المساعد FMN في الظلام وبعد إضاءة الضوء الأزرق. من المتوقع أن تظهر أطياف الأشعة المرئية وفوق البنفسجية ل disiLID الذروة الثلاثية المميزة للعامل المساعد FMN في الظلام ، والتي تنخفض بشكل كبير عند إضاءة الضوء الأزرق وتتعافى في الظلام13. يعد هذا السلوك القابل للتبديل الضوئي أمرا بالغ الأهمية للحصول على توظيف قابل للتكرار وقابل للعكس في الخطوات التالية. العمل مع الضوء الأحمر الواقي وتعريض disiLID للحد الأدنى من الإضاءة الخارجية أثناء تحضير العينات يزيد من أداء التجارب.
خطوة أخرى حاسمة ، وربما الأكثر أهمية ، هي تشكيل SLBs المناسبة. ستؤثر العيوب في الأغشية و / أو تكوين SLBs غير المتجانسة (أي وجود SLBs متعددة الطبقات أو SLBs المصححة) على جودة نمط البروتين. لذلك ، بالنسبة للمستخدمين عديمي الخبرة ، يوصى بإعادة إنتاج البروتوكول عن طريق تسمية سيارات الدفع الرباعي ببعض أصباغ الغشاء ، مثل DiD و DiO ، من أجل تشكيل SLBs ذات العلامات الفلورية. بهذه الطريقة ، يمكن تمييز خصائص وجودة SLBs بشكل جيد باستخدام الفحص المجهري الفلوري. تمثل قياسات FRAP نهجا نموذجيا لتقييم جودة SLB من خلال تقييم سيولة الأغشية. بدلا من ذلك ، في حالة SLBs البيوتينيلية مثل تلك الموصوفة في هذا البروتوكول ، يمكن استخدام SAv المسمى بالفلورسنت (على سبيل المثال ، Atto 488-SAv) لتصور وتقييم جودة SLBs.
يصف الجزء الأول من البروتوكول تكوين الأنماط على SLBs. لضمان الحصول على أفضل نتيجة ، من المهم إضافة mOrange-Nano إلى SLBs وترك العينة تحضن في الظلام لمدة 15 دقيقة. أثناء التنشيط الضوئي ، لا يقتصر اختيار عائد الاستثمار على حجم معين. ومع ذلك ، يجب تنظيم كثافة الليزر ووقت التعرض من أجل تقليل التبييض الضوئي غير المرغوب فيه للبروتينات الفلورية.
لا تقتصر هذه الطريقة على البروتينات البيوتينيلية ، ويمكن استخدام طرق أخرى لترسيخ disiLID إلى SLBs. على سبيل المثال ، يمكن التعبير عن disiLID الموسوم به وتثبيته على SLBs المحتوية على Ni- NTA. ومع ذلك ، من الأهمية بمكان التعبير عن Nano و disiLID بعلامات مختلفة لتجنب استبدال البروتينات الموجودة على SLBs. تسمح هذه الطريقة أيضا بإمكانية عكس ترتيب البروتينات ، وبالتالي تشغيل SLBs مع Nano وتجنيد disiLID (أو البروتينات المنصهرة disiLID) عند إضاءة الضوء الأزرق.
للتحكم الديناميكي في توطين البروتين ، يجب أن يكون التوطين العكسي للبروتين في المنطقة المحددة ممكنا بشكل متكرر. لتحقيق ذلك ، يعد تركيز النانو (200 نانومتر) في المحلول معلمة حرجة للحصول على قابلية انعكاس عالية.
مصدر قلق آخر هو تجنيد نانو على سطح GUV الذي يعمل ب disiLID. كما هو الحال في نمط البروتين على SLBs ، يمكن توسيع هذه الطريقة لتشمل استراتيجيات وظيفية مختلفة للأغشية. في هذا البروتوكول ، تمت إضاءة GUV بالكامل بالضوء الأزرق لتجنيد mOrange-Nano على سطح GUV بأكمله. ومع ذلك ، يجب أن يؤدي اختيار عائد الاستثمار الصغير الموضعي على غشاء GUV إلى التوطين الدقيق للبروتينات في منطقة أكثر تقييدا.
لا تقدم هذه الطريقة سوى قيد يتعلق باختيار الفلوروفور المستخدم لتصوير توظيف النانو في غشاء سيارات الدفع الرباعي أو GUVs. على وجه الخصوص ، يجب تجنب الفلوروفورات ذات طيف الإثارة في نطاق الضوء الأزرق ، لأن استخدامها سيتداخل مع التنشيط الضوئي ل (dis) iLID. لذلك ، يوصى باختيار الفلوروفورات في نطاق الضوء الأخضر أو الأحمر (على سبيل المثال ، mOrange أو Cy5) لهذا النوع من التجارب.
يوفر تصميم disiLID طريقة بسيطة وقابلة للتكيف لتحسين توظيف البروتين المحلي للأغشية ويوسع النطاق الديناميكي ل iLID و Nano من علم البصرياتالوراثي 4. تركز هذه الطرق على توظيف النانو على الأغشية المقلدة مثل طبقات الدهون الثنائية و GUVs. ومع ذلك ، فإن هذا النهج قابل للتمديد ليشمل العديد من الأدوات الوراثية البصرية في الخلايا حيث ترتبط (dis) iLID أو Nano بغشاء.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم تمويل هذا العمل من قبل مجلس البحوث الأوروبي ERC بدء منحة الفنان (# 757593 SVW.). يشكر معهد دسمان للسكري مؤسسة ألكسندر فون هومبولت على زمالة ما بعد الدكتوراه.
Materials
| Name | Company | Catalog Number | Comments |
| µ-Slide 18 Well | Ibidi | 81817 | For SLB preparation |
| 25 µL Microliter Syringe | Hamilton | Model 702 N | For the preparation of lipid mixture and spreading the lipid solution on the PVA layer |
| Biotinyl Cap PE (1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl)) (sodium salt) | Avanti Polar Lipids | 870273C | For SUVs preparation |
| CaCl2 (Calcium chloride) | Sigma-Aldrich | C5670 | For SLB formation |
| Cover Slips 24 mm x 60 mm | Engelbrecht | K12460 | For GUVs formation |
| DiD (1,1'-Dioctadecyl-3,3,3',3'- Tetramethylindodicarbocyanine) | Thermo Fisher Scientific | D7757 | Membrane dye |
| disiLID | Sequence: MGGSGLNDIFEAQKIEWHEGGSH HHHHHGSMAATELRGVVGPGPAA IAALGGGGAGPPVGGGGGRGDA GPGSGAASGTVVAAAAGGPGPG AGGVAAAGPPAPPTGGSGGSGA GGSGSAGEFLATTLERIEKNFVIT DPRLPDNPIIFASDSFLQLTEYSR EEILGRNCRFLQGPETDRATVRK IRDAIDNQTEVTVQLINYTKSGKK FWNVFHLQPMRDYKGDVQYFIG VQLDGTERLHGAAEREAVMLIKK TAFQIAEAANDENYF | ||
| DOPC (1,2-di-(9Z-octadecenoyl)-sn-glycero-3-phosphocholine) | Avanti Polar Lipids | 850375P | For SUVs lipid composition |
| Eppendorf Protein LoBind microcentrifuge tubes | Merk | EP0030108116-100EA | For collecting freshly made GUVs |
| mOrange-Nano | Sequence: MRGSHHHHHHGSKIEEGKLVI WINGDKGYNGLAEVGKKFEKDT GIKVTVEHPDKLEEKFPQVAATG DGPDIIFWAHDRFGGYAQSGLLA EITPDKAFQDKLYPFTWDAVRYN GKLIAYPIAVEALSLIYNKDLLPNP PKTWEEIPALDKELKAKGKSALM FNLQEPYFTWPLIAADGGYAFKY ENGKYDIKDVGVDNAGAKAGLTF LVDLIKNKHMNADTDYSIAEAAFN KGETAMTINGPWAWSNIDTSKVN YGVTVLPTFKGQPSKPFVGVLSA GINAASPNKELAKEFLENYLLTDE GLEAVNKDKPLGAVALKSYEEELA KDPRIAATMENAQKGEIMPNIPQM SAFWYAVRTAVINAASGRQTVDEA LKDAQTNSSSNNNNNNNNNNLGI EGTTENLYFQGSVSKGEENNMAI IKEFMRFKVRMEGSVNGHEFEIE GEGEGRPYEGFQTAKLKVTKGG PLPFAWDILSPQFTYGSKAYVKH PADIPDYFKLSFPEGFKWERVMN FEDGGVVTVTQDSSLQDGEFIYK VKLRGTNFPSDGPVMQKKTMG WEASSERMYPEDGALKGEIKMR LKLKDGGHYTSEVKTTYKAKKPV QLPGAYIVGIKLDITSHNEDYTIVE QYERAEGRHSTGGMDELYKGG SGTSSPKRPKLLREYYDWLVDN SFTPYLVVDATYLGVNVPVEYVK DGQIVLNLSASATGNLQLTNDFIQ FNARFKGVSRELYIPMGAALAIYA RENGDGVMFEPEEIYDELNIG | ||
| NaCl (Sodium chloride) | Sigma-Aldrich | S9888 | For buffer |
| NaOH (Sodium hydroxide) | Sigma-Aldrich | 1064980500 | For surface activation in SLB formation |
| POPC (1-Palmitoyl-2- oleoylphosphatidylcholine) | Avanti Polar Lipids | 850457C | For GUVs lipid composition |
| PVA (Polyvinyl alcohol) fully hydrolyzed | Sigma-Aldrich | 8148940101 | For GUVs formation |
| SP8 confocal laser scanning microscope | Leica | ||
| Streptavidin | TermoFisher | 434301 | |
| Sucrose | Sigma-Aldrich | 84097 | For GUVs formation |
| Tris hydrochloride | Sigma-Aldrich | 10812846001 | For buffer |
References
- Kretschmer, S., Schwille, P. Pattern formation on membranes and its role in bacterial cell division. Curr Opin Cell Biol. 38, 52-59 (2016).
- Yang, H. W., Collins, S. R., Meyer, T. Locally excitable Cdc42 signals steer cells during chemotaxis. Nat Cell Biol. 18 (2), 191-201 (2016).
- Caldwell, R. M., et al. Optochemical control of protein localization and activity within cell-like compartments. Biochem. 57 (18), 2590-2596 (2018).
- Kennedy, M. J., et al. Rapid blue-light-mediated induction of protein interactions in living cells. Nat Methods. 7 (12), 973-975 (2010).
- Guntas, G., et al. Engineering an improved light-induced dimer (iLID) for controlling the localization and activity of signaling proteins. Proc Natl Acad Sci. 112 (1), 112-117 (2015).
- Levskaya, A., Weiner, O. D., Lim, W. A., Voigt, C. A. Spatiotemporal control of cell signalling using a light-switchable protein interaction. Nature. 461 (7266), 997-1001 (2009).
- Bartelt, S. M., et al. Dynamic blue light-switchable protein patterns on giant unilamellar vesicles. Chem Commun. 54 (8), 948-951 (2018).
- Di Iorio, D., Bergmann, J., Higashi, S. L., Hoffmann, A., Wegner, S. V. A disordered tether to iLID improves photoswitchable protein patterning on model membranes. Chem. Commun. 59 (29), 4380-4383 (2023).
- Hartzell, E. J., Terr, J., Chen, W. Engineering a blue light inducible Spytag system (BLISS). J Am Chem Soc. 143 (23), 8572-8577 (2021).
- Xu, D., Bartelt, S. M., Rasoulinejad, S., Chen, F., Wegner, S. V. Green light lithography: a general strategy to create active protein and cell micropatterns. Mater Horiz. 6 (6), 1222-1229 (2019).
- Jia, H., et al. Light-induced printing of protein structures on membranes in vitro. Nano Lett. 18 (11), 7133-7140 (2018).
- Di Iorio, D., Verheijden, M. L., vander Vries, E., Jonkheijm, P., Huskens, J. Weak Multivalent Binding of influenza hemagglutinin nanoparticles at a sialoglycan-functionalized supported lipid bilayer. ACS Nano. 13 (3), 3413-3423 (2019).
- Kasahara, M., Torii, M., Fujita, A., Tainaka, K. FMN binding and photochemical properties of plant putative photoreceptors containing two LOV domains, LOV/LOV proteins. J Biol Chem. 285 (45), 34765-34772 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved