Method Article
Model Membranlarda Dinamik Işık Kaynaklı Protein Modelleri
Bu Makalede
Özet
Burada, yapay lipid membranlarda yüksek uzay-zamansal hassasiyetle ışık regüle edilmiş ve geri dönüşümlü protein modelleri oluşturmak için bir protokol açıklanmaktadır. Yöntem, mavi ışık altında ortak proteini Nano'ya (vahşi tip SspB) bağlanan model zarlar üzerinde hareketsiz hale getirilen protein iLID'in (geliştirilmiş ışıkla indüklenebilir dimer) lokalize fotoaktivasyonundan oluşur.
Özet
Proteinlerin belirli bir zamanda hücre zarında kesin olarak lokalizasyonu ve aktivasyonu, hücre polarizasyonu, göç ve bölünme dahil olmak üzere birçok hücresel sürece yol açar. Bu nedenle, sentetik hücrelerde bu tür süreçleri çoğaltırken ve kontrol ederken, hücre altı çözünürlüğe ve yüksek zamansal kontrole sahip zarları modellemek için proteinleri işe alma yöntemleri gereklidir. Burada, yüksek uzay-zamansal hassasiyetle lipid zarlarında ışık regüle edilen tersinir protein modellerinin üretilmesi için bir yöntem açıklanmaktadır. Bu amaçla, desteklenen lipid çift katmanları (SLB'ler) ve dev unilameller veziküllerin (GUV'ler) dış zarı üzerinde foto-değiştirilebilir protein iLID'i (geliştirilmiş ışıkla indüklenebilir dimer) hareketsiz hale getiriyoruz. Yerel mavi ışık aydınlatması üzerine iLID, ortağı Nano'ya (vahşi tip SspB) bağlanır ve Nano'ya kaynaşmış herhangi bir ilgilenilen proteinin (POI) çözeltiden membran üzerindeki aydınlatılmış alana alınmasına izin verir. Bu bağlanma karanlıkta tersine çevrilebilir, bu da POI'nin dinamik bağlanmasını ve serbest bırakılmasını sağlar. Genel olarak, bu, mavi ışık kullanarak proteinlerin uzay ve zamanda yüksek hassasiyetle lokalizasyonunu düzenlemek için esnek ve çok yönlü bir yöntemdir.
Giriş
Hücre altı bölgelerdeki hücre zarlarında protein modellerinin oluşumu, göç, bölünme ve lokalize hücreden hücreye iletişim dahil olmak üzere çok sayıda biyolojik sürece yol açar 1,2. Bu protein kalıpları uzay ve zamanda düzenlenir ve oldukça dinamiktir. Sentetik hücrelerde bu tür protein kalıplarının çoğaltılması, onlardan kaynaklanan hücresel süreçleri taklit etmek ve bu tür bir düzenlemenin moleküler düzeyde nasıl çalıştığını daha iyi anlamak için gereklidir. Canlı hücrelerdeki zarlar için gözlemlenene benzer şekilde, yapay zarlar üzerinde protein kalıpları oluşturma yöntemleri, dinamiklerini yakalamalı ve hassas uzay-zamansal kontrol sağlamalıdır.
Çeşitli uyaranlar arasında ışık, en yüksek uzay-zamansal kontrolü ve birkaç ek avantajı sağlamasıyla öne çıkar3. Işıkla düzenleme sayesinde, istenen bir alanı istenen herhangi bir zamanda eşsiz bir hassasiyetle aydınlatmak kolaydır. Ek olarak, hem ışık yoğunluğu hem de darbe süreleri ayarlanabildiği için ışık yüksek ayarlanabilirlik sağlar. Ayrıca, görünür ışık, proteinler de dahil olmak üzere biyomoleküller için zararsızdır ve farklı dalga boylarına sahip birden fazla işlevi bile ele almak mümkündür. Bu nedenle, görünür ışığa dayalı ışığa duyarlı yaklaşımlar, uzay ve zamandaki protein modellerinin kontrollü ve biortogonal düzenlenmesi için umut verici yollar olarak ortaya çıkmaktadır 4,5,6. Optogenetikten foto-değiştirilebilir protein çiftlerinin kullanılması, ışıkla indüklenebilir dimerizatörler olarak işlev görmesi, spesifik proteinleri zarlara almak için basit bir yöntem sağlar. Özellikle, iLID (Avena sativa'nın foto değiştirilebilir LOV2 alanına dayalı geliştirilmiş ışıkla indüklenebilir dimer) ve Nano (vahşi tip SspB)7,8, mavi ışıkla indüklenebilir SpyTag sistemi (BLISS)9, yeşil ışığa duyarlı protein tetramer CarH 10 ve PhyB ile PIF611 arasındaki kırmızı ışıkla tetiklenen etkileşim kullanılarak yapay zarlar üzerinde başarılı bir şekilde protein desenleri oluşturulmuştur.
iLID ve Nano5 arasındaki foto-değiştirilebilir etkileşimin, mavi ışık7 kullanarak model membranlar üzerindeki proteinleri fotoğraflamak için kullanılabileceği gösterilmiştir. iLID/Nano etkileşimi karanlıkta tersine çevrilebilir, oldukça spesifiktir ve fizyolojik koşullar altında çalışır. iLID'in dev unilameller veziküller (GUV'ler) veya desteklenen lipid çift katmanları (SLB'ler) gibi lipid membran modellerine sabitlenmesi, karanlıkta geri dönüşümlü olan bu membranlara ışık tarafından düzenlenen Nano alımını sağlar. Özellikle, iLID'in N-terminaline (disiLID adlı bir proteinle sonuçlanan) bir model lipid zarına bir bağ olarak düzensiz bir alanın eklenmesinin, Nano işe alım verimliliğini ve geri dönüş dinamikleriniartırdığını gözlemledik 8.
disiLID/Nano etkileşimini kullanarak, SLB'ler ve GUV'lerin dış zarları üzerinde ilgilenilen Nano kaynaşmış proteinlerin (POI) yüksek kontrastlı modellerini oluşturmak için bir yöntem geliştirdik. Bu yöntem, dakikalar içinde olağanüstü uzamsal ve zamansal çözünürlüğe ve yüksek tersine çevrilebilirliğe sahip protein modellerinin oluşturulmasına izin verir. Ayrıntılı protokol, proteinlerin yapay zarlara yerel olarak alınması sürecini özetlemektedir. Spesifik olarak, bu, biotin-streptavidin (SAv) etkileşimi yoluyla SLB'ler ve GUV'ler üzerinde disiLID'in biyotinillenmiş bir versiyonunun hareketsiz hale getirilmesiyle elde edilir. Daha sonra, floresan etiketli Nano (mOrange-Nano), mavi ışık aydınlatması altında bu disiLID işlevselleştirilmiş membranlara alınır. Deneysel protokolümüz, membranlara lokalize protein alımını sağlamak için basit ve uyarlanabilir bir yaklaşım sunar. Daha da önemlisi, bu metodoloji rapor edilen SLB ve GUV arayüzleri veya mOrange-Nano ile sınırlı değildir; Nano ile kaynaşmış diğer disiLID ile işlevselleştirilmiş malzemelere ve proteinlere genişletilebilir.
Protokol
1. Deneysel hazırlık
- Biyotinile disiLID (b-disiLID) ve mOrange-Nano'yu (Malzeme Tablosuna bakınız) daha önce bildirilen prosedürleri izleyerek eksprese edin ve saflaştırın 7,8.
- Seçilen lipit bileşimi ve konsantrasyonları ile cam şişelerde lipit karışımları hazırlayın. İlk olarak, 1 mg / mL konsantrasyonlu nihai bir lipit çözeltisi elde etmek için lipitleri kloroformda çözün.
- 94.9 mol% 2-dioleoil-sn-glisero-3-fosfokolin (DOPC), 5 mol% 1,2-dioleoil-sn-glisero-3-fosfoetanolaminN- (kap biyotinil) sodyum tuzu (DOPE-biotin) ve 0.1 mol% 1,1'-Dioktadesil-3,3,3 ', 3'-Tetrametilindodikarbosiyanin (DiD) (Malzeme Tablosuna bakınız).
NOT: Lipid karışımı, değişen oranlarda ve DOPE-biotin konsantrasyonu ve / veya farklı membran boyaları ile ayarlanabilir. Önerilen DOPE-biyotin konsantrasyonu (% 5 mol), aşağıdaki adımlarda yüksek yoğunluklu bir Streptavidin (SAv) tabakasının oluşumuna izin verir.
- 94.9 mol% 2-dioleoil-sn-glisero-3-fosfokolin (DOPC), 5 mol% 1,2-dioleoil-sn-glisero-3-fosfoetanolaminN- (kap biyotinil) sodyum tuzu (DOPE-biotin) ve 0.1 mol% 1,1'-Dioktadesil-3,3,3 ', 3'-Tetrametilindodikarbosiyanin (DiD) (Malzeme Tablosuna bakınız).
- Daha önce bildirilen yöntemleri izleyerek küçük unilamellar veziküller (SUV'lar) hazırlayın 7,8,12. Bu adım için ≤100 nm çapında SUV'ların hazırlanması tavsiye edilir.
- Bu çalışma için sonikasyon yöntemi kullanılmıştır. İlk olarak, ince bir lipit filmi oluşturmak için şişeleri döndürürken cam şişedeki kloroform çözeltisini bir nitrojen akışı ile buharlaştırın. Daha sonra, kalan kloroformu vakum altında en az 1 saat çıkarın.
- Kurutulmuş filmi, girdaplama yoluyla 1 mg / mL lipit nihai konsantrasyonu ile ultra saf suda rehidre edin. Son olarak, opak çözelti berraklaşana kadar elde edilen çözeltiyi 10 dakika boyunca sonikleştirin.
NOT: Lipid karışımını buzdolabında bir mikrosantrifüj tüpünde en fazla 2 hafta saklayın. Nihai SUV'ların boyutu ≤ 100 nm olduğu sürece farklı SUV hazırlama yöntemleri (örneğin ekstrüzyon yöntemi) de kullanılabilir.
- Kurutulmuş filmi, girdaplama yoluyla 1 mg / mL lipit nihai konsantrasyonu ile ultra saf suda rehidre edin. Son olarak, opak çözelti berraklaşana kadar elde edilen çözeltiyi 10 dakika boyunca sonikleştirin.
2. disiLID işlevselleştirilmiş SLB'lere mOrange-Nano alımı
- μ kızaklı 18 kuyulu cam tabanlı haznenin her bir oyuğuna 150 μL 2 M NaOH ekleyin ( Malzeme Tablosuna bakınız) ve oda sıcaklığında 1 saat inkübe edin. Daha sonra, NaOH'yi çıkarın ve kuyuları önce 150 μL ultra saf su ile 3-5 kez ve daha sonra 10 mM CaCl2 içeren 150 μL tampon (10 mM Tris pH 7.4, 100 mM NaCl) ile 3 kez yıkayın.
- Tamponda SUV'ların yaklaşık 10 faktör seyreltilmesine sahip olmak için 10 mM CaCl2 ile 150 μL tampon içeren kuyucuklara 15 μL taze hazırlanmış SUV (su içinde stok konsantrasyonu 1 mg/mL) ekleyin. SUV'ların oda sıcaklığında 30 dakika kuluçkaya yatmasına izin verin. Kuluçka süresinden sonra, biyotinillenmiş SLB'ler oluşacaktır.
- SLB'leri CaCl2 olmadan tamponla (10 mM Tris pH 7.4, 100 mM NaCl) en az 7 kez önce çözeltiyi çıkararak ve ardından her adımda taze tampon ekleyerek yıkayın. Her yıkama adımı için 80 μL tampon kullanılması tavsiye edilir.
NOT: SLB'lerin optimum şekilde yıkanması, taze çözeltinin yüzeye temas etmeden birkaç kez yukarı ve aşağı pipetlenmesiyle elde edilir. Oluşan SLB'lere zarar verebilecek küçük hava kabarcıklarının oluşumunu azaltmak için çözeltinin yeni oluşturulan SLB'leri içeren kuyucuklarda pipetlenmesi nazik olmalıdır. Bu andan itibaren, SLB'lerin kurumasını önlemek için kuyular yeterli miktarda tampon içermelidir. - Biyotinile SLB'lerin SAv ile daha fazla işlevselleştirilmesi için, 250 nM'lik bir nihai konsantrasyona kadar bir SAv çözeltisi ekleyin ve oda sıcaklığında 30 dakika inkübe edin. Daha sonra, SAv fazlalığını en az 5 kez bir tampon (10 mM Tris pH 7.4, 100 mM NaCl) ile yıkayarak çıkarın.
- Bu andan itibaren, foto-değiştirilebilir proteinlerin istenmeyen fotoaktivasyonunu önlemek için numuneleri koruyucu bir kırmızı ışık altında tutun. Kuyuda 1 μM'lik bir nihai konsantrasyona b-disiILD ekleyin (Malzeme Tablosuna bakınız). Oda sıcaklığında 30 dakika inkübasyondan sonra, en az 5 kez tampon ile yıkayarak fazla proteini çıkarın.
- 200 nM'lik bir nihai konsantrasyona mOrange-Nano ekleyin ( Malzeme Tablosuna bakın) ve numuneyi alüminyum folyo ile kaplayarak karanlıkta tutun.
- μ slaytı floresan mikroskobunun altına yerleştirin ve görüntüleme ayarlarını yapın. 552 nm lazeri mOrange-Nano'nun uyarılması için ayarlayın. mOrange sinyalini optimize etmek için emisyon aralığını ayarlayın. disiLID'in fotoaktivasyonu, 2.58 s aralıklarla ışık darbeleri kullanılarak 488 nm'lik bir lazerle elde edilir.
3. GUV'ların Hazırlanması
- Ultra saf suda 100 mM sükroz ile %5 (a/h) polivinil alkol (PVA, Malzeme Tablosuna bakınız) (MW: 145 000 g/mol) çözeltisi hazırlayın, gece boyunca 80 °C'de 400 rpm'de karıştırın.
- İstenilen bir bileşime sahip kloroformda bir lipit çözeltisi hazırlayın (nihai konsantrasyon 10 mg / mL). Bu yöntem için 10 mg/mL POPC, 10 mol %1-palmitoil-2-oleoil-sn-glisero-3-fosfo-(1'-rac-gliserol) (POPG), %2 mol DOPE-biotin ve %1 mol DiD'den oluşan bir bileşim önerilir (bkz.
- GUV'leri hidrasyon tekniği ile hazırlayın 7,8. İlk olarak, hazırlanan PVA çözeltisinin 40 μL'sini 60 mm x 24 mm'lik bir cam slaytın üzerine, tercihen bir pipet ucu ile homojen ince bir tabaka halinde yayın. Daha sonra ince tabakayı 50 °C'de 30 dakika kurutun.
- PVA tabakasına bir iğne ile 5 μL lipit çözeltisi yayın ve 30 ° C'de 1 saat kurumaya bırakın.
- Bir ara parça (~40 mm × 24 mm × 2 mm, Malzeme Tablosuna bakın) ve ikinci bir cam slayt kullanarak işlevselleştirilmiş cam slayt üzerine bir oda monte edin.
- GUV'ler oluşturmak için oda sıcaklığında 1 saat boyunca hazneye 1 mL rehidrasyon tamponu (10 mM Tris pH 7.4, 100 mM NaCl) ekleyin. 1 saat sonra, hazneyi ters çevirin ve bir pipet ucuyla cam yüzeylere hafifçe vurun.
- İnşa edilmiş hazneyi açmak için bir taraftaki cam sürgüyü dikkatlice çıkarın ve GUV'leri bir pipetle hasat edin.
- Solüsyonu plastik bir tüpe yerleştirin ve GUV'lerin 2 saat oturmasına izin verin.
4. disiLID işlevselleştirilmiş GUV'lere mOrange-Nano İşe Alım
- Taze hasat edilmiş GUV'lara bir SAv çözeltisi ekleyin ve oda sıcaklığında 30 dakika bekletin.
NOT: disiLID'in fotoaktivasyonunu önlemek için aşağıdaki adımlar koruyucu kırmızı ışıkla gerçekleştirilmelidir. - GUVs solüsyonuna 1 μM b-disiLID ekleyin ve numuneyi alüminyum folyo ile kaplayarak 30 dakika karanlıkta bekletin.
- μ slaytlı 18 oyuklu cam alt hazneyi 150 μL BSA çözeltisi (suda %3 a/h) ile 10 dakika boyunca ön işlemden geçirin. Daha sonra, BSA çözeltisini çıkarın ve kuyuları 3 kez 150 μL ultra saf su ile yıkayın.
- Kuyuya 145 μL 200 nM mOrange-Nano tampon içinde (10 mM Tris pH 7.4, 100 mM NaCl) ekleyin.
- Daha sonra, çözeltiye b-disiLID ile süslenmiş 5 μL GUV ekleyin ve GUV'lerin çökmesi için ~ 15 dakika bekleyin.
- μ slaytı konfokal mikroskobun altına yerleştirin. mOrange (λex = 557 nm; λem = 576 nm) floresansını görselleştirmek için numuneyi 552 nm'de ve GUV membranlarında DiD'yi (λex = 644 nm; λem = 665 nm) görselleştirmek için 638 nm'de uyarın. mOrange-Nano alımı, istenmeyen foto ağartma etkilerini en aza indirmek için her 5,3 saniyede bir mavi ışık darbeleri (488 nm, yoğunluk %1) ile tetiklenir.
NOT: Uyarma dalga boyları, kullanılan mikroskop tipine göre uyarlanabilir. Mikroskoplar için mevcut olan diğer yaygın uyarma dalga boyları da 532 nm veya 561 nm ve 633 nm, 647 nm, 639 nm veya 640 nm lazerlerdir.
Sonuçlar
Açıklanan prosedürler, sentetik membranlar üzerinde mOrange-Nano'yu işe almak için SLB'lerin oluşumuna izin verir. b-disiLID ile işlevselleştirilmiş SLB'ler üzerinde tanımlanmış mOrange-Nano desenli oluşumu Şekil 1A'da gösterilmiştir. SLB üzerindeki kare (24 μm × 24 μm) bir ilgi bölgesi (ROI) 488 nm mavi ışıkla aydınlatıldığında, ROI'de 200 s içinde mOrange kanalında (kırmızı ile gösterilmiştir) hızlı bir floresan sinyali artışı gözlenir. Desen, fotoaktif alan üzerinde yüksek uzamsal kontrolü gösteren çok tanımlanmış ve keskin kenarları gösterir (Şekil 1B). Mavi ışıklı aydınlatma kesintiye uğradığı için etkileşim hızlı ve tamamen tersine çevrilebilir. Bu yöntem aynı zamanda birkaç aydınlatma döngüsü boyunca desenlerin oluşturulmasına da izin verir (Şekil 2). ~ 200 s mavi ışık ve 200 s karanlık alternatif döngüleri, desenlerde karşılaştırılabilir Δ floresan yoğunluğu değerleri ile seçilen alanda birden çok kez geri dönüşümlü mOrange-Nano alımına yol açar.
Şekil 3 , GUV'lerin hazırlanmasının şematik gösterimini göstermektedir. mOrange-Nano'nun işe alımı GUV'larda da gözlenmektedir. Karanlıkta yerleştirilen GUV'ların mOrange floresan göstermediği gösterilmiştir (Şekil 4A). GUV'lar küresel olarak mavi ışıkla aydınlatıldığından, GUV membran boyası (DiD) ile birlikte lokalize olan mOrange floresansı gözlenir. Aydınlatma sonlandırıldığı için etkileşim oldukça tersine çevrilebilir. GUV membranındaki mOrange yoğunluğunun zaman içinde miktar tayini, proteinlerin hızlı ve etkili bir şekilde toplanmasını ve tam tersinirliği gösterir (Şekil 4B).
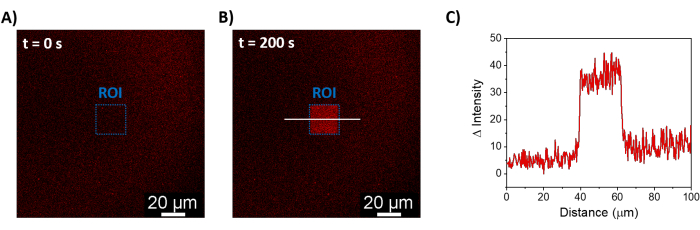
Şekil 1: b-disiLID ile işlevselleştirilmiş SLB'lerin floresan mikroskobu görüntüleri. ROI'de (A) yerel mavi ışık (488 nm) aydınlatmasından önce ve (B) sırasında mOrange-Nano varlığında floresan görüntüleri. Ölçek çubuğu = 20 μm. (C) b-disiLID ile işlevselleştirilmiş SLB'ler için ROI'de ölçülen mOrange'ın floresan yoğunluğu (= 200 s'de). Şekil Di Iorio ve ark.8'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
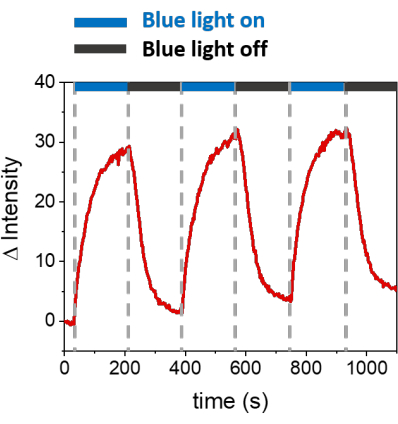
Şekil 2: Üç işe alım döngüsü sırasında b-disiLID ile süslenmiş SLB'lerde ROI'de işe alınan mOrange'ın floresan yoğunluğu. Her fotoaktivasyon adımından sonra, mOrange-Nano floresan ROI içinde arttı. Desen 120 s içinde doygunluğa ulaşır ve floresan 120 s içinde neredeyse arka plan seviyelerine düşer. Farklı mavi aydınlık/karanlık döngülerinde desen kalitesinde herhangi bir kayıp gözlenmez. Şekil Di Iorio ve ark.8'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
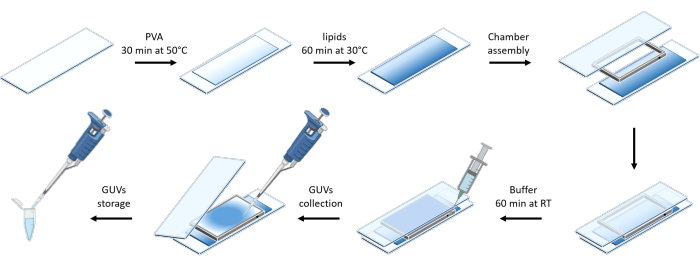
Şekil 3: Nazik hidrasyon yöntemi kullanılarak GUV preparatının şematik gösterimi. Şema, birkaç adımın ve iki cam slayt ve bir ara parça kullanılarak inşa edilen odanın görsel bir temsilini sunar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
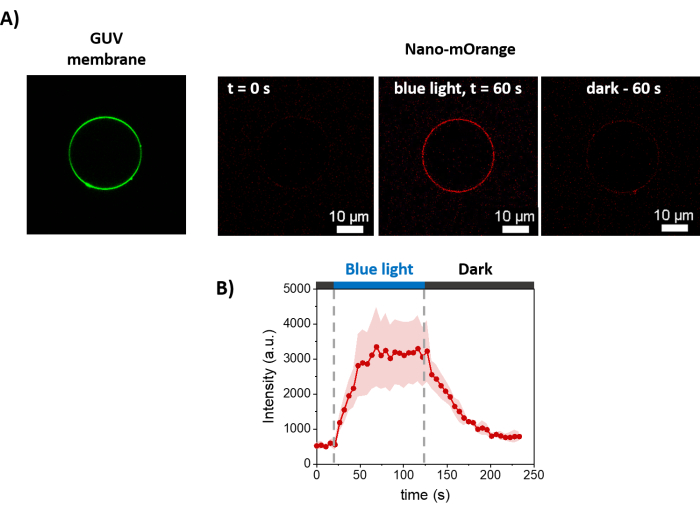
Şekil 4: GUV membranları üzerinde ışığa bağlı mOrange-Nano alımının floresan mikroskobu ölçümleri. (A) mOrange-Nano varlığında disiLID ile işlevselleştirilmiş bir GUV'nin floresan görüntüleri. Yeşil, GUV'lerin membran boyasıdır ve kırmızı, mavi ışık aydınlatması öncesinde, sırasında ve sonrasında mOrange floresansıdır. Ölçek çubukları = 10 μm. (B) Zaman içinde GUV üzerinde lokalize olan mOrange'ın floresan yoğunluğu. Aydınlatma üzerine, lipit zarı üzerindeki mOrange floresansı (kırmızı ile gösterilmiştir), 5,9 kat floresan yoğunluğu artışıyla 60 saniye içinde maksimum yoğunluğa ulaşır. Aydınlatma durdurulduğunda, mOrange floresansı 60 saniye içinde neredeyse ön aydınlatma değerlerine düşer (%90 geri kazanım ile). Şekil Di Iorio ve ark.8'den uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Foto-değiştirilebilir protein disiLID8 kullanarak, desteklenen lipid çift tabakası ve dev unilamellar veziküller gibi model membranlar üzerinde mOrange-Nano proteinlerinin lokalize alımı için bir yöntem tanımladık. Modelin kalitesine katkıda bulunan unsurlar arasında proteinlerin kalitesinin yanı sıra SLB'lerin ve GUV'lerin kalitesi de yer alır.
Ekspresyon ve saflaştırmadan sonra iyi bir protein kalitesi sağlamak için, öncelikle disiLID'in foto-değiştirilebilir özelliklerini değerlendirmek önemlidir. Bu amaçla, FMN kofaktörünün absorpsiyonu karanlıkta ve mavi ışık aydınlatmasından sonra ölçülmelidir. disiLID'in UV-Vis spektrumlarının, karanlıkta FMN kofaktörünün karakteristik üçlü zirvesini göstermesi beklenir, bu da mavi ışık aydınlatmasıyla önemli ölçüde azalır ve karanlıkta iyileşir13. Bu foto değiştirilebilir davranış, sonraki adımlarda tekrarlanabilir ve geri dönüşümlü işe alım elde etmek için çok önemlidir. Numunelerin hazırlanması sırasında koruyucu kırmızı ışık ile çalışılması ve disiLID'in minimum dış aydınlatmaya maruz bırakılması deneylerin performansını artırmaktadır.
Bir diğer kritik adım ve belki de en önemlisi, uygun SLB'lerin oluşturulmasıdır. Membranlardaki kusurlar ve/veya homojen olmayan SLB'lerin oluşumu (yani, çok katmanlı veya yamalı SLB'lerin varlığı) protein modellemesinin kalitesini etkileyecektir. Bu nedenle, deneyimsiz kullanıcılar için, floresan etiketli SLB'ler oluşturmak için SUV'ları DiD ve DiO gibi bazı membran boyaları ile etiketleyerek protokolün çoğaltılması önerilir. Bu şekilde, SLB'lerin özellikleri ve kalitesi floresan mikroskobu ile iyi bir şekilde karakterize edilebilir. FRAP ölçümleri, membranların akışkanlığını değerlendirerek bir SLB'nin kalitesini değerlendirmek için tipik bir yaklaşımı temsil eder. Alternatif olarak, bu protokolde tarif edilenler gibi biyotinillenmiş SLB'ler söz konusu olduğunda, SLB'lerin kalitesini görselleştirmek ve değerlendirmek için floresan etiketli SAv (örneğin, Atto 488-SAv) kullanılabilir.
Protokolün ilk kısmı, SLB'ler üzerinde kalıpların oluşumunu açıklar. En iyi sonucu elde etmek için, SLB'lere mOrange-Nano eklemek ve numunenin karanlıkta 15 dakika inkübe etmesine izin vermek önemlidir. Fotoaktivasyon sırasında, ROI seçimi belirli bir boyutla sınırlı değildir. Bununla birlikte, floresan proteinlerin istenmeyen foto-ağartılmasını azaltmak için lazer yoğunluğunun ve maruz kalma süresinin düzenlenmesi gerekir.
Bu yöntem biyotinile proteinlerle sınırlı değildir ve disiLID'i SLB'lere bağlamak için başka yaklaşımlar da kullanılabilir. Örneğin, His etiketli disiLID ifade edilebilir ve Ni-NTA içeren SLB'lere sabitlenebilir. Bununla birlikte, SLB'ler üzerindeki proteinlerin yer değiştirmesini önlemek için Nano ve disiLID'i farklı etiketlerle ifade etmek çok önemlidir. Bu yöntem aynı zamanda proteinlerin sırasını tersine çevirme olanağına da izin verir, böylece SLB'leri Nano ile işlevselleştirir ve mavi ışık aydınlatması üzerine disiLID (veya disiLID ile kaynaşmış proteinler) alır.
Protein lokalizasyonunun dinamik kontrolü için, proteinin seçilen bölgeye geri dönüşümlü lokalizasyonu tekrar tekrar mümkün olmalıdır. Bunu başarmak için, çözeltideki Nano (200 nM) konsantrasyonu, yüksek tersinirlik elde etmek için kritik bir parametredir.
Diğer bir endişe, Nano'nun disiLID ile işlevselleştirilmiş GUV yüzeyine alınmasıdır. SLB'lerde protein modelleme durumunda olduğu gibi, bu yöntem farklı membran işlevselleştirme stratejilerine genişletilebilir. Bu protokolde, tüm GUV yüzeyinde mOrange-Nano'yu işe almak için tüm GUV mavi ışıkla aydınlatıldı. Bununla birlikte, GUV membranı üzerinde lokalize olan küçük ROI'lerin seçimi, proteinlerin daha kısıtlı bir alanda kesin lokalizasyonuna yol açmalıdır.
Bu yöntem, yalnızca SUV'ların veya GUV'lerin membranında Nano alımının görüntülenmesi için kullanılan florofor seçimi ile ilgili bir sınırlama sunar. Özellikle, mavi ışık aralığında bir uyarma spektrumuna sahip floroforlardan kaçınılmalıdır, çünkü kullanımları (dis)iLID'in fotoaktivasyonunu engelleyecektir. Bu nedenle, bu tür bir deney için yeşil veya kırmızı ışık aralığında (örneğin, mOrange veya Cy5) florofor seçimi önerilir.
disiLID tasarımı, membranlara yerel protein alımını iyileştirmek için basit ve uyarlanabilir bir yol sunar ve optogenetik4'ten iLID ve Nano'nun dinamik aralığını genişletir. Bu yöntemler, Nano'nun lipid çift katmanları ve GUV'ler gibi taklit zarlarına alınmasına odaklanır. Bununla birlikte, bu yaklaşım, (dis)iLID veya Nano'nun bir zara bağlı olduğu hücrelerdeki çok sayıda optogenetik araca genişletilebilir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Avrupa Araştırma Konseyi ERC Başlangıç Hibesi ARTIST (# 757593 S.V.W.) tarafından finanse edilmiştir. DDI, Alexander von Humboldt Vakfı'na doktora sonrası burs için teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| µ-Slide 18 Well | Ibidi | 81817 | For SLB preparation |
| 25 µL Microliter Syringe | Hamilton | Model 702 N | For the preparation of lipid mixture and spreading the lipid solution on the PVA layer |
| Biotinyl Cap PE (1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl)) (sodium salt) | Avanti Polar Lipids | 870273C | For SUVs preparation |
| CaCl2 (Calcium chloride) | Sigma-Aldrich | C5670 | For SLB formation |
| Cover Slips 24 mm x 60 mm | Engelbrecht | K12460 | For GUVs formation |
| DiD (1,1'-Dioctadecyl-3,3,3',3'- Tetramethylindodicarbocyanine) | Thermo Fisher Scientific | D7757 | Membrane dye |
| disiLID | Sequence: MGGSGLNDIFEAQKIEWHEGGSH HHHHHGSMAATELRGVVGPGPAA IAALGGGGAGPPVGGGGGRGDA GPGSGAASGTVVAAAAGGPGPG AGGVAAAGPPAPPTGGSGGSGA GGSGSAGEFLATTLERIEKNFVIT DPRLPDNPIIFASDSFLQLTEYSR EEILGRNCRFLQGPETDRATVRK IRDAIDNQTEVTVQLINYTKSGKK FWNVFHLQPMRDYKGDVQYFIG VQLDGTERLHGAAEREAVMLIKK TAFQIAEAANDENYF | ||
| DOPC (1,2-di-(9Z-octadecenoyl)-sn-glycero-3-phosphocholine) | Avanti Polar Lipids | 850375P | For SUVs lipid composition |
| Eppendorf Protein LoBind microcentrifuge tubes | Merk | EP0030108116-100EA | For collecting freshly made GUVs |
| mOrange-Nano | Sequence: MRGSHHHHHHGSKIEEGKLVI WINGDKGYNGLAEVGKKFEKDT GIKVTVEHPDKLEEKFPQVAATG DGPDIIFWAHDRFGGYAQSGLLA EITPDKAFQDKLYPFTWDAVRYN GKLIAYPIAVEALSLIYNKDLLPNP PKTWEEIPALDKELKAKGKSALM FNLQEPYFTWPLIAADGGYAFKY ENGKYDIKDVGVDNAGAKAGLTF LVDLIKNKHMNADTDYSIAEAAFN KGETAMTINGPWAWSNIDTSKVN YGVTVLPTFKGQPSKPFVGVLSA GINAASPNKELAKEFLENYLLTDE GLEAVNKDKPLGAVALKSYEEELA KDPRIAATMENAQKGEIMPNIPQM SAFWYAVRTAVINAASGRQTVDEA LKDAQTNSSSNNNNNNNNNNLGI EGTTENLYFQGSVSKGEENNMAI IKEFMRFKVRMEGSVNGHEFEIE GEGEGRPYEGFQTAKLKVTKGG PLPFAWDILSPQFTYGSKAYVKH PADIPDYFKLSFPEGFKWERVMN FEDGGVVTVTQDSSLQDGEFIYK VKLRGTNFPSDGPVMQKKTMG WEASSERMYPEDGALKGEIKMR LKLKDGGHYTSEVKTTYKAKKPV QLPGAYIVGIKLDITSHNEDYTIVE QYERAEGRHSTGGMDELYKGG SGTSSPKRPKLLREYYDWLVDN SFTPYLVVDATYLGVNVPVEYVK DGQIVLNLSASATGNLQLTNDFIQ FNARFKGVSRELYIPMGAALAIYA RENGDGVMFEPEEIYDELNIG | ||
| NaCl (Sodium chloride) | Sigma-Aldrich | S9888 | For buffer |
| NaOH (Sodium hydroxide) | Sigma-Aldrich | 1064980500 | For surface activation in SLB formation |
| POPC (1-Palmitoyl-2- oleoylphosphatidylcholine) | Avanti Polar Lipids | 850457C | For GUVs lipid composition |
| PVA (Polyvinyl alcohol) fully hydrolyzed | Sigma-Aldrich | 8148940101 | For GUVs formation |
| SP8 confocal laser scanning microscope | Leica | ||
| Streptavidin | TermoFisher | 434301 | |
| Sucrose | Sigma-Aldrich | 84097 | For GUVs formation |
| Tris hydrochloride | Sigma-Aldrich | 10812846001 | For buffer |
Referanslar
- Kretschmer, S., Schwille, P. Pattern formation on membranes and its role in bacterial cell division. Curr Opin Cell Biol. 38, 52-59 (2016).
- Yang, H. W., Collins, S. R., Meyer, T. Locally excitable Cdc42 signals steer cells during chemotaxis. Nat Cell Biol. 18 (2), 191-201 (2016).
- Caldwell, R. M., et al. Optochemical control of protein localization and activity within cell-like compartments. Biochem. 57 (18), 2590-2596 (2018).
- Kennedy, M. J., et al. Rapid blue-light-mediated induction of protein interactions in living cells. Nat Methods. 7 (12), 973-975 (2010).
- Guntas, G., et al. Engineering an improved light-induced dimer (iLID) for controlling the localization and activity of signaling proteins. Proc Natl Acad Sci. 112 (1), 112-117 (2015).
- Levskaya, A., Weiner, O. D., Lim, W. A., Voigt, C. A. Spatiotemporal control of cell signalling using a light-switchable protein interaction. Nature. 461 (7266), 997-1001 (2009).
- Bartelt, S. M., et al. Dynamic blue light-switchable protein patterns on giant unilamellar vesicles. Chem Commun. 54 (8), 948-951 (2018).
- Di Iorio, D., Bergmann, J., Higashi, S. L., Hoffmann, A., Wegner, S. V. A disordered tether to iLID improves photoswitchable protein patterning on model membranes. Chem. Commun. 59 (29), 4380-4383 (2023).
- Hartzell, E. J., Terr, J., Chen, W. Engineering a blue light inducible Spytag system (BLISS). J Am Chem Soc. 143 (23), 8572-8577 (2021).
- Xu, D., Bartelt, S. M., Rasoulinejad, S., Chen, F., Wegner, S. V. Green light lithography: a general strategy to create active protein and cell micropatterns. Mater Horiz. 6 (6), 1222-1229 (2019).
- Jia, H., et al. Light-induced printing of protein structures on membranes in vitro. Nano Lett. 18 (11), 7133-7140 (2018).
- Di Iorio, D., Verheijden, M. L., vander Vries, E., Jonkheijm, P., Huskens, J. Weak Multivalent Binding of influenza hemagglutinin nanoparticles at a sialoglycan-functionalized supported lipid bilayer. ACS Nano. 13 (3), 3413-3423 (2019).
- Kasahara, M., Torii, M., Fujita, A., Tainaka, K. FMN binding and photochemical properties of plant putative photoreceptors containing two LOV domains, LOV/LOV proteins. J Biol Chem. 285 (45), 34765-34772 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır