Method Article
Динамические световые паттерны белков на модельных мембранах
В этой статье
Резюме
Здесь описан протокол генерации светорегулируемых и обратимых белковых паттернов с высокой пространственно-временной точностью на искусственных липидных мембранах. Метод заключается в локализованной фотоактивации иммобилизованного на модельных мембранах белка iLID (улучшенного светоиндуцируемого димера), который под действием синего света связывается со своим партнерским белком Nano (дикий тип SspB).
Аннотация
Точная локализация и активация белков на клеточной мембране в определенное время приводит к возникновению многих клеточных процессов, включая поляризацию клеток, миграцию и деление. Таким образом, методы рекрутирования белков для моделирования мембран с субклеточным разрешением и высоким временным контролем имеют важное значение при воспроизведении и контроле таких процессов в синтетических клетках. В данной работе описан способ получения светорегулируемых обратимых белковых паттернов на липидных мембранах с высокой пространственно-временной точностью. С этой целью мы иммобилизуем фотопереключаемый белок iLID (улучшенный димер, индуцируемый светом) на поддерживаемых липидных бислоях (SLB) и на внешней мембране гигантских униламеллярных везикул (GUV). При локальном освещении синим светом iLID связывается со своим партнером Nano (SspB дикого типа) и позволяет рекрутировать любой представляющий интерес белок (POI), слитый с Nano, из раствора в освещенную область мембраны. Эта привязка является обратимой в темноте, что обеспечивает динамическую привязку и освобождение POI. В целом, это гибкий и универсальный метод регулирования локализации белков с высокой точностью в пространстве и времени с помощью синего света.
Введение
Формирование белковых узоров на клеточных мембранах в субклеточных областях приводит к многочисленным биологическим процессам, включая миграцию, деление и локализованную межклеточную коммуникацию 1,2. Эти белковые паттерны регулируются в пространстве и времени и очень динамичны. Репликация таких белковых паттернов в синтетических клетках имеет важное значение для имитации клеточных процессов, которые возникают из них, и для лучшего понимания того, как такая регуляция работает на молекулярном уровне. Аналогично тому, что наблюдается в отношении мембран в живых клетках, методы генерации белковых узоров на искусственных мембранах должны отражать их динамику и обеспечивать точный пространственно-временной контроль.
Среди различных стимулов свет выделяется тем, что обеспечивает наивысший пространственно-временной контроль и имеет ряд дополнительных преимуществ3. Благодаря регулированию с помощью света можно легко осветить нужную область в любое желаемое время с непревзойденной точностью. Кроме того, свет обеспечивает высокую настраиваемость, так как можно регулировать как интенсивность света, так и продолжительность импульсов. Кроме того, видимый свет безвреден для биомолекул, в том числе белков, и можно даже обращаться к нескольким функциям с разными длинами волн. Следовательно, светочувствительные подходы, основанные на видимом свете, становятся многообещающими направлениями контролируемой и биортогональной регуляции белковых паттернов в пространстве и времени 4,5,6. Использование фотопереключаемых белковых пар из оптогенетики, действующих как светоиндуцируемые димеризаторы, обеспечивает простой метод привлечения специфических белков к мембранам. В частности, белковые узоры были успешно сформированы на искусственных мембранах с использованием инертного взаимодействия между iLID (улучшенный димер, индуцируемый светом, основанный на фотопереключаемом домене LOV2 из Avena sativa) и Nano (SspB дикого типа)7,8, индуцируемой синим светом системой SpyTag (BLISS)9, чувствительным к зеленому свету белком тетрамером CarH10 и индуцируемым красным светом взаимодействием между PhyB и PIF611.
Было продемонстрировано, что фотопереключаемое взаимодействие между iLID и Nano5 может быть использовано для фотомоделирования белков на мембранах модели с использованием синего света7. Взаимодействие iLID/Nano обратимо в темноте, высокоспецифично и действует в физиологических условиях. Закрепление iLID на моделях липидных мембран, таких как гигантские униламеллярные везикулы (GUV) или поддерживаемые липидные бислои (SLB), обеспечивает регулируемое светом привлечение Nano к этим мембранам, что является обратимым в темноте. В частности, мы заметили, что введение неупорядоченного домена на N-конец iLID (в результате чего получается белок под названием disiLID) в качестве троса к модельной липидной мембране повышает эффективность Nano рекрутингаи динамику реверсии.
Используя взаимодействие disiLID/Nano, мы разработали метод генерации высококонтрастных паттернов нано-слитых белков интереса (POI) на SLB и внешних мембранах GUV. Этот метод позволяет создавать белковые паттерны с замечательным пространственным и временным разрешением и высокой обратимостью в течение нескольких минут. В подробном протоколе описан процесс локального рекрутирования белков на искусственных мембранах. В частности, это достигается путем иммобилизации биотинилированной версии disiLID на SLB и GUVs посредством взаимодействия биотин-стрептавидина (SAv). Затем флуоресцентно меченный Nano (mOrange-Nano) рекрутируется на эти функционализированные мембраны disiLID под действием синего света. Наш экспериментальный протокол предлагает простой и адаптируемый подход к достижению локализованного набора белка в мембраны. Важно отметить, что эта методология не ограничивается заявленными интерфейсами SLB и GUV или mOrange-Nano; он может быть расширен на другие материалы, функционализированные disiLID, и белки, слитые с Nano.
протокол
1. Подготовка к эксперименту
- Экспрессируйте и очищайте biotinylated-disiLID (b-disiLID) и mOrange-Nano (см. Таблицу материалов) в соответствии с ранее описанными процедурами 7,8.
- Готовят липидные смеси в стеклянных флаконах с выбранным липидным составом и концентрацией. Сначала растворите липиды в хлороформе, чтобы получить окончательный липидный раствор с концентрацией 1 мг/мл.
- Смешать липиды с целью получения композиции 94,9 мол.% 2-диолеоил-sn-глицеро-3-фосфохолина (DOPC), 5 мол.% 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламинаN-(cap biotinyl) натриевой соли (DOPE-биотин) и 0,1 мол.% 1,1'-диоктадецил-3,3,3',3'-тетраметилиндодикарбоцианина (DiD) (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Липидная смесь может быть отрегулирована с различными соотношениями и концентрацией DOPE-биотина и/или различными мембранными красителями. Рекомендуемая концентрация DOPE-биотина (5 моль %) позволяет сформировать слой стрептавидина высокой плотности (SAv) на следующих этапах.
- Смешать липиды с целью получения композиции 94,9 мол.% 2-диолеоил-sn-глицеро-3-фосфохолина (DOPC), 5 мол.% 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламинаN-(cap biotinyl) натриевой соли (DOPE-биотин) и 0,1 мол.% 1,1'-диоктадецил-3,3,3',3'-тетраметилиндодикарбоцианина (DiD) (см. Таблицу материалов).
- Подготовьте небольшие униламеллярные везикулы (SUV) в соответствии с ранее описанными методами 7,8,12. Для этого этапа рекомендуется подготовить внедорожники диаметром ≤100 нм.
- Для данного исследования используется метод ультразвуковой обработки. Сначала испарите раствор хлороформа в стеклянном флаконе струей азота, вращая флаконы с целью образования тонкой липидной пленки. Затем удалите остатки хлороформа не менее чем на 1 ч под вакуумом.
- Регидратируйте высушенную пленку в ультрачистой воде с конечной концентрацией липидов 1 мг/мл методом вортексирования. Наконец, обрабатывайте полученный раствор ультразвуком в течение 10 минут, пока непрозрачный раствор не станет прозрачным.
ПРИМЕЧАНИЕ: Храните липидную смесь в микроцентрифужной пробирке в холодильнике не более 2 недель. Также можно использовать различные методы подготовки внедорожников (например, метод экструзии), если размер готовых внедорожников составляет ≤ 100 морских миль.
- Регидратируйте высушенную пленку в ультрачистой воде с конечной концентрацией липидов 1 мг/мл методом вортексирования. Наконец, обрабатывайте полученный раствор ультразвуком в течение 10 минут, пока непрозрачный раствор не станет прозрачным.
2. Рекрутинг mOrange-Nano для функционализированных SLB disiLID
- Добавьте 150 мкл 2 М NaOH в каждую лунку μ-слайдовой 18-луночной камеры со стеклянным дном (см. Таблицу материалов) и инкубируйте в течение 1 ч при комнатной температуре. Впоследствии удалите NaOH и промойте лунки 3-5 раз сначала 150 мкл сверхчистой водой, а затем 3 раза 150 мкл буфером (10 мМ Tris pH 7,4, 100 мМ NaCl), содержащим 10 мМ CaCl2.
- Добавьте 15 мкл свежеприготовленных внедорожников (исходная концентрация 1 мг/мл в воде) в лунки, содержащие 150 мкл буфера с 10 мМ CaCl2, чтобы получить примерно 10-кратное разведение SUV в буфере. Дайте внедорожникам поинкубироваться в течение 30 минут при комнатной температуре. После инкубации образуются биотинилированные SLB.
- Промойте SLB не менее 7 раз буфером (10 мМ Tris pH 7,4, 100 мМ NaCl) без CaCl2 , предварительно удаляя раствор и затем добавляя свежий буфер на каждом этапе. Рекомендуется использовать 80 мкл буфера для каждого этапа промывки.
ПРИМЕЧАНИЕ: Оптимальная промывка SLB достигается путем пипетирования свежего раствора вверх и вниз несколько раз, не касаясь поверхности. Пипетирование раствора в лунках, содержащих вновь образованные SLB, должно быть щадящим, чтобы уменьшить образование мелких пузырьков воздуха, которые могут повредить образовавшиеся SLB. С этого момента лунки должны содержать достаточный объем буфера, чтобы предотвратить высыхание SLB. - Для дальнейшей функционализации биотинилированных SLB с SAv добавляют раствор SAv до конечной концентрации 250 нМ и инкубируют в течение 30 мин при комнатной температуре. Впоследствии удалите избыток SAv, промыв его буфером (10 мМ Tris pH 7,4, 100 мМ NaCl) не менее 5 раз.
- С этого момента образцы следует держать под защитным красным светом, чтобы избежать нежелательной фотоактивации фотопереключаемых белков. Добавьте b-disiILD (см. Таблицу материалов) до конечной концентрации 1 мкМ в лунке. После 30 мин инкубации при комнатной температуре удалить излишки белка путем промывания буфером не менее 5 раз.
- Добавьте mOrange-Nano (см. Таблицу материалов) до конечной концентрации 200 нМ и держите образец в темноте, накрыв его алюминиевой фольгой.
- Поместите предметное μ предметное стекло под флуоресцентный микроскоп и отрегулируйте параметры изображения. Установите лазер с длиной волны 552 нм для возбуждения mOrange-Nano. Отрегулируйте диапазон излучения для оптимизации сигнала mOrange. Фотоактивация disiLID осуществляется с помощью лазера с длиной волны 488 нм с использованием световых импульсов с интервалом 2,58 с.
3. Подготовка ГУВ
- Приготовьте 5% (масс./об.) раствор поливинилового спирта (ПВА, см. Таблицу материалов) (МВ: 145 000 г/моль) со 100 мМ сахарозы в ультрачистой воде, перемешайте в течение ночи при 80 °C при 400 об/мин.
- Приготовьте липидный раствор в хлороформе с нужным составом (конечная концентрация 10 мг/мл). Для этого метода рекомендуется состав, состоящий из 10 мг/мл POPC, 10 моль % 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфо-(1'-rac-глицерин) (POPG), 2 моль % DOPE-биотина и 1 моль % DiD (см. Таблицу материалов).
- Подготовьте GUV по методике гидратации 7,8. Сначала распределите 40 мкл приготовленного раствора ПВА в виде однородного тонкого слоя поверх предметного стекла размером 60 мм x 24 мм, предпочтительно с наконечником для дозатора. Далее высушите тонкий слой при температуре 50 °C в течение 30 минут.
- Распределите 5 мкл липидного раствора иглой по слою ПВА и дайте высохнуть при температуре 30 °C в течение 1 ч.
- Соберите камеру на функционализированном предметном стекле с помощью дистанционной рамки (~40 мм × 24 мм × 2 мм, см. Таблицу материалов) и второго предметного стекла.
- Добавьте 1 мл регидратационного буфера (10 мМ Tris pH 7,4, 100 мМ NaCl) в камеру на 1 ч при комнатной температуре для образования GUVs. Через 1 час переверните камеру и аккуратно постучите по стеклянным поверхностям наконечником пипетки.
- Осторожно снимите предметное стекло с одной стороны, чтобы открыть встроенную камеру, и соберите GUV с помощью пипетки.
- Поместите раствор в пластиковую пробирку и дайте GUV отстояться в течение 2 часов.
4. mOrange-Nano Рекрутинг для функционализированных GUV disiLID
- Добавьте раствор SAv в свежесобранные GUV и оставьте на 30 минут при комнатной температуре.
ПРИМЕЧАНИЕ: Следующие шаги следует выполнять с защитным красным светом, чтобы избежать фотоактивации disiLID. - Добавьте 1 мкМ b-disiLID в раствор GUVs и поместите образец на 30 мин в темноту, накрыв его алюминиевой фольгой.
- Предварительно обработайте μ-слайдовую 18-луночную стеклянную нижнюю камеру раствором 150 μL BSA (3% w/v в воде) в течение 10 минут. Далее удалите раствор БСА и промойте лунки 150 μл ультрачистой водой 3 раза.
- Добавьте в лунку 145 мкл 200 нМ mOrange-Nano в буфере (10 мМ Tris pH 7,4, 100 мМ NaCl).
- Затем добавьте в раствор 5 μL GUV, украшенных b-disiLID, и подождите ~15 минут, пока GUV осядут.
- Поместите предметное μ предметное стекло под конфокальный микроскоп. Возбуждайте образец на длине волны 552 нм, чтобы визуализировать флуоресценцию mOrange (λex = 557 нм; λem = 576 нм), и на длине волны 638 нм, чтобы визуализировать DiD (λex = 644 нм; λem = 665 нм) в мембранах GUV. Рекрутинг mOrange-Nano запускается импульсами синего света (488 нм, интенсивность 1%) каждые 5,3 с, чтобы свести к минимуму нежелательные эффекты фотообесцвечивания.
ПРИМЕЧАНИЕ: Длины волн возбуждения могут быть адаптированы в зависимости от типа используемого микроскопа. Другими распространенными длинами волн возбуждения, доступными для микроскопов, также являются лазеры 532 нм или 561 нм и 633 нм, 647 нм, 639 нм или 640 нм.
Результаты
Описанные процедуры позволяют формировать SLB для рекрутирования mOrange-Nano на синтетических мембранах. Формирование определенного mOrange-Nano с рисунком на SLB, функционализированных с помощью b-disiLID, показано на рисунке 1A. Поскольку квадратная (24 мкм × 24 мкм) область интереса (ROI) на SLB освещается синим светом с длиной волны 488 нм, в канале mOrange (показан красным) в ROI в течение 200 с наблюдается быстрое увеличение флуоресцентного сигнала. Узор показывает очень четкие и острые края (рис. 1B), что указывает на высокий пространственный контроль над фотоактивированной областью. Взаимодействие происходит быстро и полностью обратимо, так как подсветка синим светом прерывается. Этот метод также позволяет формировать узоры в течение нескольких циклов освещения (рис. 2). Чередование циклов ~200 с синего света и 200 с темноты приводит к обратимому рекрутированию mOrange-Nano в выбранной области в течение нескольких раз с сопоставимыми значениями интенсивности флуоресценции Δ в паттернах.
На рисунке 3 представлено схематическое изображение подготовки GUVs. Рекрутирование mOrange-Nano наблюдается и на GUV. Показано, что GUV, помещенные в темноте, не проявляют флуоресценции mOrange (рис. 4A). Поскольку GUV глобально освещаются синим светом, наблюдается флуоресценция mOrange, колокализующаяся с мембранным красителем GUV (DiD). Взаимодействие является весьма обратимым, так как освещение прекращается. Количественная оценка интенсивности mOrange на мембране GUV с течением времени показывает быстрое и эффективное пополнение белков, а также полную обратимость (рис. 4B).
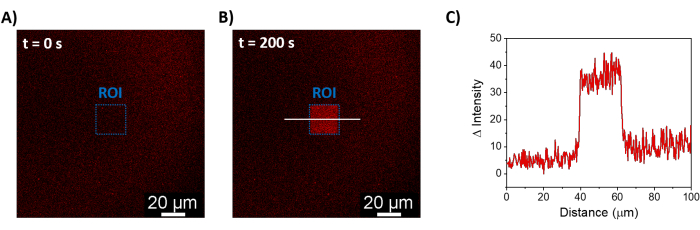
Рисунок 1: Флуоресцентные микроскопические изображения SLB, функционализированных с помощью b-disiLID. Флуоресцентные изображения в присутствии mOrange-Nano до (A) и во время (B) локального синего света (488 нм) в ROI. Масштабная линейка = 20 мкм. (C) Интенсивность флуоресценции mOrange, измеренная в ROI для SLB, функционализированных с помощью b-disiLID (при = 200 с). Рисунок адаптирован из Di Iorio et al.8. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
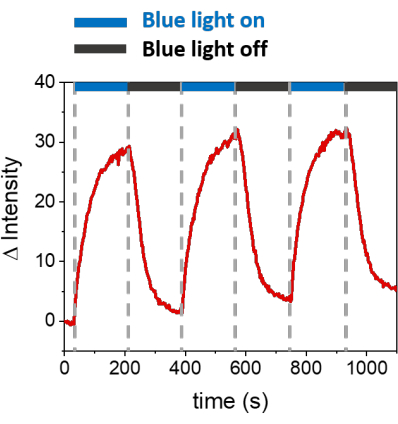
Рисунок 2: Интенсивность флуоресценции mOrange, рекрутируемого в ROI на SLB, оснащенных b-disiLID, в течение трех циклов рекрутинга. После каждого этапа фотоактивации флуоресценция mOrange-Nano увеличивалась в пределах ROI. Картина достигает насыщения в течение 120 с, а флуоресценция уменьшается в течение 120 с, почти до фонового уровня. При различных циклах синего света/темноты не наблюдается потери качества рисунка. Рисунок адаптирован из Di Iorio et al.8. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
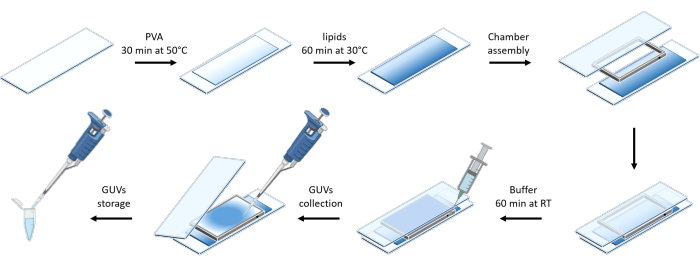
Рисунок 3: Схематическое изображение приготовления GUVs методом щадящей гидратации. Схема предлагает визуальное представление нескольких ступеней и камеры, построенной с помощью двух стеклянных стекол и дистанционной рамки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
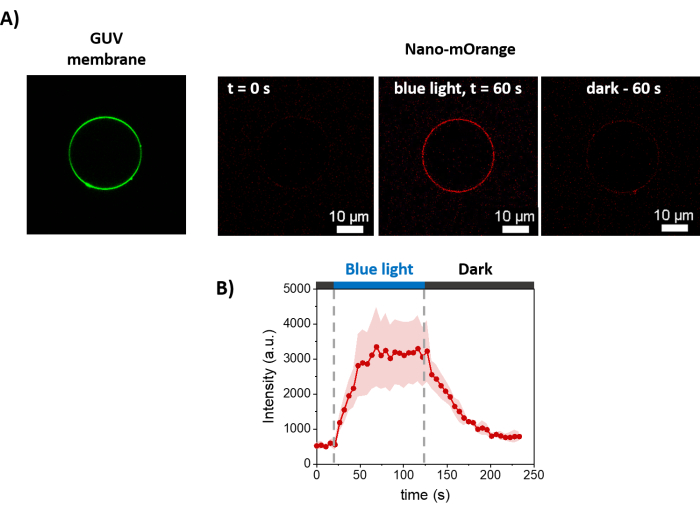
Рисунок 4: Флуоресцентные микроскопические измерения светозависимого набора mOrange-Nano на мембранах GUVs. (A) Флуоресцентные изображения дисиLID-функционализированного GUV в присутствии mOrange-Nano. Зеленым цветом обозначен мембранный краситель GUV, а красным — флуоресценция mOrange до, во время и после освещения синим светом. Масштабные линейки = 10 мкм. (B) Интенсивность флуоресценции mOrange, локализованная на GUV с течением времени. При освещении флуоресценция mOrange (показана красным) на липидной мембране достигает максимальной интенсивности в течение 60 с, при этом интенсивность флуоресценции увеличивается в 5,9 раза. При прекращении освещения флуоресценция mOrange уменьшается почти до значений предварительного освещения в течение 60 с (с восстановлением 90%). Рисунок адаптирован из Di Iorio et al.8. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Мы описали метод локализованного рекрутирования белков mOrange-Nano на модельных мембранах, таких как поддерживаемый липидный бислой и гигантские униламеллярные везикулы, с использованием фотопереключаемого белка disiLID8. Аспекты, влияющие на качество рисунка, включают качество белков, а также хорошее качество SLB и GUV.
Чтобы обеспечить хорошее качество белка после сцеживания и очистки, важно сначала оценить фотопереключаемые свойства disiLID. Для этого необходимо измерить поглощение кофактора ФМН в темноте и после синего освещения. Ожидается, что УФ-ВИД спектры disiLID покажут характерный тройной пик кофактора FMN в темноте, который значительно уменьшается при освещении синим светом и восстанавливается втемноте 13. Это фотопереключаемое поведение имеет решающее значение для получения воспроизводимого и обратимого рекрутинга на следующих этапах. Работа с защитным красным светом и воздействие на disiLID минимального внешнего освещения во время подготовки образцов повышает производительность экспериментов.
Еще одним важным этапом и, возможно, самым важным является формирование правильных SLB. Дефекты в мембранах и/или образование неоднородных SLB (т.е. наличие многослойных или заплатенных SLB) повлияют на качество структуры белка. Поэтому неопытным пользователям рекомендуется воспроизвести протокол, пометив внедорожники некоторыми мембранными красителями, такими как DiD и DiO, чтобы сформировать флуоресцентно меченные SLB. Таким образом, свойства и качество SLB можно хорошо охарактеризовать с помощью флуоресцентной микроскопии. Измерения FRAP представляют собой типичный подход к оценке качества SLB путем оценки текучести мембран. В качестве альтернативы, в случае биотинилированных SLB, подобных описанным в настоящем протоколе, для визуализации и оценки качества SLB можно использовать флуоресцентно меченые SAv (например, Atto 488-SAv).
В первой части протокола описывается формирование паттернов на SLB. Чтобы обеспечить оптимальный результат, важно добавить mOrange-Nano в SLB и дать образцу инкубироваться в темноте в течение 15 минут. Во время фотоактивации выбор ROI не ограничивается конкретным размером. Тем не менее, интенсивность лазера и время воздействия необходимо регулировать, чтобы уменьшить нежелательное фотообесцвечивание флуоресцентных белков.
Этот метод не ограничивается биотинилированными белками, и для привязки disiLID к SLB могут быть использованы другие подходы. Например, disiLID, помеченный His, может быть экспрессирован и закреплен на Ni-NTA-содержащих SLB. Тем не менее, крайне важно экспрессировать Nano и disiLID с разными метками, чтобы избежать замены белков на SLB. Этот метод также позволяет инвертировать порядок белков, тем самым функционализируя SLB с Nano и рекрутируя disiLID (или белки, слитые с disiLID) при освещении синим светом.
Для динамического контроля локализации белка должна быть возможна многократная обратимая локализация белка в выбранной области. Для достижения этой цели концентрация Nano (200 нМ) в растворе является критическим параметром для получения высокой обратимости.
Еще одной проблемой является привлечение Nano к дисиLID-функционализированной поверхности GUV. Как и в случае структурирования белков на SLB, этот метод может быть распространен на различные стратегии функционализации мембран. В этом протоколе весь GUV освещался синим светом для привлечения mOrange-Nano на всей поверхности GUV. Тем не менее, выбор небольших ROI, локализованных на мембране GUV, должен привести к точной локализации белков в более ограниченной области.
Этот метод имеет только ограничение, связанное с выбором флуорофора, используемого для визуализации набора Nano на мембране внедорожников или GUV. В частности, следует избегать флуорофоров со спектром возбуждения в диапазоне синего света, так как их использование будет препятствовать фотоактивации (dis)iLID. Таким образом, для этого типа экспериментов рекомендуется выбирать флуорофоры в зеленом или красном диапазоне света (например, mOrange или Cy5).
Конструкция disiLID предлагает простой и адаптируемый способ улучшения рекрутирования локальных белков в мембранах и расширяет динамический диапазон iLID и Nano из оптогенетики4. Эти методы сосредоточены на привлечении Nano на мимические мембраны, такие как липидные бислои и GUV. Тем не менее, этот подход может быть распространен на многочисленные оптогенетические инструменты в клетках, где (dis)iLID или Nano связаны с мембраной.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была профинансирована Европейским исследовательским советом ERC Starting Grant ARTIST (# 757593 S.V.W.). DDI благодарит Фонд Александра фон Гумбольдта за стипендию для постдокторантуры.
Материалы
| Name | Company | Catalog Number | Comments |
| µ-Slide 18 Well | Ibidi | 81817 | For SLB preparation |
| 25 µL Microliter Syringe | Hamilton | Model 702 N | For the preparation of lipid mixture and spreading the lipid solution on the PVA layer |
| Biotinyl Cap PE (1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl)) (sodium salt) | Avanti Polar Lipids | 870273C | For SUVs preparation |
| CaCl2 (Calcium chloride) | Sigma-Aldrich | C5670 | For SLB formation |
| Cover Slips 24 mm x 60 mm | Engelbrecht | K12460 | For GUVs formation |
| DiD (1,1'-Dioctadecyl-3,3,3',3'- Tetramethylindodicarbocyanine) | Thermo Fisher Scientific | D7757 | Membrane dye |
| disiLID | Sequence: MGGSGLNDIFEAQKIEWHEGGSH HHHHHGSMAATELRGVVGPGPAA IAALGGGGAGPPVGGGGGRGDA GPGSGAASGTVVAAAAGGPGPG AGGVAAAGPPAPPTGGSGGSGA GGSGSAGEFLATTLERIEKNFVIT DPRLPDNPIIFASDSFLQLTEYSR EEILGRNCRFLQGPETDRATVRK IRDAIDNQTEVTVQLINYTKSGKK FWNVFHLQPMRDYKGDVQYFIG VQLDGTERLHGAAEREAVMLIKK TAFQIAEAANDENYF | ||
| DOPC (1,2-di-(9Z-octadecenoyl)-sn-glycero-3-phosphocholine) | Avanti Polar Lipids | 850375P | For SUVs lipid composition |
| Eppendorf Protein LoBind microcentrifuge tubes | Merk | EP0030108116-100EA | For collecting freshly made GUVs |
| mOrange-Nano | Sequence: MRGSHHHHHHGSKIEEGKLVI WINGDKGYNGLAEVGKKFEKDT GIKVTVEHPDKLEEKFPQVAATG DGPDIIFWAHDRFGGYAQSGLLA EITPDKAFQDKLYPFTWDAVRYN GKLIAYPIAVEALSLIYNKDLLPNP PKTWEEIPALDKELKAKGKSALM FNLQEPYFTWPLIAADGGYAFKY ENGKYDIKDVGVDNAGAKAGLTF LVDLIKNKHMNADTDYSIAEAAFN KGETAMTINGPWAWSNIDTSKVN YGVTVLPTFKGQPSKPFVGVLSA GINAASPNKELAKEFLENYLLTDE GLEAVNKDKPLGAVALKSYEEELA KDPRIAATMENAQKGEIMPNIPQM SAFWYAVRTAVINAASGRQTVDEA LKDAQTNSSSNNNNNNNNNNLGI EGTTENLYFQGSVSKGEENNMAI IKEFMRFKVRMEGSVNGHEFEIE GEGEGRPYEGFQTAKLKVTKGG PLPFAWDILSPQFTYGSKAYVKH PADIPDYFKLSFPEGFKWERVMN FEDGGVVTVTQDSSLQDGEFIYK VKLRGTNFPSDGPVMQKKTMG WEASSERMYPEDGALKGEIKMR LKLKDGGHYTSEVKTTYKAKKPV QLPGAYIVGIKLDITSHNEDYTIVE QYERAEGRHSTGGMDELYKGG SGTSSPKRPKLLREYYDWLVDN SFTPYLVVDATYLGVNVPVEYVK DGQIVLNLSASATGNLQLTNDFIQ FNARFKGVSRELYIPMGAALAIYA RENGDGVMFEPEEIYDELNIG | ||
| NaCl (Sodium chloride) | Sigma-Aldrich | S9888 | For buffer |
| NaOH (Sodium hydroxide) | Sigma-Aldrich | 1064980500 | For surface activation in SLB formation |
| POPC (1-Palmitoyl-2- oleoylphosphatidylcholine) | Avanti Polar Lipids | 850457C | For GUVs lipid composition |
| PVA (Polyvinyl alcohol) fully hydrolyzed | Sigma-Aldrich | 8148940101 | For GUVs formation |
| SP8 confocal laser scanning microscope | Leica | ||
| Streptavidin | TermoFisher | 434301 | |
| Sucrose | Sigma-Aldrich | 84097 | For GUVs formation |
| Tris hydrochloride | Sigma-Aldrich | 10812846001 | For buffer |
Ссылки
- Kretschmer, S., Schwille, P. Pattern formation on membranes and its role in bacterial cell division. Curr Opin Cell Biol. 38, 52-59 (2016).
- Yang, H. W., Collins, S. R., Meyer, T. Locally excitable Cdc42 signals steer cells during chemotaxis. Nat Cell Biol. 18 (2), 191-201 (2016).
- Caldwell, R. M., et al. Optochemical control of protein localization and activity within cell-like compartments. Biochem. 57 (18), 2590-2596 (2018).
- Kennedy, M. J., et al. Rapid blue-light-mediated induction of protein interactions in living cells. Nat Methods. 7 (12), 973-975 (2010).
- Guntas, G., et al. Engineering an improved light-induced dimer (iLID) for controlling the localization and activity of signaling proteins. Proc Natl Acad Sci. 112 (1), 112-117 (2015).
- Levskaya, A., Weiner, O. D., Lim, W. A., Voigt, C. A. Spatiotemporal control of cell signalling using a light-switchable protein interaction. Nature. 461 (7266), 997-1001 (2009).
- Bartelt, S. M., et al. Dynamic blue light-switchable protein patterns on giant unilamellar vesicles. Chem Commun. 54 (8), 948-951 (2018).
- Di Iorio, D., Bergmann, J., Higashi, S. L., Hoffmann, A., Wegner, S. V. A disordered tether to iLID improves photoswitchable protein patterning on model membranes. Chem. Commun. 59 (29), 4380-4383 (2023).
- Hartzell, E. J., Terr, J., Chen, W. Engineering a blue light inducible Spytag system (BLISS). J Am Chem Soc. 143 (23), 8572-8577 (2021).
- Xu, D., Bartelt, S. M., Rasoulinejad, S., Chen, F., Wegner, S. V. Green light lithography: a general strategy to create active protein and cell micropatterns. Mater Horiz. 6 (6), 1222-1229 (2019).
- Jia, H., et al. Light-induced printing of protein structures on membranes in vitro. Nano Lett. 18 (11), 7133-7140 (2018).
- Di Iorio, D., Verheijden, M. L., vander Vries, E., Jonkheijm, P., Huskens, J. Weak Multivalent Binding of influenza hemagglutinin nanoparticles at a sialoglycan-functionalized supported lipid bilayer. ACS Nano. 13 (3), 3413-3423 (2019).
- Kasahara, M., Torii, M., Fujita, A., Tainaka, K. FMN binding and photochemical properties of plant putative photoreceptors containing two LOV domains, LOV/LOV proteins. J Biol Chem. 285 (45), 34765-34772 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены