Method Article
التنبيب الرغامي عن طريق بضع القصبة الهوائية وبضع الصدر اللاحق في الفئران لتطبيقات عدم البقاء على قيد الحياة
In This Article
Summary
نقدم هنا إجراء موحدا للتنبيب الرغامي عن طريق بضع القصبة الهوائية متبوعا ببضع الصدر في الفئران ، يهدف إلى تعزيز دقة وقابلية تكرار التطبيقات غير القابلة للبقاء على قيد الحياة التي تتطلب تهوية جراحية وتعرض الأعضاء الصدرية في نماذج الفئران في الجسم الحي .
Abstract
غالبا ما يكون التنبيب الرغامي والتهوية اللاحقة من المتطلبات الأساسية للبحث الانتقالي في نماذج الفئران للتدخلات المختلفة التي تتطلب ضغوط تهوية خاضعة للرسيبة أو عالية أو الوصول إلى التجويف الصدري والأعضاء. التنبيب الداخلي التقليدي باستخدام المسار التشريحي عبر الفم مناسب تماما لتجارب البقاء على قيد الحياة. ومع ذلك ، فإن هذا الإجراء يطرح بعض التحديات ، بما في ذلك مستويات أعلى بشكل عام من الخبرة والمهارة الفنية المطلوبة ، ومعدات أكثر تقدما ، وبذل جهد زمني أكبر مع معدلات فشل التنبيب ذات الصلة والمضاعفات مثل ثقب القصبة الهوائية ، ونقص الأكسجين الجهازي المؤقت ، والتسرب الجوي ذي الصلة.
لذلك ، تقدم هذه المخطوطة بروتوكولا مفصلا خطوة بخطوة للتنبيب الرغامي من خلال بضع القصبة الهوائية في نماذج الفئران غير الناجية عند ضمان نجاح التنبيب ، أو مستويات الأكسجين الثابتة ، أو ضغوط التهوية العالية ، أو بضع الصدر المفتوح.
يؤكد البروتوكول على أهمية التقنية الجراحية الدقيقة لضمان نتائج متسقة وموثوقة ، خاصة للباحثين الذين يفتقرون إلى الخبرة أو يفتقرون إلى الروتين في تقنية التنبيب الداخلي عن طريق تنظير الحنجرة المباشر. لذلك ، من المتوقع أن يقلل هذا الإجراء من معاناة والخسائر غير الضرورية للحيوانات.
Introduction
بشكل عام ، القوارض قادرة على تعويض الضائقة التنفسية لفترة أطول بكثير من المرضى. يمكن أن تظل مستقرة في القلب والدورة الدموية وكافية تحت التهوية التلقائية لفترة أطول وأثناء الإجراءات الأكثر توغلا ، على سبيل المثال ، حتى من خلال زراعة الكبد ، والتي من المعروف أنها واحدة من أكثر الإجراءات إرهاقا للدورة الدموية القلبية الرئوية1،2،3.
ومع ذلك ، فإن التنبيب الرغامي هو مطلب أساسي للبحث الانتقالي في نماذج الفئران لمختلف الإعدادات والتدخلات الناشئة عن مجموعة متنوعة من المجالات الطبية الحيوية وهو ضروري في المشهد العلمي اليوم4،5،6،7،8،9،10،11. في حين أن غالبية أعمال المختبر التجريبية التي يتم إجراؤها في الفئران بشكل عام لا تزال لا تتطلب تهوية غازية12 ، إلا أن هناك بعض الإعدادات التجريبية التي تتطلب التنبيب والمساعدة التنفسية الخاضعة للرقابة. تتضمن هذه الإعدادات التجريبية أي تجربة تتطلب مجرى هواء آمن ، وضغوط تهوية عالية ، وتنظير البطن أو الوصول المباشر إلى التجويف الصدري والأعضاء.
خاصة في حالة الوصول المطلوب إلى التجويف الصدري والأعضاء ، فإن التنبيب الرغامي أمر حتمي لأن انهيار الرئة سيؤدي إلى قصور تنفسي قاتل بمجرد فقدان الضغط السلبي في الفضاء داخل الجنبي وآلية الإلهام بواسطة العضلات الوربية والحجاب الحاجز13.
في حين أن هناك العديد من المنشورات حول طرق التنبيب الداخلي غير الغازي في القوارض14،15،16،17 ، يبدو أن هناك نقصا في بروتوكولات الإجراءات للتنبيب الرغامي الغازي عن طريق بضع القصبة الهوائية. على الرغم من غزو هذا الأخير ، والذي يسمح فقط بالتطبيق في نماذج غير القابلة للبقاء على قيد الحياة ، إلا أن هناك مزايا كبيرة للتنبيب عن طريق بضع القصبة الهوائية. وتشمل هذه منحنى التعلم الأكثر حدة ، ومعدلات نجاح أعلى وأكثر ثباتا ، ومعدات تقنية أقل حاجة ، وفرص مراقبة النجاحالمحسنة 18،19.
نجاح التنبيب ضروري للنتيجة. في حين أن التنبيب الكاذب المختلف ، بالإضافة إلى محاولات التنبيب المتكررة لدى المرضى ، ترتبط بوضوح بأحداث ومضاعفات ضارة مثل الموت20،21 ، فإن مثل هذه الأحداث ضارة أيضا في الاختبار. في أفضل الأحوال ، فإنها تمثل متغيرا مربكا قويا في التجربة ، ولكنها يمكن أن تؤدي أيضا إلى فقدان غير ضروري للحيوان. لذلك ، من المنطقي زيادة معدلات نجاح التنبيب على حساب عدم التدخل الجراحي إذا سمح الإعداد التجريبي والاستراتيجية بذلك.
يوفر هذا البروتوكول الموحد للتنبيب عن طريق بضع القصبة الهوائية الجراحي العديد من المزايا ، بما في ذلك تقليل التباين في معدلات نجاح التنبيب ، وتقليل التأثيرات على معلمات فسيولوجيا القلب والجهاز التنفسي ، والتحكم الكامل في التحقيق والتلاعب بالمعلمات. يساعد في توفير مجرى هواء آمن ، خاصة للباحثين عديمي الخبرة في إجراء التنبيب الرغامي عن طريق تنظير الحنجرة المباشر ، ويسمح للباحثين بإجراء دراسات عدم البقاء على قيد الحياة في ظروف شديدة الخاضعة للرقابة. نسلط الضوء على المعالم التشريحية الرئيسية ونقدم رؤى حول استكشاف الأخطاء وإصلاحها للتحديات الشائعة التي تواجهها أثناء الإجراء.
Protocol
تمت الموافقة على جميع الأنشطة الحيوانية الموضحة هنا من قبل اللجنة المؤسسية لرعاية واستخدامها (IACUC) التابعة لمجلس بادن فورتمبيرغ الإقليمي في كارلسروه ، ألمانيا. تمت إدارة التجارب وفقا للمعايير المؤسسية ووفقا للقوانين الألمانية لاستخدام ورعايتها ووفقا لتوجيهات مجلس الجماعة الأوروبية (2010/63 / EU) بالإضافة إلى إرشادات ARRIVE وتم إجراؤها في مرافق معتمدة. تم استخدام ذكور فئران Spraque Dawley من Janvier Labs بوزن طلب 400 جرام.
1. إعداد الإجراء (الشكل 1)
- قم بإعداد خطافات التحضير الجراحي عن طريق طي القنيات بزاوية 135 درجة عند 1 سم إلى الحافة ، وتوصيلها بأنابيب التروية البلاستيكية عبر قفل Luer ، وتطبيق الشد باستخدام مشبك البعوض الجراحي (الشكل 1 أ ، ب).
- تحضير جهاز التعرض الجراحي للقوارض.
ملاحظة: إلى جانب توفر المنصات التجارية ، يمكن أيضا أن تكون ذاتية البناء بشكل فعال من حيث التكلفة ، كما في هذه الدراسة.- لهذا ، استخدم صفيحة فولاذية مقاس 40 سم × 50 سم بسماكة 4 مم. قم بإنشاء عدة ثقوب مقاس 8 مم باستخدام مثقاب فولاذي في الموقع المطلوب لنقاط الشد اللاحقة. ضع قضبان التثبيت على شكل حرف Y في هذه المواقع.
- ضع وسادة تسخين أعلى الصفيحة الفولاذية لجهاز التعرض الجراحي لتوفير الدعم الحراري.
- قم بإعداد خطافات التحضير الجراحي بأنابيب بلاستيكية متصلة ومشابك البعوض الجراحية لتطبيق التوتر لاحقا على الأنسجة للتعرض الجراحي.
- قم بإزالة سدادة حقنة بلاستيكية سعة 10 مل بطرف قفل لورير ذكر واقطع الطرف القريب من المحقنة. أدخل الجزء البعيد في كيس التهوية كما هو موضح وأغلقه بإحكام عن طريق تغطيته بأنبوب انكماش حراري وتطبيق حرارة لطيفة باستخدام شعلة مختبر (الشكل 1D-F).
- قم بتقصير وشطبة أحجام مختلفة من القسطرة الوريدية وإدخال سلك توجيه من مجموعة القسطرة الشريانية مع نهاية السلك المرن عند الحافة في حجم القسطرة الأنسب لحجم المعني (من المفترض 14 جم) لتقنية Seldinger اللاحقة22،23 أثناء التنبيب (الشكل 1G ، H).
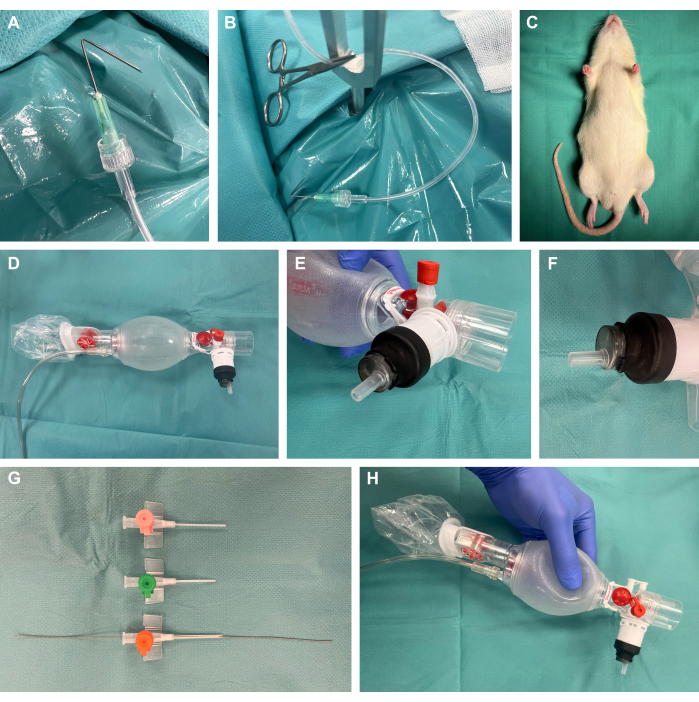
الشكل 1: الإعداد التجريبي. (أ) قنية مطوية متصلة بأنبوب تروية يستخدم كخطاف تحضير جراحي. (ب) خطاف التحضير مع المشبك الموضوع في قضيب تثبيت معدني. (ج) المخدر قبل التدخل. (د) كيس تهوية من طب حديثي الولادة. (E-F) تركيب محكم لحقنة قفل لور على كيس التهوية باستخدام أنبوب انكماش حراري. (ز) قسطرة وريدية قصيرة ومشطوفة بأحجام مختلفة بسلك توجيه من مجموعة قسطرة الزعيم الشرياني لتقنية Seldinger. (ح) البناء النهائي المصنوع حسب الطلب. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. التخدير والتسكين
- تخدير الجرذ بالدواء المفضل.
ملاحظة: هنا ، تم إنشاء التخدير والتسكين باستخدام الكيتامين 10٪ (100 مجم / مل) ، زيلازين 2٪ (20 مجم / مل) ، كاربروفين 50 مجم / مل ، والأيزوفلوران. تم استخدام تخفيف 1:10 من الزيلازين والكاربروفين كحلول مخزون للتطبيق.- تحفيز التخدير عن طريق وضع في صندوق تحريضي مغمور بالأكسجين بنسبة 100٪ بمعدل تدفق 5 لتر / دقيقة مكملا بنسبة 4٪ (v) من الأيزوفلوران باستخدام المرذاذ.
- بعد تحقيق فقدان الوعي ، قم بإزالة من صندوق الحث وحقنه (IP) ب 100 مجم / كجم من وزن الجسم كيتامين و 4 مجم / كجم من وزن الجسم زيلازين.
ملاحظة: هذا يعادل 40 مجم من الكيتامين (0.4 مل من المحلول الأصلي) و 1.6 مجم من الزيلازين (0.08 مل من المحلول الأصلي أو 0.8 مل من محلول 1:10) لحيوان 400 ملغ. - ضع مرة أخرى في صندوق الحث المغمور بالأيزوفلوران حتى يبدأ تأثير حقن IP.
- ضمان عمق التخدير المناسب من خلال اختبار عدم استجابة الفئران لقرص إصبع القدم الثابت.
- ضع مرهم العيون على العينين.
- تقييم عمق التخدير والحفاظ عليه أثناء الجراحة.
- عندما يبدو أن التأثيرات المخدرة تتضاءل بمرور الوقت (كل ساعة تقريبا) ، قم بحقن بكمية إضافية من 50 مجم / كجم من وزن الجسم و 1 مجم / كجم من وزن الجسم زيلازين. هذا يتوافق مع 20 مجم من الكيتامين (0.2 مل من المحلول الأصلي) و 0.4 مجم من الزيلازين (0.2 مل من محلول 1:10) لحيوان 400 مجم.
- توفير تسكين إضافي قبل بضع الصدر بحقن SC بمقدار 5 ملغ/كغ من الكاربروفين. هذا يتوافق مع 2 مجم من الكاربروفين (0.04 مل من المحلول الأصلي أو 0.4 مل من محلول 1:10) لحيوان 400 ملغ.
3. التحضير الجراحي (الشكل 2)
- تشبع الدورة الدموية للحيوان بالأكسجين عن طريق استنشاق الأكسجين بنسبة 100٪ عبر قناع حديثي الولادة عبر الأنف (الشكل 2 أ).
- بعد 5 دقائق ، قم بالتبديل من قناع حديثي الولادة عبر الأنف إلى بناء كيس تهوية لحديثي الولادة مع طرف قفل لور من حقنة بلاستيكية للذكور كما هو موضح أعلاه وقدم الأكسجين في حالة فائض مع طرف المحقنة بالقرب من طرف أنف (الشكل 2 ب).
- قم بإجراء شق متوسط في الجلد الصدري عبر الطول المطلوب وفضح فتحة العين الجراحية باستخدام خطافات التحضير الجراحي (الشكل 2C ، D).
- تقدم في التحضير عن طريق التشريح الحاد بمقص ناعم من خلال لفافة عنق الرحم. كشف القصية الترقوية الخشائية والعضلة تحت اللاهيويد ووضع العضلات تحت اللاويويد المتوسطة إلى اليمين بعد تشريح الغشاء الجانبي الأيسر (الشكل 2E-G).
- قم بإجراء تشريح حاد باتجاه القصبة الهوائية ونفق القصبة الهوائية باستخدام مشابك overholt (الشكل 2H-I).
- حبال القصبة الهوائية باستخدام حلقة وعاء سيليكون وحبال مزدوجة للقصبة الهوائية البعيدة باستخدام خياطة متعددة الشعيرات لتثبيت قنية القصبة الهوائية في وقت لاحق (الشكل 2J-N).

الشكل 2: تحضير القصبة الهوائية. (أ) استنشاق الأكسجين عن طريق القناع. (ب) قم بالتبديل من القناع إلى حقنة قفل Luer الذكور لتطبيق الأكسجين. (ج) شق الجلد الصدري العنقي. (د) التحضير من خلال اللفافة العنقية. (ه) التعرض للعضلة القصية الترقوية الخشائية والعضلة تحت الهيويد. (و) الجانبي للعضلة تحت الهيويدات المتوسطة. (ز) تشريح حاد باتجاه القصبة الهوائية. (ح) حفر نفق للقصبة الهوائية باستخدام مشابك الحفر الزائدة. (ط) حبال القصبة الهوائية باستخدام حلقة وعاء سيليكون. (J-N) حبال ذيلية مزدوجة للقصبة الهوائية باستخدام خياطة خيوط متعددة لتثبيت قنية القصبة الهوائية في وقت لاحق. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. إجراء التنبيب (الشكل 3)
- قم بإطالة القصبة الهوائية باستخدام كماشة غير رضحية (الشكل 3 أ ، ب).
- قم بإجراء شق جزئي في القصبة الهوائية بزاوية 180 درجة من المحيط باستخدام المقص (الشكل 3C-F).
- أدخل سلك توجيه Seldinger بنهاية مرنة في القصبة الهوائية (الشكل 3G-H) ثم أدخل القسطرة الوريدية المعدلة ذات المقاس المناسب في القصبة الهوائية الموجهة بسلك Seldinger (الشكل 3I-N).
- قم بإزالة سلك Seldinger (الشكل 3O) ، وقم بتوصيل طرف قفل Luer لقسطرة القصبة الهوائية بكيس التهوية المعدل ، وابدأ التهوية اليدوية اللطيفة الواقية للرئة بتردد عال وحجم مد وجزر منخفض (الشكل 3P). إجراء التهوية اليدوية طالما لم يتم إجراء بضع الصدر المتوسط ولم تكن الرئة على مرأى من الجميع.
- اربط خياطة القفل الموضوعة مسبقا بعقدة منزلقة لتجنب التسرب الجوي وإزالة القسطرة العرضية (الشكل 3Q-T).

الشكل 3: التنبيب الرغامي عن طريق بضع القصبة الهوائية. (أ) الحالة الأولية بعد التحضير. (ب) إطالة الذيلية للقصبة الهوائية باستخدام كماشة غير رضحية. (C-F) شق جزئي في القصبة الهوائية بزاوية 180 درجة من المحيط. (ز ، ح) إدخال سلك توجيه Seldinger في القصبة الهوائية. (آي إم) إدخال القسطرة الوريدية المعدلة في القصبة الهوائية مسترشدة بسلك Seldinger. (غير رسمي) إزالة سلك Seldinger. (P) توصيل قفل لور لقسطرة القصبة الهوائية بكيس التهوية المعدل. (Q-T) ربط خياطة القفل الموضوعة مسبقا لتجنب إزالة القسطرة عن طريق الخطأ. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. التهوية اليدوية وبضع الصدر المتوسط (الشكل 4)
- ابدأ بضع الصدر المتوسط من الخنجري باستخدام مقص مادة حاد ومستقر (الشكل 4 أ ، ب) واستمر في الجمجمة من خلال القص. أوقف التهوية مؤقتا دائما لبضع ثوان عند التقدم بالمقص تحت الظهر وعند القطع لتجنب صدمة الرئة (الشكل 4C-E).
- اكتسب التعرض الصدري باستخدام خطافات التحضير الجراحي وإزالة الأغشية المصلية المنصف (الشكل 4F-H).
- استمر في التهوية اليدوية بالتردد المطلوب وحجم المد والجزر وتوسيع نطاق المراقبة (على سبيل المثال ، إنشاء قياس ضغط الدم داخل الشرايين ، وتركيب قسطرة شريانية مركزية أو رئوية اعتمادا على الغرض أو سؤال البحث المعني) (الشكل 4I-L).

الشكل 4: التهوية اليدوية وبضع الصدر المتوسط. (أ) الوضع الأولي بعد التنبيب. (ب - ه) متوسط بضع الصدر بدءا من الخنجري. (و-1) التعرض الصدري باستخدام خطافات التحضير الجراحي. (ي) الإعداد النهائي أثناء التهوية. (K-L) عملية التهوية اليدوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. القتل الرحيم
- تحقيق القتل الرحيم عن طريق استئصال القلب الحاد المفاجئ باستخدام المقص في المخدر بعمق.
النتائج
تم إجراء التنبيب الرغامي عن طريق بضع القصبة الهوائية وبضع الصدر اللاحق في 10 ذكور من الفئران (متوسط الوزن 405 ± 30 جم) لتطبيقات غير البقاء على قيد الحياة. تم تنفيذ الإجراء من قبل طبيب مقيم في السنة الثانية في الجراحة. كان معدل النجاح المحدد من خلال البقاء على قيد الحياة أكثر من 20 دقيقة من التنبيب والتهوية 100٪. كان متوسط مدة إجراء التحضير والتنبيب من شق الجلد حتى تثبيت أنبوب التنبيب 6:55 ± 0:53 دقيقة (الجدول 1).
| عدد المستخدمة | 10 |
| وزن الجسم (المتوسط والانحراف المعياري) | 405 ± 30 جم |
| معدل نجاح التنبيب | 100% |
| مدة الإجراء (المتوسط والانحراف المعياري) | 6:55 ± 0:53 دقيقة |
| متوسط تشبع الأكسجين | 96% |
| الحد الأدنى من تشبع الأكسجين | 92% |
الجدول 1: النتائج التمثيلية. النتائج التمثيلية للبروتوكول في 10.
تمت مراقبة التشبع من خلال مسبار قياس التأكسج النبضي ذاتي الاستخدام على الساق الخلفية ولم ينخفض أبدا عن 92٪. تم احتواء التهوية العفوية حتى شق الحجاب الحاجز. نجت جميع الفئران من ال 20 دقيقة المطلوبة للقياسات التجريبية حتى القتل الرحيم المتعمد من خلال استئصال القلب الحاد المفاجئ (الشكل 5).

الشكل 5: تشبع الأكسجين المحيطي. تم قياس تشبع الأكسجين المحيطي طوال مدة هذا الإجراء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في الولايات المتحدة وحدها ، يتم استخدام حوالي 110 مليون جرذ وفئران في التجارب على سنويا24. على الرغم من عدم العثور على إحصاءات موثوقة ، إلا أن نسبة ذات صلة منها ستتلقى تهوية مدعومة ، خاصة في مجالات أبحاث الرئة والقلب وكذلك التخدير. تتلقى معظم هذه التنبيب الداخلي غير الغازي ، والذي ينطوي على عدد من التحديات. وتشمل هذه منحنيات التعلم البطيئة ، ومعدلات أعلى من فشل التنبيب ، وأعداد أكبر من عمليات إعادة التنبيب ، والمضاعفات التنفسية المرتبطة بها بالإضافة إلى تسرب الجهازالتنفسي 25. لذلك ، سيتطلب التنبيب غير الجراحي عموما طاقم أبحاث أكثر خبرة ، وتكنولوجيا أكثر تقدما مثل الألياف البصرية ، وقياس الكبنوة ، وأجهزة التنفس الصناعي الميكانيكية ، وموارد مالية وماديةأكبر 26. وبالتالي ، فإن الجانب الكامل للتنبيب هو مربك ذي مغزى ذي صلة بالتحليل الإحصائي اللاحق وعدم التجانس بين الأفراد للنتائج. ومع ذلك ، غالبا ما يكون التنبيب الداخلي غير الجراحي هو الخيار الوحيد الممكن في تصميمات التجارب الطولية.
البدائل هي فغر القصبة الهوائية للوصول المطلوب على المدى الطويل في التجارب الطولية أو بضع القصبة الهوائية الجراحي "للاستخدام الفردي" في التجارب غير القابلة للبقاء على قيد الحياة. في حين أن البروتوكولات الخاصة بتقنية الجراحة المجهرية لفغر القصبة الهوائية في الفئران متوفرة27 ، لا توجد حاليا بروتوكولات للتنبيب الرغامي عن طريق بضع القصبة الهوائية في نماذج الفئران غير الباقية على قيد الحياة.
وبالتالي ، فإن الإجراء الموحد الموصوف هنا للتنبيب الرغامي عن طريق بضع القصبة الهوائية وبضع الصدر اللاحق في الفئران يمثل طريقة قيمة للباحثين المشاركين في دراسات عدم البقاء على قيد الحياة. ولا يتطلب هذا الإجراء موظفين خبراء ولا تدريبا مكثفا. لديها معدل نجاح التنبيب أعلى بكثير من التنبيب الداخلي ويسمح بخطوات إجرائية أكثر تحكما
تشمل قيود التقنيات المقدمة بشكل أساسي غزو الإجراء ، وعلى التوالي ، التوافق الحصري مع تجارب عدم البقاء على قيد الحياة. نظرا للعيوب الكبيرة في الجلد والأنسجة الرخوة ، وكذلك ناسور القصبة الهوائية الجراحي ، فإن نزع الأنبوب والتعافي من هذا الإجراء غير ممكنين ولا يوصى بهما ، خاصة عند دمجه مع بضع الصدر.
عند استكشاف الأخطاء وإصلاحها للتحديات الشائعة التي تمت مواجهتها أثناء الإجراء ، نود أن نلفت الانتباه إلى النقاط والتوصيات التالية: يجب على المرء إعداد المعدات والأدوية على أوسع نطاق ممكن. يجب على المجرب إجراء التحكم في المرقئ بدقة عن طريق التحضير الدقيق واستخدام مسحات قطنية غير مؤلمة. يجب على المجرب تحضير القصبة الهوائية بطول لا يقل عن 0.5 سم للسماح بالحركة الكافية واستخدام حلقة وعاء السيليكون حتى لا تفقد القصبة الهوائية بعد الشق ، حيث يمكن أن يؤدي ذلك إلى الشفط والاختناق عند فقدان القصبة الهوائية في عمق الأنسجة بسبب ظاهرة الخلفية. قم بشق القصبة الهوائية جزئيا فقط بضربة واحدة واضحة من المقص. من الناحية المثالية ، يجب على المرء أن يقطع محيطا بزاوية 180 درجة. أقل من هذا قد يؤدي إلى فشل التنبيب. أعلاه ، قد يؤدي ذلك إلى انقطاع القصبة الهوائية مع تراجع كلا الطرفين في عمق الأنسجة والاختناق اللاحق. عند ربط خياطة الشعيرات المتعددة لتأمين أنبوب التنبيب ، يجب استخدام عقدة منزلقة لضمان إحكام كاف لتجنب تسرب الهواء أو خلع الأنبوب العرضي مع تجنب الإغلاق غير المقصود للأنبوب في نفس الوقت. يمكن أن يؤدي ترك سلك Seldinger في مكانه أثناء الخياطة إلى تجنب الإغلاق غير المقصود. عند إجراء التهوية اليدوية باستخدام كيس التهوية ، يجب على المرء أن يتجنب بدقة الرضح الضغطي للرئة بأحجام المد والجزر العالية. بدلا من ذلك ، يجب على المرء أن يهدف إلى تهوية واقية من الرئة ، وعالية التكرار ، ومنخفضة المد والجزر ، خاصة طالما لم يتم إجراء بضع الصدر ولا يمكن تقييم أحجام الرئة بصريا.
من خلال تقديم منهجية مفصلة وقابلة للتكرار ، يسهل هذا البروتوكول توحيد الإجراءات التجريبية ، مما يحسن موثوقية البيانات وقابليتها للمقارنة عبر الدراسات. نتيجة لذلك ، تساهم هذه الطريقة في صقل التقنيات العلمية في البحوث قبل السريرية ، مما يعزز في النهاية الأهمية الانتقالية للنتائج في مجالات علم وظائف الأعضاء وعلم الأدوية والعلوم الجراحية والطبية الحيوية.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
يعرب المؤلفون عن امتنانه لخدمة تخزين البيانات SDS@hd بدعم من وزارة العلوم والبحث والفنون في بادن فورتمبيرغ (MWK) ومؤسسة الأبحاث الألمانية (DFG) من خلال منحة INST 35 / 1314-1 FUGG و INST 35 / 1503-1 FUGG. علاوة على ذلك ، يقر المؤلفون بامتنان بالدعم المقدم من NCT (المركز الوطني لأمراض الأورام في هايدلبرغ ، ألمانيا) من خلال برنامج ما بعد الدكتوراه المنظم وبرنامج جراحة الأورام. كما نعترف بالدعم من خلال أموال الدولة التي وافق عليها برلمان ولاية بادن فورتمبيرغ لتحالف Innovation Campus Health + Life Science Alliance Heidelberg Mannheim من برنامج ما بعد الدكتوراه المنظم لألكسندر ستودييه فيشر: الذكاء الاصطناعي في الصحة (AIH) - تعاون بين DKFZ و EMBL وجامعة هايدلبرغ ومستشفى جامعة هايدلبرغ ومستشفى مانهايم الجامعي والمعهد المركزي للصحة العقلية ، ومعهد ماكس بلانك للبحوث الطبية. علاوة على ذلك ، فإننا نقدر الدعم من خلال معهد DKFZ Hector للسرطان في المركز الطبي الجامعي في مانهايم. بالنسبة لرسوم النشر ، نقر بالدعم المالي من Deutsche Forschungsgemeinschaft ضمن برنامج التمويل "Open Access Publikationskoste" وكذلك من قبل جامعة هايدلبرغ.
Materials
| Name | Company | Catalog Number | Comments |
| Ambu Spur II Single-Use ventilation bag for neonates | Meier Medizintechnik | 335 102 000 | Ventilation bag |
| BD Microlance 3 cannula 20 G | BD (Beckton, Dickinson) | 301300 | Cannula |
| BD Microlance Discardit II 20 mL Syringe | BD (Beckton, Dickinson) | 300296 | Plastic syringe |
| Fixation rods | Legefirm | 500343896 | Tuning forks used as y-shaped metal fixation rods |
| Heat-shrinking tube | Sekesoer | RSG-400 | Heat-shrinking tube |
| Intravenous catheter | BD (Beckton, Dickinson) | 393230 | BD Venflon Pro Safety intravenous catheter 14 G; shortened using scissors; alternatively 16 G or 18 G can be used |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | Connecting tube COEX 150 cm |
| Polyfilament suture | COVIDIEN | CL331 | Polyfilament surgical suture recommended with a strength of 1 to 2; needle can be removed |
| Royal Gardineer Heating Pad Size S, 20 Watt | Royal Gardineer | IP67 | Heating pad |
| Seldinger guide wire | VYGON | 115.798 | Metal guide wire from the arterial leadercath set |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | Silicone vessel loop tie 2.5 mm red |
| Spraque Dawley rats | Janvier Labs | Male rats weighing 400 grams | |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
References
- Czigany, Z., et al. Limb remote ischemic conditioning of the recipient protects the liver in a rat model of arterialized orthotopic liver transplantation. PLoS One. 13 (4), e0195507 (2018).
- Czigány, Z., et al. Improving research practice in rat orthotopic and partial orthotopic liver transplantation: A review, recommendation, and publication guide. Eur Surg Res. 55 (1-2), 119-138 (2015).
- Nagai, K., Yagi, S., Uemoto, S., Tolba, R. H. Surgical procedures for a rat model of partial orthotopic liver transplantation with hepatic arterial reconstruction. J Vis Exp. 73, e4376 (2013).
- Jahshan, F., et al. A novel rat model for assessment of laryngotracheal injury following transoral intubation. Int J Pediatr Otorhinolaryngol. 113, 4-10 (2018).
- Lamoureux, L., Radhakrishnan, J., Gazmuri, R. J. A rat model of ventricular fibrillation and resuscitation by conventional closed-chest technique. J Vis Exp. 98, 52413 (2015).
- Wang, Z., et al. Autoinducer-2 of streptococcus mitis as a target molecule to inhibit pathogenic multi-species biofilm formation in vitro and in an endotracheal intubation rat model. Front Microbiol. 7, 88 (2016).
- Jahshan, F., et al. A novel rat model for tracheal mucosal damage assessment of following long term intubation. Int J Pediatr Otorhinolaryngol. 128, 109738 (2020).
- Rivard, A. L., et al. Rat intubation and ventilation for surgical research. J Invest Surg. 19 (4), 267-274 (2006).
- Na, N., Zhao, D. Q., Huang, Z. Y., Hong, L. Q. An improved method for rat intubation and thymectomy. Chin Med J (Engl). 124 (17), 2723-2727 (2011).
- Cicero, L., Fazzotta, S., Palumbo, V. D., Cassata, G., Lo Monte, A. I. Anesthesia protocols in laboratory animals used for scientific purposes. Acta Biomed. 89 (3), 337-342 (2018).
- Fuentes, J. M., et al. Videoendoscopic endotracheal intubation in the rat: A comprehensive rodent model of laparoscopic surgery. J Surg Res. 122 (2), 240-248 (2004).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Lazopoulos, A., et al. Open thoracotomy for pneumothorax. J Thorac Dis. 7 (S1), S50-S55 (2015).
- Rendell, V. R., Giamberardino, C., Li, J., Markert, M. L., Brennan, T. V. Complete thymectomy in adult rats with non-invasive endotracheal intubation. J Vis Exp. 94, 52152 (2014).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. 86, 50269 (2014).
- Nelson, A. M., Nolan, K. E., Davis, I. C. Repeated orotracheal intubation in mice. J Vis Exp. 157, 60844 (2020).
- Das, S., Macdonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. 73, e50318 (2013).
- Massick, D. D., et al. Quantification of the learning curve for percutaneous dilatational tracheotomy. Laryngoscope. 110 (2 Pt 1), 222-228 (2000).
- Giugliano, G., et al. Learning curve for translaryngeal tracheotomy in head and neck surgery. Laryngoscope. 111 (4 Pt 1), 628-633 (2001).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesth Analg. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Ann Emerg Med. 60 (6), 749-754.e742 (2012).
- Titu, I. M., Delaca, G. B., Teterea, F., Ciulic, S. A., Palade, E. Percutaneous tracheostomy using the Seldinger technique. Multimed Man Cardiothorac Surg. 2023, (2023).
- Garry, B. P., Bivens, H. E. The Seldinger technique. J Cardiothorac Anesth. 2 (3), 403 (1988).
- Carbone, L. Estimating mouse and rat use in American laboratories by extrapolation from animal welfare act-regulated species. Sci Rep. 11 (1), 493 (2021).
- Su, C. S., et al. Efficacious and safe orotracheal intubation for laboratory mice using slim torqueable guidewire-based technique: Comparisons between a modified and a conventional method. BMC Anesthesiol. 16, 5 (2016).
- Clary, E. M., O'halloran, E. K., De La Fuente, S. G., Eubanks, S. Videoendoscopic endotracheal intubation of the rat. Lab Anim. 38 (2), 158-161 (2004).
- Ghali, M. G. Z. Microsurgical technique for tracheostomy in the rat. MethodsX. 5, 61-67 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved