Method Article
Endotracheale Intubation mittels Tracheotomie und anschließender Thorakotomie bei Ratten für Anwendungen ohne Überleben
In diesem Artikel
Zusammenfassung
Hier stellen wir ein standardisiertes Verfahren für die endotracheale Intubation mittels Tracheotomie gefolgt von einer Thorakotomie bei Ratten vor, das darauf abzielt, die Präzision und Reproduzierbarkeit von Nicht-Überlebensanwendungen zu verbessern, die eine invasive Beatmung und Exposition von Thoraxorganen in in vivo Rattenmodellen erfordern.
Zusammenfassung
Die endotracheale Intubation und die anschließende Beatmung sind oft Grundvoraussetzungen für die translationale Forschung in Rattenmodellen für verschiedene Eingriffe, die kontrollierte oder hohe Beatmungsdrücke oder den Zugang zur Brusthöhle und zu den Organen erfordern. Die konventionelle endoorotracheale Intubation über den anatomisch vorhandenen Weg durch den Mund eignet sich gut für Überlebensexperimente. Dieses Verfahren bringt jedoch einige Herausforderungen mit sich, darunter im Allgemeinen ein höheres Maß an erforderlicher Erfahrung und technischem Können, fortschrittlichere Geräte und einen größeren Zeitaufwand mit relevanten Intubationsversagensraten und Komplikationen wie Trachealperforation, vorübergehender systemischer Hypooxygenierung und relevanter Leckage aus der Luft.
Dieses Manuskript stellt daher ein detailliertes Schritt-für-Schritt-Protokoll für die endotracheale Intubation durch Tracheotomie in Rattenmodellen ohne Überleben vor, wenn ein garantierter Intubationserfolg, konstante Sauerstoffversorgung, hohe Beatmungsdrücke oder eine offene Thorakotomie erforderlich sind.
Das Protokoll betont die Bedeutung einer sorgfältigen Operationstechnik, um konsistente und zuverlässige Ergebnisse zu gewährleisten, insbesondere für Forscher, die unerfahren sind oder keine Routine in der Technik der endoorotrachealen Intubation über die direkte Laryngoskopie haben. Dieses Verfahren soll daher das Leiden der Tiere und unnötige Tierverluste minimieren.
Einleitung
Im Allgemeinen sind Nagetiere in der Lage, Atemnot viel länger auszugleichen als Patienten. Sie können unter Spontanbeatmung viel länger und bei invasiveren Eingriffen kardiovaskulatorisch stabil und ausreichend bleiben, z. B. auch bei einer Lebertransplantation, die bekanntermaßen zu den belastendsten Verfahren für den Herz-Lungen-Kreislauf gehört 1,2,3.
Die endotracheale Intubation ist jedoch eine Grundvoraussetzung für die translationale Forschung in Rattenmodellen für verschiedene Umgebungen und Interventionen aus einer Vielzahl von biomedizinischen Bereichen und ist in der heutigen Wissenschaftslandschaft unerlässlich 4,5,6,7,8,9,10,11 . Während die Mehrzahl der experimentellen Labortierarbeiten, die an Ratten durchgeführt werden, im Allgemeinen immer noch keine invasive Beatmung erfordern12, gibt es bestimmte Versuchsanordnungen, die eine Intubation und kontrollierte Beatmungsunterstützung erfordern. Zu diesen Versuchsaufbauten gehören alle Experimente, die einen gesicherten Atemweg, hohe Beatmungsdrücke und Laparoskopie oder einen direkten Zugang zur Brusthöhle und zu den Organen erfordern.
Insbesondere bei einem erforderlichen Zugang zur Brusthöhle und zu den Organen ist eine endotracheale Intubation zwingend erforderlich, da der Kollaps der Lunge nach Verlust des Unterdrucks im intrapleuralen Raum und des Inspirationsmechanismus durch die Interkostalmuskulatur und das Zwerchfell zu einer tödlichen respiratorischen Insuffizienz führt13.
Während es viele Veröffentlichungen über Methoden zur nicht-invasiven endootrachealen Intubation bei Nagetieren gibt 14,15,16,17, scheint es einen Mangel an Verfahrensprotokollen für die invasive endotracheale Intubation durch Tracheotomie zu geben. Trotz der Invasivität der letzteren, die nur eine Anwendung in Nicht-Überlebenstiermodellen zulässt, gibt es große Vorteile der Intubation mittels Tracheotomie. Dazu gehören eine steilere Lernkurve, höhere und anhaltendere Erfolgsquoten, weniger benötigte technische Ausrüstung und verbesserte Möglichkeiten zur Erfolgskontrolle18,19.
Der Erfolg der Intubation ist entscheidend für das Ergebnis. Während verschiedene falsche Intubationen sowie wiederholte Intubationsversuche bei Patienten eindeutig mit unerwünschten Ereignissen und Komplikationen verbunden sind, die so schwerwiegend wie der Tod sind20,21, sind solche Ereignisse auch bei Versuchstieren schädlich. Im besten Fall stellen sie eine starke Störvariable im Versuch dar, können aber auch zum unnötigen Verlust des Tieres führen. Daher ist es sinnvoll, die Intubationserfolgsraten auf Kosten der Nicht-Invasivität zu erhöhen, wenn der Versuchsaufbau und die Strategie dies zulassen.
Dieses standardisierte Protokoll der Intubation über chirurgische Tracheotomie bietet mehrere Vorteile, darunter eine geringere Variabilität der Intubationserfolgsraten, minimierte Auswirkungen auf die kardiorespiratorischen physiologischen Parameter und eine vollständige Kontrolle und Manipulation der Parameter. Es hilft bei der Bereitstellung eines gesicherten Atemwegs, insbesondere für unerfahrene Forscher im Verfahren der endotrachealen Intubation durch direkte Laryngoskopie, und ermöglicht es Forschern, Nicht-Überlebensstudien unter streng kontrollierten Bedingungen durchzuführen. Wir beleuchten wichtige anatomische Meilensteine und geben Einblicke in die Fehlerbehebung bei häufigen Herausforderungen, die während des Eingriffs auftreten.
Protokoll
Alle hier beschriebenen Tieraktivitäten wurden vom Institutional Animal Care and Use Committee (IACUC) des Regierungspräsidiums Baden-Württemberg in Karlsruhe genehmigt. Die Versuchstiere wurden nach institutionellen Standards und nach den deutschen Gesetzen zur Verwendung und Pflege von Tieren und gemäß den Richtlinien des Rates der Europäischen Gemeinschaft (2010/63/EU) sowie den ANARRIVE-Richtlinien gehalten und in akkreditierten Einrichtungen durchgeführt. Zum Einsatz kamen männliche Spraque Dawley Ratten von Janvier Labs mit einem Bestellgewicht von 400 g.
1. Vorbereitung des Eingriffs (Abbildung 1)
- Bereiten Sie die chirurgischen Präparationshaken vor, indem Sie die Kanülen in einem Winkel von 135° in einem Abstand von 1 cm zur Spitze falten, sie über einen Luer-Lock mit Kunststoff-Perfusionsschläuchen verbinden und mit einer chirurgischen Moskitoklemme Spannung ausüben (Abbildung 1A,B).
- Bereiten Sie ein chirurgisches Expositionsgerät für Nagetiere vor.
HINWEIS: Neben der Verfügbarkeit kommerzieller Plattformen können diese auch leicht und kostengünstig selbst gebaut werden, wie in dieser Studie.- Verwenden Sie dazu eine 40 cm x 50 cm große Stahlplatte mit einer Dicke von 4 mm. Erzeugen Sie mit einem Stahlbohrer an der gewünschten Stelle mehrere 8 mm Löcher für nachfolgende Spannpunkte. Platzieren Sie die Y-förmigen Befestigungsstäbe an diesen Stellen.
- Legen Sie ein Heizkissen auf die Stahlplatte des chirurgischen Expositionsgeräts, um eine thermische Unterstützung zu gewährleisten.
- Bereiten Sie die chirurgischen Vorbereitungshaken mit beigefügten Kunststoffschläuchen und chirurgischen Moskitoklemmen vor, um später das Gewebe für die chirurgische Exposition zu spannen.
- Entfernen Sie den Stopfen einer 10-ml-Kunststoffspritze mit einem männlichen Luer-Lock-Ende und schneiden Sie das proximale Ende der Spritze ab. Führen Sie den distalen Teil wie abgebildet in den Beatmungsbeutel ein und verschließen Sie ihn luftdicht, indem Sie ihn mit einem Schrumpfschlauch abdecken und mit einem Laborbrenner sanfter Hitze anwenden (Abbildung 1D-F).
- Kürzen und fasen Sie intravenöse Katheter unterschiedlich groß ab und führen Sie einen Führungsdraht aus einem arteriellen Leader-Katheter-Set mit dem flexiblen Drahtende an der Spitze in die für die jeweilige Tiergröße am besten geeignete Kathetergröße (vermutlich 14 G) für die anschließende Seldinger-Technik22,23 während der Intubation ein (Abbildung 1G,H).
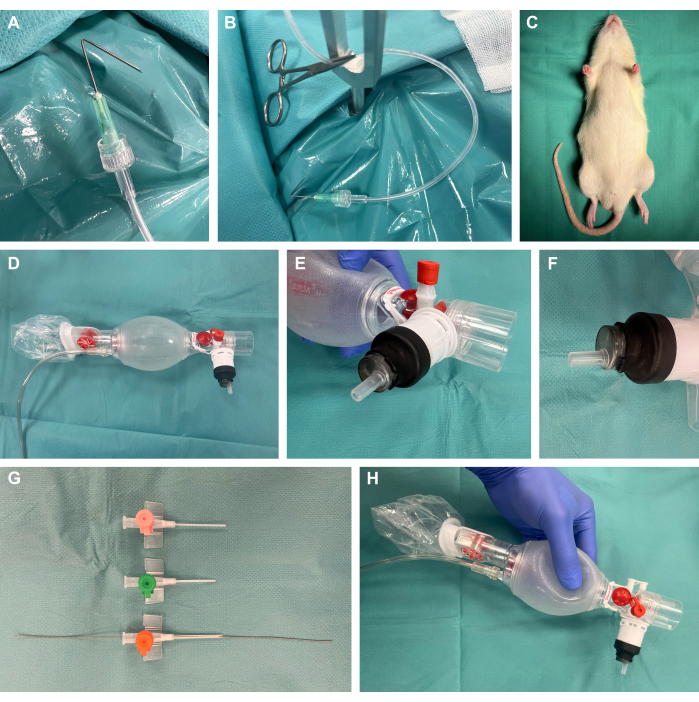
Abbildung 1: Versuchsaufbau. (A) Eine gefaltete Kanüle, die mit einem Perfusionsschlauch verbunden ist und als chirurgischer Vorbereitungshaken verwendet wird. (B) Präparationshaken mit Klemme, die in einer Befestigungsstange aus Metall positioniert ist. (C) Das Tier wurde vor der Intervention sediert. (D) Beatmungsbeutel aus der Neonatologie. (E-F) Die luftdichte Befestigung einer Luer-Lock-Spritze auf dem Beatmungsbeutel erfolgt mit einem Schrumpfschlauch. (G) Verkürzte und abgeschrägte intravenöse Katheter in verschiedenen Größen mit einem Führungsdraht aus einem arteriellen Leader-Katheter-Set für die Seldinger-Technik. (H) Endgültige Sonderanfertigung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Anästhesie und Analgesie
- Betäuben Sie die Ratte mit dem Medikament Ihrer Wahl.
HINWEIS: Hier wurden Anästhesie und Analgesie mit Ketamin 10% (100 mg/ml), Xylazin 2% (20 mg/ml), Carprofen 50 mg/ml und Isofluran etabliert. Eine 1:10-Verdünnung von Xylazin und Carprofen wurde als Stammlösungen für die Anwendung verwendet.- Induzieren Sie die Anästhesie, indem Sie das Tier mit einem Verdampfer in eine mit 100 % Sauerstoff geflutete Induktionsbox mit einer Zuflussrate von 5 l/min, ergänzt durch 4 % (v) Isofluran, legen.
- Nachdem die Bewusstlosigkeit erreicht wurde, nehmen Sie das Tier aus der Induktionsbox und injizieren Sie ihm 100 mg/kg Ketamin und 4 mg/kg Xylazin (i.p.).
HINWEIS: Dies entspricht 40 mg Ketamin (0,4 mL der Originallösung) und 1,6 mg Xylazin (0,08 mL der Originallösung oder 0,8 mL der 1:10-Lösung) für ein Tier mit 400 mg. - Setzen Sie das Tier wieder in die mit Isofluran überflutete Induktionsbox, bis die Wirkung der i.p.-Injektion einsetzt.
- Garantieren Sie die richtige Narkosetiefe, indem Sie testen, ob die Ratte nicht auf ein festes Einklemmen der Zehe reagiert.
- Tragen Sie eine Augensalbe auf die Augen auf.
- Beurteilen und erhalten Sie die Narkosetiefe während der Operation.
- Wenn die narkotische Wirkung im Laufe der Zeit (etwa stündlich) nachlässt, injizieren Sie dem Tier zusätzlich 50 mg/kg Ketamin und 1 mg/kg Xylazin pro Körpergewicht. Dies entspricht 20 mg Ketamin (0,2 mL der Originallösung) und 0,4 mg Xylazin (0,2 mL der 1:10-Lösung) für ein 400 mg Tier.
- Führen Sie vor der Thorakotomie eine zusätzliche Analgesie mit einer s.c.-Injektion von 5 mg/kg Carprofen mit Körpergewicht durch. Dies entspricht 2 mg Carprofen (0,04 mL der Originallösung oder 0,4 mL der 1:10-Lösung) für ein Tier mit 400 mg.
3. Chirurgische Vorbereitung (Abbildung 2)
- Sättigen Sie den Tierkreislauf mit Sauerstoff, indem Sie eine Inhalation von 100 % Sauerstoff über eine transnasale Neugeborenenmaske anbieten (Abbildung 2A).
- Wechseln Sie nach 5 Minuten von der transnasalen Neugeborenenmaske zur Konstruktion eines Neugeborenen-Beatmungsbeutels mit einer Luer-Lock-Spitze aus Kunststoffspritze für Männer, wie oben beschrieben, und bieten Sie Sauerstoff im Überlauf an, wobei die Spritzenspitze nahe der Nasenspitze des Tieres liegt (Abbildung 2B).
- Führen Sie einen medianen thorakozervikalen Hautschnitt über die gewünschte Länge durch und legen Sie den chirurgischen Situs mit den chirurgischen Präparationshaken frei (Abbildung 2C,D).
- Treiben Sie die Präparation durch stumpfe Dissektion mit einer feinen Schere durch die Halsfaszie voran. Legen Sie den M. sternocleidomastoideus und den Musculus infrahyoidalis frei und lateralisieren Sie den Musculus infrahyoidalis medianus nach rechts nach der Dissektion der linken lateralen Membran (Abbildung 2E-G).
- Führen Sie eine stumpfe Dissektion in Richtung der Luftröhre und eine Tunnelung der Luftröhre mit Overholt-Klemmen durch (Abbildung 2H-I).
- Die Luftröhre wird mit einer Silikongefäßschlaufe umschlingt und die distale Luftröhre mit einer polyfilen Naht für die spätere Fixierung der endotrachealen Kanüle doppelt geschlingen (Abbildung 2J-N).

Abbildung 2: Vorbereitung der Luftröhre. (A) Inhalation von Sauerstoff über eine Maske. (B) Wechseln Sie von der Maske zur männlichen Luer-Lock-Spritze für die Sauerstoffanwendung. (C) Thorakzervikaler Hautschnitt. (D) Präparation durch die Halsfaszie. (E) Freilegung des Musculus sternocleidomastoideus und des Musculus infrahyoidalis. (F) Lateralisation des Musculus infrahyoidalis medianus. (G) Stumpfe Dissektion in Richtung Luftröhre. (H) Tunnelung der Luftröhre mit Hilfe von Overholt-Klemmen. (I) Schleudern der Luftröhre mit einer Silikongefäßschlaufe. (J-N) Kaudale Doppelschlinge der Luftröhre mit einer Polyfilamentnaht zur späteren Fixierung der endotrachealen Kanüle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Ablauf der Intubation (Abbildung 3)
- Verlängern Sie die Luftröhre kaudal mit einer atraumatischen Zange (Abbildung 3A,B).
- Führen Sie mit einer Schere einen Teilschnitt der Luftröhre von 180° Umfang durch (Abbildung 3C-F).
- Führen Sie einen Seldinger-Führungsdraht mit dem flexiblen Ende in die Luftröhre ein (Abbildung 3G-H) und führen Sie anschließend den modifizierten intravenösen Katheter mit entsprechendem Umfang in die Luftröhre ein, geführt durch den Seldinger-Draht (Abbildung 3I-N).
- Entfernen Sie den Seldinger-Draht (Abbildung 3O), verbinden Sie die Luer-Lock-Spitze des Trachealkatheters mit dem modifizierten Beatmungsbeutel und beginnen Sie mit der sanften lungenschonenden manuellen Beatmung mit hoher Frequenz und geringem Atemzugvolumen (Abbildung 3P). Führen Sie eine manuelle Beatmung durch, solange keine mediane Thorakotomie durchgeführt wurde und die Lunge nicht sichtbar ist.
- Binden Sie die zuvor platzierte Verriegelungsnaht mit einem Gleitknoten, um Leckagen aus der Luft und eine versehentliche Entfernung des Katheters zu vermeiden (Abbildung 3Q-T).

Abbildung 3: Endotracheale Intubation mittels Tracheotomie. (A) Ausgangssituation nach der Präparation. (B) Kaudale Verlängerung der Luftröhre mit einer atraumatischen Zange. (C-F) Teilweiser Schnitt der Luftröhre mit einem Umfang von 180°. (G,H) Einbringen eines Seldinger-Führungsdrahtes in die Luftröhre. (I-M) Einführung des modifizierten intravenösen Katheters in die Luftröhre geführt durch den Seldinger-Draht. (N-O) Entfernen des Seldinger-Drahtes. (P) Luer-Lock-Verbindung des Trachealkatheters mit dem modifizierten Beatmungsbeutel. (Q-T) Binden der zuvor platzierten Verriegelungsnaht, um eine versehentliche Entfernung des Katheters zu vermeiden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Manuelle Beatmung und mediane Thorakotomie (Abbildung 4)
- Beginnen Sie die mediane Thorakotomie am Xiphoid mit einer stumpfen und stabilen Materialschere (Abbildung 4A,B) und setzen Sie sie kranial durch das Brustbein fort. Pausieren Sie die Beatmung immer für einige Sekunden, wenn Sie mit der Schere substernal vorrücken und schneiden, um ein Trauma der Lunge zu vermeiden (Abbildung 4C-E).
- Die Thoraxfreilegung erfolgt mit chirurgischen Präparationshaken und die Entfernung der mediastinalen Serosalmembranen (Abbildung 4F-H).
- Die manuelle Beatmung mit der gewünschten Häufigkeit und dem gewünschten Atemzugvolumen fortsetzen und das Monitoring erweitern (z. B. Etablierung einer intraarteriellen Blutdruckmessung, Anlage eines zentralen venösen oder pulmonalarteriellen Katheters je nach Zweck oder jeweiliger Forschungsfragestellung) (Abbildung 4I-L).

Abbildung 4: Manuelle Beatmung und mediane Thorakotomie. (A) Ausgangssituation nach Intubation. (B-E) Mediane Thorakotomie ausgehend vom Xiphoid. (F-I) Thoraxfreilegung mit chirurgischen Präparationshaken. (J) Endeinrichtung während der Beatmung. (K-L) der Prozess der manuellen Beatmung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
6. Euthanasie
- Erreichen Sie Euthanasie durch abrupte scharfe Kardiektomie mit einer Schere bei dem tief betäubten Tier.
Ergebnisse
Eine endotracheale Intubation mittels Tracheotomie und anschließender Thorakotomie wurde bei 10 männlichen Ratten (Durchschnittsgewicht 405 ± 30 g) für Nicht-Überlebensanwendungen durchgeführt. Der Eingriff wurde von einem chirurgischen Assistenzarzt im zweiten Jahr durchgeführt. Die Erfolgsrate, die durch das Überleben über 20 Minuten Intubation und Beatmung definiert wurde, betrug 100%. Die mittlere Dauer der Präparation und des Intubationsverfahrens von der Hautinzision bis zur Fixierung des Intubationsschlauchs betrug 6:55 ± 0:53 min (Tabelle 1).
| Anzahl der verwendeten Tiere | 10 |
| Körpergewicht (Mittelwert und Standardabweichung) | 405 ± 30 g |
| Erfolgsquote bei der Intubation | 100% |
| Dauer des Eingriffs (Mittelwert und Standardabweichung) | 6:55 ± 0:53 min |
| Mittlere Sauerstoffsättigung | 96% |
| Minimale Sauerstoffsättigung | 92% |
Tabelle 1: Repräsentative Ergebnisse. Repräsentative Ergebnisse des Protokolls an 10 Tieren.
Die Sättigung wurde durch eine Einweg-Selbststick-Pulsoximetrie-Sonde am Hinterbein überwacht und fiel nie unter 92 %. Die Spontanbeatmung wurde bis zur Inzision des Zwerchfells eingedämmt. Alle Ratten überlebten die für die experimentellen Messungen erforderlichen 20 Minuten bis zur absichtlichen Euthanasie durch abrupte scharfe Kardiektomie (Abbildung 5).

Abbildung 5: Periphere Sauerstoffsättigung. Periphere Sauerstoffsättigung, gemessen über die gesamte Dauer dieses Verfahrens. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Allein in den USA werden pro Jahr etwa 110 Millionen Ratten und Mäuse in Tierversuchen eingesetzt24. Es gibt zwar keine verlässlichen Statistiken, aber ein relevanter Prozentsatz von ihnen wird eine unterstützte Beatmung erhalten, insbesondere in den Bereichen der Lungen- und Herzforschung sowie der Anästhesiologie. Die meisten dieser Tiere erhalten eine nicht-invasive endoorotracheale Intubation, die eine Reihe von Herausforderungen mit sich bringt. Dazu gehören langsamere Lernkurven, höhere Raten von Intubationsversagen, eine größere Anzahl von Reintubationen und damit verbundene respiratorische Komplikationen sowie Atemwegsleckagen25. Eine nicht-invasive Intubation erfordert daher in der Regel erfahreneres Forschungspersonal, fortschrittlichere Technologien wie Faseroptik, Kapnometrie und mechanische Beatmungsgeräte sowie größere finanzielle und materielle Ressourcen26. Der gesamte Aspekt der Intubation ist daher ein bedeutender Störfaktor, der für die nachfolgende statistische Analyse und die interindividuelle Heterogenität der Ergebnisse relevant ist. Die nicht-invasive endoorotracheale Intubation ist jedoch oft die einzige praktikable Option in longitudinalen Versuchsdesigns.
Alternativen sind die Tracheotomie für den erforderlichen langfristigen Trachealzugang in longitudinalen Experimenten oder die chirurgische Tracheotomie für den "Einmalgebrauch" in Nicht-Überlebensexperimenten. Während Protokolle zur mikrochirurgischen Technik für die Tracheotomie bei Ratten verfügbar sind27, gibt es derzeit keine Protokolle für die endotracheale Intubation mittels Tracheotomie in Rattenmodellen, die nicht überleben.
Das hier beschriebene standardisierte Verfahren zur endotrachealen Intubation mittels Tracheotomie und anschließender Thorakotomie bei Ratten stellt daher eine wertvolle Methode für Forscher dar, die sich mit Nicht-Überlebensstudien beschäftigen. Dieses Verfahren erfordert weder Fachpersonal noch eine umfangreiche Schulung. Sie hat eine Intubationserfolgsrate, die viel höher ist als die endoorotracheale Intubation und ermöglicht viel kontrolliertere Verfahrensschritte.
Zu den Einschränkungen der vorgestellten Techniken gehören vor allem die Invasivität des Verfahrens und damit die ausschließliche Kompatibilität mit Nicht-Survival-Experimenten. Aufgrund der großen Defekte an Haut und Weichgewebe sowie der Schnittluftfistel sind eine Extubation und Genesung von diesem Eingriff weder durchführbar noch zu empfehlen, insbesondere in Kombination mit einer Thorakotomie.
Bei der Behebung häufiger Herausforderungen, die während des Eingriffs auftreten, möchten wir auf die folgenden Punkte und Empfehlungen aufmerksam machen: Man sollte Geräte und Medikamente so umfassend wie möglich vorbereiten. Der Experimentator sollte die hämostatische Kontrolle durch feine Vorbereitung und mit nicht-traumatischen Wattestäbchen sorgfältig durchführen. Der Experimentator sollte die Luftröhre über eine Länge von mindestens 0,5 cm präparieren, um eine ausreichende Beweglichkeit zu ermöglichen, und die Silikongefäßschlaufe verwenden, um die Luftröhre nach der Inzision nicht zu verlieren, da dies zu einer Aspiration und Erstickung führen kann, wenn die Luftröhre aufgrund des Hintergrundphänomens in der Gewebetiefe verloren geht. Die Luftröhre mit einem deutlichen Scherenstrich nur teilweise einschneiden. Idealerweise sollte man einen Umfang von 180° einschneiden. Darunter kann dies dazu führen, dass die Intubation fehlschlägt. Darüber hinaus kann es zu einem Einreißen der Luftröhre mit Rückzug beider Enden in die Tiefe des Gewebes und anschließender Erstickung kommen. Beim Binden des polyfilen Nahtmaterials zur Sicherung des Intubationsschlauchs sollte ein Gleitknoten verwendet werden, um eine ausreichende Dichtheit zu gewährleisten, um ein Austreten von Luft oder eine versehentliche Luxation des Schlauchs zu vermeiden und gleichzeitig ein unbeabsichtigtes Schließen des Schlauchs zu vermeiden. Wenn Sie den Seldinger-Draht während des Nähens an Ort und Stelle belassen, kann ein unbeabsichtigter Verschluss vermieden werden. Bei der manuellen Beatmung mit dem Beatmungsbeutel sollte ein Barotrauma der Lunge durch hohe Tidalvolumina strikt vermieden werden. Stattdessen sollte eine lungenprotektive, hochfrequente und tidale Beatmung angestrebt werden, insbesondere wenn keine Thorakotomie durchgeführt wurde und das Lungenvolumen nicht visuell beurteilt werden kann.
Durch das Angebot einer detaillierten und reproduzierbaren Methodik erleichtert dieses Protokoll die Standardisierung experimenteller Verfahren und verbessert die Zuverlässigkeit der Daten und die Vergleichbarkeit zwischen Studien. Damit trägt diese Methode zur Verfeinerung wissenschaftlicher Techniken in der präklinischen Forschung bei und erhöht letztlich die translationale Relevanz von Erkenntnissen aus den Bereichen Physiologie, Pharmakologie, Chirurgie und Biomedizin.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Autorinnen und Autoren danken dem Datenspeicherungsdienst, der vom Ministerium für Wissenschaft, Forschung und Kunst Baden-Württemberg (MWK) und der Deutschen Forschungsgemeinschaft (DFG) durch die Zuwendungen INST 35/1314-1 FUGG und INST 35/1503-1 FUGG unterstützt SDS@hd. Darüber hinaus bedanken sich die Autoren für die Unterstützung durch das NCT (Nationales Centrum für Tumorerkrankungen in Heidelberg, Deutschland) durch sein strukturiertes Postdoc-Programm und das Programm Chirurgische Onkologie. Wir würdigen auch die vom Landtag Baden-Württemberg bewilligte Unterstützung aus Landesmitteln für den Innovationscampus Health + Life Science Allianz Heidelberg Mannheim aus dem strukturierten Postdoc-Programm für Alexander Studier-Fischer: Artificial Intelligence in Health (AIH) - Eine Kooperation von DKFZ, EMBL, Universität Heidelberg, Universitätsklinikum Heidelberg, Universitätsklinikum Mannheim, Zentralinstitut für Seelische Gesundheit, und das Max-Planck-Institut für medizinische Forschung. Des Weiteren bedanken wir uns für die Unterstützung durch das DKFZ Hector Krebsinstitut am Universitätsklinikum Mannheim. Für die Publikationsgebühr danken wir der Deutschen Forschungsgemeinschaft im Rahmen des Förderprogramms "Open Access Publikationskoste" sowie der Universität Heidelberg für die finanzielle Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Ambu Spur II Single-Use ventilation bag for neonates | Meier Medizintechnik | 335 102 000 | Ventilation bag |
| BD Microlance 3 cannula 20 G | BD (Beckton, Dickinson) | 301300 | Cannula |
| BD Microlance Discardit II 20 mL Syringe | BD (Beckton, Dickinson) | 300296 | Plastic syringe |
| Fixation rods | Legefirm | 500343896 | Tuning forks used as y-shaped metal fixation rods |
| Heat-shrinking tube | Sekesoer | RSG-400 | Heat-shrinking tube |
| Intravenous catheter | BD (Beckton, Dickinson) | 393230 | BD Venflon Pro Safety intravenous catheter 14 G; shortened using scissors; alternatively 16 G or 18 G can be used |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | Connecting tube COEX 150 cm |
| Polyfilament suture | COVIDIEN | CL331 | Polyfilament surgical suture recommended with a strength of 1 to 2; needle can be removed |
| Royal Gardineer Heating Pad Size S, 20 Watt | Royal Gardineer | IP67 | Heating pad |
| Seldinger guide wire | VYGON | 115.798 | Metal guide wire from the arterial leadercath set |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | Silicone vessel loop tie 2.5 mm red |
| Spraque Dawley rats | Janvier Labs | Male rats weighing 400 grams | |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
Referenzen
- Czigany, Z., et al. Limb remote ischemic conditioning of the recipient protects the liver in a rat model of arterialized orthotopic liver transplantation. PLoS One. 13 (4), e0195507 (2018).
- Czigány, Z., et al. Improving research practice in rat orthotopic and partial orthotopic liver transplantation: A review, recommendation, and publication guide. Eur Surg Res. 55 (1-2), 119-138 (2015).
- Nagai, K., Yagi, S., Uemoto, S., Tolba, R. H. Surgical procedures for a rat model of partial orthotopic liver transplantation with hepatic arterial reconstruction. J Vis Exp. 73, e4376 (2013).
- Jahshan, F., et al. A novel rat model for assessment of laryngotracheal injury following transoral intubation. Int J Pediatr Otorhinolaryngol. 113, 4-10 (2018).
- Lamoureux, L., Radhakrishnan, J., Gazmuri, R. J. A rat model of ventricular fibrillation and resuscitation by conventional closed-chest technique. J Vis Exp. 98, 52413 (2015).
- Wang, Z., et al. Autoinducer-2 of streptococcus mitis as a target molecule to inhibit pathogenic multi-species biofilm formation in vitro and in an endotracheal intubation rat model. Front Microbiol. 7, 88 (2016).
- Jahshan, F., et al. A novel rat model for tracheal mucosal damage assessment of following long term intubation. Int J Pediatr Otorhinolaryngol. 128, 109738 (2020).
- Rivard, A. L., et al. Rat intubation and ventilation for surgical research. J Invest Surg. 19 (4), 267-274 (2006).
- Na, N., Zhao, D. Q., Huang, Z. Y., Hong, L. Q. An improved method for rat intubation and thymectomy. Chin Med J (Engl). 124 (17), 2723-2727 (2011).
- Cicero, L., Fazzotta, S., Palumbo, V. D., Cassata, G., Lo Monte, A. I. Anesthesia protocols in laboratory animals used for scientific purposes. Acta Biomed. 89 (3), 337-342 (2018).
- Fuentes, J. M., et al. Videoendoscopic endotracheal intubation in the rat: A comprehensive rodent model of laparoscopic surgery. J Surg Res. 122 (2), 240-248 (2004).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Lazopoulos, A., et al. Open thoracotomy for pneumothorax. J Thorac Dis. 7 (S1), S50-S55 (2015).
- Rendell, V. R., Giamberardino, C., Li, J., Markert, M. L., Brennan, T. V. Complete thymectomy in adult rats with non-invasive endotracheal intubation. J Vis Exp. 94, 52152 (2014).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. 86, 50269 (2014).
- Nelson, A. M., Nolan, K. E., Davis, I. C. Repeated orotracheal intubation in mice. J Vis Exp. 157, 60844 (2020).
- Das, S., Macdonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. 73, e50318 (2013).
- Massick, D. D., et al. Quantification of the learning curve for percutaneous dilatational tracheotomy. Laryngoscope. 110 (2 Pt 1), 222-228 (2000).
- Giugliano, G., et al. Learning curve for translaryngeal tracheotomy in head and neck surgery. Laryngoscope. 111 (4 Pt 1), 628-633 (2001).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesth Analg. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Ann Emerg Med. 60 (6), 749-754.e742 (2012).
- Titu, I. M., Delaca, G. B., Teterea, F., Ciulic, S. A., Palade, E. Percutaneous tracheostomy using the Seldinger technique. Multimed Man Cardiothorac Surg. 2023, (2023).
- Garry, B. P., Bivens, H. E. The Seldinger technique. J Cardiothorac Anesth. 2 (3), 403 (1988).
- Carbone, L. Estimating mouse and rat use in American laboratories by extrapolation from animal welfare act-regulated species. Sci Rep. 11 (1), 493 (2021).
- Su, C. S., et al. Efficacious and safe orotracheal intubation for laboratory mice using slim torqueable guidewire-based technique: Comparisons between a modified and a conventional method. BMC Anesthesiol. 16, 5 (2016).
- Clary, E. M., O'halloran, E. K., De La Fuente, S. G., Eubanks, S. Videoendoscopic endotracheal intubation of the rat. Lab Anim. 38 (2), 158-161 (2004).
- Ghali, M. G. Z. Microsurgical technique for tracheostomy in the rat. MethodsX. 5, 61-67 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten