Method Article
Hayatta kalamayan uygulamalar için sıçanlarda trakeotomi ile endotrakeal entübasyon ve ardından torakotomi
Bu Makalede
Özet
Burada, invaziv ventilasyon ve torasik organların in vivo sıçan modellerinde maruziyeti gerektiren sağkalım dışı uygulamaların hassasiyetini ve tekrarlanabilirliğini artırmayı amaçlayan, sıçanlarda trakeotomi yoluyla endotrakeal entübasyon ve ardından torakotomi için standart bir prosedür sunuyoruz.
Özet
Endotrakeal entübasyon ve müteakip ventilasyon, kontrollü veya yüksek ventilasyon basınçları veya torasik boşluk ve organlara erişim gerektiren çeşitli müdahaleler için sıçan modellerinde translasyonel araştırmalar için genellikle temel gereksinimlerdir. Konvansiyonel endoorotrakeal entübasyon, anatomik olarak ağızdan geçen yolu kullanarak sağkalım deneyleri için çok uygundur. Bununla birlikte, bu prosedür, genellikle gerekli deneyim ve teknik becerinin daha yüksek seviyeleri, daha gelişmiş ekipman ve ilgili entübasyon başarısızlık oranları ve trakeal perforasyon, geçici sistemik hipooksijenasyon ve ilgili hava sızıntısı gibi komplikasyonlarla daha fazla zaman çabası dahil olmak üzere bazı zorluklar ortaya çıkarmaktadır.
Bu nedenle, bu makale, garantili entübasyon başarısı, sabit oksijenasyon seviyeleri, yüksek ventilasyon basınçları veya açık torakotomi gerektiğinde hayatta kalamayan sıçan modellerinde trakeotomi yoluyla endotrakeal entübasyon için ayrıntılı bir adım adım protokol sunmaktadır.
Protokol, özellikle doğrudan laringoskopi ile endoorotrakeal entübasyon tekniğinde deneyimsiz veya rutin olmayan araştırmacılar için tutarlı ve güvenilir sonuçlar sağlamak için titiz cerrahi tekniğin önemini vurgulamaktadır. Bu nedenle, bu prosedürün hayvanların çektiği acıları ve gereksiz hayvan kayıplarını en aza indirmesi beklenmektedir.
Giriş
Genel olarak, kemirgenler solunum sıkıntısını hastalardan çok daha uzun süre telafi edebilir. Spontan ventilasyon altında çok daha uzun süre ve daha invaziv prosedürler sırasında, örneğin kardiyopulmoner dolaşım için en stresli prosedürlerden biri olduğu bilinen karaciğer nakli sırasında bile kardiyovasküler dolaşım stabil ve yeterli kalabilirler, 1,2,3.
Bununla birlikte, endotrakeal entübasyon, çeşitli biyomedikal alanlardan kaynaklanan çeşitli ortamlar ve müdahaleler için sıçan modellerinde translasyonel araştırmalar için temel bir gerekliliktir ve günümüzün bilimsel ortamında esastır 4,5,6,7,8,9,10,11 . Genel olarak sıçanlarda gerçekleştirilen deneysel laboratuvar hayvanı çalışmalarının çoğunluğu hala invaziv ventilasyon gerektirmesede 12, entübasyon ve kontrollü ventilasyon yardımı gerektiren bazı deney düzenekleri vardır. Bu deney düzenekleri, güvenli bir hava yolu, yüksek ventilasyon basınçları ve laparoskopi veya göğüs boşluğuna ve organlara doğrudan erişim gerektiren herhangi bir deneyi içerir.
Özellikle göğüs boşluğuna ve organlara erişim gerektiğinde, intraplevral boşluktaki negatif basınç ve interkostal kaslar ve diyaframın inspirasyon mekanizması kaybedildiğinde akciğerin çökmesi ölümcül bir solunum yetmezliğine yol açacağından endotrakeal entübasyon zorunludur13.
Kemirgenlerde non-invaziv endoorotrakeal entübasyon yöntemleri hakkında birçok yayın olmasına rağmen 14,15,16,17, trakeotomi ile invaziv endotrakeal entübasyon için prosedür protokolleri eksik görünmektedir. Sadece hayatta kalamayan hayvan modellerinde uygulamaya izin veren ikincisinin invazivliğine rağmen, trakeotomi yoluyla entübasyonun büyük avantajları vardır. Bunlar arasında daha dik bir öğrenme eğrisi, daha yüksek ve daha kalıcı başarı oranları, daha az gerekli teknik ekipman ve gelişmiş başarı izleme fırsatlarıyer alır 18,19.
Entübasyon başarısı sonuç için esastır. Hastalarda çeşitli yanlış entübasyonlar ve tekrarlanan entübasyon girişimleri, ölüm kadar ciddi advers olaylar ve komplikasyonlarla açıkça ilişkili olsa da20,21, bu tür olaylar test hayvanlarında da zararlıdır. En iyi durumda, deneyde güçlü bir karıştırıcı değişkeni temsil ederler, ancak aynı zamanda hayvanın gereksiz kaybına da yol açabilirler. Bu nedenle, deney düzeneği ve stratejisi izin veriyorsa, invaziv olmama pahasına entübasyon başarı oranlarını artırmak mantıklıdır.
Cerrahi trakeotomi ile bu standardize entübasyon protokolü, entübasyon başarı oranlarında azaltılmış değişkenlik, kardiyorespiratuar fizyoloji parametreleri üzerindeki etkilerin en aza indirilmesi ve parametrelerin tam araştırma kontrolü ve manipülasyonu dahil olmak üzere çeşitli avantajlar sunar. Özellikle doğrudan laringoskopi ile endotrakeal entübasyon prosedüründe deneyimsiz araştırmacılar için güvenli bir hava yolu sağlamaya yardımcı olur ve araştırmacıların yüksek kontrollü koşullarla hayatta kalmama çalışmaları yürütmelerine olanak tanır. Önemli anatomik işaretleri vurguluyor ve prosedür sırasında karşılaşılan yaygın zorlukların giderilmesine ilişkin içgörüler sağlıyoruz.
Protokol
Burada açıklanan tüm hayvan faaliyetleri, Almanya'nın Karlsruhe kentindeki Baden-Württemberg Bölge Konseyi'nin kurumsal hayvan bakımı ve kullanımı komitesi (IACUC) tarafından onaylanmıştır. Deney hayvanları, kurumsal standartlara ve Alman hayvan kullanımı ve bakımı yasalarına göre ve Avrupa Topluluk Konseyi direktiflerine (2010/63/EU) ve ARRIVE yönergelerine göre yönetildi ve akredite tesislerde gerçekleştirildi. Janvier Labs'tan 400 g sipariş ağırlığına sahip erkek Spraque Dawley sıçanları kullanıldı.
1. Prosedür hazırlığı (Şekil 1)
- Kanülleri uca 1 cm olacak şekilde 135° açıyla katlayarak, Luer-lock ile plastik perfüzyon tüplerine bağlayarak ve cerrahi sivrisinek kelepçesi kullanarak gerginlik uygulayarak cerrahi hazırlık kancaları hazırlayın (Şekil 1A,B).
- Bir kemirgen cerrahi maruz kalma aparatı hazırlayın.
NOT: Ticari platformların mevcudiyetinin yanı sıra, bunlar bu çalışmada olduğu gibi kolayca kendi kendine uygun maliyetli bir şekilde oluşturulabilir.- Bunun için 4 mm kalınlığında 40 cm x 50 cm çelik levha kullanın. Sonraki gergi noktaları için istenen yerde çelik bir matkap kullanarak birkaç 8 mm'lik delik oluşturun. Y şeklindeki sabitleme çubuklarını bu konumlara yerleştirin.
- Termal destek sağlamak için cerrahi maruz kalma cihazının çelik plakasının üzerine bir ısıtma yastığı yerleştirin.
- Daha sonra cerrahi maruziyet için dokuya gerginlik uygulamak için cerrahi hazırlık kancalarını takılı plastik tüpler ve cerrahi sivrisinek kelepçeleri ile hazırlayın.
- Erkek Luer-lock ucu olan 10 mL'lik plastik bir şırınganın tapasını çıkarın ve şırınganın proksimal ucunu kesin. Distal parçayı gösterildiği gibi ventilasyon torbasına yerleştirin ve ısıyla daralan bir tüp ile kaplayarak ve bir laboratuvar meşalesi kullanarak hafif ısı uygulayarak hava geçirmez şekilde kapatın (Şekil 1D-F).
- Farklı boyutlardaki intravenöz kateterleri kısaltın ve eğimlendirin ve entübasyon sırasında sonraki Seldinger tekniği22,23 için ilgili hayvan boyutuna (muhtemelen 14 G) en uygun kateter boyutuna (muhtemelen 14 G) bir arteriyel lider-kateter setinden bir kılavuz tel yerleştirin (Şekil 1G,H).
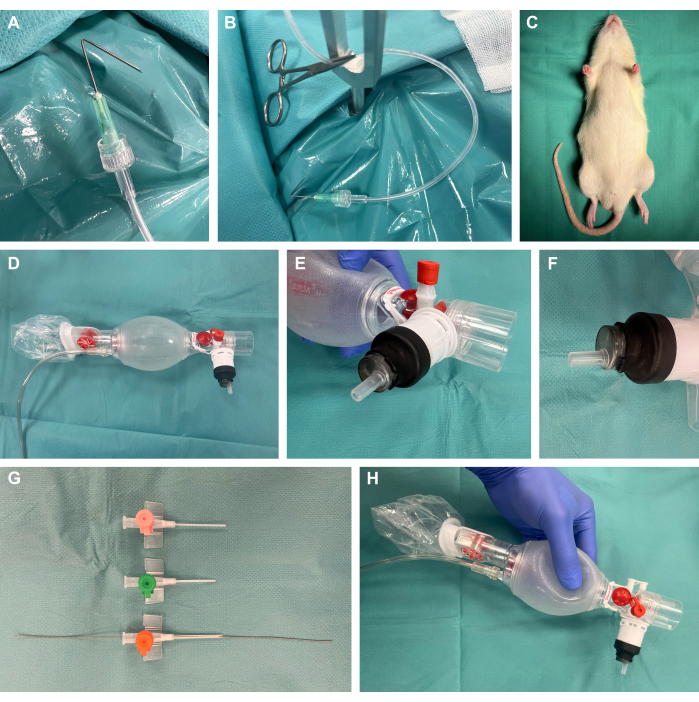
Şekil 1: Deney düzeneği. (A) Cerrahi hazırlık kancası olarak kullanılan bir perfüzyon tüpüne bağlı katlanmış bir kanül. (B) Metal bir sabitleme çubuğuna yerleştirilmiş kelepçeli hazırlık kancası. (C) Müdahaleden önce yatıştırılmış hayvan. (D) Neonatolojiden ventilasyon torbası. (E-F) Luer kilitli bir şırınganın ısıyla daralan bir tüp kullanılarak havalandırma torbasına hava geçirmez şekilde monte edilmesi. (G) Seldinger tekniği için bir arteriyel lider-kateter setinden bir kılavuz tel ile farklı boyutlarda kısaltılmış ve eğimli intravenöz kateterler. (H) Nihai ısmarlama yapı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Anestezi ve analjezi
- Fareyi tercih edilen ilaçla uyuşturun.
NOT: Burada ketamin %10 (100 mg/mL), ksilazin %2 (20 mg/mL), karprofen 50 mg/mL ve izofluran kullanılarak anestezi ve analjezi yapıldı. Uygulama için stok çözeltileri olarak 1:10 oranında ksilazin ve carprofen seyreltmesi kullanıldı.- Hayvanı, bir buharlaştırıcı kullanarak% 4 (v) izofluran ile tamamlanan% 5 / dak'lık bir giriş hızında% 100 oksijenle doldurulmuş bir indüksiyon kutusuna yerleştirerek anesteziyi indükleyin.
- Bilinç kaybı sağlandıktan sonra, hayvanı indüksiyon kutusundan çıkarın ve 100 mg / kg vücut ağırlığı ketamin ve 4 mg / kg vücut ağırlığı ksilazin enjekte edin (i.p.).
NOT: Bu, 400 mg'lık bir hayvan için 40 mg ketamin (orijinal çözeltinin 0.4 mL'si) ve 1.6 mg ksilazinin (orijinal çözeltinin 0.08 mL'si veya 1:10 çözeltinin 0.8 mL'si) karşılık gelir. - Hayvanı, i.p. enjeksiyonunun etkisi başlayana kadar izofluran su basmış indüksiyon kutusuna geri yerleştirin.
- Sıçanın sert bir ayak parmağı tutamına tepki vermediğini test ederek uygun anestezik derinliği garanti edin.
- Gözlere oftalmik merhem sürün.
- Ameliyat sırasında anestezi derinliğini değerlendirin ve koruyun.
- Narkotik etkiler zamanla azalmış gibi göründüğünde (yaklaşık her saat), hayvana ek olarak 50 mg / kg vücut ağırlığı ketamin ve 1 mg / kg vücut ağırlığı ksilazin enjekte edin (s.c). Bu, 400 mg'lık bir hayvan için 20 mg ketamin (orijinal çözeltinin 0.2 mL'si) ve 0.4 mg ksilazinin (1:10 çözeltinin 0.2 mL'si) karşılık gelir.
- Torakotomiden önce 5 mg / kg vücut ağırlığı carprofen sc enjeksiyonu ile ek analjezi sağlayın. Bu, 400 mg'lık bir hayvan için 2 mg carprofen'e (0.04 mL orijinal çözelti veya 0.4 mL 1:10 çözelti) karşılık gelir.
3. Cerrahi hazırlık (Şekil 2)
- Transnazal yenidoğan maskesi ile %100 oksijen soluyarak hayvan dolaşımını oksijenle doyurun (Şekil 2A).
- 5 dakika sonra, transnazal yenidoğan maskesinden, yukarıda tarif edildiği gibi bir erkek plastik şırınga Luer-lock uçlu bir yenidoğan ventilasyon torbasının yapımına geçin ve şırınga ucu hayvanın burun ucuna yakın olacak şekilde taşma halinde oksijen verin (Şekil 2B).
- İstenilen uzunlukta medyan torakoservikal cilt insizyonu yapın ve cerrahi hazırlık kancalarını kullanarak cerrahi durumu ortaya çıkarın (Şekil 2C,D).
- Servikal fasya boyunca ince makasla künt diseksiyon ile hazırlığı ilerletin. Sol lateral membran diseksiyonundan sonra sternokleidomastoid ve infrahyoidal kası açığa çıkarın ve median infrahyoidal kası sağa lateralize edin (Şekil 2E-G).
- Trakeaya doğru künt diseksiyon yapın ve overholt klempleri kullanarak trakeanın tünelini açın (Şekil 2H-I).
- Silikon bir damar halkası kullanarak trakeayı askıya alın ve daha sonra endotrakeal kanül fiksasyonu için bir polifilament sütür kullanarak distal trakeayı çift askılayın (Şekil 2J-N).

Şekil 2: Trakeanın hazırlanması. (A) Maske yoluyla oksijenin solunması. (B) Oksijen uygulaması için maskeden erkek Luer kilitli şırıngaya geçin. (C) Torakoservikal cilt kesisi. (D) Servikal fasya yoluyla hazırlık. (E) sternokleidomastoid kasın ve infrahyoidal kasın maruz kalması. (F) Medyan infrahyoidal kasın lateralizasyonu. (G) Trakeaya doğru künt diseksiyon. (H) trakeanın overholt kelepçeleri kullanılarak tünellenmesi. (I) Silikon damar halkası kullanılarak trakeanın asılması. (J-N) Daha sonra endotrakeal kanül fiksasyonu için bir poli filament sütür kullanılarak trakeanın kaudal çift askılanması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Entübasyon prosedürü (Şekil 3)
- Atravmatik pense kullanarak trakeayı kaudal olarak uzatın (Şekil 3A,B).
- Makas kullanarak trakeanın 180° çevresine kısmi bir kesi yapın (Şekil 3C-F).
- Esnek ucu trakeaya olan bir Seldinger kılavuz teli yerleştirin (Şekil 3G-H) ve ardından uygun çevresi olan modifiye edilmiş intravenöz kateteri Seldinger teli tarafından yönlendirilen trakeaya sokun (Şekil 3I-N).
- Seldinger telini çıkarın (Şekil 3O), trakeal kateterin Luer kilitli ucunu modifiye ventilasyon torbasına bağlayın ve yüksek frekans ve düşük tidal hacim ile nazik akciğer koruyucu manuel ventilasyonu başlatın (Şekil 3P). Median torakotomi yapılmadığı ve akciğer düz bir şekilde görünmediği sürece manuel ventilasyon yapın.
- Havadan sızıntıyı ve kazara kateterin çıkarılmasını önlemek için önceden yerleştirilmiş kilitleme sütürünü kayar bir düğümle bağlayın (Şekil 3Q-T).

Şekil 3: Trakeotomi ile endotrakeal entübasyon. (A) Hazırlıktan sonraki ilk durum. (B) Atravmatik pense kullanılarak trakeanın kaudal uzaması. (C-F) Çevresi 180° olan trakeanın kısmi insizyonu. (G,H) Trakeaya bir Seldinger kılavuz telinin sokulması. (I-M) Modifiye intravenöz kateterin Seldinger teli tarafından yönlendirilen trakeaya sokulması. (N-O) Seldinger telinin çıkarılması. (P) Trakeal kateterin modifiye ventilasyon torbasına luer kilit bağlantısı. (S-T) Kazara kateterin çıkarılmasını önlemek için önceden yerleştirilmiş kilitleme sütürünün bağlanması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Manuel ventilasyon ve median torakotomi (Şekil 4)
- Median torakotomiye künt ve stabil materyal makası kullanarak ksifoidden başlayın (Şekil 4A,B) ve sternumdan kraniyal olarak devam edin. Makasla substernal olarak ilerlerken ve keserken akciğere travma yaşamamak için ventilasyonu daima birkaç saniye duraklatın (Şekil 4C-E).
- Cerrahi hazırlık kancalarını kullanarak torasik maruziyet kazanın ve mediastinal serozal membranları çıkarın (Şekil 4F-H).
- İstenilen frekans ve tidal hacim ile manuel ventilasyona devam edin ve izlemeyi genişletin (örneğin, intra-arteriyel kan basıncı ölçümü oluşturmak, amaca veya ilgili araştırma sorusuna bağlı olarak merkezi venöz veya pulmoner arteriyel kateter takmak) (Şekil 4I-L).

Şekil 4: Manuel ventilasyon ve medyan torakotomi. (A) entübasyondan sonraki ilk durum. (B-E) Ksifoidden başlayan medyan torakotomi. (F-I) Cerrahi hazırlık kancaları kullanılarak torasik maruziyet. (J) Havalandırma sırasında son kurulum. (K-L) manuel havalandırma işlemi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
6. Ötenazi
- Derin anestezi uygulanmış hayvanda makas kullanarak ani keskin kardiyektomi ile ötenazi elde edin.
Sonuçlar
Trakeotomi ile endotrakeal entübasyon ve ardından torakotomi, sağkalım dışı uygulamalar için 10 erkek sıçanda (ortalama ağırlık 405 ± 30 g) yapıldı. Prosedür ikinci yıl cerrahi asistanı tarafından gerçekleştirildi. 20 dakikalık entübasyon ve ventilasyondan sonra sağkalım ile tanımlanan başarı oranı %100 idi. Deri insizyonundan entübasyon tüpünün fiksasyonuna kadar hazırlık ve entübasyon işleminin ortalama süresi 6:55 ± 0:53 dk idi (Tablo 1).
| Kullanılan hayvan sayısı | 10 |
| Vücut ağırlığı (ortalama ve standart sapma) | 405 ± 30 g |
| Entübasyon başarı oranı | 100% |
| İşlem süresi (ortalama ve standart sapma) | 6:55 ± 0:53 dk |
| Ortalama oksijen doygunluğu | 96% |
| Minimum oksijen doygunluğu | 92% |
Tablo 1: Temsili sonuçlar. 10 hayvanda protokolün temsili sonuçları.
Doygunluk, arka bacakta tek kullanımlık kendinden yapışkanlı nabız oksimetresi probu ile izlendi ve hiçbir zaman %92'nin altına düşmedi. Diyafram insizyonuna kadar spontan ventilasyon yapıldı. Tüm sıçanlar, ani keskin kardiyoloji yoluyla kasıtlı ötenaziye kadar deneysel ölçümler için gereken 20 dakika boyunca hayatta kaldı (Şekil 5).

Şekil 5: Periferik oksijen doygunluğu. Bu prosedürün tüm süresi boyunca ölçülen periferik oksijen doygunluğu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Yalnızca ABD'de, yılda yaklaşık 110 milyon sıçan ve fare hayvan deneylerinde kullanılmaktadır24. Güvenilir istatistikler bulunamamakla birlikte, bunların önemli bir yüzdesi, özellikle pulmoner ve kardiyak araştırmaların yanı sıra anesteziyoloji alanlarında destekli ventilasyon alacaktır. Bu hayvanların çoğuna non-invaziv endoorotrakeal entübasyon uygulanır ve bu da bir takım zorluklar gerektirir. Bunlar arasında daha yavaş öğrenme eğrileri, daha yüksek entübasyon başarısızlığı oranları, daha fazla sayıda reentübasyon ve ilişkili solunum komplikasyonlarının yanı sıra solunum sızıntıları bulunur25. Bu nedenle, non-invaziv entübasyon genellikle daha deneyimli araştırma personeli, fiber optik, kapnometri ve mekanik ventilatörler gibi daha ileri teknolojiler ve daha fazla finansal ve materyalist kaynak gerektirecektir26. Bu nedenle, entübasyonun tüm yönü, sonraki istatistiksel analiz ve sonuçların bireyler arası heterojenliği ile ilgili anlamlı bir karıştırıcıdır. Bununla birlikte, non-invaziv endoorotrakeal entübasyon, uzunlamasına deney tasarımlarında genellikle tek uygulanabilir seçenektir.
Alternatifler, uzunlamasına deneylerde gerekli uzun süreli trakeal erişim için trakeostomi veya sağkalım dışı deneylerde "tek kullanımlık" cerrahi trakeotomidir. Sıçanlarda trakeostomi için mikrocerrahi tekniğe ilişkin protokoller mevcut olsa da27, şu anda hayatta kalamayan sıçan modellerinde trakeotomi yoluyla endotrakeal entübasyon için herhangi bir protokol bulunmamaktadır.
Bu nedenle, sıçanlarda trakeotomi ve müteakip torakotomi yoluyla endotrakeal entübasyon için burada açıklanan standartlaştırılmış prosedür, hayatta kalmayan çalışmalarda bulunan araştırmacılar için değerli bir yöntemi temsil etmektedir. Bu prosedür ne uzman personel ne de kapsamlı bir eğitim gerektirir. Endoorotrakeal entübasyondan çok daha yüksek bir entübasyon başarı oranına sahiptir ve çok daha kontrollü prosedür adımlarına izin verir.
Sunulan tekniklerin sınırlamaları esas olarak prosedürün invazivliğini ve sonuç olarak, hayatta kalma dışı deneylerle özel uyumluluğu içerir. Deri ve yumuşak dokudaki büyük kusurların yanı sıra insizyonel trakeal fistül nedeniyle, özellikle torakotomi ile kombine edildiğinde, bu prosedürden ekstübasyon ve iyileşme ne uygulanabilir ne de önerilir.
Prosedür sırasında karşılaşılan yaygın zorlukları giderirken, aşağıdaki noktalara ve tavsiyelere dikkat çekmek isteriz: ekipman ve ilaçlar mümkün olduğunca kapsamlı bir şekilde hazırlanmalıdır. Deneyi yapan kişi, ince hazırlık ve travmatik olmayan pamuklu çubuklar kullanarak hemostatik kontrolü titizlikle yapmalıdır. Deneyi yapan kişi, yeterli hareketliliği sağlamak için trakeayı en az 0,5 cm uzunluğunda hazırlamalı ve insizyondan sonra trakeayı kaybetmemek için silikon damar halkasını kullanmalıdır, çünkü bu, trakea zemin fenomeni nedeniyle doku derinliğinde kaybolduğunda aspirasyon ve boğulma ile sonuçlanabilir. Makasın net bir darbesiyle trakeayı sadece kısmen kesin. İdeal olarak, 180° çevre kesilmelidir. Bunun altında entübe edilememesine neden olabilir. Bunun üzerinde, her iki ucun dokunun derinliğine geri çekilmesi ve ardından boğulma ile trakeanın kopması ile sonuçlanabilir. Entübasyon tüpünü sabitlemek için polifilament sütürün bağlanırken, hava sızıntısını veya kazara tüp çıkığını önlemek için yeterli sızdırmazlığı sağlamak ve aynı zamanda tüpün istenmeyen kapanmasını önlemek için kayar bir düğüm kullanılmalıdır. Dikiş sırasında Seldinger telinin yerinde bırakılması, istenmeyen kapanmayı önleyebilir. Ventilasyon torbasını kullanarak manuel ventilasyon gerçekleştirirken, yüksek tidal hacimler tarafından akciğerin barotravmasından kesinlikle kaçınılmalıdır. Bunun yerine, özellikle torakotomi yapılmadığı ve akciğer hacimleri görsel olarak değerlendirilemediği sürece, akciğer koruyucu, yüksek sıklıkta ve düşük tidal ventilasyon hedeflenmelidir.
Bu protokol, ayrıntılı ve tekrarlanabilir bir metodoloji sunarak, deneysel prosedürlerin standardizasyonunu kolaylaştırır, veri güvenilirliğini ve çalışmalar arasında karşılaştırılabilirliği artırır. Sonuç olarak, bu yöntem klinik öncesi araştırmalarda bilimsel tekniklerin geliştirilmesine katkıda bulunur ve sonuçta fizyoloji, farmakoloji, cerrahi ve biyomedikal bilimler alanlarındaki bulguların translasyonel alaka düzeyini arttırır.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Yazarlar, Baden-Württemberg Bilim, Araştırma ve Sanat Bakanlığı (MWK) ve Alman Araştırma Vakfı (DFG) tarafından INST 35/1314-1 FUGG ve INST 35/1503-1 FUGG hibeleri aracılığıyla desteklenen veri depolama hizmetine minnetle SDS@hd teşekkür eder. Ayrıca yazarlar, yapılandırılmış doktora sonrası programı ve Cerrahi Onkoloji programı aracılığıyla NCT'nin (Heidelberg, Almanya'daki Ulusal Tümör Hastalıkları Merkezi) desteğini minnetle kabul ederler. Ayrıca, Baden-Württemberg Eyalet Parlamentosu tarafından onaylanan Devlet Fonları aracılığıyla onaylanan Devlet Fonları aracılığıyla sağlanan desteği de kabul ediyoruz. Alexander Studier-Fischer için yapılandırılmış doktora sonrası programından Kampüs Sağlık + Yaşam Bilimleri İttifakı Heidelberg Mannheim: Sağlıkta Yapay Zeka (AIH) - DKFZ, EMBL, Heidelberg Üniversitesi, Heidelberg Üniversite Hastanesi, Mannheim Üniversite Hastanesi, Ruh Sağlığı Merkez Enstitüsü, ve Max Planck Tıbbi Araştırma Enstitüsü. Ayrıca, Mannheim Üniversitesi Tıp Merkezi'ndeki DKFZ Hector Kanser Enstitüsü aracılığıyla verilen desteği de kabul ediyoruz. Yayın ücreti için, Deutsche Forschungsgemeinschaft'ın "Açık Erişim Publikationskoste" finansman programı kapsamında ve Heidelberg Üniversitesi'nin mali desteğini kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Ambu Spur II Single-Use ventilation bag for neonates | Meier Medizintechnik | 335 102 000 | Ventilation bag |
| BD Microlance 3 cannula 20 G | BD (Beckton, Dickinson) | 301300 | Cannula |
| BD Microlance Discardit II 20 mL Syringe | BD (Beckton, Dickinson) | 300296 | Plastic syringe |
| Fixation rods | Legefirm | 500343896 | Tuning forks used as y-shaped metal fixation rods |
| Heat-shrinking tube | Sekesoer | RSG-400 | Heat-shrinking tube |
| Intravenous catheter | BD (Beckton, Dickinson) | 393230 | BD Venflon Pro Safety intravenous catheter 14 G; shortened using scissors; alternatively 16 G or 18 G can be used |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | Connecting tube COEX 150 cm |
| Polyfilament suture | COVIDIEN | CL331 | Polyfilament surgical suture recommended with a strength of 1 to 2; needle can be removed |
| Royal Gardineer Heating Pad Size S, 20 Watt | Royal Gardineer | IP67 | Heating pad |
| Seldinger guide wire | VYGON | 115.798 | Metal guide wire from the arterial leadercath set |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | Silicone vessel loop tie 2.5 mm red |
| Spraque Dawley rats | Janvier Labs | Male rats weighing 400 grams | |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
Referanslar
- Czigany, Z., et al. Limb remote ischemic conditioning of the recipient protects the liver in a rat model of arterialized orthotopic liver transplantation. PLoS One. 13 (4), e0195507 (2018).
- Czigány, Z., et al. Improving research practice in rat orthotopic and partial orthotopic liver transplantation: A review, recommendation, and publication guide. Eur Surg Res. 55 (1-2), 119-138 (2015).
- Nagai, K., Yagi, S., Uemoto, S., Tolba, R. H. Surgical procedures for a rat model of partial orthotopic liver transplantation with hepatic arterial reconstruction. J Vis Exp. 73, e4376 (2013).
- Jahshan, F., et al. A novel rat model for assessment of laryngotracheal injury following transoral intubation. Int J Pediatr Otorhinolaryngol. 113, 4-10 (2018).
- Lamoureux, L., Radhakrishnan, J., Gazmuri, R. J. A rat model of ventricular fibrillation and resuscitation by conventional closed-chest technique. J Vis Exp. 98, 52413 (2015).
- Wang, Z., et al. Autoinducer-2 of streptococcus mitis as a target molecule to inhibit pathogenic multi-species biofilm formation in vitro and in an endotracheal intubation rat model. Front Microbiol. 7, 88 (2016).
- Jahshan, F., et al. A novel rat model for tracheal mucosal damage assessment of following long term intubation. Int J Pediatr Otorhinolaryngol. 128, 109738 (2020).
- Rivard, A. L., et al. Rat intubation and ventilation for surgical research. J Invest Surg. 19 (4), 267-274 (2006).
- Na, N., Zhao, D. Q., Huang, Z. Y., Hong, L. Q. An improved method for rat intubation and thymectomy. Chin Med J (Engl). 124 (17), 2723-2727 (2011).
- Cicero, L., Fazzotta, S., Palumbo, V. D., Cassata, G., Lo Monte, A. I. Anesthesia protocols in laboratory animals used for scientific purposes. Acta Biomed. 89 (3), 337-342 (2018).
- Fuentes, J. M., et al. Videoendoscopic endotracheal intubation in the rat: A comprehensive rodent model of laparoscopic surgery. J Surg Res. 122 (2), 240-248 (2004).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Lazopoulos, A., et al. Open thoracotomy for pneumothorax. J Thorac Dis. 7 (S1), S50-S55 (2015).
- Rendell, V. R., Giamberardino, C., Li, J., Markert, M. L., Brennan, T. V. Complete thymectomy in adult rats with non-invasive endotracheal intubation. J Vis Exp. 94, 52152 (2014).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. 86, 50269 (2014).
- Nelson, A. M., Nolan, K. E., Davis, I. C. Repeated orotracheal intubation in mice. J Vis Exp. 157, 60844 (2020).
- Das, S., Macdonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. 73, e50318 (2013).
- Massick, D. D., et al. Quantification of the learning curve for percutaneous dilatational tracheotomy. Laryngoscope. 110 (2 Pt 1), 222-228 (2000).
- Giugliano, G., et al. Learning curve for translaryngeal tracheotomy in head and neck surgery. Laryngoscope. 111 (4 Pt 1), 628-633 (2001).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesth Analg. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Ann Emerg Med. 60 (6), 749-754.e742 (2012).
- Titu, I. M., Delaca, G. B., Teterea, F., Ciulic, S. A., Palade, E. Percutaneous tracheostomy using the Seldinger technique. Multimed Man Cardiothorac Surg. 2023, (2023).
- Garry, B. P., Bivens, H. E. The Seldinger technique. J Cardiothorac Anesth. 2 (3), 403 (1988).
- Carbone, L. Estimating mouse and rat use in American laboratories by extrapolation from animal welfare act-regulated species. Sci Rep. 11 (1), 493 (2021).
- Su, C. S., et al. Efficacious and safe orotracheal intubation for laboratory mice using slim torqueable guidewire-based technique: Comparisons between a modified and a conventional method. BMC Anesthesiol. 16, 5 (2016).
- Clary, E. M., O'halloran, E. K., De La Fuente, S. G., Eubanks, S. Videoendoscopic endotracheal intubation of the rat. Lab Anim. 38 (2), 158-161 (2004).
- Ghali, M. G. Z. Microsurgical technique for tracheostomy in the rat. MethodsX. 5, 61-67 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır