Method Article
Non-survival 응용 프로그램을 위한 쥐의 기관절개술을 통한 기관내 삽관 및 후속 흉곽절개술
요약
여기에서는 생체 내 쥐 모델에서 흉부 기관의 침습적 환기 및 노출이 필요한 비생존 응용 프로그램의 정밀도와 재현성을 향상시키는 것을 목표로 하는 쥐에서 기관절개술과 개흉술을 통한 기관내 삽관에 대한 표준화된 절차를 소개합니다.
초록
기관내 삽관 및 후속 인공호흡은 제어되거나 높은 인공호흡 압력 또는 흉강 및 장기에 대한 접근이 필요한 다양한 중재를 위한 쥐 모델의 중개 연구를 위한 기본 요구 사항인 경우가 많습니다. 해부학적으로 기존의 입 통과 경로를 사용하는 기존의 실내 기관 삽관은 생존 실험에 매우 적합합니다. 그러나 이 절차는 일반적으로 더 높은 수준의 경험과 기술, 더 높은 수준의 고급 장비, 관련 삽관 실패율 및 기관 천공, 일시적인 전신 저산소화 및 관련 공중 누출과 같은 합병증으로 인한 더 많은 시간 노력을 포함하여 몇 가지 문제를 제기합니다.
따라서 본 원고는 보장된 삽관 성공, 일정한 산소 공급 수준, 높은 환기압 또는 개흉술이 필요한 경우 비생존 쥐 모델에서 기관절개술을 통한 기관내 삽관에 대한 자세한 단계별 프로토콜을 제시합니다.
이 프로토콜은 특히 직접 후두경을 통한 실내악관 삽관 기술에 경험이 없거나 일상적이지 않은 연구자의 경우 일관되고 신뢰할 수 있는 결과를 보장하기 위해 세심한 수술 기법의 중요성을 강조합니다. 따라서 이 절차는 동물의 고통과 불필요한 동물 손실을 최소화할 것으로 예상됩니다.
서문
일반적으로 설치류는 환자보다 훨씬 더 오랫동안 호흡 곤란을 보상할 수 있습니다. 심폐순환에 가장 스트레스를 주는 시술 중 하나로 알려진 간 이식과 같은 침습적인 시술을 통해서도 자연 환기 하에서 훨씬 더 오랫동안 심순환계를 안정적으로 유지하고 충분한 상태를 유지할 수 있습니다 1,2,3.
그러나 기관내 삽관은 다양한 생물 의학 분야에서 비롯된 다양한 환경 및 중재를 위한 쥐 모델의 중개 연구를 위한 기본 요구 사항이며 오늘날의 과학 환경에서 필수적입니다 4,5,6,7,8,9,10,11 . 일반적으로 쥐를 대상으로 한 실험 동물 실험의 대다수는 여전히 침습적 인공호흡을 필요로 하지 않지만(12), 삽관 및 통제된 인공호흡 보조를 필요로 하는 특정 실험 환경이 있다. 이러한 실험 설정에는 안전한 기도, 높은 인공호흡기, 복강경 검사 또는 흉강 및 장기에 대한 직접적인 접근이 필요한 모든 실험이 포함됩니다.
특히 흉강과 장기에 접근해야 하는 경우, 늑간근과 횡격막에 의한 흉막내 공간의 음압과 흡기 기전이 손실되면 폐의 붕괴로 인해 치명적인 호흡 부전이 발생하므로 기관내 삽관이 필수적이다13.
설치류 14,15,16,17에서 비침습적 기관내 삽관 방법에 대한 많은 출판물이 있지만, 기관절개술에 의한 침습적 기관내 삽관에 대한 절차 프로토콜은 부족한 것으로 보인다. 비생존 동물 모델에만 적용할 수 있는 후자의 침습성에도 불구하고 기관 절개술을 통한 삽관에는 큰 이점이 있습니다. 여기에는 더 가파른 학습 곡선, 더 높고 지속적인 성공률, 더 적은 기술 장비, 향상된 성공 모니터링 기회등이 포함됩니다 18,19.
삽관의 성공은 결과를 위해 필수적입니다. 환자에 대한 반복적인 삽관 시도뿐만 아니라 다양한 잘못된 삽관은 사망과 같은 심각한 부작용 및 합병증과 명백히 연관되어 있지만, 20,21 이러한 사례는 실험 동물에서도 해롭다. 가장 좋은 경우, 그들은 실험에서 강력한 교란 변수를 나타내지만 동물의 불필요한 손실로 이어질 수도 있습니다. 그러므로, 실험 설정 및 전략이 허용하는 경우 비침습성을 희생하면서 삽관 성공률을 높이는 것이 합리적입니다.
외과적 기관절개술을 통한 이 표준화된 삽관 프로토콜은 삽관 성공률의 변동성 감소, 심폐 생리학적 매개변수에 대한 영향 최소화, 매개변수의 완전한 조사 제어 및 조작 등 여러 가지 이점을 제공합니다. 특히 직접 후두경을 통한 기관 내 삽관 절차에 대한 경험이 부족한 연구자에게 안전한 기도를 제공하는 데 도움이 되며, 연구자가 고도로 통제된 조건에서 비생존 연구를 수행할 수 있습니다. 우리는 주요 해부학적 랜드마크를 강조하고 절차 중에 직면하는 일반적인 문제를 해결하는 방법에 대한 통찰력을 제공합니다.
프로토콜
여기에 설명된 모든 동물 활동은 독일 카를스루에에 있는 바덴-뷔르템베르크 지역 위원회의 기관 동물 관리 및 사용 위원회(IACUC)의 승인을 받았습니다. 실험 동물은 제도적 기준과 동물 사용 및 관리에 대한 독일 법률, 유럽 공동체 이사회(2010/63/EU)의 지침 및 ARRIVE 지침에 따라 관리되었으며 공인된 시설에서 수행되었습니다. 주문 중량이 400g인 Janvier Labs의 수컷 Spraque Dawley 쥐가 사용되었습니다.
1. 시술 준비(그림 1)
- 캐뉼러를 팁까지 1cm에서 135° 각도로 접고, Luer-lock을 통해 플라스틱 관류 튜브에 연결하고, 수술용 모기 클램프를 사용하여 장력을 가하여 수술 준비 후크를 준비합니다(그림 1A, B).
- 설치류 수술 노출 장치를 준비하십시오.
참고: 상용 플랫폼의 가용성 외에도 이 연구에서와 같이 비용 효율적으로 쉽게 자체 구축할 수 있습니다.- 이를 위해 40mm 두께의 50cm x 4cm 강판을 사용하십시오. 후속 장력 점을 위해 원하는 위치에 강철 드릴을 사용하여 여러 개의 8mm 구멍을 만듭니다. 이 위치에 Y자형 고정 막대를 놓습니다.
- 열 지지를 제공하기 위해 수술 노출 장치의 강판 위에 가열 패드를 놓습니다.
- 플라스틱 튜브와 수술용 모기 클램프가 부착된 수술 준비 고리를 준비하여 나중에 수술 노출을 위해 조직에 장력을 가합니다.
- 수 Luer-lock 끝이 있는 10mL 플라스틱 주사기의 플러그를 제거하고 주사기의 근위 끝을 잘라냅니다. 그림과 같이 말단 부분을 환기 백에 삽입하고 열수축 튜브로 덮고 실험실 토치를 사용하여 약한 열을 가하여 밀폐합니다(그림 1D-F).
- 다양한 크기의 정맥 내 카테터를 줄이고 베벨로 절단하고, 팁의 유연한 와이어 끝이 있는 동맥 리더 카테터 세트의 가이드 와이어를 삽관 중 후속 Seldinger 기술22,23을 위해 해당 동물 크기(아마도 14G)에 가장 적합한 카테터 크기에 삽입합니다(그림 1G, H).
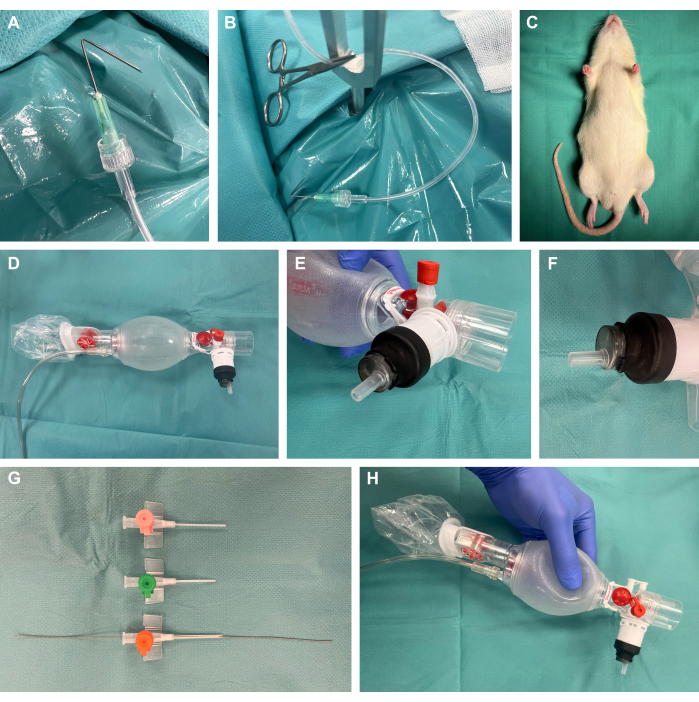
그림 1: 실험 설정.(A) 수술 준비 고리로 사용되는 관류 튜브에 연결된 접힌 캐뉼라. (B) 금속 고정 막대에 클램프가 위치한 준비 후크. (C) 개입 전에 동물을 진정시켰습니다. (D) 신생아학의 환기 백. (E-F) 열수축 튜브를 사용하여 Luer-lock 주사기를 환기 백에 밀폐 장착합니다. (G) Seldinger 기술을 위한 동맥 리더-카테터 세트의 가이드 와이어를 사용하여 다양한 크기의 정맥 카테터를 단축 및 비스듬하게 만들었습니다. (H) 최종 맞춤형 건축. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 마취 및 진통
- 선택한 약물로 쥐를 마취하십시오.
참고: 여기에서는 케타민 10%(100mg/mL), 자일라진 2%(20mg/mL), 카프로펜 50mg/mL 및 이소플루란을 사용하여 마취 및 진통제를 확립했습니다. 자일라진(xylazine)과 카프로펜(carprofen)의 1:10 희석액이 적용을 위한 원액으로 사용되었습니다.- 기화기를 사용하여 5L/min의 유입 속도로 100% 산소가 주입된 유도 상자에 동물을 넣고 4%(v)의 이소플루란으로 마취를 유도합니다.
- 의식을 잃은 후, 유도 상자에서 동물을 꺼내 100mg/kg 체중 케타민과 4mg/kg 체중 자일라진을 주입(ip)합니다.
참고: 이는 400mg 동물의 경우 케타민 40mg(원래 용액 0.4mL) 및 자일라진 1.6mg(원래 용액 0.08mL 또는 1:10 용액 0.8mL)에 해당합니다. - i.p. 주입 효과가 나타날 때까지 동물을 이소플루란 주입 상자에 다시 넣습니다.
- 단단한 발가락 꼬집음에 대한 쥐의 반응 부족을 테스트하여 적절한 마취 깊이를 보장합니다.
- 눈에 안과 연고를 바르십시오.
- 수술 중 마취의 깊이를 평가하고 유지합니다.
- 시간이 지남에 따라(약 1시간마다) 마약 효과가 감소하는 것 같으면 동물에게 체중 케타민 50mg과 체중 1kg의 자일라진을 추가로 주사합니다. 이는 400mg 동물의 경우 20mg의 케타민(원래 용액의 0.2mL)과 0.4mg의 자일라진(0.2mL의 1:10 용액)에 해당합니다.
- 개흉술 전에 체중 5mg/kg 카프로펜의 SC 주사로 추가 진통제를 제공합니다. 이는 400mg 동물의 경우 2mg의 카프로펜(원래 용액의 0.04mL 또는 1:10 용액의 0.4mL)에 해당합니다.
3. 수술 준비(그림 2)
- 경비강 신생아 마스크를 통해 100% 산소를 흡입하여 동물의 순환을 산소로 포화시킵니다(그림 2A).
- 5분 후, 위에서 설명한 대로 경비강 신생아 마스크에서 남성용 플라스틱 주사기 Luer-lock 팁이 있는 신생아 환기 백으로 전환하고 주사기 팁이 동물 비강 끝에 가깝게 오버플로 산소를 공급합니다(그림 2B).
- 원하는 길이에 걸쳐 흉경부 정중 피부 절개를 수행하고 수술 준비 고리를 사용하여 수술 부위를 노출시킵니다(그림 2C, D).
- 경추 근막을 통해 미세한 가위로 둔기를 해부하여 준비를 진행하십시오. 흉쇄유돌근 및 하부근을 노출시키고 좌측 측막 절제 후 정중 하부근을 오른쪽으로 측방화합니다(그림 2E-G).
- 오버홀트 클램프를 사용하여 기관을 향해 무딘 해부를 수행하고 기관을 터널링합니다(그림 2H-I).
- 실리콘 혈관 고리를 사용하여 기관을 슬링하고 나중에 기관내 캐뉼라 고정을 위해 폴리필라멘트 봉합사를 사용하여 원위 기관을 이중 슬링합니다(그림 2J-N).

그림 2: 기관 준비. (A) 마스크를 통한 산소 흡입. (B) 산소 적용을 위해 마스크에서 남성용 Luer-lock 주사기로 전환합니다. (C) 흉강경추 피부 절개. (D) 경추 근막을 통한 준비. (E) 흉쇄유돌근(sternocleidomastoid muscle) 및 하부근(infrahyoidal muscle)의 노출. (F) 정중 하저근(infrahyoidal muscle)의 측방화(Lateralization). (G) 기관 쪽으로 둔탁한 해부. (H) 오버홀트 클램프를 사용한 기관 터널링. (I) 실리콘 용기 고리를 사용하여 기관을 슬링하는 행위. (제이-엔) 나중에 기관내 캐뉼라 고정을 위해 폴리 필라멘트 봉합사를 사용하여 기관을 이중 슬링합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 삽관 절차(그림 3)
- 비외상성 플라이어를 사용하여 기관을 꼬리로 늘립니다(그림 3A, B).
- 가위를 사용하여 둘레 180°의 기관을 부분적으로 절개합니다(그림 3C-F).
- 유연한 끝이 있는 Seldinger 가이드 와이어를 기관에 삽입하고(그림 3G-H) 이후에 적절한 둘레의 수정된 정맥 카테터를 Seldinger 와이어에 의해 안내되는 기관에 삽입합니다(그림 3I-N).
- Seldinger 와이어를 제거하고(그림 3O), 기관 카테터의 Luer-lock 팁을 수정된 환기 백에 연결하고 고주파 및 낮은 일회량으로 부드러운 폐 보호 수동 환기를 시작합니다(그림 3P). 정중 개흉술이 시행되지 않았고 폐가 잘 보이지 않는 한 수동 인공호흡을 수행합니다.
- 공중 누출 및 우발적인 카테터 제거를 방지하기 위해 이전에 배치된 잠금 봉합사를 슬라이딩 매듭으로 묶습니다(그림 3Q-T).

그림 3: 기관절개술을 통한 기관내 삽관.(A) 준비 후 초기 상황. (B) 비외상성 플라이어를 사용한 기관의 꼬리 연장. (씨-에프) 둘레 180°의 기관 부분 절개. (G,H) 기관에 Seldinger 가이드 와이어 도입. (나-엠) Seldinger 와이어에 의해 안내되는 기관에 변형된 정맥 주사 카테터를 도입합니다. (해당 없음) Seldinger 와이어 제거. (P) 기관 카테터와 변형된 환기 백의 루어락 연결. (큐-T) 우발적인 카테터 제거를 방지하기 위해 이전에 배치된 잠금 봉합사를 묶습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 수동 인공호흡 및 정중 개흉술(그림 4)
- 뭉툭하고 안정적인 재료 가위(그림 4A, B)를 사용하여 xipoid에서 중앙 개흉술을 시작하고 흉골을 통해 두개골로 계속합니다. 가위를 아래로 전진할 때와 절단할 때는 폐에 대한 외상을 피하기 위해 항상 몇 초 동안 인공호흡을 일시 중지하십시오(그림 4C-E).
- 수술용 후크를 사용하여 흉부에 노출시키고 종격동 장막을 제거합니다(그림 4F-H).
- 원하는 빈도와 일회량으로 수동 인공호흡을 계속하고 모니터링을 확대합니다(예: 동맥 내 혈압 측정 확립, 목적 또는 해당 연구 질문에 따라 중심 정맥 또는 폐 동맥 카테터 설치)(그림 4I-L).

그림 4: 수동 인공호흡 및 정중 개흉술.(A) 삽관 후 초기 상황. (B-E) xiphoid에서 시작하는 중앙 개흉술. (F-I) 수술 준비 후크를 사용한 흉부 노출. (J) 환기 중 최종 설정. (K-L) 수동 환기 과정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 안락사
- 심하게 마취된 동물에게 가위를 사용하여 갑작스럽고 날카로운 심장 절제술을 통해 안락사를 달성하십시오.
결과
기관절개술과 후속 개흉술을 통한 기관내 삽관은 비생존 적용을 위해 10마리의 수컷 쥐(평균 체중 405 ± 30g)에서 수행되었습니다. 이 수술은 외과 레지던트 2년차가 집도했습니다. 삽관 및 인공호흡 20분 이상 생존율로 정의되는 성공률은 100%였습니다. 피부 절개부터 삽관 튜브가 고정될 때까지 준비 및 삽관 절차의 평균 시간은 6분 55초 ± 0분 53초였습니다(표 1).
| 사용된 동물의 수 | 10 |
| 체중(평균 및 표준 편차) | 405 ± 30 그램 |
| 삽관 성공률 | 100% |
| 시술 기간(평균 및 표준 편차) | 6분 55초 ± 0분 53초 |
| 평균 산소 포화도 | 96% |
| 최소 산소 포화도 | 92% |
표 1: 대표적인 결과. 10마리의 동물을 대상으로 한 프로토콜의 대표 결과.
채도는 뒷다리의 일회용 자체 접착식 맥박 산소 측정 프로브를 통해 모니터링되었으며 92% 이하로 떨어지지 않았습니다. 횡격막이 절개될 때까지 자발적 환기가 억제되었습니다. 모든 쥐는 갑작스런 날카로운 심장 절제술을 통해 의도적으로 안락사될 때까지 실험 측정에 필요한 20분을 생존했습니다(그림 5).

그림 5: 말초 산소 포화도. 이 절차의 전체 기간에 걸쳐 측정된 말초 산소 포화도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
미국에서만 매년 약 1억 1,000만 마리의 쥐와 쥐가 동물 실험에 사용됩니다24. 신뢰할 수 있는 통계는 찾을 수 없지만, 이들 중 적절한 비율이 특히 마취학뿐만 아니라 폐 및 심장 연구 분야에서 지원되는 인공호흡을 받게 될 것입니다. 이 동물의 대부분은 비침습적 실내 기관 삽관을 받으며, 여기에는 여러 가지 어려움이 수반됩니다. 여기에는 느린 학습 곡선, 더 높은 삽관 실패율, 더 많은 재삽관 횟수, 관련 호흡기 합병증 및 호흡기 누출 등이 포함된다25. 따라서 비침습적 삽관은 일반적으로 더 경험이 많은 연구진, 광섬유, 정전 측정법, 기계식 인공호흡기와 같은 더 발전된 기술, 그리고 더 많은 재정적, 물질적 자원을 필요로 한다26. 따라서 삽관의 모든 측면은 후속 통계 분석 및 결과의 개인 간 이질성과 관련된 의미 있는 교란입니다. 그러나 비침습적 실내악관 삽관은 종단 실험 설계에서 유일하게 실현 가능한 옵션인 경우가 많습니다.
대안으로는 종단 실험에서 필요한 장기 기관 접근을 위한 기관절개술 또는 비생존 실험에서 "일회용"을 위한 외과적 기관절개술이 있습니다. 쥐의 기관절개술을 위한 미세수술 기법에 대한 프로토콜은 이용 가능하지만, 27, 현재 비생존 쥐 모델에서 기관절개술을 통한 기관내 삽관에 대한 프로토콜은 없다.
따라서 랫트에서 기관절개술과 후속 흉강절개술을 통한 기관내 삽관에 대한 본원의 표준화된 절차는 비생존 연구에 종사하는 연구자에게 유용한 방법을 나타냅니다. 이 절차에는 전문 인력이나 광범위한 교육이 필요하지 않습니다. 이 삽관 성공률은 실내 기관 삽관보다 훨씬 높으며 훨씬 더 통제된 절차적 단계를 허용합니다.
제시된 기술의 한계는 주로 절차의 침습성과 연속적으로 비생존 실험과의 독점적인 호환성을 포함합니다. 절개 기관 누공뿐만 아니라 피부와 연조직의 큰 결함으로 인해 이 절차의 발관 및 회복은 특히 개흉술과 결합할 때 가능하지도 권장되지도 않습니다.
시술 중 발생하는 일반적인 문제를 해결할 때 다음 사항에 주의를 기울이고 권장 사항을 강조하고자 합니다. 장비와 약물은 가능한 한 광범위하게 준비해야 합니다. 실험자는 미세한 준비와 외상이 없는 면봉을 사용하여 지혈 제어를 꼼꼼하게 수행해야 합니다. 실험자는 충분한 이동성을 허용하기 위해 최소 0.5cm 길이로 기관을 준비해야 하며, 절개 후 기관을 잃지 않도록 실리콘 혈관 루프를 사용해야 합니다. 이는 배경 현상으로 인해 기관 깊이에서 기관이 손실될 때 흡인 및 질식을 초래할 수 있습니다. 가위를 한 번 명확하게 긋는 것으로 기관을 부분적으로만 절개합니다. 이상적으로는 둘레를 180° 절개해야 합니다. 이 이하에서는 삽관에 실패할 수 있습니다. 위에서는 양쪽 끝이 조직 깊숙이 후퇴하면서 기관이 끊어지고 질식할 수 있습니다. 삽관 튜브를 고정하기 위해 폴리필라멘트 봉합사를 묶을 때 슬라이딩 매듭을 사용하여 공기 누출이나 우발적인 튜브 탈구를 방지할 수 있는 충분한 견고성을 보장하는 동시에 튜브가 의도하지 않게 닫히는 것을 방지해야 합니다. 봉합하는 동안 Seldinger 와이어를 제자리에 두면 의도하지 않은 폐쇄를 방지할 수 있습니다. 인공호흡백을 이용하여 수동 인공호흡을 할 때는 높은 일회량으로 인한 폐의 기압외상을 엄격히 피해야 합니다. 대신, 폐를 보호하고, 빈도가 높고, 저조도 호흡을 목표로 해야 하며, 특히 개흉술이 시행되지 않았고 폐 용적을 육안으로 평가할 수 없는 한 더욱 그렇습니다.
이 프로토콜은 상세하고 재현 가능한 방법론을 제공함으로써 실험 절차의 표준화를 용이하게 하여 연구 전반에 걸쳐 데이터 신뢰성과 비교 가능성을 향상시킵니다. 결과적으로, 이 방법은 전임상 연구에서 과학적 기술의 개선에 기여하며, 궁극적으로 생리학, 약리학, 외과 및 생물 의학 분야에서 연구 결과의 중개 관련성을 향상시킵니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
저자는 바덴뷔르템베르크 과학연구예술부(MWK)와 독일연구재단(DFG)이 INST 35/1314-1 FUGG 및 INST 35/1503-1 FUGG 보조금을 통해 지원하는 데이터 스토리지 서비스 SDS@hd에 감사의 뜻을 전합니다. 또한, 저자는 NCT(National Center for Tumor Diseases in Heidelberg, Germany)의 체계적인 박사후 연구원 프로그램과 외과 종양학 프로그램을 통한 지원에 감사를 표합니다. 우리는 또한 바덴뷔르템베르크 주 의회가 Innovation Campus Health + Life Science Alliance 하이델베르크 만하임을 위해 승인한 주정부 기금을 통한 Alexander Studier-Fischer: Artificial Intelligence in Health(AIH) - DKFZ, EMBL, 하이델베르크 대학, 하이델베르크 대학 병원, 만하임 대학병원, 중앙 정신 건강 연구소, 막스 플랑크 의학 연구소(Max Planck Institute for Medical Research). 또한, 만하임 대학 의료 센터(University Medical Center Mannheim)의 DKFZ 헥터 암 연구소(DKFZ Hector Cancer Institute)를 통한 지원에 감사드립니다. 출판 수수료의 경우, Deutsche Forschungsgemeinschaft와 하이델베르크 대학의 자금 지원 프로그램인 "Open Access Publikationskoste"의 재정 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Ambu Spur II Single-Use ventilation bag for neonates | Meier Medizintechnik | 335 102 000 | Ventilation bag |
| BD Microlance 3 cannula 20 G | BD (Beckton, Dickinson) | 301300 | Cannula |
| BD Microlance Discardit II 20 mL Syringe | BD (Beckton, Dickinson) | 300296 | Plastic syringe |
| Fixation rods | Legefirm | 500343896 | Tuning forks used as y-shaped metal fixation rods |
| Heat-shrinking tube | Sekesoer | RSG-400 | Heat-shrinking tube |
| Intravenous catheter | BD (Beckton, Dickinson) | 393230 | BD Venflon Pro Safety intravenous catheter 14 G; shortened using scissors; alternatively 16 G or 18 G can be used |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | Connecting tube COEX 150 cm |
| Polyfilament suture | COVIDIEN | CL331 | Polyfilament surgical suture recommended with a strength of 1 to 2; needle can be removed |
| Royal Gardineer Heating Pad Size S, 20 Watt | Royal Gardineer | IP67 | Heating pad |
| Seldinger guide wire | VYGON | 115.798 | Metal guide wire from the arterial leadercath set |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | Silicone vessel loop tie 2.5 mm red |
| Spraque Dawley rats | Janvier Labs | Male rats weighing 400 grams | |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
참고문헌
- Czigany, Z., et al. Limb remote ischemic conditioning of the recipient protects the liver in a rat model of arterialized orthotopic liver transplantation. PLoS One. 13 (4), e0195507 (2018).
- Czigány, Z., et al. Improving research practice in rat orthotopic and partial orthotopic liver transplantation: A review, recommendation, and publication guide. Eur Surg Res. 55 (1-2), 119-138 (2015).
- Nagai, K., Yagi, S., Uemoto, S., Tolba, R. H. Surgical procedures for a rat model of partial orthotopic liver transplantation with hepatic arterial reconstruction. J Vis Exp. 73, e4376 (2013).
- Jahshan, F., et al. A novel rat model for assessment of laryngotracheal injury following transoral intubation. Int J Pediatr Otorhinolaryngol. 113, 4-10 (2018).
- Lamoureux, L., Radhakrishnan, J., Gazmuri, R. J. A rat model of ventricular fibrillation and resuscitation by conventional closed-chest technique. J Vis Exp. 98, 52413 (2015).
- Wang, Z., et al. Autoinducer-2 of streptococcus mitis as a target molecule to inhibit pathogenic multi-species biofilm formation in vitro and in an endotracheal intubation rat model. Front Microbiol. 7, 88 (2016).
- Jahshan, F., et al. A novel rat model for tracheal mucosal damage assessment of following long term intubation. Int J Pediatr Otorhinolaryngol. 128, 109738 (2020).
- Rivard, A. L., et al. Rat intubation and ventilation for surgical research. J Invest Surg. 19 (4), 267-274 (2006).
- Na, N., Zhao, D. Q., Huang, Z. Y., Hong, L. Q. An improved method for rat intubation and thymectomy. Chin Med J (Engl). 124 (17), 2723-2727 (2011).
- Cicero, L., Fazzotta, S., Palumbo, V. D., Cassata, G., Lo Monte, A. I. Anesthesia protocols in laboratory animals used for scientific purposes. Acta Biomed. 89 (3), 337-342 (2018).
- Fuentes, J. M., et al. Videoendoscopic endotracheal intubation in the rat: A comprehensive rodent model of laparoscopic surgery. J Surg Res. 122 (2), 240-248 (2004).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Lazopoulos, A., et al. Open thoracotomy for pneumothorax. J Thorac Dis. 7 (S1), S50-S55 (2015).
- Rendell, V. R., Giamberardino, C., Li, J., Markert, M. L., Brennan, T. V. Complete thymectomy in adult rats with non-invasive endotracheal intubation. J Vis Exp. 94, 52152 (2014).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. 86, 50269 (2014).
- Nelson, A. M., Nolan, K. E., Davis, I. C. Repeated orotracheal intubation in mice. J Vis Exp. 157, 60844 (2020).
- Das, S., Macdonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. 73, e50318 (2013).
- Massick, D. D., et al. Quantification of the learning curve for percutaneous dilatational tracheotomy. Laryngoscope. 110 (2 Pt 1), 222-228 (2000).
- Giugliano, G., et al. Learning curve for translaryngeal tracheotomy in head and neck surgery. Laryngoscope. 111 (4 Pt 1), 628-633 (2001).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesth Analg. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Ann Emerg Med. 60 (6), 749-754.e742 (2012).
- Titu, I. M., Delaca, G. B., Teterea, F., Ciulic, S. A., Palade, E. Percutaneous tracheostomy using the Seldinger technique. Multimed Man Cardiothorac Surg. 2023, (2023).
- Garry, B. P., Bivens, H. E. The Seldinger technique. J Cardiothorac Anesth. 2 (3), 403 (1988).
- Carbone, L. Estimating mouse and rat use in American laboratories by extrapolation from animal welfare act-regulated species. Sci Rep. 11 (1), 493 (2021).
- Su, C. S., et al. Efficacious and safe orotracheal intubation for laboratory mice using slim torqueable guidewire-based technique: Comparisons between a modified and a conventional method. BMC Anesthesiol. 16, 5 (2016).
- Clary, E. M., O'halloran, E. K., De La Fuente, S. G., Eubanks, S. Videoendoscopic endotracheal intubation of the rat. Lab Anim. 38 (2), 158-161 (2004).
- Ghali, M. G. Z. Microsurgical technique for tracheostomy in the rat. MethodsX. 5, 61-67 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유