Method Article
Intubazione endotracheale tramite tracheotomia e successiva toracotomia nei ratti per applicazioni non di sopravvivenza
In questo articolo
Riepilogo
Qui introduciamo una procedura standardizzata per l'intubazione endotracheale tramite tracheotomia seguita da toracotomia nei ratti, volta a migliorare la precisione e la riproducibilità delle applicazioni non di sopravvivenza che richiedono ventilazione invasiva ed esposizione di organi toracici in modelli di ratto in vivo .
Abstract
L'intubazione endotracheale e la successiva ventilazione sono spesso requisiti di base per la ricerca traslazionale in modelli di ratto per vari interventi che richiedono pressioni di ventilazione controllate o elevate o l'accesso alla cavità toracica e agli organi. L'intubazione endoorotracheale convenzionale che utilizza la via anatomicamente esistente attraverso la bocca è adatta per gli esperimenti di sopravvivenza. Tuttavia, questa procedura pone alcune sfide, tra cui livelli generalmente più elevati di esperienza e competenza tecnica richieste, attrezzature più avanzate e un maggiore sforzo in termini di tempo con tassi di fallimento dell'intubazione e complicanze rilevanti come perforazione tracheale, ipoossigenazione sistemica temporanea e perdite aeree rilevanti.
Questo manoscritto, quindi, presenta un protocollo dettagliato passo dopo passo per l'intubazione endotracheale attraverso la tracheotomia in modelli di ratto non sopravviventi, quando sono richiesti il successo garantito dell'intubazione, livelli di ossigenazione costanti, alte pressioni di ventilazione o toracotomia aperta.
Il protocollo sottolinea l'importanza di una tecnica chirurgica meticolosa per garantire risultati coerenti e affidabili, soprattutto per i ricercatori che sono inesperti o privi di routine nella tecnica di intubazione endoorotracheale tramite laringoscopia diretta. Si prevede quindi che questa procedura riduca al minimo la sofferenza degli animali e le perdite inutili degli animali.
Introduzione
In generale, i roditori sono in grado di compensare il distress respiratorio molto più a lungo di quanto farebbero i pazienti. Possono rimanere cardiocircolatori stabili e sufficienti sotto ventilazione spontanea per molto più tempo e durante le procedure più invasive, ad esempio anche attraverso il trapianto di fegato, che è noto per essere una delle procedure più stressanti per la circolazione cardiopolmonare 1,2,3.
Tuttavia, l'intubazione endotracheale è un requisito fondamentale per la ricerca traslazionale in modelli di ratto per vari contesti e interventi provenienti da una varietà di campi biomedici ed è essenziale nel panorama scientifico odierno 4,5,6,7,8,9,10,11 . Sebbene la maggior parte del lavoro sperimentale sugli animali da laboratorio eseguito sui ratti in generale non richieda ancora una ventilazione invasiva12, ci sono alcune configurazioni sperimentali che richiedono l'intubazione e l'assistenza ventilatoria controllata. Queste configurazioni sperimentali includono qualsiasi esperimento che richieda una sicurezza delle vie aeree, alte pressioni di ventilazione e laparoscopia o accesso diretto alla cavità toracica e agli organi.
Soprattutto nel caso in cui sia necessario l'accesso alla cavità toracica e agli organi, l'intubazione endotracheale è indispensabile in quanto il collasso del polmone provocherà un'insufficienza respiratoria fatale una volta persa la pressione negativa nello spazio intrapleurico e il meccanismo di inspirazione da parte dei muscoli intercostali e del diaframma13.
Sebbene esistano molte pubblicazioni sui metodi per l'intubazione endoorotracheale non invasiva nei roditori 14,15,16,17, sembra che manchino protocolli di procedura per l'intubazione endotracheale invasiva mediante tracheotomia. Nonostante l'invasività di quest'ultima, che ne consente l'applicazione solo in modelli animali non di sopravvivenza, ci sono grandi vantaggi dell'intubazione tramite tracheotomia. Questi includono una curva di apprendimento più ripida, tassi di successo più elevati e più persistenti, meno attrezzature tecniche richieste e migliori opportunità di monitoraggio del successo18,19.
Il successo dell'intubazione è essenziale per il risultato. Mentre varie false intubazioni, così come ripetuti tentativi di intubazione nei pazienti, sono chiaramente associati a eventi avversi e complicanze gravi come la morte20,21, tali eventi sono anche deleteri negli animali da laboratorio. Nel migliore dei casi, rappresentano una forte variabile confondente nell'esperimento, ma possono anche portare all'inutile perdita dell'animale. Pertanto, ha senso aumentare le percentuali di successo dell'intubazione a scapito della non invasività se la configurazione e la strategia sperimentale lo consentono.
Questo protocollo standardizzato di intubazione tramite tracheotomia chirurgica offre numerosi vantaggi, tra cui una ridotta variabilità nelle percentuali di successo dell'intubazione, effetti ridotti al minimo sui parametri fisiologici cardiorespiratori e un controllo investigativo completo e la manipolazione dei parametri. Aiuta a fornire una via aerea sicura, in particolare per i ricercatori inesperti nella procedura di intubazione endotracheale tramite laringoscopia diretta, e consente ai ricercatori di condurre studi di non sopravvivenza con condizioni altamente controllate. Evidenziamo i principali punti di riferimento anatomici e forniamo approfondimenti sulla risoluzione dei problemi comuni incontrati durante la procedura.
Protocollo
Tutte le attività animali qui descritte sono state approvate dal comitato istituzionale per la cura e l'uso degli animali (IACUC) del Consiglio regionale del Baden-Württemberg a Karlsruhe, in Germania. Gli animali da esperimento sono stati gestiti secondo gli standard istituzionali e secondo le leggi tedesche per l'uso e la cura degli animali e secondo le direttive del Consiglio della Comunità Europea (2010/63/UE) e le linee guida ARRIVE e sono stati condotti in strutture accreditate. Sono stati utilizzati ratti maschi Spraque Dawley di Janvier Labs con un peso dell'ordine di 400 g.
1. Preparazione della procedura (Figura 1)
- Preparare i ganci per la preparazione chirurgica piegando le cannule con un angolo di 135° a 1 cm rispetto alla punta, collegandole a tubi di perfusione in plastica tramite Luer-lock e applicando tensione utilizzando una pinza chirurgica per zanzare (Figura 1A, B).
- Preparare un apparecchio chirurgico per l'esposizione ai roditori.
NOTA: Oltre alla disponibilità di piattaforme commerciali, queste possono anche essere facilmente costruite in modo economico ed economico, come in questo studio.- Per questo, utilizzare una piastra in acciaio di 40 cm x 50 cm con uno spessore di 4 mm. Creare diversi fori da 8 mm utilizzando un trapano in acciaio nella posizione desiderata per i punti di tensione successivi. Posizionare le aste di fissaggio a forma di Y in queste posizioni.
- Posizionare un termoforo sopra la piastra d'acciaio dell'apparecchio chirurgico per fornire un supporto termico.
- Preparare i ganci di preparazione chirurgica con i tubi di plastica attaccati e le pinze chirurgiche per zanzare per applicare successivamente la tensione al tessuto per l'esposizione chirurgica.
- Rimuovere il tappo di una siringa di plastica da 10 ml con un'estremità Luer-lock maschio e tagliare l'estremità prossimale della siringa. Inserire la parte distale nella sacca di ventilazione come illustrato e sigillarla ermeticamente coprendola con un tubo termorestringente e applicando un calore delicato utilizzando una torcia da laboratorio (Figura 1D-F).
- Accorciare e smussare cateteri endovenosi di diverse dimensioni e inserire un filo guida da un set di catetere arterioso con l'estremità del filo flessibile sulla punta nella dimensione del catetere più appropriata per la rispettiva taglia dell'animale (presumibilmente 14 G) per la successiva tecnica di Seldinger22,23 durante l'intubazione (Figura 1G, H).
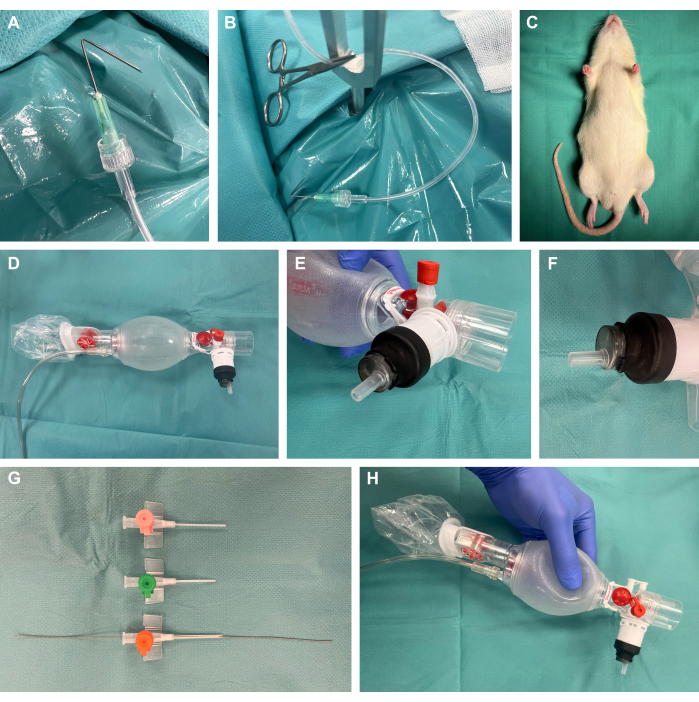
Figura 1: Configurazione sperimentale. (A) Una cannula piegata collegata a un tubo di perfusione utilizzato come gancio per la preparazione chirurgica. (B) Gancio di preparazione con morsetto posizionato in un'asta di fissaggio metallica. (C) Animale sedato prima dell'intervento. (D) Sacca di ventilazione da neonatologia. (E-F) Montaggio ermetico di una siringa Luer-lock sulla sacca di ventilazione utilizzando un tubo termoretraibile. (G) Cateteri endovenosi accorciati e smussati di diverse dimensioni con un filo guida da un set di cateterismo arterioso per la tecnica di Seldinger. (H) Costruzione finale su misura. Clicca qui per visualizzare una versione più grande di questa figura.
2. Anestesia e analgesia
- Anestetizzare il ratto con il farmaco di scelta.
NOTA: Qui, l'anestesia e l'analgesia sono state stabilite utilizzando ketamina 10% (100 mg/mL), xilazina 2% (20 mg/mL), carprofene 50 mg/mL e isoflurano. Una diluizione 1:10 di xilazina e carprofene sono stati utilizzati come soluzioni stock per l'applicazione.- Indurre l'anestesia mettendo l'animale in una scatola di induzione inondata di ossigeno al 100% a una velocità di afflusso di 5 L/min integrata dal 4% (v) di isoflurano utilizzando un vaporizzatore.
- Dopo aver raggiunto lo stato di incoscienza, rimuovere l'animale dalla scatola di induzione e iniettarlo (i.p.) con 100 mg/kg di peso corporeo di ketamina e 4 mg/kg di peso corporeo di xilazina.
NOTA: Ciò corrisponde a 40 mg di ketamina (0,4 ml della soluzione originale) e 1,6 mg di xilazina (0,08 ml della soluzione originale o 0,8 ml della soluzione 1:10) per un animale da 400 mg. - Rimetti l'animale nella scatola di induzione inondata di isoflurano fino a quando non si manifesta l'effetto dell'iniezione i.p.
- Garantire un'adeguata profondità dell'anestesia testando la mancanza di risposta del ratto a un fermo pizzicamento del dito.
- Applicare un unguento oftalmico sugli occhi.
- Valutare e mantenere la profondità dell'anestesia durante l'intervento chirurgico.
- Quando gli effetti narcotici sembravano diminuire nel tempo (circa ogni ora), iniettare (s.c) all'animale altri 50 mg/kg di peso corporeo di ketamina e 1 mg/kg di peso corporeo di xilazina. Ciò corrisponde a 20 mg di ketamina (0,2 mL della soluzione originale) e 0,4 mg di xilazina (0,2 mL della soluzione 1:10) per un animale da 400 mg.
- Fornire ulteriore analgesia prima della toracotomia con un'iniezione s.c. di 5 mg/kg di peso corporeo di carprofene. Ciò corrisponde a 2 mg di carprofene (0,04 mL della soluzione originale o 0,4 mL della soluzione 1:10) per un animale da 400 mg.
3. Preparazione chirurgica (Figura 2)
- Saturare la circolazione animale con ossigeno offrendo l'inalazione di ossigeno al 100% tramite una maschera neonatale transnasale (Figura 2A).
- Dopo 5 minuti, passare dalla maschera neonatale transnasale alla costruzione di una sacca di ventilazione neonatale con una siringa di plastica maschile con punta Luer-lock come descritto sopra e offrire ossigeno in eccesso con la punta della siringa vicino alla punta nasale dell'animale (Figura 2B).
- Eseguire un'incisione cutanea toracocervicale mediana per la lunghezza desiderata ed esporre il sito chirurgico utilizzando i ganci di preparazione chirurgica (Figura 2C, D).
- Far avanzare la preparazione mediante dissezione smussata con forbici sottili attraverso la fascia cervicale. Esporre il muscolo sternocleidomastoideo e infraioideo e lateralizzare il muscolo infraioideo mediano a destra dopo la dissezione della membrana laterale sinistra (Figura 2E-G).
- Eseguire la dissezione smussata verso la trachea e il tunneling della trachea utilizzando i morsetti overholt (Figura 2H-I).
- Imbracare la trachea utilizzando un anello vascolare in silicone e imbracare la trachea distale utilizzando una sutura in polifilamento per la successiva fissazione della cannula endotracheale (Figura 2J-N).

Figura 2: Preparazione della trachea. (A) Inalazione di ossigeno tramite maschera. (B) Passare dalla maschera alla siringa Luer-lock maschile per l'applicazione di ossigeno. (C) Incisione cutanea toracocervicale. (D) Preparazione attraverso la fascia cervicale. (E) esposizione del muscolo sternocleidomastoideo e del muscolo infraioideo. (F) Lateralizzazione del muscolo infraioidale mediano. (G) Dissezione smussata verso la trachea. (H) tunneling della trachea mediante morsetti overholt. (I) Imbracatura della trachea utilizzando un anello del vaso in silicone. (J-N) Doppia imbracatura caudale della trachea utilizzando una sutura in polifilamento per la successiva fissazione della cannula endotracheale. Clicca qui per visualizzare una versione più grande di questa figura.
4. Procedura di intubazione (Figura 3)
- Allungare caudalmente la trachea utilizzando una pinza atraumatica (Figura 3A, B).
- Eseguire un'incisione parziale della trachea di 180° di circonferenza utilizzando le forbici (Figura 3C-F).
- Introdurre un filo guida di Seldinger con l'estremità flessibile nella trachea (Figura 3G-H) e successivamente introdurre il catetere endovenoso modificato di circonferenza appropriata nella trachea guidata dal filo di Seldinger (Figura 3I-N).
- Rimuovere il filo di Seldinger (Figura 3O), collegare la punta Luer-lock del catetere tracheale alla sacca di ventilazione modificata e avviare una delicata ventilazione manuale polmonare protettiva con alta frequenza e basso volume corrente (Figura 3P). Eseguire la ventilazione manuale fino a quando non è stata eseguita la toracotomia mediana e il polmone non è in bella vista.
- Legare la sutura di bloccaggio precedentemente posizionata con un nodo scorrevole per evitare perdite aeree e rimozione accidentale del catetere (Figura 3Q-T).

Figura 3: Intubazione endotracheale tramite tracheotomia. (A) Situazione iniziale dopo la preparazione. (B) Allungamento caudale della trachea mediante pinze atraumatiche. (C-F) Incisione parziale della trachea di 180° di circonferenza. (G,H) Introduzione di un filo guida Seldinger nella trachea. (I-M) Introduzione del catetere endovenoso modificato nella trachea guidata dal filo di Seldinger. (N-O) Rimozione del filo di Seldinger. (P) Collegamento Luer-lock del catetere tracheale alla sacca di ventilazione modificata. (Q-T) Legatura della sutura di bloccaggio precedentemente posizionata per evitare la rimozione accidentale del catetere. Clicca qui per visualizzare una versione più grande di questa figura.
5. Ventilazione manuale e toracotomia mediana (Figura 4)
- Iniziare la toracotomia mediana dallo xifoide utilizzando forbici di materiale smussate e stabili (Figura 4A, B) e continuare cranialmente attraverso lo sterno. Mettere sempre in pausa la ventilazione per alcuni secondi quando si avanza con le forbici sottosternalmente e quando si taglia per evitare traumi al polmone (Figura 4C-E).
- Ottenere l'esposizione toracica utilizzando i ganci di preparazione chirurgica e rimuovere le membrane sierose mediastiniche (Figura 4F-H).
- Continuare la ventilazione manuale con la frequenza e il volume corrente desiderati ed espandere il monitoraggio (ad esempio, stabilire una misurazione della pressione arteriosa intra-arteriosa, installare un catetere arterioso venoso centrale o polmonare a seconda dello scopo o della rispettiva domanda di ricerca) (Figura 4I-L).

Figura 4: Ventilazione manuale e toracotomia mediana. (A) situazione iniziale dopo l'intubazione. (B-E) Toracotomia mediana a partire dallo xifoide. (F-I) Esposizione toracica mediante ganci di preparazione chirurgica. (J) Configurazione finale durante la ventilazione. (K-L) il processo di ventilazione manuale. Clicca qui per visualizzare una versione più grande di questa figura.
6. Eutanasia
- Raggiungere l'eutanasia mediante cardiectomia brusca e acuta usando le forbici nell'animale profondamente anestetizzato.
Risultati
L'intubazione endotracheale tramite tracheotomia e successiva toracotomia è stata eseguita in 10 ratti maschi (peso medio 405 ± 30 g) per applicazioni non di sopravvivenza. La procedura è stata eseguita da uno specializzando in chirurgia del secondo anno. Il tasso di successo definito dalla sopravvivenza oltre 20 minuti di intubazione e ventilazione è stato del 100%. La durata media della procedura di preparazione e intubazione dall'incisione cutanea fino al fissaggio del tubo di intubazione è stata di 6:55 ± 0:53 min (Tabella 1).
| Numero di animali utilizzati | 10 |
| Peso corporeo (media e deviazione standard) | 405 ± 30 g |
| Tasso di successo dell'intubazione | 100% |
| Durata della procedura (media e deviazione standard) | 6:55 ± 0:53 min |
| Saturazione media di ossigeno | 96% |
| Saturazione minima di ossigeno | 92% |
Tabella 1: Risultati rappresentativi. Risultati rappresentativi del protocollo in 10 animali.
La saturazione è stata monitorata attraverso una sonda monouso auto-ossimetrica sulla zampa posteriore e non è mai scesa al di sotto del 92%. La ventilazione spontanea è stata contenuta fino all'incisione del diaframma. Tutti i ratti sono sopravvissuti ai 20 minuti necessari per le misurazioni sperimentali fino all'eutanasia intenzionale attraverso una brusca cardiectomia acuta (Figura 5).

Figura 5: Saturazione periferica di ossigeno. Saturazione periferica di ossigeno misurata per l'intera durata di questa procedura. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Solo negli Stati Uniti, circa 110 milioni di ratti e topi vengono utilizzati negli esperimenti sugli animali ogni anno24. Sebbene non sia possibile trovare statistiche affidabili, una percentuale rilevante di questi riceverà una ventilazione supportata, soprattutto nel campo della ricerca polmonare e cardiaca e dell'anestesiologia. La maggior parte di questi animali riceve un'intubazione endoorotracheale non invasiva, che comporta una serie di sfide. Questi includono curve di apprendimento più lente, tassi più elevati di fallimento dell'intubazione, un numero maggiore di reintubazioni e complicanze respiratorie associate, nonché perdite respiratorie25. L'intubazione non invasiva, quindi, richiederà generalmente personale di ricerca più esperto, tecnologie più avanzate come fibre ottiche, capnometria e ventilatori meccanici e maggiori risorse finanziarie e materialistiche26. L'intero aspetto dell'intubazione è, quindi, un fattore confondente significativo rilevante nelle successive analisi statistiche e nell'eterogeneità interindividuale dei risultati. Tuttavia, l'intubazione endoorotracheale non invasiva è spesso l'unica opzione praticabile nei disegni di esperimenti longitudinali.
Le alternative sono la tracheostomia per l'accesso tracheale a lungo termine richiesto negli esperimenti longitudinali o la tracheotomia chirurgica per "monouso" negli esperimenti non di sopravvivenza. Sebbene siano disponibili27 protocolli sulla tecnica microchirurgica per la tracheostomia nei ratti, attualmente non esistono protocolli per l'intubazione endotracheale tramite tracheotomia nei modelli di ratto non sopravviventi.
La procedura standardizzata qui descritta per l'intubazione endotracheale tramite tracheotomia e successiva toracotomia nei ratti, quindi, rappresenta un metodo prezioso per i ricercatori impegnati in studi di non sopravvivenza. Questa procedura non richiede né personale esperto né una formazione approfondita. Ha un tasso di successo dell'intubazione molto più alto dell'intubazione endoorotracheale e consente passaggi procedurali molto più controllati.
I limiti delle tecniche presentate includono principalmente l'invasività della procedura e, consecutivamente, l'esclusiva compatibilità con esperimenti di non sopravvivenza. A causa dei grandi difetti della pelle e dei tessuti molli, nonché della fistola tracheale incisionale, l'estubazione e il recupero da questa procedura non sono né fattibili né raccomandati, soprattutto se combinati con la toracotomia.
Durante la risoluzione delle sfide comuni incontrate durante la procedura, vorremmo attirare l'attenzione sui seguenti punti e raccomandazioni: si dovrebbero preparare attrezzature e farmaci il più ampiamente possibile. Lo sperimentatore deve eseguire meticolosamente il controllo emostatico mediante una preparazione fine e l'uso di tamponi di cotone non traumatici. Lo sperimentatore deve preparare la trachea su una lunghezza di almeno 0,5 cm per consentire una mobilità sufficiente e utilizzare l'anello del vaso in silicone per non perdere la trachea dopo l'incisione, poiché ciò può provocare aspirazione e soffocamento quando la trachea viene persa nella profondità del tessuto a causa del fenomeno dello sfondo. Incidere solo parzialmente la trachea con un chiaro colpo di forbice. Idealmente, si dovrebbe incidere 180° di circonferenza. Al di sotto di questo valore potrebbe verificarsi la mancata intubazione. Al di sopra di questo potrebbe verificarsi lo schiocco della trachea con retrazione di entrambe le estremità nella profondità del tessuto e successivo soffocamento. Quando si lega la sutura in polifilamento per fissare il tubo di intubazione, è necessario utilizzare un nodo scorrevole per garantire una tenuta sufficiente per evitare perdite d'aria o lussazioni accidentali del tubo, evitando allo stesso tempo la chiusura involontaria del tubo. Lasciare il filo di Seldinger in posizione durante la sutura può evitare la chiusura involontaria. Quando si esegue la ventilazione manuale utilizzando la sacca di ventilazione, si dovrebbe evitare rigorosamente il barotrauma del polmone da parte di volumi correnti elevati. Invece, si dovrebbe piuttosto mirare alla ventilazione polmonare protettiva, ad alta frequenza e a bassa corrente, soprattutto finché non è stata eseguita la toracotomia e i volumi polmonari non possono essere valutati visivamente.
Offrendo una metodologia dettagliata e riproducibile, questo protocollo facilita la standardizzazione delle procedure sperimentali, migliorando l'affidabilità e la comparabilità dei dati tra gli studi. Di conseguenza, questo metodo contribuisce al perfezionamento delle tecniche scientifiche nella ricerca preclinica, migliorando in ultima analisi la rilevanza traslazionale dei risultati nei campi della fisiologia, della farmacologia, delle scienze chirurgiche e biomediche.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano il servizio di archiviazione dei dati SDS@hd sostenuto dal Ministero della Scienza, della Ricerca e delle Arti del Baden-Württemberg (MWK) e dalla Fondazione tedesca per la ricerca (DFG) attraverso le sovvenzioni INST 35/1314-1 FUGG e INST 35/1503-1 FUGG. Inoltre, gli autori riconoscono con gratitudine il supporto dell'NCT (National Center for Tumor Diseases di Heidelberg, Germania) attraverso il suo programma post-dottorato strutturato e il programma di oncologia chirurgica. Ringraziamo inoltre il sostegno attraverso i fondi statali approvati dal Parlamento del Land Baden-Württemberg per l'Innovation Campus Health + Life Science Alliance Heidelberg Mannheim dal programma postdoc strutturato per Alexander Studier-Fischer: Artificial Intelligence in Health (AIH) - Una collaborazione di DKFZ, EMBL, Università di Heidelberg, Ospedale universitario di Heidelberg, Ospedale universitario di Mannheim, Istituto centrale di salute mentale, e l'Istituto Max Planck per la ricerca medica. Inoltre, ringraziamo il supporto attraverso il DKFZ Hector Cancer Institute presso il Centro medico universitario di Mannheim. Per il pagamento del canone di pubblicazione, ringraziamo il sostegno finanziario della Deutsche Forschungsgemeinschaft nell'ambito del programma di promozione "Open Access Publikationskoste" e dell'Università di Heidelberg.
Materiali
| Name | Company | Catalog Number | Comments |
| Ambu Spur II Single-Use ventilation bag for neonates | Meier Medizintechnik | 335 102 000 | Ventilation bag |
| BD Microlance 3 cannula 20 G | BD (Beckton, Dickinson) | 301300 | Cannula |
| BD Microlance Discardit II 20 mL Syringe | BD (Beckton, Dickinson) | 300296 | Plastic syringe |
| Fixation rods | Legefirm | 500343896 | Tuning forks used as y-shaped metal fixation rods |
| Heat-shrinking tube | Sekesoer | RSG-400 | Heat-shrinking tube |
| Intravenous catheter | BD (Beckton, Dickinson) | 393230 | BD Venflon Pro Safety intravenous catheter 14 G; shortened using scissors; alternatively 16 G or 18 G can be used |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | Connecting tube COEX 150 cm |
| Polyfilament suture | COVIDIEN | CL331 | Polyfilament surgical suture recommended with a strength of 1 to 2; needle can be removed |
| Royal Gardineer Heating Pad Size S, 20 Watt | Royal Gardineer | IP67 | Heating pad |
| Seldinger guide wire | VYGON | 115.798 | Metal guide wire from the arterial leadercath set |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | Silicone vessel loop tie 2.5 mm red |
| Spraque Dawley rats | Janvier Labs | Male rats weighing 400 grams | |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
Riferimenti
- Czigany, Z., et al. Limb remote ischemic conditioning of the recipient protects the liver in a rat model of arterialized orthotopic liver transplantation. PLoS One. 13 (4), e0195507 (2018).
- Czigány, Z., et al. Improving research practice in rat orthotopic and partial orthotopic liver transplantation: A review, recommendation, and publication guide. Eur Surg Res. 55 (1-2), 119-138 (2015).
- Nagai, K., Yagi, S., Uemoto, S., Tolba, R. H. Surgical procedures for a rat model of partial orthotopic liver transplantation with hepatic arterial reconstruction. J Vis Exp. 73, e4376 (2013).
- Jahshan, F., et al. A novel rat model for assessment of laryngotracheal injury following transoral intubation. Int J Pediatr Otorhinolaryngol. 113, 4-10 (2018).
- Lamoureux, L., Radhakrishnan, J., Gazmuri, R. J. A rat model of ventricular fibrillation and resuscitation by conventional closed-chest technique. J Vis Exp. 98, 52413 (2015).
- Wang, Z., et al. Autoinducer-2 of streptococcus mitis as a target molecule to inhibit pathogenic multi-species biofilm formation in vitro and in an endotracheal intubation rat model. Front Microbiol. 7, 88 (2016).
- Jahshan, F., et al. A novel rat model for tracheal mucosal damage assessment of following long term intubation. Int J Pediatr Otorhinolaryngol. 128, 109738 (2020).
- Rivard, A. L., et al. Rat intubation and ventilation for surgical research. J Invest Surg. 19 (4), 267-274 (2006).
- Na, N., Zhao, D. Q., Huang, Z. Y., Hong, L. Q. An improved method for rat intubation and thymectomy. Chin Med J (Engl). 124 (17), 2723-2727 (2011).
- Cicero, L., Fazzotta, S., Palumbo, V. D., Cassata, G., Lo Monte, A. I. Anesthesia protocols in laboratory animals used for scientific purposes. Acta Biomed. 89 (3), 337-342 (2018).
- Fuentes, J. M., et al. Videoendoscopic endotracheal intubation in the rat: A comprehensive rodent model of laparoscopic surgery. J Surg Res. 122 (2), 240-248 (2004).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Lazopoulos, A., et al. Open thoracotomy for pneumothorax. J Thorac Dis. 7 (S1), S50-S55 (2015).
- Rendell, V. R., Giamberardino, C., Li, J., Markert, M. L., Brennan, T. V. Complete thymectomy in adult rats with non-invasive endotracheal intubation. J Vis Exp. 94, 52152 (2014).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. 86, 50269 (2014).
- Nelson, A. M., Nolan, K. E., Davis, I. C. Repeated orotracheal intubation in mice. J Vis Exp. 157, 60844 (2020).
- Das, S., Macdonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. 73, e50318 (2013).
- Massick, D. D., et al. Quantification of the learning curve for percutaneous dilatational tracheotomy. Laryngoscope. 110 (2 Pt 1), 222-228 (2000).
- Giugliano, G., et al. Learning curve for translaryngeal tracheotomy in head and neck surgery. Laryngoscope. 111 (4 Pt 1), 628-633 (2001).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesth Analg. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Ann Emerg Med. 60 (6), 749-754.e742 (2012).
- Titu, I. M., Delaca, G. B., Teterea, F., Ciulic, S. A., Palade, E. Percutaneous tracheostomy using the Seldinger technique. Multimed Man Cardiothorac Surg. 2023, (2023).
- Garry, B. P., Bivens, H. E. The Seldinger technique. J Cardiothorac Anesth. 2 (3), 403 (1988).
- Carbone, L. Estimating mouse and rat use in American laboratories by extrapolation from animal welfare act-regulated species. Sci Rep. 11 (1), 493 (2021).
- Su, C. S., et al. Efficacious and safe orotracheal intubation for laboratory mice using slim torqueable guidewire-based technique: Comparisons between a modified and a conventional method. BMC Anesthesiol. 16, 5 (2016).
- Clary, E. M., O'halloran, E. K., De La Fuente, S. G., Eubanks, S. Videoendoscopic endotracheal intubation of the rat. Lab Anim. 38 (2), 158-161 (2004).
- Ghali, M. G. Z. Microsurgical technique for tracheostomy in the rat. MethodsX. 5, 61-67 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon