Method Article
非生存アプリケーションのためのラットにおける気管切開術およびその後の開胸術による気管内挿管術
要約
ここでは、気管切開術とそれに続く開胸術によるラットの気管内挿管の標準化された手順を紹介します。これは、 in vivo ラットモデルで胸部臓器の侵襲的換気と曝露を必要とする非生存アプリケーションの精度と再現性を高めることを目的としています。
要約
気管内挿管とその後の換気は、制御された換気圧または高い換気圧、または胸腔や臓器へのアクセスを必要とするさまざまな介入のためのラットモデルでのトランスレーショナルリサーチの基本的な要件であることがよくあります。解剖学的に存在する口を通る経路を使用した従来の気管内挿管は、生存実験に適しています。ただし、この手順には、一般的に必要な経験と技術スキルのレベルが高い、より高度な機器、関連する挿管の失敗率や気管穿孔、一時的な全身性低酸素化、関連する空中漏れなどの合併症を伴う時間の労力の増加など、いくつかの課題があります。
したがって、この原稿では、非生存ラットモデルにおける気管切開による気管内挿管術の詳細なステップバイステップのプロトコルを示しています 挿管の成功が保証され、一定の酸素レベル、高い換気圧、または開胸術が必要な場合。
このプロトコルは、特に直接喉頭鏡検査による気管内挿管の技術に経験が浅い、またはルーチンが不足している研究者にとって、一貫した信頼性の高い結果を確保するために、細心の注意を払った外科的技術の重要性を強調しています。したがって、この手順により、動物の苦痛と不必要な動物の損失を最小限に抑えることが期待されます。
概要
一般に、げっ歯類は患者よりもはるかに長く呼吸困難を補うことができます。それらは、自発換気の下で、より侵襲的な処置中、例えば、心肺循環にとって最もストレスの多い処置の1つであることが知られている肝移植を通じてさえ、はるかに長く、心循環を安定させ、十分に維持することができる1,2,3。
しかし、気管内挿管は、さまざまな生物医学分野に由来するさまざまな設定や介入のためのラットモデルでのトランスレーショナルリサーチの基本的な要件であり、今日の科学界では不可欠です4,5,6,7,8,9,10,11 .一般的にラットで行われる実験動物研究の大部分は、依然として侵襲的換気を必要としない12が、挿管および制御された換気補助を必要とする特定の実験セットアップがある。これらの実験装置には、気道の確保、高い換気圧、腹腔鏡検査、または胸腔や臓器への直接アクセスを必要とするあらゆる実験が含まれます。
特に胸腔や臓器へのアクセスが必要な場合、肺の虚脱により致命的な呼吸不全につながるため、気管内挿管が不可欠です 胸腔内の陰圧と肋間筋と横隔膜による吸気メカニズムが失われると13。
げっ歯類 14,15,16,17 の非侵襲的気管内挿管の方法に関する多くの出版物がありますが、気管切開による侵襲的気管内挿管の手順プロトコルが不足しているようです。後者は侵襲性があり、非生存動物モデルにしか適用できませんが、気管切開による挿管には大きな利点があります。これらには、学習曲線の急化、成功率の向上と持続性の向上、必要な技術機器の減少、成功監視の機会の改善などが含まれます18,19。
挿管の成功は結果に不可欠です。さまざまな誤挿管や、患者における挿管の繰り返しの試みは、明らかに有害事象や死亡20,21のような重篤な合併症と関連していますが、そのような事象は試験動物でも有害です。最良の場合、それらは実験で強い交絡変数を表しますが、動物の不必要な損失につながる可能性もあります。したがって、実験の設定と戦略が許す限り、非侵襲性を犠牲にして挿管の成功率を高めることは理にかなっています。
外科的気管切開による挿管のこの標準化されたプロトコルには、挿管成功率の変動性の低減、心肺生理学的パラメーターへの影響の最小化、パラメーターの完全な調査制御と操作など、いくつかの利点があります。これは、特に直接喉頭鏡検査による気管内挿管の手順で経験の浅い研究者に安全な気道を提供するのに役立ち、研究者が高度に制御された条件下で非生存研究を行うことを可能にします。主要な解剖学的ランドマークを強調し、手順中に遭遇する一般的な課題のトラブルシューティングに関する洞察を提供します。
プロトコル
ここに記載されているすべての動物活動は、ドイツのカールスルーエにあるバーデン・ヴュルテンベルク州地域評議会の動物管理・使用委員会(IACUC)によって承認されています。実験動物は、動物の使用と世話に関するドイツの法律、欧州共同体理事会(2010/63/EU)の指令、およびARRIVEガイドラインに従って、施設の基準に従って管理され、認定施設で実施されました。Janvier LabsのSpraque Dawleyラットの雄で、注文重量が400 gでした。
1. 手続きの準備(図1)
- カニューレを先端から1cmの角度で135°の角度で折り畳み、ルアーロックを介してプラスチック製の灌流チューブに接続し、外科用蚊クランプを使用して張力を加えて、外科用準備フックを準備します(図1A、B)。
- げっ歯類の外科的曝露装置を準備します。
注:商用プラットフォームの可用性に加えて、この研究のように、これらもコスト効率よく自己構築することもできます。- これには、厚さ4mmの40cm×50cmの鋼板を使用します。スチールドリルを使用して、後続のテンションポイントの目的の位置にいくつかの8mmの穴を作成します。Y字型の固定ロッドをこれらの場所に置きます。
- 外科的暴露装置の鋼板の上に加熱パッドを置き、熱サポートを提供します。
- プラスチックチューブと外科用蚊クランプを取り付けた手術準備フックを準備し、後で組織に張力をかけて外科的に曝露します。
- オスのルアーロックエンドが付いた10 mLプラスチックシリンジのプラグを取り外し、シリンジの近位端を切り取ります。.図のように遠位部を換気バッグに挿入し、熱収縮チューブで覆い、実験室用トーチを使用して穏やかな熱を加えて気密に密閉します(図1D-F)。
- さまざまなサイズの静脈内カテーテルを短くして面取りし、先端に柔軟なワイヤー端を持つ動脈リーダーカテーテルセットから、挿管中の後続のセルディンガー技術22,23のそれぞれの動物サイズ(おそらく14G)に最も適したカテーテルサイズにガイドワイヤーを挿入します(図1G、H)。
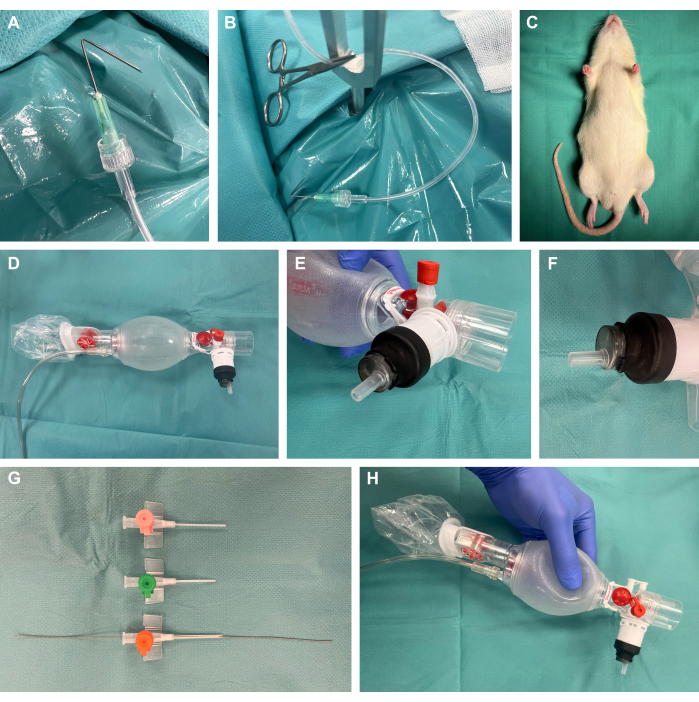
図1:実験セットアップ(A)手術準備フックとして使用される灌流チューブに接続された折り畳まれたカニューレ。(B)金属製の固定ロッドに配置されたクランプ付き準備フック。 (C)介入前に鎮静させた動物。(D)新生児科の換気バッグ。(E-F)ルアーロックシリンジを熱収縮チューブを使用して換気バッグに気密取り付けします。(G)セルディンガー法用の動脈リーダーキャスセットからのガイドワイヤーを使用して、さまざまなサイズの短く面取りされた静脈内カテーテル。(H)最終的なカスタムビルド構造。この図の拡大版を表示するには、ここをクリックしてください。
2.麻酔と鎮痛
- 選択した薬でラットに麻酔をかけます。
注:ここでは、麻酔と鎮痛は、ケタミン10%(100 mg / mL)、キシラジン2%(20 mg / mL)、カルプロフェン50 mg / mL、およびイソフルランを使用して確立されました。.キシラジンとカルプロフェンの1:10希釈液を塗布用のストック溶液として使用しました。- 気化器を使用して、5 L / minの流入速度で100%酸素が充填された誘導ボックスに動物を置き、4%(v)のイソフルランで補完することにより、麻酔を誘発します。
- 意識を失った後、動物を誘導ボックスから取り出し、100 mg / kg体重ケタミンと4 mg / kg体重キシラジンを注射します(i.p.)。
注:これは、400 mgの動物に対して40 mgのケタミン(元の溶液0.4 mL)と1.6 mgのキシラジン(元の溶液0.08 mLまたは0.8 mLの1:10溶液)に相当します。. - I.P.注射の効果が始まるまで、動物をイソフルラン浸水誘導ボックスに戻します。
- つま先の固いつま先をつまむことに対するラットの反応の欠如をテストすることにより、適切な麻酔の深さを保証します。
- 眼科用軟膏を目に塗ります。
- 手術中の麻酔の深さを評価し、維持します。
- 麻薬効果が時間の経過とともに(約1時間ごとに)減少したように見えた場合は、動物に追加の50 mg / kg体重ケタミンと1 mg / kg体重キシラジンを注射します(sc)。.これは、400 mgの動物に対して20 mgのケタミン(元の溶液の0.2 mL)と0.4 mgのキシラジン(1:10溶液の0.2 mL)に相当します。
- 開胸術の前に、5 mg / kg体重カルプロフェンの皮下注射で追加の鎮痛を提供します。.これは、400 mgの動物に対して2 mgのカルプロフェン(元の溶液0.04 mLまたは1:10溶液の0.4 mL)に相当します。.
3. 手術準備(図2)
- 経鼻新生児マスクを介して100%酸素を吸入することにより、動物の循環を酸素で飽和させます(図2A)。
- 5分後、経鼻新生児マスクから、上記のように男性用プラスチックシリンジルアーロックチップを備えた新生児換気バッグの構造に切り替え、シリンジチップを動物の鼻先に近づけて酸素をオーバーフローさせます(図2B)。
- 胸頸部の中央部皮膚を所望の長さで切開し、手術準備フックを使用して手術場を露出させます(図2C、D)。
- 頸部筋膜を通して細かいはさみで鈍い解剖によって準備を進めます。胸鎖乳突筋と舌骨下筋を露出させ、左外側膜解剖後に正中舌骨下筋を右側に外側にします(図2E-G)。
- オーバーホルトクランプを使用して、気管に向かって鈍的解剖を行い、気管のトンネリングを行います(図2H-I)。
- シリコン血管ループを使用して気管をスリングし、後で気管内カニューレを固定するためにポリフィラメント縫合糸を使用して遠位気管をダブルスリングします(図2J-N)。

図2:気管の準備 (A)マスクによる酸素の吸入。(B)酸素塗布用のマスクからオス型ルアーロックシリンジに切り替えます。(C)胸部頸部皮膚切開。(D)頸部筋膜を介した準備。(E)胸鎖乳突筋および舌骨下筋の露出。(F)舌骨下筋の中央部の側方化。(G)気管に向かって鈍的解剖。(H)オーバーホルトクランプを使用した気管のトンネリング。 (I)シリコン血管ループを使用した気管のスリング。(J-N)ポリフィラメント縫合糸を使用した気管の尾側ダブルスリングで、後の気管内カニューレ固定術を行います。この図の拡大版を表示するには、ここをクリックしてください。
4. 挿管手順(図3)
- 非外傷性ペンチを使用して気管を尾側に伸ばします(図3A、B)。
- はさみを使用して、気管の円周180°の部分切開を行います(図3C-F)。
- フレキシブルエンドを備えたセルディンガーガイドワイヤーを気管に導入し(図3G-H)、続いて適切な胴回りの修正された静脈内カテーテルをセルディンガーワイヤーによってガイドされた気管に導入します(図3I-N)。
- セルディンガーワイヤーを取り外し(図3O)、気管カテーテルのルアーロックチップを変更された換気バッグに接続し、高周波で低潮汐量で穏やかな肺保護手動換気を開始します(図3P)。正中開胸術が行われておらず、肺が目立たないように、手動換気を行います。
- 前に配置したロッキング縫合糸をスライド式の結び目で結び、空気漏れや偶発的なカテーテルの抜去を防ぎます(図3Q-T)。

図3:気管切開による気管内挿管術 (A)準備後の初期状況。(B)非外傷性ペンチを使用した気管の尾側延長。(C-F)円周180°の気管の部分切開。(G,H)セルディンガーガイドワイヤーを気管に導入。(I-M)セルディンガーワイヤーによって導かれる気管への修正された静脈内カテーテルの導入。(N-O)セルディンガーワイヤーの取り外し。(P)気管カテーテルと改造されたベンチレーションバッグのルアーロック接続。(Q-T)誤ってカテーテルを抜かないように、以前に配置したロック縫合糸を結ぶ。この図の拡大版を表示するには、ここをクリックしてください。
5. 手動換気と中央切胸術(図4)
- 鈍くて安定した材料のはさみを使用して剣状突起から正中開胸術を開始し (図 4A、B)、胸骨を頭蓋状に続けます。肺への外傷を避けるために、はさみで大幅に前進するとき、および切断するときは、常に換気を数秒間一時停止してください(図4C-E)。
- 外科的製剤フックを使用して胸部に露出し、縦隔漿膜を切除します(図4F-H)。
- 希望の周波数と一回換気量で手動換気を継続し、モニタリングを拡大します(例:動脈内血圧測定の確立、目的またはそれぞれの研究課題に応じて中心静脈または肺動脈カテーテルの設置)(図4I-L)。

図4:手動換気と開胸術の中央値(A)挿管後の初期状況。(B-E)剣状突起から始まる正中開胸術。(F-I)外科的製剤フックを使用した胸部への曝露。(J)換気中の最終セットアップ。(KL)手動換気のプロセス。この図の拡大版を表示するには、ここをクリックしてください。
6.安楽死
- 深く麻酔をかけられた動物にハサミを使用して突然の鋭い心臓摘出術を行うことにより、安楽死を達成します。
結果
気管切開術による気管内挿管とその後の開胸術は、非生存適用のために10匹の雄ラット(平均体重405±30g)で行われました。手術は、2年目の外科研修医によって行われました。挿管と換気の20分以上の生存率によって定義される成功率は100%でした。皮膚切開から挿管チューブの固定までの準備と挿管手順の平均時間は6:55±0:53分でした(表1)。
| 使用した動物の数 | 10 |
| 体重(平均と標準偏差) | 405 ± 30グラム |
| 挿管成功率 | 100% |
| 処置期間(平均と標準偏差) | 6:55 ± 0:53 分 |
| 平均酸素飽和度 | 96% |
| 最小酸素飽和度 | 92% |
表1:代表的な結果。 10匹の動物におけるプロトコルの代表的な結果。
飽和度は、後肢の単回使用セルフスティックパルスオキシメトリープローブを介して監視され、92%を下回ることはありませんでした。自発換気は、横隔膜の切開まで封じ込められました。すべてのラットは、突然の鋭い心臓摘出術による意図的な安楽死まで、実験測定に必要な20分間生き残りました(図5)。

図5:末梢酸素飽和度。 この手順の全期間にわたって測定された末梢酸素飽和度。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
米国だけでも、年間約1億1000万匹のラットとマウスが動物実験に使用されています24。信頼できる統計は見つかりませんが、これらのうちの関連する割合は、特に呼吸器および心臓の研究、および麻酔学の分野で、サポートされている換気を受けます。これらの動物のほとんどは、非侵襲的な気管内挿管術を受けますが、これには多くの課題が伴います。これらには、学習曲線の遅さ、挿管失敗率の上昇、再挿管の回数の増加、および関連する呼吸器合併症、および呼吸器漏れが含まれます25。したがって、非侵襲的挿管には、一般的に、より経験豊富な研究スタッフ、光ファイバー、カプノメトリー、人工呼吸器などのより高度な技術、およびより大きな財政的および物質的なリソースが必要です26。したがって、挿管の全体的な側面は、その後の統計分析と結果の個々の不均一性に関連する意味のある交絡因子です。しかし、非侵襲的な気管内挿管は、縦断的な実験デザインにおいて唯一の実行可能な選択肢であることが多い。
代替案は、縦断的実験で必要な長期気管アクセスのための気管切開術、または非生存実験での「単回使用」のための外科的気管切開術です。ラットの気管切開術のための顕微手術技術に関するプロトコルは利用可能ですが27、現在、非生存ラットモデルでの気管切開による気管内挿管のプロトコルはありません。
したがって、ラットにおける気管切開術およびその後の開胸術による気管内挿管のための本明細書に記載の標準化された手順は、非生存研究に従事する研究者にとって貴重な方法である。この手順には、専門家の人員も広範なトレーニングも必要ありません。気管内挿管よりもはるかに高い挿管成功率を持ち、より制御された手順が可能になります。
提示された技術の限界には、主に手順の侵襲性、および連続して、非生存実験との排他的な互換性が含まれます。皮膚や軟部組織に大きな欠陥があり、切開性気管瘻もあるため、抜管やこの手順からの回復は、特に開胸術と併用した場合、実現可能ではなく、推奨もされません。
手順中に遭遇する一般的な問題をトラブルシューティングする際には、次の点と推奨事項に注意を喚起したいと思います:機器と薬をできるだけ広範囲に準備する必要があります。実験者は、細かい準備と非外傷性の綿棒を使用して、細心の注意を払って止血制御を行う必要があります。実験者は、十分な可動性を確保するために少なくとも0.5cmの長さで気管を準備し、切開後に気管を失わないようにシリコーン血管ループを使用する必要があります。はさみの1回の明確なストロークで気管を部分的にのみ切開します。理想的には、円周の180°を切開する必要があります。これを下回ると、挿管が失敗する可能性があります。.これを超えると、気管が折れ、両端が組織の深部に収縮し、その後窒息する可能性があります。ポリフィラメント縫合糸を結んで挿管チューブを固定する場合は、空気漏れや偶発的なチューブの脱臼を防ぐための十分な気密性を確保すると同時に、チューブの意図しない閉鎖を避けるために、スライドノットを使用する必要があります。縫合中にセルディンガーワイヤーを所定の位置に残しておくと、意図しない閉鎖を避けることができます。換気バッグを使用して手動換気を行うときは、高潮量による肺の圧外傷を厳密に避ける必要があります。むしろ、特に開胸術が行われておらず、肺容量を視覚的に評価できない限り、肺保護換気、高頻度換気、低潮換気を目指すべきです。
このプロトコルは、詳細で再現性のある方法論を提供することで、実験手順の標準化を促進し、データの信頼性と研究間の比較可能性を向上させます。その結果、この方法は前臨床研究における科学的技術の洗練に貢献し、最終的には生理学、薬理学、外科および生物医学の分野における知見の翻訳的関連性を高めます。
開示事項
著者は何も開示していません。
謝辞
著者らは、バーデン・ヴュルテンベルク州科学研究芸術省(MWK)とドイツ研究財団(DFG)が助成金INST 35/1314-1 FUGGおよびINST 35/1503-1 FUGGを通じて支援しているデータストレージサービスに感謝SDS@hd。さらに、著者らは、NCT(ドイツのハイデルベルクにある国立腫瘍疾患センター)から、構造化されたポスドクプログラムと外科腫瘍学プログラムを通じて支援されていることに感謝しています。また、バーデン・ヴュルテンベルク州議会が承認したイノベーション・キャンパス・ヘルス+ライフサイエンス・アライアンス・ハイデルベルク・マンハイムの支援を、Alexander Studier-Fischer: Artificial Intelligence in Health(AIH)の構造化ポスドク・プログラムから受けたものに感謝します - DKFZ、EMBL、ハイデルベルク大学、ハイデルベルク大学病院、マンハイム大学病院、メンタルヘルス中央研究所の協力 マックスプランク医学研究所。さらに、マンハイム大学医療センターのDKFZヘクターがん研究所を通じた支援に感謝します。出版料については、Deutsche Forschungsgemeinschaftが「Open Access Publikationskoste」の助成プログラムに所属し、ハイデルベルク大学が財政的支援を行っていることを認めています。
資料
| Name | Company | Catalog Number | Comments |
| Ambu Spur II Single-Use ventilation bag for neonates | Meier Medizintechnik | 335 102 000 | Ventilation bag |
| BD Microlance 3 cannula 20 G | BD (Beckton, Dickinson) | 301300 | Cannula |
| BD Microlance Discardit II 20 mL Syringe | BD (Beckton, Dickinson) | 300296 | Plastic syringe |
| Fixation rods | Legefirm | 500343896 | Tuning forks used as y-shaped metal fixation rods |
| Heat-shrinking tube | Sekesoer | RSG-400 | Heat-shrinking tube |
| Intravenous catheter | BD (Beckton, Dickinson) | 393230 | BD Venflon Pro Safety intravenous catheter 14 G; shortened using scissors; alternatively 16 G or 18 G can be used |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | Connecting tube COEX 150 cm |
| Polyfilament suture | COVIDIEN | CL331 | Polyfilament surgical suture recommended with a strength of 1 to 2; needle can be removed |
| Royal Gardineer Heating Pad Size S, 20 Watt | Royal Gardineer | IP67 | Heating pad |
| Seldinger guide wire | VYGON | 115.798 | Metal guide wire from the arterial leadercath set |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | Silicone vessel loop tie 2.5 mm red |
| Spraque Dawley rats | Janvier Labs | Male rats weighing 400 grams | |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
参考文献
- Czigany, Z., et al. Limb remote ischemic conditioning of the recipient protects the liver in a rat model of arterialized orthotopic liver transplantation. PLoS One. 13 (4), e0195507 (2018).
- Czigány, Z., et al. Improving research practice in rat orthotopic and partial orthotopic liver transplantation: A review, recommendation, and publication guide. Eur Surg Res. 55 (1-2), 119-138 (2015).
- Nagai, K., Yagi, S., Uemoto, S., Tolba, R. H. Surgical procedures for a rat model of partial orthotopic liver transplantation with hepatic arterial reconstruction. J Vis Exp. 73, e4376 (2013).
- Jahshan, F., et al. A novel rat model for assessment of laryngotracheal injury following transoral intubation. Int J Pediatr Otorhinolaryngol. 113, 4-10 (2018).
- Lamoureux, L., Radhakrishnan, J., Gazmuri, R. J. A rat model of ventricular fibrillation and resuscitation by conventional closed-chest technique. J Vis Exp. 98, 52413 (2015).
- Wang, Z., et al. Autoinducer-2 of streptococcus mitis as a target molecule to inhibit pathogenic multi-species biofilm formation in vitro and in an endotracheal intubation rat model. Front Microbiol. 7, 88 (2016).
- Jahshan, F., et al. A novel rat model for tracheal mucosal damage assessment of following long term intubation. Int J Pediatr Otorhinolaryngol. 128, 109738 (2020).
- Rivard, A. L., et al. Rat intubation and ventilation for surgical research. J Invest Surg. 19 (4), 267-274 (2006).
- Na, N., Zhao, D. Q., Huang, Z. Y., Hong, L. Q. An improved method for rat intubation and thymectomy. Chin Med J (Engl). 124 (17), 2723-2727 (2011).
- Cicero, L., Fazzotta, S., Palumbo, V. D., Cassata, G., Lo Monte, A. I. Anesthesia protocols in laboratory animals used for scientific purposes. Acta Biomed. 89 (3), 337-342 (2018).
- Fuentes, J. M., et al. Videoendoscopic endotracheal intubation in the rat: A comprehensive rodent model of laparoscopic surgery. J Surg Res. 122 (2), 240-248 (2004).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Lazopoulos, A., et al. Open thoracotomy for pneumothorax. J Thorac Dis. 7 (S1), S50-S55 (2015).
- Rendell, V. R., Giamberardino, C., Li, J., Markert, M. L., Brennan, T. V. Complete thymectomy in adult rats with non-invasive endotracheal intubation. J Vis Exp. 94, 52152 (2014).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. 86, 50269 (2014).
- Nelson, A. M., Nolan, K. E., Davis, I. C. Repeated orotracheal intubation in mice. J Vis Exp. 157, 60844 (2020).
- Das, S., Macdonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. 73, e50318 (2013).
- Massick, D. D., et al. Quantification of the learning curve for percutaneous dilatational tracheotomy. Laryngoscope. 110 (2 Pt 1), 222-228 (2000).
- Giugliano, G., et al. Learning curve for translaryngeal tracheotomy in head and neck surgery. Laryngoscope. 111 (4 Pt 1), 628-633 (2001).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesth Analg. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Ann Emerg Med. 60 (6), 749-754.e742 (2012).
- Titu, I. M., Delaca, G. B., Teterea, F., Ciulic, S. A., Palade, E. Percutaneous tracheostomy using the Seldinger technique. Multimed Man Cardiothorac Surg. 2023, (2023).
- Garry, B. P., Bivens, H. E. The Seldinger technique. J Cardiothorac Anesth. 2 (3), 403 (1988).
- Carbone, L. Estimating mouse and rat use in American laboratories by extrapolation from animal welfare act-regulated species. Sci Rep. 11 (1), 493 (2021).
- Su, C. S., et al. Efficacious and safe orotracheal intubation for laboratory mice using slim torqueable guidewire-based technique: Comparisons between a modified and a conventional method. BMC Anesthesiol. 16, 5 (2016).
- Clary, E. M., O'halloran, E. K., De La Fuente, S. G., Eubanks, S. Videoendoscopic endotracheal intubation of the rat. Lab Anim. 38 (2), 158-161 (2004).
- Ghali, M. G. Z. Microsurgical technique for tracheostomy in the rat. MethodsX. 5, 61-67 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved