Method Article
التمايز في المختبر للخلايا التائية CD4 + الساذجة إلى خلايا Th17 المسببة للأمراض في الماوس
* These authors contributed equally
In This Article
Summary
يصف هذا البروتوكول تمايز الخلايا التائية CD4 + T الساذجة إلى خلايا Th17 المسببة للأمراض في المختبر. على وجه التحديد ، عند دمجها مع نهج قائم على قياس التدفق الخلوي متعدد المعلمات ، يمكن الحصول على نقاء 90٪ من خلايا Th17 المسببة للأمراض من خلايا CD4 + T الساذجة باستخدام طريقة التمايز هذه.
Abstract
في المختبر تعد تقنيات تمايز الخلايا التائية ضرورية لكل من التحقيقات الوظيفية والميكانيكية للخلايا التائية CD4 + . تم ربط خلايا Th17 المسببة للأمراض بمجموعة واسعة من الأمراض في الآونة الأخيرة ، بما في ذلك التصلب المتعدد (MS) والتهاب المفاصل الروماتويدي ومتلازمة الضائقة التنفسية الحادة (ARDS) والإنتان واضطرابات المناعة الذاتية الأخرى. ومع ذلك ، فإن بروتوكولات التمايز في المختبر المعروفة حاليا تواجه صعوبة في تحقيق نقاء عال لخلايا Th17 المسببة للأمراض ، مع كفاءة الحث في كثير من الأحيان أقل من 50 ٪ ، وهو تحد رئيسي في التجارب في المختبر . في هذا البروتوكول ، نقترح بروتوكولا معززا للثقافة والتمايز في المختبر لخلايا Th17 المسببة للأمراض ، والذي يستخدم للتمييز المباشر بين خلايا CD4 + T الساذجة المعزولة من طحال الفئران إلى خلايا Th17 المسببة للأمراض. يوفر هذا البروتوكول تعليمات مفصلة حول عزل الخلايا الطحالية ، وتنقية الخلايا التائية CD4 + الساذجة ، وتمايز خلايا Th17 المسببة للأمراض. من خلال هذا البروتوكول ، يمكننا تحقيق نقاء تمايز بنسبة 90٪ تقريبا لخلايا Th17 المسببة للأمراض ، والتي تلبي الاحتياجات الأساسية للعديد من التجارب الخلوية.
Introduction
بعد مغادرة الغدة الصعترية ، تمر الخلايا الليمفاوية التائية CD4 + T الساذجة عبر الأعضاء اللمفاوية الثانوية. الخلايا المقدمة للمستضد التي تنقل المستضدات المتماثلة إلى خلايا CD4 + T الساذجة تنشطها ، وتبدأ سلسلة من برامج التمايز التي تؤدي في النهاية إلى إنتاج سلالات الخلايا التائية المساعدة (Th) عالية التخصص1. يميز إنتاج Interleukin 17 (IL-17) خلايا Th17 ، وهي مجموعة فرعية من الخلايا Th المؤيدة للالتهابات2. تلعب خلايا Th17 دورا في دفاع المضيف ضد مسببات الأمراض خارج الخلية وفي التسبب في العديد من أمراض المناعة الذاتية ، مثل التهاب القزحية المناعي الذاتي والتصلب المتعدد. تحفز الإشارات الصادرة من مستقبلات الخلايا التائية والسيتوكينات IL-6 وتحويل عامل النمو β (TGF-β) تمايز الخلايا التائية الساذجة إلى خلايا Th17 من خلال فسفرة محول الإشارة ومنشط النسخ (STAT)3 3. يتم تضخيم STAT3 بشكل أكبر في حلقة ردود فعل إيجابية من خلال الإشارات بوساطة IL-23 و IL-21 4,5. يمكن أن تحفز فسفرة STAT3 التعبير عن عوامل النسخ RORγt و RORα ، والتي تعمل كمفاتيح رئيسية تنظم ملف تعريف السيتوكين ل IL-17A و IL-17F و IL-21 و IL-22 في خلايا Th176. ومع ذلك ، فقد تم الإبلاغ عن أن خلايا Th17 التي يسببها IL-6 و TGF β غير كافية لتحفيز أمراض المناعة الذاتية ، والتي تتطلب التحفيز المشترك بواسطة IL-23 أو التحفيز المشترك المنفصل ل IL-6 و IL-1β و IL-23 في غياب TGF-β 7,8.
يشار أحيانا إلى المجموعات الفرعية Th17 التي لا يمكنها تحفيز التهاب الدماغ والنخاع المناعي الذاتي التجريبي (EAE) على أنها Th17 غير المسببة للأمراض بينما تعرف المجموعات الفرعية Th17 التي يمكن أن تحفز EAE باسم Th179 المسببة للأمراض. أظهرت الدراسات الحالية أنه على الرغم من أن Th17 الممرض وغير الممرض Th17 يشتركان في التعبير عن عامل النسخ الأساسي RORγt ، إلا أن هناك اختلافات كبيرة في القدرة على إنتاج IL-17A والخصائص المؤيدة للالتهابات والمضادةللالتهابات 10. بالإضافة إلى التعبير العالي ل RORγt و CCR6 و STAT4 و RUNX4 ، وهي عوامل نسخ مميزة شائعة ل Th17 ، تظهر خلايا Th17 المسببة للأمراض أيضا خصائص تعبير إشارة جينية إضافية تتعلق بالمرض ، مثل TBX21 و IFN-γ و CXCR3 ، والتي لها خصائص مجموعات فرعية من خلايا Th1. يمكن لخلايا Th17 المسببة للأمراض أن تفرز مستويات عالية من عامل تحفيز مستعمرة الخلايا المحببة والبلاعم (GM-CSF) ، IFN-γ ، TNF-α ، والسيتوكينات الأخرى11,12. النمط الظاهري لخلايا Th17 غير المسببة للأمراض غير مستقر ، وفقط تحت تحفيز CD3 والسيتوكين IL-2 يمكن لبعض هذه الخلايا أن تتمايز إلى خلايا Th17 المسببة للأمراض. لذلك ، في نماذج الأمراض السريرية الشائعة مثل التهاب المفاصل الروماتويدي والتصلب المتعدد ومتلازمة الضائقة التنفسية الحادة ، تمارس خلايا Th17 المسببة للأمراض تأثيرات مسببة للأمراض بشكل أساسي.
يمكن لخلايا Th17 المسببة للأمراض وغير المسببة للأمراض أن تتمايز في المختبر تحت تأثير السيتوكينات المختلفة. في السنوات الأخيرة ، اقترحت العديد من الدراسات طرقا لإحداث تمايز خلايا Th17 باستخدام أنواع وتركيزات مختلفة من السيتوكينات. يتم تحفيز خلايا Th17 بواسطة مزيج من IL-6 و IL-1β و IL-2313،14،15،16. لقد ثبت أن IL-6 و TGF-β ، وهما سيتوكينات ضروريان لتمايز خلايا Th17 ، ينظمان بشكل تآزري التعبير عن تمايز خلايا RORγt و Th17 من خلال التفاعل مع تسلسلين مختلفين من الحمض النووي غير المشفر المحفوظ في موضع جين Rorc 17. يتم الحفاظ على المرحلة المستقرة من خلايا Th17 المسببة للأمراض بشكل رئيسي بواسطة IL-2318,19. يرتبط IL-23 بمستقبلاته وينشط مسار إشارات JAK-STAT20 ، مما يتسبب في فسفرة Jak2 و Tyk2 وتعزيز فسفرة STAT1 و STAT3 و STAT4 و STAT5. IL-4 و IFN-γ هي منظمات سلبية لهذا المسار. ومع ذلك ، فقد أظهرت الدراسات أن IL-1β قد ينظم بشكل إيجابي نسخ Rorα و Rorγt من خلال مسار mTOR للحفاظ على استقرار النمط الظاهري لخلية Th1721.
نظرا لعدم تجانس العديد من الدراسات ، اخترنا بروتوكولات الحث لخلايا Th17 المسببة للأمراض وغير المسببة للأمراض من أحدث الأبحاث كعناصر تحكم22. تشير النتائج إلى أنه بافتراض أن كل شيء يتم وفقا لهذا البروتوكول ، بعد 5 أيام من الثقافة بشرط توليد Th17 الممرض ، يمكن أن يكون أكثر من 90٪ من الخلايا الباقية خلايا Th17 المسببة للأمراض.
Protocol
وافقت لجنة المراجعة المؤسسية للدراسات الحيوانية في جامعة ساوث إيست على جميع الدراسات الحيوانية المفصلة في هذه الدراسة ، والتي أجريت وفقا لمعايير المكاتب المحلية والمؤسسية. تم أخذ عينات الطحال من الفئران C57BL6 / J. تم تضمين كل من الفئران الإناث والذكور ، الذين تتراوح أعمارهم بين 5 و 8 أسابيع ، في هذه الدراسة. تم تخزين وسط الاستزراع والمخزن المؤقت عند 4 درجات مئوية لمدة تصل إلى 1 شهر. تم تعقيم الأدوات الجراحية قبل الاستخدام. ارتداء قفازات وأقنعة اللاتكس لتجنب تلوث الجلد والعينين والملابس بالكواشف ؛ استخدم الكثير من الماء أو الشطف الملحي للبشرة والعينين.
1. الطلاء المسبق للوحة زراعة الأنسجة المكونة من 24 بئرا بمضاد CD3
- خفف مضاد CD3 إلى تركيز نهائي قدره 1 ميكروغرام / مل في محلول ملحي معقم 1x مخزن بالفوسفات (PBS) أو وسط RPMI 1640.
- ملء صفيحة زراعة الأنسجة المكونة من 24 بئرا جيدا ب 1 مل من محلول مضاد CD3 (1 ميكروغرام / مل) ؛ ثم قم بتغطية البئر ب parafilm.
- ضع اللوحة المطلية المضادة ل CD3 في الثلاجة (2 درجة مئوية -8 درجة مئوية) لمدة 16 ساعة أو احتفظ بها عند 37 درجة مئوية في حاضنة الخلايا لمدة 2-3 ساعات.
2. عزل طحال الفأر وإعداد تعليق الطحال أحادي الخلية
- تحفيز التخدير الكامل في C57BL / 6J مع 3٪ إيزوفلوران والقتل الرحيم عن طريق استنشاق 100٪ ثاني أكسيد الكربون لمدة 2 دقيقة. مباشرة بعد وفاة الفئران ، انقعها في 75٪ من الإيثانول للتطهير لمنع التلوث.
- ضع الماوس في وضع ضعيف على المقعد النظيف ، واقطعه مفتوحا على طول خط الوسط للبطن ، وافصل هياكل البطن طبقة تلو الأخرى. افتح الثرب والمعدة برفق باستخدام ملاقط ، واسحب الطحال برفق باستخدام الرباط المعدي الطحال ، وافصل الطحال بصراحة عن الأنسجة والأربطة المحيطة للحصول على طحال سليم (احرص على تجنب سحق الطحال أو تمزقه).
ملاحظة: للحفاظ على حالة معقمة ، يتم تنفيذ العملية التالية في مقعد معقم فائق النظافة. - ضع مرشح خلية 70 ميكرومتر في طبق ثقافة معقم 100 مم ، وأضف الطحال إلى مصفاة الخلية ، وسحقه بمكبس حقنة. في الوقت نفسه ، أضف 5-8 مل من سائل التنظيف المتجانس لدفع جميع الخلايا عبر المرشح إلى طبق الاستزراع.
ملاحظة: يمكن رؤية تركيبة مجموعة سائل فصل الخلايا الليمفاوية في جدول المواد. - أجهزة الطرد المركزي المرشح في 450 × غرام لمدة 5 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية.
- أعد تعليق حبيبات الخلية باستخدام مخفف العينة المرفق مع مجموعة فصل الخلايا الليمفاوية أو بوسط PBS أو RPMI 1640. اضبط تركيز الخلية في تعليق الخلية على 2 × 108-1 × 109 خلايا / مل.
ملاحظة: عادة ، مطلوب 4-6 مل من مخفف العينة لطحال واحد. - في أنبوب الطرد المركزي ، خذ نفس الكمية من محلول فصل الخلايا الليمفاوية مثل تعليق الأنسجة أحادي الخلية. ماصة بعناية تعليق الخلية واحدة على سطح محلول فصل الخلايا الليمفاوية وأجهزة الطرد المركزي عند 800 × جم ، 25 درجة مئوية لمدة 30 دقيقة. اضبط تسارع وتباطؤ جهاز الطرد المركزي على نطاق مناسب (على سبيل المثال ، اضبط على 3 إذا كان هناك التروس المعتادة من 1 إلى 9).
ملاحظة: يجب ألا يقل محلول فصل الخلايا الليمفاوية عن 3 مل. - بعد الطرد المركزي ، لاحظ الطبقات الأربع في أنبوب الطرد المركزي من الأعلى إلى الأسفل. تتوافق الطبقة الأولى مع مخفف العينة ، تليها طبقة الخلايا الليمفاوية البيضاء اللبنية الحلقية الحلقي. الطبقة الثالثة هي سائل الفصل ، والطبقة الرابعة تتكون من خلايا الدم الحمراء.
- استخدم ماصة لسحب الطبقة الثانية بعناية من طبقة الخلايا الليمفاوية البيضاء اللبنية الحلقية في أنبوب طرد مركزي آخر وإضافة 10 مل من محلول التنظيف إلى أنبوب الطرد المركزي لخلط الخلايا.
- أجهزة الطرد المركزي في 250 × غرام لمدة 5 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية. استخدم 10 مل من وسيط RPMI 1640 لإعادة تعليق حبيبات الخلية لعد الخلايا.
3. تنقية الخلايا التائية CD4 + الساذجة على أساس الاختيار السلبي للخرز المغناطيسي
ملاحظة: عزل خلايا CD4 + T الساذجة التي لم تمسها وعالية النقاء (CD4 + CD44lowCD62Lhigh) من خلايا الطحال الفأرية عن طريق الانتقاء السلبي المناعي.
- تحضير العينة للحصول على 1 × 108 خلايا / مل ضمن نطاق حجم 0.1-2 مل.
- أضف 50 ميكرولتر / مل من مصل الفئران وانقل العينة إلى أنبوب مستدير القاع من البوليسترين سعة 5 مل.
ملاحظة: يمكن رؤية تركيبة مجموعة فرز الخلايا التائية CD4 الساذجة في جدول المواد. - أضف 50 ميكرولتر / مل من كوكتيل العزل إلى العينة ، واخلطها جيدا ، واحتضنها لمدة 7.5 دقيقة في درجة حرارة الغرفة.
- أضف 50 ميكرولتر / مل من كوكتيل النضوب إلى العينة ، واخلطها جيدا ، واحتضنها لمدة 2.5 دقيقة في درجة حرارة الغرفة.
- دوامة الخرز المغناطيسي لضمان التشتت حتى. أضف 75 ميكرولتر / مل من الخرز المغناطيسي إلى العينة ، واخلطها جيدا ، واحتضنها لمدة 2.5 دقيقة في درجة حرارة الغرفة.
ملاحظة: يجب أن تظهر الجسيمات مشتتة بالتساوي ؛ يجب ألا يقل وقت الدوامة عن 30 ثانية. - قم بتعبئة العينة باستخدام RPMI 1640 متوسط إلى حجم نهائي يبلغ 2.5 مل. تخلط عدة مرات عن طريق سحب بلطف لأعلى ولأسفل.
- ضع الأنبوب (بدون غطاء) في المغناطيس واحتضانه لمدة 2.5 دقيقة في درجة حرارة الغرفة.
- التقاط المغناطيس ، عكس المغناطيس والأنبوب في حركة واحدة مستمرة وصبتعليق الخلية المخصب في أنبوب جديد.
ملاحظة: حافظ على الأنبوب والمغناطيس مقلوبين لمدة 2-3 ثوان قبل قلبهما في وضع مستقيم. لا تزعج أي قطرات قد تبقى على فم الأنبوب. - تحديد رقم الخلية باستخدام مقياس الدم.
- إجراء تحليل التدفق الخلوي للخلايا التائية CD4 + T الساذجة قبل وبعد العزل (الشكل 1).
- نقل الخلايا إلى أنبوب طرد مركزي جديد ، جهاز طرد مركزي عند 400 × جم لمدة 5 دقائق في درجة حرارة الغرفة ، وتخلص من المادة الطافية.
- أعد تعليق الخلايا في 200-500 ميكرولتر من وسط RPMI 1640 (مكمل بمصل بقري جنيني بنسبة 10٪). لكل 1 مل من زراعة الخلايا (على سبيل المثال ، ~ 106 خلية / مل) ، أضف 2 ميكرولتر من كوكتيل تنشيط الكريات البيض واخلطه. استزراع الخلايا في حاضنة CO2 عند 37 درجة مئوية والرطوبة المشبعة لمدة 4-6 ساعات.
ملاحظة: كانت الخلايا دوامة مرة واحدة كل 1-2 ساعة. - أجهزة الطرد المركزي الخلايا في 400 × غرام ، 4 درجة مئوية لمدة 5 دقائق. تخلص بعناية من المادة الطافية وأعد تعليق الخلايا في 200 ميكرولتر من PBS. أضف 1 ميكرولتر من مانع Fc إلى الخلايا (على سبيل المثال ، ~ 106 خلية / مل). احتضان الخلايا لمدة 10 دقائق عند 4 درجات مئوية.
- اغسل الخلايا مرة واحدة باستخدام 1 مل من PBS عن طريق الطرد المركزي عند 400 × جم لمدة 5 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية وأعد تعليق الخلايا في 200 ميكرولتر من برنامج تلفزيوني.
- أضف كوكتيل الأجسام المضادة (صبغة قابلة للتثبيت ، 1: 1000 ؛ مضاد CD4 ، 1: 200 ؛ مضاد CD44 ، 1: 200 ؛ مضاد CD62L ، 1: 200) واحتضان الخلايا لمدة 15-20 دقيقة في الظلام عند 4 درجات مئوية.
- اغسل الخلايا ب 2 × 1 مل من PBS ثم ، جهاز طرد مركزي عند 400 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية ، وأعد تعليق الخلايا في 250 ميكرولتر من المخزن المؤقت الثابت ، واحتضانها لمدة 40-60 دقيقة في الظلام عند 4 درجات مئوية.
ملاحظة: يتم توفير المخزن المؤقت للإصلاح مع مخزن تلطيخ عامل النسخ Foxp3 / ، وهو محلول مخزون 4x يجب تخفيفه بمخفف النفاذية. - أضف 1 مل من 1x مخزن مؤقت للنفاذ لغسل الخلايا 2x عن طريق الطرد المركزي للخلايا عند 300 × جم ، 4 درجات مئوية لمدة 5 دقائق.
- تخلص من المادة الطافية ، وأعد تعليق الخلايا في 200 ميكرولتر من المخزن المؤقت للنفاذ ، وأضف الجسم المضاد (Foxp3 [نووي] ، 1: 200) إلى الخلايا. بعد التثبيت وتمزق الغشاء ، احتضان مخاليط الأجسام المضادة الخلوية في الظلام لمدة 40-60 دقيقة مع الرج من حين لآخر لفترات قصيرة عند 4 درجات مئوية.
ملاحظة: محلول النفاذية / الغسيل عبارة عن محلول مخزون 10x يجب تخفيفه قبل الاستخدام مع برنامج تلفزيوني.
4. تحريض خلايا Th17 المسببة للأمراض في المختبر
- قم بإزالة برنامج تلفزيوني معقم من الألواح المطلية مسبقا المكونة من 24 بئرا قبل الاستخدام.
- استخدم وسط زراعة الخلايا Th17 (الجدول 1) ووسط التباين للثقافة ، بما في ذلك وسط زراعة الخلايا Th0 (الجدول 1) ، ووسط ثقافة Th17 الكلاسيكي غير الممرض (الجدول 1) ، ووسط ثقافة Th17 الممرض الكلاسيكي (الجدول 1). أعد تعليق خلايا CD4 + T الساذجة المخصبة وتوزيعها في آبار مختلفة في نفس اللوحة المكونة من 24 بئرا (مغلفة مسبقا بمضاد CD3) ، مع ضبط التركيز إلى 4 × 105 خلايا / مل ، مع 1 مل من الوسط في كل بئر.
- أضف 1 ميكرولتر / مل من محلول مضاد CD28 (التركيز النهائي: مخفف بمتوسط إلى 2 ميكروغرام / مل) إلى كل بئر. استزرع الخلايا في حاضنة CO2 5٪ عند 37 درجة مئوية لمدة 5 أيام.
- استبدل الوسط الطافي لزراعة الخلايا بوسط المزرعة (Th0 ، Th17 غير الممرض ، Th17 الممرض الكلاسيكي ، والهدف Th17) عن طريق سحب العينات بعناية لتوزيع الخلايا بالتساوي ، وتجاهل نصف الوسط الذي يحتوي على الخلايا ، ثم إضافة وسيط جديد يساوي حجم التجاهل في اليوم 2. كرر في اليوم 4.
- راقب الخلايا تحت المجهر الضوئي في اليوم 5 (الشكل 2). اجمع طافات الخلايا من كل مجموعة واحفظها بالتبريد عند -80 درجة مئوية.
5. تحليل التدفق الخلوي لتمايز الخلايا Th17 و Th0 المسببة للأمراض
- حصاد جميع الخلايا (لكل بئر) بعد 5 أيام من بدء الثقافة. قم بتنفيذ الخطوات 3.12-3.15.
- أضف كوكتيل الأجسام المضادة (صبغة قابلة للتثبيت ، 1: 1000 ؛ مضاد CD4 ، 1: 200) واحتضان الخلايا لمدة 15-20 دقيقة في الظلام عند 4 درجات مئوية.
- قم بتنفيذ الخطوات 3.17-3.19.
- تخلص من المادة الطافية ، وأعد تعليق الخلايا في 200 ميكرولتر من المخزن المؤقت للنفاذ ، وأضف كوكتيل الأجسام المضادة (IL-17A [داخل الخلايا] ، 1: 200 ؛ RORγT [نووي] ، 1: 200) إلى الخلايا. بعد التثبيت وتمزق الغشاء ، احتضان مخاليط الأجسام المضادة الخلوية في الظلام لمدة 40-60 دقيقة مع الرج من حين لآخر لفترات قصيرة عند 4 درجات مئوية.
- أضف 1 مل من 1x محلول نفاذية / غسيل لغسل الخلايا 2x ، والطرد المركزي للخلايا عند 400 × جم لمدة 5 دقائق عند 4 درجات مئوية ؛ ثم تخلص من المادة الطافية.
- افحص الخلايا الموجودة على مقياس التدفق الخلوي وقم بتحليل البيانات باستخدام البرنامج (الشكل 3).
- قم بتشغيل مقياس التدفق الخلوي ، وقم بتشغيل عملية التنظيف والمعايرة ذاتية التشغيل.
- حدد قناة الليزر المستخدمة في هذه التجربة ، وقم بإعداد أنبوب فارغ ، وأنابيب أحادية اللون ، وأنابيب عينة.
- انقر فوق خيار الأنبوب الفارغ واختبره على الجهاز ؛ اضبط الجهد بحيث يكون حدث الخلية ، قدر الإمكان ، في وسط صندوق التجميع.
- جمع خلايا الأنبوب أحادية اللون وإجراء الكشف الطيفي للقنوات المقابلة للتأكد من إضافة الجسم المضاد الفلوري بشكل صحيح.
- انقر فوق زر unmix ودع الجهاز يضبط التعويض الطيفي تلقائيا. مع أدوات قياس التدفق الخلوي الأخرى ، اضبط تعويض التألق بشكل طبيعي.
- اجمع كل خلية أنبوبية نموذجية ، واحفظ تنسيق البيانات كملفات FCS ، وقم بالتصدير. تحليل ورسم في برنامج تحليل بيانات قياس التدفق الخلوي ذي الصلة.
- ضع دائرة حول مجموعة الخلايا الرئيسية وقم بإزالة الالتصاقات الخلايا المحتملة من خلال بوابات الدائرة القطرية ل FSC-H و FSC-A.
- دائرة الخلايا الحية وفقا لمنطقة الدائرة السلبية FVS ؛ بعد ذلك ، ضع دائرة حول مجتمع خلايا CD4 +.
- بناء البوابة المتقاطعة مع المحور الأفقي مثل IL-17 A والمحور الرأسي ك RORγT ؛ الاختيار الإيجابي المزدوج في منطقة Q2 هو مجتمع خلايا Th17.
6. مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) للكشف عن إفراز IL-17A الناجم عن وسائط مختلفة
- قم بإذابة طافات الخلايا المجمدة التي تم جمعها في القسم 4.5.
- أضف 100 ميكرولتر من المعيار المخفف ، فارغا ، وعينة في الآبار المخصصة. استخدم مانع التسرب لتغطية الطبق واحتضانه لمدة 90 دقيقة عند 37 درجة مئوية.
ملاحظة: أضف المحاليل إلى الجزء السفلي من لوحة ELISA الدقيقة جيدا دون لمس الجدار الداخلي أو التسبب في أي رغوة. - صب السائل من كل بئر وإضافة 100 ميكرولتر على الفور من محلول عمل الأجسام المضادة للكشف عن البيوتينيل. استخدم مادة مانعة للتسرب جديدة لتغطية اللوحة واحتضانها لمدة 1 ساعة عند 37 درجة مئوية.
- صب المحلول وأضف 350 ميكرولتر من محلول الغسيل إلى كل بئر. بعد 1 دقيقة ، قم بشفط أو صب المحلول من كل بئر واتركه حتى يجف على ورق ماص نظيف. كرر خطوة الغسيل هذه 3x.
- أضف 100 ميكرولتر من محلول عمل بيروكسيديز الفجل المترافق إلى كل بئر. استخدم مادة مانعة للتسرب جديدة لتغطية اللوحة واحتضانها لمدة 30 دقيقة عند 37 درجة مئوية.
- صب المحلول من كل بئر ، وكرر عملية الغسيل 5 مرات كما هو موضح في الخطوة 6.4.
- أضف 90 ميكرولتر من كاشف الركيزة إلى كل بئر ، واحتضنها لمدة 15 دقيقة عند 37 درجة مئوية باستخدام مادة مانعة للتسرب جديدة ، تحمي اللوحة من الضوء.
ملاحظة: يمكن تغيير وقت رد الفعل بناء على تغير اللون الفعلي ولكن يجب ألا يتجاوز 30 دقيقة. دع قارئ الصفيحة الدقيقة يسخن لمدة ~ 15 دقيقة قبل قياس OD. - أضف 50 ميكرولتر / بئر من محلول التوقف بنفس ترتيب محلول الركيزة.
- حدد الكثافة الضوئية (قيمة OD) لكل بئر مرة واحدة باستخدام قارئ microplate مضبوط على 450 نانومتر.
- الحصول على قيم OD للعينات القياسية وتكرار الآبار للعينات ، وطرح قيم OD للآبار الفارغة للحصول على القيم المصححة. بعد ذلك ، قم بإجراء التركيب الخطي مع التركيز كقيمة الإحداثي و OD كإحداثي. بناء على المعادلة المجهزة ، احسب قيم تركيز IL-17A لآبار العينة.
ملاحظة: بعد 4 أيام من التمايز ، يظهر محتوى IL-17A في طاف كل مجموعة في الشكل 4. يمكن أن تشير طريقة التركيب إلى برنامج Orgin21. المنحنى القياسي الذي تم الحصول عليه من هذه التجربة له قيمة R2 تبلغ 0.9946.
7. تمايز الخلايا التائية عن طريق مقايسات التعبير الجيني التوقيعي عبر تفاعل البوليميراز المتسلسل الكمي (qPCR)
ملاحظة: لاستبعاد إمكانية عدم استقرار قياس التدفق الخلوي بسبب تأثيرات الأصباغ والتثبيت / التمزق ، اكتشفنا التعبير عن الجينات المميزة بواسطة qPCR لتوضيح تأثير التمايز ل Th17 الممرض على مستوى النسخ.
- قياس عدد الخلايا في نهاية زراعة الخلايا التائية. اجمع الخلايا في أنابيب طرد مركزي سعة 1.5 مل وأجهزة طرد مركزي عند 400 × جم لمدة 5 دقائق. تخلص بعناية من جميع المواد الطافية.
- استخراج الحمض النووي الريبي
ملاحظة: يجب أن تتم عملية الاستخراج في غطاء دخان أو مقعد نظيف للغاية لتجنب تلوث إنزيم الحمض النووي الريبي.- أضف 500 ميكرولتر من Lysis Buffer (على سبيل المثال ، إلى 1-2 × 106 خلايا) إلى أنبوب العينة (الخطوة 7.1) ، رجها واخلطها على الفور حتى لا تكون هناك كتلة خلية ، واتركها لمدة دقيقة واحدة.
- أضف الخليط إلى عمود الامتزاز الموضوع في أنبوب تجميع ، وأجهزة طرد مركزي عند 13400 × جم لمدة 30 ثانية ، وتخلص من الترشيح.
- أضف الكمية المحددة من الإيثانول المطلق إلى زجاجة الغسيل العازلة قبل استخدامها لأول مرة. أضف 500 ميكرولتر من المخزن المؤقت للغسيل إلى عمود الامتزاز ، وأجهزة الطرد المركزي عند 13400 × جم لمدة 30 ثانية ، وتخلص من المرشح.
- كرر الغسيل في الخطوة 7.2.3.
- ضع عمود الامتزاز RA في أنبوب التجميع الفارغ وأجهزة الطرد المركزي عند 13400 × جم لمدة 2 دقيقة لإزالة محلول الشطف.
ملاحظة: يجب إزالة محلول الشطف لمنع الإيثانول المتبقي في محلول الشطف من تثبيط تفاعل المصب. - قم بإزالة عمود الامتزاز RA وضعه في أنبوب طرد مركزي نظيف خال من RNase. أضف 50 ميكرولتر من H2O الخالي من RNase إلى منتصف غشاء الامتزاز ، واتركه يقف لمدة دقيقة واحدة في درجة حرارة الغرفة ، وأجهزة الطرد المركزي عند 9600 × جم لمدة 1 دقيقة.
- قياس نقاء وتركيز الحمض النووي الريبي.
- توليف الشريط الأول من cDNA باتباع تعليمات الشركة المصنعة للمجموعة.
- إزالة الحمض النووي الجينومي. خذ 500 نانوغرام من قالب الحمض النووي الريبي المستخرج في أنبوب طرد مركزي خال من RNase ؛ أضف مزيج ddH2O الخالي من RNase و 4x gDNA لتشكيل خليط. امزجيه برفق باستخدام ماصة وضعيه في حمام مائي على حرارة 42 درجة مئوية لمدة 2 دقيقة.
ملاحظة: ترتبط كمية خليط التفاعل والكمية المضافة بتركيز الحمض النووي الريبي. راجع التعليمات بالتفصيل. تم استخدام نظام التفاعل 20 ميكرولتر في هذه التجربة. - أضف مباشرة نظام تفاعل النسخ العكسي 5x في أنبوب التفاعل في الخطوة السابقة. خذ 4 ميكرولتر من نظام تفاعل النسخ العكسي و 16 ميكرولتر من الخليط من الخطوة السابقة واخلطه برفق مع ماصة.
ملاحظة: يتضمن نظام النسخ العكسي جميع النسخ العكسي المطلوب ، وهو نظام نسخ عكسي مكون مباشرة. - اضبط تفاعل النسخ العكسي: 37 درجة مئوية 15 دقيقة ، 85 درجة مئوية ، 5 ثوان ، وأخيرا تبرد إلى 4 درجات مئوية.
- إزالة الحمض النووي الجينومي. خذ 500 نانوغرام من قالب الحمض النووي الريبي المستخرج في أنبوب طرد مركزي خال من RNase ؛ أضف مزيج ddH2O الخالي من RNase و 4x gDNA لتشكيل خليط. امزجيه برفق باستخدام ماصة وضعيه في حمام مائي على حرارة 42 درجة مئوية لمدة 2 دقيقة.
- قم بإعداد تفاعل تفاعل PCR باتباع تعليمات الشركة المصنعة.
- أضف 10 ميكرولتر من خليط إنزيم تفاعل PCR 2x في أنبوب qPCR ، و 0.4 ميكرولتر من التمهيدي 1 ، و 0.4 ميكرولتر من التمهيدي 2 ، و 0.4 ميكرولتر من 50x من ROX Reference Dye 1 ، و 2 ميكرولتر من قالب cDNA ، و 6.8 ميكرولتر من ddH2O لتحضير خليط 20 ميكرولتر.
- إجراء تفاعل البوليميراز المتسلسل في أداة تفاعل البوليميراز المتسلسل الكمي الفلوري في الوقت الفعلي باستخدام الإعدادات التالية: المرحلة 1 ، 95 درجة مئوية ، 30 ثانية ، Rep x 1 ؛ المرحلة 2 ، أول 95 درجة مئوية ، 10 ثوان ، ثم 60 درجة مئوية ، 30 ثانية ، ممثل × 40 ؛ المرحلة 3 ، أول 95 درجة مئوية ، 15 ثانية ، 60 درجة مئوية التالية ، 60 ثانية ، أخيرا 95 درجة مئوية ، 15 ثانية ، ممثل × 1.
ملاحظة: بعد 4 أيام من التمايز ، تظهر مستويات التعبير النسبية ل Il17a و Il17f و Rora و Il23r في خلايا CD4 + T الساذجة في الشكل 5.
النتائج
تم تطوير بروتوكولنا بناء على بحث سابق حول تمايز خلايا Th17 المسببة للأمراض. تتمثل الخطوة الأولى من التجربة في اكتشاف نقاء الخلايا التائية CD4 + T الساذجة المعزولة من الطحال عن طريق فرز الخرزة المغناطيسية ، وهو أساس نجاح تمايز خلايا Th17 الممرضة اللاحقة. تم الكشف عن نقاء الخلايا التائية CD4 + T الساذجة باستخدام علامات السطح CD62L23 و CD4424 بينما تم استخدام FOXP325 كعلامة لخلايا Treg. وجدنا أن محتوى خلايا Treg قد انخفض بشكل كبير بعد الفرز ، ويمكن أن تصل نقاء الخلايا التائية CD4 + T الساذجة إلى 95٪ على الأقل (الشكل 1). لمقارنة تمايز خلايا Th17 المسببة للأمراض ، تم استزراع الخلايا التائية CD4 + T الساذجة باستخدام وسط Th0 (الجدول 1) ووسط تمايز Th17 (الجدول 1) لمدة 5 أيام. وجد أن الخلايا التائية أظهرت نموا عنقوديا في كل من وسائط Th0 و Th17 (الشكل 2).
بعد ذلك ، تم تثبيت الخلايا واختراقها ووسمها بأجسام مضادة ضد العديد من السيتوكينات في خلايا CD4 + T المتمايزة بناء على قياس التدفق الخلوي. قمنا بفحص IL17A26 و RORγT27 كسيتوكينات مميزة لتمايز خلايا Th17 ووجدنا أن 90٪ من خلايا CD4 + T الساذجة تمايزت بنجاح إلى خلايا Th17 المسببة للأمراض تحت تحفيز وسط زراعة الخلايا Th17 الجديد (الشكل 3). يوضح الشكل 5 الجينات المميزة لخلايا Th17 التي تم اكتشافها بواسطة تفاعل البوليميراز المتسلسل ، والتي أثبتت أن خلايا Th17 المسببة للأمراض التي حصلنا عليها عن طريق التمايز كانت تعبر بشكل ثابت.
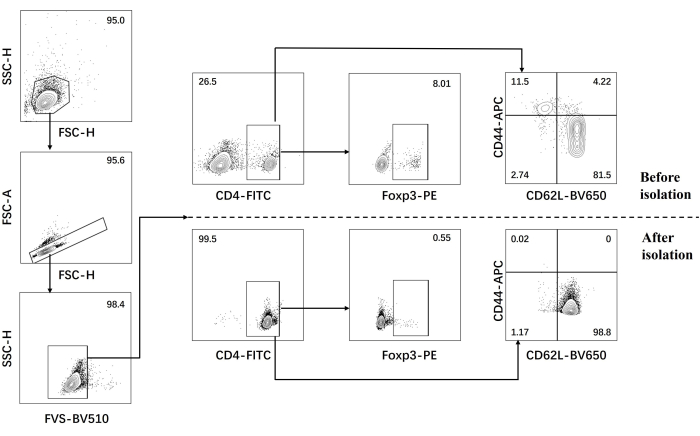
الشكل 1: استراتيجية البوابات لتحليل السيتوكينات المميزة في فأر C57BL / 6J قبل وبعد عزل الخلايا التائية CD4 + الساذجة. الاختصارات: FSC-H = ارتفاع ذروة التشتت الأمامي ؛ SSC-H = ارتفاع التشتت الجانبي ؛ FSC-A = منطقة ذروة التشتت الأمامية ؛ FITC = فلوريسئين إيزوثيوسيانات ؛ PE = فيكوريثرين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
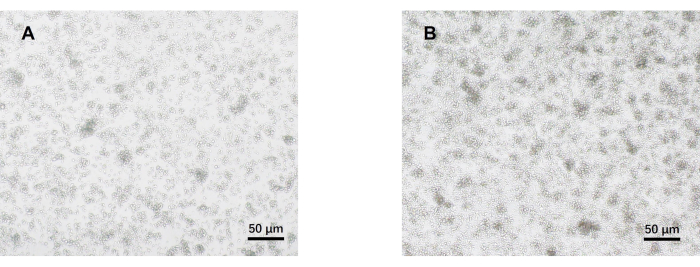
الشكل 2: صور تمثيلية لخلايا CD4+ T الساذجة للفأر المزروعة في ظل ظروف Th17 و Th0 المسببة للأمراض لمدة 5 أيام. (أ) خلايا Th0؛ ب: خلايا Th17 المسببة للأمراض. قضبان المقياس = 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
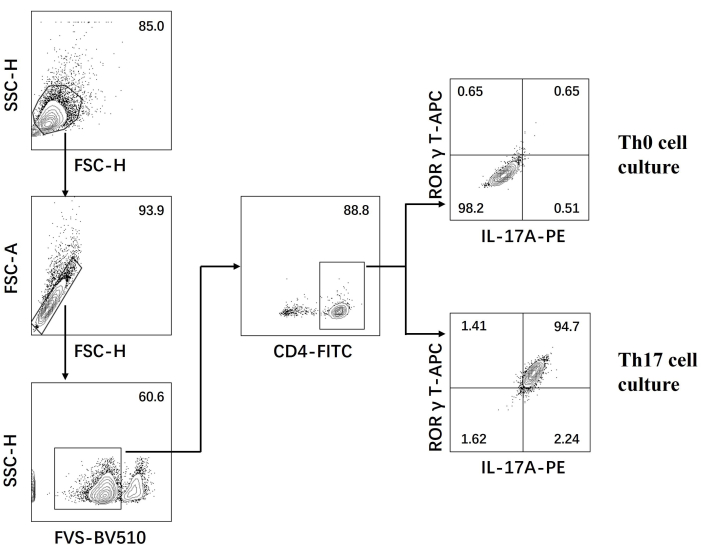
الشكل 3: تحليل قياس التدفق الخلوي بعد التمايز الناجم عن وسط زراعة الخلايا Th0 ووسط زراعة الخلايا Th17. الاختصارات: FSC-H = ارتفاع ذروة التشتت الأمامي ؛ SSC-H = ارتفاع التشتت الجانبي ؛ FSC-A = منطقة ذروة التشتت الأمامية ؛ FITC = فلوريسئين إيزوثيوسيانات ؛ PE = فيكوريثرين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
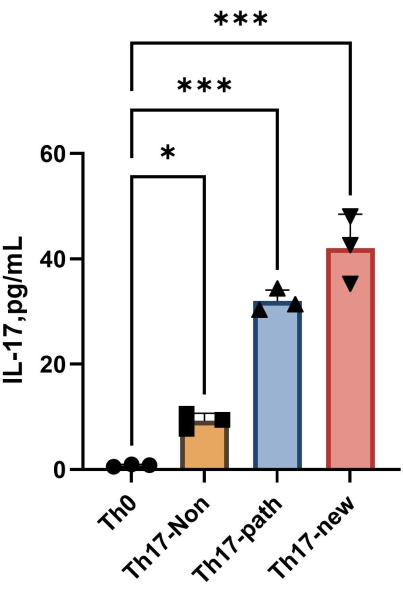
الشكل 4: محتوى IL-17A في طافية وسط زراعة الخلايا Th0 ووسط زراعة الخلايا Th17 بعد تحريض التمايز. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
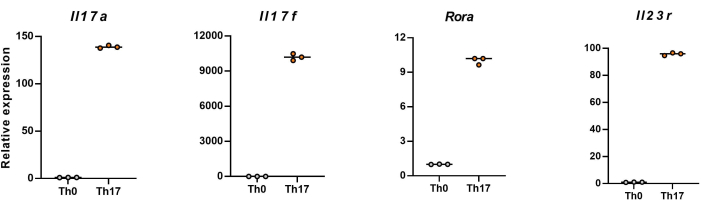
الشكل 5: النتائج التمثيلية لمستويات التعبير عن السيتوكينات المميزة في الخلايا التائية CD4 + T المتمايزة للفأر C57BL / 6J. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
| استهداف وسط زراعة الخلايا Th17 المسببة للأمراض | Th0 وسط زراعة الخلايا | وسط زراعة الخلايا Th17 الكلاسيكية غير المسببة للأمراض | الكلاسيكية المسببة للأمراض Th17 خلية زرع المتوسطة. | |||||||||||
| الكاشف | التركيز النهائي | مبلغ | التركيز النهائي | مبلغ | التركيز النهائي | مبلغ | التركيز النهائي | مبلغ | ||||||
| البنسلين والستربتومايسين (100x) | 1x | 500 ميكرولتر | 1x | 500 ميكرولتر | 1x | 500 ميكرولتر | 1x | 500 ميكرولتر | ||||||
| مصل الجنين البقري | 10% | 5 مل | 10% | 5 مل | 10% | 5 مل | 10% | 5 مل | ||||||
| β-ميركابتوإيثانول | 50 ميكرومتر | 50 ميكرولتر | 50 ميكرومتر | 50 ميكرولتر | 50 ميكرومتر | 50 ميكرولتر | 50 ميكرومتر | 50 ميكرولتر | ||||||
| مكمل الجلوتا ماكستم (100x) | 1x | 500 ميكرولتر | 1x | 500 ميكرولتر | 1x | 500 ميكرولتر | 1x | 500 ميكرولتر | ||||||
| محلول بيروفات الصوديوم (100x) | 1 مللي متر | 500 ميكرولتر | 1 مللي متر | 500 ميكرولتر | 1 مللي متر | 500 ميكرولتر | 1 مللي متر | 500 ميكرولتر | ||||||
| جاما IFN المضادة للفأر (1 ملغ / مل) | 5 ميكروغرام / مل | 250 ميكرولتر | 10 ميكروغرام / مل | 500 ميكرولتر | 10 ميكروغرام / مل | 500 ميكرولتر | ||||||||
| مضاد للماوس IL-4 (2 مجم / مل) | 5 ميكروغرام / مل | 125 ميكرولتر | 5 ميكروغرام / مل | 250 ميكرولتر | 10 ميكروغرام / مل | 250 ميكرولتر | ||||||||
| الماوس rIL-1 بيتا (20 ميكروغرام) | 20 نانوغرام / مل | غير متوفر | ||||||||||||
| ماوس rIL-6 (20 ميكروغرام) | 20 نانوغرام / مل | غير متوفر | 50 نانوغرام / مل | غير متوفر | 50 نانوغرام / مل | غير متوفر | ||||||||
| الماوس rIL-23 (50 ميكروغرام) | 50 نانوغرام / مل | غير متوفر | 10 نانوغرام / مل | غير متوفر | ||||||||||
| ماوس TGF بيتا (100 ميكروغرام) | 3 نانوغرام / مل | غير متوفر | 1 نانوغرام / مل | غير متوفر | 1 نانوغرام / مل | غير متوفر | ||||||||
| الفئران IL-2 (5 ميكروغرام) | 20 نانوغرام / مل | غير متوفر | ||||||||||||
| RPMI 1640 | غير متوفر | إلى 50 مل | غير متوفر | إلى 50 مل | غير متوفر | إلى 50 مل | ||||||||
| مجموع | غير متوفر | 50 مل | غير متوفر | 50 مل | غير متوفر | 50 مل | ||||||||
الجدول 1: استهداف ثقافة الخلايا المسببة للأمراض Th17 ، ثقافة الخلايا Th0 ، وسائط زراعة الخلايا الكلاسيكية غير المسببة للأمراض والمسببة للأمراض Th17.
Discussion
قدم هذا الإجراء طريقة مثمرة لزيادة عدد خلايا CD4 + T الساذجة للفئران لإنتاج خلايا Th17 المسببة للأمراض في المختبر . على الرغم من أننا نستخدم المزيد من السيتوكينات أكثر من وسائط زراعة خلايا Th17 الأخرى المبلغ عنها ، إلا أننا ملتزمون بتحسين ظروف نمو خلايا Th17 المسببة للأمراض. نحن نفكر في مزيد من التحسين لبروتوكول التمايز المستحث لدينا.
هنا ، استخدمنا ببساطة قياس التدفق الخلوي و qPCR لفحص إنتاج السيتوكينات المميزة. مع بعض التعديلات الطفيفة ، يمكن أيضا استخدام هذا النهج لاختبارات الوظائف الأخرى ، مثل تكاثر الخلايا.
استخدمنا مجموعة عزل الخلايا الليمفاوية المنتجة في الصين لعزل الخلايا الليمفاوية لطحال الفئران لأنها فعالة وموفرة للوقت. يمكن لحلول فصل الخلايا الليمفاوية القائمة على العلامات التجارية الأخرى أن تحقق أيضا الغرض من فصل الخلايا الليمفاوية لطحال الفئران من خلال خطوات مختلفة. طريقة أخرى هي تحلل خلايا الدم الحمراء مباشرة من تعليق خلايا الطحال التي تم الحصول عليها. ومع ذلك ، وجدنا أن خلايا الدم الحمراء الطحال في كثير من الأحيان لا يمكن تحللها في وقت واحد.
يمكن أن تنشأ بعض المشاكل أثناء تنفيذ هذا البروتوكول. أولا ، قد يكون عدد خلايا CD4 + T الساذجة التي تم الحصول عليها عن طريق فرز الخرزة المغناطيسية منخفضا جدا (خطوة البروتوكول 3). يمكن أن يعزى ذلك إلى أن عملية سحق الأعضاء غير كافية. من المهم التأكد من أن العضو متجانس بشكل صحيح. ستؤدي زيادة وتيرة الشطف أثناء عملية التجانس إلى تحسين معدل الاسترداد. للحصول على عدد أكبر من الخلايا التائية CD4 + T الساذجة الطحالية ، نقترح استخدام الفئران الأصغر سنا (6-10 أسابيع من العمر). هناك العديد من الطرق المتاحة لفصل الخلايا الليمفاوية الطحال ، وقد يختلف العائد اعتمادا على سائل الفصل المستخدم. يوصى باستخدام سائل فصل معتمد عالميا ومحاولة استخراج طبقة الخلايا الليمفاوية قدر الإمكان.
ثانيا ، قد تكون نسبة خلايا CD4 + T في قياس التدفق الخلوي <80٪ (خطوة البروتوكول 5). قد يكون أحد الأسباب المحتملة لهذه المشكلة هو عدد الخلايا الطحالية غير الدقيق ، مما يؤدي إلى عدد خلايا أكبر من عدد الخلايا الإضافية لكوكتيل الأجسام المضادة والخرز المغناطيسي. لزيادة فعالية تنقية الخلايا التائية CD4 + الساذجة ، يجب أن يكون عد الخلايا دقيقا. بالإضافة إلى ذلك ، يمكن استخدام 10٪ أكثر من كوكتيل الأجسام المضادة والخرز المغناطيسي على ما يوصي به هذا البروتوكول. أخيرا ، يمكن إجراء قياس التدفق الخلوي مباشرة بعد فرز الخلايا التائية CD4 + الساذجة.
ثالثا ، قد لا يكون هناك العديد من مجموعات الخلايا التائية التي تشكلت أثناء المزرعة ، وربما ماتت معظم الخلايا أثناء تمايز الخلايا التائية (بروتوكول الخطوة 4). قد يكون السبب المحتمل لهذه المشكلة هو التحديد غير الدقيق لأعداد الخلايا لخلايا CD4 + T الساذجة قبل البذر ، مما يؤدي إلى انخفاض كثافة الخلايا. يوصى باعتماد طريقة عد أكثر دقة لتحقيق كثافة الخلايا المطلوبة التي تبلغ حوالي 4 × 105 خلايا / مل لكل بئر في صفيحة 48 بئرا. قد يكون السبب المحتمل الآخر هو المشاكل الفنية في حاضنة CO2 ، مثل درجة الحرارة غير الصحيحة أو تركيز CO2 . أخيرا ، يمكن أن تتسبب القوة المفرطة أثناء تغيير وسط زراعة الخلايا في موت الخلايا.
رابعا ، قد تكون مستويات التعبير النسبية لجينات السيتوكين المميزة منخفضة (خطوة البروتوكول 7). لضمان صحة الحمض النووي الريبي المستخرج ، يوصى باستخدام تركيز للكشف عن القطرات النانوية يزيد عن 100 نانوغرام / مل. قد يكون السبب المحتمل لانخفاض التركيز هو الطبيعة غير الصحية للخلايا المستزرعة ، مثل موت جزء كبير من الخلايا التي تم جمعها أو في طور الموت. للحصول على تركيز الحمض النووي الريبي الحقيقي ، من الضروري حل الموقف الذي قد يؤدي إلى ضعف النمو أثناء زراعة الخلايا. قد يكون السبب البديل وراء هذا القلق هو الانخفاض المفرط في عدد الخلايا النهائي الذي تم تحقيقه أثناء استخراج الحمض النووي الريبي ، ربما بسبب فقدان الخلايا غير المقصود أثناء التخلص من المواد الطافية. يمكن أن يكون استخدام تقنيات استخراج الحمض النووي الريبي المتقدمة مثل مجموعات استخراج الحمض النووي الريبي ذات الخطوة الواحدة مفيدا. يجب أن تقع نسبة OD260 / OD280 المثالية ، كما تم قياسها بواسطة Nanodrop ، في نطاق 1.9-2.1. في حالة وجود نسبة منخفضة للغاية ، يصبح تلوث البروتين احتمالا. قد تساعد زيادة وتيرة الغسيل العازل الخالي من RNase في التخفيف من هذه المشكلة. على العكس من ذلك ، فإن النسبة المنخفضة بشكل غير معهود تعني تدهور محتمل للحمض النووي الريبي. لمواجهة هذه المشكلة ، يوصى باستخدام مياه خالية من RNase واستخدام أنابيب 1.5 مل لأغراض إزالة التلوث من RNase.
في الختام ، يصف البروتوكول الحالي استخدام وسط زراعة الخلايا الجديد للحث المباشر على الخلايا التائية CD4 + T الساذجة للتمايز إلى خلايا Th17 المسببة للأمراض في المختبر. بالمقارنة مع الفصل المباشر ، ليس هناك شك في أن هذه الطريقة أكثر مباشرة وغير مكلفة وأكثر كفاءة. كما أن تكوين الوسط بسيط للغاية بحيث يمكن استخدام خلايا Th17 المبنية بشكل أكثر حدسية في التجارب اللاحقة ، مما يوفر نموذجا خلويا جيدا جدا لدراسة العديد من الأمراض.
Disclosures
يعلن المؤلفون أنه لا يوجد تضارب في المصالح فيما يتعلق بنشر هذه الورقة.
Acknowledgements
تم دعم العمل من قبل البرنامج الوطني للبحث والتطوير الرئيسي في الصين (رقم 2022YFC2304604) ، والمؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 81971812) ، والمؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 82272235) ، ومؤسسة العلوم التابعة للجنة الصحة في مقاطعة جيانغسو (رقم. ZDB2020009) ، مشروع خاص لبرنامج البحث والتطوير الرئيسي بمقاطعة جيانغسو (التنمية الاجتماعية) (رقم BE2021734) ، البرنامج الوطني للبحث والتطوير الرئيسي التابع لوزارة العلوم والتكنولوجيا (رقم 2020YFC083700) ، مختبر مقاطعة جيانغسو الرئيسي لطب الرعاية الحرجة (BM2020004) ، المشروع الرئيسي للمؤسسة الوطنية للعلوم الطبيعية في الصين (81930058) ، المؤسسة الوطنية للعلوم الطبيعية في الصين (82171717) ، صناديق البحوث الأساسية للجامعات المركزية (2242022K4007) ، والمشروع العام لمؤسسة العلوم الطبيعية لمقاطعة جيانغسو (BK20211170).
Materials
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Rat anti-mouse CD62L, BV650, clone MEL-14, 1:200 dilution | BD | Cat# 564108; RRID: AB_2738597 | |
| Rat monoclonal anti-CD4, FITC, clone RM4-5, 1:200 dilution | BioLegend | Cat#100509; RRID: AB_312712 | |
| Rat monoclonal anti-IL-17A, PE, clone TC11-18H10.1, 1:200 dilution | BioLegend | Cat#506903; RRID: AB_ 315463 | |
| Rat monoclonal anti mouse/human CD44, APC, clone IM&, 1:200 dilution | BioLegend | Cat#103012; RRID: AB_312963 | |
| Rat monoclonal anti-RORγT, APC, clone B2D, 1:200 dilution | Invitrogen | Cat#17-6981-80; RRID: AB_2573253 | |
| Rat monoclonal FOXP3 antibody, PE, clone FJK-16s, 1:200 dilution | Invitrogen | Cat#12-5773-82; RRID: AB_465936 | |
| Chemicals, peptides, and recombinant proteins | |||
| Anti-Mouse CD3 SAFIRE purified | biogems | Cat#05112-25 | |
| Anti-Mouse CD28 SAFIRE purified | biogems | Cat#10312-25 | |
| Anti-Mouse IFN gamma | biogems | Cat#80822-25 | |
| Anti-Mouse IL-4 | biogems | Cat#81112-25 | |
| Ethanol | Xilong scientific | Cat#64-17-5 | |
| Fetal bovine serum | Gibco | Cat#10437-028 | |
| FcR Blocking reagent | Miltenyi Biotec | Cat#130-092-575 | |
| GlutaMAX supplement | gibco | Cat#35050079 | |
| Mouse rIL-1 beta | Sino Biological | Cat#50101-MNAE | |
| Mouse rIL-6 | Sino Biological | Cat#50136-MNAE | |
| Mouse rIL-23 | Sino Biological | Cat#CT028-M08H | |
| Mouse TGF beta 1 | Sino Biological | Cat#50698-M08H | |
| PBS | Procell | Cat#PB180327 | |
| Recombinant Murine IL-2 | peprotech | Cat#212-12 | |
| RPMI 1640 with L-glutamine | Gibco | Cat#11875-119 | |
| Penicillin-streptomycin solution | Gibco | Cat#15070063 | |
| β-mercaptoethanol | Sigma-Aldrich | Cat#M6250-100ML | |
| Critical commercial assays | |||
| Animal Organ Lymphocyte Separation Solution Kit | Tbdscience | Cat#TBD0018SOP | Contains animal spleen tissue lymphocyte separation liquid, tissue sample diluent (cat no. 2010C1119), sample cleaning solution (cat no. 2010X1118), sample washing solution (cat no. TBTDM-W), tissue homogenate flushing liquid (F2013TBD) |
| ChamQ SYBR qPCR Master Mix (High ROX Premixed) | Vazyme | Cat#Q341-02 | https://www.vazymebiotech.com/product-center/chamq-sybr-qpcr-master-mix-high-rox-premixed-q341.html. |
| Fixation/permeabilization Concentrate | invitrogen | Cat#00-5123-43 | |
| Fixation / Permeabilization Diluent | invitrogen | Cat#00-5223-56 | |
| Fixable Viability Dye EF506 | invitrogen | Cat#65-0866 | |
| HiScript II Q RT SuperMix for qPCR (+gDNA wiper) | Vazyme | Cat#R223-01 | https://www.vazymebiotech.com/product-center/hiscript-ii-q-rt-supermix-for-qpcr-gdna-wiper-r223.html. |
| Leukocyte Activation Cocktail | BD | Cat#550583 | |
| Mouse IL-17A (Interleukin 17A) ELISA Kit | Elabscience® | Cat#E-EL-M0047 | |
| Naïve CD4+ T cells isolation kit, mouse | STEMCELL | Cat#19765 | EasySep kit contains mouse CD4+ T cell isolation cocktail [cat no. 19852C.1], mouse memory T cell depletion cocktail [cat no. 18766C], streptavidin RapidSphered 50001 [cat no. 50001], normal rat serum [cat no. 13551]); only store rat serum at -20 °C; other components to be stored at 2-8 °C. |
| Permeabilization Buffer | invitrogen | Cat#00-8333-56 | |
| SPARKeasy Cell RNA Kit | Sparkjade | Cat#AC0205-B | https://www.sparkjade.com/product/detail?id=85 |
| Experimental models: Organisms/strains | |||
| Mouse: C57BL/6 | Gempharmatech | Cat#000013 | |
| Oligonucleotides | |||
| Mouse Il17a TaqMan primers with probe | ribobio | NA | |
| Mouse Il17f TaqMan primers with probe | ribobio | NA | |
| Mouse Il23r TaqMan primers with probe | ribobio | NA | |
| Mouse Rora TaqMan primers with probe | ribobio | NA | |
| β-actin TaqMan primers with probe | ribobio | NA | |
| Software and algorithms | |||
| Cytek Aurora | Cytek | https://spectrum.cytekbio.com/ | |
| FlowJo v10.8.1 | Tree Star | https://www.flowjo.com | |
| GraphPad prism 9 | GraphPad Software | https://www.graphpad-prism.cn | |
| Other | |||
| 1 mL syringe | Kindly | NA | |
| 1.5 mL Centrifuge tubes | Eppendorf | Cat#MCT-150-C | |
| 5 mL Round-bottom tubes | Corning | Cat#352235 | |
| 15 mL Centrifuge tubes | NEST | Cat#601052 | |
| 48-Well tissue culture plate (flatten bottom) | Corning | Cat#3548 | |
| 50 mL Centrifuge tubes | NEST | Cat#602052 | |
| 70 µm Cell strainer | Biosharp | Cat#BS-70-XBS | |
| 96-well Unskirted qPCR Plates | VIOX scientific | Cat#V4801-M | |
| 100 mm Petri dish | Corning | Cat#430167 | |
| Centrifuge | Eppendorf | 5425R | |
| Cell culture CO2 incubator | Thermo Fisher | HEPA Class100 | |
| Cytek Aurora | Cytek | NA | |
| dissecting scissors | RWD | S12003-09 | |
| Hemocytometer | AlphaCell | Cat#J633201 | |
| NanoDrop 2000 Spectrophotometer | Thermo Fisher | ND-2000 | |
| Real-time PCR System | Roche | LightCycler96 | |
| Surgical tweezers | RWD | F12005-10 | |
| Thermal cycler | Bio-Rad | C1000 Touch |
References
- Korn, T., Bettelli, E., Oukka, M., Kuchroo, V. K. IL-17 and Th17 cells. Annu Rev Immunol. 27, 485-517 (2009).
- Bhaumik, S., Basu, R. Cellular and molecular dynamics of Th17 differentiation and its developmental plasticity in the intestinal immune response. Front Immunol. 8, 254 (2017).
- Bettelli, E., Korn, T., Oukka, M., Kuchroo, V. K. Induction and effector functions of T(H)17 cells. Nature. 453 (7198), 1051-1057 (2008).
- Korn, T., et al. IL-21 initiates an alternative pathway to induce proinflammatory T(H)17 cells. Nature. 448 (7152), 484-487 (2007).
- Bettelli, E., et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature. 441 (7090), 235-238 (2006).
- Yang, X. O., et al. T helper 17 lineage differentiation is programmed by orphan nuclear receptors ROR alpha and ROR gamma. Immunity. 28 (1), 29-39 (2008).
- Ghoreschi, K., et al. Generation of pathogenic T(H)17 cells in the absence of TGF-β signalling. Nature. 467 (7318), 967-971 (2010).
- Lee, Y., et al. Induction and molecular signature of pathogenic TH17 cells. Nat Immunol. 13 (10), 991-999 (2012).
- McGeachy, M. J., et al. The interleukin 23 receptor is essential for the terminal differentiation of interleukin 17-producing effector T helper cells in vivo. Nat Immunol. 10 (3), 314-324 (2009).
- Wu, B., et al. The TGF-β superfamily cytokine Activin-A is induced during autoimmune neuroinflammation and drives pathogenic Th17 cell differentiation. Immunity. 54 (2), 308-323 (2021).
- Ramesh, R., et al. Pro-inflammatory human Th17 cells selectively express P-glycoprotein and are refractory to glucocorticoids. J Exp Med. 211 (1), 89-104 (2014).
- Basdeo, S. A., et al. Ex-Th17 (nonclassical Th1) cells are functionally distinct from classical Th1 and Th17 cells and are not constrained by regulatory T cells. J Immunol. 198 (6), 2249-2259 (2017).
- Cua, D. J., et al. Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain. Nature. 421 (6924), 744-748 (2003).
- Awasthi, A., et al. Cutting edge: IL-23 receptor gfp reporter mice reveal distinct populations of IL-17-producing cells. J Immunol. 182 (10), 5904-5908 (2009).
- Jäger, A., Dardalhon, V., Sobel, R. A., Bettelli, E., Kuchroo, V. K. Th1, Th17, and Th9 effector cells induce experimental autoimmune encephalomyelitis with different pathological phenotypes. J Immunol. 183 (11), 7169-7177 (2009).
- Lee, Y., Collins, M., Kuchroo, V. K. Unexpected targets and triggers of autoimmunity. J Clin Immunol. 34, S56-S60 (2014).
- Chang, D., et al. The conserved non-coding aequences CNS6 and CNS9 control cytokine-induced Rorc transcription during T helper 17 cell differentiation. Immunity. 53 (3), 614-626 (2020).
- Bunte, K., Beikler, T. Th17 cells and the IL-23/IL-17 axis in the pathogenesis of periodontitis and immune-mediated inflammatory diseases. Int J Mol Sci. 20 (14), 3394 (2019).
- Zhao, Y., Liu, Z., Qin, L., Wang, T., Bai, O. Insights into the mechanisms of Th17 differentiation and the Yin-Yang of Th17 cells in human diseases. Mol Immunol. 134, 109-117 (2021).
- Berghmans, N., et al. Interferon-γ orchestrates the number and function of Th17 cells in experimental autoimmune encephalomyelitis. J Interferon Cytokine Res. 31 (7), 575-587 (2011).
- Wu, B., Wan, Y. Molecular control of pathogenic Th17 cells in autoimmune diseases. Int Immunopharmacol. 80, 106187 (2020).
- Du, L., et al. Growth hormone releasing hormone signaling promotes Th17 cell differentiation and autoimmune inflammation. Nat Commun. 14 (1), 3298 (2023).
- Ernst, D. N., Weigle, W. O., Noonan, D. J., McQuitty, D. N., Hobbs, M. V. The age-associated increase in IFN-gamma synthesis by mouse CD8+ T cells correlates with shifts in the frequencies of cell subsets defined by membrane CD44, CD45RB, 3G11, and MEL-14 expression. J Immunol. 151 (2), 575-587 (1993).
- Radtke, A. J., et al. IBEX: an iterative immunolabeling and chemical bleaching method for high-content imaging of diverse tissues. Nat Protoc. 17 (2), 378-401 (2022).
- El-Hindi, K., et al. T-cell-specific CerS4 depletion prolonged inflammation and enhanced tumor burden in the AOM/DSS-induced CAC model. Int J Mol Sci. 23 (3), 1866 (2022).
- Cooney, L. A., Towery, K., Endres, J., Fox, D. A. Sensitivity and resistance to regulation by IL-4 during Th17 maturation. J Immunol. 187 (9), 4440-4450 (2011).
- Zhu, X., et al. A novel interleukin-2-based fusion molecule, HCW9302, differentially promotes regulatory T cell expansion to treat atherosclerosis in mice. Front Immunol. 14, 1114802 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved