Method Article
마우스에서 Naive CD4+ T 세포를 병원성 Th17 세포로 체외에서 분화
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 in vitro에서 naive CD4+ T 세포를 병원성 Th17 세포로 분화하는 과정을 설명합니다. 특히, 다중 파라미터 유세포 분석 기반 접근법과 결합하면 이 분화 방법을 사용하여 naïve CD4+ T 세포에서 병원성 Th17 세포의 90% 순도를 얻을 수 있습니다.
초록
인비트로(In vitro ) T 세포 분화 기법은 CD4+ T 세포의 기능적 및 기계론적 연구에 필수적입니다. 병원성 Th17 세포는 최근 다발성 경화증(MS), 류마티스 관절염, 급성 호흡곤란 증후군(ARDS), 패혈증 및 기타 자가면역 질환을 포함한 광범위한 질병과 관련이 있습니다. 그러나 현재 알려진 in vitro 분화 프로토콜은 고순도의 병원성 Th17 세포를 달성하는 데 어려움이 있으며, 유도 효율이 종종 50% 미만이며, 이는 in vitro 실험의 주요 과제입니다. 이 프로토콜에서는 병원성 Th17 세포에 대한 향상된 시험관 내 배양 및 분화 프로토콜을 제안하며, 이는 마우스 비장에서 분리된 naive CD4+ T 세포를 병원성 Th17 세포로 직접 분화하는 데 사용됩니다. 이 프로토콜은 비장 세포 분리, naive CD4+ T 세포 정제 및 병원성 Th17 세포 분화에 대한 자세한 지침을 제공합니다. 이 프로토콜을 통해 병원성 Th17 세포에 대해 약 90%의 분화 순도를 달성할 수 있으며, 이는 많은 세포 실험의 기본 요구 사항을 충족합니다.
서문
흉선을 떠난 후, 미성숙한 CD4+ T 림프구는 2차 림프구를 통과합니다. 상동성 항원을 naive CD4+ T 세포에 전달하는 항원 제시 세포는 이 세포를 활성화하여 일련의 분화 프로그램을 시작하여 결국 고도로 전문화된 T helper(Th) 세포 계통을 생산하게 됩니다1. 인터루킨 17(IL-17) 생산은 전염증성 Th 세포의 하위 집단인 Th17 세포를 특성화합니다2. Th17 세포는 세포외 병원체에 대한 숙주의 방어와 자가면역 포도막염 및 다발성 경화증과 같은 많은 자가면역 질환의 발병에 중요한 역할을 합니다. T 세포 수용체 및 사이토카인 IL-6 및 형질전환 성장 인자 β(TGF-β)의 신호는 신호 전달자 및 전사 활성제(STAT)의 인산화를 통해 미성숙 T 세포를 Th17 세포로 분화하도록 유도합니다.33. STAT3는 IL-23 및 IL-21 4,5에 의해 매개되는 시그널링을 통한 포지티브 피드백 루프에서 더욱 증폭됩니다. STAT3의 인산화는 Th17 세포에서 IL-17A, IL-17F, IL-21 및 IL-22의 사이토카인 프로필을 조절하는 마스터 스위치 역할을 하는 전사 인자 RORγt 및 RORα의 발현을 유도할 수 있습니다6. 그러나 IL-6 및 TGF-β 유도 Th17 세포는 IL-23에 의한 동시 자극 또는 TGF-β 7,8이 없는 경우 IL-23에 의한 동시 자극 또는 IL-6, IL-1β 및 IL-23의 별도 동시 자극이 필요한 자가면역 질환을 유발하기에 불충분한 것으로 보고되었습니다.
실험적 자가면역 뇌척수염(EAE)을 효과적으로 유도할 수 없는 Th17 subset은 비병원성 Th17이라고도 하며, EAE를 유도할 수 있는 Th17 subset은 병원성 Th17로 알려져 있다9. 현재 연구에 따르면 병원성 Th17과 비병원성 Th17이 핵심 전사 인자 RORγt를 함께 발현하지만, IL-17A를 생성하는 능력과 전염증 및 항염증 특성에는 큰 차이가 있는 것으로 나타났습니다10. 병원성 Th17 세포는 Th17의 일반적인 특성 전사 인자인 RORγt, CCR6, STAT4 및 RUNX4의 높은 발현 외에도 Th1 cell subset의 특성을 가진 TBX21, IFN-γ, CXCR3 등 질병과 관련된 추가적인 유전자 신호 발현 특성을 보여줍니다. 병원성 Th17 세포는 높은 수준의 과립구-대식세포 집락 자극 인자(GM-CSF), IFN-γ, TNF-α 및 기타 사이토카인을 분비할 수 있습니다11,12. 비병원성 Th17 세포의 표현형은 불안정하며, CD3 및 사이토카인 IL-2의 자극 하에서만 이러한 세포 중 일부가 병원성 Th17 세포로 분화할 수 있습니다. 따라서 류마티스 관절염, 다발성 경화증 및 급성 호흡곤란 증후군과 같은 일반적인 임상 질환 모델에서 병원성 Th17 세포는 주로 병원성 효과를 발휘합니다.
병원성 및 비병원성 Th17 세포는 다양한 사이토카인의 영향으로 시험관 내에서 분화할 수 있습니다. 최근 몇 년 동안 여러 연구에서 다양한 유형과 농도의 사이토카인을 사용하여 Th17 세포의 분화를 유도하는 방법을 제안했습니다. Th17 세포는 IL-6, IL-1β 및 IL-23 13,14,15,16의 조합에 의해 자극됩니다. Th17 세포 분화에 필요한 두 가지 사이토카인인 IL-6 및 TGF-β가 Rorc 유전자좌17에서 두 개의 서로 다른 보존된 non-coding DNA 서열과 상호 작용하여 RORγt 및 Th17 세포 분화의 발현을 시너지 효과로 조절하는 것으로 입증되었습니다. 병원성 Th17 세포의 안정상은 주로 IL-2318,19에 의해 유지된다. IL-23은 수용체에 결합하고 JAK-STAT 신호 경로20을 활성화하여 Jak2 및 Tyk2의 인산화를 유발하고 STAT1, STAT3, STAT4 및 STAT5의 인산화를 촉진합니다. IL-4 및 IFN-γ는 이 경로의 음성 조절자입니다. 그러나 연구에 따르면 IL-1β는 Th17 세포 표현형21의 안정성을 유지하기 위해 mTOR 경로를 통해 Rorα 및 Rorγt의 전사를 긍정적으로 조절할 수 있습니다.
수많은 연구의 이질성으로 인해 최신 연구에서 병원성 및 비병원성 Th17 세포에 대한 유도 프로토콜을 대조군22로 선택했습니다. 결과는 모든 것이 이 프로토콜에 따라 수행된다고 가정할 때 병원성 Th17을 생성하는 조건에서 5일 동안 배양한 후 살아남은 세포의 90% 이상이 병원성 Th17 세포가 될 수 있음을 나타냅니다.
프로토콜
동남대학교의 동물연구를 위한 기관 검토 위원회(Institutional Review Committee for Animal Studies)는 이 연구에 자세히 설명된 모든 동물 연구를 승인했으며, 이는 지역 및 기관 사무실 표준에 따라 수행되었습니다. 비장 샘플은 C57BL6/J 마우스에서 채취하였다. 5주에서 8주 사이의 암컷과 수컷 쥐 모두가 이 연구에 포함되었습니다. 배양 배지 및 완충액은 4°C에서 최대 1개월 동안 보관하였다. 수술 기구는 사용 전에 고압 멸균되었습니다. 시약으로 피부, 눈 및 의복이 오염되지 않도록 라텍스 장갑과 마스크를 착용하십시오. 피부와 눈에 물이나 식염수를 많이 사용하십시오.
1. 24웰 조직 배양 플레이트에 anti-CD3 사전 코팅
- 멸균 1x 인산염 완충 식염수(PBS) 또는 RPMI 1640 배지에 anti-CD3를 최종 농도 1μg/mL로 희석합니다.
- 24웰 조직 배양 플레이트에 1mL의 항-CD3 용액(1μg/mL)을 잘 채웁니다. 그런 다음 파라 필름으로 우물을 덮으십시오.
- anti-CD3 코팅 플레이트를 냉장고(2°C-8°C)에 16시간 동안 넣거나 세포 인큐베이터에서 37°C에서 2-3시간 동안 보관합니다.
2. 마우스 비장 분리 및 비장 단세포 현탁액의 제조
- 3% 이소플루란으로 C57BL/6J에서 완전 마취를 유도하고 2분 동안 100% 이산화탄소를 흡입하여 안락사시킵니다. 생쥐가 죽은 직후에는 오염을 방지하기 위해 소독을 위해 75% 에탄올에 담그십시오.
- 깨끗한 벤치에 마우스를 누운 자세로 놓고 복부 정중선을 따라 잘라 열고 복부 구조를 층별로 분리합니다. 핀셋으로 대구와 위를 부드럽게 열고 위비장 인대로 비장을 부드럽게 빼내고 비장을 주변 조직 및 인대와 뭉툭하게 분리하여 온전한 비장을 얻습니다(비장이 눌리거나 파열되지 않도록 주의).
알림: 멸균 상태를 유지하기 위해 멸균 슈퍼 클린 벤치에서 다음 작업을 수행합니다. - 70μm 세포 필터를 100mm 멸균 배양 접시에 넣고 비장을 세포 여과기에 넣고 주사기 플런저로 분쇄합니다. 동시에 5-8mL의 균질액 세척액을 추가하여 필터를 통해 모든 세포를 배양 접시로 밀어 넣습니다.
알림: 림프구 분리액 키트의 구성은 재료 표에서 볼 수 있습니다. - 여과액을 450× g 에서 실온에서 5분 동안 원심분리합니다. 상층액을 버리십시오.
- 림프구 분리 키트 또는 PBS 또는 RPMI 1640 배지와 함께 제공된 샘플 희석제로 세포 펠릿을 재현탁시킵니다. 세포 현탁액의 세포 농도를 2 × 108-1 × 109 cells/mL로 조정합니다.
참고: 일반적으로 비장 하나에 4-6mL의 시료 희석제가 필요합니다. - 원심분리기 튜브에서 조직 단세포 현탁액과 동일한 양의 림프구 분리 용액을 복용합니다. 단세포 현탁액을 림프구 분리 용액의 표면에 조심스럽게 피펫팅하고 800× g, 25°C에서 30분 동안 원심분리합니다. 원심분리기의 가속 및 감속을 적절한 범위로 설정합니다(예: 일반적인 1-9 기어가 있는 경우 3으로 설정).
참고: 림프구 분리 용액은 3mL 이상이어야 합니다. - 원심분리 후 원심분리기 튜브의 4개 층을 위에서 아래로 관찰합니다. 첫 번째 층은 샘플 희석제에 해당하고 그 다음은 환형 유백색 림프구 층에 해당합니다. 세 번째 층은 분리액이고 네 번째 층은 적혈구로 구성됩니다.
- 피펫을 사용하여 환형 유백색 림프구 층의 두 번째 층을 다른 원심분리기 튜브에 조심스럽게 끌어들이고 원심분리기 튜브에 10mL의 세척액을 추가하여 세포를 혼합합니다.
- 250× g 에서 실온에서 5분 동안 원심분리합니다. 상층액을 버리십시오. 10mL의 RPMI 1640 배지를 사용하여 세포 계수를 위해 세포 펠릿을 재현탁시킵니다.
3. magnetic bead의 negative selection에 기반한 naive CD4+ T cell의 정제
참고: 면역자기 음성 선택을 통해 마우스 비장 세포에서 손대지 않고 고도로 정제된 naive CD4+ T 세포(CD4+CD44lowCD62Lhigh)를 분리합니다.
- 0.1-2mL의 부피 범위 내에서 1 × 108 cells/mL를 갖도록 샘플을 준비합니다.
- 50μL/mL의 쥐 혈청을 넣고 샘플을 5mL 폴리스티렌 둥근 바닥 튜브로 옮깁니다.
참고: naive CD4 T cell sorting kit의 구성은 재료 표에서 볼 수 있습니다. - 50 μL/mL의 Isolation Cocktail을 샘플에 넣고 잘 섞은 다음 실온에서 7.5분 동안 배양합니다.
- 50 μL/mL의 Depletion Cocktail을 샘플에 넣고 잘 섞은 다음 실온에서 2.5분 동안 배양합니다.
- 균일한 분산을 보장하기 위해 마그네틱 비드를 소용돌이치게 합니다. 75 μL/mL의 마그네틱 비드를 샘플에 넣고 잘 섞은 다음 실온에서 2.5분 동안 배양합니다.
참고: 입자는 균일하게 분산되어 나타나야 합니다. 소용돌이 시간은 30초 이상이어야 합니다. - RPMI 1640 배지로 시료를 최종 부피 2.5mL까지 보충합니다. 위아래로 부드럽게 피펫팅하여 여러 번 혼합합니다.
- 튜브(뚜껑 제외)를 자석에 넣고 실온에서 2.5분 동안 배양합니다.
- 자석을 집어 들고 자석과 튜브를 한 번의 연속 동작으로 뒤집고 농축된 셀 현탁액을 새 튜브에 붓습니다.
알림: 튜브와 자석을 똑바로 세우기 전에 2-3초 동안 뒤집어 두십시오. 튜브 입구에 남아 있을 수 있는 방울을 방해하지 마십시오. - 혈구계를 사용하여 세포 수를 결정합니다.
- 분리 전후에 naive CD4+ T cell에 대한 유세포 분석을 수행합니다(그림 1).
- 세포를 새 원심분리기 튜브로 옮기고 실온에서 400×g에서 5분 동안 원심분리한 다음 상층액을 버립니다.
- 200-500 μL의 RPMI 1640 배지(10% 소 태아 혈청 보충)에 세포를 재현탁시킵니다. 세포 배양 1mL(예: ~106세포/mL)당 2μL의 백혈구 활성화 칵테일을 추가하고 혼합합니다. CO2 인큐베이터에서 37°C와 포화 습도에서 4-6시간 동안 세포를 배양합니다.
참고: 세포는 1-2시간마다 한 번씩 소용돌이쳤습니다. - 400× g, 4°C에서 5분 동안 셀을 원심분리합니다. 상층액을 조심스럽게 버리고 200μL의 PBS에 세포를 재현탁시킵니다. 세포에 1μL의 Fc 차단제를 추가합니다(예: ~106 cells/mL). 4°C에서 10분 동안 세포를 배양합니다.
- 400× g 에서 4°C에서 5분 동안 원심분리하여 PBS 1mL로 세포를 한 번 세척합니다. 상층액을 버리고 200μL의 PBS에 세포를 재현탁시킵니다.
- 항체 칵테일 (Fixable Viability Dye, 1 : 1,000; anti-CD4, 1 : 200; anti-CD44, 1 : 200; anti-CD62L, 1 : 200)을 넣고 4 ° C의 어두운 곳에서 15-20 분 동안 세포를 배양합니다.
- 2 x 1mL의 PBS로 세포를 세척한 다음 400× g 으로 4°C에서 5분 동안 원심분리합니다.
- 상층액을 버리고 세포를 250μL의 고정 완충액에 재현탁시킨 다음 4°C의 어두운 곳에서 40-60분 동안 배양합니다.
참고: 수정 완충액은 투과화 희석제로 희석해야 하는 4x 스톡 용액인 Foxp3/transcription factor 염색 완충액과 함께 제공됩니다. - 1x 투과화 완충액 1mL를 추가하여 세포를 300× g, 4°C에서 5분 동안 원심분리하여 세포를 2배 세척합니다.
- 상층액을 버리고, 200μL의 투과화 완충액에 세포를 재현탁시킨 다음 항체(Foxp3 [nuclear], 1:200)를 세포에 추가합니다. 고정 및 막 파열 후 세포-항체 혼합물을 어두운 곳에서 40-60분 동안 배양하고 4°C에서 가끔 짧게 흔듭니다.
알림: 투과성/세척 용액은 PBS와 함께 사용하기 전에 희석해야 하는 10배 스톡 용액입니다.
4. in vitro에서 병원성 Th17 세포 유도
- 사용하기 전에 사전 코팅된 24웰 플레이트에서 멸균 PBS를 제거합니다.
- Th0 세포 배양 배지(표 1), 고전적 비병원성 Th17 배양 배지(표 1) 및 고전적 병원성 Th17 배양 배지(표 1)를 포함한 배양용 Th17 세포 배양 배지(표 1)와 조영제를 사용합니다. 농축된 naive CD4 + T 세포를 재현탁하고 동일한 24웰 플레이트(anti-CD3로 사전 코팅됨)의 다른 웰에 분주하여 농도를 4 × 105 cells/mL로 조정하고 각 웰에 1mL의 배지를 사용합니다.
- 1 μL/mL의 anti-CD28 용액(최종 농도: 2 μg/mL로 매체로 희석)을 각 웰에 추가합니다. 37°C의 5% CO2 인큐베이터에서 5일 동안 세포를 배양합니다.
- 세포 배양 상층액 배지를 배양 배지(Th0, 비병원성 Th17, 고전적 병원성 Th17 및 대물렌즈 Th17)로 조심스럽게 피펫팅하여 세포가 고르게 분포되도록 교체하고 세포가 포함된 배지의 절반을 버린 다음 2일차에 폐기량과 동일한 새 배지를 추가합니다. 4일째에 반복합니다.
- 5일째에 광학 현미경으로 세포를 관찰합니다(그림 2). 각 그룹에서 세포 상층액을 수집하고 -80°C에서 냉동 보존합니다.
5. 병원성 Th17 및 Th0 세포 분화를 위한 유세포 분석
- 배양 시작 후 5일 후에 모든 세포(웰당)를 수확합니다. 3.12-3.15단계를 수행합니다.
- 항체 칵테일(Fixable Viability Dye, 1:1,000; anti-CD4, 1:200)을 넣고 4°C의 어두운 곳에서 15-20분 동안 세포를 배양합니다.
- 3.17-3.19단계를 수행합니다.
- 상층액을 버리고, 세포를 200μL의 투과화 완충액에 재현탁시키고, 항체 칵테일(IL-17A [intracellular], 1:200; RORγT [핵], 1:200)을 세포에 추가합니다. 고정 및 막 파열 후 세포-항체 혼합물을 어두운 곳에서 40-60분 동안 배양하고 4°C에서 가끔 짧게 흔듭니다.
- 1mL의 1x 투과성/세척 용액을 추가하여 세포를 2배 세척하고 400× g 에서 4°C에서 5분 동안 세포를 원심분리합니다. 그런 다음 상층액을 버리십시오.
- 유세포분석기에서 세포를 검사하고 소프트웨어를 사용하여 데이터를 분석합니다(그림 3).
- 유세포분석기를 켜고 자가 시작 세척 및 보정 프로세스를 켭니다.
- 이 실험에 사용된 레이저 채널을 선택하고 빈 튜브, 단일 염색 튜브 및 샘플 튜브를 설정합니다.
- 빈 튜브 옵션을 클릭하고 기계에서 테스트하십시오. 볼륨 조정tage 셀 이벤트가 가능한 한 수집 상자의 중앙에 오도록 합니다.
- 단일 염색된 튜브 세포를 수집하고 해당 채널의 스펙트럼 검출을 수행하여 형광 항체가 올바르게 추가되었는지 확인합니다.
- unmix 버튼을 클릭하고 기계가 스펙트럼 보정을 자동으로 조정하도록 합니다. 다른 유세포 분석 기기를 사용하여 형광 보정을 일반적으로 조정하십시오.
- 각 샘플 튜브 셀을 수집하고 데이터 형식을 FCS 파일로 저장한 다음 내보냅니다. 관련 유세포 분석 데이터 분석 소프트웨어에서 분석하고 플롯합니다.
- 주 세포 집단에 동그라미를 치고 FSC-H 및 FSC-A의 대각선 원 게이트를 통해 가능한 세포 접착을 제거합니다.
- FVS 네거티브 서클 영역에 따라 라이브 셀을 동그라미로 만듭니다. 다음으로, CD4+ 세포 집단에 동그라미를 칩니다.
- 수평축을 IL-17 A로, 수직축을 RORγT로 하여 크로스게이트를 구축합니다. Q2 영역의 이중 양성 선택은 Th17 세포 집단입니다.
6. 다양한 매체에 의해 유도된 IL-17A 분비 검출을 위한 효소 결합 면역흡착 분석법(ELISA)
- 섹션 4.5에서 수집된 동결 세포 상층액을 해동합니다.
- 희석된 표준물질 100μL를 블랭크 및 샘플로 지정된 웰에 넣습니다. 밀봉기를 사용하여 플레이트를 덮고 37°C에서 90분 동안 배양합니다.
알림: 내벽을 만지거나 거품을 일으키지 않고 micro-ELISA 플레이트 웰의 바닥에 용액을 추가하십시오. - 각 웰에서 액체를 디캔팅하고 즉시 100μL의 비오틴화 검출 항체 작업 용액을 추가합니다. 새 밀봉기를 사용하여 플레이트를 덮고 37°C에서 1시간 동안 배양합니다.
- 용액을 디캔팅하고 각 웰에 350μL의 세척 완충액을 추가합니다. 1분 후 각 웰에서 용액을 흡입하거나 디캔팅하고 깨끗한 흡수성 종이에 두드려 건조시킵니다. 이 세탁 단계를 3회 반복합니다.
- 100 μL의 양 고추냉이 과산화효소 접합 작업 용액을 각 웰에 추가합니다. 새 밀봉기를 사용하여 플레이트를 덮고 37°C에서 30분 동안 배양합니다.
- 각 웰에서 용액을 디캔팅하고 5단계에서 설명한 대로 세척 과정을 6.4번 반복합니다.
- 각 웰에 90 μL의 기질 시약을 추가하고 플레이트를 빛으로부터 보호하여 새 밀봉기로 37 °C에서 약 15 분 동안 배양합니다.
알림: 반응 시간은 실제 색상 변화에 따라 변경할 수 있지만 30분을 초과해서는 안 됩니다. OD 측정 전에 마이크로플레이트 리더를 ~15분 동안 예열하십시오. - 50 μL/웰의 Stop Solution을 기질 용액과 동일한 순서로 추가합니다.
- 각 웰의 광학 밀도(OD 값)를 450nm로 설정된 microplate reader를 사용하여 한 번에 측정합니다.
- 표준 샘플에 대한 OD 값을 구하고 샘플의 반복 웰을 구하고, 빈 웰의 OD 값을 빼서 수정된 값을 얻습니다. 그런 다음, 농도를 가로 좌표축으로, OD 값을 세로좌표로 하여 선형 피팅을 수행합니다. 적합된 방정식을 기반으로 샘플 웰의 IL-17A 농도 값을 계산합니다.
참고: 4일간의 분화 후 각 그룹의 상층액에 있는 IL-17A의 함량은 그림 4에 나와 있습니다. 피팅 방법은 Orgin21 소프트웨어를 참조할 수 있습니다. 이 실험에서 얻은 표준 곡선의 R2 값은 0.9946입니다.
7. 정량적 PCR(qPCR)을 통한 시그니처 유전자 발현 분석에 의한 T 세포 분화
참고: 염료의 영향 및 고정/파열로 인한 유세포 분석 불안정 가능성을 배제하기 위해 qPCR에 의한 특성 유전자의 발현을 검출하여 전사 수준에서 병원성 Th17의 분화 효과를 규명했습니다.
- T 세포 배양 말기의 세포 수를 측정합니다. 1.5mL 원심분리기 튜브에 세포를 수집하고 400× g 에서 5분 동안 원심분리합니다. 모든 상층액을 조심스럽게 버리십시오.
- RNA 추출
알림: 추출 과정은 RNA 효소 오염을 방지하기 위해 흄 후드 또는 매우 깨끗한 벤치에서 수행해야 합니다.- 500 μL의 용해 완충액(예: 1-2 × 106 세포)을 시료 튜브에 추가하고(단계 7.1), 즉시 세포 질량이 없을 때까지 흔들어 혼합한 다음 1분 동안 그대로 둡니다.
- 혼합물을 수집 튜브에 놓인 흡착 컬럼에 넣고 13,400× g 에서 30초 동안 원심분리한 다음 여과액을 버립니다.
- 처음 사용하기 전에 Washing Buffer 병에 지정된 양의 절대 에탄올을 추가하십시오. 흡착 컬럼에 세척 완충액 500μL를 추가하고 13,400× g 에서 30초 동안 원심분리한 다음 여과액을 버립니다.
- 7.2.3단계에서 세탁을 반복합니다.
- 흡착 컬럼 RA를 빈 수집 튜브에 넣고 13,400× g 에서 2분 동안 원심분리하여 헹굼 용액을 제거합니다.
알림: 헹굼 용액의 잔류 에탄올이 다운스트림 반응을 억제하지 않도록 헹굼 용액을 제거해야 합니다. - 흡착 컬럼 RA를 제거하고 깨끗한 RNase가 없는 원심분리기 튜브에 넣습니다. 흡착막 중앙에 RNase-free H2O 50 μL를 첨가하고 실온에서 1분 동안 방치한 후 9,600 × g 에서 1분 동안 원심분리합니다.
- RNA의 순도와 농도를 측정합니다.
- 키트 제조업체의 지침에 따라 cDNA의 첫 번째 가닥을 합성합니다.
- 게놈 DNA를 제거합니다. RNase-free 원심분리기 튜브에서 추출된 템플릿 RNA 500ng를 취합니다. RNase-free ddH2O 및 4x gDNA 혼합물을 첨가하여 혼합물을 형성합니다. 피펫으로 부드럽게 블렌딩하고 42°C 수조에 2분 동안 담뱉니다.
참고: 반응 혼합물의 양과 첨가된 양은 RNA 농도와 관련이 있습니다. 자세한 내용은 지침을 참조하십시오. 이 실험에는 20μL 반응 시스템이 사용되었습니다. - 이전 단계의 반응 튜브에 5x 역전사 반응 시스템을 직접 추가합니다. 이전 단계에서 4 μL의 역전사 반응 시스템과 16 μL의 혼합물을 취하여 피펫으로 부드럽게 혼합합니다.
참고: 역전사 시스템에는 직접 구성된 역전사 시스템인 필요한 모든 역전사 효소가 포함됩니다. - 역전사 반응을 37°C 15분, 85°C, 5초로 설정하고 마지막으로 4°C로 냉각합니다.
- 게놈 DNA를 제거합니다. RNase-free 원심분리기 튜브에서 추출된 템플릿 RNA 500ng를 취합니다. RNase-free ddH2O 및 4x gDNA 혼합물을 첨가하여 혼합물을 형성합니다. 피펫으로 부드럽게 블렌딩하고 42°C 수조에 2분 동안 담뱉니다.
- 제조업체의 지침에 따라 PCR 반응을 설정합니다.
- qPCR 튜브에 2x PCR 반응 효소 혼합물 10μL, 프라이머 1 0.4μL, 프라이머 2 0.4μL, ROX 참조 염료 1 50배 0.4μL, 템플릿 cDNA 2μL 및 ddH2O6.8μL를 추가하여 20μL 혼합물을 제조합니다.
- 다음 설정을 사용하여 실시간 형광 정량 PCR 기기에서 PCR을 수행합니다: stage 1, 95 °C, 30 s, Rep x 1; 2단계, 처음 95°C, 10초, 그 다음 60°C, 30초, Rep x 40; 3단계, 처음 95°C, 15초, 다음 60°C, 60초, 마지막으로 95°C, 15초, Rep x 1.
참고: 4일간의 분화 후 naive CD4+ T 세포에서 Il17a, Il17f, Rora 및 Il23r의 상대적 발현 수준이 그림 5에 나와 있습니다.
결과
당사의 프로토콜은 병원성 Th17 세포 분화에 대한 이전 연구를 기반으로 개발되었습니다. 실험의 첫 번째 단계는 자기 비드 분류를 통해 비장에서 분리된 naive CD4+ T 세포의 순도를 검출하는 것이며, 이는 후속 병원성 Th17 세포 분화 성공의 기초가 됩니다. naive CD4+ T 세포의 순도는 표면 마커 CD62L23 및 CD4424 를 사용하여 검출되었으며 FOXP325 는 Treg 세포의 마커로 사용되었습니다. 분류 후 Treg 세포의 함량이 현저히 감소했으며 naive CD4+ T 세포의 순도가 95% 이상에 도달할 수 있음을 발견했습니다(그림 1). 병원성 Th17 세포의 분화를 비교하기 위해 naive CD4+ T 세포를 Th0 배지(표 1) 및 Th17 분화 배지(표 1)로 총 5일 동안 배양했습니다. T 세포는 Th0 및 Th17 매체 모두에서 클러스터 성장을 보이는 것으로 밝혀졌습니다(그림 2).
다음으로, 세포를 고정, 투과화하고 유세포 분석을 기반으로 분화된 CD4+ T 세포에서 여러 사이토카인에 대한 항체로 표지했습니다. Th17 세포 분화의 특징인 IL17A26 및 RORγT27 을 조사한 결과, naive CD4+ T 세포의 90%가 새로운 Th17 세포 배양 배지의 자극 하에 병원성 Th17 세포로 성공적으로 분화했음을 발견했습니다(그림 3). 그림 5 는 PCR에 의해 검출된 Th17 세포의 시그니처 유전자를 나타낸 것으로, 분화로 얻은 병원성 Th17 세포가 안정적으로 발현되고 있음을 입증하였다.
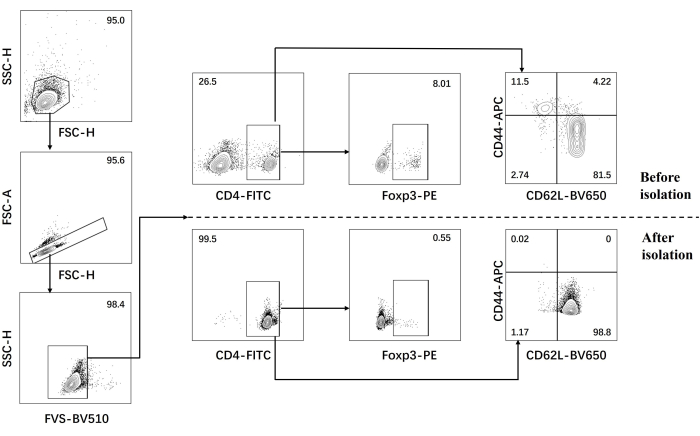
그림 1: naive CD4+ T 세포 분리 전후의 C57BL/6J 마우스에서 시그니처 사이토카인 분석을 위한 게이팅 전략. 약어: FSC-H = 전방 산란 피크 높이; SSC-H = 측면 산란-완두콩 높이; FSC-A = 전방 산란 피크 면적; FITC = 플루오레세인 이소티오시아네이트; PE = 피코에리트린. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
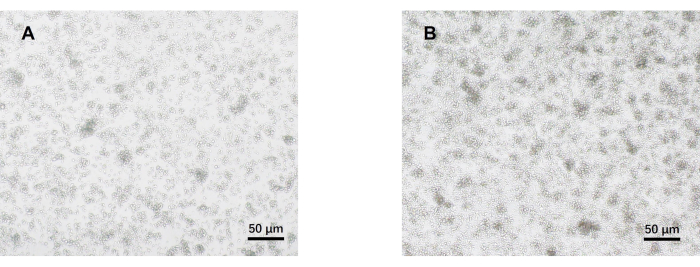
그림 2: 병원성 Th17 및 Th0 조건에서 5일 동안 배양한 마우스 순진한 CD4+ T 세포의 대표 이미지. (A) Th0 세포; (B) 병원성 Th17 세포. 스케일 바 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
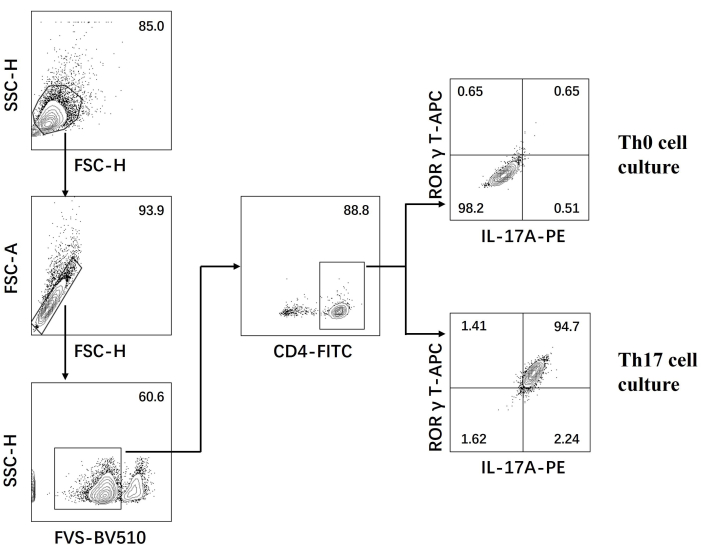
그림 3: Th0 세포 배양 배지 및 Th17 세포 배양 배지에 의해 유도된 분화 후 유세포 분석. 약어: FSC-H = 전방 산란 피크 높이; SSC-H = 측면 산란-완두콩 높이; FSC-A = 전방 산란 피크 면적; FITC = 플루오레세인 이소티오시아네이트; PE = 피코에리트린. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
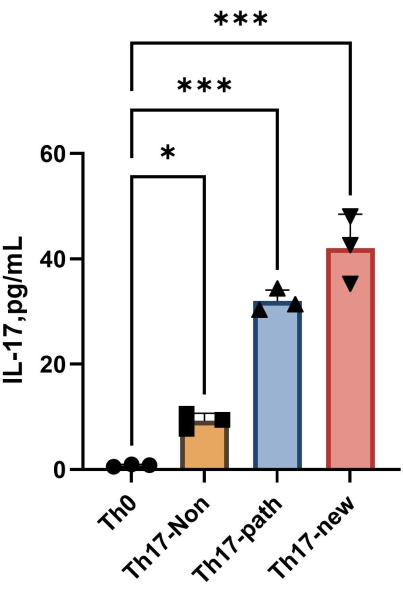
그림 4: 분화 유도 후 Th0 세포 배양 배지와 Th17 세포 배양 배지의 상층액에서 IL-17A의 함량. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
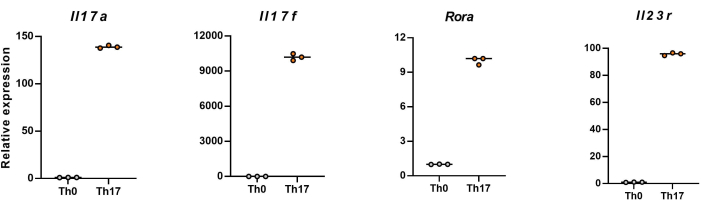
그림 5: C57BL/6J 마우스의 분화된 CD4+ T 세포에서 시그니처 사이토카인의 발현 수준을 나타내는 대표적인 결과. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 표적 병원성 Th17 세포 배양 배지 | Th0 세포 배양 배지 | 고전적인 비병원성 Th17 세포 배양 배지 | 고전적인 병원성 Th17 세포 배양 배지. | |||||||||||
| 시약 | 최종 농도 | 분량 | 최종 농도 | 분량 | 최종 농도 | 분량 | 최종 농도 | 분량 | ||||||
| 페니실린-스트렙토마이신(×100) | 1배 | 500 마이크로리터 | 1배 | 500 마이크로리터 | 1배 | 500 마이크로리터 | 1배 | 500 마이크로리터 | ||||||
| 소 태아 세럼 | 10% | 5mL | 10% | 5mL | 10% | 5mL | 10% | 5mL | ||||||
| β-메르캅토에탄올 | 50 마이크로미터 | 50 μL | 50 마이크로미터 | 50 μL | 50 마이크로미터 | 50 μL | 50 마이크로미터 | 50 μL | ||||||
| GlutaMAXTM 보충제(×100) | 1배 | 500 마이크로리터 | 1배 | 500 마이크로리터 | 1배 | 500 마이크로리터 | 1배 | 500 마이크로리터 | ||||||
| 피루브산 나트륨 용액(×100) | 1 m엠 | 500 마이크로리터 | 1 m엠 | 500 마이크로리터 | 1 m엠 | 500 마이크로리터 | 1 m엠 | 500 마이크로리터 | ||||||
| 안티-마우스 IFN 감마(1mg/mL) | 5μg/mL | 250 마이크로리터 | 10μg/mL | 500 마이크로리터 | 10μg/mL | 500 마이크로리터 | ||||||||
| 안티-마우스 IL-4 (2 mg/mL) | 5μg/mL | 125 마이크로리터 | 5μg/mL | 250 마이크로리터 | 10μg/mL | 250 마이크로리터 | ||||||||
| 마우스 rIL-1 베타(20μg) | 20ng/mL | 해당 없음 | ||||||||||||
| 마우스 rIL-6 (20 μg) | 20ng/mL | 해당 없음 | 50ng/mL | 해당 없음 | 50ng/mL | 해당 없음 | ||||||||
| 마우스 rIL-23 (50 μg) | 50ng/mL | 해당 없음 | 10ng/mL | 해당 없음 | ||||||||||
| 마우스 TGF 베타(100μg) | 3ng/mL | 해당 없음 | 1ng/mL | 해당 없음 | 1ng/mL | 해당 없음 | ||||||||
| 뮤린 IL-2 (5 μg) | 20ng/mL | 해당 없음 | ||||||||||||
| RPMI 1640년 | 해당 없음 | 최대 50mL | 해당 없음 | 최대 50mL | 해당 없음 | 최대 50mL | ||||||||
| 합계 | 해당 없음 | 50mL | 해당 없음 | 50mL | 해당 없음 | 50mL | ||||||||
표 1: 표적 병원성 Th17 세포 배양, Th0 세포 배양, 고전적인 비병원성 및 병원성 Th17 세포 배양 배지.
토론
이 절차는 병원성 Th17 세포의 시험관 내 생산을 위해 생쥐 비장 순진한 CD4+ T 세포의 수를 증가시키는 생산적인 방법을 제공했습니다. 당사는 보고된 다른 Th17 세포 배양 배지보다 더 많은 사이토카인을 사용하지만, 병원성 Th17 세포의 성장 조건을 최적화하기 위해 최선을 다하고 있습니다. 우리는 유도 차별화 프로토콜의 추가 최적화를 고려하고 있습니다.
여기서는 유세포 분석과 qPCR을 사용하여 특징적인 사이토카인의 생산을 조사했습니다. 몇 가지 사소한 수정을 통해 이 접근 방식은 세포 증식과 같은 다른 기능 테스트에도 사용할 수 있습니다.
우리는 중국에서 생산된 림프구 분리 키트를 사용하여 쥐 비장 림프구를 분리했는데, 이는 효과적이고 시간을 절약할 수 있기 때문입니다. 다른 브랜드를 기반으로 하는 림프구 분리 솔루션도 여러 단계를 통해 마우스 비장 림프구를 분리하는 목적을 달성할 수 있습니다. 또 다른 방법은 얻어진 비장 세포 현탁액의 적혈구를 직접 용해하는 것입니다. 그러나 우리는 비장 적혈구가 한 번에 용해되지 않는 경우가 많다는 것을 발견했습니다.
이 프로토콜을 실행하는 동안 몇 가지 문제가 발생할 수 있습니다. 첫째, 마그네틱 비드 분류에 의해 얻어진 naive CD4+ T cell의 수가 매우 적을 수 있습니다(프로토콜 단계 3). 이것은 장기를 분쇄하는 과정이 불충분하기 때문일 수 있습니다. 장기가 적절하게 균질화되었는지 확인하는 것이 중요합니다. 균질화 과정에서 헹굼 빈도를 늘리면 회수율이 향상됩니다. 더 많은 수의 비장 순진한 CD4+ T 세포를 얻으려면 더 어린 마우스(6-10주령)를 사용하는 것이 좋습니다. 비장 림프구를 분리하는 방법에는 여러 가지가 있으며, 사용하는 분리액에 따라 수율이 달라질 수 있습니다. 보편적으로 인증된 분리액을 사용하고 가능한 한 림프구층을 추출하도록 노력하는 것이 좋습니다.
둘째, 유세포 분석에서 CD4+ T 세포의 비율은 <80%일 수 있습니다(프로토콜 단계 5). 이 문제의 한 가지 가능한 원인은 부정확한 비장 세포 수일 수 있으며, 이로 인해 추가 항체 칵테일 및 자성 비드의 세포 수보다 더 많은 세포 수가 발생할 수 있습니다. naive CD4+ T 세포 정제의 효과를 높이려면 세포 계수가 정밀해야 합니다. 또한 이 프로토콜에서 권장하는 것보다 10% 더 많은 항체 칵테일과 마그네틱 비드를 사용할 수 있습니다. 마지막으로, naive CD4+ T 세포를 분류한 직후 유세포 분석을 수행할 수 있습니다.
셋째, 배양 중에 형성된 T 세포 클러스터가 많지 않을 수 있으며, 대부분의 세포가 T 세포의 분화 중에 죽었을 수 있습니다(프로토콜 단계 4). 이 문제의 잠재적 원인은 seeding 전에 naive CD4+ T cell의 세포 수를 부정확하게 측정하여 세포 밀도가 낮아지기 때문일 수 있습니다. 48웰 플레이트의 각 웰에 대해 약 4 × 105 cells/mL의 원하는 세포 밀도를 달성하기 위해 보다 정확한 계수 방법을 채택하는 것이 좋습니다. 또 다른 가능한 원인은 잘못된 온도 또는 CO2 농도와 같은 CO2 인큐베이터의 기술적 문제일 수 있습니다. 마지막으로, 세포 배양 배지를 변경하는 동안 과도한 힘을 가하면 잠재적으로 세포 사멸을 유발할 수 있습니다.
넷째, 시그니처 사이토카인 유전자의 상대적 발현 수준이 낮을 수 있다(프로토콜 단계 7). 추출된 RNA의 신뢰성을 보장하려면 100ng/mL 이상의 나노방울 검출 농도를 사용하는 것이 좋습니다. 농도 감소의 잠재적 원인은 수집된 세포의 상당 부분이 죽었거나 사멸 과정에 있는 것과 같은 배양된 세포의 건강하지 않은 특성일 수 있습니다. 실제 RNA 농도를 얻기 위해서는 세포 배양 중 성장 저하로 이어질 수 있는 상황을 해결해야 합니다. 이러한 우려의 이면에 있는 또 다른 이유는 RNA 추출 중에 달성되는 최종 세포 수가 과도하게 낮기 때문일 수 있으며, 이는 상층액 폐기 중 부주의한 세포 손실로 인한 것일 수 있습니다. 원스텝 RNA 추출 키트와 같은 고급 RNA 추출 기술을 사용하는 것이 유리할 수 있습니다. Nanodrop으로 측정한 이상적인 OD260/OD280 비율은 1.9-2.1 범위에 속해야 합니다. 비율이 과도하게 낮을 경우 단백질 오염이 발생할 수 있습니다. RNase-free buffer washing의 빈도를 늘리면 이 문제를 완화하는 데 도움이 될 수 있습니다. 반대로, 비정상적으로 낮은 비율은 잠재적인 RNA 분해를 의미합니다. 이 문제를 해결하려면 RNase가 없는 물을 사용하고 RNase 오염 제거를 위해 1.5mL 튜브를 사용하는 것이 좋습니다.
결론적으로, 현재 프로토콜은 새로운 세포 배양 배지를 사용하여 naive CD4+ T 세포가 in vitro에서 병원성 Th17 세포로 분화하도록 직접 유도하는 방법을 설명합니다. 직접 분리와 비교할 때 이 방법이 더 직접적이고 저렴하며 효율적이라는 것은 의심의 여지가 없습니다. 배지의 구성도 매우 간단하여 구성된 Th17 세포를 후속 실험에 보다 직관적으로 사용할 수 있어 많은 질병 연구를 위한 매우 우수한 세포 모델을 제공합니다.
공개
저자들은 이 논문의 출판과 관련하여 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 중국 국가중점연구개발프로그램(No.2022YFC2304604), 중국국가자연과학재단(No.81971812), 중국국가자연과학재단(No.82272235), 장쑤성 건강위원회 과학재단(No. ZDB2020009), 장쑤성 중점연구개발프로그램(사회개발) 특별사업(제BE2021734호), 과학기술부 국가중점R&D사업(제2020YFC083700호), 장쑤성 중점의학연구실(BM2020004), 중국국가자연과학재단(81930058), 중국국가자연과학재단(82171717), 중앙대학교 기초연구기금(2242022K4007), 및 Jiangsu Provincial Natural Science Foundation General Project (BK20211170).
자료
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Rat anti-mouse CD62L, BV650, clone MEL-14, 1:200 dilution | BD | Cat# 564108; RRID: AB_2738597 | |
| Rat monoclonal anti-CD4, FITC, clone RM4-5, 1:200 dilution | BioLegend | Cat#100509; RRID: AB_312712 | |
| Rat monoclonal anti-IL-17A, PE, clone TC11-18H10.1, 1:200 dilution | BioLegend | Cat#506903; RRID: AB_ 315463 | |
| Rat monoclonal anti mouse/human CD44, APC, clone IM&, 1:200 dilution | BioLegend | Cat#103012; RRID: AB_312963 | |
| Rat monoclonal anti-RORγT, APC, clone B2D, 1:200 dilution | Invitrogen | Cat#17-6981-80; RRID: AB_2573253 | |
| Rat monoclonal FOXP3 antibody, PE, clone FJK-16s, 1:200 dilution | Invitrogen | Cat#12-5773-82; RRID: AB_465936 | |
| Chemicals, peptides, and recombinant proteins | |||
| Anti-Mouse CD3 SAFIRE purified | biogems | Cat#05112-25 | |
| Anti-Mouse CD28 SAFIRE purified | biogems | Cat#10312-25 | |
| Anti-Mouse IFN gamma | biogems | Cat#80822-25 | |
| Anti-Mouse IL-4 | biogems | Cat#81112-25 | |
| Ethanol | Xilong scientific | Cat#64-17-5 | |
| Fetal bovine serum | Gibco | Cat#10437-028 | |
| FcR Blocking reagent | Miltenyi Biotec | Cat#130-092-575 | |
| GlutaMAX supplement | gibco | Cat#35050079 | |
| Mouse rIL-1 beta | Sino Biological | Cat#50101-MNAE | |
| Mouse rIL-6 | Sino Biological | Cat#50136-MNAE | |
| Mouse rIL-23 | Sino Biological | Cat#CT028-M08H | |
| Mouse TGF beta 1 | Sino Biological | Cat#50698-M08H | |
| PBS | Procell | Cat#PB180327 | |
| Recombinant Murine IL-2 | peprotech | Cat#212-12 | |
| RPMI 1640 with L-glutamine | Gibco | Cat#11875-119 | |
| Penicillin-streptomycin solution | Gibco | Cat#15070063 | |
| β-mercaptoethanol | Sigma-Aldrich | Cat#M6250-100ML | |
| Critical commercial assays | |||
| Animal Organ Lymphocyte Separation Solution Kit | Tbdscience | Cat#TBD0018SOP | Contains animal spleen tissue lymphocyte separation liquid, tissue sample diluent (cat no. 2010C1119), sample cleaning solution (cat no. 2010X1118), sample washing solution (cat no. TBTDM-W), tissue homogenate flushing liquid (F2013TBD) |
| ChamQ SYBR qPCR Master Mix (High ROX Premixed) | Vazyme | Cat#Q341-02 | https://www.vazymebiotech.com/product-center/chamq-sybr-qpcr-master-mix-high-rox-premixed-q341.html. |
| Fixation/permeabilization Concentrate | invitrogen | Cat#00-5123-43 | |
| Fixation / Permeabilization Diluent | invitrogen | Cat#00-5223-56 | |
| Fixable Viability Dye EF506 | invitrogen | Cat#65-0866 | |
| HiScript II Q RT SuperMix for qPCR (+gDNA wiper) | Vazyme | Cat#R223-01 | https://www.vazymebiotech.com/product-center/hiscript-ii-q-rt-supermix-for-qpcr-gdna-wiper-r223.html. |
| Leukocyte Activation Cocktail | BD | Cat#550583 | |
| Mouse IL-17A (Interleukin 17A) ELISA Kit | Elabscience® | Cat#E-EL-M0047 | |
| Naïve CD4+ T cells isolation kit, mouse | STEMCELL | Cat#19765 | EasySep kit contains mouse CD4+ T cell isolation cocktail [cat no. 19852C.1], mouse memory T cell depletion cocktail [cat no. 18766C], streptavidin RapidSphered 50001 [cat no. 50001], normal rat serum [cat no. 13551]); only store rat serum at -20 °C; other components to be stored at 2-8 °C. |
| Permeabilization Buffer | invitrogen | Cat#00-8333-56 | |
| SPARKeasy Cell RNA Kit | Sparkjade | Cat#AC0205-B | https://www.sparkjade.com/product/detail?id=85 |
| Experimental models: Organisms/strains | |||
| Mouse: C57BL/6 | Gempharmatech | Cat#000013 | |
| Oligonucleotides | |||
| Mouse Il17a TaqMan primers with probe | ribobio | NA | |
| Mouse Il17f TaqMan primers with probe | ribobio | NA | |
| Mouse Il23r TaqMan primers with probe | ribobio | NA | |
| Mouse Rora TaqMan primers with probe | ribobio | NA | |
| β-actin TaqMan primers with probe | ribobio | NA | |
| Software and algorithms | |||
| Cytek Aurora | Cytek | https://spectrum.cytekbio.com/ | |
| FlowJo v10.8.1 | Tree Star | https://www.flowjo.com | |
| GraphPad prism 9 | GraphPad Software | https://www.graphpad-prism.cn | |
| Other | |||
| 1 mL syringe | Kindly | NA | |
| 1.5 mL Centrifuge tubes | Eppendorf | Cat#MCT-150-C | |
| 5 mL Round-bottom tubes | Corning | Cat#352235 | |
| 15 mL Centrifuge tubes | NEST | Cat#601052 | |
| 48-Well tissue culture plate (flatten bottom) | Corning | Cat#3548 | |
| 50 mL Centrifuge tubes | NEST | Cat#602052 | |
| 70 µm Cell strainer | Biosharp | Cat#BS-70-XBS | |
| 96-well Unskirted qPCR Plates | VIOX scientific | Cat#V4801-M | |
| 100 mm Petri dish | Corning | Cat#430167 | |
| Centrifuge | Eppendorf | 5425R | |
| Cell culture CO2 incubator | Thermo Fisher | HEPA Class100 | |
| Cytek Aurora | Cytek | NA | |
| dissecting scissors | RWD | S12003-09 | |
| Hemocytometer | AlphaCell | Cat#J633201 | |
| NanoDrop 2000 Spectrophotometer | Thermo Fisher | ND-2000 | |
| Real-time PCR System | Roche | LightCycler96 | |
| Surgical tweezers | RWD | F12005-10 | |
| Thermal cycler | Bio-Rad | C1000 Touch |
참고문헌
- Korn, T., Bettelli, E., Oukka, M., Kuchroo, V. K. IL-17 and Th17 cells. Annu Rev Immunol. 27, 485-517 (2009).
- Bhaumik, S., Basu, R. Cellular and molecular dynamics of Th17 differentiation and its developmental plasticity in the intestinal immune response. Front Immunol. 8, 254 (2017).
- Bettelli, E., Korn, T., Oukka, M., Kuchroo, V. K. Induction and effector functions of T(H)17 cells. Nature. 453 (7198), 1051-1057 (2008).
- Korn, T., et al. IL-21 initiates an alternative pathway to induce proinflammatory T(H)17 cells. Nature. 448 (7152), 484-487 (2007).
- Bettelli, E., et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature. 441 (7090), 235-238 (2006).
- Yang, X. O., et al. T helper 17 lineage differentiation is programmed by orphan nuclear receptors ROR alpha and ROR gamma. Immunity. 28 (1), 29-39 (2008).
- Ghoreschi, K., et al. Generation of pathogenic T(H)17 cells in the absence of TGF-β signalling. Nature. 467 (7318), 967-971 (2010).
- Lee, Y., et al. Induction and molecular signature of pathogenic TH17 cells. Nat Immunol. 13 (10), 991-999 (2012).
- McGeachy, M. J., et al. The interleukin 23 receptor is essential for the terminal differentiation of interleukin 17-producing effector T helper cells in vivo. Nat Immunol. 10 (3), 314-324 (2009).
- Wu, B., et al. The TGF-β superfamily cytokine Activin-A is induced during autoimmune neuroinflammation and drives pathogenic Th17 cell differentiation. Immunity. 54 (2), 308-323 (2021).
- Ramesh, R., et al. Pro-inflammatory human Th17 cells selectively express P-glycoprotein and are refractory to glucocorticoids. J Exp Med. 211 (1), 89-104 (2014).
- Basdeo, S. A., et al. Ex-Th17 (nonclassical Th1) cells are functionally distinct from classical Th1 and Th17 cells and are not constrained by regulatory T cells. J Immunol. 198 (6), 2249-2259 (2017).
- Cua, D. J., et al. Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain. Nature. 421 (6924), 744-748 (2003).
- Awasthi, A., et al. Cutting edge: IL-23 receptor gfp reporter mice reveal distinct populations of IL-17-producing cells. J Immunol. 182 (10), 5904-5908 (2009).
- Jäger, A., Dardalhon, V., Sobel, R. A., Bettelli, E., Kuchroo, V. K. Th1, Th17, and Th9 effector cells induce experimental autoimmune encephalomyelitis with different pathological phenotypes. J Immunol. 183 (11), 7169-7177 (2009).
- Lee, Y., Collins, M., Kuchroo, V. K. Unexpected targets and triggers of autoimmunity. J Clin Immunol. 34, S56-S60 (2014).
- Chang, D., et al. The conserved non-coding aequences CNS6 and CNS9 control cytokine-induced Rorc transcription during T helper 17 cell differentiation. Immunity. 53 (3), 614-626 (2020).
- Bunte, K., Beikler, T. Th17 cells and the IL-23/IL-17 axis in the pathogenesis of periodontitis and immune-mediated inflammatory diseases. Int J Mol Sci. 20 (14), 3394 (2019).
- Zhao, Y., Liu, Z., Qin, L., Wang, T., Bai, O. Insights into the mechanisms of Th17 differentiation and the Yin-Yang of Th17 cells in human diseases. Mol Immunol. 134, 109-117 (2021).
- Berghmans, N., et al. Interferon-γ orchestrates the number and function of Th17 cells in experimental autoimmune encephalomyelitis. J Interferon Cytokine Res. 31 (7), 575-587 (2011).
- Wu, B., Wan, Y. Molecular control of pathogenic Th17 cells in autoimmune diseases. Int Immunopharmacol. 80, 106187 (2020).
- Du, L., et al. Growth hormone releasing hormone signaling promotes Th17 cell differentiation and autoimmune inflammation. Nat Commun. 14 (1), 3298 (2023).
- Ernst, D. N., Weigle, W. O., Noonan, D. J., McQuitty, D. N., Hobbs, M. V. The age-associated increase in IFN-gamma synthesis by mouse CD8+ T cells correlates with shifts in the frequencies of cell subsets defined by membrane CD44, CD45RB, 3G11, and MEL-14 expression. J Immunol. 151 (2), 575-587 (1993).
- Radtke, A. J., et al. IBEX: an iterative immunolabeling and chemical bleaching method for high-content imaging of diverse tissues. Nat Protoc. 17 (2), 378-401 (2022).
- El-Hindi, K., et al. T-cell-specific CerS4 depletion prolonged inflammation and enhanced tumor burden in the AOM/DSS-induced CAC model. Int J Mol Sci. 23 (3), 1866 (2022).
- Cooney, L. A., Towery, K., Endres, J., Fox, D. A. Sensitivity and resistance to regulation by IL-4 during Th17 maturation. J Immunol. 187 (9), 4440-4450 (2011).
- Zhu, X., et al. A novel interleukin-2-based fusion molecule, HCW9302, differentially promotes regulatory T cell expansion to treat atherosclerosis in mice. Front Immunol. 14, 1114802 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유