Method Article
Diferenciación in vitro de linfocitos T CD4+ naive en linfocitos Th17 patógenos en ratón
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe la diferenciación de linfocitos T CD4+ naïve en linfocitos Th17 patógenos in vitro. Específicamente, cuando se combina con un enfoque basado en citometría de flujo multiparamétrica, se puede obtener una pureza del 90% de las células Th17 patógenas a partir de células T CD4+ naïve utilizando este método de diferenciación.
Resumen
In vitro Las técnicas de diferenciación de linfocitos T son esenciales para las investigaciones funcionales y mecanicistas de los linfocitos T CD4+ . Las células patógenas Th17 se han relacionado con una amplia gama de enfermedades en los últimos tiempos, como la esclerosis múltiple (EM), la artritis reumatoide, el síndrome de dificultad respiratoria aguda (SDRA), la sepsis y otros trastornos autoinmunes. Sin embargo, los protocolos de diferenciación in vitro actualmente conocidos tienen dificultades para lograr una alta pureza de las células Th17 patógenas, con una eficiencia de inducción a menudo inferior al 50%, lo cual es un desafío clave en los experimentos in vitro . En este protocolo, proponemos un protocolo mejorado de cultivo y diferenciación in vitro para células Th17 patógenas, que se utiliza para diferenciar directamente las células T CD4+ vírgenes aisladas del bazo de ratón en células Th17 patógenas. Este protocolo proporciona instrucciones detalladas sobre el aislamiento de esplenocitos, la purificación de células T CD4+ vírgenes y la diferenciación de células Th17 patógenas. A través de este protocolo, podemos lograr una pureza de diferenciación de aproximadamente el 90% para las células Th17 patógenas, lo que satisface las necesidades básicas de muchos experimentos celulares.
Introducción
Después de salir del timo, los linfocitos T CD4+ naïve pasan a través de los órganos linfoides secundarios. Las células presentadoras de antígenos que transmiten antígenos homólogos a los linfocitos T CD4+ naïve los activan, iniciando una serie de programas de diferenciación que finalmente dan como resultado la producción delinajes de células T auxiliares (Th) altamente especializados. La producción de interleucina 17 (IL-17) caracteriza a las células Th17, una subpoblación de células Th proinflamatorias2. Las células Th17 desempeñan un papel en la defensa del huésped contra patógenos extracelulares y en la patogénesis de muchas enfermedades autoinmunes, como la uveítis autoinmune y la esclerosis múltiple. Las señales de los receptores de linfocitos T y las citocinas IL-6 y el factor de crecimiento transformante-β (TGF-β) inducen la diferenciación de los linfocitos T vírgenes en linfocitos Th17 a través de la fosforilación del transductor de señales y activador de la transcripción (STAT)33. STAT3 se amplifica aún más en un bucle de retroalimentación positiva a través de la señalización mediada por IL-23 e IL-21 4,5. La fosforilación de STAT3 puede inducir la expresión de los factores de transcripción RORγt y RORα, que actúan como interruptores maestros que regulan el perfil de citocinas de IL-17A, IL-17F, IL-21 e IL-22 en las células Th176. Sin embargo, se ha informado que las células Th17 inducidas por IL-6 y TGF-β son insuficientes para desencadenar enfermedades autoinmunes, que requieren coestimulación por IL-23 o coestimulación separada de IL-6, IL-1β e IL-23 en ausencia de TGF-β 7,8.
Los subconjuntos Th17 que no pueden inducir eficazmente la encefalomielitis autoinmune experimental (EAE) a veces se denominan Th17 no patógenos, mientras que los subconjuntos Th17 Th17 patogénicos se conocen como Th17 patógenos9. Los estudios actuales han demostrado que, aunque el Th17 patógeno y el Th17 no patógeno co-expresan el factor de transcripción central RORγt, existen grandes diferencias en la capacidad de producir IL-17A y las propiedades proinflamatorias y antiinflamatorias10. Además de la alta expresión de RORγt, CCR6, STAT4 y RUNX4, que son factores de transcripción característicos comunes de Th17, las células patógenas Th17 también muestran características adicionales de expresión de señales génicas relacionadas con la enfermedad, como TBX21, IFN-γ y CXCR3, que tienen las características de los subconjuntos de células Th1. Las células patógenas Th17 pueden secretar altos niveles de factor estimulante de colonias de granulocitos-macrófagos (GM-CSF), IFN-γ, TNF-α y otras citocinas 11,12. El fenotipo de las células Th17 no patógenas es inestable, y solo bajo la estimulación de CD3 y la citocina IL-2 pueden algunas de estas células diferenciarse en células Th17 patógenas. Por lo tanto, en modelos clínicos de enfermedades comunes como la artritis reumatoide, la esclerosis múltiple y el síndrome de dificultad respiratoria aguda, las células patógenas Th17 ejercen principalmente efectos patógenos.
Las células Th17 patógenas y no patógenas pueden diferenciarse in vitro bajo la influencia de diferentes citocinas. En los últimos años, varios estudios han propuesto métodos para inducir la diferenciación de las células Th17 utilizando diferentes tipos y concentraciones de citocinas. Las células Th17 son estimuladas por una combinación de IL-6, IL-1β e IL-23 13,14,15,16. Se ha demostrado que IL-6 y TGF-β, dos citoquinas necesarias para la diferenciación de las células Th17, regulan sinérgicamente la expresión de RORγt y la diferenciación de las células Th17 al interactuar con dos diferentes secuencias de ADN no codificante conservadas en el locus17 del gen Rorc. La fase estable de las células patógenas Th17 es mantenida principalmente por la IL-2318,19. La IL-23 se une a su receptor y activa la vía de señalizaciónJAK-STAT 20, lo que provoca la fosforilación de Jak2 y Tyk2 y promueve la fosforilación de STAT1, STAT3, STAT4 y STAT5. La IL-4 y el IFN-γ son reguladores negativos de esta vía. Sin embargo, los estudios han demostrado que la IL-1β puede regular positivamente la transcripción de Rorα y Rorγt a través de la vía mTOR para mantener la estabilidad del fenotipo de la célula Th1721.
Debido a la heterogeneidad de numerosos estudios, elegimos los protocolos de inducción para células Th17 patógenas y no patógenas de las últimas investigaciones como controles22. Los resultados indican que, asumiendo que todo se lleva a cabo según este protocolo, después de 5 días de cultivo bajo la condición de generar Th17 patógeno, más del 90% de las células supervivientes pueden ser células Th17 patógenas.
Protocolo
El Comité de Revisión Institucional para Estudios Animales de la Universidad del Sureste aprobó todos los estudios con animales que se detallan en este estudio, los cuales se llevaron a cabo de acuerdo con los estándares de las oficinas locales e institucionales. Se tomaron muestras de bazo de ratones C57BL6/J. En este estudio se incluyeron ratones hembra y macho, con edades comprendidas entre las 5 y las 8 semanas. El medio de cultivo y el tampón se almacenaron a 4 °C durante un máximo de 1 mes. Los instrumentos quirúrgicos se esterilizaron en autoclave antes de su uso. Use guantes y mascarillas de látex para evitar la contaminación de la piel, los ojos y la ropa con reactivos; Use mucha agua o enjuague salino para la piel y los ojos.
1. Prerrecubrimiento de la placa de cultivo de tejidos de 24 pocillos con anti-CD3
- Diluir el anti-CD3 hasta una concentración final de 1 μg/mL en un medio estéril de solución salina tamponada con fosfato (PBS) 1x o RPMI 1640.
- Llene un pocillo de una placa de cultivo de tejidos de 24 pocillos con 1 mL de solución anti-CD3 (1 μg/mL); Luego, cubre el pozo con parafilm.
- Coloque la placa recubierta anti-CD3 en el refrigerador (2 °C-8 °C) durante 16 h o manténgala a 37 °C en una incubadora de celdas durante 2-3 h.
2. Aislamiento del bazo de ratón y preparación de la suspensión unicelular del bazo
- Inducir la anestesia completa en C57BL/6J con isoflurano al 3% y eutanasiar inhalando dióxido de carbono al 100% durante 2 min. Inmediatamente después de la muerte de los ratones, sumérjalos en etanol al 75% para desinfectarlos y evitar la contaminación.
- Coloque el ratón en posición supina en el banco limpio, córtelo a lo largo de la línea media del abdomen y separe las estructuras abdominales capa por capa. Abra suavemente el epiplón mayor y el estómago con pinzas, extraiga suavemente el bazo con el ligamento gastrosplénico y separe sin rodeos el bazo de los tejidos y ligamentos circundantes para obtener un bazo intacto (tenga cuidado de evitar que el bazo se aplaste o se rompa).
NOTA: Para mantener un estado estéril, se realiza la siguiente operación en un banco súper limpio estéril. - Coloque un filtro celular de 70 μm en una placa de cultivo estéril de 100 mm, agregue el bazo al filtro celular y tritúrelo con un émbolo de jeringa. Al mismo tiempo, agregue 5-8 mL de líquido de lavado homogeneizado para empujar todas las células a través del filtro hacia la placa de cultivo.
NOTA: La composición del kit de líquido de separación de linfocitos se puede ver en la Tabla de Materiales. - Centrifugar el filtrado a 450 × g durante 5 min a temperatura ambiente. Deseche el sobrenadante.
- Vuelva a suspender el pellet celular con el diluyente de muestra suministrado con el kit de separación de linfocitos o con medio PBS o RPMI 1640. Ajuste la concentración celular de la suspensión celular a 2 × 108-1 × 109 células /mL.
NOTA: Por lo general, se requieren 4-6 mL de diluyente de muestra para un bazo. - En un tubo de centrífuga, tome la misma cantidad de solución de separación de linfocitos que la suspensión unicelular de tejido. Pipetear con cuidado la suspensión unicelular sobre la superficie de la solución de separación de linfocitos y centrifugar a 800 × g, 25 °C durante 30 min. Ajuste la aceleración y desaceleración de la centrífuga a un rango apropiado (por ejemplo, establezca en 3 si hay las marchas habituales de 1 a 9).
NOTA: La solución de separación de linfocitos no debe ser inferior a 3 mL. - Después de la centrifugación, observe las cuatro capas en el tubo de centrífuga de arriba hacia abajo. La primera capa corresponde al diluyente de la muestra, seguida de la capa anular de linfocitos de color blanco lechoso. La tercera capa es el líquido de separación y la cuarta capa consta de glóbulos rojos.
- Utilice una pipeta para extraer cuidadosamente la segunda capa de linfocitos anulares de color blanco lechoso en otro tubo de centrífuga y añada 10 ml de solución de limpieza al tubo de centrífuga para mezclar las células.
- Centrifugar a 250 × g durante 5 min a temperatura ambiente. Deseche el sobrenadante. Utilice 10 ml de medio RPMI 1640 para resuspender el pellet de celdas para el recuento de células.
3. Purificación de células T CD4+ ingenuas basada en la selección negativa de perlas magnéticas
NOTA: Aísle linfocitos T CD4+ vírgenes intactos y altamente purificados (CD4+CD44lowCD62Lhigh) de esplenocitos de ratón mediante selección inmunomagnética negativa.
- Prepare la muestra para que tenga 1 × 108 células/mL dentro del rango de volumen de 0,1-2 mL.
- Añadir 50 μL/mL de suero de rata y transferir la muestra a un tubo de poliestireno de fondo redondo de 5 mL.
NOTA: La composición del kit de clasificación de células T CD4 ingenuas se puede ver en la Tabla de Materiales. - Añadir 50 μL/mL de cóctel de aislamiento a la muestra, mezclar bien e incubar durante 7,5 min a temperatura ambiente.
- Añadir 50 μL/mL de Cóctel de Agotamiento a la muestra, mezclar bien e incubar durante 2,5 min a temperatura ambiente.
- Agite las perlas magnéticas para garantizar una dispersión uniforme. Añada 75 μL/mL de las perlas magnéticas a la muestra, mezcle bien e incube durante 2,5 min a temperatura ambiente.
NOTA: Las partículas deben aparecer dispersas uniformemente; El tiempo de vórtice no debe ser inferior a 30 s. - Rellene la muestra con medio RPMI 1640 hasta un volumen final de 2,5 mL. Mezcle varias veces pipeteando suavemente hacia arriba y hacia abajo.
- Coloque el tubo (sin la tapa) en el imán e incube durante 2,5 minutos a temperatura ambiente.
- Levantando el imán, invierta el imán y el tubo en un movimiento continuo y vierta la suspensión de celda enriquecida en un tubo nuevo.
NOTA: Mantenga el tubo y el imán invertidos durante 2-3 segundos antes de girarlos en posición vertical. No moleste las gotas que puedan quedar en la boca del tubo. - Determine el número de células con un hemocitómetro.
- Realice un análisis de citometría de flujo para células T CD4+ vírgenes antes y después del aislamiento (Figura 1).
- Transfiera las células a un nuevo tubo de centrífuga, centrifugue a 400 × g durante 5 minutos a temperatura ambiente y deseche el sobrenadante.
- Resuspender las células en 200-500 μL de medio RPMI 1640 (suplementado con un 10% de suero fetal bovino). Por cada 1 mL de cultivo celular (por ejemplo, ~106 células/mL), agregue 2 μL de cóctel de activación de leucocitos y mezcle. Cultivar las células en una incubadora de CO2 a 37 °C y humedad saturada durante 4-6 h.
NOTA: Las células se agitaron en vórtice una vez cada 1-2 h. - Centrifugar las células a 400 × g, 4 °C durante 5 min. Deseche cuidadosamente el sobrenadante y vuelva a suspender las células en 200 μL de PBS. Agregue 1 μL de bloqueador Fc a las células (por ejemplo, ~106 células/mL). Incubar las células durante 10 min a 4 °C.
- Lavar las células una vez con 1 mL de PBS centrifugando a 400 × g durante 5 min a 4 °C. Deseche el sobrenadante y vuelva a suspender las células en 200 μL de PBS.
- Añadir cóctel de anticuerpos (Fixable Viability Dye, 1:1.000; anti-CD4, 1:200; anti-CD44, 1:200; anti-CD62L, 1:200) e incubar las células durante 15-20 min en la oscuridad a 4 °C.
- Lavar las celdas con 2 x 1 mL de PBS y luego centrifugar a 400 × g durante 5 min a 4 °C.
- Deseche el sobrenadante, vuelva a suspender las células en 250 μL de tampón fijo e incube durante 40-60 min en la oscuridad a 4 °C.
NOTA: El tampón fijo se proporciona con el tampón de tinción Foxp3/factor de transcripción, que es una solución madre 4x que debe diluirse con diluyente de permeabilización. - Añadir 1 mL de tampón de permeabilización 1x para lavar las células 2x centrifugando las células a 300 × g, 4 °C durante 5 min.
- Deseche el sobrenadante, vuelva a suspender las células en 200 μL de tampón de permeabilización y agregue el anticuerpo (Foxp3 [nuclear], 1:200) a las células. Después de la fijación y la ruptura de la membrana, incubar las mezclas de células y anticuerpos en la oscuridad durante 40-60 minutos con agitación ocasional durante períodos cortos a 4 °C.
NOTA: La solución de permeabilización/lavado es una solución madre 10x que debe diluirse antes de usarse con PBS.
4. Inducción de células patógenas Th17 in vitro
- Retire el PBS estéril de las placas de 24 pocillos prerrevestidas antes de usarlo.
- Utilice el medio de cultivo celular Th17 (Tabla 1) y el medio de contraste para el cultivo, incluido el medio de cultivo celular Th0 (Tabla 1), el medio de cultivo Th17 no patógeno clásico (Tabla 1) y el medio de cultivo Th17 patógeno clásico (Tabla 1). Vuelva a suspender las células T CD4+ naïve enriquecidas y dispense en diferentes pocillos en la misma placa de 24 pocillos (prerrecubierta con anti-CD3), ajustando la concentración a 4 × 105 células/mL, con 1 mL de medio en cada pocillo.
- Añadir 1 μL/mL de solución anti-CD28 (concentración final: diluida con medio a 2 μg/mL) a cada pocillo. Cultivar las células en una incubadora de CO2 al 5% a 37 °C durante 5 días.
- Reemplace el medio sobrenadante de cultivo celular con medio de cultivo (Th0, Th17 no patógeno, Th17 patógeno clásico y Th17 objetivo) pipeteando cuidadosamente para distribuir las células de manera uniforme, deseche la mitad del medio que contiene las células y luego agregue un medio nuevo igual al volumen de descarte el día 2. Repita el día 4.
- Observe las células bajo un microscopio óptico el día 5 (Figura 2). Recoger los sobrenadantes celulares de cada grupo y criopreservarlos a -80 °C.
5. Análisis de citometría de flujo para la diferenciación de células patógenas Th17 y Th0
- Coseche todas las células (por pocillo) después de 5 días del inicio del cultivo. Realice los pasos 3.12 a 3.15.
- Añadir un cóctel de anticuerpos (Fixable Viability Dye, 1:1.000; anti-CD4, 1:200) e incubar las células durante 15-20 min en la oscuridad a 4 °C.
- Realice los pasos 3.17 a 3.19.
- Deseche el sobrenadante, vuelva a suspender las células en 200 μL de tampón de permeabilización y agregue el cóctel de anticuerpos (IL-17A [intracelular], 1:200; RORγT [nuclear], 1:200) a las células. Después de la fijación y la ruptura de la membrana, incubar las mezclas de células y anticuerpos en la oscuridad durante 40-60 minutos con agitación ocasional durante períodos cortos a 4 °C.
- Añadir 1 mL de solución de permeabilización/lavado 1x para lavar las células 2x, centrifugando las células a 400 × g durante 5 min a 4 °C; Luego, desecha el sobrenadante.
- Examine las células en un citómetro de flujo y analice los datos utilizando el software (Figura 3).
- Encienda el citómetro de flujo y active el proceso de limpieza y calibración de inicio automático.
- Seleccione el canal láser utilizado en este experimento y configure un tubo en blanco, tubos de una sola tinción y tubos de muestra.
- Haga clic en la opción de tubo en blanco y pruebe en la máquina; Ajuste el voltaje para que el evento de celda esté, en la medida de lo posible, en el centro de la caja de recolección.
- Recoja células de tubo de un solo tinte y realice la detección espectral de los canales correspondientes para confirmar que el anticuerpo fluorescente se ha añadido correctamente.
- Haga clic en el botón desmezclar y deje que la máquina ajuste automáticamente la compensación espectral. Con otros instrumentos de citometría de flujo, ajuste la compensación de fluorescencia normalmente.
- Recoja cada celda de tubo de muestra, guarde el formato de datos como archivos FCS y exporte. Analice y trace en el software de análisis de datos de citometría de flujo correspondiente.
- Encierre en un círculo la población celular principal y elimine las posibles adherencias celulares a través de las puertas circulares diagonales de FSC-H y FSC-A.
- Circule las celdas vivas de acuerdo con el área del círculo negativo FVS; a continuación, encierre en un círculo la población de células CD4+.
- Construya la puerta transversal con el eje horizontal como IL-17 A y el eje vertical como RORγT; la doble selección positiva en el área Q2 es la población de células Th17.
6. Ensayo de inmunoadsorción enzimática (ELISA) para la detección de la secreción de IL-17A inducida por diferentes medios
- Descongele los sobrenadantes celulares congelados recogidos en la sección 4.5.
- Agregue 100 μL del patrón diluido, blanco y muestra en los pocillos designados. Utilice el sellador para cubrir la placa e incubar durante 90 min a 37 °C.
NOTA: Agregue las soluciones al fondo del pozo de la placa de micro-ELISA sin tocar la pared interior ni causar espuma. - Decantar el líquido de cada pocillo y añadir inmediatamente 100 μL de solución de trabajo de anticuerpos de detección biotinilados. Utilice un sellador nuevo para cubrir la placa e incubar durante 1 h a 37 °C.
- Decantar la solución y añadir 350 μL de tampón de lavado a cada pocillo. Después de 1 minuto, aspire o decante la solución de cada pocillo y séquela con palmaditas contra papel absorbente limpio. Repite este paso de lavado 3 veces.
- Agregue 100 μL de la solución de trabajo conjugada de peroxidasa de rábano picante a cada pocillo. Utilice un sellador nuevo para cubrir la placa e incube durante 30 minutos a 37 °C.
- Decantar la solución de cada pocillo y repetir el proceso de lavado 5 veces como se describe en el paso 6.4.
- Añadir 90 μL del reactivo de sustrato a cada pocillo e incubar durante unos 15 minutos a 37 °C con un nuevo sellador, protegiendo la placa de la luz.
NOTA: El tiempo de reacción puede modificarse en función del cambio de color real, pero no debe exceder los 30 minutos. Deje que el lector de microplacas se caliente durante ~ 15 minutos antes de la medición de OD. - Agregue 50 μL/pocillo de solución de parada en el mismo orden que la solución de sustrato.
- Determine la densidad óptica (valor OD) de cada pozo a la vez con un lector de microplacas configurado a 450 nm.
- Obtenga los valores de DE para las muestras estándar y los pocillos replicados de las muestras, y reste los valores de DE de los pocillos en blanco para obtener los valores corregidos. A continuación, realice un ajuste lineal con la concentración como abscisa y el valor OD como ordenada. Con base en la ecuación ajustada, calcule los valores de concentración de IL-17A para los pocillos de muestra.
NOTA: Después de 4 días de diferenciación, el contenido de IL-17A en el sobrenadante de cada grupo se muestra en la Figura 4. El método de ajuste puede referirse al software Orgin21. La curva estándar obtenida de este experimento tiene un valor R2 de 0,9946.
7. Diferenciación de células T mediante ensayos de expresión génica de firma mediante PCR cuantitativa (qPCR)
NOTA: Para descartar la posibilidad de inestabilidad de la citometría de flujo debido a los efectos de los colorantes y la fijación/ruptura, detectamos la expresión de genes característicos por qPCR para dilucidar el efecto de diferenciación del Th17 patógeno a nivel transcripcional.
- Mida el número de células al final del cultivo de células T. Recoja las células en tubos de centrífuga de 1,5 ml y centrifugue a 400 × g durante 5 minutos. Deseche con cuidado todos los sobrenadantes.
- Extracción de ARN
NOTA: El proceso de extracción debe llevarse a cabo en una campana extractora o en un banco ultralimpio para evitar la contaminación de la enzima ARN.- Añadir 500 μL de tampón de lisis (por ejemplo, a 1-2 × 106 células) al tubo de muestra (paso 7.1), agitar y mezclar inmediatamente hasta que no quede masa celular, y dejar reposar durante 1 min.
- Añadir la mezcla a la columna de adsorción colocada en un tubo de recogida, centrifugar a 13.400 × g durante 30 s y desechar el filtrado.
- Agregue la cantidad especificada de etanol absoluto a la botella de tampón de lavado antes de usarla por primera vez. Añadir 500 μL de tampón de lavado a la columna de adsorción, centrifugar a 13.400 × g durante 30 s y desechar el filtrado.
- Repita el lavado en el paso 7.2.3.
- Coloque la columna de adsorción RA en el tubo de recogida vacío y centrifuga a 13.400 × g durante 2 minutos para eliminar la solución de enjuague.
NOTA: La solución de enjuague debe retirarse para evitar que el etanol residual en la solución de enjuague inhiba la reacción posterior. - Retire la columna de adsorción RA y colóquela en un tubo centrífugo limpio y libre de RNasa. Añadir 50 μL de H2O libre de RNasa en el centro de la membrana de adsorción, dejar reposar durante 1 min a temperatura ambiente y centrifugar a 9.600 × g durante 1 min.
- Mida la pureza y la concentración de ARN.
- Sintetice la primera hebra de ADNc siguiendo las instrucciones del fabricante del kit.
- Eliminar el ADN genómico. Tome 500 ng del ARN molde extraído en un tubo centrífugo libre de ARNasa; agregue ddH2O sin RNasa y una mezcla de ADNg 4x para formar una mezcla. Triturar suavemente con una pipeta y colocar en un baño de agua a 42 °C durante 2 min.
NOTA: La cantidad de la mezcla de reacción y la cantidad agregada están relacionadas con la concentración de ARN; Consulte las instrucciones en detalle. En este experimento se utilizó el sistema de reacción de 20 μL. - Agregue directamente un sistema de reacción de transcripción inversa 5x en el tubo de reacción del paso anterior. Tome 4 μL del sistema de reacción de transcripción inversa y 16 μL de la mezcla del paso anterior y mezcle suavemente con una pipeta.
NOTA: El sistema de transcripción inversa incluye toda la transcriptasa inversa requerida, que es un sistema de transcripción inversa configurado directamente. - Ajuste la reacción de transcripción inversa: 37 °C 15 min, 85 °C, 5 s y finalmente enfríe a 4 °C.
- Eliminar el ADN genómico. Tome 500 ng del ARN molde extraído en un tubo centrífugo libre de ARNasa; agregue ddH2O sin RNasa y una mezcla de ADNg 4x para formar una mezcla. Triturar suavemente con una pipeta y colocar en un baño de agua a 42 °C durante 2 min.
- Configure la reacción de PCR siguiendo las instrucciones del fabricante.
- Agregue 10 μL de mezcla de enzimas de reacción de PCR 2x en el tubo de qPCR, 0,4 μL de cebador 1, 0,4 μL de cebador 2, 0,4 μL de 50x de ROX Reference Dye 1, 2 μL de ADNc molde y 6,8 μL de ddH2O para preparar una mezcla de 20 μL.
- Realice la PCR en el instrumento de PCR cuantitativa de fluorescencia en tiempo real utilizando los siguientes ajustes: etapa 1, 95 °C, 30 s, Rep x 1; etapa 2, primero 95 °C, 10 s, luego 60 °C, 30 s, Rep x 40; etapa 3, primero 95 °C, 15 s, siguiente 60 °C, 60 s, finalmente 95 °C, 15 s, Rep x 1.
NOTA: Después de 4 días de diferenciación, los niveles de expresión relativa de Il17a, Il17f, Rera e Il23r en células T CD4+ vírgenes se muestran en la Figura 5.
Resultados
Nuestro protocolo se desarrolló en base a investigaciones previas sobre la diferenciación patógena de las células Th17. El primer paso del experimento es detectar la pureza de las células T CD4+ vírgenes aisladas del bazo mediante la clasificación magnética de perlas, que es la base del éxito de nuestra posterior diferenciación de células Th17 patógenas. La pureza de los linfocitos T CD4+ naïve se detectó utilizando los marcadores de superficie CD62L23 y CD4424 , mientras que FOXP325 se utilizó como marcador de linfocitos Treg. Descubrimos que el contenido de células Treg se redujo significativamente después de la clasificación, y la pureza de las células T CD4+ vírgenes pudo alcanzar al menos el 95% (Figura 1). Para comparar la diferenciación de las células Th17 patógenas, las células T CD4+ vírgenes se cultivaron con medio Th0 (Tabla 1) y medio de diferenciación Th17 (Tabla 1) durante un total de 5 días. Se encontró que las células T mostraron crecimiento de racimos tanto en medios Th0 como Th17 (Figura 2).
A continuación, las células se fijaron, permeabilizaron y marcaron con anticuerpos contra varias citocinas en células T CD4+ diferenciadas según la citometría de flujo. Examinamos IL17A26 y RORγT27 como las citocinas distintivas de la diferenciación de células Th17 y encontramos que el 90% de las células T CD4+ vírgenes se diferenciaron con éxito en células Th17 patógenas bajo la estimulación de un nuevo medio de cultivo celular Th17 (Figura 3). En la figura 5 se muestran los genes característicos de las células Th17 detectados por PCR, lo que demuestra que las células Th17 patógenas que obtuvimos por diferenciación se expresaban de forma estable.
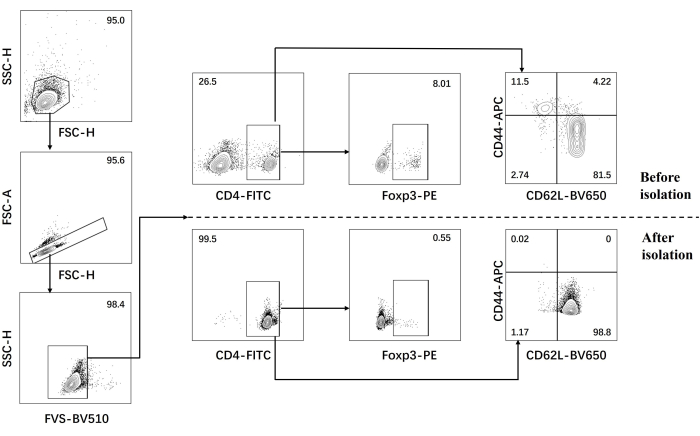
Figura 1: Estrategia de activación para el análisis de citocinas de firma en ratones C57BL/6J antes y después del aislamiento previo de células T CD4+ . Abreviaturas: FSC-H = altura del pico de dispersión hacia adelante; SSC-H = altura de dispersión lateral; FSC-A = área de pico de dispersión hacia adelante; FITC = isotiocianato de fluoresceína; PE = ficoeritrina. Haga clic aquí para ver una versión más grande de esta figura.
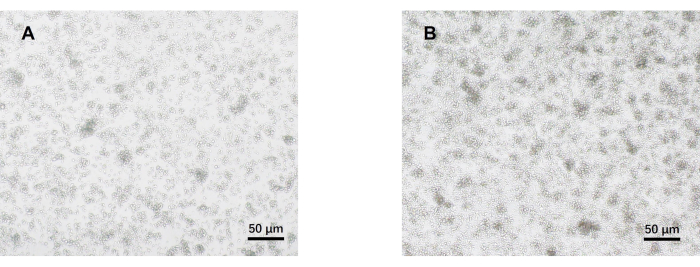
Figura 2: Imágenes representativas de linfocitos T CD4+ naïve de ratón cultivados en condiciones patogénicas Th17 y Th0 durante 5 días. (A) células Th0; (B) células patógenas Th17. Barras de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
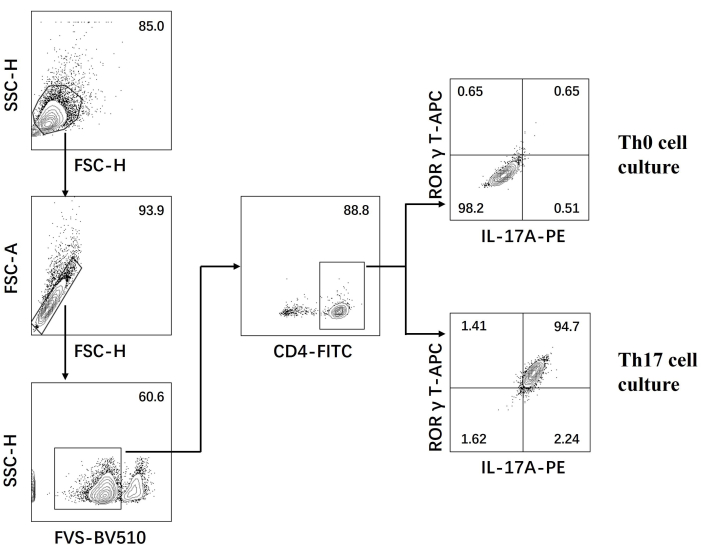
Figura 3: Análisis de citometría de flujo después de la diferenciación inducida por el medio de cultivo celular Th0 y el medio de cultivo celular Th17. Abreviaturas: FSC-H = altura del pico de dispersión hacia adelante; SSC-H = altura de dispersión lateral; FSC-A = área de pico de dispersión hacia adelante; FITC = isotiocianato de fluoresceína; PE = ficoeritrina. Haga clic aquí para ver una versión más grande de esta figura.
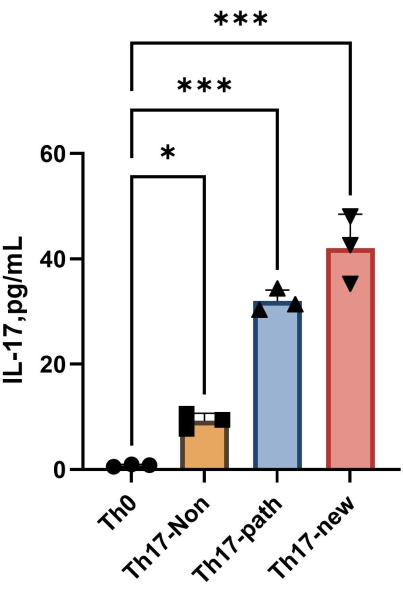
Figura 4: El contenido de IL-17A en el sobrenadante del medio de cultivo celular Th0 y el medio de cultivo celular Th17 después de la inducción de la diferenciación. Haga clic aquí para ver una versión más grande de esta figura.
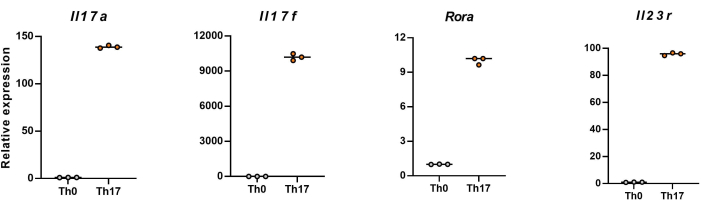
Figura 5: Resultados representativos de los niveles de expresión de citocinas de firma en células T CD4+ diferenciadas de ratón C57BL/6J. Haga clic aquí para ver una versión más grande de esta figura.
| Medio de cultivo celular Th17 patógeno objetivo | Medio de cultivo celular Th0 | Medio de cultivo celular Th17 no patógeno clásico | Medio de cultivo celular Th17 patógeno clásico. | |||||||||||
| Reactivo | Concentración final | Importe | Concentración final | Importe | Concentración final | Importe | Concentración final | Importe | ||||||
| Penicilina-estreptomicina (100x) | 1 vez | 500 μL | 1 vez | 500 μL | 1 vez | 500 μL | 1 vez | 500 μL | ||||||
| Suero Fetal Bovino | 10% | 5 mL | 10% | 5 mL | 10% | 5 mL | 10% | 5 mL | ||||||
| β-mercaptoetanol | 50 μM | 50 μL | 50 μM | 50 μL | 50 μM | 50 μL | 50 μM | 50 μL | ||||||
| Suplemento GlutaMAXTM (100x) | 1 vez | 500 μL | 1 vez | 500 μL | 1 vez | 500 μL | 1 vez | 500 μL | ||||||
| Solución de piruvato de sodio (100x) | 1 mM | 500 μL | 1 mM | 500 μL | 1 mM | 500 μL | 1 mM | 500 μL | ||||||
| Anti-Ratón IFN gamma (1 mg/mL) | 5 μg/mL | 250 μL | 10 μg/mL | 500 μL | 10 μg/mL | 500 μL | ||||||||
| IL-4 anti-ratón (2 mg/mL) | 5 μg/mL | 125 μL | 5 μg/mL | 250 μL | 10 μg/mL | 250 μL | ||||||||
| Ratón rIL-1 beta (20 μg) | 20 ng/mL | NA | ||||||||||||
| Ratón rIL-6 (20 μg) | 20 ng/mL | NA | 50 ng/mL | NA | 50 ng/mL | NA | ||||||||
| Ratón rIL-23 (50 μg) | 50 ng/mL | NA | 10 ng/mL | NA | ||||||||||
| TGF beta de ratón (100 μg) | 3 ng/mL | NA | 1 ng/mL | NA | 1 ng/mL | NA | ||||||||
| IL-2 murina (5 μg) | 20 ng/mL | NA | ||||||||||||
| RPMI 1640 | NA | Hasta 50 mL | NA | Hasta 50 mL | NA | Hasta 50 mL | ||||||||
| Total | NA | 50 mL | NA | 50 mL | NA | 50 mL | ||||||||
Tabla 1: Cultivo de células Th17 patógenas objetivo, cultivo celular Th0, medios de cultivo celular Th17 patógenos y no patógenos clásicos.
Discusión
Este procedimiento ofreció una forma productiva de aumentar el número de células T CD4+ naïve esplénicas de ratones para la producción in vitro de células Th17 patógenas. Aunque utilizamos más citocinas que otros medios de cultivo celular Th17 reportados, estamos comprometidos a optimizar las condiciones de crecimiento de las células Th17 patógenas. Estamos considerando una mayor optimización de nuestro protocolo de diferenciación inducida.
En este caso, simplemente utilizamos la citometría de flujo y la qPCR para examinar la producción de citocinas distintivas. Con algunas modificaciones menores, este enfoque también se puede utilizar para otras pruebas de función, como la proliferación celular.
Utilizamos un kit de aislamiento de linfocitos producido en China para aislar los linfocitos del bazo de ratón porque es eficaz y ahorra tiempo. Las soluciones de separación de linfocitos basadas en otras marcas también pueden lograr el propósito de separar los linfocitos del bazo de ratón a través de diferentes pasos. Otro método es lisar directamente los glóbulos rojos de la suspensión de células del bazo obtenida; Sin embargo, descubrimos que los glóbulos rojos del bazo a menudo no se pueden lisar a la vez.
Algunos problemas pueden surgir durante la ejecución de este protocolo. En primer lugar, el número de linfocitos T CD4+ vírgenes obtenidos mediante clasificación magnética de perlas puede ser muy bajo (paso 3 del protocolo). Esto podría atribuirse a que el proceso de trituración de órganos es insuficiente. Es importante asegurarse de que el órgano esté correctamente homogeneizado. Aumentar la frecuencia de enjuague durante el proceso de homogeneización mejorará la tasa de recuperación. Para obtener un mayor número de linfocitos T CD4+ naïve esplénicos, sugerimos utilizar ratones más jóvenes (6-10 semanas de edad). Existen varios métodos disponibles para separar los linfocitos del bazo, y el rendimiento puede variar según el líquido de separación utilizado. Se recomienda utilizar un líquido de separación certificado universalmente y tratar de extraer la capa de linfocitos tanto como sea posible.
En segundo lugar, la proporción de linfocitos T CD4+ en la citometría de flujo puede ser del <80% (paso 5 del protocolo). Una posible causa de este problema podría ser un recuento inexacto de esplenocitos, lo que resulta en un recuento de células mayor que el del cóctel de anticuerpos adicional y las perlas magnéticas. Para aumentar la eficacia de la purificación ingenua de células T CD4+ , el recuento de células debe ser preciso. Además, se puede utilizar un 10% más de cóctel de anticuerpos y perlas magnéticas de lo que recomienda este protocolo. Por último, la citometría de flujo se puede realizar inmediatamente después de clasificar las células T CD4+ vírgenes.
En tercer lugar, es posible que no se formen muchos grupos de células T durante el cultivo, y que la mayoría de las células hayan muerto durante la diferenciación de las células T (paso 4 del protocolo). La posible razón de este problema puede ser la determinación inexacta del número de células para las células T CD4+ vírgenes antes de la siembra, lo que resulta en una baja densidad de células. Se recomienda adoptar un método de conteo más preciso para lograr la densidad celular deseada de aproximadamente 4 × 105 celdas/mL para cada pocillo en una placa de 48 pocillos. Otra posible causa podrían ser problemas técnicos con la incubadora de CO2 , como una temperatura o concentración de CO2 incorrectas. Por último, una fuerza excesiva al cambiar el medio de cultivo celular podría causar la muerte celular.
En cuarto lugar, los niveles relativos de expresión de los genes de citocinas característicos pueden ser bajos (paso 7 del protocolo). Para garantizar la autenticidad del ARN extraído, se recomienda utilizar una concentración de detección de nanogotas de más de 100 ng/mL. La posible razón de la disminución de la concentración puede ser la naturaleza poco saludable de las células cultivadas, como que una gran parte de las células recolectadas estén muertas o en proceso de muerte. Para obtener la verdadera concentración de ARN, es necesario resolver la situación que puede conducir a un crecimiento deficiente durante el cultivo celular. Una razón alternativa detrás de esta preocupación podría ser el recuento final de células excesivamente bajo logrado durante la extracción de ARN, posiblemente debido a la pérdida inadvertida de células durante la eliminación del sobrenadante. El empleo de técnicas avanzadas de extracción de ARN, como los kits de extracción de ARN de un solo paso, podría resultar ventajoso. La relación ideal OD260/OD280, medida por Nanodrop, debe estar dentro del rango de 1,9-2,1. En el caso de una proporción excesivamente baja, la contaminación de proteínas se convierte en una posibilidad. El aumento de la frecuencia de lavado del tampón sin RNasa puede ayudar a mitigar este problema. Por el contrario, una proporción inusualmente baja implica una posible degradación del ARN. Para contrarrestar este problema, se recomienda emplear agua libre de RNasa y utilizar tubos de 1,5 mL para la descontaminación de la RNasa.
En conclusión, el protocolo actual describe el uso de un nuevo medio de cultivo celular para inducir directamente a las células T CD4+ vírgenes naïve para diferenciarse en células Th17 patógenas in vitro. En comparación con la separación directa, no hay duda de que este método es más directo, económico y más eficiente. La configuración del medio también es muy sencilla, por lo que las células Th17 construidas pueden utilizarse de forma más intuitiva para experimentos posteriores, proporcionando un muy buen modelo celular para el estudio de muchas enfermedades.
Divulgaciones
Los autores declaran que no existen conflictos de intereses con respecto a la publicación de este artículo.
Agradecimientos
El trabajo fue apoyado por el Programa Nacional Clave de Investigación y Desarrollo de China (No.2022YFC2304604), la Fundación Nacional de Ciencias Naturales de China (No.81971812), la Fundación Nacional de Ciencias Naturales de China (No.82272235), la Fundación de Ciencias de la Comisión de Salud de la Provincia de Jiangsu (No. ZDB2020009), Proyecto especial del Programa de investigación y desarrollo (desarrollo social) de la provincia de Jiangsu (No.BE2021734), Programa Nacional Clave de Investigación y Desarrollo del Ministerio de Ciencia y Tecnología (No.2020YFC083700), Laboratorio Provincial Clave de Medicina de Cuidados Críticos de Jiangsu (BM2020004), Proyecto clave de la Fundación Nacional de Ciencias Naturales de China (81930058), Fundación Nacional de Ciencias Naturales de China (82171717), Fondos de Investigación Básica de Universidades Centrales (2242022K4007), y el Proyecto General de la Fundación Provincial de Ciencias Naturales de Jiangsu (BK20211170).
Materiales
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Rat anti-mouse CD62L, BV650, clone MEL-14, 1:200 dilution | BD | Cat# 564108; RRID: AB_2738597 | |
| Rat monoclonal anti-CD4, FITC, clone RM4-5, 1:200 dilution | BioLegend | Cat#100509; RRID: AB_312712 | |
| Rat monoclonal anti-IL-17A, PE, clone TC11-18H10.1, 1:200 dilution | BioLegend | Cat#506903; RRID: AB_ 315463 | |
| Rat monoclonal anti mouse/human CD44, APC, clone IM&, 1:200 dilution | BioLegend | Cat#103012; RRID: AB_312963 | |
| Rat monoclonal anti-RORγT, APC, clone B2D, 1:200 dilution | Invitrogen | Cat#17-6981-80; RRID: AB_2573253 | |
| Rat monoclonal FOXP3 antibody, PE, clone FJK-16s, 1:200 dilution | Invitrogen | Cat#12-5773-82; RRID: AB_465936 | |
| Chemicals, peptides, and recombinant proteins | |||
| Anti-Mouse CD3 SAFIRE purified | biogems | Cat#05112-25 | |
| Anti-Mouse CD28 SAFIRE purified | biogems | Cat#10312-25 | |
| Anti-Mouse IFN gamma | biogems | Cat#80822-25 | |
| Anti-Mouse IL-4 | biogems | Cat#81112-25 | |
| Ethanol | Xilong scientific | Cat#64-17-5 | |
| Fetal bovine serum | Gibco | Cat#10437-028 | |
| FcR Blocking reagent | Miltenyi Biotec | Cat#130-092-575 | |
| GlutaMAX supplement | gibco | Cat#35050079 | |
| Mouse rIL-1 beta | Sino Biological | Cat#50101-MNAE | |
| Mouse rIL-6 | Sino Biological | Cat#50136-MNAE | |
| Mouse rIL-23 | Sino Biological | Cat#CT028-M08H | |
| Mouse TGF beta 1 | Sino Biological | Cat#50698-M08H | |
| PBS | Procell | Cat#PB180327 | |
| Recombinant Murine IL-2 | peprotech | Cat#212-12 | |
| RPMI 1640 with L-glutamine | Gibco | Cat#11875-119 | |
| Penicillin-streptomycin solution | Gibco | Cat#15070063 | |
| β-mercaptoethanol | Sigma-Aldrich | Cat#M6250-100ML | |
| Critical commercial assays | |||
| Animal Organ Lymphocyte Separation Solution Kit | Tbdscience | Cat#TBD0018SOP | Contains animal spleen tissue lymphocyte separation liquid, tissue sample diluent (cat no. 2010C1119), sample cleaning solution (cat no. 2010X1118), sample washing solution (cat no. TBTDM-W), tissue homogenate flushing liquid (F2013TBD) |
| ChamQ SYBR qPCR Master Mix (High ROX Premixed) | Vazyme | Cat#Q341-02 | https://www.vazymebiotech.com/product-center/chamq-sybr-qpcr-master-mix-high-rox-premixed-q341.html. |
| Fixation/permeabilization Concentrate | invitrogen | Cat#00-5123-43 | |
| Fixation / Permeabilization Diluent | invitrogen | Cat#00-5223-56 | |
| Fixable Viability Dye EF506 | invitrogen | Cat#65-0866 | |
| HiScript II Q RT SuperMix for qPCR (+gDNA wiper) | Vazyme | Cat#R223-01 | https://www.vazymebiotech.com/product-center/hiscript-ii-q-rt-supermix-for-qpcr-gdna-wiper-r223.html. |
| Leukocyte Activation Cocktail | BD | Cat#550583 | |
| Mouse IL-17A (Interleukin 17A) ELISA Kit | Elabscience® | Cat#E-EL-M0047 | |
| Naïve CD4+ T cells isolation kit, mouse | STEMCELL | Cat#19765 | EasySep kit contains mouse CD4+ T cell isolation cocktail [cat no. 19852C.1], mouse memory T cell depletion cocktail [cat no. 18766C], streptavidin RapidSphered 50001 [cat no. 50001], normal rat serum [cat no. 13551]); only store rat serum at -20 °C; other components to be stored at 2-8 °C. |
| Permeabilization Buffer | invitrogen | Cat#00-8333-56 | |
| SPARKeasy Cell RNA Kit | Sparkjade | Cat#AC0205-B | https://www.sparkjade.com/product/detail?id=85 |
| Experimental models: Organisms/strains | |||
| Mouse: C57BL/6 | Gempharmatech | Cat#000013 | |
| Oligonucleotides | |||
| Mouse Il17a TaqMan primers with probe | ribobio | NA | |
| Mouse Il17f TaqMan primers with probe | ribobio | NA | |
| Mouse Il23r TaqMan primers with probe | ribobio | NA | |
| Mouse Rora TaqMan primers with probe | ribobio | NA | |
| β-actin TaqMan primers with probe | ribobio | NA | |
| Software and algorithms | |||
| Cytek Aurora | Cytek | https://spectrum.cytekbio.com/ | |
| FlowJo v10.8.1 | Tree Star | https://www.flowjo.com | |
| GraphPad prism 9 | GraphPad Software | https://www.graphpad-prism.cn | |
| Other | |||
| 1 mL syringe | Kindly | NA | |
| 1.5 mL Centrifuge tubes | Eppendorf | Cat#MCT-150-C | |
| 5 mL Round-bottom tubes | Corning | Cat#352235 | |
| 15 mL Centrifuge tubes | NEST | Cat#601052 | |
| 48-Well tissue culture plate (flatten bottom) | Corning | Cat#3548 | |
| 50 mL Centrifuge tubes | NEST | Cat#602052 | |
| 70 µm Cell strainer | Biosharp | Cat#BS-70-XBS | |
| 96-well Unskirted qPCR Plates | VIOX scientific | Cat#V4801-M | |
| 100 mm Petri dish | Corning | Cat#430167 | |
| Centrifuge | Eppendorf | 5425R | |
| Cell culture CO2 incubator | Thermo Fisher | HEPA Class100 | |
| Cytek Aurora | Cytek | NA | |
| dissecting scissors | RWD | S12003-09 | |
| Hemocytometer | AlphaCell | Cat#J633201 | |
| NanoDrop 2000 Spectrophotometer | Thermo Fisher | ND-2000 | |
| Real-time PCR System | Roche | LightCycler96 | |
| Surgical tweezers | RWD | F12005-10 | |
| Thermal cycler | Bio-Rad | C1000 Touch |
Referencias
- Korn, T., Bettelli, E., Oukka, M., Kuchroo, V. K. IL-17 and Th17 cells. Annu Rev Immunol. 27, 485-517 (2009).
- Bhaumik, S., Basu, R. Cellular and molecular dynamics of Th17 differentiation and its developmental plasticity in the intestinal immune response. Front Immunol. 8, 254 (2017).
- Bettelli, E., Korn, T., Oukka, M., Kuchroo, V. K. Induction and effector functions of T(H)17 cells. Nature. 453 (7198), 1051-1057 (2008).
- Korn, T., et al. IL-21 initiates an alternative pathway to induce proinflammatory T(H)17 cells. Nature. 448 (7152), 484-487 (2007).
- Bettelli, E., et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature. 441 (7090), 235-238 (2006).
- Yang, X. O., et al. T helper 17 lineage differentiation is programmed by orphan nuclear receptors ROR alpha and ROR gamma. Immunity. 28 (1), 29-39 (2008).
- Ghoreschi, K., et al. Generation of pathogenic T(H)17 cells in the absence of TGF-β signalling. Nature. 467 (7318), 967-971 (2010).
- Lee, Y., et al. Induction and molecular signature of pathogenic TH17 cells. Nat Immunol. 13 (10), 991-999 (2012).
- McGeachy, M. J., et al. The interleukin 23 receptor is essential for the terminal differentiation of interleukin 17-producing effector T helper cells in vivo. Nat Immunol. 10 (3), 314-324 (2009).
- Wu, B., et al. The TGF-β superfamily cytokine Activin-A is induced during autoimmune neuroinflammation and drives pathogenic Th17 cell differentiation. Immunity. 54 (2), 308-323 (2021).
- Ramesh, R., et al. Pro-inflammatory human Th17 cells selectively express P-glycoprotein and are refractory to glucocorticoids. J Exp Med. 211 (1), 89-104 (2014).
- Basdeo, S. A., et al. Ex-Th17 (nonclassical Th1) cells are functionally distinct from classical Th1 and Th17 cells and are not constrained by regulatory T cells. J Immunol. 198 (6), 2249-2259 (2017).
- Cua, D. J., et al. Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain. Nature. 421 (6924), 744-748 (2003).
- Awasthi, A., et al. Cutting edge: IL-23 receptor gfp reporter mice reveal distinct populations of IL-17-producing cells. J Immunol. 182 (10), 5904-5908 (2009).
- Jäger, A., Dardalhon, V., Sobel, R. A., Bettelli, E., Kuchroo, V. K. Th1, Th17, and Th9 effector cells induce experimental autoimmune encephalomyelitis with different pathological phenotypes. J Immunol. 183 (11), 7169-7177 (2009).
- Lee, Y., Collins, M., Kuchroo, V. K. Unexpected targets and triggers of autoimmunity. J Clin Immunol. 34, S56-S60 (2014).
- Chang, D., et al. The conserved non-coding aequences CNS6 and CNS9 control cytokine-induced Rorc transcription during T helper 17 cell differentiation. Immunity. 53 (3), 614-626 (2020).
- Bunte, K., Beikler, T. Th17 cells and the IL-23/IL-17 axis in the pathogenesis of periodontitis and immune-mediated inflammatory diseases. Int J Mol Sci. 20 (14), 3394 (2019).
- Zhao, Y., Liu, Z., Qin, L., Wang, T., Bai, O. Insights into the mechanisms of Th17 differentiation and the Yin-Yang of Th17 cells in human diseases. Mol Immunol. 134, 109-117 (2021).
- Berghmans, N., et al. Interferon-γ orchestrates the number and function of Th17 cells in experimental autoimmune encephalomyelitis. J Interferon Cytokine Res. 31 (7), 575-587 (2011).
- Wu, B., Wan, Y. Molecular control of pathogenic Th17 cells in autoimmune diseases. Int Immunopharmacol. 80, 106187 (2020).
- Du, L., et al. Growth hormone releasing hormone signaling promotes Th17 cell differentiation and autoimmune inflammation. Nat Commun. 14 (1), 3298 (2023).
- Ernst, D. N., Weigle, W. O., Noonan, D. J., McQuitty, D. N., Hobbs, M. V. The age-associated increase in IFN-gamma synthesis by mouse CD8+ T cells correlates with shifts in the frequencies of cell subsets defined by membrane CD44, CD45RB, 3G11, and MEL-14 expression. J Immunol. 151 (2), 575-587 (1993).
- Radtke, A. J., et al. IBEX: an iterative immunolabeling and chemical bleaching method for high-content imaging of diverse tissues. Nat Protoc. 17 (2), 378-401 (2022).
- El-Hindi, K., et al. T-cell-specific CerS4 depletion prolonged inflammation and enhanced tumor burden in the AOM/DSS-induced CAC model. Int J Mol Sci. 23 (3), 1866 (2022).
- Cooney, L. A., Towery, K., Endres, J., Fox, D. A. Sensitivity and resistance to regulation by IL-4 during Th17 maturation. J Immunol. 187 (9), 4440-4450 (2011).
- Zhu, X., et al. A novel interleukin-2-based fusion molecule, HCW9302, differentially promotes regulatory T cell expansion to treat atherosclerosis in mice. Front Immunol. 14, 1114802 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados