Method Article
マウスにおけるナイーブCD4+ T細胞の病原性Th17細胞へのin vitro分化
* これらの著者は同等に貢献しました
要約
このプロトコルは、ナイーブCD4+ T細胞の in vitroでの病原性Th17細胞への分化について説明しています。具体的には、マルチパラメータフローサイトメトリーベースのアプローチと組み合わせると、この分化法を用いてナイーブなCD4+ T細胞から90%の純度の病原性Th17細胞を得ることができます。
要約
インビトロT細胞分化技術は、CD4+ T細胞の機能的および機構的研究の両方に不可欠です。病原性Th17細胞は、近年、多発性硬化症(MS)、関節リウマチ、急性呼吸瀉迫症候群(ARDS)、敗血症、その他の自己免疫疾患など、さまざまな疾患に関連しています。しかし、現在知られているin vitro分化プロトコルでは、高純度の病原性Th17細胞を達成することが難しく、誘導効率が50%未満であることが多く、これはin vitro実験における重要な課題です。このプロトコールでは、マウスの脾臓から単離されたナイーブCD4+ T細胞を病原性Th17細胞に直接分化するために使用される、病原性Th17細胞の強化されたin vitro培養および分化プロトコールを提案します。このプロトコルは、脾細胞の単離、ナイーブCD4+ T細胞の精製、および病原性Th17細胞の分化に関する詳細な指示を提供します。このプロトコールにより、病原性Th17細胞の分化純度を約90%にすることができ、多くの細胞実験の基本的なニーズを満たしています。
概要
胸腺を出た後、ナイーブなCD4+ Tリンパ球は二次リンパ器官を通過します。相同抗原をナイーブCD4+ T細胞に伝達する抗原提示細胞は、それらを活性化し、一連の分化プログラムを開始し、最終的に高度に特殊化されたヘルパーT(Th)細胞系譜の産生をもたらします1。インターロイキン17(IL-17)の産生は、炎症誘発性Th細胞2の亜集団であるTh17細胞を特徴付ける。Th17細胞は、細胞外病原体に対する宿主の防御や、自己免疫性ブドウ膜炎や多発性硬化症などの多くの自己免疫疾患の病因に関与する役割を果たしています。T細胞受容体およびサイトカインIL-6およびトランスフォーミング成長因子-β(TGF-β)からのシグナルは、シグナルトランスデューサーおよび転写活性化因子(STAT)33のリン酸化を通じて、ナイーブT細胞のTh17細胞への分化を誘導します。STAT3 は、IL-23 と IL-21 4,5 によって媒介されるシグナル伝達を通じて、正のフィードバック ループでさらに増幅されます。STAT3のリン酸化は、Th17細胞6のIL-17A、IL-17F、IL-21、およびIL-22のサイトカインプロファイルを調節するマスタースイッチとして機能する転写因子RORγtおよびRORαの発現を誘導することができます。しかし、IL-6-およびTGF-β誘導性Th17細胞は、自己免疫疾患を引き起こすには不十分であることが報告されており、IL-23による共刺激またはTGF-β非存在下でのIL-6、IL-1β、およびIL-23の個別の同時刺激が必要です7,8。
実験的自己免疫性脳脊髄炎 (EAE) を効果的に誘導できない Th17 サブセットは非病原性 Th17 と呼ばれることがあり、EAE を誘導できる Th17 サブセットは病原性 Th179 として知られています。現在の研究では、病原性Th17と非病原性Th17がコア転写因子RORγtを共発現する一方で、IL-17Aを産生する能力と炎症誘発性および抗炎症性の特性には大きな違いがあることが示されています10。病原性Th17細胞は、Th17の一般的な特徴的な転写因子であるRORγt、CCR6、STAT4、およびRUNX4の高発現に加えて、TBX21、IFN-γ、CXCR3など、Th1細胞サブセットの特性を持つ疾患に関連する追加の遺伝子シグナル発現特性も示します。病原性Th17細胞は、高レベルの顆粒球-マクロファージコロニー刺激因子(GM-CSF)、IFN-γ、TNF-α、およびその他のサイトカインを分泌することができる11,12。非病原性Th17細胞の表現型は不安定であり、CD3およびサイトカインIL-2の刺激下でのみ、これらの細胞の一部が病原性Th17細胞に分化することができる。したがって、関節リウマチ、多発性硬化症、急性呼吸窮迫症候群などの一般的な臨床疾患モデルでは、病原性Th17細胞が主に病原性影響を及ぼします。
病原性および非病原性のTh17細胞は、異なるサイトカインの影響下でin vitroで分化することができます。近年、いくつかの研究により、異なる種類と濃度のサイトカインを用いてTh17細胞の分化を誘導する方法が提案されています。Th17細胞は、IL-6、IL-1β、およびIL-23の組み合わせによって刺激されます13,14,15,16。Th17細胞の分化に必要な2つのサイトカインであるIL-6とTGF-βは、Rorc遺伝子座17で保存された2つの異なる非コードDNA配列と相互作用することにより、RORγtとTh17細胞の分化の発現を相乗的に制御することが証明されています。病原性Th17細胞の安定相は、主にIL-23によって維持されます18,19。IL-23はその受容体に結合し、JAK-STATシグナル伝達経路20を活性化し、それによってJak2およびTyk2のリン酸化を引き起こし、STAT1、STAT3、STAT4、およびSTAT5のリン酸化を促進します。IL-4およびIFN-γは、この経路の負の調節因子です。しかし、研究によると、IL-1βはmTOR経路を介してRorαおよびRorγtの転写を積極的に調節し、Th17細胞表現型の安定性を維持する可能性があることが示されています21。
多数の研究の不均一性のために、我々は最新の研究から病原性および非病原性Th17細胞の誘導プロトコルをコントロール22として選択した。結果は、すべてがこのプロトコルに従って行われると仮定すると、病原性Th17を生成する条件下での5日間の培養後、生存細胞の90%以上が病原性Th17細胞であり得ることを示している。
プロトコル
サウスイースト大学の動物研究のための機関審査委員会は、この研究で詳述されているすべての動物研究を承認しました。これらは、地域および機関のオフィス基準に準拠して実施されました。脾臓サンプルはC57BL6/Jマウスから採取した。この研究には、5週齢から8週齢の雌マウスと雄マウスの両方が含まれていました。培地とバッファーを4°Cで最大1ヶ月間保存しました。手術器具は使用前にオートクレーブ滅菌しました。試薬による皮膚、目、衣服の汚染を避けるために、ラテックス手袋とマスクを着用してください。肌や目には、水や生理食塩水を大量に使用してください。
1. 24ウェル組織培養プレートを抗CD3でプレコート
- 滅菌済みの1倍リン酸緩衝生理食塩水(PBS)またはRPMI 1640培地で抗CD3を最終濃度1 μg/mLに希釈します。
- 24ウェル組織培養プレートウェルに1 mLの抗CD3溶液(1 μg/mL)を充填します。次に、ウェルをパラフィルムで覆います。
- 抗CD3コーティングプレートを冷蔵庫(2°C〜8°C)に16時間置くか、細胞インキュベーターで37°Cに2〜3時間保管します。
2. マウス脾臓の単離と脾臓単細胞懸濁液の調製
- C57BL/6J で 3% イソフルランで完全麻酔を誘発し、100% 二酸化炭素を 2 分間吸入して安楽死させます。マウスが死亡した直後は、75%エタノールに浸して消毒し、汚染を防ぎます。
- マウスをクリーンベンチの仰臥位に置き、腹部の正中線に沿って切り開き、腹部の構造を層ごとに分離します。ピンセットで大網と胃をそっと開き、胃脾靭帯で脾臓をそっと引き出し、脾臓を周囲の組織や靭帯から鈍く分離して無傷の脾臓を得ます(脾臓の潰れや破裂を避けてください)。
注:無菌状態を維持するために、以下の操作を無菌スーパークリーンベンチで行います。 - 100 mmの滅菌培養皿に70 μmの細胞フィルターを入れ、細胞ストレーナーに脾臓を加え、シリンジプランジャーで粉砕します。同時に、5〜8 mLのホモジネートフラッシング液を加えて、すべての細胞をフィルターを通して培養皿に押し込みます。
注:リンパ球分離液キットの組成は、 材料の表で見ることができます。 - 濾液を450 × g で室温で5分間遠心分離します。上清を捨てます。
- リンパ球分離キットに付属のサンプル希釈液、またはPBSまたはRPMI 1640培地を使用して、細胞ペレットを再懸濁します。細胞懸濁液の細胞濃度を2 × 108-1 × 109 細胞/mLに調整します。
注:通常、1つの脾臓に4〜6mLのサンプル希釈液が必要です。 - 遠心チューブに、組織単細胞懸濁液と同量のリンパ球分離溶液を採取します。単細胞懸濁液をリンパ球分離溶液の表面に慎重にピペットで移動し、800 × g、25°Cで30分間遠心分離します。遠心分離機の加速と減速を適切な範囲に設定します(たとえば、通常の1〜9ギアがある場合は3に設定します)。
注:リンパ球分離溶液は3mL以上でなければなりません。 - 遠心分離後、遠心チューブ内の4つの層を上から下に観察します。最初の層はサンプル希釈液に対応し、その後に環状の乳白色リンパ球層が続きます。3番目の層は分離液であり、4番目の層は赤血球で構成されています。
- ピペットを使用して、環状の乳白色リンパ球層の2番目の層を別の遠心分離管に慎重に引き込み、遠心分離管に10 mLの洗浄液を加えて細胞を混合します。
- 250 × g で室温で5分間遠心分離します。上清を捨てます。10 mLのRPMI 1640培地を使用して、細胞計数用の細胞ペレットを再懸濁します。
3. 磁気ビーズのネガティブセレクションに基づくナイーブCD4+ T細胞の精製
注:マウス脾細胞から免疫磁気陰性選択により、手つかずで高度に精製されたナイーブCD4 + T細胞(CD4 + CD44lowCD62Lhigh)を単離します。
- 0.1〜2mLの容量範囲内に1×108 細胞/mLが含まれるようにサンプルを準備します。
- 50 μL/mLのラット血清を加え、サンプルを5 mLのポリスチレン丸底チューブに移します。
注:ナイーブCD4 T細胞ソーティングキットの組成は、 材料の表に記載されています。 - 50 μL/mLのアイソレーションカクテルをサンプルに加え、よく混合し、室温で7.5分間インキュベートします。
- 50 μL/mLのDepletion Cocktailをサンプルに加え、よく混合し、室温で2.5分間インキュベートします。
- 磁気ビーズを渦巻きにして、均一な分散を確保します。75 μL/mLの磁気ビーズをサンプルに加え、よく混合し、室温で2.5分間インキュベートします。
注:粒子は均一に分散しているように見えます。ボルテックス時間は30秒以上でなければなりません。 - RPMI 1640 Mediumでサンプルを補充し、最終容量2.5 mLにします。ピペッティングで優しく上下させて数回混合します。
- チューブ(蓋なし)を磁石に入れ、室温で2.5分間インキュベートします。
- 磁石を拾い上げ、磁石とチューブを1つの連続的な動きで反転させ、濃縮された細胞懸濁液を新しいチューブに注ぎます。
注意: チューブと磁石を逆さまにして2〜3秒間置いてから、直立させてください。チューブの口に残っている可能性のある滴を邪魔しないでください。 - 血球計算盤を使用して細胞数を決定します。
- 単離前後のナイーブCD4+ T細胞のフローサイトメトリー解析を実施します(図1)。
- 細胞を新しい遠心チューブに移し、室温で400 × gで5分間遠心分離し、上清を捨てます。
- 細胞を200-500 μLのRPMI 1640培地(10%ウシ胎児血清を添加)に再懸濁します。細胞培養1 mL(~106細胞/mLなど)ごとに、白血球活性化カクテル2 μLを加えて混合します。CO2インキュベーターで細胞を37°C、飽和湿度で4〜6時間培養します。
注:細胞は1〜2時間ごとに1回ボルテックスされました。 - 細胞を400 × g、4°Cで5分間遠心分離します。上清を慎重に捨て、細胞を200 μLのPBSに再懸濁します。1 μL の Fc ブロッカーを細胞に加えます (例: ~106 細胞/mL)。細胞を4°Cで10分間インキュベートします。
- 細胞を1 mLのPBSで1回洗浄し、400 × g で4°Cで5分間遠心分離します。 上清を捨て、細胞を200μLのPBSに再懸濁します。
- 抗体カクテル(Fixable Viability Dye、1:1,000、抗CD4、1:200、抗CD44、1:200、抗CD62L、1:200)を添加し、4°Cの暗所で15〜20分間細胞をインキュベートします。
- 細胞を2 x 1 mLのPBSで洗浄し、400 × g で4°Cで5分間遠心分離します。
- 上清を捨て、細胞を250 μLの固定バッファーに再懸濁し、4°Cの暗所で40〜60分間インキュベートします。
注:固定バッファーには、透過化希釈液で希釈する必要がある4倍ストック溶液であるFoxp3/転写因子染色バッファーが付属しています。 - 1x 透過化バッファー 1 mL を添加し、細胞を 300 × g、4 °C で 5 分間遠心分離して、細胞を 2 回洗浄します。
- 上清を捨て、細胞を200 μLの透過化緩衝液に再懸濁し、抗体(Foxp3 [核]、1:200)を細胞に加えます。固定および膜破裂後、細胞-抗体混合物を暗所で40〜60分間インキュベートし、時々4°Cで短時間振とうします。
注:透過化/洗浄液は10倍ストック溶液であり、PBSで使用する前に希釈する必要があります。
4. in vitroでの病原性Th17細胞の誘導
- 使用前に、プレコートされた24ウェルプレートから滅菌PBSを取り出します。
- Th17細胞培養培地(表1)およびTh0細胞培養培地(表1)、古典的非病原性Th17培地(表1)、古典的病原性Th17培地(表1)を含む造影剤を培養に使用します。濃縮ナイーブCD4 + T細胞を再懸濁し、同じ24ウェルプレート(抗CD3でプレコート)内の異なるウェルに分注し、濃度を4 × 105 細胞/mLに調整し、各ウェルに1 mLの培地を入れます。
- 各ウェルに1 μL/mLの抗CD28溶液(最終濃度:中程度から2 μg/mLで希釈)を加えます。5% CO2 インキュベーターで細胞を37°Cで5日間培養します。
- 細胞培養上清培地を培養培地(Th0、非病原性Th17、古典的病原性Th17、および対物Th17)に交換し、慎重にピペッティングして細胞を均等に分布させ、細胞を含む培地の半分を廃棄し、2日目に廃棄量に等しい新しい培地を追加します。4日目に繰り返します。
- 5日目に光学顕微鏡で細胞を観察します(図2)。各グループから細胞上清を採取し、-80°Cで凍結保存します。
5. 病原性Th17およびTh0細胞分化のためのフローサイトメトリー解析
- 培養開始から5日後にすべての細胞を(ウェルごとに)回収します。手順3.12-3.15を実行します。
- 抗体カクテル(Fixable Viability Dye、1:1,000、抗CD4、1:200)を添加し、4°Cの暗所で15〜20分間細胞をインキュベートします。
- 手順 3.17 から 3.19 を実行します。
- 上清を捨て、細胞を200 μLの透過化緩衝液に再懸濁し、抗体カクテル(IL-17A [細胞内]、1:200;RORγT [核]、1:200)を細胞に送る。固定および膜破裂後、細胞-抗体混合物を暗所で40〜60分間インキュベートし、時々4°Cで短時間振とうします。
- 1 mLの1倍透過化/洗浄液を添加して細胞を2回洗浄し、細胞を400 × g で4°Cで5分間遠心分離します。次に、上清を捨てます。
- フローサイトメーターで細胞を検査し、ソフトウェアを使用してデータを解析します(図3)。
- フローサイトメーターの電源を入れ、セルフスタートのクリーニングとキャリブレーションプロセスをオンにします。
- この実験で使用するレーザーチャンネルを選択し、ブランクチューブ、シングルステンドチューブ、サンプルチューブをセットします。
- ブランクチューブオプションをクリックして、マシンでテストします。電圧を調整して、セルイベントが収集ボックスの中央にできるだけ来るようにします。
- 単一染色チューブ細胞を採取し、対応するチャンネルのスペクトル検出を行って、蛍光抗体が正しく添加されていることを確認します。
- アンミックスボタンをクリックすると、マシンが自動的にスペクトル補正を調整できます。他のフローサイトメトリー装置では、蛍光補正を通常どおり調整します。
- 各サンプルチューブセルを採取し、データ形式をFCSファイルとして保存し、エクスポートします。関連するフローサイトメトリーデータ解析ソフトウェアで解析し、プロットします。
- メイン細胞集団を円で囲み、FSC-HおよびFSC-Aの斜めの円ゲートを介して細胞接着の可能性を取り除きます。
- FVSの負の円の領域に従って生細胞を丸で囲みます。次に、CD4+細胞集団を丸で囲みます。
- 横軸をIL-17 A、縦軸をRORγTとしてクロスゲートを構築します。Q2領域における二重陽性選択は、Th17細胞集団です。
6. 異なる媒体によって誘導されるIL-17A分泌を検出するための酵素結合免疫吸着アッセイ(ELISA)
- セクション4.5で収集した凍結細胞上清を解凍します。
- 希釈した標準試料、ブランク、サンプル100 μLを指定のウェルに加えます。シーラーを使用してプレートを覆い、37°Cで90分間インキュベートします。
注意: 内壁に触れたり、発泡を引き起こしたりしないように、micro-ELISAプレートの底に溶液をしっかりと追加します。 - 各ウェルから液体をデカントし、すぐに100 μLのビオチン化検出抗体ワーキング溶液を加えます。新しいシーラーを使用してプレートを覆い、37°Cで1時間インキュベートします。
- 溶液をデカントし、各ウェルに350 μLの洗浄バッファーを加えます。1分後、各ウェルから溶液を吸引またはデカントし、きれいな吸収紙で軽くたたいて乾かします。この洗浄手順を3回繰り返します。
- 100 μLの西洋ワサビペルオキシダーゼコンジュゲートワーキング溶液を各ウェルに加えます。新しいシーラーを使用してプレートを覆い、37°Cで30分間インキュベートします。
- 各ウェルから溶液をデカントし、ステップ6.4で説明したように洗浄プロセスを5回繰り返します。
- 各ウェルに90 μLのSubstrate Reagentを添加し、新しいシーラーで37°Cで約15分間インキュベートし、プレートを光から保護します。
注:反応時間は実際の色の変化に基づいて変更できますが、30分を超えてはなりません。マイクロプレートリーダーをウォームアップして~15分後、OD測定を行います。 - 50 μL/ウェルのストップ溶液を基質溶液と同じ順序で加えます。
- 各ウェルの光学濃度(OD値)を一度に測定するには、450 nmに設定されたマイクロプレートリーダーを使用します。
- 標準サンプルとサンプルのレプリケートウェルのOD値を取得し、ブランクウェルのOD値を差し引いて補正値を取得します。次に、横軸を濃度、OD値を縦軸として線形フィットを実行します。適合した方程式に基づいて、サンプルウェルのIL-17A濃度値を計算します。
注:4日間の分化後、各群の上清中のIL-17Aの含有量を 図4に示します。フィッティング方法は、Orgin21ソフトウェアを参照できます。この実験から得られた標準曲線のR2 値は0.9946です。
7. 定量PCR(qPCR)によるシグネチャー遺伝子発現アッセイによるT細胞分化
注:色素の影響や固定/破裂によるフローサイトメトリーの不安定性の可能性を排除するために、qPCRによる特徴的な遺伝子の発現を検出し、転写レベルでの病原性Th17の分化効果を解明しました。
- T細胞培養終了時の細胞数を測定します。細胞を1.5 mLの遠心チューブに集め、400 × g で5分間遠心分離します。すべての上清を慎重に捨てます。
- RNA抽出
注:抽出プロセスは、RNA酵素の汚染を避けるために、ドラフトまたは超クリーンベンチで実行する必要があります。- 500 μLのLysis Buffer(例:1-2 × 106 細胞)をサンプルチューブに加え(ステップ7.1)、すぐに振とうして細胞塊がなくなるまで混合し、1分間放置します。
- 収集チューブに入れた吸着カラムに混合物を加え、13,400 × g で30秒間遠心分離し、濾液を廃棄します。
- 初めて使用する前に、指定量の無水エタノールを洗浄バッファーボトルに追加してください。吸着カラムに500 μLの洗浄バッファーを加え、13,400 × g で30秒間遠心分離し、ろ液を廃棄します。
- 手順7.2.3で洗濯を繰り返します。
- 吸着カラムRAを空の収集チューブに入れ、13,400 × g で2分間遠心分離してリンス液を除去します。
注:リンス溶液中の残留エタノールが下流の反応を阻害するのを防ぐために、リンス液を除去する必要があります。 - 吸着カラムRAを取り外し、清潔なRNaseフリーの遠心分離チューブに入れます。吸着膜の中央にRNaseフリーのH2O50 μLを加え、室温で1分間静置した後、9,600 × g で1分間遠心分離します。
- RNAの純度と濃度を測定します。
- キットの製造元の指示に従って、cDNAの最初の鎖を合成します。
- ゲノムDNAを除去します。抽出したテンプレートRNA500 ngをRNaseフリーの遠心分離チューブに取ります。RNaseフリーのddH2Oと4x gDNAミックスを添加して混合物を形成します。ピペットで穏やかにブレンドし、42°Cのウォーターバスに2分間入れます。
注:反応混合物の量と添加される量は、RNA濃度に関連しています。詳細な手順を参照してください。この実験では、20 μLの反応システムを使用しました。 - 5倍逆転写反応系を前のステップの反応チューブに直接追加します。逆転写反応系を4 μL、前工程の混合物を16 μL取り、ピペットで穏やかに混合します。
注:逆転写システムには、直接設定された逆転写システムである必要なすべての逆転写酵素が含まれています。 - 逆転写反応を37°C15分、85°C、5秒に設定し、最後に4°Cに冷却します。
- ゲノムDNAを除去します。抽出したテンプレートRNA500 ngをRNaseフリーの遠心分離チューブに取ります。RNaseフリーのddH2Oと4x gDNAミックスを添加して混合物を形成します。ピペットで穏やかにブレンドし、42°Cのウォーターバスに2分間入れます。
- 製造元の指示に従ってPCR反応を設定します。
- qPCRチューブに2x PCR反応酵素混合物10 μL、プライマー1 0.4 μL、プライマー2 0.4 μL、50xROX Reference Dye 1 0.4 μL、テンプレートcDNA2 2 μL、ddH2O6.8 μLを10 μL加えて、20 μLの混合物を調製します。
- 次の設定を使用して、リアルタイム蛍光定量PCR装置でPCRを実行します:ステージ1、95°C、30秒、担当者x 1;ステージ 2、最初は 95 °C、10 秒、次に 60 °C、30 秒、担当者 x 40;ステージ 3、最初の 95 °C、15 秒、次の 60 °C、60 秒、最後に 95 °C、15 秒、Rep x 1。
注:分化の4日後、ナイーブCD4+ T細胞におけるIl17a、Il17f、Rora、およびIl23rの相対発現レベルを図5に示します。
結果
私たちのプロトコルは、病原性Th17細胞分化に関する以前の研究に基づいて開発されました。実験の最初のステップは、磁気ビーズソーティングによって脾臓から単離されたナイーブCD4+ T細胞の純度を検出することであり、これがその後の病原性Th17細胞分化の成功の基礎となります。ナイーブCD4+ T細胞の純度は、表面マーカーCD62L23 およびCD4424 を使用して検出され、FOXP325 はTreg細胞のマーカーとして使用されました。ソーティング後、Treg細胞の含有量は大幅に減少し、ナイーブCD4+ T細胞の純度は少なくとも95%に達する可能性があることがわかりました(図1)。病原性Th17細胞の分化を比較するために、ナイーブCD4+ T細胞をTh0培地(表1)およびTh17分化培地(表1)で合計5日間培養しました。その結果、T細胞はTh0培地とTh17培地の両方でクラスター増殖を示すことがわかりました(図2)。
次に、細胞を固定し、透過処理し、フローサイトメトリーに基づいて分化したCD4+ T細胞のいくつかのサイトカインに対する抗体で標識しました。私たちは、Th17細胞分化の特徴であるサイトカインとしてIL17A26 とRORγT27 を調べ、ナイーブCD4+ T細胞の90%が新しいTh17細胞培養培地の刺激下で病原性Th17細胞にうまく分化することを発見しました(図3)。 図5 は、PCRで検出したTh17細胞のシグネチャー遺伝子を示しており、分化によって得られた病原性Th17細胞が安定して発現していることが証明されました。
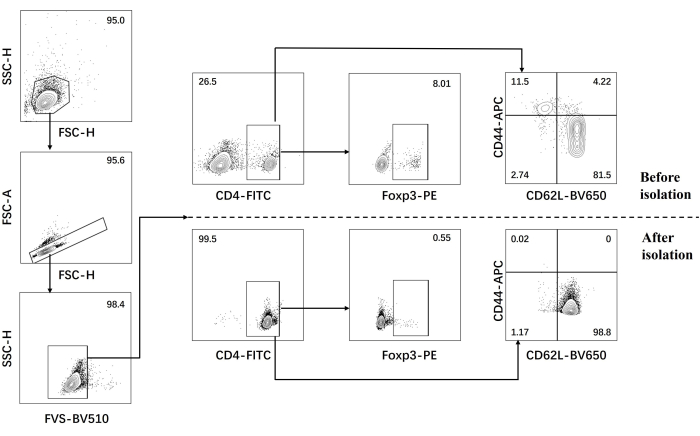
図1:ナイーブCD4+ T細胞単離前後のC57BL/6Jマウスのシグネチャーサイトカイン解析のためのゲーティング戦略。 略語:FSC-H =前方散乱ピーク高さ;SSC-H = サイドスキャッター-ピーハイト;FSC-A = 前方散乱ピーク面積;FITC = フルオレセインイソチオシアネート;PE =フィコエリトリン。 この図の拡大版を表示するには、ここをクリックしてください。
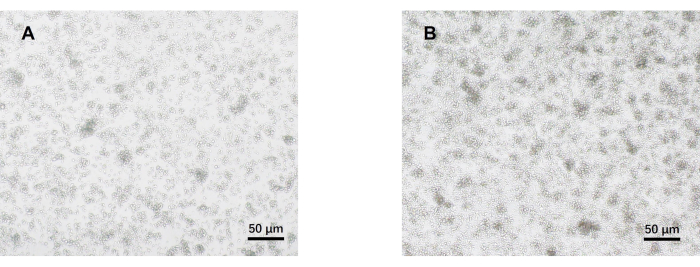
図2:病原性Th17およびTh0条件下で5日間培養したマウスナイーブCD4+ T細胞の代表画像。(b)病原性Th17細胞。スケールバー = 50 μm. この図の拡大版を表示するには、ここをクリックしてください。
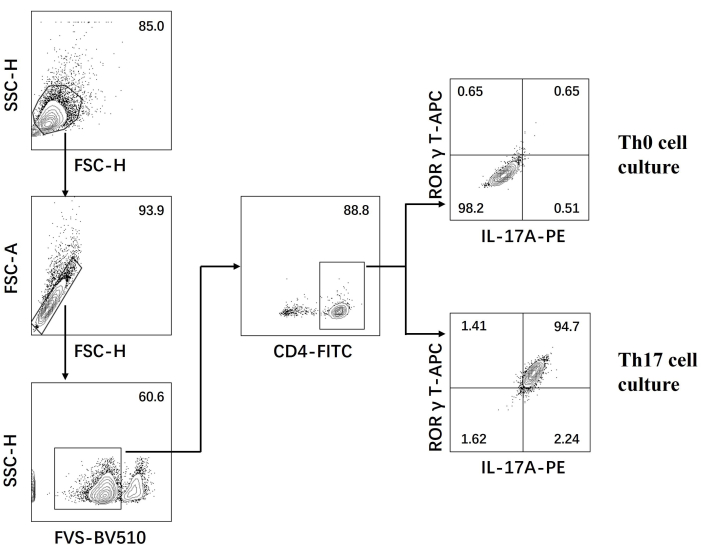
図3:Th0細胞培養培地およびTh17細胞培養培地による分化後のフローサイトメトリー解析。 略語:FSC-H =前方散乱ピーク高さ;SSC-H = サイドスキャッター-ピーハイト;FSC-A = 前方散乱ピーク面積;FITC = フルオレセインイソチオシアネート;PE =フィコエリトリン。 この図の拡大版を表示するには、ここをクリックしてください。
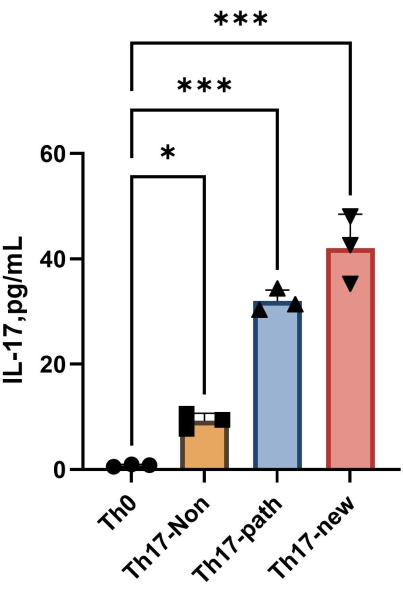
図4:分化誘導後のTh0細胞培養培地およびTh17細胞培養培地の上清中のIL-17Aの含有量。 この図の拡大版を見るには、ここをクリックしてください。
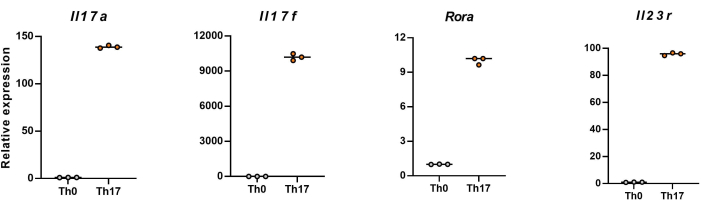
図5:C57BL/6Jマウスの分化したCD4+ T細胞におけるシグネチャーサイトカインの発現レベルの代表的な結果。 この 図の拡大版を見るには、ここをクリックしてください。
| 標的病原性Th17細胞培養培地 | Th0細胞培養液 | 古典的非病原性Th17細胞培養培地 | 古典的な病原性Th17細胞培養培地。 | |||||||||||
| 試薬 | 最終濃度 | 量 | 最終濃度 | 量 | 最終濃度 | 量 | 最終濃度 | 量 | ||||||
| ペニシリン-ストレプトマイシン(100x) | 1倍 | 500μL | 1倍 | 500μL | 1倍 | 500μL | 1倍 | 500μL | ||||||
| ウシ胎児血清 | 10% | 5ミリリットル | 10% | 5ミリリットル | 10% | 5ミリリットル | 10% | 5ミリリットル | ||||||
| β-メルカプトエタノール | 50 μM | 50 μL | 50 μM | 50 μL | 50 μM | 50 μL | 50 μM | 50 μL | ||||||
| GlutaMAXTM サプリメント (100x) | 1倍 | 500μL | 1倍 | 500μL | 1倍 | 500μL | 1倍 | 500μL | ||||||
| ピルビン酸ナトリウム溶液(100x) | 1 mM | 500μL | 1 mM | 500μL | 1 mM | 500μL | 1 mM | 500μL | ||||||
| 抗マウスIFNガンマ(1 mg / mL) | 5 μg/mL | 250μL | 10 μg/mL | 500μL | 10 μg/mL | 500μL | ||||||||
| 抗マウスIL-4(2 mg / mL) | 5 μg/mL | 125μL | 5 μg/mL | 250μL | 10 μg/mL | 250μL | ||||||||
| マウス rIL-1 ベータ (20 μg) | 20 ng/mL | NAの | ||||||||||||
| マウス rIL-6 (20 μg) | 20 ng/mL | NAの | 50 ng/mL | NAの | 50 ng/mL | NAの | ||||||||
| マウス rIL-23 (50 μg) | 50 ng/mL | NAの | 10 ng/mL | NAの | ||||||||||
| マウスTGFベータ(100μg) | 3 ng/mL | NAの | 1 ng/mL | NAの | 1 ng/mL | NAの | ||||||||
| マウスIL-2(5μg) | 20 ng/mL | NAの | ||||||||||||
| RPMIの1640 | NAの | 50mLまで | NAの | 50mLまで | NAの | 50mLまで | ||||||||
| トータル | NAの | 50ミリリットル | NAの | 50ミリリットル | NAの | 50ミリリットル | ||||||||
表1:標的病原性Th17細胞培養、Th0細胞培養、古典的非病原性および病原性Th17細胞培養培地。
ディスカッション
この手順は、病原性Th17細胞の in vitro 産生のために、マウスの脾臓ナイーブCD4+ T細胞の数を増やす生産的な方法を提供しました。当社は、報告されている他のTh17細胞培養培地よりも多くのサイトカインを使用していますが、病原性Th17細胞の増殖条件の最適化に取り組んでいます。私たちは、誘導分化プロトコルのさらなる最適化を検討しています。
ここでは、フローサイトメトリーとqPCRを使用して、特徴的なサイトカインの産生を調べました。いくつかの小さな変更を加えるだけで、このアプローチは細胞増殖などの他の機能試験にも使用できます。
マウス脾臓リンパ球の単離には、効果があり時間も節約できる中国製のリンパ球単離キットを使用しました。他のブランドに基づくリンパ球分離ソリューションは、さまざまなステップを通じてマウス脾臓リンパ球を分離する目的も達成できます。別の方法は、得られた脾臓細胞懸濁液の赤血球を直接溶解することです。しかし、脾臓の赤血球は一度に溶解できないことが多いことがわかりました。
このプロトコルの実行中にいくつかの問題が発生する可能性があります。まず、磁気ビーズソーティングによって得られるナイーブCD4+ T細胞の数は非常に少ない可能性があります(プロトコルステップ3)。これは、臓器を粉砕するプロセスが不十分であることに起因する可能性があります。臓器が適切に均質化されていることを確認することが重要です。均質化プロセス中のすすぎの頻度を増やすと、回収率が向上します。脾臓ナイーブCD4+ T細胞の数を増やすために、若いマウス(6〜10週齢)を使用することをお勧めします。脾臓リンパ球の分離にはさまざまな方法があり、使用する分離液によって収量が異なる場合があります。普遍的に認定された分離液を使用し、リンパ球層をできるだけ抽出するようにすることをお勧めします。
次に、フローサイトメトリーにおけるCD4+ T細胞の割合は<80%である可能性があります(プロトコルステップ5)。この問題の原因として考えられるのは、脾細胞の数が不正確であり、その結果、追加の抗体カクテルや磁気ビーズの細胞数よりも細胞数が多くなることである可能性があります。ナイーブCD4+ T細胞精製の有効性を高めるためには、細胞のカウントが正確でなければなりません。さらに、このプロトコルが推奨するものよりも10%多くの抗体カクテルと磁気ビーズを使用することができます。最後に、フローサイトメトリーは、ナイーブCD4+ T細胞を選別した直後に行うことができます。
第三に、培養中に形成されるT細胞クラスターは多くない可能性があり、ほとんどの細胞はT細胞の分化中に死滅した可能性があります(プロトコルステップ4)。この問題の潜在的な原因は、播種前のナイーブCD4+ T細胞の細胞数の決定が不正確であり、その結果、細胞密度が低くなることである可能性があります。48ウェルプレートの各ウェルで約4×105 細胞/mLの所望の細胞密度を達成するためには、より正確な計数方法を採用することをお勧めします。また、CO2 インキュベーターの技術的な問題(温度の誤りやCO2 濃度など)も考えられる原因です。最後に、細胞培養培地を交換する際の過度の力は、細胞死を引き起こす可能性があります。
第四に、シグネチャーサイトカイン遺伝子の相対発現レベルが低い可能性があります(プロトコールステップ7)。抽出したRNAの真正性を確保するため、100 ng/mLを超えるナノ液滴検出濃度を使用することが推奨されます。濃度の低下の潜在的な理由は、採取した細胞の大部分が死んでいる、または死にかけているなど、培養細胞の不健康な性質である可能性があります。真のRNA濃度を得るためには、細胞培養中の増殖不良につながる可能性のある状況を解決する必要があります。この懸念の背後にある別の理由は、RNA抽出中に達成される最終細胞数が過度に少ないことであり、これはおそらく上清処理中の不注意による細胞損失によるものかもしれません。ワンステップRNA抽出キットなどの高度なRNA抽出技術を採用することは、有利であることが証明される可能性があります。Nanodropで測定した理想的なOD260 / OD280比は、1.9〜2.1の範囲に収まる必要があります。比率が低すぎると、タンパク質汚染の可能性があります。RNaseフリーバッファー洗浄の頻度を増やすと、この問題の軽減に役立つ可能性があります。逆に、特徴的に低い比率は、RNAの分解の可能性を意味します。この問題に対処するために、RNaseを含まない水を使用し、RNaseの除染目的で1.5mLチューブを使用することをお勧めします。
結論として、現在のプロトコルでは、ナイーブCD4+ T細胞を直接誘導してin vitroで病原性Th17細胞に分化させるための新しい細胞培養培地の使用について説明しています。直接分離と比較して、この方法がより直接的で、安価で、より効率的であることは間違いありません。培地の構成も非常にシンプルなため、構築されたTh17細胞をその後の実験により直感的に使用でき、多くの疾患の研究に非常に優れた細胞モデルを提供します。
開示事項
著者らは、この論文の出版に関して利益相反がないことを宣言します。
謝辞
本研究は、中国国家重点研究開発プログラム(No.2022YFC2304604)、中国国家自然科学基金会(No.81971812)、中国国家自然科学基金会(No.82272235)、江蘇省衛生委員会科学基金会(No.ZDB2020009)、江蘇省重点研究開発プログラム(社会開発)特別プロジェクト(No.BE2021734)、科学技術部国家重点研究開発プログラム(No.2020YFC083700)、江蘇省救命救急医学重点研究所(BM2020004)、中国国家自然科学基金会重点プロジェクト(81930058)、中国国家自然科学基金会(82171717)、中央大学基礎研究費(2242022K4007)、 江蘇省自然科学財団一般プロジェクト(BK20211170)。
資料
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Rat anti-mouse CD62L, BV650, clone MEL-14, 1:200 dilution | BD | Cat# 564108; RRID: AB_2738597 | |
| Rat monoclonal anti-CD4, FITC, clone RM4-5, 1:200 dilution | BioLegend | Cat#100509; RRID: AB_312712 | |
| Rat monoclonal anti-IL-17A, PE, clone TC11-18H10.1, 1:200 dilution | BioLegend | Cat#506903; RRID: AB_ 315463 | |
| Rat monoclonal anti mouse/human CD44, APC, clone IM&, 1:200 dilution | BioLegend | Cat#103012; RRID: AB_312963 | |
| Rat monoclonal anti-RORγT, APC, clone B2D, 1:200 dilution | Invitrogen | Cat#17-6981-80; RRID: AB_2573253 | |
| Rat monoclonal FOXP3 antibody, PE, clone FJK-16s, 1:200 dilution | Invitrogen | Cat#12-5773-82; RRID: AB_465936 | |
| Chemicals, peptides, and recombinant proteins | |||
| Anti-Mouse CD3 SAFIRE purified | biogems | Cat#05112-25 | |
| Anti-Mouse CD28 SAFIRE purified | biogems | Cat#10312-25 | |
| Anti-Mouse IFN gamma | biogems | Cat#80822-25 | |
| Anti-Mouse IL-4 | biogems | Cat#81112-25 | |
| Ethanol | Xilong scientific | Cat#64-17-5 | |
| Fetal bovine serum | Gibco | Cat#10437-028 | |
| FcR Blocking reagent | Miltenyi Biotec | Cat#130-092-575 | |
| GlutaMAX supplement | gibco | Cat#35050079 | |
| Mouse rIL-1 beta | Sino Biological | Cat#50101-MNAE | |
| Mouse rIL-6 | Sino Biological | Cat#50136-MNAE | |
| Mouse rIL-23 | Sino Biological | Cat#CT028-M08H | |
| Mouse TGF beta 1 | Sino Biological | Cat#50698-M08H | |
| PBS | Procell | Cat#PB180327 | |
| Recombinant Murine IL-2 | peprotech | Cat#212-12 | |
| RPMI 1640 with L-glutamine | Gibco | Cat#11875-119 | |
| Penicillin-streptomycin solution | Gibco | Cat#15070063 | |
| β-mercaptoethanol | Sigma-Aldrich | Cat#M6250-100ML | |
| Critical commercial assays | |||
| Animal Organ Lymphocyte Separation Solution Kit | Tbdscience | Cat#TBD0018SOP | Contains animal spleen tissue lymphocyte separation liquid, tissue sample diluent (cat no. 2010C1119), sample cleaning solution (cat no. 2010X1118), sample washing solution (cat no. TBTDM-W), tissue homogenate flushing liquid (F2013TBD) |
| ChamQ SYBR qPCR Master Mix (High ROX Premixed) | Vazyme | Cat#Q341-02 | https://www.vazymebiotech.com/product-center/chamq-sybr-qpcr-master-mix-high-rox-premixed-q341.html. |
| Fixation/permeabilization Concentrate | invitrogen | Cat#00-5123-43 | |
| Fixation / Permeabilization Diluent | invitrogen | Cat#00-5223-56 | |
| Fixable Viability Dye EF506 | invitrogen | Cat#65-0866 | |
| HiScript II Q RT SuperMix for qPCR (+gDNA wiper) | Vazyme | Cat#R223-01 | https://www.vazymebiotech.com/product-center/hiscript-ii-q-rt-supermix-for-qpcr-gdna-wiper-r223.html. |
| Leukocyte Activation Cocktail | BD | Cat#550583 | |
| Mouse IL-17A (Interleukin 17A) ELISA Kit | Elabscience® | Cat#E-EL-M0047 | |
| Naïve CD4+ T cells isolation kit, mouse | STEMCELL | Cat#19765 | EasySep kit contains mouse CD4+ T cell isolation cocktail [cat no. 19852C.1], mouse memory T cell depletion cocktail [cat no. 18766C], streptavidin RapidSphered 50001 [cat no. 50001], normal rat serum [cat no. 13551]); only store rat serum at -20 °C; other components to be stored at 2-8 °C. |
| Permeabilization Buffer | invitrogen | Cat#00-8333-56 | |
| SPARKeasy Cell RNA Kit | Sparkjade | Cat#AC0205-B | https://www.sparkjade.com/product/detail?id=85 |
| Experimental models: Organisms/strains | |||
| Mouse: C57BL/6 | Gempharmatech | Cat#000013 | |
| Oligonucleotides | |||
| Mouse Il17a TaqMan primers with probe | ribobio | NA | |
| Mouse Il17f TaqMan primers with probe | ribobio | NA | |
| Mouse Il23r TaqMan primers with probe | ribobio | NA | |
| Mouse Rora TaqMan primers with probe | ribobio | NA | |
| β-actin TaqMan primers with probe | ribobio | NA | |
| Software and algorithms | |||
| Cytek Aurora | Cytek | https://spectrum.cytekbio.com/ | |
| FlowJo v10.8.1 | Tree Star | https://www.flowjo.com | |
| GraphPad prism 9 | GraphPad Software | https://www.graphpad-prism.cn | |
| Other | |||
| 1 mL syringe | Kindly | NA | |
| 1.5 mL Centrifuge tubes | Eppendorf | Cat#MCT-150-C | |
| 5 mL Round-bottom tubes | Corning | Cat#352235 | |
| 15 mL Centrifuge tubes | NEST | Cat#601052 | |
| 48-Well tissue culture plate (flatten bottom) | Corning | Cat#3548 | |
| 50 mL Centrifuge tubes | NEST | Cat#602052 | |
| 70 µm Cell strainer | Biosharp | Cat#BS-70-XBS | |
| 96-well Unskirted qPCR Plates | VIOX scientific | Cat#V4801-M | |
| 100 mm Petri dish | Corning | Cat#430167 | |
| Centrifuge | Eppendorf | 5425R | |
| Cell culture CO2 incubator | Thermo Fisher | HEPA Class100 | |
| Cytek Aurora | Cytek | NA | |
| dissecting scissors | RWD | S12003-09 | |
| Hemocytometer | AlphaCell | Cat#J633201 | |
| NanoDrop 2000 Spectrophotometer | Thermo Fisher | ND-2000 | |
| Real-time PCR System | Roche | LightCycler96 | |
| Surgical tweezers | RWD | F12005-10 | |
| Thermal cycler | Bio-Rad | C1000 Touch |
参考文献
- Korn, T., Bettelli, E., Oukka, M., Kuchroo, V. K. IL-17 and Th17 cells. Annu Rev Immunol. 27, 485-517 (2009).
- Bhaumik, S., Basu, R. Cellular and molecular dynamics of Th17 differentiation and its developmental plasticity in the intestinal immune response. Front Immunol. 8, 254 (2017).
- Bettelli, E., Korn, T., Oukka, M., Kuchroo, V. K. Induction and effector functions of T(H)17 cells. Nature. 453 (7198), 1051-1057 (2008).
- Korn, T., et al. IL-21 initiates an alternative pathway to induce proinflammatory T(H)17 cells. Nature. 448 (7152), 484-487 (2007).
- Bettelli, E., et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature. 441 (7090), 235-238 (2006).
- Yang, X. O., et al. T helper 17 lineage differentiation is programmed by orphan nuclear receptors ROR alpha and ROR gamma. Immunity. 28 (1), 29-39 (2008).
- Ghoreschi, K., et al. Generation of pathogenic T(H)17 cells in the absence of TGF-β signalling. Nature. 467 (7318), 967-971 (2010).
- Lee, Y., et al. Induction and molecular signature of pathogenic TH17 cells. Nat Immunol. 13 (10), 991-999 (2012).
- McGeachy, M. J., et al. The interleukin 23 receptor is essential for the terminal differentiation of interleukin 17-producing effector T helper cells in vivo. Nat Immunol. 10 (3), 314-324 (2009).
- Wu, B., et al. The TGF-β superfamily cytokine Activin-A is induced during autoimmune neuroinflammation and drives pathogenic Th17 cell differentiation. Immunity. 54 (2), 308-323 (2021).
- Ramesh, R., et al. Pro-inflammatory human Th17 cells selectively express P-glycoprotein and are refractory to glucocorticoids. J Exp Med. 211 (1), 89-104 (2014).
- Basdeo, S. A., et al. Ex-Th17 (nonclassical Th1) cells are functionally distinct from classical Th1 and Th17 cells and are not constrained by regulatory T cells. J Immunol. 198 (6), 2249-2259 (2017).
- Cua, D. J., et al. Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain. Nature. 421 (6924), 744-748 (2003).
- Awasthi, A., et al. Cutting edge: IL-23 receptor gfp reporter mice reveal distinct populations of IL-17-producing cells. J Immunol. 182 (10), 5904-5908 (2009).
- Jäger, A., Dardalhon, V., Sobel, R. A., Bettelli, E., Kuchroo, V. K. Th1, Th17, and Th9 effector cells induce experimental autoimmune encephalomyelitis with different pathological phenotypes. J Immunol. 183 (11), 7169-7177 (2009).
- Lee, Y., Collins, M., Kuchroo, V. K. Unexpected targets and triggers of autoimmunity. J Clin Immunol. 34, S56-S60 (2014).
- Chang, D., et al. The conserved non-coding aequences CNS6 and CNS9 control cytokine-induced Rorc transcription during T helper 17 cell differentiation. Immunity. 53 (3), 614-626 (2020).
- Bunte, K., Beikler, T. Th17 cells and the IL-23/IL-17 axis in the pathogenesis of periodontitis and immune-mediated inflammatory diseases. Int J Mol Sci. 20 (14), 3394 (2019).
- Zhao, Y., Liu, Z., Qin, L., Wang, T., Bai, O. Insights into the mechanisms of Th17 differentiation and the Yin-Yang of Th17 cells in human diseases. Mol Immunol. 134, 109-117 (2021).
- Berghmans, N., et al. Interferon-γ orchestrates the number and function of Th17 cells in experimental autoimmune encephalomyelitis. J Interferon Cytokine Res. 31 (7), 575-587 (2011).
- Wu, B., Wan, Y. Molecular control of pathogenic Th17 cells in autoimmune diseases. Int Immunopharmacol. 80, 106187 (2020).
- Du, L., et al. Growth hormone releasing hormone signaling promotes Th17 cell differentiation and autoimmune inflammation. Nat Commun. 14 (1), 3298 (2023).
- Ernst, D. N., Weigle, W. O., Noonan, D. J., McQuitty, D. N., Hobbs, M. V. The age-associated increase in IFN-gamma synthesis by mouse CD8+ T cells correlates with shifts in the frequencies of cell subsets defined by membrane CD44, CD45RB, 3G11, and MEL-14 expression. J Immunol. 151 (2), 575-587 (1993).
- Radtke, A. J., et al. IBEX: an iterative immunolabeling and chemical bleaching method for high-content imaging of diverse tissues. Nat Protoc. 17 (2), 378-401 (2022).
- El-Hindi, K., et al. T-cell-specific CerS4 depletion prolonged inflammation and enhanced tumor burden in the AOM/DSS-induced CAC model. Int J Mol Sci. 23 (3), 1866 (2022).
- Cooney, L. A., Towery, K., Endres, J., Fox, D. A. Sensitivity and resistance to regulation by IL-4 during Th17 maturation. J Immunol. 187 (9), 4440-4450 (2011).
- Zhu, X., et al. A novel interleukin-2-based fusion molecule, HCW9302, differentially promotes regulatory T cell expansion to treat atherosclerosis in mice. Front Immunol. 14, 1114802 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved