Method Article
تمنح الخلايا البدينة في البيئة المكروية لسرطان الخلايا الكبدية تشخيصا إيجابيا: دراسة بأثر رجعي باستخدام برنامج تحليل الصور QuPath
In This Article
Summary
إن وجود الخلايا البدينة في الهامش الداخلي ومناطق الورم في سرطان الخلايا الكبدية بعد الاستئصال يمنح تشخيصا إيجابيا. تؤيد هذه الدراسة برنامج تحليل الصور QuPath كمنصة واعدة يمكن أن تلبي الحاجة إلى التكرار والاتساق والدقة في علم الأمراض الرقمي.
Abstract
قد تقدم الأفكار التي يوفرها الكشف في الموقع عن الخلايا المناعية داخل سرطان الخلايا الكبدية (HCC) معلومات عن نتائج المرضى. ترتبط الدراسات التي تبحث في التعبير عن الخلايا المناعية وتوطينها داخل أنسجة الورم بالعديد من التحديات ، بما في ذلك عدم وجود تعليق توضيحي دقيق لمناطق الورم والاختيار العشوائي لمجالات الرؤية المجهرية. QuPath هو برنامج مفتوح المصدر وسهل الاستخدام يمكنه تلبية الحاجة المتزايدة لعلم الأمراض الرقمي في تحليل صورة الشريحة الكاملة (WSI).
تم تقييم تسلل سرطان الكبد والأنسجة المجاورة بواسطة الخلايا المتغصنة غير الناضجة CD1a + (iDCs) والخلايا البدينة CD117 + والخلايا القاتلة الطبيعية NKp46 + (NKs) من الناحية المناعية الكيميائية في عينات تمثيلية ل 67 مريضا يعانون من سرطان الكبد الذين خضعوا للاستئصال العلاجي. تم تقييم جزء المساحة (AF) للخلايا الملطخة إيجابيا تلقائيا في WSIs باستخدام QuPath في مركز الورم (TC) والهامش الداخلي (IM) والهامش الخارجي (OM) ومنطقة peritumor (PT). تم تقييم الأهمية النذير للخلايا المناعية لوقت التكرار (TTR) ، والبقاء على قيد الحياة بدون أمراض (DFS) ، والبقاء على قيد الحياة بشكل عام (OS).
كان الرجفان الأذيني للخلايا البدينة أكبر بكثير من AF ل NKs ، وكان AF ل iDCs أقل بكثير مقارنة ب NKs في كل منطقة من مناطق الاهتمام. ارتبطت AFs العالية للخلايا البدينة في مناطق IM و PT مع DFS أطول. بالإضافة إلى ذلك ، ارتبط التركيز البؤري التلقائي العالي للخلايا البدينة في المراسلة الفورية بنظام تشغيل أطول.
يعد التحليل بمساعدة الكمبيوتر باستخدام هذا البرنامج أداة مناسبة للحصول على معلومات تنبؤية للخلايا المناعية المتسللة إلى الورم (iDCs والخلايا البدينة و NKs) في مناطق مختلفة من سرطان الكبد بعد الاستئصال. أظهرت الخلايا البدينة أكبر تركيز بؤري تلقائي في جميع مناطق الاهتمام (ROIs). أظهرت الخلايا البدينة في منطقة الورم و IM أهمية تنبؤية إيجابية.
Introduction
ثبت أن التنظيم المكاني ووفرة الخلايا المناعية المتسللة إلى الورم يؤثران على البقاء على قيد الحياة في أنواع مختلفة من السرطان ، وشمل سرطان الخلايا الكبدية (HCC)1،2،3،4. تم عرض الأهمية النذير للخلايا الليمفاوية المتسللة إلى الورم في السرطانات لأول مرة على الهيماتوكسيلين ويوزين (H&E) الملطخة 5,6. بعد ذلك ، أظهرت دراسة رائدة أجراها Galon et al. باستخدام الكيمياء الهيستولوجية المناعية (IHC) ارتباطات كثافات الخلايا التائية CD3 + و CD8 + في أنسجة سرطان القولون مع التشخيص4.
IHC هو المعيار الذهبي لتصور الخلايا المناعية وقياسها ورسم خرائطها داخل أنسجة الورم لمزيد من الارتباط بالنتائج السريرية7. تقدم المدينة العالمية للخدمات الإنسانية العديد من المزايا ، مثل التكلفة المنخفضة ، والتوافر على نطاق واسع ، والتوافق مع الأنسجة المضمنة في البارافين المثبتة بالفورمالين (FFPE)8. ومع ذلك ، فإن التقييم الدقيق للخلايا المناعية الملطخة ب IHC يمثل تحديا كبيرا. يستغرق التسجيل التقليدي في مجالات الرؤية المجهرية المختارة وقتا طويلا ولم يعد كافيا لضمان التحليل الموضوعي عالي الجودة والقابل للتكرار الضروري لاختيار العلامات الحيوية المرشحة والارتباط السريري الموثوقبه 9. يمكن تقييم عمليات المسح الضوئي للشرائح الكاملة كصورة كاملة أو بعد أخذ عينات فرعية10.
يمكن أن يضمن التقييم الكمي المحوسب لوفرة الخلايا المناعية في عينات الأنسجة بيانات عملية ودقيقة وموثوقة وذات صلة سريريا11. QuPath هو برنامج مجاني مفتوح المصدر يتيح تحليل الصور الرقمية للشرائح الملطخة ب IHC ويزيد من كمية المعلومات الناتجة عن العينات الفردية12.
نظرا لأن الخلايا المتغصنة غير الناضجة (iDCs) والخلايا القاتلة الطبيعية (NK) والخلايا البدينة تشارك في الاستجابات المناعية المضادة للورم وقد ثبت أنها ترتبط بنتائج المرضى13،14،15 ، فإننا نقدم هنا بروتوكولا خطوة بخطوة لتقييم توزيعها المكاني في أنسجة FFPE HCC واستكشاف تأثيرها النذير. يتم التعبير عن CD1a بشكل رئيسي على غشاء الخلايا المتغصنة غير الناضجة ، والتي ارتبطت كثافتها بالنتائج السريرية في مجموعة متنوعة من الأورام البشرية16,17. يمكن أن تلعب الخلايا البدينة دورا في الورم أو دورا مضادا للورم داخل البيئة المكروية للورم (TME)18. يمكنهم دعم تكوين الأوعية وتسهيل ورم خبيث19. على العكس من ذلك ، فقد تم الإبلاغ عن أن الخلايا البدينة يمكن أن تتوسط في موت الخلايا المبرمج للخلايا السرطانية من خلال إنتاج IL-420. يستخدم تلطيخ مضاد CD117 بشكل شائع لتصور وقياس الخلايا البدينة داخل أنسجة الورم21. يعتقد أن الخلايا القاتلة الطبيعية تساهم في مراقبة ومراقبة سرطان الكبد22 عن طريق قتل الخلايا السرطانية23. يعد تعبير NKp46 بواسطة NK معلمة حاسمة لنشاطهم المضاد للورم24. ومع ذلك ، ارتبطت خلايا NKp46 + NK بشكل إيجابي مع قطر الورم في مرضى سرطان الكبد25. على الرغم من ذلك ، لا يعرف سوى القليل عن علاقتها ببقاء المريض.
كنا نهدف إلى إجراء تقييم كمي لوفرة خلايا CD1a + iDCs وخلايا CD117 + البدينة وخلايا NKp46 + NK في مناطق مختلفة من سرطان الكبد وتسليط الضوء على أهميتها النذير. تم تضمين ما مجموعه 70 مريضا متتاليا يعانون من المرحلة الأولى إلى الرابعة من HCC المؤكدة مرضيا ، والذين كانوا مؤهلين للاستئصال وفقا لإرشادات BCLC وخضعوا لاستئصال الكبد بقصد علاجي في مستشفى جامعة بيلسن بين عامي 1997 و 2019 ، في الدراسة الحالية بأثر رجعي. تمت مراجعة تقارير علم الأمراض للمرضى. لم يكن لدى أي من المرضى المشمولين في هذه الدراسة نقائل بعيدة ولم يتلقوا علاجا مساعدا جديدا مثل العلاج الكيميائي أو العلاج الإشعاعي قبل الجراحة. تم استبعاد ما مجموعه 3 مرضى يعانون من عينات نسيجية رديئة الجودة ، وتم تضمين المرضى ال 67 المتبقين في الدراسة (الجدول 1).
Protocol
كان هذا البروتوكول جزءا من دراسة أجريت وفقا للمعايير الأخلاقية المنصوص عليها في إعلان هلسنكي (إصدار 2013) ؛ تمت الموافقة عليه من قبل لجنة الأخلاقيات بكلية الطب والمستشفى الجامعي في بلسن (118/2021 ، 11 مارس 2021). يوضح الشكل 1 ملخصا للطرق المستخدمة.
1. اختيار كتل الأنسجة FFPE
- استرجع معرفات كتلة FFPE من ملفات المرضى بمساعدة الأطباء المعالجين أو أخصائيي علم الأمراض.
- اطلب كتل FFPE من أرشيف علم الأمراض المحلي.
- لكل مريض ، حدد 2-3 كتل FFPE تحتوي على أنسجة ورم قابلة للحياة ، بشكل تفضيلي مع منطقة الورم المحيطة والكبد غير الورم.
ملاحظة: ينصح بالحصول على رأي أخصائي علم الأمراض لهذا الاختيار. تم استخدام التقييم النسيجي للكبد غير الورمي ، جنبا إلى جنب مع البيانات السريرية والمخبرية لتحديد المسببات الأساسية لسرطان الكبد.
2. إزالة البارافين والإماهة من أنسجة FFPE
- قطع واحد أو اثنين من أقسام الأنسجة بسمك 4 ميكرومتر من كل من كتل الأنسجة FFPE على ميكروتوم.
ملاحظة: يمكن أن يتراوح سمك المقاطع بين 3 ميكرومتر و 5 ميكرومتر دون تأثير تلطيخ ملحوظ ؛ ومع ذلك ، فإن سمك 4 ميكرومتر هو المعيار. - ضع الأقسام في حمام مائي (42 درجة مئوية) لإزالة التجاعيد.
- قم بتركيب الشرائح عن طريق التقاطها ووضعها على شريحة مجهرية زجاجية موجبة الشحنة. ثم قم بتطبيق الشرائح للتجفيف في درجة الحرارة المحيطة (AT) لمدة 24 ساعة.
- ضع الشرائح في ترموستات (56 درجة مئوية) لمدة 1 ساعة.
- استخدم autostainer لإزالة البارافين من الأقسام في محلول إزالة الشمع -1 (30 ثانية عند 72 درجة مئوية) ، محلول إزالة الشمع -2 (10 ثوان عند 72 درجة مئوية) ، محلول إزالة الشمع -3 (10 ثوان عند AT) ، الإيثانول 96٪ -1 (10 ثوان) ، الإيثانول 96٪ -2 (10 ثوان) ، والإيثانول 96٪ -3 (10 ثوان).
- استخدم ملطخا تلقائيا لإعادة ترطيب الأقسام في محلول الغسيل -1 (10 ثوان ، AT) ، ومحلول الغسيل -2 (10 ثوان ، AT) ، ومحلول الغسيل -3 (5 دقائق ، AT).
3. أداء IHC في ملطخ مؤتمت بالكامل
ملاحظة: يتم تنفيذ IHC وفقا لبروتوكول الشركة المصنعة. الخطوات موضحة بإيجاز أدناه.
- طريقة استرجاع المستضد
- استرجع المستضد باستخدام إجراء استرجاع الحواتم المستحثة بالحرارة (ER) في محلول ER بدرجة حموضة عالية (على سبيل المثال ، Tris-EDTA): محلول ER-1 (10 ثوان ، AT) ، محلول ER -2 (10 ثوان ، AT) ، محلول ER -3 (20 دقيقة عند 100 درجة مئوية) ، محلول ER -4 (12 دقيقة ، AT).
- اشطف الشريحة في محلول غسيل لمدة 3 مرات (30 ثانية لكل منهما) و 1x (3 دقائق).
- قم بحظر البيروكسيديز الداخلي باستخدام محلول كتلة بيروكسيد لمدة 5 دقائق في AT.
- اشطفها في محلول غسيل لمدة 3 مرات (30 ثانية لكل منهما).
- منع الارتباط غير المحدد للأجسام المضادة مع كتلة البروتين ل NKp46 فقط لمدة 30 دقيقة في AT.
- الارتباط بالأجسام المضادة الأولية: احتضان الأجسام المضادة الأولية لمدة 15 دقيقة في AT، ثم اشطفها بمحلول غسيل لمدة 3 مرات (30 ثانية لكل منها).
- بالنسبة لربط الأجسام المضادة الثانوية ، اتبع الخطوات الموضحة أدناه.
- احتضان مع الأجسام المضادة الثانوية المترافقة بيروكسيديز الفجل لمدة 8 دقائق في AT.
- اشطفه بمحلول غسيل لمدة 2x (2 دقيقة لكل منهما) و 1x بالماء منزوع الأيونات.
- تصور التفاعل عن طريق شطف الشرائح بمحلول ديامينوبنزيدين (DAB) ثم احتضانها بمحلول DAB لمدة 10 دقائق في AT.
- اشطفيه لمدة 3 مرات (30 ثانية) بالماء منزوع الأيونات.
- قم بتلطيخ الأقسام باستخدام الهيماتوكسيلين من ماير.
- اشطفه بالماء منزوع الأيونات لمدة 1x (30 ثانية) ، ومحلول الغسيل لمدة 1x (30 ثانية) ، والماء منزوع الأيونات لمدة 1x (30 ثانية).
- استخدم ملطخا منزلقا مؤتمتا بالكامل لتجفيف الأقسام في الإيثانول 70٪ (2 دقيقة) ، والإيثانول 80٪ (2 دقيقة) ، والإيثانول 96٪ -1 (3 دقائق) ، والإيثانول 96٪ -2 (3 دقائق) ، والإيثانول 100٪ (3 دقائق) ، والزيلين -1 (4 دقائق) ، والزيلين -2 (4 دقائق) ، والزيلين -3 (4 دقائق).
- استخدم شبشب غطاء زجاجي مؤتمت بالكامل لتركيب الأقسام الموجودة على الشرائح في وسط تركيب.
ملاحظة: تم استخدام عينات مراقبة الأنسجة السلبية والإيجابية (اللوزتين) طوال الوقت.
4. الحصول على مسح الشرائح بالكامل
- امسح الشرائح الملطخة ضوئيا باستخدام الهدف 20x والكثافة المتوسطة العالية للتركيز على ماسح ضوئي كامل الشرائح.
5. تحليل المدينة العالمية للخدمات الإنسانية باستخدام البرنامج
- إنشاء مشروع لصور المدينة العالمية للخدمات الإنسانية في البرنامج.
- قم بتنزيل QuPath-0.4.3 (أو أعلى) وفتحه.exe
- قم بإنشاء مجلد جديد باسم مناسب.
- انقر فوق الزر "إنشاء مشروع " في الزاوية اليسرى العليا من البرنامج وحدد المجلد الذي تم إنشاؤه حديثا.
- اسحب الصور الممسوحة ضوئيا إلى نافذة البرنامج. عندما تنبثق نافذة جديدة تلقائيا ، حدد تعيين نوع الصورة > H-DAB وانقر فوق استيراد (الشكل 2).
- مراقبة قائمة الصور في النافذة اليسرى من القائمة ؛ انقر نقرا مزدوجا لفتح الصورة.
- حدد من القائمة الرئيسية في الجزء العلوي ملف لحفظ الصور كمشروع.
ملاحظة: يمكن للبرنامج التعامل مع مجموعة واسعة من تنسيقات الصور ، بما في ذلك العديد من تنسيقات الشرائح بأكملها. ومع ذلك ، يفضل تنسيق tiff لمنع فقدان البيانات الأولية والبيانات الوصفية المرتبطة بها.
- إضافة تعليقات توضيحية إلى المناطق ذات الأهمية
- حدد أداة الفرشاة أو أداة العصا من القائمة الرئيسية في الأعلى للتعليق على منطقة الورم. بالنسبة للمناطق المتقطعة من الورم ، اتبع الخطوات 5.2.1.1-5.2.1.3.
- أضف تعليقات توضيحية عليها بشكل منفصل.
- اضغط مع الاستمرار على المفتاح Ctrl أثناء تحديد جميع مناطق الورم
- انقر بزر الماوس الأيمن وحدد تحرير > متعددة دمج المحدد.
- تأكد من تحديد التعليق التوضيحي للورم (الحدود لها لون أصفر).
- انقر فوق أتمتة في القائمة الرئيسية وحدد إظهار محرر البرامج النصية.
- انسخ البرنامج النصي المتوفر في الملف التكميلي 1 أو في https://petebankhead.github.io/qupath/scripts/2018/08/08/three-regions.htmls والصقه في محرر البرامج النصية، ثم انقر فوق تشغيل. سيتم إنشاء عائد الاستثمار: مركز الورم (TC) والهامش الداخلي (IM) والهامش الخارجي (OM) ومنطقة الورم (PT) وتسميتها تلقائيا.
- للحصول على طريقة بديلة لإنشاء مناطق الاهتمام، اتبع الخطوات 5.2.5.1-5.2.5.5.
- حدد أداة Polyline من القائمة الرئيسية في الأعلى لرسم حد يفصل بين أعشاش الخلايا الخبيثة والأنسجة المجاورة غير الورمية.
- حدد الحد الناتج. حدد من القائمة الرئيسية في الجزء العلوي الكائنات > التعليقات التوضيحية > توسيع التعليقات التوضيحية > 500 ميكرومتر لنصف قطر التمدد > مسطح لغطاء الخط. قم بتنشيط إزالة الداخلية وتنشيط تقييد الوالدين.
- انقر بزر الماوس الأيمن فوق التعليق التوضيحي الناتج ، تحرير تقسيم > واحد. سيتم تمديد شروحين منفصلين تلقائيا كمناطق بعرض 500 ميكرومتر على كل جانب من الحدود.
- قم بتسمية المناطق المشروحة بشكل مناسب ل IM و OM بالنقر بزر الماوس الأيمن فوق التعليق التوضيحي في القائمة الموجودة على اليمين، وتحديد تعيين الخصائص، وإدخال الاسم.
- يمثل TC منطقة الورم المتبقية. قم بتوسيع منطقة PT بعرض 500 ميكرومتر المجاورة ل OM باستخدام نفس الإجراء.
ملاحظة: تمت مراجعة الشرائح المشروحة واكتشافات QuPath AF بواسطة أخصائي أمراض نسيجية.
- حدد أداة الفرشاة أو أداة العصا من القائمة الرئيسية في الأعلى للتعليق على منطقة الورم. بالنسبة للمناطق المتقطعة من الورم ، اتبع الخطوات 5.2.1.1-5.2.1.3.
- تحسين تصنيف البكسل
- حدد أداة المستطيل من القائمة الرئيسية. ثم قم بالتعليق على منطقة تحتوي على جميع أنواع وحدات البكسل التي يجب تمييزها (على سبيل المثال ، الهيماتوكسيلين ، DAB ، والخلفية).
- من القائمة الرئيسية، حدد تحليل > المعالجة المسبقة > تقدير متجه البقعة.
- عندما تنبثق النافذة Visual Stain Editor تلقائيا ، حدد Auto > OK ، وقم بتعيين H- DAB المقدر كاسم لمتجه البقعة.
- للحصول على طريقة بديلة ، اتبع الخطوات 5.3.4.1 إلى 5.3.4.3.
- حدد أداة المستطيل من القائمة الرئيسية وقم بالتعليق على منطقة صغيرة من نواة نموذجية ملطخة بالهيماتوكسيلين.
- حدد صورة من القائمة اليسرى وانقر نقرا مزدوجا فوق Stain 1 > Yes.
- حدد أداة المستطيل من القائمة الرئيسية وقم بتعليق منطقة صغيرة من التلطيخ الإيجابي باستخدام DAB. حدد صورة من القائمة اليسرى وانقر نقرا مزدوجا فوق Stain 2 > Yes.
- تقييم جزء مساحة الخلايا المناعية الإيجابية باستخدام خيار تصنيف البكسل .
- من القائمة الرئيسية، انقر على تصنيف > تصنيف البيكسل > إنشاء عتبة.
- حدد مرتفع للدقة > القناة: DAB > المرشح الأولي: غاوسي > سيجما: 0.5 > (الشكل 3) العتبة: (0.2-0.3) > فوق العتبة: موجبة > أقل من العتبة: سلبية.
- بالنسبة للمنطقة، حدد أي تعليق توضيحي، واكتب اسما للمصنف > حفظ > قياس > موافق. سيتم تغيير الخلايا الإيجابية DAB إلى اللون الأحمر (الشكل 4).
- انسخ النتائج من القائمة الموجودة على الجانب الأيمن إلى جدول بيانات.
- أو افتح القياس في القائمة الرئيسية العلوية، وحدد إظهار قياسات التعليقات التوضيحية > نسخ إلى الحافظة، والصق النتائج في جدول بيانات.
- لإغلاق الصورة، انقر بزر الماوس الأيمن > Multi View > Close Viewer.
ملاحظة: قبل القياس الكمي ، تم التخلص من أي قطع أثرية. تم تعديل العتبة لكل حالة مع تلطيخ إيجابي محدد ضعيف. تم التحقق أولا من صحة التعليقات التوضيحية وتصنيف البكسل ثم مراجعتها من قبل أخصائي علم الأنسجة الأقدم. تم إجراء جميع التحليلات بطريقة عمياء. يمكن العثور على مزيد من المعلومات حول تحليل IHC باستخدام البرنامج على https://forum.image.sc/tag/QP.
6. الأساليب الإحصائية وتحليل البيانات
- كانت نقاط نهاية الدراسة هي وقت التكرار (TTR) ، والبقاء على قيد الحياة بدون أمراض (DFS) ، والبقاء على قيد الحياة بشكل عام (OS). تم فرض رقابة على المرضى الذين لم ينتكسوا أو يموتون في آخر متابعة لهم.
ملاحظة: يتم التعبير عن البيانات المستمرة الموزعة بشكل غير طبيعي كوسيط (min-max). يتم التعبير عن النسب كبيانات أولية (نسب مئوية). تمت مقارنة أجزاء منطقة الخلايا المناعية في مناطق مختلفة من الاهتمام (ROIs) بواسطة فريدمان أنوفا ، تليها اختبار أزواج ويلكوكسون المطابق مع تصحيح بونفيروني. بسبب التوزيع اللامعلمي لمعظم المتغيرات ، تم استخدام ارتباط سبيرمان لتقييم الارتباطات بين أزواج المتغيرات الترتيبية أو الكمية. لتحديد القيمة النذير للمتنبئين الفرديين لنقاط النهاية ، تم إجراء متغير أحادي متبوعا بتحليل انحدار كوكس متعدد المتغيرات. تم حساب نسب الخطر (HR). كانت الموارد البشرية تظهر المخاطر النسبية للمجموعة المتوسطة العالية المجمعة مقارنة ب 1 للمجموعة المنخفضة. تم حساب جميع تقديرات البقاء على قيد الحياة بطريقة كابلان ماير ومقارنتها بين المجموعات بواسطة اختبار رتبة اللوغاريتم. تم استخدام GraphPad Prism 9.0 (GraphPad Software LLC) للتحليلات الإحصائية. تم اعتبار قيمة p من جانبين < 0.05 ذات دلالة إحصائية.
النتائج
يتم عرض التركيبة السكانية والخصائص السريرية للمرضى في الجدول 1. بلغ متوسط عمر المرضى 69 عاما، وكان معظمهم من الذكور (77.6٪). فيما يتعلق بمسببات سرطان الكبد ، كان التهاب الكبد المزمن غير الفيروسي هو أكثر الأمراض الخلفية شيوعا ، مع انتشار التهاب الكبد الدهني غير الكحولي (NASH) (23.9٪). كان 15 مريضا فقط (22.4٪) يعانون من تليف الكبد كمرض خلفي. غالبية المرضى (68.7٪) لديهم المرحلة الأولى من TNM. تم وصف نتائج سريرية ومرضية أكثر تفصيلا في عملناالمنشور سابقا 2،26.
نتائج
في المتابعة الأخيرة ، لوحظ تكرار الورم في 29 مريضا (41.8٪) ، منهم 89.7٪ لديهم تكرار موضعي وتوفي 38 (56.7٪) مريضا. في 5 سنوات بعد الجراحة ، كانت نسبة DFS 33.2 ٪ ، وكانت نسبة OS 49.4 ٪ ، وكانت نسبة خالية من التكرار (RFP) 48.7 ٪ (الجدول 2).
توزيع الخلايا المناعية في مناطق مختلفة من الاهتمام
تم العثور على بروتين CD117 في الغالب في الغشاء السيتوبلازمي للخلايا المستديرة (الشكل 5 أ). في TC و IM ، كانت موضعية في الغالب في السدى وفي الفضاء حول الأوعية. في مناطق OM و PT ، لوحظت خلايا CD117 + في كبسولة الورم وفي الفضاء حول الأوعية.
تم العثور على بروتين NKp46 في الغالب في الغشاء السيتوبلازمي للخلايا المستديرة ، والتي كانت موجودة داخل مساحات تشبه الجيوب الأنفية في TC و IM ، بالإضافة إلى ارتباطها بالسدى (الشكل 5B). في منطقة OM و PT ، لوحظت خلايا NKp46 + في كبسولات حول أعشاش الورم وفي سدى المسالك البابية.
تم العثور على بروتين CD1a في TC و IM ، ومعظمهم في الغشاء السيتوبلازمي للخلايا المستديرة (المتناثرة أو في المجاميع) في السدى ، داخل وعلى طول حدود المساحات الشبيهة بالجيوب الأنفية (الشكل 5C). في منطقة PT ، لوحظ CD1a + DC داخل وعلى طول حدود الجيوب الأنفية وداخل الظهارة الصفراوية في المسالك البابية.
كان الرجفان الأذيني للخلايا البدينة أكبر بكثير من AF لخلايا NKp46 + (p < 0.001) (الشكل 6). أظهرت CD1a + iDCs في كل عائد استثمار أدنى تركيز بؤري تلقائي مقارنة بالخلايا البدينة والخلايا القاتلة الطبيعية (p < 0.001) (الشكل 6). كان AF لخلايا CD117 + و NKp46 + في TC أو IM أصغر بكثير من تلك الموجودة في منطقة PT و OM (p < 0.001) (الشكل 6). بالنسبة لخلايا CD1a + ، لم يختلف التركيز البؤري التلقائي بشكل كبير بين المناطق.
يوضح الجدول 3 الارتباطات المهمة للخلايا المناعية الفردية بين جميع عائد الاستثمار. يوضح الشكل 7 خريطة الحرارة للارتباطات المهمة بين الخلايا المناعية المختلفة داخل المناطق المختلفة. ارتبط AF للخلايا البدينة CD117 + في TC بشكل كبير مع AF ل CD1a في TC و IM.
القيمة النذير للمتغيرات السريرية والمرضية
من بين المتغيرات السريرية والمرضية ، ارتبط العمر الأصغر فقط بزيادة خطر التكرار (HR = 0.96 ، CI: 0.93-0.99 ، p = 0.007) ، في حين لم يرتبط أي متغير ب DFS و OS (الجدول 4).
القيم النذير للخلايا المناعية المتسللة
ارتبط التركيز البؤري التلقائي المرتفع للخلايا البدينة CD117 + في IM ب DFS أطول (HR = 0.48 ، CI: 0.241 - 0.935 ، p = 0.031) ونظام التشغيل (HR = 0.34 ، CI: 0.167 - 0.703 ، p = 0.004) (الشكل 8 ، الجدول 5). بالإضافة إلى ذلك ، ارتبط AF مرتفع للخلايا البدينة CD117 + في منطقة PT ب DFS أطول (HR = 0.48 ، CI: 0.247 - 0.945 ، p = 0.034) (الشكل 8 ، الجدول 5). على النقيض من ذلك ، لم ترتبط AFs لخلايا iDC و NK بأي من النتائج. احتفظت الخلايا البدينة CD117+ في الهامش الداخلي بارتباطات كبيرة مع DFS (HR = 0.46 ، CI: 0.23-0.91 ، p = 0.027) ونظام التشغيل (HR = 0.33 ، CI: 0.16-0.68 ، p = 0.003) بعد التعديل لمرحلة TNM (الجدول 6). أما بالنسبة للخلايا البدينة في منطقة PT ، فقد ظل الارتباط مع DFS كبيرا أيضا (HR = 0.47 ، CI: 0.24-0.93 ، p = 0.029) (الجدول 6).
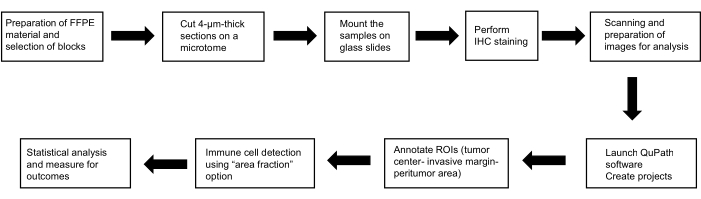
الشكل 1: تخطيطي تمثيلي للطرق. رسم تخطيطي لتدفق العمل لتحديد الدور النذير للخلايا البدينة والخلايا المتغصنة والخلايا القاتلة الطبيعية في سرطان الكبد. الاختصارات: FFPE ، البارافين الثابت الفورمالين جزءا لا يتجزأ ؛ H& E ، الهيماتوكسيلين ويوزين. عائد الاستثمار ، مناطق الاهتمام. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
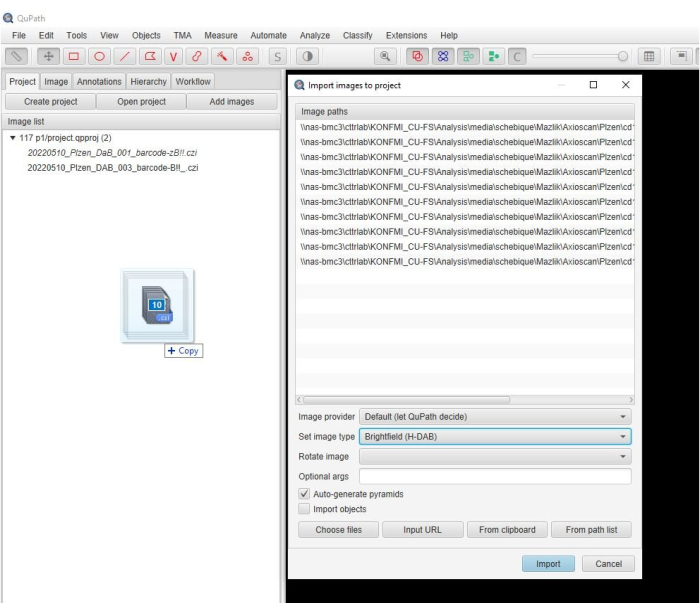
الشكل 2: لقطة شاشة لنافذة البرنامج. لقطة شاشة وصفية توضح خطوة استيراد الصور إلى مشروع في البرنامج. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
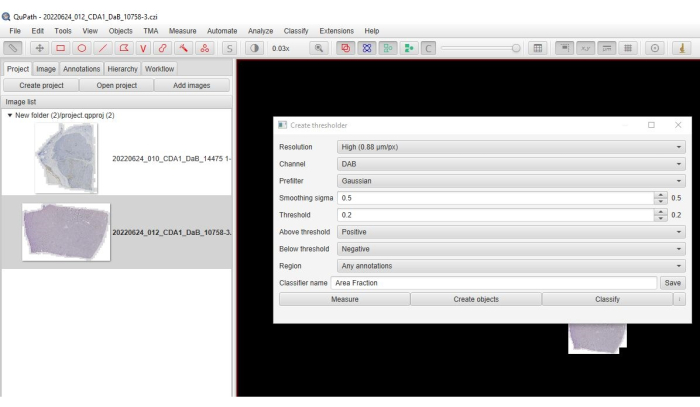
الشكل 3: لقطة شاشة لخيار كسر المساحة. لقطة شاشة من البرنامج توضح المعلمات المحددة لتحديد جزء مساحة التلوين الإيجابي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
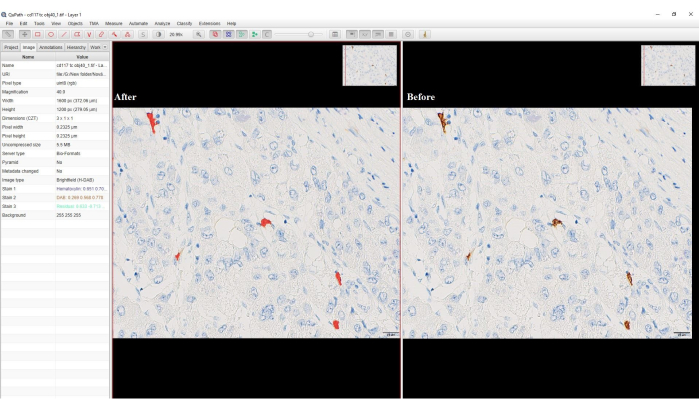
الشكل 4: لقطة شاشة لخيار تصنيف البكسل. لقطة شاشة من البرنامج تظهر خلايا DAB الموجبة قبل وبعد تصنيف البكسل. تم تحويل تلطيخ DAB البني إلى اللون الأحمر بعد تصنيف البكسل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
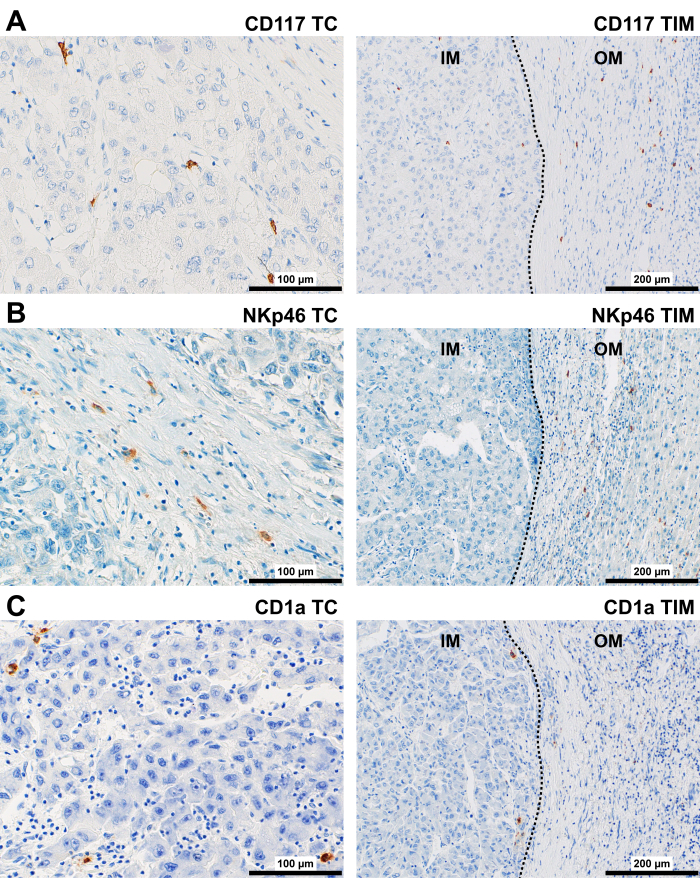
الشكل 5: تلطيخ مناعي تمثيلي للخلايا المناعية الفطرية في مرضى سرطان الكبد. تلطيخ مناعي تمثيلي لخلايا (A) CD117 + و (B) NKp46 + و (C) CD1a + في TC (400x) و TIM (200x) من سرطان الكبد. الاختصارات: سرطان الكبد ، سرطان الخلايا الكبدية. TC ، مركز الأورام. TIM ، الهامش الغازي للورم ، مع الهامش الداخلي (IM) والهامش الخارجي (OM). يمثل الخط المنقط حدا بين الورم والأنسجة غير الورمية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
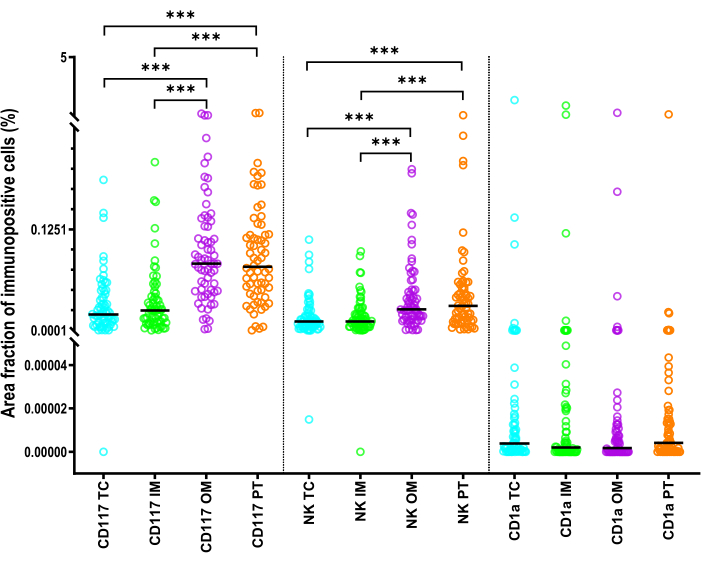
الشكل 6: إحصائيات تصف جزء مساحة الخلايا المناعية الفطرية في مرضى سرطان الكبد. إحصائيات لجزء مساحة الخلايا المتغصنة CD1a + والخلايا البدينة CD117 + وخلايا NKp46 + NK) في مناطق TC و IM و OM و PT من HCC. الخطوط السوداء هي المتوسطات. تم استخدام اختبار الأزواج المتطابقة مع Wilcoxon مع تصحيح Bonferroni للمقارنات. الاختصارات: سرطان الكبد ، سرطان الخلايا الكبدية. TC ، مركز الأورام. IM ، الهامش الداخلي ؛ OM ، الهامش الخارجي ؛ PT ، منطقة peritumor. : p <0.001 الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
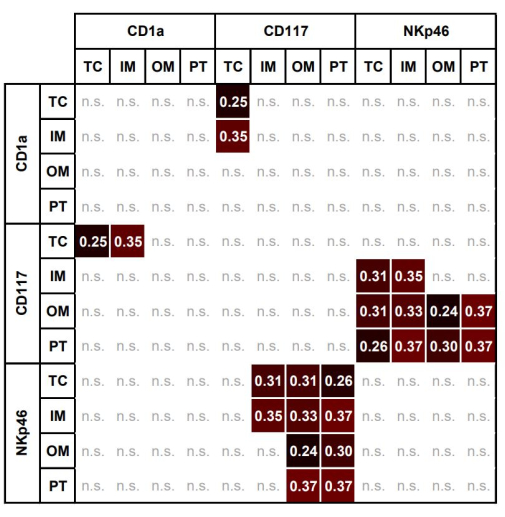
الشكل 7: خريطة حرارية للارتباطات المعنوية بين كسور مساحة الخلايا البدينة و DCs و NKs في مناطق مختلفة ذات أهمية. خريطة حرارية للارتباطات المعنوية بين كسور المنطقة للخلايا البدينة CD117 + و CD1a + DCs و NKp46 + NKs في TC و IM و OM و PT (سبيرمان ρ ، p < 0.05). الاختصارات: TC ، مركز الأورام. IM ، الهامش الداخلي ؛ OM ، الهامش الخارجي ؛ PT ، منطقة peritumor. DC ، الخلايا المتغصنة. NK ، الخلايا القاتلة الطبيعية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
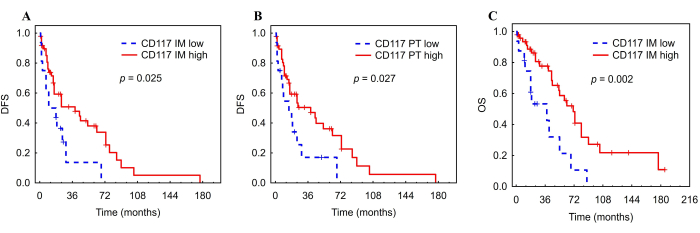
الشكل 8: منحنيات Kaplan-Meier DFS و OS للخلايا البدينة المتسللة للورم في مرضى سرطان الكبد. تحليل كابلان ماير ل DFS و OS وفقا للتركيز البؤري التلقائي المنخفض مقابل العالي للخلايا البدينة المتسللة للورم في الهامش الداخلي (A ، C) و PT (B) من سرطان الكبد. الاختصارات: سرطان الكبد ، سرطان الخلايا الكبدية. DFS ، البقاء على قيد الحياة خالية من الأمراض ؛ IM ، الغازية الداخلية ؛ PT ، منطقة peritumor. تم تكييف الرقم بإذن من Ali et al.26. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: الخلفية السريرية لمرضى سرطان الخلايا الكبدية المسجلين. الخلفية السريرية للحالات المسجلة من سرطان الخلايا الكبدية. الاختصارات: NAFLD ، مرض الكبد الدهني غير الكحولي. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: الاحتمال المقدر للنتائج في تحليل كابلان-ماير. الاحتمال المقدر ل RFP و DFS ونظام التشغيل في تحليل كابلان ماير. الاختصارات: RFP ، نسبة خالية من التكرار ؛ DFS ، البقاء على قيد الحياة خالية من الأمراض ؛ نظام التشغيل ، البقاء على قيد الحياة بشكل عام. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 3: العلاقة بين جزء المنطقة من الخلايا البدينة المتسللة إلى الورم والخلايا المتغصنة والخلايا القاتلة الطبيعية في عائد استثمار مختلف. ارتباط سبيرمان (ρ) بين جزء مساحة الخلايا البدينة المتسللة إلى الورم والخلايا المتغصنة والخلايا القاتلة الطبيعية في عائد استثمار مختلف ، p < 0.038. الاختصارات: TC ، مركز الأورام. IM ، الهامش الداخلي ؛ OM ، الهامش الخارجي ؛ PT ، منطقة peritumor. عائد الاستثمار ، مناطق الاهتمام. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 4: تحليل أحادي المتغير للمتغيرات السريرية والمرضية المرتبطة بوقت التكرار (TTR) ، والبقاء على قيد الحياة بدون أمراض (DFS) ، والبقاء على قيد الحياة بشكل عام (OS). " لا" ، جنس الإناث أو "أ" كانت الفئات المرجعية للمتغيرات ثنائية التفرع. تشير القيم الغامقة إلى دلالة إحصائية عند مستوى p < 0.05. الاختصارات: الموارد البشرية ، نسبة الخطر ؛ CI ، فاصل الثقة ؛ TTR ، وقت التكرار ؛ DFS ، البقاء على قيد الحياة خالية من الأمراض. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 5: تحليل أحادي المتغير لارتباط جزء المساحة للخلايا البدينة CD117 + وخلايا CD1a + denderitic والخلايا القاتلة الطبيعية NKp46 + مع TTR و DFS و OS لكل منطقة اهتمام فردية باستخدام انحدار كوكس (67 مريضا بسرطان الكبد). تم تحويل جزء مساحة الخلايا المناعية لكل قسم مساحة (مم 2) إلى نسب مئوية ثم تصنيفها إلى منخفضة (0-25 في المائة) مقابل عالية (25-100 في المائة). تظهر نسب الخطر المخاطر النسبية مقارنة ب 1 للتركيز البؤري التلقائي المنخفض. تشير القيم الغامقة إلى دلالة إحصائية عند مستوى p < 0.05. الاختصارات: AF ، جزء المنطقة ؛ DFS ، البقاء على قيد الحياة خالية من الأمراض ؛ نظام التشغيل ، البقاء على قيد الحياة بشكل عام ؛ الموارد البشرية ، نسبة الخطر. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 6: جزء المساحة من الخلايا البدينة CD117 + لكل عائد استثمار فردي مرتبط بالبقاء على قيد الحياة بدون مرض والبقاء على قيد الحياة بشكل عام (تحليل متعدد المتغيرات). تحليل متعدد المتغيرات لارتباط جزء المساحة للخلايا البدينة CD117 + مع DFS و OS في منطقة IM و PT باستخدام تحوف كوكس (67 مريضا بسرطان الكبد). تم تحويل جزء مساحة الخلايا المناعية لكل قسم مساحة (مم2) إلى نسب مئوية ثم تصنيفها إلى منخفضة (0-24 في المائة) مقابل عالية (25-100 في المائة). تظهر نسب الخطر المخاطر النسبية مقارنة ب 1 للتركيز البؤري التلقائي المنخفض. تشير القيم الغامقة إلى دلالة إحصائية عند مستوى p > 0.05. الاختصارات: AF ، جزء المنطقة ؛ DFS ، البقاء على قيد الحياة خالية من الأمراض ؛ نظام التشغيل ، البقاء على قيد الحياة بشكل عام ؛ الموارد البشرية ، نسبة الخطر. الرجاء الضغط هنا لتنزيل هذا الجدول.
الملف التكميلي 1: برنامج نصي لإنشاء عائد استثمار. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
من خلال مراقبة التنظيم المناعي في الموقع في TME ، يمكن لمجال علم الأورام المناعي إضافة مؤشرات حيوية تنبؤية وتنبؤية جديدة للسرطان. أظهرت ورقتنا المنشورة سابقا حول دور الخلايا المناعية التكيفية في TME لسرطان الكبد ارتباطات تنبؤية إيجابية لخلايا CD3 + و CD8 + T بالإضافة إلى خلايا CD20 + B في عائد استثمار محدد إلى وقت التكرار2. هنا ، تم استخدام برنامج تحليل الصور QuPath لتقييم وفرة CD1a + iDCs والخلايا البدينة CD117 + وخلايا NKp46 + NK في عدة مناطق متميزة من HCC وتقييم أهميتها النذيرية. بسبب الأشكال غير المنتظمة لبعض الخلايا المناعية الفطرية ، يمكن أن يكون قياسها الكمي غير دقيق. هذا هو السبب في أن تقييم جزء مساحة الخلايا الإيجابية المناعية كان الخيار الأمثل. من بين أنواع الخلايا الثلاثة ، أظهرت الخلايا البدينة CD117 + فقط تأثيرا تنبؤيا كبيرا: ارتبط AF أعلى للخلايا البدينة في IM ومنطقة PT ببقاء أطول.
كانت الخلايا البدينة هي الأكثر وفرة في جميع عائد الاستثمار ، ويعكس ارتباط الرجفان الأذيني في منطقة الورم والهامش الداخلي مع بقاء أفضل الدور المضاد للورم للخلايا البدينة. يمكن جذب الخلايا البدينة إلى TME بواسطة الجاذبات الكيميائية التي تطلقها الخلايا السرطانية ، مثل SCF أو CCL1518. يمكن أن تؤثر الخلايا البدينة على الاستجابة المضادة للورم عن طريق السمية الخلوية المباشرة للخلاياالسرطانية 27 أو عن طريق إفراز السيتوكينات المؤيدة للالتهابات التي يمكن أن تمنع نمو الورم18. كانت زيادة كثافة الخلايا البدينة وقائية ضد تكرار الإصابة بسرطان البروستاتا28 ، وسرطان المعدة27 ، وسرطان الكبد بعد زرع الكبد29. وجد تحقيق شامل يتكون من مجموعة أكبر من 245 مريضا بسرطان الكبد وجود علاقة إيجابية بين تسلل الخلايا البدينة الأكثر أهمية في عينات الورم والبقاء على قيد الحياة لفترة أطول بعد استئصالالورم 30. أبلغ Rohr-Udilova et al. عن نتائج مماثلة لزيادة كثافة الخلايا البدينة في أنسجة سرطان الكبد المحيطة. ومع ذلك ، ارتبطت كثافة الخلايا البدينة داخل الورم فقط بمعدل تكرار أقل29.
في هذه الدراسة ، مارست الخلايا البدينة تأثيرا مضادا للورم في الكبد العضلي و PT فقط. TME للأورام المختلفة غير متجانسة فيما يتعلق بالتوزيع المكاني للخلايا المناعية31. ترتبط الأهمية النذير للخلايا المناعية في TME أيضا ارتباطا وثيقا بتوزيعها المكاني32,33. تم اقتراح طرق مختلفة لشرح الهامش الغازي للورم ، بما في ذلك هامش كامل بعرض مختلف4،34،35 ، هوامش داخلية وخارجية ، مرة أخرى بعرض مختلف36,37 ، مع أو بدون PT 2,7. لقد اتبعنا المنهجية الموحدة القابلة للتكرار من مجموعة عمل المؤشرات الحيوية المناعية الدولية لتحديد الهامش الغازي على أنه منطقة 1 مم تتمركز على الحدود التي تفصل أعشاش الخلايا الخبيثة عن الأنسجة المضيفة وتمثل الورم المركزي على أنه منطقة الورم المتبقية38. منذ أن أبرزت الدراسة السابقة اختلافات كبيرة في نتائج الهامش الغازي الداخلي والخارجي2 ، تم تحليل تلك المناطق (كل 500 ميكرومتر في العرض) بشكل منفصل. التنميط المناعي المكاني لمنطقة الورم له أهميته التنبؤية المميزة39,40 ، وبالتالي ، تم تضمين منطقة PT أيضا.
تم إجراء تحليل TC وهامش الورم وكبد PT في WSIs بدلا من خيار تقييم مجالات الرؤية المختارة في المناطق المعنية. يعد تصوير الشرائح بالكامل مصدرا غنيا محتملا للبيانات41. نظرا لأننا لم نقم بأخذ عينات فرعية ، فقد تم الحصول على "القيمة المتوقعة الحقيقية" بطريقة فعالة من حيث الوقت10. بالإضافة إلى ذلك ، كان هذا النظام معقولا لأنه تم تحليل 1 أو 2 شريحة فقط لكل كتلة ، مما مكننا من تجنب تحيز اختيار التصحيح42. تحدانا سير العمل البطيء في الدراسة السابقة عندما تم تطبيق علم التعقيم لتحديد كمية الخلايا المناعية2.
يسمح IHC بالتوطين المباشر لتعبير الخلايا البدينة CD1a + iDCs و NKp46 + NK و CD117 + في أنسجة الكبد ، وتحديد توزيعاتها ، وبالتالي التصنيف الفرعي للمجموعة. يعطي تحليل IHC هذه الدراسة مزايا مهمة على المقايسات الكيميائية الحيوية في الأنسجة الذائبة ، والتي قد تؤدي إلى نتائج سلبية خاطئة عند وجود عدد قليل فقط من الخلايا الإيجابية للعلامات الحيوية43 ولا تعكس رد الفعل الإقليمي للخلايا المناعية على السمات النسيجيةالمرضية 44. يفضل أيضا استخدام IHC على التحليل في الأقسام الملطخة ب H&E. أظهرت الدراسات التي أجريت على سرطان القولون والمستقيم وسرطان الرئة ذو الخلايا الصغيرة أن تقييم الأقسام الملطخة ب H&E يمكن أن يوفر مؤشرات حيوية قوية وكمية للورمالمناعي 45،46،47 ؛ ومع ذلك ، لا تزال القيود التي تعكس الوجود الفعلي لأنواع فرعية محددة موجودة.
تعد الجودة العالية لأقسام الأنسجة وتلطيخ IHC شرطا أساسيا لإجراء تقييم دقيق. الخلفية العالية ، والتحف الحافة ، والتلوين المحدد ولكن غير المرغوب فيه (على سبيل المثال ، تلطيخ الخلايا البطانية للمساحات الجيبية للكبد بأجسام مضادة ل CD4) قد تفسد جميع النتائج. كان الجسم المضاد CD56 هو الخيار الأول في الدراسة الحالية للكشف عن الخلايا القاتلة الطبيعية ولكن تم استبداله بالجسم المضاد NKp46 بسبب التعبير عن CD56 في القنوات الصفراوية غير الناضجة. يمثل اختيار العلامة الأنسب من حيث الخصوصية ونمط التلوين القوي والاستقرار في كتل FFPE مشكلة أخرى يجب مراعاتها. على سبيل المثال ، تم اختيار CD117 بدلا من التريبتاز لأن تعبير التريبتاز قد يكون أقل تنظيما بشدة ، إلى جانب ذلك ، الخلايا التي لا تعبر عن CD117 ليست خلايا بدينة48.
يوفر QuPath خيار تنعيم حدود عائد الاستثمار من الخارج وإزالة أي قطع أثرية وأوعية كبيرة وأنسجة نخرية وتلطيخ غير محدد وخلفية وتجميع كريات الدم الحمراء التي لا ينبغي أن تكون جزءا من عائد الاستثمار. يحتاج المشغل إلى تحديد عائد الاستثمار والضغط على مفتاح "Alt" أثناء التعليق على تلك القطع الأثرية. تم التخلص من التلوين غير المحدد في هذه الدراسة كقطع أثرية قبل القياس الكمي بحيث لا يؤثر على النتائج. في حالة التلوين النوعي المنخفض بشكل منهجي أو الخلفية العالية ، يجب مراجعة البروتوكول لتجنب التحيز المحتمل. تم تعديل العتبة لكل حالة مع تلطيخ إيجابي محدد ضعيف. قبل أي استخدام روتيني ، يجب تحسين البروتوكول. يجب إجراء جميع التحليلات بطريقة عمياء ، ومن الناحية المثالية ، تستحق دقة العتبة التحقق منها.
QuPath هو حل سهل الاستخدام وبديهي وقابل للتوسيع ومفتوح المصدر لعلم الأمراض الرقمي وتحليل صورة الشريحةالكاملة 9 ، تم اختباره مسبقا لتحليل الصور في HCC49 وأنواع مختلفة من السرطان50,51. ومن المزايا الرئيسية التشغيل السهل للبرنامج الخاص بمؤشرات القمة العالمية للتنبؤ وخيارات التعليق التوضيحي للمناطق ذات الأهمية (مثل المناطق الورمية أو المحيطة بالورم).
قد يؤدي تطبيق البرامج النصية الموجودة أو المعدلة أو التي تم إنشاؤها من جديد إلى تسريع التحليل بشكل كبير. تم تطبيق البرنامج النصي لإنشاء تعليقات توضيحية لعائد الاستثمار ، مما مكن من التقسيم الإقليمي السريع والدقيق بدلا من التحديد اليدوي. البرنامج النصي غير ثابت ، ويمكن تخصيصه بسهولة إلى هوامش أقل من 500 ميكرومتر للمناطق ذات حدود الأنسجة غير الكافية. يمكن تخصيص عرض منطقة المراسلة الفورية أو OM أو PT عبر محرر البرامج النصية Automate > Show > تكييف الخط 30 ميكرون هامش التوسيع المزدوج = 500 ميكرومتر إلى العرض المتاح > Run. يمكن أيضا إضافة عائد الاستثمار أو إزالته. بشكل عام ، لا يتم إصلاح سير العمل في البرنامج ، والمشغل حر في تطويرها وتعديلها.
يتوفر الآن عدد كبير من أدوات البرامج المتاحة لتحليل الصور المرضية ، بما في ذلك CellProfiler و ImageJ و Fiji و Microscopy Image Browser وغيرها. ومع ذلك ، يميز QuPath نفسه من خلال مجموعة من المزايا مثل البنية مفتوحة المصدر ، والواجهة سهلة الاستخدام ، وقدرات تخصيص الخوارزمية ، وتكامل أدوات التعلم الآلي المتقدمة. تضع هذه الميزات مجتمعة برنامج تحليل الصور هذا كخيار قوي للتحليل الدقيق للأنسجة السرطانية في عالم علم الأمراض الرقمي.
أظهر QuPath أقل تباين مقارنة بالبرامج التجارية HALO (IndicaLab) و QuantCenter (3DHistech) للكشف عن تعبير Ki67 في سرطان الثدي52. يمتلك البرنامج أيضا القدرة على الحصول على تعليمات لتشغيل برنامج نصي لجميع صور المشروع بطريقة معالجة دفعية قابلة للتكرار.
مكننا QuPath من إنشاء بيانات كمية مستمرة بدلا من البيانات الترتيبية (شبه الكمية). البيانات الترتيبية التي يتم الحصول عليها عن طريق التسجيل البصري محفوفة بالمشاكل بسبب الذاتية في التفسير ، والتباين بين المراقبين ، وضعف التكاثر53. تم تحسين سرعة التحليل الحالي من خلال حقيقة أن الأفراد الذين ليس لديهم خلفية واسعة في علم الأنسجة المرضي وخبرة في البرمجة يمكنهم إجراء تحليل تلقائي ، بشرط أن يتم فحص دقة التعليقات التوضيحية من قبل أخصائي علم الأمراض. أظهرت دراسة أجريت على أورام الرأس والرقبة مدى ملاءمة QuPath للتقييم السريع والقابل للتكرار للقيمة النذير للخلايا الليمفاوية المتسللة إلى الورمCD57 + 50. أظهرت الدراسة أيضا توافقا كبيرا بين المراقبين البشريين و QuPath. كما تم تقديم توافق عالي بين الملاحظة اليدوية والتقييم باستخدام QuPath في سرطان الفم54 وسرطان الثدي55. قارنت الورقة المذكورة أعلاه القياس الكمي ل IHC ل 5 مؤشرات حيوية سريرية لسرطان الثدي باستخدام QuPath و 2 من منتجات البرامج التجارية (Definiens Tissue Studio و inForm) مع تسجيل يدوي من قبل أخصائي علم الأمراض. خلال هذه الدراسة ، أظهر QuPath باستمرار أفضل أداء بالإضافة إلى أقل وقت للإعداد والتطبيق ، مما يدل على أنه بديل مستقبلي ممتاز للمراقبة المرئية والبرامج التجارية. حتى بالمقارنة مع ImageJ ، أشهر برنامج مفتوح المصدر لتحليل الصور الطبية الحيوية ، يتفوق QuPath في التعامل مع WSIs56 كبيرة الحجم.
هناك منتدى مفتوح عبر الإنترنت ل QuPath حيث ينشر المستخدمون أسئلتهم حول طرق علم الأمراض الرقمي ويقدمون مجتمعا نشطا ومشاركا لدعم تطوير أدوات تحليل الصور (https://forum.image.sc/tag/qupath).
كانت المجموعة المستخدمة في هذه الدراسة فريدة من نوعها ولا تمثل عامة السكان المصابين بسرطان الكبد لأنها شملت فقط المرضى المؤهلين لاستئصال الكبد. بشكل عام ، أقلية من المرضى الذين يعانون من سرطان الكبد (20٪ -30٪) مؤهلون لاستئصال الكبد57. قد يكون هذا أيضا سببا في تأكيد عدد أقل من المرضى تليف الكبد لأن المرضى الذين يعانون من مسببات سرطان الكبد هذه ربما كان لديهم درجات أعلى من Child-Pugh ولم يتم اعتبارهم قابلين للاستئصال. كانت المجموعة أيضا صغيرة إلى حد ما ، وكان لدى معظم المرضى مراحل مبكرة من TNM من المرض. لذلك ، ينبغي استقراء النتائج على مجموعات سكانية أخرى بحذر.
في الدراسة الحالية ، تم تقدير وفرة الخلايا المناعية الفطرية في البيئة المكروية لسرطان الكبد من خلال تقييم AF الخاص بها ، حيث يمكن أن يكون العد الدقيق للخلايا المناعية غير المنتظمة الشكل مثل الخلايا المتغصنة أمرا صعبا. من ناحية أخرى ، عادة ما يرتبط جزء مساحة الخلايا المناعية ارتباطا وثيقا بكثافتها58. يوفر وضع العلامات المناعية بيروكسيديز بيانات لتوطين المستضد أو جزء المنطقة أو كثافة الخلايا التي تعبر عنه ، لكن شدة التلوين لا ترتبط خطيا بكمية المستضد. لذلك ، لا ينبغي استخدام IHC لتقييم مستوى التعبير عن بروتين معين كميا. تعتمد دقة الطريقة أيضا على توحيد سمك القسم وجودة الصورة والدقة المحددة لتصنيف البكسل. يجب التحقق من صحة أي نتائج لتحليل الصور والتعامل معها بحذر. نظرا لأن علامة واحدة لا يمكنها التقاط تعقيد الخلايا المناعية بشكل كامل ، فهناك حاجة إلى المزيد من علامات IHC وتلطيخ متعدد الإرسال للحصول على صورة موثوقة ل TME المناعي لسرطان الكبد. يمثل استخدام علامة IHC واحدة فقط للتنميط الظاهري للخلايا المناعية تقديرا تقريبيا ، ويجب تفسير النتائج بحذر.
مكننا استخدام برنامج تحليل الصور QuPath لتقييم الشرائح الملطخة ب IHC من تقييم التوزيع وجزء المساحة من iDCs المحلية والخلايا البدينة و NKs في الورم والورم المحيط لمرضى سرطان الكبد ثم تحليل علاقاتهم مع التشخيص. ترتبط وفرة الخلايا البدينة في الهامش الداخلي والكبد حول الورم في سرطان الكبد ب DFS و OS أطول ، مما يسلط الضوء على التأثيرات المضادة للورم لتلك الخلايا المناعية الفطرية. سير العمل التحليلي في QuPath سهل الاستخدام وسريع وسهل الاستخدام ، مع إعدادات افتراضية مفيدة وتصدير سهل للبيانات. تم اعتماد هذا البرنامج كمنصة واعدة لتحليل الصور الرقمية ، والتي يمكن أن تلبي الحاجة إلى التكرار والاتساق والدقة في علم الأمراض الرقمي.
Disclosures
لا يوجد تضارب في المصالح المالية للإفصاح عنه.
Acknowledgements
نحن نعترف بمساهمات المونسنيور Ondřej Šebesta (مرفق Vinicna Microscopy Core ، كلية العلوم ، جامعة تشارلز) لمسح الشرائح بالكامل ومشروع "e-Infrastruktura CZ" (e-INFRA LM2018140) ، الذي زودنا بالموارد الحسابية لهذه الدراسة. تم الاعتراف بالفنيين يانا دوسوديلوفا وجان جافوريك لمساعدتهم الفنية الممتازة. تم تمويل هذا البحث من قبل برنامج البحث والابتكار Horizon 2020 التابع للاتحاد الأوروبي ، المنحة رقم 856620 ، ووزارة الصحة في جمهورية التشيك ، منحة AZV NU21-03-00506 ، وبرنامج Cooperatio (التخصصات الجراحية). ويشترك في تمويل مرفق فينيكنا المجهري الأساسي مشروع الاستشعار المجهري الكبير LM2023050 التابع لشركة Czech-BioAging.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-CD1a | Leica Biosystems | PA0235 | Identifier- immature dendritic cells; RTU, Protocol F, ER2/20 min |
| Anti-CD117 | Leica Biosystems | PA0007 | Identifier- mast cells; RTU, Protocol F, ER2/20 min |
| BOND Plus Microscope Slides | Leica Biosystems, Germany | S21.2113.A | |
| BOND RXm | Leica Biosystems | 49.1501 | Fully Automated IHC Stainer |
| Bond Aspirating Probe Cleaning Kit | Leica Biosystems | CS9100 | |
| Bond Dewax Solution | Leica Biosystems | AR9222 | |
| Bond Polymer Refine Detection Kit | Leica Biosystems | DS9800 | |
| BondTM Epitope Retrieval 2 | Leica Biosystems | AR9640 | |
| BondTM Primary Antibody Diluent | Leica Biosystems | AR9352 | |
| BondTM Wash Solution 10X Concentrate | Leica Biosystems | AR9590 | |
| Computer Specifications: Intel(R) Core(TM) i5-10500 CPU @ 3.10GHz 3.10 GHz Installed RAM: 128 G | Intel | A 64-bit operating system that has Windows 7. Any computer with Java-based operating system and Excel available | |
| Coverslips | Leica Biosystems, Germany | 14071135636 | |
| CV Mount | Leica Biosystems, Germany | 14046430011 | |
| CV5030 Fully Automated Glass Coverslipper | Leica Biosystems | 149CVTS5025 | |
| Drying Oven UN30 | Memmert GmbH | UN30 | |
| GraphPad Prism 9.0 | GraphPad Software LLC | Version 12 | |
| Human NKp46/NCR1 Antibody, Monoclonal Mouse IgG2B Clone # 195314 | R&D Systems, Inc., United States | MAB1850 | Identifier- natural killer cells; Dilution 1:150, Protocol F + BLOK, ER2/20 min |
| Leica HI1210 - Water Bath | Leica Biosystems | 14041521466 | |
| Protein Block | Agilent Dako, United States | X0909 | |
| QuPath 0.3.2 or higher versions | version (QuPath v.0.3.2) | ||
| RM2235 Rotary Microtome | Leica Biosystems | 149AUTO00C1 | |
| ST5020 Multistainer Slide Stainer | Leica Biosystems | DEV-ST5010-CV5030 | |
| Statistica | StatSoft Inc. | version 7 | |
| Zeiss Axio Scan.Z1 | ScienceServices GmbH, Germany | 430038-9000-000 | Slide scanner |
References
- Du, M., Yin, Y. L., Xiao, L., Cai, Y. M., Ji, Y. Evaluating tumor-infiltrating lymphocytes in hepatocellular carcinoma using hematoxylin and eosin-stained tumor sections. World J Clin Cases. 10 (3), 856-869 (2022).
- Trailin, A., et al. T-and B-cells in the inner invasive margin of hepatocellular carcinoma after resection associate with favorable prognosis. Cancers (Basel). 14 (3), 604(2022).
- Xiao, N., et al. CD74+ macrophages are associated with favorable prognosis and immune contexture in hepatocellular carcinoma. Cancer Immunol Immunother. 71 (1), 57-69 (2022).
- Galon, J., et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science. 313 (5795), 1960-1964 (2006).
- Roxburgh, C. S. D., Salmond, J. M., Horgan, P. G., Oien, K. A., McMillan, D. C. Tumour inflammatory infiltrate predicts survival following curative resection for node-negative colorectal cancer. Eur J Cancer. 45 (12), 2138-2145 (2009).
- Klintrup, K., et al. Inflammation and prognosis in colorectal cancer. Eur J Cancer. 41 (17), 2645-2654 (2005).
- Kather, J. N., et al. Topography of cancer-associated immune cells in human solid tumors. Elife. 7, e36967(2018).
- Cho, J. Basic immunohistochemistry for lymphoma diagnosis. Blood Res. 57 (S1), 55-61 (2022).
- Bankhead, P., et al. QuPath: Open source software for digital pathology image analysis. Sci Rep. 7 (1), 16878(2017).
- Kolinko, Y., et al. Using virtual microscopy for the development of sampling strategies in quantitative histology and design-based stereology. Anat Histol Embryol. 51 (1), 3-22 (2022).
- Rodrigues, A., et al. Computer-assisted tumor grading, validation of PD-L1 scoring, and quantification of CD8-positive immune cell density in urothelial carcinoma, a visual guide for pathologists using QuPath. Surg Exp Pathol. 5, 12(2022).
- Hein, A. L., et al. QuPath digital immunohistochemical analysis of placental tissue. J Pathol Inform. 12, 40(2021).
- Lichterman, J. N., Reddy, S. M. Mast cells: A new frontier for cancer immunotherapy. Cells. 10 (6), 1270(2021).
- Veglia, F., Gabrilovich, D. I. Dendritic cells in cancer: the role revisited. Curr Opin Immunol. 45, 43-51 (2017).
- Wu, S. -Y., Fu, T., Jiang, Y. -Z., Shao, Z. -M. Natural killer cells in cancer biology and therapy. Mol Cancer. 19 (1), 120(2020).
- Kai, K., et al. Immunohistochemical analysis of the aggregation of CD1a-positive dendritic cells in resected specimens and its association with surgical outcomes for patients with gallbladder cancer. Transl Oncol. 14 (1), 100923(2021).
- Minesaki, A., Kai, K., Kuratomi, Y., Aishima, S. Infiltration of CD1a-positive dendritic cells in advanced laryngeal cancer correlates with unfavorable outcomes post-laryngectomy. BMC Cancer. 21 (1), 973(2021).
- Komi, D. E. A., Redegeld, F. A. Role of mast cells in shaping the tumor microenvironment. Clin Rev Allergy Immunol. 58 (3), 313-325 (2020).
- Maltby, S., Khazaie, K., McNagny, K. M. Mast cells in tumor growth: Angiogenesis, tissue remodelling and immune-modulation. Biochim Biophys Acta. 1796 (1), 19-26 (2009).
- Gooch, J. L., Lee, A. V., Yee, D. Interleukin 4 inhibits growth and induces apoptosis in human breast cancer cells. Cancer Res. 58 (18), 4199-4205 (1998).
- Brockmeyer, P., et al. High mast cell density indicates a longer overall survival in oral squamous cell carcinoma. Sci Rep. 7 (1), 14677(2017).
- Lee, H. A., et al. Natural killer cell activity is a risk factor for the recurrence risk after curative treatment of hepatocellular carcinoma. BMC Gastroenterol. 21 (1), 258(2021).
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 19 (3), 200-218 (2020).
- Barrow, A. D., Martin, C. J., Colonna, M. The natural cytotoxicity receptors in health and disease. Front Immunol. 10, 909(2019).
- Guan, X., et al. Tumor-associated NK cells facilitate tumor growth via NKp46 in immunocompetent murine hepatocellular carcinoma. Immunol Lett. 258, 8-19 (2023).
- Ali, E., et al. Prognostic role of macrophages and mast cells in the microenvironment of hepatocellular carcinoma after resection. BMC Cancer. 24 (1), 142(2024).
- Lin, C., et al. Tryptase expression as a prognostic marker in patients with resected gastric cancer. Br J Surg. 104 (8), 1037-1044 (2017).
- Hempel, H. A., et al. Low intratumoral mast cells are associated with a higher risk of prostate cancer recurrence. Prostate. 77 (4), 412-424 (2017).
- Rohr-Udilova, N., et al. Morphometric analysis of mast cells in tumor predicts recurrence of hepatocellular carcinoma after liver transplantation. Hepatol Commun. 5 (11), 1939-1952 (2021).
- Lin, S. Z., et al. Prediction of recurrence and survival in hepatocellular carcinoma based on two cox models mainly determined by FoxP3+ regulatory T cells. Cancer Prev Res. 6 (6), 594-602 (2013).
- Jia, Q., Wang, A., Yuan, Y., Zhu, B., Long, H. Heterogeneity of the tumor immune microenvironment and its clinical relevance. Exp Hematol Oncol. 11 (1), 24(2022).
- Pyo, J. -S., Son, B. K., Lee, H. Y., Oh, I. H., Chung, K. H. Prognostic implications of intratumoral and peritumoral infiltrating lymphocytes in pancreatic ductal adenocarcinoma. Curr Oncol. 28 (6), 4367-4376 (2021).
- Yusa, T., et al. Survival impact of immune cells infiltrating peritumoral area of hepatocellular carcinoma. Cancer Sci. 113 (12), 4048-4058 (2022).
- Halama, N., et al. Localization and density of immune cells in the invasive margin of human colorectal cancer liver metastases are prognostic for response to chemotherapy. Cancer Res. 71 (17), 5670-5677 (2011).
- Zwing, N., et al. Analysis of spatial organization of suppressive myeloid cells and effector T cells in colorectal cancer-A potential tool for discovering prognostic biomarkers in clinical research. Front Immunol. 11, 550250(2020).
- Soeratram, T. T. D., et al. Prognostic value of T-cell density in the tumor center and outer margins in gastric cancer. Mod Pathol. 36 (9), 100218(2023).
- Gonzàlez-Farré, M., et al. Characterization and spatial distribution of the immune cell infiltrate in triple-negative breast cancer: a novel classification based on plasma cells and CD8+ T cells. Hum Pathol. 139, 91-105 (2023).
- Hendry, S., et al. Assessing tumor-infiltrating lymphocytes in solid tumors: A practical review for pathologists and proposal for a standardized method from the International Immunooncology Biomarkers Working Group: Part 1: Assessing the host immune response, TILs in invasive breast carcinoma and ductal carcinoma in situ, metastatic tumor deposits and areas for further research. Adv Anat Pathol. 24 (5), 235-251 (2017).
- Brück, O., et al. Spatial immunoprofiling of the intratumoral and peritumoral tissue of renal cell carcinoma patients. Mod Pathol. 34 (12), 2229-2241 (2021).
- Knebel, M., et al. Prognostic impact of intra- and peritumoral immune cell subpopulations in head and neck squamous cell carcinomas - comprehensive analysis of the TCGA-HNSC cohort and immunohistochemical validation on 101 patients. Front Immunol. 14, 1172768(2023).
- Lee, S., et al. Interactive classification of whole-slide imaging data for cancer researchers. Cancer Res. 81 (4), 1171-1177 (2021).
- Ciga, O., et al. Overcoming the limitations of patch-based learning to detect cancer in whole slide images. Sci Rep. 11 (1), 8894(2021).
- Rizzardi, A. E., et al. Quantitative comparison of immunohistochemical staining measured by digital image analysis versus pathologist visual scoring. Diagn Pathol. 7, 42(2012).
- Masuda, S., Nakanishi, Y. Application of immunohistochemistry in clinical practices as a standardized assay for breast cancer. Acta Histochem Cytochem. 56 (1), 1-8 (2023).
- Matsutani, S., et al. Tumor-infiltrating immune cells in H&E-stained sections of colorectal cancer tissue as a reasonable immunological biomarker. Anticancer Res. 38 (12), 6721-6727 (2018).
- Väyrynen, J. P., et al. Prognostic significance of immune cell populations identified by machine learning in colorectal cancer using routine hematoxylin and eosin-stained sections. Clin Cancer Res. 26 (16), 4326-4338 (2020).
- Zhou, G., et al. Clinical significance of tumor-infiltrating lymphocytes investigated using routine H&E slides in small cell lung cancer. Radiat Oncol. 17 (1), 127(2022).
- Horny, H. -P., Sotlar, K., Valent, P. Mastocytosis. Immunol Allergy Clin North Am. 34 (2), 315-321 (2014).
- Mi, H., Ho, W. J., Yarchoan, M., Popel, A. S. Multi-scale spatial analysis of the tumor microenvironment reveals features of cabozantinib and nivolumab efficacy in hepatocellular carcinoma. Front Immunol. 13, 892250(2022).
- de Ruiter, E. J., et al. Assessing the prognostic value of tumor-infiltrating CD57+ cells in advanced stage head and neck cancer using QuPath digital image analysis. Virchows Archiv. 481 (2), 223-231 (2022).
- Fanucci, K. A., et al. Image analysis-based tumor infiltrating lymphocytes measurement predicts breast cancer pathologic complete response in SWOG S0800 neoadjuvant chemotherapy trial. NPJ Breast Cancer. 9 (1), 38(2023).
- Acs, B., et al. Ki67 reproducibility using digital image analysis: an inter-platform and inter-operator study. Lab Invest. 99 (1), 107-117 (2019).
- Sobottka, B., et al. Establishing standardized immune phenotyping of metastatic melanoma by digital pathology. Lab Invest. 101 (12), 1561-1570 (2021).
- Moratin, J., et al. Digital pathology scoring of immunohistochemical staining reliably identifies prognostic markers and anatomical associations in a large cohort of oral cancers. Front Oncol. 11, 712944(2021).
- Bankhead, P., et al. Integrated tumor identification and automated scoring minimizes pathologist involvement and provides new insights to key biomarkers in breast cancer. Lab Invest. 98 (1), 15-26 (2018).
- Humphries, M. P., Maxwell, P., Salto-Tellez, M. QuPath: The global impact of an open source digital pathology system. Comput Struct Biotechnol J. 19, 852-859 (2021).
- Koh, J. H., et al. Liver resection versus liver transplantation for hepatocellular carcinoma within Milan criteria: a meta-analysis of 18,421 patients. Hepatobiliary Surg Nutr. 11 (1), 78-93 (2022).
- Eriksen, A. C., et al. Computer-assisted stereology and automated image analysis for quantification of tumor infiltrating lymphocytes in colon cancer. Diagn Pathol. 12 (1), 65(2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved