Method Article
肝细胞癌微环境中的肥大细胞赋予良好的预后:使用 QuPath 图像分析软件的回顾性研究
摘要
肝细胞癌切除术后内缘和瘤周区域存在肥大细胞,预后良好。本研究认可 QuPath 图像分析软件是一个很有前途的平台,可以满足数字病理学对可重复性、一致性和准确性的需求。
摘要
肝细胞癌 (HCC) 内免疫细胞的 原位 检测提供的见解可能提供有关患者预后的信息。调查肿瘤组织内免疫细胞表达和定位的研究面临多项挑战,包括缺乏对肿瘤区域的精确注释和微观视野的随机选择。QuPath 是一款开源、用户友好的软件,可以满足全玻片图像 (WSI) 分析中对数字病理学日益增长的需求。
在 67 例接受根治性切除术的 HCC 患者的代表性标本中,对 CD1a+ 未成熟树突状细胞 (iDC) 、CD117+ 肥大细胞和 NKp46+ 自然杀伤细胞 (NKs) 细胞对 HCC 和癌旁组织的浸润进行了免疫组织化学评估。使用 QuPath 在 WSI 中自动评估肿瘤中心 (TC) 、内缘 (IM)、外缘 (OM) 和瘤周 (PT) 区域的阳性染色细胞的面积分数 (AF)。评估免疫细胞的预后意义包括复发时间 (TTR) 、无病生存期 (DFS) 和总生存期 (OS)。
肥大细胞的 AF 显著大于 NKs 的 AF,并且 iDCs 的 AF 在每个感兴趣区域的 AF 均显著低于 NKs。IM 和 PT 区肥大细胞的高 AF 与较长的 DFS 相关。此外,IM 中肥大细胞的高 AF 与较长的 OS 相关。
使用该软件进行计算机辅助分析是获取切除后 HCC 不同区域肿瘤浸润免疫细胞 (iDC、肥大细胞和 NKs) 预后信息的合适工具。肥大细胞在所有感兴趣区域 (ROI) 中显示出最大的 AF。瘤周区域的肥大细胞和 IM 显示出积极的预后意义。
引言
肿瘤浸润免疫细胞的空间组织和丰度已被证明会影响不同癌症的生存率,包括肝细胞癌 (HCC) 1,2,3,4。癌症中肿瘤浸润淋巴细胞的预后意义首先显示在苏木精和伊红 (H&E) 染色切片上 5,6。然后,Galon 等人使用免疫组织化学 (IHC) 进行的一项开创性研究证明了结肠癌组织中 CD3+ 和 CD8+ T 细胞密度与预后相关的关联4。
IHC 是可视化、量化和绘制肿瘤组织内免疫细胞以进一步与临床结果关联的金标准7。IHC 具有多种优势,例如成本低、可用性广泛以及与福尔马林固定石蜡包埋 (FFPE) 组织的兼容性8。然而,准确评估 IHC 染色的免疫细胞是一项巨大的挑战。在选定的微观视野中进行传统评分非常耗时,并且已不足以确保对候选生物标志物选择和可靠的临床相关性至关重要的高质量、可重复、客观的分析9。全玻片扫描可以作为整个图像或在子采样10 之后进行评估。
对组织样本中免疫细胞丰度进行计算机化定量评估可以确保数据实用、准确、可靠和临床相关11。QuPath 是一款免费的开源软件,可对 IHC 染色玻片进行数字图像分析,并最大限度地提高单个样品的信息量12。
由于未成熟的树突状细胞 (iDC)、自然杀伤 (NK) 细胞和肥大细胞参与抗肿瘤免疫反应,并被证明与患者的预后相关 13,14,15,我们在这里提出了一个分步方案,用于评估它们在 FFPE HCC 组织中的空间分布并探索它们的预后影响。CD1a 主要在未成熟树突状细胞的膜上表达,其密度与多种人类肿瘤的临床结果有关16,17。肥大细胞可以在肿瘤微环境 (TME) 中发挥促肿瘤或抗肿瘤作用18。它们可以支持血管生成并促进转移19。相反,据报道,肥大细胞可以通过产生 IL-420 介导肿瘤细胞凋亡。抗 CD117 染色通常用于可视化和定量肿瘤组织内的肥大细胞21。NK 细胞被认为通过杀死癌细胞来帮助监测和控制 HCC22 23。NK 表达 NKp46 是其抗肿瘤活性的关键参数24。然而,NKp46 + NK 细胞与 HCC 患者的肿瘤直径呈正相关25。尽管如此,人们对它们与患者生存率的相关性知之甚少。
我们旨在定量评估 HCC 不同区域 CD1a+ iDCs 、 CD117+ 肥大细胞和 NKp46+ NK 细胞的丰度,并强调它们的预后意义。共有 70 例连续经病理证实的 I-IV 期 HCC 患者,根据 BCLC 指南符合切除条件,并于 1997 年至 2019 年期间在皮尔森大学医院接受了根治性肝切除术,被纳入本回顾性研究。回顾患者的病理报告。本研究纳入的患者均无远处转移,术前未接受过化疗或放疗等新辅助治疗。共排除了 3 例组织学标本质量差的患者,其余 67 例患者被纳入研究 (表1)。
研究方案
该协议是根据《赫尔辛基宣言》(2013 年版)中规定的道德标准进行的研究的一部分;它得到了医学院和比尔森大学医院伦理委员会的批准(118/2021,2021 年 3 月 11 日)。 图 1 显示了所采用方法的摘要。
1. FFPE 组织块的选择
- 在治疗医师或病理学家的帮助下,从患者档案中检索 FFPE 块标识符。
- 从本地病理档案中请求 FFPE 块。
- 对于每个患者,选择 2-3 个含有活肿瘤组织的 FFPE 块,优先与周围的肿瘤周围区域和非肿瘤肝脏。
注意:建议获得病理学专家对此选择的意见。非肿瘤肝脏的组织学评估以及记忆学、临床和实验室数据用于确定 HCC 的潜在病因。
2. FFPE 组织的脱蜡和再水化
- 在切片机上从每个 FFPE 组织块上切下一或两个 4 μm 厚的组织切片。
注:切片的厚度可在 3 μm 至 5 μm 之间,不会产生明显的染色影响;但是,4 μm 的厚度是标准。 - 将切片放入水浴 (42°C) 中去除皱纹。
- 通过拾取载玻片并将其放在带正电的玻璃显微镜载玻片上来安装载玻片。然后,将载玻片贴在环境温度 (AT) 下干燥 24 小时。
- 将载玻片置于恒温器 (56 °C) 中 1 小时。
- 使用自动染色机在脱蜡溶液-1(72°C下30秒)、脱蜡溶液-2(72°C下10秒)、脱蜡溶液-3(AT下10秒)、乙醇96%-1(10秒)、乙醇96%-2(10秒)和乙醇96%-3(10秒)中对切片进行脱蜡。
- 使用自动染色机在洗涤液-1(10 秒,AT)、洗涤液-2(10 秒,AT)和洗涤液-3(5 分钟,AT)中对切片再水化。
3. 在全自动染色机中进行 IHC
注意:IHC 根据制造商的方案进行。下面简要说明这些步骤。
- 抗原修复法
- 在具有高 pH 值的 ER 溶液(例如,Tris-EDTA)中使用热诱导表位修复 (ER) 程序检索抗原:ER 溶液-1(10 s,AT)、ER 溶液-2(10 s,AT)、ER 溶液-3(在 100 °C 下 20 分钟)、ER 溶液-4(12 分钟,AT)。
- 在洗涤溶液中冲洗载玻片 3 次(每次 30 秒)和 1 次(3 分钟)。
- 在 AT 下使用 Peroxide Block 溶液封闭内源性过氧化物酶 5 分钟。
- 在洗涤溶液中冲洗 3 次(每次 30 秒)。
- 在 AT 下,仅阻断抗体与 NKp46 蛋白块的非特异性结合 30 分钟。
- 与一抗结合:在 AT 与一抗孵育 15 分钟,然后用洗涤溶液冲洗 3 次(每次 30 秒)。
- 对于二抗结合,请按照以下步骤操作。
- 在 AT 与辣根过氧化物酶偶联的二抗孵育 8 分钟。
- 用洗涤液冲洗 2 次(每次 2 分钟),然后用去离子水冲洗 1 次。
- 通过用二氨基联苯胺 (DAB) 溶液冲洗载玻片,然后在 AT 上将它们与 DAB 溶液孵育 10 分钟来观察反应。
- 用去离子水冲洗 3 次(30 秒)。
- 用 Mayer 苏木精对切片进行复染。
- 用去离子水冲洗 1 次(30 秒),洗涤液 1 次(30 秒),然后用去离子水冲洗 1 次(30 秒)。
- 使用全自动玻片染色机在乙醇 70%(2 分钟)、乙醇 80%(2 分钟)、乙醇 96%-1(3 分钟)、乙醇 96%-2(3 分钟)、乙醇 100%(3 分钟)、二甲苯-1(4 分钟)、二甲苯-2(4 分钟)和二甲苯-3(4 分钟)中脱水切片。
- 使用全自动玻璃盖玻片将载玻片上的切片安装到安装介质中。
注意:整个过程中使用了阴性和阳性(扁桃体)组织对照样品。
4. 获得全玻片扫描
- 使用 20 倍物镜和全玻片扫描仪上的中高密度聚焦扫描染色玻片。
5. 使用软件进行 IHC 分析
- 在软件中为 IHC 映像创建一个项目。
- 下载并打开 QuPath-0.4.3(或更高版本).exe
- 创建一个具有合适名称的新文件夹。
- 点击 创建项目 软件左上角的按钮,然后选择新创建的文件夹。
- 将扫描的图像拖动到软件窗口中。当自动弹出新窗口时,选择 > H-DAB 设置图像类型 ,然后单击 导入 (图 2)。
- 观察菜单左侧窗口中的图像列表;双击以打开图像。
- 从顶部的主菜单中选择 文件 将图像另存为项目。
注意:该软件可以处理多种图像格式,包括许多整个幻灯片格式。但是,首选 tiff 格式,以防止丢失原始数据和相关元数据。
- 注释感兴趣区域
- 从顶部的主菜单中选择 Brush (画笔 ) 工具或 Wand (棒 ) 工具,以注释肿瘤区域。对于肿瘤的不连续区域,请遵循步骤 5.2.1.1-5.2.1.3。
- 分别对它们进行注释。
- 按住 Ctrl 键,同时选择所有肿瘤区域
- 右键单击并选择 Edit Multiple > Merge Selected。
- 确保已选择肿瘤注释(边界为黄色)。
- 单击主菜单中的 Automate ,然后选择 Show Script Editor。
- 复制 Supplementary File 1 或 https://petebankhead.github.io/qupath/scripts/2018/08/08/three-regions.htmls 中可用的脚本并将其粘贴到 Script Editor 中,然后单击 Run。ROIs:肿瘤中心 (TC)、内缘 (IM)、外缘 (OM) 和瘤周区域 (PT) 将被自动创建和标记。
- 有关创建感兴趣区域的替代方法,请遵循步骤 5.2.5.1-5.2.5.5。
- 从顶部的主菜单中选择 Polyline (折线 ) 工具,绘制分隔恶性细胞巢和相邻非肿瘤组织的边界。
- 选择生成的边框。从顶部的主菜单中选择 Objects > Annotation > Expand annotations ,> 500 μm 的 Expansion Radius,> Flat 的线 端头。激活 Remove Interior 并激活 Constrain to parent。
- 右键单击生成的注释 Edit Single > Split。两个单独的注释将自动扩展为边界两侧 500 μm 宽的区域。
- 右键单击左侧列表中的注释,选择 Set Properties,然后输入名称,为 IM 和 OM 适当地命名注释区域。
- TC 代表剩余的肿瘤区域。使用相同的程序扩展与 OM 相邻的 500 μm 宽的 PT 区域。
注意:带注释的玻片和 QuPath AF 检测由组织病理学专家审查。
- 从顶部的主菜单中选择 Brush (画笔 ) 工具或 Wand (棒 ) 工具,以注释肿瘤区域。对于肿瘤的不连续区域,请遵循步骤 5.2.1.1-5.2.1.3。
- 像素分类优化
- 从主菜单中选择 Rectangle 工具。然后注释一个区域,其中包含要区分的所有类型的像素(例如,苏木精、DAB 和背景)。
- 从主菜单中,选择 Analyze > Preprocessing > Estimate Stain Vector。
- 当 Visual Stain Editor 窗口自动弹出时,选择 Auto > OK,并将 H-DAB estimated 设置为污点载体的名称。
- 对于替代方法,请按照步骤 5.3.4.1-5.3.4.3 进行操作。
- 从主菜单中选择 Rectangle (矩形 ) 工具,并注释用苏木精染色的典型细胞核的一小块区域。
- 从左侧菜单中选择 图像 ,然后双击 Stain 1 > Yes。
- 从主菜单中选择 矩形 工具,并使用 DAB 注释一小块阳性染色区域。从左侧菜单中选择 图像 ,然后双击 Stain 2 > Yes。
- 使用 Pixel Classification 选项评估阳性免疫细胞的面积分数。
- 在主菜单中,单击 Classify > Pixel classification > Create thresholder 创建阈值器。
- 为分辨率>通道选择高:DAB > 预滤波器:高斯> Sigma:0.5 >(图 3) 阈值:(0.2-0.3) >高于阈值:正>低于阈值:负。
- 对于区域,选择 Any Annotation (任何注释),键入 分类器的名称,> Save > Measure (保存度量) > OK (确定)。 DAB 阳性细胞将变为红色(图 4)。
- 将结果从左侧菜单复制到电子表格。
- 或者打开上方主菜单中的 Measure ,选择 Show Annotation Measurements > Copy to Clipboard,然后将结果粘贴到电子表格中。
- 要关闭图像,请右键单击 > Multi View > Close Viewer。
注:在定量之前,消除了所有伪影。针对每个具有弱特异性阳性染色的病例调整阈值。首先交叉检查注释和像素分类的正确性,然后由高级组织病理学家审查。所有分析均以盲法进行。有关使用该软件分析 IHC 的更多信息,请访问 https://forum.image.sc/tag/QP。
6. 统计方法和数据分析
- 研究终点是复发时间 (TTR) 、无病生存期 (DFS) 和总生存期 (OS)。无复发或死亡的患者在最后一次随访时被删失。
注意:连续非正态分布数据表示为中位数 (min-max)。比例表示为原始数据 (百分比)。通过 Friedman 方差分析比较不同感兴趣区域 (ROIs) 中免疫细胞的面积分数,然后进行 Wilcoxon 匹配对检验和 Bonferroni 校正。由于大多数变量是非参数分布的,因此使用 Spearman 相关来评估有序变量或定量变量对之间的关联。为了确定终点的单个预测因子的预后价值,进行了单变量后多变量 Cox 回归分析。计算风险比 (HR)。HR 显示联合中高组的相对风险,而低组为 1。所有生存估计值均通过 Kaplan-Meier 方法计算,并通过对数秩检验在组间进行比较。使用 GraphPad Prism 9.0 (GraphPad Software LLC) 进行统计分析。< 0.05 的 2 侧 p 值被认为具有统计显著性。
结果
患者的人口统计学和临床特征见表 1。患者的中位年龄为 69 岁,大多数为男性 (77.6%)。关于 HCC 的病因,慢性非病毒性肝炎是最常见的背景疾病,非酒精性脂肪性肝炎 (NASH) 的患病率为 23.9%。只有 15 例患者 (22.4%) 将肝硬化作为背景疾病。大多数患者 (68.7%) 患有 TNM I 期。我们之前发表的工作中描述了更详细的临床和病理学发现 2,26。
结果
在最后一次随访中,29 例 (41.8%) 患者观察到肿瘤复发,其中 89.7% 出现局部复发,38 例 (56.7%) 患者死亡。术后 5 年,DFS 比例为 33.2%,OS 比例为 49.4%,无复发比例 (RFP) 为 48.7%(表 2)。
免疫细胞在不同感兴趣区域的分布
CD117 蛋白主要存在于圆形细胞的细胞质膜中(图 5A)。在 TC 和 IM 中,它们主要位于基质和血管周围间隙。在 OM 和 PT 区域,在肿瘤包膜和血管周围间隙中观察到 CD117 + 细胞。
NKp46 蛋白主要存在于圆形细胞的细胞质膜中,这些细胞存在于 TC 和 IM 的正弦状空间内,并与基质相关(图 5B)。在 OM 和 PT 区域,在肿瘤巢周围的包膜和门静脉束的基质中观察到 NKp46 + 细胞。
CD1a 蛋白存在于 TC 和 IM 中,主要存在于基质中圆形细胞(散在或聚集)的细胞质膜中,位于正弦状空间的内部和沿边界(图 5C)。在 PT 区域,在门静脉束的正弦椎边界内和胆道上皮内观察到 CD1a+ DC。
肥大细胞的 AF 显着大于 NKp46 + 细胞的 AF (p < 0.001)(图 6)。与肥大细胞和 NK 细胞相比,每个 ROI 中的 CD1a+ iDC 显示出最低的 AF (p < 0.001)(图 6)。TC 或 IM 中 CD117 + 和 NKp46 + 细胞的 AF 显着小于 PT 区域和 OM 中的 AF (p < 0.001)(图 6)。对于 CD1a+ 细胞,区域间 AF 没有显着差异。
表 3 显示了所有 ROI 之间单个免疫细胞的显著关联。图 7 显示了不同区域内不同免疫细胞之间显著关联的热图。TC 中 CD117 + 肥大细胞的 AF 与 TC 和 IM 中 CD1a 的 AF 显著相关。
临床和病理变量的预后价值
在临床和病理变量中,只有年轻与较高的复发风险相关 (HR = 0.96,CI: 0.93-0.99,p = 0.007),而没有变量与 DFS 和 OS 相关(表 4)。
浸润免疫细胞的预后价值
IM 中 CD117 + 肥大细胞的高 AF 与较长的 DFS (HR = 0.48,CI: 0.241 - 0.935,p = 0.031) 和 OS (HR = 0.34,CI: 0.167 - 0.703,p = 0.004) 相关(图 8, 表 5)。此外,PT 区域 CD117+ 肥大细胞的高 AF 与较长的 DFS 相关 (HR = 0.48,CI:0.247 - 0.945,p = 0.034)(图 8, 表 5)。相比之下,iDC 和 NK 细胞的 AFs 与任何结果无关。内缘的 CD117 + 肥大细胞与 DFS (HR = 0.46,CI: 0.23-0.91,p = 0.027) 和 OS (HR = 0.33,CI: 0.16-0.68,p = 0.003) 保持显着关联调整 TNM 分期后(表 6)。至于 PT 区域的肥大细胞,与 DFS 的相关性也仍然显着 (HR = 0.47,CI: 0.24-0.93,p = 0.029) (表 6)。
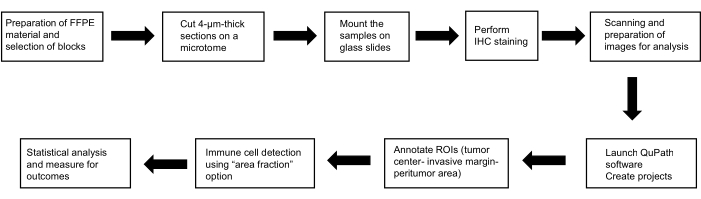
图 1:方法的代表性示意图。 鉴定肥大细胞、树突状细胞和自然杀伤细胞在 HCC 中预后作用的工作流程示意图。缩写:FFPE,福尔马林固定石蜡包埋;H&E、苏木精和伊红;ROIs、感兴趣的区域。请单击此处查看此图的较大版本。
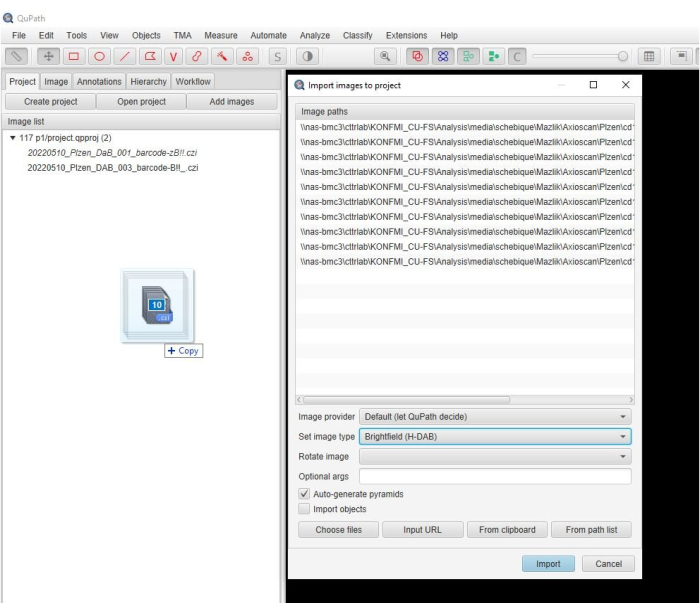
图 2:软件窗口的屏幕截图。 描述性屏幕截图,显示了将图像导入软件项目中的步骤。 请单击此处查看此图的较大版本。
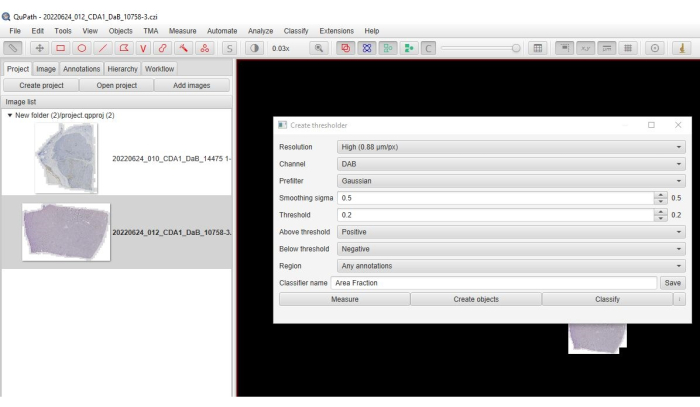
图 3:面积分数选项的屏幕截图。 软件的屏幕截图显示了用于量化阳性染色面积分数的所选参数。 请单击此处查看此图的较大版本。
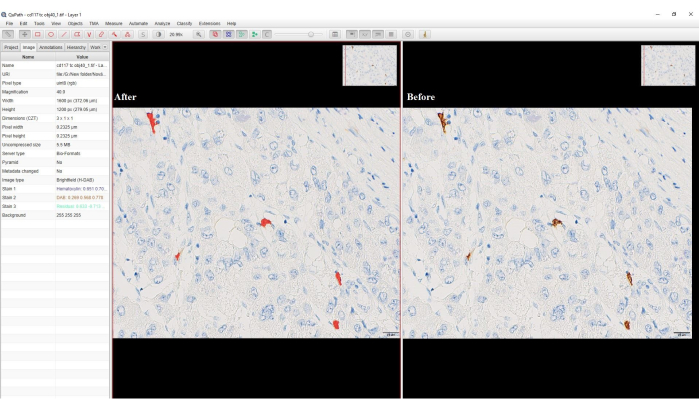
图 4:像素分类选项的屏幕截图。 软件截图显示了像素分类前后的 DAB 阳性细胞。像素分类后,褐色 DAB 染色已转换为红色。 请单击此处查看此图的较大版本。
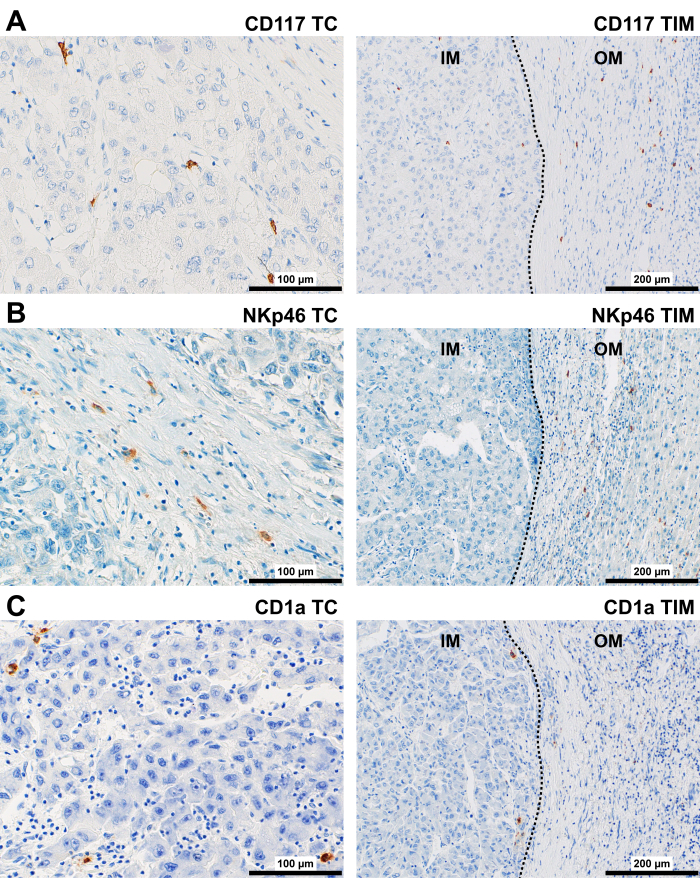
图 5:HCC 患者先天免疫细胞的代表性免疫染色。 HCC TC (400x) 和 TIM (200x) 中 (A) CD117+、(B) NKp46+ 和 (C) CD1a+ 细胞的代表性免疫染色。缩写:HCC,肝细胞癌;TC, 肿瘤中心;TIM,肿瘤浸润性切缘,具有内切缘 (IM) 和外缘 (OM)。虚线代表肿瘤和非肿瘤组织之间的边界。 请单击此处查看此图的较大版本。
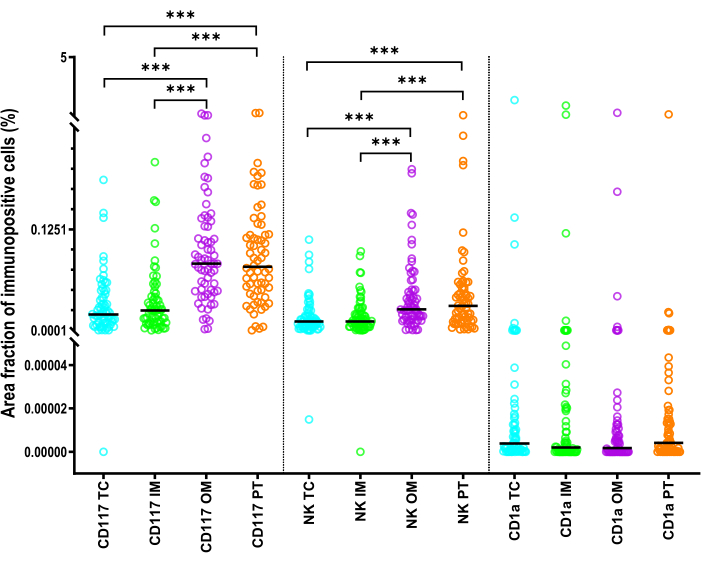
图 6:描述 HCC 患者先天免疫细胞面积分数的统计数据。 统计 HCC 的 TC、IM、OM 和 PT 区域中 CD1a+ 树突状细胞、CD117+ 肥大细胞和 NKp46+ NK 细胞的面积分数。黑线是中位数。采用 Wilcoxon 匹配对检验和 Bonferroni 校正进行比较。缩写:HCC,肝细胞癌;TC, 肿瘤中心;IM,内缘;OM, 外缘;PT,瘤周区域。: p <0.001 请点击此处查看此图的较大版本。
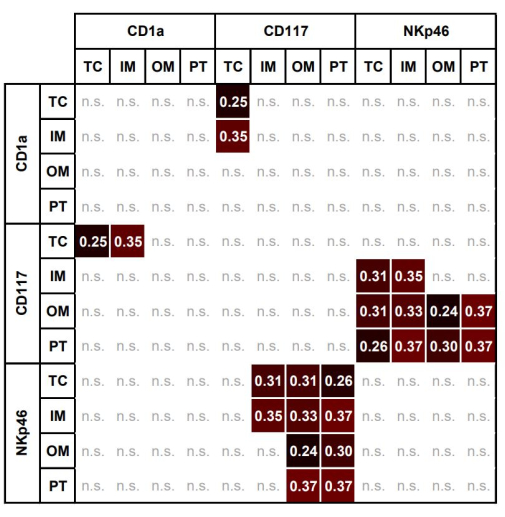
图 7:不同感兴趣区域中肥大细胞、DC 和 NK 的面积分数之间显著相关性的热图。 TC、IM、OM 和 PT 中 CD117 + 肥大细胞、CD1a + DC 和 NKp46 + NK 的面积分数之间显着相关性的热图 (Spearman ρ,p < 0.05)。缩写: TC, tumor center;IM,内缘;OM, 外缘;PT, 瘤周区域;DC,树突状细胞;NK,自然杀伤细胞。请单击此处查看此图的较大版本。
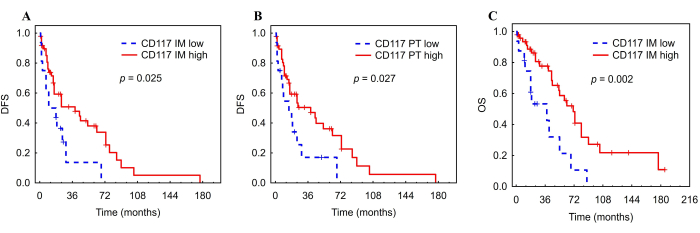
图 8:HCC 患者肿瘤浸润肥大细胞的 Kaplan-Meier DFS 和 OS 曲线。 根据 HCC 内缘 (A、C) 和 PT (B) 中肿瘤浸润肥大细胞的低 AF 与高 AF 对 DFS 和 OS 进行 Kaplan-Meier 分析。缩写:HCC,肝细胞癌;DFS,无病生存期;IM,内侵;PT,瘤周区域。该图经 Ali 等人许可改编26。 请单击此处查看此图的较大版本。
表 1:入组肝细胞癌患者的临床背景。 入组肝细胞癌病例的临床背景。缩写:NAFLD,非酒精性脂肪肝病。 请点击此处下载此表格。
表 2:Kaplan-Meier 分析中估计的结果概率。 Kaplan-Meier 分析中 RFP 、 DFS 和 OS 的估计概率。缩写:RFP,无复发比例;DFS,无病生存期;OS,总生存期。 请点击此处下载此表格。
表 3:不同 ROI 中肿瘤浸润肥大细胞、树突状细胞和自然杀伤细胞的面积分数之间的相关性。 不同 ROI 中肿瘤浸润肥大细胞、树突状细胞和自然杀伤细胞的面积分数之间的 Spearman 相关性 (ρ),p < 0.038。缩写: TC, tumor center;IM,内缘;OM, 外缘;PT, 瘤周区域;ROIs、感兴趣的区域。 请点击此处下载此表格。
表 4:与复发时间 (TTR)、无病生存期 (DFS) 和总生存期 (OS) 相关的临床和病理变量的单变量分析。 No"、female gender 或 "A" 是二分变量的参考类别。粗体值表示 p < 0.05 水平的统计显著性。缩写: HR, hazard ratio;CI,置信区间;TTR,复发时间;DFS,无病生存期。 请点击此处下载此表格。
表 5:使用 Cox 回归对 CD117 + 肥大细胞、CD1a + 树突细胞和 NKp46 + 自然杀伤细胞的面积分数与每个感兴趣区域的 TTR、DFS 和 OS 的关联进行单变量分析(67 名 HCC 患者)。 将免疫细胞每面积截面的面积分数 (mm2) 转换为百分位数,然后分为低 (0-25 个百分位数) 和高 (25-100 个百分位数)。风险比显示相对风险,而低 AF 为 1。粗体值表示 p < 0.05 水平的统计显著性。缩写: AF,面积分数;DFS,无病生存期;OS,总生存期;HR,风险比。 请点击此处下载此表格。
表 6:每个个体 ROI 中 CD117 + 肥大细胞的面积分数与无病生存期和总生存期相关(多变量分析)。 使用 Cox 回归对 IM 和 PT 区域 CD117 + 肥大细胞的面积分数与 DFS 和 OS 的相关性进行多变量分析 (67 例 HCC 患者)。将每个面积切片 (mm2) 的免疫细胞面积分数转换为百分位数,然后分为低 (0-24 个百分位数) 和高 (25-100 个百分位数)。风险比显示相对风险,而低 AF 为 1。粗体值表示 p > 0.05 水平的统计显著性。缩写: AF,面积分数;DFS,无病生存期;OS,总生存期;HR,风险比。 请点击此处下载此表格。
补充文件 1:用于创建 ROI 的脚本。请点击此处下载此文件。
讨论
通过监测 TME 中的 原位 免疫组织,免疫肿瘤学领域可以增加新的癌症预后和预测生物标志物。我们之前发表的关于适应性免疫细胞在 HCC TME 中的作用的论文显示,CD3 + 和 CD8 + T 细胞以及 CD20 + B 细胞在选定的 ROI 中与复发时间呈阳性预后关联2。在这里,图像分析软件 QuPath 用于评估 HCC 几个不同区域中 CD1a+ iDC 、 CD117+ 肥大细胞和 NKp46+ NK 细胞的丰度,并评估它们的预后意义。由于一些先天免疫细胞的形状不规则,它们的定量可能不准确。这就是为什么评估免疫阳性细胞的面积分数是最佳选择的原因。在三种细胞类型中,只有 CD117 + 肥大细胞表现出显着的预后影响:IM 和 PT 区域中肥大细胞的较高 AF 与较长的生存期相关。
肥大细胞在所有 ROIs 中含量最高,它们在瘤周区域和内缘的 AF 与较好生存率的相关性反映了肥大细胞的抗肿瘤作用。肥大细胞可被肿瘤细胞释放的趋化因子(如 SCF 或 CCL1518)吸引到 TME 中。肥大细胞可通过对肿瘤细胞产生直接细胞毒性27 或通过分泌可抑制肿瘤生长的促炎细胞因子18 来影响抗肿瘤反应。肥大细胞密度增加可防止肝移植后前列腺癌28 、胃癌27 和 HCC 的复发29。一项由 245 名 HCC 患者组成的更大队列的综合调查发现,肿瘤样本中更显着的肥大细胞浸润与肿瘤切除后延长的生存期之间存在正相关30。Rohr-Udilova 等人报告了周围 HCC 组织中肥大细胞密度更高的类似结果;然而,只有肿瘤内肥大细胞密度与较低的复发率相关29。
在本研究中,肥大细胞仅在 IM 和 PT 肝脏中发挥抗肿瘤作用。不同肿瘤的 TME 在免疫细胞的空间分布方面是异质性的31。TME 中免疫细胞的预后意义也与它们的空间分布密切相关32,33。已经提出了不同的方法来注释肿瘤侵袭性边缘,包括不同宽度 4,34,35 的整个边缘,内边缘和外边缘,同样具有不同宽度 36,37,有或没有 PT 2,7。我们遵循国际免疫肿瘤学生物标志物工作组的可重复、标准化方法,将侵袭性边缘定义为以边界为中心的 1 mm 区域,将恶性细胞巢与宿主组织分开,并将中央肿瘤表示为剩余的肿瘤区域38。由于早期的研究强调了内外侵入边缘2 结果的显着差异,因此已分别分析了这些区域(每个 500 μm 宽)。瘤周区域的空间免疫分析具有其独特的预测重要性39,40,因此,PT 区域也包括在内。
TC 、 肿瘤边缘和 PT 肝脏的分析是在 WSI 中进行的,而不是在相应区域中评估选定视野的选项。全玻片成像是一个潜在的丰富数据来源41。由于我们没有进行子采样,因此以省时的方式获得了"真实期望值"10。此外,该系统是合理的,因为每个模块只分析了 1 或 2 张载玻片,这使我们能够避免补丁选择42 的偏差。在之前的研究中,当立体学应用于免疫细胞的定量时,缓慢的工作流程对我们提出了挑战2。
IHC 允许直接定位肝组织中 CD1a+ iDC、NKp46+NK 和 CD117+ 肥大细胞表达,量化它们的分布,从而对队列进行亚分类。IHC 分析使这项研究比溶解组织中的生化测定具有重要优势,当仅存在少数生物标志物阳性细胞时,这可能会导致假阴性结果43 并且不反映免疫细胞对组织病理学特征的区域反应44。IHC 也优于 H&E 染色切片的分析。对结直肠癌和小细胞肺癌的研究表明,H&E 染色切片的评估可以提供稳健、定量的肿瘤免疫生物标志物 45,46,47;但是,反映特定子类型实际存在的限制仍然存在。
高质量的组织切片和 IHC 染色是准确评估的先决条件。高背景、边缘伪影和特异性但不需要的染色(例如,用抗 CD4 抗体对肝窦腔的内皮细胞进行染色)可能会破坏所有结果。CD56 抗体是当前研究中检测自然杀伤细胞的首选,但由于 CD56 在未成熟胆管中的表达而被 NKp46 抗体取代。在 FFPE 块中选择特异性、稳健染色模式和稳定性方面最合适的标志物是另一个需要考虑的问题。例如,选择 CD117 而不是类胰蛋白酶,因为类胰蛋白酶的表达可能强烈下调,此外,不表达 CD117 的细胞不是肥大细胞48。
QuPath 提供了从外部平滑 ROI 边界的选项,并去除任何不应属于 ROI 的伪影、大血管、坏死组织、非特异性染色、背景和红细胞聚集。操作员需要选择 ROI 并在注释这些工件时按 "Alt" 键。在本研究中,非特异性染色在定量前作为伪影被消除,因此不会影响结果。在系统性低特异性染色或高背景的情况下,应审查方案以避免可能的偏倚。针对每个具有弱特异性阳性染色的病例调整阈值。在进行任何常规使用之前,应优化协议。所有分析都应以盲目方式进行,理想情况下,阈值的准确性值得交叉检查。
QuPath 是一种用户友好、直观、可扩展的开源解决方案,用于数字病理学和全玻片图像分析9,之前已针对 HCC49 和不同癌症50,51 进行过图像分析测试。WSI 软件易于操作和感兴趣区域(例如,肿瘤或瘤周区域)的注释选项是主要优势。
应用现有的、修改的或从 头 创建的脚本可以大大加快分析速度。应用了为 ROI 创建注释的脚本,从而实现了快速准确的区域细分,而不是手动描述。该脚本不是固定的,对于组织边界不足的区域,可以很容易地将其定制为小于 500 μm 的边缘。IM、OM 或 PT 区域的宽度可以通过 Automate > Show 脚本编辑器 进行自定义,>将 30 双扩展裕度微米 = 500 μm 的线调整为运行>可用 宽度。还可以添加或删除 ROI。一般来说,软件中的工作流程不是固定的,操作员可以自由开发和修改它们。
现在有大量用于病理图像分析的软件工具可用,包括 CellProfiler、ImageJ、Fiji、Microscopy Image Browser 等。然而,QuPath 通过一系列优势脱颖而出,例如开源架构、用户友好的界面、算法定制功能以及高级机器学习工具的集成。这些功能共同使该图像分析软件成为数字病理学领域中癌症组织细致分析的可靠选择。
与商业软件 HALO (IndicaLab) 和 QuantCenter (3DHistech) 相比,QuPath 在乳腺癌中检测 Ki67 表达的变异性最低52。该软件还可以指示以可重现的批处理方式为所有项目图像运行脚本。
QuPath 使我们能够创建定量连续数据,而不是有序(半定量)数据。由于解释的主观性、观察者间的变异性和可重复性差,通过视觉评分获得的序数数据充满了问题53。如果注释的准确性由病理学家检查,则没有广泛组织病理学背景和编程专业知识的个体可以进行自动分析,这一事实提高了当前分析的及时性。一项关于头颈部肿瘤的研究表明,QuPath 适用于快速且可重现地评估 CD57 + 肿瘤浸润淋巴细胞的预后价值50。该研究还表明,人类观察者和 QuPath 之间存在很大的一致性。人工观察和使用 QuPath 评估之间的高度一致性也出现在口腔癌54 和乳腺癌55 中。上述论文将 QuPath 和 2 种商业软件产品(Definiens Tissue Studio 和 inForm)对 5 种临床乳腺癌生物标志物的 IHC 定量与病理学家的手动评分进行了比较。在整个研究过程中,QuPath 始终表现出最佳性能以及最短的设置和应用时间,因此表明它是视觉监控和商业软件的绝佳未来替代方案。即使与最著名的生物医学图像分析开源软件 ImageJ 相比,QuPath 也擅长处理大型 WSI56。
QuPath 有一个开放的在线论坛,用户可以在其中发布有关数字病理学方法的问题,并提供了一个活跃且参与的社区,以支持图像分析 (https://forum.image.sc/tag/qupath) 工具的开发。
本研究中使用的队列是独一无二的,不能代表一般 HCC 人群,因为它仅包括符合肝切除术条件的患者。一般来说,少数 HCC 患者 (20%-30%) 有资格进行肝切除术57。这也可能是确诊肝硬化的患者较少的原因,因为具有这种 HCC 病因的患者可能具有较高的 Child-Pugh 评分并且被认为不可切除。该队列也相当小,大多数患者处于疾病的早期 TNM 阶段。因此,应谨慎地将结果外推到其他人群。
在目前的研究中,已经通过评估其 AF 来估计 HCC 微环境中先天免疫细胞的丰度,因为精确计数形状不规则的免疫细胞(如树突状细胞)可能很困难。另一方面,免疫细胞的面积分数通常与它们的密度密切相关58。免疫过氧化物酶标记为抗原的定位、面积分数或表达它的细胞密度提供数据,但染色强度与抗原量呈非线性关系。因此,IHC 不应用于定量评估特定蛋白质的表达水平。该方法的准确性还取决于切片厚度的均匀性、图像质量和所选的像素分类分辨率。应验证并谨慎对待图像分析的任何结果。由于单个标记物无法完全捕获免疫细胞的复杂性,因此需要更多的 IHC 标记物和多重染色来获得 HCC 免疫 TME 的可靠图像。仅使用单个 IHC 标记物对免疫细胞进行表型分析代表近似值,应谨慎解释结果。
使用 QuPath 图像分析软件评估 IHC 染色玻片使我们能够评估局部 iDC 、肥大细胞和 NKs 在 HCC 患者肿瘤和瘤周的分布和面积分数,然后分析它们与预后的关系。HCC 内缘和瘤周肝脏肥大细胞的丰度与较长的 DFS 和 OS 相关,突出了这些先天免疫细胞的抗肿瘤作用。QuPath 的分析工作流程用户友好、快速且易于使用,具有有用的默认设置和轻松的数据导出。该软件已被公认为一个很有前途的数字图像分析平台,可以满足数字病理学对可重复性、一致性和准确性的需求。
披露声明
没有需要披露的财务利益冲突。
致谢
我们感谢 Ondřej Šebesta 主教(查理大学理学院 Vinicna 显微镜核心设施)对全玻片扫描和"e-Infrastruktura CZ"(e-INFRA LM2018140)项目的贡献,该项目为我们提供了本研究的计算资源。技术人员 Jana Dosoudilova 和 Jan Javurek 因其出色的技术帮助而受到认可。这项研究由欧盟的 Horizon 2020 研究和创新计划资助,拨款 N°856620,捷克共和国卫生部,拨款 AZV NU21-03-00506,以及合作计划(外科学科)。Vinicna 显微镜核心设施由 Czech-BioImaging 大型 RI 项目LM2023050共同资助。
材料
| Name | Company | Catalog Number | Comments |
| Anti-CD1a | Leica Biosystems | PA0235 | Identifier- immature dendritic cells; RTU, Protocol F, ER2/20 min |
| Anti-CD117 | Leica Biosystems | PA0007 | Identifier- mast cells; RTU, Protocol F, ER2/20 min |
| BOND Plus Microscope Slides | Leica Biosystems, Germany | S21.2113.A | |
| BOND RXm | Leica Biosystems | 49.1501 | Fully Automated IHC Stainer |
| Bond Aspirating Probe Cleaning Kit | Leica Biosystems | CS9100 | |
| Bond Dewax Solution | Leica Biosystems | AR9222 | |
| Bond Polymer Refine Detection Kit | Leica Biosystems | DS9800 | |
| BondTM Epitope Retrieval 2 | Leica Biosystems | AR9640 | |
| BondTM Primary Antibody Diluent | Leica Biosystems | AR9352 | |
| BondTM Wash Solution 10X Concentrate | Leica Biosystems | AR9590 | |
| Computer Specifications: Intel(R) Core(TM) i5-10500 CPU @ 3.10GHz 3.10 GHz Installed RAM: 128 G | Intel | A 64-bit operating system that has Windows 7. Any computer with Java-based operating system and Excel available | |
| Coverslips | Leica Biosystems, Germany | 14071135636 | |
| CV Mount | Leica Biosystems, Germany | 14046430011 | |
| CV5030 Fully Automated Glass Coverslipper | Leica Biosystems | 149CVTS5025 | |
| Drying Oven UN30 | Memmert GmbH | UN30 | |
| GraphPad Prism 9.0 | GraphPad Software LLC | Version 12 | |
| Human NKp46/NCR1 Antibody, Monoclonal Mouse IgG2B Clone # 195314 | R&D Systems, Inc., United States | MAB1850 | Identifier- natural killer cells; Dilution 1:150, Protocol F + BLOK, ER2/20 min |
| Leica HI1210 - Water Bath | Leica Biosystems | 14041521466 | |
| Protein Block | Agilent Dako, United States | X0909 | |
| QuPath 0.3.2 or higher versions | version (QuPath v.0.3.2) | ||
| RM2235 Rotary Microtome | Leica Biosystems | 149AUTO00C1 | |
| ST5020 Multistainer Slide Stainer | Leica Biosystems | DEV-ST5010-CV5030 | |
| Statistica | StatSoft Inc. | version 7 | |
| Zeiss Axio Scan.Z1 | ScienceServices GmbH, Germany | 430038-9000-000 | Slide scanner |
参考文献
- Du, M., Yin, Y. L., Xiao, L., Cai, Y. M., Ji, Y. Evaluating tumor-infiltrating lymphocytes in hepatocellular carcinoma using hematoxylin and eosin-stained tumor sections. World J Clin Cases. 10 (3), 856-869 (2022).
- Trailin, A., et al. T-and B-cells in the inner invasive margin of hepatocellular carcinoma after resection associate with favorable prognosis. Cancers (Basel). 14 (3), 604(2022).
- Xiao, N., et al. CD74+ macrophages are associated with favorable prognosis and immune contexture in hepatocellular carcinoma. Cancer Immunol Immunother. 71 (1), 57-69 (2022).
- Galon, J., et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science. 313 (5795), 1960-1964 (2006).
- Roxburgh, C. S. D., Salmond, J. M., Horgan, P. G., Oien, K. A., McMillan, D. C. Tumour inflammatory infiltrate predicts survival following curative resection for node-negative colorectal cancer. Eur J Cancer. 45 (12), 2138-2145 (2009).
- Klintrup, K., et al. Inflammation and prognosis in colorectal cancer. Eur J Cancer. 41 (17), 2645-2654 (2005).
- Kather, J. N., et al. Topography of cancer-associated immune cells in human solid tumors. Elife. 7, e36967(2018).
- Cho, J. Basic immunohistochemistry for lymphoma diagnosis. Blood Res. 57 (S1), 55-61 (2022).
- Bankhead, P., et al. QuPath: Open source software for digital pathology image analysis. Sci Rep. 7 (1), 16878(2017).
- Kolinko, Y., et al. Using virtual microscopy for the development of sampling strategies in quantitative histology and design-based stereology. Anat Histol Embryol. 51 (1), 3-22 (2022).
- Rodrigues, A., et al. Computer-assisted tumor grading, validation of PD-L1 scoring, and quantification of CD8-positive immune cell density in urothelial carcinoma, a visual guide for pathologists using QuPath. Surg Exp Pathol. 5, 12(2022).
- Hein, A. L., et al. QuPath digital immunohistochemical analysis of placental tissue. J Pathol Inform. 12, 40(2021).
- Lichterman, J. N., Reddy, S. M. Mast cells: A new frontier for cancer immunotherapy. Cells. 10 (6), 1270(2021).
- Veglia, F., Gabrilovich, D. I. Dendritic cells in cancer: the role revisited. Curr Opin Immunol. 45, 43-51 (2017).
- Wu, S. -Y., Fu, T., Jiang, Y. -Z., Shao, Z. -M. Natural killer cells in cancer biology and therapy. Mol Cancer. 19 (1), 120(2020).
- Kai, K., et al. Immunohistochemical analysis of the aggregation of CD1a-positive dendritic cells in resected specimens and its association with surgical outcomes for patients with gallbladder cancer. Transl Oncol. 14 (1), 100923(2021).
- Minesaki, A., Kai, K., Kuratomi, Y., Aishima, S. Infiltration of CD1a-positive dendritic cells in advanced laryngeal cancer correlates with unfavorable outcomes post-laryngectomy. BMC Cancer. 21 (1), 973(2021).
- Komi, D. E. A., Redegeld, F. A. Role of mast cells in shaping the tumor microenvironment. Clin Rev Allergy Immunol. 58 (3), 313-325 (2020).
- Maltby, S., Khazaie, K., McNagny, K. M. Mast cells in tumor growth: Angiogenesis, tissue remodelling and immune-modulation. Biochim Biophys Acta. 1796 (1), 19-26 (2009).
- Gooch, J. L., Lee, A. V., Yee, D. Interleukin 4 inhibits growth and induces apoptosis in human breast cancer cells. Cancer Res. 58 (18), 4199-4205 (1998).
- Brockmeyer, P., et al. High mast cell density indicates a longer overall survival in oral squamous cell carcinoma. Sci Rep. 7 (1), 14677(2017).
- Lee, H. A., et al. Natural killer cell activity is a risk factor for the recurrence risk after curative treatment of hepatocellular carcinoma. BMC Gastroenterol. 21 (1), 258(2021).
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 19 (3), 200-218 (2020).
- Barrow, A. D., Martin, C. J., Colonna, M. The natural cytotoxicity receptors in health and disease. Front Immunol. 10, 909(2019).
- Guan, X., et al. Tumor-associated NK cells facilitate tumor growth via NKp46 in immunocompetent murine hepatocellular carcinoma. Immunol Lett. 258, 8-19 (2023).
- Ali, E., et al. Prognostic role of macrophages and mast cells in the microenvironment of hepatocellular carcinoma after resection. BMC Cancer. 24 (1), 142(2024).
- Lin, C., et al. Tryptase expression as a prognostic marker in patients with resected gastric cancer. Br J Surg. 104 (8), 1037-1044 (2017).
- Hempel, H. A., et al. Low intratumoral mast cells are associated with a higher risk of prostate cancer recurrence. Prostate. 77 (4), 412-424 (2017).
- Rohr-Udilova, N., et al. Morphometric analysis of mast cells in tumor predicts recurrence of hepatocellular carcinoma after liver transplantation. Hepatol Commun. 5 (11), 1939-1952 (2021).
- Lin, S. Z., et al. Prediction of recurrence and survival in hepatocellular carcinoma based on two cox models mainly determined by FoxP3+ regulatory T cells. Cancer Prev Res. 6 (6), 594-602 (2013).
- Jia, Q., Wang, A., Yuan, Y., Zhu, B., Long, H. Heterogeneity of the tumor immune microenvironment and its clinical relevance. Exp Hematol Oncol. 11 (1), 24(2022).
- Pyo, J. -S., Son, B. K., Lee, H. Y., Oh, I. H., Chung, K. H. Prognostic implications of intratumoral and peritumoral infiltrating lymphocytes in pancreatic ductal adenocarcinoma. Curr Oncol. 28 (6), 4367-4376 (2021).
- Yusa, T., et al. Survival impact of immune cells infiltrating peritumoral area of hepatocellular carcinoma. Cancer Sci. 113 (12), 4048-4058 (2022).
- Halama, N., et al. Localization and density of immune cells in the invasive margin of human colorectal cancer liver metastases are prognostic for response to chemotherapy. Cancer Res. 71 (17), 5670-5677 (2011).
- Zwing, N., et al. Analysis of spatial organization of suppressive myeloid cells and effector T cells in colorectal cancer-A potential tool for discovering prognostic biomarkers in clinical research. Front Immunol. 11, 550250(2020).
- Soeratram, T. T. D., et al. Prognostic value of T-cell density in the tumor center and outer margins in gastric cancer. Mod Pathol. 36 (9), 100218(2023).
- Gonzàlez-Farré, M., et al. Characterization and spatial distribution of the immune cell infiltrate in triple-negative breast cancer: a novel classification based on plasma cells and CD8+ T cells. Hum Pathol. 139, 91-105 (2023).
- Hendry, S., et al. Assessing tumor-infiltrating lymphocytes in solid tumors: A practical review for pathologists and proposal for a standardized method from the International Immunooncology Biomarkers Working Group: Part 1: Assessing the host immune response, TILs in invasive breast carcinoma and ductal carcinoma in situ, metastatic tumor deposits and areas for further research. Adv Anat Pathol. 24 (5), 235-251 (2017).
- Brück, O., et al. Spatial immunoprofiling of the intratumoral and peritumoral tissue of renal cell carcinoma patients. Mod Pathol. 34 (12), 2229-2241 (2021).
- Knebel, M., et al. Prognostic impact of intra- and peritumoral immune cell subpopulations in head and neck squamous cell carcinomas - comprehensive analysis of the TCGA-HNSC cohort and immunohistochemical validation on 101 patients. Front Immunol. 14, 1172768(2023).
- Lee, S., et al. Interactive classification of whole-slide imaging data for cancer researchers. Cancer Res. 81 (4), 1171-1177 (2021).
- Ciga, O., et al. Overcoming the limitations of patch-based learning to detect cancer in whole slide images. Sci Rep. 11 (1), 8894(2021).
- Rizzardi, A. E., et al. Quantitative comparison of immunohistochemical staining measured by digital image analysis versus pathologist visual scoring. Diagn Pathol. 7, 42(2012).
- Masuda, S., Nakanishi, Y. Application of immunohistochemistry in clinical practices as a standardized assay for breast cancer. Acta Histochem Cytochem. 56 (1), 1-8 (2023).
- Matsutani, S., et al. Tumor-infiltrating immune cells in H&E-stained sections of colorectal cancer tissue as a reasonable immunological biomarker. Anticancer Res. 38 (12), 6721-6727 (2018).
- Väyrynen, J. P., et al. Prognostic significance of immune cell populations identified by machine learning in colorectal cancer using routine hematoxylin and eosin-stained sections. Clin Cancer Res. 26 (16), 4326-4338 (2020).
- Zhou, G., et al. Clinical significance of tumor-infiltrating lymphocytes investigated using routine H&E slides in small cell lung cancer. Radiat Oncol. 17 (1), 127(2022).
- Horny, H. -P., Sotlar, K., Valent, P. Mastocytosis. Immunol Allergy Clin North Am. 34 (2), 315-321 (2014).
- Mi, H., Ho, W. J., Yarchoan, M., Popel, A. S. Multi-scale spatial analysis of the tumor microenvironment reveals features of cabozantinib and nivolumab efficacy in hepatocellular carcinoma. Front Immunol. 13, 892250(2022).
- de Ruiter, E. J., et al. Assessing the prognostic value of tumor-infiltrating CD57+ cells in advanced stage head and neck cancer using QuPath digital image analysis. Virchows Archiv. 481 (2), 223-231 (2022).
- Fanucci, K. A., et al. Image analysis-based tumor infiltrating lymphocytes measurement predicts breast cancer pathologic complete response in SWOG S0800 neoadjuvant chemotherapy trial. NPJ Breast Cancer. 9 (1), 38(2023).
- Acs, B., et al. Ki67 reproducibility using digital image analysis: an inter-platform and inter-operator study. Lab Invest. 99 (1), 107-117 (2019).
- Sobottka, B., et al. Establishing standardized immune phenotyping of metastatic melanoma by digital pathology. Lab Invest. 101 (12), 1561-1570 (2021).
- Moratin, J., et al. Digital pathology scoring of immunohistochemical staining reliably identifies prognostic markers and anatomical associations in a large cohort of oral cancers. Front Oncol. 11, 712944(2021).
- Bankhead, P., et al. Integrated tumor identification and automated scoring minimizes pathologist involvement and provides new insights to key biomarkers in breast cancer. Lab Invest. 98 (1), 15-26 (2018).
- Humphries, M. P., Maxwell, P., Salto-Tellez, M. QuPath: The global impact of an open source digital pathology system. Comput Struct Biotechnol J. 19, 852-859 (2021).
- Koh, J. H., et al. Liver resection versus liver transplantation for hepatocellular carcinoma within Milan criteria: a meta-analysis of 18,421 patients. Hepatobiliary Surg Nutr. 11 (1), 78-93 (2022).
- Eriksen, A. C., et al. Computer-assisted stereology and automated image analysis for quantification of tumor infiltrating lymphocytes in colon cancer. Diagn Pathol. 12 (1), 65(2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。