Method Article
Les mastocytes dans le microenvironnement du carcinome hépatocellulaire confèrent un pronostic favorable : une étude rétrospective à l’aide du logiciel d’analyse d’images QuPath
Dans cet article
Résumé
La présence de mastocytes dans la marge interne et les zones péritumorales du carcinome hépatocellulaire après résection confère un pronostic favorable. Cette étude confirme que le logiciel d’analyse d’images QuPath est une plate-forme prometteuse qui pourrait répondre au besoin de reproductibilité, de cohérence et de précision en pathologie numérique.
Résumé
Les informations fournies par la détection in situ des cellules immunitaires dans le carcinome hépatocellulaire (CHC) pourraient présenter des informations sur les résultats des patients. Les études portant sur l’expression et la localisation des cellules immunitaires dans les tissus tumoraux sont associées à plusieurs défis, notamment un manque d’annotation précise pour les régions tumorales et une sélection aléatoire de champs de vision microscopiques. QuPath est un logiciel open source et convivial qui pourrait répondre au besoin croissant de pathologie numérique dans l’analyse d’images de lames entières (WSI).
L’infiltration du CHC et des tissus adjacents par les cellules dendritiques immatures CD1a+ (iDC), les mastocytes CD117+ et les cellules tueuses naturelles (NK) NKp46+ a été évaluée immunohistochimiquement dans des échantillons représentatifs de 67 patients atteints de CHC ayant subi une résection curative. La fraction de surface (AF) des cellules colorées positivement a été évaluée automatiquement dans les WSI à l’aide de QuPath dans le centre tumoral (TC), la marge interne (IM), la marge externe (OM) et la zone péritumorale (PT). La signification pronostique des cellules immunitaires a été évaluée pour le temps avant récidive (TTR), la survie sans maladie (DFS) et la survie globale (OS).
La FA des mastocytes était significativement plus élevée que la FA des NK, et la FA des iDC était significativement plus faible que celle des NK dans chaque région d’intérêt. Des FA élevés des mastocytes dans les zones IM et PT étaient associés à une DFS plus longue. De plus, une FA élevée des mastocytes dans l’IM était associée à une SG plus longue.
L’analyse assistée par ordinateur à l’aide de ce logiciel est un outil approprié pour obtenir des informations pronostiques pour les cellules immunitaires infiltrant la tumeur (iDC, mastocytes et NK) dans différentes régions du CHC après résection. Les mastocytes présentaient la plus grande FA dans toutes les régions d’intérêt (ROI). Les mastocytes de la région péritumorale et de l’IM ont montré une signification pronostique positive.
Introduction
Il a été prouvé que l’organisation spatiale et l’abondance des cellules immunitaires infiltrant la tumeur ont un impact sur la survie dans différents cancers, y compris le carcinome hépatocellulaire (CHC) 1,2,3,4. L’importance pronostique des lymphocytes infiltrant la tumeur dans les cancers a été mise en évidence pour la première fois sur des coupes 5,6 colorées à l’hématoxyline et à l’éosine (H&E). Ensuite, une étude pionnière menée par Galon et al. à l’aide de l’immunohistochimie (IHC) a démontré des associations entre les densités de lymphocytes T CD3+ et CD8+ dans le tissu cancéreux du côlon avec le pronostic4.
L’IHC est un étalon-or pour la visualisation, la quantification et la cartographie des cellules immunitaires dans le tissu tumoral afin d’une association plus poussée avec les résultats cliniques7. L’IHC présente plusieurs avantages, tels que son faible coût, sa disponibilité généralisée et sa compatibilité avec les tissus fixés au formol et inclus dans de la paraffine (FFPE)8. Cependant, l’évaluation précise des cellules immunitaires colorées par l’IHC est un grand défi. Le scoring traditionnel dans des champs de vision microscopiques sélectionnés prend du temps et ne suffit plus à garantir une analyse objective, reproductible et de haute qualité, essentielle à la sélection de biomarqueurs candidats et à une corrélation clinique fiable9. Les balayages de lames entières peuvent être évalués comme une image entière ou après sous-échantillonnage10.
L’évaluation quantitative informatisée de l’abondance des cellules immunitaires dans les échantillons de tissus peut garantir des données pratiques, précises, fiables et cliniquement pertinentes11. QuPath est un logiciel gratuit et open source qui permet l’analyse d’images numériques de lames colorées à l’IHC et maximise la quantité d’informations produites à partir d’échantillons individuels12.
Étant donné que les cellules dendritiques immatures (iDC), les cellules tueuses naturelles (NK) et les mastocytes sont impliqués dans les réponses immunitaires anti-tumorales et qu’il a été démontré qu’ils sont corrélés avec les résultats des patients 13,14,15, nous présentons ici un protocole étape par étape pour évaluer leur distribution spatiale dans le tissu FFPE HCC et explorer leur impact pronostique. CD1a est exprimé principalement sur la membrane des cellules dendritiques immatures, dont la densité a été associée à des résultats cliniques dans une variété de tumeurs humaines 16,17. Les mastocytes peuvent jouer un rôle protumoral ou antitumoral dans le microenvironnement tumoral (TME)18. Ils peuvent favoriser l’angiogenèse et faciliter les métastases19. Inversement, il a été rapporté que les mastocytes peuvent médier l’apoptose des cellules tumorales par la production d’IL-420. La coloration anti-CD117 est couramment utilisée pour visualiser et quantifier les mastocytes dans le tissu tumoral21. On pense que les cellules NK contribuent à la surveillance et au contrôle du CHC22 en tuant les cellules cancéreuses23. L’expression de NKp46 par NK est un paramètre crucial pour leur activité antitumorale24. Cependant, les cellules NK NKp46+ étaient corrélées positivement avec le diamètre de la tumeur chez les patients atteints de CHC25. Malgré cela, on sait peu de choses sur leur corrélation avec la survie des patients.
Notre objectif était d’évaluer quantitativement l’abondance des cellules CD1a+ iDC, des mastocytes CD117+ et des cellules NK NKp46+ dans différentes régions du CHC et de mettre en évidence leur signification pronostique. Au total, 70 patients consécutifs atteints d’un CHC de stade I-IV pathologiquement confirmé, éligibles à la résection selon les directives du BCLC et ayant subi une résection hépatique à visée curative à l’hôpital universitaire de Pilsen entre 1997 et 2019, ont été inclus dans l’étude rétrospective actuelle. Les rapports de pathologie des patients ont été examinés. Aucun des patients inclus dans cette étude n’avait de métastases à distance ni reçu de traitement néoadjuvant tel que la chimiothérapie ou la radiothérapie avant la chirurgie. Au total, 3 patients avec des échantillons histologiques de mauvaise qualité ont été exclus, et les 67 patients restants ont été inclus dans l’étude (tableau 1).
Protocole
Ce protocole s’inscrit dans le cadre d’une étude menée conformément aux normes éthiques énoncées dans la Déclaration d’Helsinki (version 2013) ; il a été approuvé par la Commission d’éthique de la Faculté de médecine et de l’Hôpital universitaire de Pilsen (118/2021, 11 mars 2021). La figure 1 présente un résumé des méthodes utilisées.
1. Sélection des blocs de tissu FFPE
- Récupérez les identifiants de bloc FFPE à partir des dossiers patients avec l’aide de médecins traitants ou de pathologistes.
- Demandez les blocs FFPE à partir de l’archive locale de pathologie.
- Pour chaque patient, sélectionnez 2-3 blocs FFPE contenant du tissu tumoral viable, de préférence avec la zone péritumorale environnante et le foie non tumoral.
REMARQUE : Il est conseillé d’obtenir l’avis d’un pathologiste expert pour cette sélection. L’évaluation histologique du foie non tumoral, ainsi que les données anamnestiques, cliniques et de laboratoire ont été utilisées pour définir l’étiologie sous-jacente du CHC.
2. Déparaffinisation et réhydratation des tissus FFPE
- Découper une ou deux coupes de tissu de 4 m d’épaisseur dans chacun des blocs de tissu FFPE sur un microtome.
REMARQUE : L’épaisseur des sections peut être comprise entre 3 μm et 5 μm sans impact notable sur les taches ; Cependant, une épaisseur de 4 μm est la norme. - Placez les sections dans un bain d’eau (42°C) pour éliminer les plis.
- Montez les lames en les ramassant et en les plaçant sur une lame microscopique en verre chargée positivement. Ensuite, appliquez les lames pour le séchage à température ambiante (AT) pendant 24 h.
- Placez les lames dans un thermostat (56 °C) pendant 1 h.
- À l’aide d’un colorant automatique, déparaffiniser les sections dans la solution de déparaffiné-1 (30 s à 72 °C), la solution de déparaffiné-2 (10 s à 72 °C), la solution de déparaffiné-3 (10 s à AT), l’éthanol à 96 %-1 (10 s), l’éthanol à 96 %-2 (10 s) et l’éthanol à 96 %-3 (10 s).
- Utilisez un colorant automatique pour réhydrater les sections dans la solution de lavage-1 (10 s, AT), la solution de lavage-2 (10 s, AT) et la solution de lavage-3 (5 min, AT).
3. Réalisation d’IHC dans un colorateur entièrement automatisé
REMARQUE : L’IHC est effectué selon le protocole du fabricant. Les étapes sont brièvement expliquées ci-dessous.
- Méthode de récupération d’antigène
- Récupérer l’antigène à l’aide de la procédure de récupération d’épitopes (RE) induite par la chaleur dans une solution RE à pH élevé (par exemple, Tris-EDTA) : solution RE-1 (10 s, AT), solution RE-2 (10 s, AT), solution RE-3 (20 min à 100 °C), solution RE-4 (12 min, AT).
- Rincez la lame dans une solution de lavage pendant 3x (30 s chacune) et 1x (3 min).
- Bloquez la peroxydase endogène à l’aide de la solution Peroxide Block pendant 5 min à AT.
- Rincer dans une solution de lavage pendant 3 x (30 s chacune).
- Bloquer la liaison non spécifique des anticorps avec un bloc protéique pour NKp46 uniquement pendant 30 minutes à AT.
- Liaison avec des anticorps primaires : Incuber avec des anticorps primaires pendant 15 minutes à HA, puis rincer avec une solution de lavage pendant 3 fois (30 s chacune).
- Pour la liaison d’anticorps secondaires, suivez les étapes décrites ci-dessous.
- Incuber avec des anticorps secondaires conjugués à la peroxydase de raifort pendant 8 min à AT.
- Rincer avec une solution de lavage pendant 2 fois (2 min chacune) et 1 fois avec de l’eau déminéralisée.
- Visualisez la réaction en rinçant les lames avec une solution de diaminobenzidine (DAB), puis en les incubant avec la solution de DAB pendant 10 minutes à HA.
- Rincer 3x (30 s) à l’eau déminéralisée.
- Contre-colorez les sections avec de l’hématoxyline de Mayer.
- Rincer à l’eau déminéralisée pendant 1x (30 s), à la solution de lavage pendant 1x (30 s) et à l’eau déminéralisée pendant 1x (30 s).
- À l’aide d’un colorateur de lames entièrement automatisé, déshydratez les sections dans l’éthanol à 70 % (2 min), l’éthanol à 80 % (2 min), l’éthanol à 96 %-1 (3 min), l’éthanol à 96 %-2 (3 min), l’éthanol à 100 % (3 min), le xylène-1 (4 min), le xylène-2 (4 min) et le xylène-3 (4 min).
- À l’aide d’une lamelle en verre entièrement automatisée, vous pouvez monter les sections des diapositives dans un support de montage.
REMARQUE : Des échantillons de contrôle tissulaire négatifs et positifs (amygdales) ont été utilisés tout au long de l’étude.
4. Obtention de numérisations de lames entières
- Numérisez les lames colorées à l’aide de l’objectif 20x et de la densité modérée-élevée de mise au point sur un scanner de lames entières.
5. Analyse IHC à l’aide du logiciel
- Créez un projet pour les images IHC dans le logiciel.
- Téléchargez et ouvrez QuPath-0.4.3 (ou version ultérieure).exe
- Créez un nouveau dossier avec un nom approprié.
- Cliquez sur le bouton Créer un projet dans le coin supérieur gauche du logiciel et sélectionnez le dossier nouvellement créé.
- Faites glisser les images numérisées dans la fenêtre du logiciel. Lorsqu’une nouvelle fenêtre s’affiche automatiquement, sélectionnez Définir le type d’image > H-DAB et cliquez sur Importer (Figure 2).
- Observez la liste des images dans la fenêtre de gauche du menu ; Double-cliquez pour ouvrir l’image.
- Sélectionnez dans le menu principal en haut Fichier pour enregistrer les images en tant que projet.
REMARQUE : Le logiciel peut gérer un large éventail de formats d’image, y compris de nombreux formats de diapositives entières. Cependant, le format tiff est préféré pour éviter la perte de données brutes et de métadonnées associées.
- Annoter les régions d’intérêt
- Sélectionnez l’outil Pinceau ou l’outil Baguette dans le menu principal en haut pour annoter la zone de la tumeur. Pour les régions discontinues de la tumeur, suivez les étapes 5.2.1.1-5.2.1.3.
- Annotez-les séparément.
- Appuyez sur la touche Ctrl et maintenez-la enfoncée tout en sélectionnant toutes les régions tumorales
- Cliquez avec le bouton droit de la souris et sélectionnez Modifier plusieurs > Fusionner la sélection.
- Assurez-vous que l’annotation de la tumeur est sélectionnée (les bordures ont une couleur jaune).
- Cliquez sur Automatiser dans le menu principal et sélectionnez Afficher l’éditeur de script.
- Copiez le script disponible dans le fichier supplémentaire 1 ou à l’https://petebankhead.github.io/qupath/scripts/2018/08/08/three-regions.htmls et collez-le dans l’éditeur de script, puis cliquez sur Exécuter. Les ROI : centre tumoral (TC), marge interne (IM), marge externe (OM) et zone péritumorale (PT) seront créés et étiquetés automatiquement.
- Pour une autre façon de créer des régions d’intérêt, suivez les étapes 5.2.5.1 à 5.2.5.5.
- Sélectionnez l’outil Polyligne dans le menu principal en haut pour dessiner une bordure séparant les nids de cellules malignes et les tissus non tumoraux adjacents.
- Sélectionnez la bordure résultante. Sélectionnez dans le menu principal en haut Objets > Annotation > Développer les annotations > 500 μm pour le rayon d’expansion > plat pour la fin de ligne. Activez l’option Supprimer l’intérieur et l’option Contraindre au parent.
- Cliquez avec le bouton droit de la souris sur l’annotation résultante, Modifier un > Fractionnement. Deux annotations distinctes seront étendues automatiquement sous la forme de régions de 500 μm de large de chaque côté de la bordure.
- Nommez les régions annotées de manière appropriée pour IM et OM en cliquant avec le bouton droit de la souris sur l’annotation dans la liste de gauche, en sélectionnant Définir les propriétés et en entrant le nom.
- Le CT représente la zone tumorale restante. Étendez la zone PT de 500 μm de large adjacente à la MO en utilisant la même procédure.
REMARQUE : Les lames annotées et les détections QuPath AF ont été examinées par un histopathologiste expert.
- Sélectionnez l’outil Pinceau ou l’outil Baguette dans le menu principal en haut pour annoter la zone de la tumeur. Pour les régions discontinues de la tumeur, suivez les étapes 5.2.1.1-5.2.1.3.
- Optimisation de la classification des pixels
- Sélectionnez l’outil Rectangle dans le menu principal. Annotez ensuite une région, qui contient tous les types de pixels à distinguer (par exemple, hématoxyline, DAB et arrière-plan).
- Dans le menu principal, sélectionnez Analyser > Prétraitement > Estimer le vecteur de teinte.
- Lorsque la fenêtre Visual Stain Editor s’affiche automatiquement, sélectionnez Auto > OK et définissez H-DAB estimated comme nom du vecteur de tache.
- Pour une autre méthode, suivez les étapes 5.3.4.1 à 5.3.4.3.
- Sélectionnez l’outil Rectangle dans le menu principal et annotez une petite région d’un noyau typique coloré à l’hématoxyline.
- Sélectionnez Image dans le menu de gauche et double-cliquez sur Tache 1 > Oui.
- Sélectionnez l’outil Rectangle dans le menu principal et annotez une petite zone de coloration positive avec DAB. Sélectionnez Image dans le menu de gauche et double-cliquez sur Tache 2 > Oui.
- Évaluation de la fraction de surface des cellules immunitaires positives à l’aide de l’option Classification des pixels .
- Dans le menu principal, cliquez sur Classifier > Classification des pixels > Créer un seuillateur.
- Sélectionnez Élevé pour la résolution > Canal : DAB > Préfiltre : Gaussien > Sigma : 0,5 > (Figure 3) Seuil : (0,2-0,3) > au-dessus du seuil : positif > inférieur au seuil : négatif.
- Pour la région, sélectionnez N’importe quelle annotation, tapez un nom pour le classificateur > Enregistrer > mesure > OK. Les cellules DAB positives seront remplacées par une couleur rouge (Figure 4).
- Copiez les résultats du menu de gauche dans une feuille de calcul.
- Vous pouvez également ouvrir Mesure dans le menu principal supérieur, sélectionner Afficher les mesures d’annotation > Copier dans le Presse-papiers, puis coller les résultats dans une feuille de calcul.
- Pour fermer l’image, cliquez avec le bouton droit de la souris > Vue multiple > Fermer le visualiseur.
REMARQUE : Avant la quantification, tous les artefacts ont été éliminés. Le seuil a été ajusté pour chaque cas avec une faible coloration positive spécifique. L’exactitude des annotations et de la classification des pixels a d’abord été recoupée, puis examinée par un histopathologiste senior. Toutes les analyses ont été faites à l’aveugle. Vous trouverez de plus amples informations sur l’analyse de l’IHC à l’aide du logiciel à l’adresse https://forum.image.sc/tag/QP.
6. Méthodes statistiques et analyse des données
- Les critères d’évaluation de l’étude étaient le délai de récidive (TTR), la survie sans maladie (DFS) et la survie globale (OS). Les patients sans rechute ni décès ont été censurés lors de leur dernier suivi.
REMARQUE : Les données continues non distribuées de manière normale sont exprimées en médiane (min-max). Les proportions sont exprimées en données brutes (pourcentages). Les fractions de surface des cellules immunitaires dans différentes régions d’intérêt (ROI) ont été comparées par l’ANOVA de Friedman, suivie d’un test de paires appariées de Wilcoxon avec correction de Bonferroni. En raison de la distribution non paramétrique de la plupart des variables, la corrélation de Spearman a été utilisée pour évaluer les associations entre des paires de variables ordinales ou quantitatives. Pour déterminer la valeur pronostique des prédicteurs individuels pour les paramètres, une analyse de régression de Cox univariable suivie d’une analyse de régression de Cox multivariée a été effectuée. Les rapports de risque (HR) ont été calculés. La FC montrait le risque relatif pour le groupe intermédiaire combiné élevé par rapport à 1 pour le groupe faible. Toutes les estimations de survie ont été calculées à l’aide de la méthode de Kaplan-Meier et comparées entre les groupes à l’aide du test de log-rank. GraphPad Prism 9.0 (GraphPad Software LLC) a été utilisé pour les analyses statistiques. Une valeur p à 2 côtés < 0,05 a été considérée comme statistiquement significative.
Résultats
Les caractéristiques démographiques et cliniques des patients sont présentées dans le tableau 1. L’âge médian des patients était de 69 ans, et la plupart étaient des hommes (77,6 %). En ce qui concerne l’étiologie du CHC, l’hépatite chronique non virale était la maladie de fond la plus fréquente, avec une prévalence de stéatohépatite non alcoolique (NASH) (23,9%). Seuls 15 patients (22,4 %) avaient une cirrhose comme maladie de fond. La majorité des patients (68,7 %) présentaient une TNM de stade I. Des résultats cliniques et pathologiques plus détaillés ont été décrits dans nos travaux publiés précédemment 2,26.
Résultats
Lors du dernier suivi, une récidive tumorale a été observée chez 29 patients (41,8%), dont 89,7% avaient une récidive locale et 38 (56,7%) patients étaient décédés. À 5 ans après la chirurgie, la proportion de SSM était de 33,2 %, la proportion de SG était de 49,4 % et la proportion de personnes sans récidive était de 48,7 % (tableau 2).
Distribution des cellules immunitaires dans différentes régions d’intérêt
La protéine CD117 a été trouvée principalement dans la membrane cytoplasmique des cellules arrondies (Figure 5A). Dans le CT et l’IM, ils étaient principalement localisés dans le stroma et dans l’espace périvasculaire. Dans les zones OM et PT, les cellules CD117+ ont été observées dans la capsule tumorale et dans l’espace périvasculaire.
La protéine NKp46 a été trouvée principalement dans la membrane cytoplasmique des cellules arrondies, qui étaient présentes à l’intérieur d’espaces sinusoïdes dans le TC et l’IM, et étaient associées au stroma (Figure 5B). Dans les zones OM et PT, des cellules NKp46+ ont été observées dans des capsules autour des nids tumoraux et dans le stroma des voies portes.
La protéine CD1a a été trouvée dans le TC et l’IM, principalement dans la membrane cytoplasmique des cellules arrondies (dispersées ou en agrégats) dans le stroma, à l’intérieur et le long des limites des espaces de type sinusoïdal (Figure 5C). Dans la zone PT, CD1a+ DC a été observé à l’intérieur et le long des limites des sinusoïdes et à l’intérieur de l’épithélium biliaire dans les voies portes.
La FA des mastocytes était significativement plus élevée que la FA des cellules NKp46+ (p < 0,001) (Figure 6). Les iDC CD1a+ de chaque ROI ont montré la FA la plus faible par rapport aux mastocytes et aux cellules NK (p < 0,001) (Figure 6). La FA des cellules CD117+ et NKp46+ dans le TC ou l’IM était significativement plus petite que celle dans la zone PT et MO (p < 0,001) (Figure 6). Pour les cellules CD1a+, la FA ne différait pas significativement entre les régions.
Les associations significatives pour les cellules immunitaires individuelles entre tous les OI sont présentées dans le tableau 3. La figure 7 montre la carte thermique des associations significatives entre différentes cellules immunitaires dans différentes régions. La FA des mastocytes CD117 + dans le CT était significativement corrélée avec la FA de CD1a dans le TC et le MI.
Valeur pronostique des variables cliniques et pathologiques
Parmi les variables cliniques et pathologiques, seul un âge plus jeune était associé à un risque plus élevé de récidive (HR = 0,96, IC : 0,93-0,99, p = 0,007), tandis qu’aucune variable n’était associée à la DFS et à la SG (tableau 4).
Valeurs pronostiques des cellules immunitaires infiltrantes
Une FA élevée des mastocytes CD117+ dans l’IM était associée à une DFS plus longue (HR = 0,48, IC : 0,241 - 0,935, p = 0,031) et à une SG (HR = 0,34, IC : 0,167 - 0,703, p = 0,004) (Figure 8, Tableau 5). De plus, une FA élevée des mastocytes CD117+ dans la zone PT était associée à une DFS plus longue (HR = 0,48, IC : 0,247 - 0,945, p = 0,034) (Figure 8, Tableau 5). En revanche, les FA des cellules iDC et NK n’étaient associées à aucun des résultats. Les mastocytes CD117+ de la marge interne ont conservé des associations significatives avec la DFS (HR = 0,46, IC : 0,23-0,91, p = 0,027) et la SG (HR = 0,33, IC : 0,16-0,68, p = 0,003) après ajustement pour le stade TNM (tableau 6). En ce qui concerne les mastocytes dans la région PT, l’association avec la DFS est également restée significative (HR = 0,47, IC : 0,24-0,93, p = 0,029) (Tableau 6).
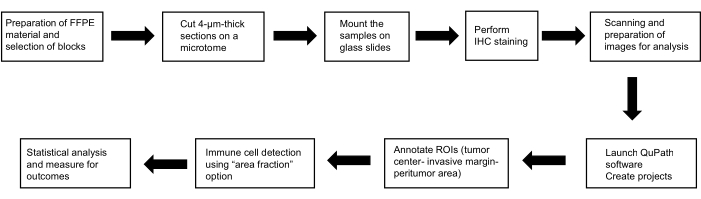
Figure 1 : Schéma représentatif des méthodes. Schéma de principe du déroulement des travaux pour l’identification du rôle pronostique des mastocytes, des cellules dendritiques et des cellules tueuses naturelles dans le CHC. Abréviations : FFPE, fixé au formol et incorporé dans de la paraffine ; H&E, hématoxyline et éosine ; ROI, régions d’intérêt. Veuillez cliquer ici pour voir une version agrandie de cette figure.
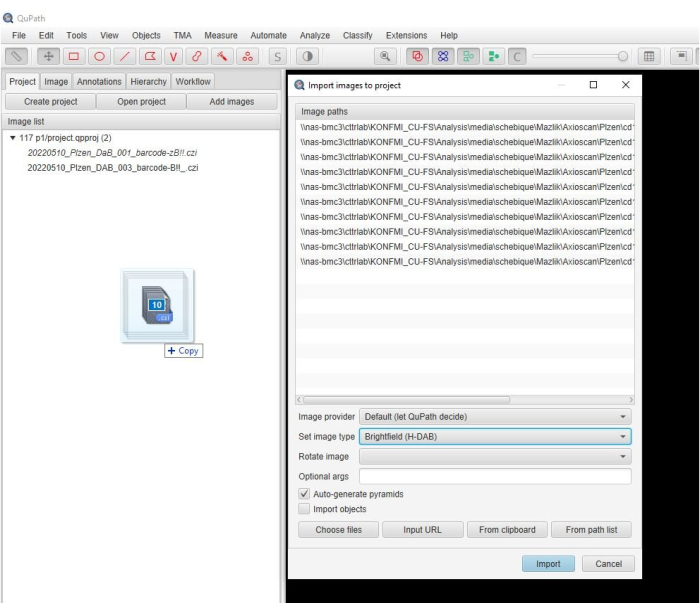
Figure 2 : capture d’écran de la fenêtre du logiciel. Une capture d’écran descriptive montrant l’étape d’importation d’images dans un projet dans le logiciel. Veuillez cliquer ici pour voir une version agrandie de cette figure.
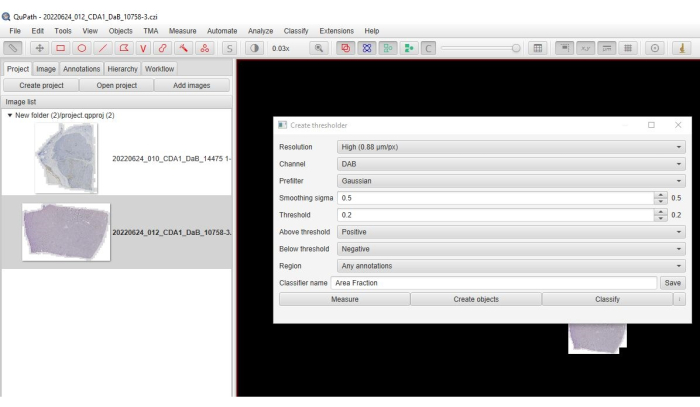
Figure 3 : Capture d’écran de l’option de fraction de surface. Une capture d’écran du logiciel montrant les paramètres sélectionnés pour quantifier la fraction de surface de coloration positive. Veuillez cliquer ici pour voir une version agrandie de cette figure.
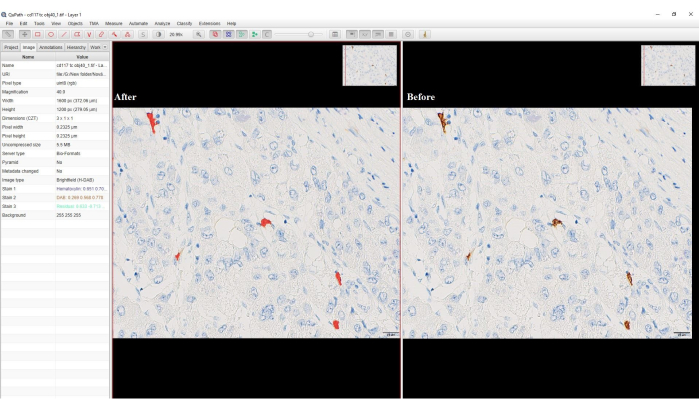
Figure 4 : Capture d’écran de l’option de classification des pixels. Capture d’écran du logiciel montrant les cellules DAB positives avant et après la classification des pixels. La coloration DAB brunâtre a été convertie en couleur rouge après la classification des pixels. Veuillez cliquer ici pour voir une version agrandie de cette figure.
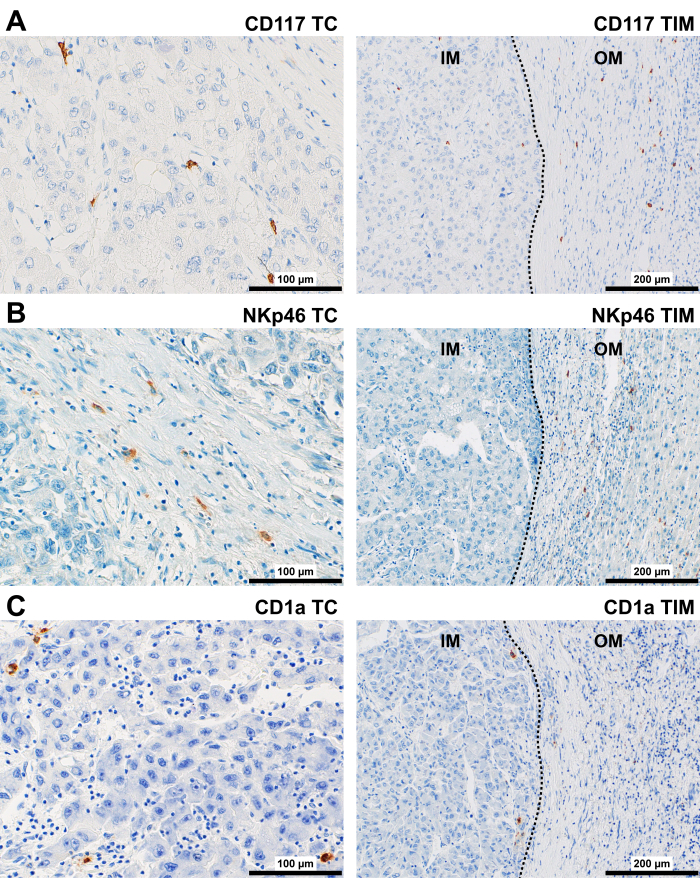
Figure 5 : Immunomarquage représentatif des cellules immunitaires innées chez les patients atteints de CHC. Immunocoloration représentative des cellules (A) CD117+, (B) NKp46+ et (C) CD1a+ dans les cellules TC (400x) et TIM (200x) du CHC. Abréviations : CHC, carcinome hépatocellulaire ; TC, centre des tumeurs ; TIM, marge tumorale invasive, avec marge interne (IM) et marge externe (OM). La ligne pointillée représente une frontière entre le tissu tumoral et le tissu non tumoral. Veuillez cliquer ici pour voir une version agrandie de cette figure.
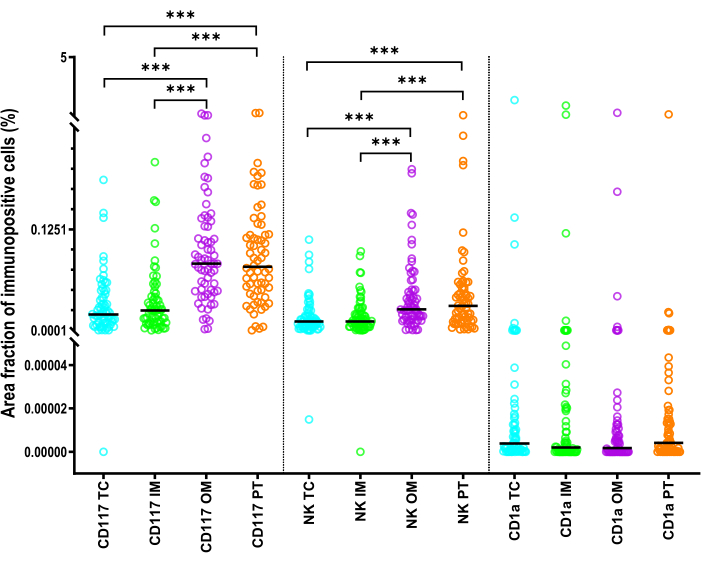
Figure 6 : Statistiques décrivant la fraction de surface des cellules immunitaires innées chez les patients atteints de CHC. Statistiques pour la fraction aire des cellules dendritiques CD1a+, des mastocytes CD117+ et des cellules NK NKp46+) dans les zones TC, IM, OM et PT du CHC. Les lignes noires sont des médianes. Le test de paires appariées de Wilcoxon avec correction de Bonferroni a été utilisé pour les comparaisons. Abréviations : CHC, carcinome hépatocellulaire ; TC, centre des tumeurs ; IM, marge interne ; OM, marge externe ; PT, zone péritumorale. : p <0.001 Veuillez cliquer ici pour voir une version agrandie de cette figure.
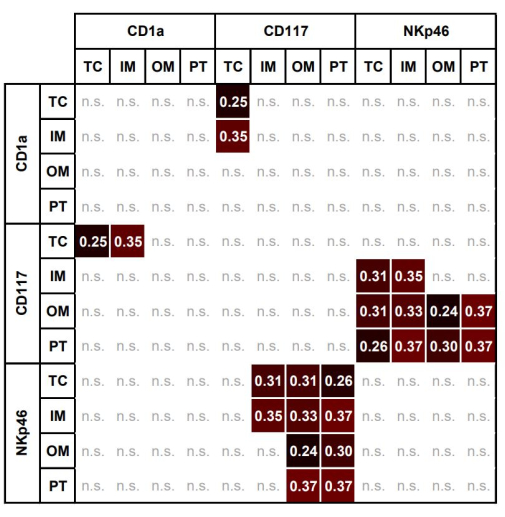
Figure 7 : Carte thermique des corrélations significatives entre les fractions d’aire des mastocytes, des DC et des NK dans différentes régions d’intérêt. Carte thermique des corrélations significatives entre les fractions d’aire des mastocytes CD117+, des DC CD1a+ et des NKp46+NK dans TC, IM, OM et PT (Spearman ρ, p < 0,05). Abréviations : TC, centre des tumeurs ; IM, marge interne ; OM, marge externe ; PT, zone péritumorale ; DC, cellules dendritiques ; NK, cellules tueuses naturelles. Veuillez cliquer ici pour voir une version agrandie de cette figure.
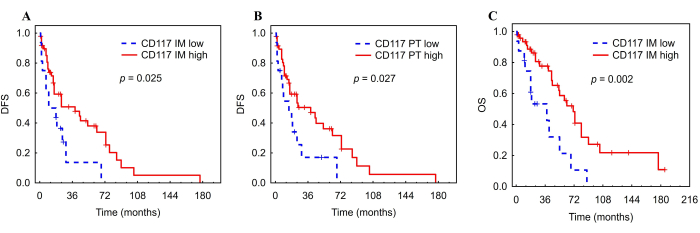
Figure 8 : Courbes de Kaplan-Meier DFS et OS pour les mastocytes infiltrant la tumeur chez les patients atteints de CHC. Analyse de Kaplan-Meier de la DFS et de la SG selon une FA faible ou élevée des mastocytes infiltrant la tumeur dans la marge interne (A, C) et la PT (B) du CHC. Abréviations : CHC, carcinome hépatocellulaire ; DFS, survie sans maladie ; IM, envahissant interne ; PT, zone péritumorale. La figure a été adaptée avec la permission d’Ali et al.26. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Antécédents cliniques des patients atteints de carcinome hépatocellulaire recrutés. Contexte clinique des cas inscrits de carcinome hépatocellulaire. Abréviations : NAFLD, stéatose hépatique non alcoolique. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Probabilité estimée des résultats dans l’analyse de Kaplan-Meier. La probabilité estimée de RFP, DFS et OS dans l’analyse de Kaplan-Meier. Abréviations : DP, proportion sans récidive ; DFS, survie sans maladie ; SG, survie globale. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Corrélation entre la fraction de surface des mastocytes infiltrant la tumeur, des cellules dendritiques et des cellules tueuses naturelles dans différents ROI. Corrélation de Spearman (ρ) entre la fraction de surface des mastocytes infiltrant la tumeur, des cellules dendritiques et des cellules tueuses naturelles dans différents ROI, p < 0,038. Abréviations : TC, centre des tumeurs ; IM, marge interne ; OM, marge externe ; PT, zone péritumorale ; ROI, régions d’intérêt. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 4 : Analyse univariée des variables cliniques et pathologiques associées au délai de récidive (TTR), à la survie sans maladie (DFS) et à la survie globale (OS). Non, le sexe féminin ou « A » étaient les catégories de référence pour les variables dichotomiques. Les valeurs en gras indiquent une signification statistique au niveau p < 0,05. Abréviations : HR, hazard ratio ; IC, intervalle de confiance ; TTR, délai de récidive ; DFS, survie sans maladie. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 5 : Analyse univariée de l’association de la fraction d’aire des mastocytes CD117+, des cellules dendéritiques CD1a+et des cellules tueuses naturelles NKp46+ avec la TTR, la DFS et la SG par région d’intérêt individuelle à l’aide de la régression de Cox (67 patients atteints de CHC). La fraction superficielle des cellules immunitaires par section d’aire (mm2) a été convertie en percentiles, puis catégorisée en faible (0-25 percentile) et élevée (25-100 percentile). Les hazard ratios montrent le risque relatif par rapport à 1 pour la FA faible. Les valeurs en gras indiquent une signification statistique au niveau p < 0,05. Abréviations : AF, fraction de surface ; DFS, survie sans maladie ; SG, survie globale ; HR, rapport de risque. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 6 : Fraction de surface des mastocytes CD117+ par retour sur investissement individuel associée à la survie sans maladie et à la survie globale (analyse multivariée). Analyse multivariée de l’association de la fraction aire des mastocytes CD117+ avec la DFS et la SG dans le domaine IM et PT à l’aide de la régression de Cox (67 patients atteints de CHC). La fraction de surface des cellules immunitaires par section d’aire (mm2) a été convertie en percentiles, puis catégorisée en faible (0-24 percentile) et élevée (25-100 percentile). Les hazard ratios montrent le risque relatif par rapport à 1 pour la FA faible. Les valeurs en gras indiquent une signification statistique au niveau p > 0,05. Abréviations : AF, fraction de surface ; DFS, survie sans maladie ; SG, survie globale ; HR, rapport de risque. Veuillez cliquer ici pour télécharger ce tableau.
Fichier supplémentaire 1 : Script de création du ROI. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Grâce au suivi de l’organisation immunitaire in situ dans l’EUT, le domaine de l’immuno-oncologie peut ajouter de nouveaux biomarqueurs pronostiques et prédictifs du cancer. Notre article précédemment publié sur le rôle des cellules immunitaires adaptatives dans l’EUT du CHC a montré des associations pronostiques positives des lymphocytes T CD3+ et CD8+ ainsi que des lymphocytes B CD20+ dans des zones d’intervention sélectionnées jusqu’au délai de récidive2. Ici, le logiciel d’analyse d’images QuPath a été utilisé pour évaluer l’abondance des iDC CD1a+, des mastocytes CD117+ et des cellules NK NKp46+ dans plusieurs régions distinctes du CHC et a évalué leur signification pronostique. En raison de la forme irrégulière de certaines cellules immunitaires innées, leur quantification peut être imprécise. C’est pourquoi l’évaluation de la fraction de surface des cellules immunopositives était l’option optimale. Parmi les trois types de cellules, seuls les mastocytes CD117+ ont montré un impact pronostique significatif : une FA plus élevée des mastocytes dans la zone IM et PT était associée à une survie plus longue.
Les mastocytes étaient les plus abondants dans tous les ROI, et l’association de leur FA dans la zone péritumorale et la marge interne avec une meilleure survie reflète le rôle anti-tumoral des mastocytes. Les mastocytes peuvent être attirés dans le TME par des chimioattractants libérés par les cellules tumorales, tels que SCF ou CCL1518. Les mastocytes peuvent affecter la réponse antitumorale en contrôlant directement les cellules tumorales27 ou en sécrétant des cytokines pro-inflammatoires qui peuvent inhiber la croissance tumorale18. L’augmentation de la densité des mastocytes protégeait contre la récidive du cancer de la prostate28, du cancer gastrique27 et du CHC après une transplantation hépatique29. Une enquête complète portant sur une cohorte plus large de 245 patients atteints de CHC a révélé une corrélation positive entre une infiltration plus importante de mastocytes dans les échantillons tumoraux et une survie plus prolongée après résection tumorale30. Rohr-Udilova et al. ont rapporté des résultats similaires de plus grandes densités de mastocytes dans le tissu CHC environnant ; Cependant, seule la densité intratumorale des mastocytes était associée à un taux de récidive plus faible29.
Dans cette étude, les mastocytes ont exercé un effet antitumoral dans le foie IM et PT uniquement. L’EUT des différentes tumeurs est hétérogène en ce qui concerne la distribution spatiale des cellules immunitaires31. La signification pronostique des cellules immunitaires dans l’EUT est également liée de manière critique à leur distribution spatiale32,33. Différentes approches pour annoter la marge invasive de la tumeur ont été proposées, y compris une marge entière de différentes largeurs 4,34,35, marges intérieure et externe, encore une fois avec des largeurs différentes36,37, avec ou sans PT 2,7. Nous avons suivi la méthodologie reproductible et standardisée du groupe de travail sur les biomarqueurs d’immuno-oncologie internationale pour définir la marge invasive comme une région de 1 mm centrée sur la bordure séparant les nids de cellules malignes du tissu hôte et représentant la tumeur centrale comme la zone tumorale restante38. Étant donné que l’étude précédente a mis en évidence des différences significatives dans les résultats des marges invasives internes et externes2, ces régions (chacune d’une largeur de 500 μm) ont été analysées séparément. Le profilage immunitaire spatial de la zone péritumorale a son importance prédictive distincte39,40, et par conséquent, la zone PT a également été incluse.
L’analyse de la CT, de la marge tumorale et du PT du foie a été effectuée dans des WSI par opposition à l’option d’évaluation de champs de vision sélectionnés dans les régions respectives. L’imagerie de lames entières est une source de données potentiellement riche41. Comme nous n’avons pas effectué de sous-échantillonnage, les « vraies valeurs attendues » ont été obtenues de manière efficace en termes de temps10. De plus, ce système était raisonnable car seulement 1 ou 2 lames par bloc ont été analysées, ce qui nous a permis d’éviter le biais de sélection de patch42. La lenteur du flux de travail nous a mis au défi dans l’étude précédente lorsque la stéréologie a été appliquée pour la quantification des cellules immunitaires2.
L’IHC permet la localisation directe des iDC CD1a+, NKp46+NK et CD117+ dans l’expression des mastocytes dans le tissu hépatique, la quantification de leurs distributions et, par conséquent, la sous-classification de la cohorte. L’analyse IHC confère à cette étude des avantages importants par rapport aux tests biochimiques dans les tissus solubilisés, ce qui peut conduire à des résultats faussement négatifs lorsque seules quelques cellules positives aux biomarqueurs sont présentes43 et ne reflètent pas la réaction régionale des cellules immunitaires aux caractéristiques histopathologiques44. L’IHC est également préférable à l’analyse dans les sections colorées H&E. Des études sur le cancer colorectal et le cancer du poumon à petites cellules ont montré que l’évaluation des coupes colorées par H&E pouvait fournir des biomarqueurs antitumoraux robustes et quantitatifs 45,46,47 ; Cependant, des limitations pour refléter la présence réelle de sous-types spécifiques sont toujours présentes.
La haute qualité des coupes de tissus et de la coloration IHC est une condition préalable à une évaluation précise. Un bruit de fond élevé, des artefacts de bord et une coloration spécifique mais indésirable (par exemple, coloration des cellules endothéliales des espaces sinusoïdaux du foie avec des anticorps anti-CD4) peuvent corrompre tous les résultats. Un anticorps CD56 était le premier choix dans l’étude actuelle pour détecter les cellules tueuses naturelles, mais a été remplacé par l’anticorps NKp46 en raison de l’expression de CD56 dans les canaux biliaires immatures. La sélection du marqueur le plus approprié en termes de spécificité, de motif de coloration robuste et de stabilité dans les blocs FFPE représente un autre problème à prendre en compte. Par exemple, CD117 a été choisi à la place de la tryptase car l’expression de la tryptase peut être fortement régulée à la baisse, de plus, les cellules qui n’expriment pas CD117 ne sont pas des mastocytes48.
QuPath offre la possibilité de lisser les limites de la zone d’intérêt de l’extérieur et d’éliminer tous les artefacts, gros vaisseaux, tissus nécrotiques, colorations non spécifiques, arrière-plan et agrégations d’érythrocytes qui ne devraient pas faire partie de la période d’investissement. L’opérateur doit sélectionner le retour d’intérêt et appuyer sur la touche « Alt » tout en annotant ces artefacts. La coloration non spécifique a été éliminée dans cette étude sous forme d’artefacts avant la quantification afin de ne pas affecter les résultats. En cas de coloration spécifique systématiquement faible ou de bruit de fond élevé, le protocole doit être revu pour éviter tout biais possible. Le seuil a été ajusté pour chaque cas avec une faible coloration positive spécifique. Avant toute utilisation de routine, le protocole doit être optimisé. Toutes les analyses doivent être faites à l’aveugle et, idéalement, la précision du seuillage mérite d’être recoupée.
QuPath est une solution conviviale, intuitive, extensible et open-source pour la pathologie numérique et l’analyse d’images de lames entières9, testée précédemment pour l’analyse d’images dans le CHC49 et différents cancers50,51. La facilité d’utilisation du logiciel pour les WSI et les possibilités d’annotation des régions d’intérêt (par exemple, les zones tumorales ou péritumorales) sont les principaux avantages.
L’application de scripts existants, modifiés ou créés de novo peut accélérer considérablement l’analyse. Le script permettant de créer des annotations pour les retours sur investissement a été appliqué, ce qui a permis une segmentation régionale rapide et précise au lieu d’une délimitation manuelle. Le script n’est pas fixe et il peut être facilement personnalisé à des marges inférieures à 500 μm pour les régions où les limites tissulaires sont insuffisantes. La largeur de la zone IM, OM ou PT peut être personnalisée via l’éditeur de script Automate > Show > en adaptant la ligne 30 Double Expand Margin Microns = 500 μm à la largeur disponible > Run. Les retours sur investissement peuvent également être ajoutés ou supprimés. En général, les flux de travail dans le logiciel ne sont pas fixes et l’opérateur est libre de les développer et de les modifier.
Une pléthore d’outils logiciels disponibles pour l’analyse d’images pathologiques, notamment CellProfiler, ImageJ, Fiji, Microscopy Image Browser, et d’autres, sont maintenant disponibles. Cependant, QuPath se distingue par un ensemble d’avantages tels qu’une architecture open source, une interface conviviale, des capacités de personnalisation des algorithmes et l’intégration d’outils d’apprentissage automatique avancés. Ces caractéristiques positionnent collectivement ce logiciel d’analyse d’images comme un choix solide pour l’analyse nuancée des tissus cancéreux dans le domaine de la pathologie numérique.
QuPath a montré la plus faible variabilité par rapport aux logiciels commerciaux HALO (IndicaLab) et QuantCenter (3DHistech) pour la détection de l’expression de Ki67 dans le cancer du sein52. Le logiciel a également la possibilité d’être chargé d’exécuter un script pour toutes les images du projet d’une manière reproductible de traitement par lots.
QuPath nous a permis de créer des données quantitatives continues au lieu de données ordinales (semi-quantitatives). Les données ordinales obtenues par notation visuelle posent de nombreux problèmes en raison de la subjectivité de l’interprétation, de la variabilité inter-observateurs et de la faible reproductibilité53. La rapidité de l’analyse actuelle a été améliorée par le fait que des personnes sans formation approfondie en histopathologie et sans expertise en programmation peuvent effectuer une analyse automatique, à condition que l’exactitude des annotations ait été vérifiée par un pathologiste. Une étude sur les tumeurs de la tête et du cou a démontré l’aptitude de QuPath à une évaluation rapide et reproductible de la valeur pronostique des lymphocytes CD57+ infiltrant la tumeur50. L’étude a également montré une concordance substantielle entre les observateurs humains et QuPath. Une concordance élevée entre l’observation manuelle et l’évaluation à l’aide de QuPath a également été observée dans le cancer de la bouche54 et le cancer du sein55. L’article susmentionné a comparé la quantification IHC de 5 biomarqueurs cliniques du cancer du sein à l’aide de QuPath et de 2 logiciels commerciaux (Definiens, Tissue Studio et inForm) avec une notation manuelle par un pathologiste. Tout au long de cette étude, QuPath a constamment présenté les meilleures performances ainsi que le moins de temps pour l’installation et l’application, s’avérant ainsi être une excellente alternative future à la surveillance visuelle et aux logiciels commerciaux. Même comparé à ImageJ, le logiciel open source le plus connu pour l’analyse d’images biomédicales, QuPath excelle dans la gestion des WSI56 de grande taille.
Il existe un forum en ligne ouvert pour QuPath où les utilisateurs postent leurs questions sur les méthodes de pathologie numérique et présentent une communauté active et engagée pour soutenir le développement d’outils d’analyse d’images (https://forum.image.sc/tag/qupath).
La cohorte utilisée dans cette étude était unique et non représentative de la population générale atteinte de CHC, car elle ne comprenait que des patients éligibles à la résection hépatique. En général, une minorité de patients atteints de CHC (20 % à 30 %) sont éligibles à une résection hépatique57. Cela pourrait également être une raison pour laquelle moins de patients avaient une cirrhose confirmée, car les patients atteints de cette étiologie du CHC avaient probablement des scores de Child-Pugh plus élevés et n’étaient pas considérés comme résécables. La cohorte était également assez petite et la plupart des patients présentaient un stade précoce de la maladie. Par conséquent, l’extrapolation des résultats à d’autres populations doit être faite avec prudence.
Dans l’étude actuelle, l’abondance des cellules immunitaires innées dans le microenvironnement du CHC a été estimée grâce à l’évaluation de leur FA, car le comptage précis des cellules immunitaires de forme irrégulière comme les cellules dendritiques peut s’avérer difficile. D’autre part, la fraction de surface des cellules immunitaires est généralement fortement corrélée à leurs densités58. Le marquage par immunoperoxydase fournit des données pour la localisation de l’antigène, de la fraction de surface ou de la densité des cellules qui l’expriment, mais l’intensité de la coloration n’est pas linéairement liée à la quantité d’antigène. Par conséquent, l’IHC ne doit pas être utilisé pour évaluer quantitativement le niveau d’expression d’une protéine particulière. La précision de la méthode dépend également de l’uniformité de l’épaisseur de la section, de la qualité de l’image et de la résolution sélectionnée pour la classification des pixels. Tous les résultats de l’analyse d’images doivent être validés et traités avec prudence. Étant donné qu’un seul marqueur ne peut pas capturer pleinement la complexité des cellules immunitaires, davantage de marqueurs IHC et de coloration multiplex sont nécessaires pour obtenir une image fiable de l’EUT immunitaire du CHC. L’utilisation d’un seul marqueur IHC pour phénotyper les cellules immunitaires représente une approximation, et les résultats doivent être interprétés avec prudence.
L’utilisation du logiciel d’analyse d’images QuPath pour évaluer les lames colorées à l’IHC nous a permis d’évaluer la distribution et la fraction de surface des iDC locaux, des mastocytes et des NK dans les tumeurs et les péritumeurs des patients atteints de CHC, puis d’analyser leurs relations avec le pronostic. L’abondance de mastocytes dans la marge interne et le foie péritumoral du CHC est associée à une DFS et une SG plus longues, mettant en évidence les effets antitumoraux de ces cellules immunitaires innées. Le flux de travail analytique de QuPath est convivial, rapide et facile à utiliser, avec des paramètres par défaut utiles et une exportation facile des données. Ce logiciel a été approuvé comme une plate-forme prometteuse pour l’analyse d’images numériques, qui pourrait répondre au besoin de reproductibilité, de cohérence et de précision en pathologie numérique.
Déclarations de divulgation
Il n’y a aucun conflit d’intérêts financier à divulguer.
Remerciements
Nous remercions Mgr. Ondřej Šebesta (Vinicna Microscopy Core Facility, Faculté des sciences, Université Charles) pour la numérisation de lames entières et le projet « e-Infrastruktura CZ » (e-INFRA LM2018140), qui nous a fourni les ressources de calcul pour cette étude. Les techniciens Jana Dosoudilova et Jan Javurek sont récompensés pour leur excellente assistance technique. Cette recherche a été financée par le programme de recherche et d’innovation Horizon 2020 de l’Union européenne, subvention N°856620, et le ministère de la Santé de la République tchèque, subvention AZV NU21-03-00506, et par le programme Cooperatio (disciplines chirurgicales). La plateforme de microscopie de Vinicna est cofinancée par le grand projet RI de Czech-BioImaging LM2023050.
matériels
| Name | Company | Catalog Number | Comments |
| Anti-CD1a | Leica Biosystems | PA0235 | Identifier- immature dendritic cells; RTU, Protocol F, ER2/20 min |
| Anti-CD117 | Leica Biosystems | PA0007 | Identifier- mast cells; RTU, Protocol F, ER2/20 min |
| BOND Plus Microscope Slides | Leica Biosystems, Germany | S21.2113.A | |
| BOND RXm | Leica Biosystems | 49.1501 | Fully Automated IHC Stainer |
| Bond Aspirating Probe Cleaning Kit | Leica Biosystems | CS9100 | |
| Bond Dewax Solution | Leica Biosystems | AR9222 | |
| Bond Polymer Refine Detection Kit | Leica Biosystems | DS9800 | |
| BondTM Epitope Retrieval 2 | Leica Biosystems | AR9640 | |
| BondTM Primary Antibody Diluent | Leica Biosystems | AR9352 | |
| BondTM Wash Solution 10X Concentrate | Leica Biosystems | AR9590 | |
| Computer Specifications: Intel(R) Core(TM) i5-10500 CPU @ 3.10GHz 3.10 GHz Installed RAM: 128 G | Intel | A 64-bit operating system that has Windows 7. Any computer with Java-based operating system and Excel available | |
| Coverslips | Leica Biosystems, Germany | 14071135636 | |
| CV Mount | Leica Biosystems, Germany | 14046430011 | |
| CV5030 Fully Automated Glass Coverslipper | Leica Biosystems | 149CVTS5025 | |
| Drying Oven UN30 | Memmert GmbH | UN30 | |
| GraphPad Prism 9.0 | GraphPad Software LLC | Version 12 | |
| Human NKp46/NCR1 Antibody, Monoclonal Mouse IgG2B Clone # 195314 | R&D Systems, Inc., United States | MAB1850 | Identifier- natural killer cells; Dilution 1:150, Protocol F + BLOK, ER2/20 min |
| Leica HI1210 - Water Bath | Leica Biosystems | 14041521466 | |
| Protein Block | Agilent Dako, United States | X0909 | |
| QuPath 0.3.2 or higher versions | version (QuPath v.0.3.2) | ||
| RM2235 Rotary Microtome | Leica Biosystems | 149AUTO00C1 | |
| ST5020 Multistainer Slide Stainer | Leica Biosystems | DEV-ST5010-CV5030 | |
| Statistica | StatSoft Inc. | version 7 | |
| Zeiss Axio Scan.Z1 | ScienceServices GmbH, Germany | 430038-9000-000 | Slide scanner |
Références
- Du, M., Yin, Y. L., Xiao, L., Cai, Y. M., Ji, Y. Evaluating tumor-infiltrating lymphocytes in hepatocellular carcinoma using hematoxylin and eosin-stained tumor sections. World J Clin Cases. 10 (3), 856-869 (2022).
- Trailin, A., et al. T-and B-cells in the inner invasive margin of hepatocellular carcinoma after resection associate with favorable prognosis. Cancers (Basel). 14 (3), 604(2022).
- Xiao, N., et al. CD74+ macrophages are associated with favorable prognosis and immune contexture in hepatocellular carcinoma. Cancer Immunol Immunother. 71 (1), 57-69 (2022).
- Galon, J., et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science. 313 (5795), 1960-1964 (2006).
- Roxburgh, C. S. D., Salmond, J. M., Horgan, P. G., Oien, K. A., McMillan, D. C. Tumour inflammatory infiltrate predicts survival following curative resection for node-negative colorectal cancer. Eur J Cancer. 45 (12), 2138-2145 (2009).
- Klintrup, K., et al. Inflammation and prognosis in colorectal cancer. Eur J Cancer. 41 (17), 2645-2654 (2005).
- Kather, J. N., et al. Topography of cancer-associated immune cells in human solid tumors. Elife. 7, e36967(2018).
- Cho, J. Basic immunohistochemistry for lymphoma diagnosis. Blood Res. 57 (S1), 55-61 (2022).
- Bankhead, P., et al. QuPath: Open source software for digital pathology image analysis. Sci Rep. 7 (1), 16878(2017).
- Kolinko, Y., et al. Using virtual microscopy for the development of sampling strategies in quantitative histology and design-based stereology. Anat Histol Embryol. 51 (1), 3-22 (2022).
- Rodrigues, A., et al. Computer-assisted tumor grading, validation of PD-L1 scoring, and quantification of CD8-positive immune cell density in urothelial carcinoma, a visual guide for pathologists using QuPath. Surg Exp Pathol. 5, 12(2022).
- Hein, A. L., et al. QuPath digital immunohistochemical analysis of placental tissue. J Pathol Inform. 12, 40(2021).
- Lichterman, J. N., Reddy, S. M. Mast cells: A new frontier for cancer immunotherapy. Cells. 10 (6), 1270(2021).
- Veglia, F., Gabrilovich, D. I. Dendritic cells in cancer: the role revisited. Curr Opin Immunol. 45, 43-51 (2017).
- Wu, S. -Y., Fu, T., Jiang, Y. -Z., Shao, Z. -M. Natural killer cells in cancer biology and therapy. Mol Cancer. 19 (1), 120(2020).
- Kai, K., et al. Immunohistochemical analysis of the aggregation of CD1a-positive dendritic cells in resected specimens and its association with surgical outcomes for patients with gallbladder cancer. Transl Oncol. 14 (1), 100923(2021).
- Minesaki, A., Kai, K., Kuratomi, Y., Aishima, S. Infiltration of CD1a-positive dendritic cells in advanced laryngeal cancer correlates with unfavorable outcomes post-laryngectomy. BMC Cancer. 21 (1), 973(2021).
- Komi, D. E. A., Redegeld, F. A. Role of mast cells in shaping the tumor microenvironment. Clin Rev Allergy Immunol. 58 (3), 313-325 (2020).
- Maltby, S., Khazaie, K., McNagny, K. M. Mast cells in tumor growth: Angiogenesis, tissue remodelling and immune-modulation. Biochim Biophys Acta. 1796 (1), 19-26 (2009).
- Gooch, J. L., Lee, A. V., Yee, D. Interleukin 4 inhibits growth and induces apoptosis in human breast cancer cells. Cancer Res. 58 (18), 4199-4205 (1998).
- Brockmeyer, P., et al. High mast cell density indicates a longer overall survival in oral squamous cell carcinoma. Sci Rep. 7 (1), 14677(2017).
- Lee, H. A., et al. Natural killer cell activity is a risk factor for the recurrence risk after curative treatment of hepatocellular carcinoma. BMC Gastroenterol. 21 (1), 258(2021).
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 19 (3), 200-218 (2020).
- Barrow, A. D., Martin, C. J., Colonna, M. The natural cytotoxicity receptors in health and disease. Front Immunol. 10, 909(2019).
- Guan, X., et al. Tumor-associated NK cells facilitate tumor growth via NKp46 in immunocompetent murine hepatocellular carcinoma. Immunol Lett. 258, 8-19 (2023).
- Ali, E., et al. Prognostic role of macrophages and mast cells in the microenvironment of hepatocellular carcinoma after resection. BMC Cancer. 24 (1), 142(2024).
- Lin, C., et al. Tryptase expression as a prognostic marker in patients with resected gastric cancer. Br J Surg. 104 (8), 1037-1044 (2017).
- Hempel, H. A., et al. Low intratumoral mast cells are associated with a higher risk of prostate cancer recurrence. Prostate. 77 (4), 412-424 (2017).
- Rohr-Udilova, N., et al. Morphometric analysis of mast cells in tumor predicts recurrence of hepatocellular carcinoma after liver transplantation. Hepatol Commun. 5 (11), 1939-1952 (2021).
- Lin, S. Z., et al. Prediction of recurrence and survival in hepatocellular carcinoma based on two cox models mainly determined by FoxP3+ regulatory T cells. Cancer Prev Res. 6 (6), 594-602 (2013).
- Jia, Q., Wang, A., Yuan, Y., Zhu, B., Long, H. Heterogeneity of the tumor immune microenvironment and its clinical relevance. Exp Hematol Oncol. 11 (1), 24(2022).
- Pyo, J. -S., Son, B. K., Lee, H. Y., Oh, I. H., Chung, K. H. Prognostic implications of intratumoral and peritumoral infiltrating lymphocytes in pancreatic ductal adenocarcinoma. Curr Oncol. 28 (6), 4367-4376 (2021).
- Yusa, T., et al. Survival impact of immune cells infiltrating peritumoral area of hepatocellular carcinoma. Cancer Sci. 113 (12), 4048-4058 (2022).
- Halama, N., et al. Localization and density of immune cells in the invasive margin of human colorectal cancer liver metastases are prognostic for response to chemotherapy. Cancer Res. 71 (17), 5670-5677 (2011).
- Zwing, N., et al. Analysis of spatial organization of suppressive myeloid cells and effector T cells in colorectal cancer-A potential tool for discovering prognostic biomarkers in clinical research. Front Immunol. 11, 550250(2020).
- Soeratram, T. T. D., et al. Prognostic value of T-cell density in the tumor center and outer margins in gastric cancer. Mod Pathol. 36 (9), 100218(2023).
- Gonzàlez-Farré, M., et al. Characterization and spatial distribution of the immune cell infiltrate in triple-negative breast cancer: a novel classification based on plasma cells and CD8+ T cells. Hum Pathol. 139, 91-105 (2023).
- Hendry, S., et al. Assessing tumor-infiltrating lymphocytes in solid tumors: A practical review for pathologists and proposal for a standardized method from the International Immunooncology Biomarkers Working Group: Part 1: Assessing the host immune response, TILs in invasive breast carcinoma and ductal carcinoma in situ, metastatic tumor deposits and areas for further research. Adv Anat Pathol. 24 (5), 235-251 (2017).
- Brück, O., et al. Spatial immunoprofiling of the intratumoral and peritumoral tissue of renal cell carcinoma patients. Mod Pathol. 34 (12), 2229-2241 (2021).
- Knebel, M., et al. Prognostic impact of intra- and peritumoral immune cell subpopulations in head and neck squamous cell carcinomas - comprehensive analysis of the TCGA-HNSC cohort and immunohistochemical validation on 101 patients. Front Immunol. 14, 1172768(2023).
- Lee, S., et al. Interactive classification of whole-slide imaging data for cancer researchers. Cancer Res. 81 (4), 1171-1177 (2021).
- Ciga, O., et al. Overcoming the limitations of patch-based learning to detect cancer in whole slide images. Sci Rep. 11 (1), 8894(2021).
- Rizzardi, A. E., et al. Quantitative comparison of immunohistochemical staining measured by digital image analysis versus pathologist visual scoring. Diagn Pathol. 7, 42(2012).
- Masuda, S., Nakanishi, Y. Application of immunohistochemistry in clinical practices as a standardized assay for breast cancer. Acta Histochem Cytochem. 56 (1), 1-8 (2023).
- Matsutani, S., et al. Tumor-infiltrating immune cells in H&E-stained sections of colorectal cancer tissue as a reasonable immunological biomarker. Anticancer Res. 38 (12), 6721-6727 (2018).
- Väyrynen, J. P., et al. Prognostic significance of immune cell populations identified by machine learning in colorectal cancer using routine hematoxylin and eosin-stained sections. Clin Cancer Res. 26 (16), 4326-4338 (2020).
- Zhou, G., et al. Clinical significance of tumor-infiltrating lymphocytes investigated using routine H&E slides in small cell lung cancer. Radiat Oncol. 17 (1), 127(2022).
- Horny, H. -P., Sotlar, K., Valent, P. Mastocytosis. Immunol Allergy Clin North Am. 34 (2), 315-321 (2014).
- Mi, H., Ho, W. J., Yarchoan, M., Popel, A. S. Multi-scale spatial analysis of the tumor microenvironment reveals features of cabozantinib and nivolumab efficacy in hepatocellular carcinoma. Front Immunol. 13, 892250(2022).
- de Ruiter, E. J., et al. Assessing the prognostic value of tumor-infiltrating CD57+ cells in advanced stage head and neck cancer using QuPath digital image analysis. Virchows Archiv. 481 (2), 223-231 (2022).
- Fanucci, K. A., et al. Image analysis-based tumor infiltrating lymphocytes measurement predicts breast cancer pathologic complete response in SWOG S0800 neoadjuvant chemotherapy trial. NPJ Breast Cancer. 9 (1), 38(2023).
- Acs, B., et al. Ki67 reproducibility using digital image analysis: an inter-platform and inter-operator study. Lab Invest. 99 (1), 107-117 (2019).
- Sobottka, B., et al. Establishing standardized immune phenotyping of metastatic melanoma by digital pathology. Lab Invest. 101 (12), 1561-1570 (2021).
- Moratin, J., et al. Digital pathology scoring of immunohistochemical staining reliably identifies prognostic markers and anatomical associations in a large cohort of oral cancers. Front Oncol. 11, 712944(2021).
- Bankhead, P., et al. Integrated tumor identification and automated scoring minimizes pathologist involvement and provides new insights to key biomarkers in breast cancer. Lab Invest. 98 (1), 15-26 (2018).
- Humphries, M. P., Maxwell, P., Salto-Tellez, M. QuPath: The global impact of an open source digital pathology system. Comput Struct Biotechnol J. 19, 852-859 (2021).
- Koh, J. H., et al. Liver resection versus liver transplantation for hepatocellular carcinoma within Milan criteria: a meta-analysis of 18,421 patients. Hepatobiliary Surg Nutr. 11 (1), 78-93 (2022).
- Eriksen, A. C., et al. Computer-assisted stereology and automated image analysis for quantification of tumor infiltrating lymphocytes in colon cancer. Diagn Pathol. 12 (1), 65(2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon