Method Article
肝細胞癌の微小環境における肥満細胞は予後良好をもたらす:QuPath画像解析ソフトウェアを使用したレトロスペクティブ研究
要約
切除後の肝細胞がんの内縁および腫瘍周囲領域に肥満細胞が存在することは、予後が良好である。この研究は、QuPath画像解析ソフトウェアが、デジタルパソロジーにおける再現性、一貫性、精度のニーズを満たす可能性のある有望なプラットフォームであることを支持しています。
要約
肝細胞がん(HCC)内の免疫細胞の in-situ 検出によって提供される洞察は、患者の転帰に関する情報を提示する可能性があります。腫瘍組織内での免疫細胞の発現と局在を調査する研究は、腫瘍領域の正確なアノテーションの欠如や顕微鏡的視野のランダムな選択など、いくつかの課題と関連しています。QuPathは、ホールスライド画像(WSI)解析におけるデジタルパソロジーのニーズの高まりに対応することができる、オープンソースのユーザーフレンドリーなソフトウェアです。
CD1a+未成熟樹状細胞(iDC)、CD117+肥満細胞、およびNKp46+ナチュラルキラー細胞(NK)細胞によるHCCおよび隣接組織への浸潤を、根治的切除を受けたHCC患者67人の代表標本において免疫組織化学的に評価した。陽性染色した細胞の面積分率(AF)は、腫瘍中心(TC)、内縁(IM)、外縁(OM)、および腫瘍周囲(PT)領域でQuPathを使用してWSIで自動的に評価されました。免疫細胞の予後的意義を、再発までの時間(TTR)、無病生存期間(DFS)、および全生存期間(OS)について評価した。
肥満細胞のAFはNKのAFよりも有意に高く、iDCのAFは各関心領域のNKと比較して有意に低かった。IMおよびPT領域の肥満細胞のAFが高いほど、DFSが長くなることが示された。さらに、IMにおける肥満細胞のAFが高いほど、OSが長くなることと関連していた。
このソフトウェアを使用したコンピューター支援解析は、切除後のHCCのさまざまな領域の腫瘍浸潤免疫細胞(iDC、肥満細胞、およびNK)の予後情報を取得するのに適したツールです。肥満細胞は、すべての関心領域(ROI)で最大のAFを示しました。腫瘍周囲領域およびIMの肥満細胞は、予後において良好な意義を示した。
概要
腫瘍浸潤免疫細胞の空間的組織と豊富さは、肝細胞がん(HCC)を含むさまざまながんの生存に影響を与えることが証明されています1,2,3,4。がんにおける腫瘍浸潤リンパ球の予後的意義は、ヘマトキシリンおよびエオシン(H&E)染色切片5,6で初めて示された。その後、免疫組織化学(IHC)を用いたGalonらによる先駆的な研究では、結腸がん組織におけるCD3+およびCD8+ T細胞の密度と予後との関連が示されました4。
IHCは、腫瘍組織内の免疫細胞を視覚化、定量化、マッピングし、臨床転帰とさらに関連づけるためのゴールドスタンダードです7。IHCには、低コスト、広範な入手可能性、ホルマリン固定パラフィン包埋(FFPE)組織との適合性など、いくつかの利点があります8。しかし、IHC染色された免疫細胞を正確に評価することは大きな課題です。選択した顕微鏡の視野での従来のスコアリングは時間がかかり、候補バイオマーカーの選択と信頼性の高い臨床相関に不可欠な高品質で再現性のある客観的な分析を確保するにはもはや十分ではありません9。ホールスライドスキャンは、画像全体として評価することも、サブサンプリング後に評価することもできる10。
組織サンプル中の免疫細胞の存在量のコンピュータ化された定量的評価により、実用的で、正確で、信頼性が高く、臨床的に関連性のあるデータを確保できます11。QuPathは、IHC染色スライドのデジタル画像解析を可能にし、個々のサンプルから得られる情報量を最大化する無料のオープンソースソフトウェアです12。
未熟樹状細胞 (iDC)、ナチュラルキラー (NK) 細胞、および肥満細胞は抗腫瘍免疫応答に関与しており、患者の転帰と相関することが示されているため 13,14,15、ここでは、FFPE HCC 組織におけるそれらの空間分布を評価し、予後への影響を調査するための段階的なプロトコルを示します。CD1aは主に未熟な樹状細胞の膜に発現し、その密度はさまざまなヒト腫瘍の臨床転帰と関連しています16,17。肥満細胞は、腫瘍微小環境(TME)18内で腫瘍形成型または抗腫瘍性の役割を果たすことができる。それらは血管新生をサポートし、転移を促進することができます19。逆に、肥満細胞はIL-420の産生を通じて腫瘍細胞のアポトーシスを媒介できることが報告されています。抗CD117染色は、腫瘍組織21内の肥満細胞を可視化し定量するために一般的に使用される。NK細胞は、がん細胞を殺傷することにより、HCC22の監視と制御に寄与すると考えられている23。NKによるNKp46の発現は、その抗腫瘍活性にとって重要なパラメータである24。しかし、NKp46+ NK細胞は、HCC患者の腫瘍径と正の相関を示した25。それにもかかわらず、それらが患者の生存率と相関していることについてはほとんど知られていません。
HCCのさまざまな領域におけるCD1a+ iDC、CD117+肥満細胞、およびNKp46+ NK細胞の存在量を定量的に評価し、それらの予後的意義を強調することを目指しました。病理学的にI-IV期のHCCと確認された患者で、BCLCガイドラインに従って切除に適格であり、1997年から2019年の間にピルゼン大学病院で治癒目的の肝切除を受けた合計70人の連続した患者が、現在の後ろ向き研究に含まれました。患者の病理報告がレビューされました。この研究に含まれた患者はいずれも遠隔転移を持たず、手術前に化学療法や放射線療法などのネオアジュバント療法を受けていませんでした。組織学的標本の質が悪い合計3人の患者を除外し、残りの67人の患者を研究に含めた(表1)。
プロトコル
この議定書は、ヘルシンキ宣言(2013年版)に定められた倫理基準に従って実施された研究の一部でした。これは、医学部の倫理委員会とピルゼンの大学病院によって承認されました(118/2021、2021年3月11日)。 図 1 は、採用された方法の概要を示しています。
1. FFPE組織ブロックの選定
- 治療を行う医師や病理医の助けを借りて、患者ファイルからFFPEブロック識別子を取得します。
- ローカルの病理アーカイブから FFPE ブロックをリクエストします。
- 各患者について、生存可能な腫瘍組織を含む 2 〜 3 個の FFPE ブロックを、周囲の腫瘍周囲領域および非腫瘍性肝臓に優先的に選択します。
注:この選択については、専門の病理医の意見を得ることをお勧めします。非腫瘍性肝臓の組織学的評価、既往歴のあるデータ、臨床データ、および検査データを用いて、HCCの根底にある病因を定義した。
2. FFPE組織の脱パラフィンと再水和
- ミクロトーム上の各FFPE組織ブロックから厚さ4 μmの組織切片を1つまたは2つ切り取ります。
注:切片の厚さは3μmから5μmの間で、目立った染色の影響はありません。ただし、厚さは4μmが目安です。 - 切片を水浴(42°C)に入れて、しわを取り除きます。
- スライドを持ち上げて、正に帯電したガラスの顕微鏡スライドに置いて取り付けます。次に、スライドを周囲温度(AT)で24時間乾燥させます。
- スライドをサーモスタット(56°C)に1時間置きます。
- 脱ロウ溶液-1(72°Cで30秒)、脱ロウ溶液-2(72°Cで10秒)、脱ロウ溶液-3(ATで10秒)、エタノール96%-1(10秒)、エタノール96%-2(10秒)、およびエタノール96%-3(10秒)中の切片を脱パラフィンするには、オートステイナーを使用します。
- オートステイナーを使用して、洗浄液-1(10秒、AT)、洗浄液-2(10秒、AT)、および洗浄液-3(5分、AT)の切片を再水和します。
3. 全自動ステイナーでのIHCの実施
注:IHCは、製造元のプロトコルに従って実行されます。手順について、以下で簡単に説明します。
- 抗原賦活化法
- 高pHのER溶液(Tris-EDTAなど)で、熱誘起エピトープ賦活化(ER)手順を使用して抗原を回収します:ER溶液-1(10秒、AT)、ER溶液-2(10秒、AT)、ER溶液-3(100°Cで20分)、ER溶液-4(12分、AT)。
- スライドを洗浄液で3回(各30秒)および1回(3分)すすぎます。
- 過酸化物ブロック溶液を使用して、ATで5分間内因性ペルオキシダーゼをブロックします。
- 洗浄液で3回(各30秒)すすぎます。
- NKp46のタンパク質ブロックによる抗体の非特異的結合をATで30分間のみブロックします。
- 一次抗体との結合:ATで一次抗体と15分間インキュベートした後、洗浄液で3回(各30秒)すすぎます。
- 二次抗体の結合については、以下の手順に従ってください。
- 西洋ワサビペルオキシダーゼ標識二次抗体とATで8分間インキュベートします。
- 洗浄液で2回(各2分)および脱イオン水で1回すすぎます。
- スライドをジアミノベンジジン(DAB)溶液ですすぎ、次にATでDAB溶液と10分間インキュベートすることにより、反応を視覚化します。
- 脱イオン水で3回(30秒)すすぎます。
- 切片をメイヤーのヘマトキシリンで対比染色します。
- 脱イオン水で1x(30秒)、洗浄液で1x(30秒)、脱イオン水で1x(30秒)ですすいでください。
- 全自動スライドステイナーを使用して、エタノール70%(2分)、エタノール80%(2分)、エタノール96%-1(3分)、エタノール96%-2(3分)、エタノール100%(3分)、キシレン-1(4分)、キシレン-2(4分)、キシレン-3(4分)で切片を脱水します。
- 全自動ガラスカバースリッパを使用して、スライド上のセクションを封入剤に取り付けます。
注:陰性および陽性(扁桃腺)組織対照サンプルを全体を通して使用しました。
4. ホールスライドスキャンの取得
- 20倍の対物レンズと中密度のホールスライドスキャナーに焦点を合わせて、染色されたスライドをスキャンします。
5. ソフトウェアによるIHC解析
- ソフトウェアでIHCイメージのプロジェクトを作成します。
- QuPath-0.4.3 (またはそれ以降) をダウンロードして開きます.exe
- 適切な名前で新しいフォルダを作成します。
- ソフトウェアの左上隅にある[ プロジェクトの作成 ]ボタンをクリックして、新しく作成したフォルダを選択します。
- スキャンした画像をソフトウェアウィンドウにドラッグします。新しいウィンドウが自動的に表示されたら、[ Set Image Type] > H-DAB を選択し、[ Import](インポート )をクリックします(図2)。
- メニューの左側のウィンドウにある画像のリストを確認します。ダブルクリックして画像を開きます。
- 上部の メインメニューから[ファイル ]を選択して、画像をプロジェクト として保存 します。
注:このソフトウェアは、多くのスライド全体形式を含む、幅広い画像形式を処理できます。ただし、生データと関連するメタデータの損失を防ぐために、tiff形式が推奨されます。
- 関心領域に注釈を付ける
- 上部のメインメニューから ブラシ ツールまたは ワンド ツールを選択して、腫瘍領域に注釈を付けます。腫瘍の不連続領域については、手順5.2.1.1〜5.2.1.3に従います。
- 個別に注釈を付けます。
- Ctrlキーを押しながら、すべての腫瘍領域を選択します
- 右クリックして [ Edit Multiple > Merge Selected] を選択します。
- 腫瘍の注釈が選択されていることを確認します (境界線は黄色です)。
- メインメニューの 「自動化 」をクリックし、「 スクリプトエディタを表示」を選択します。
- 補足ファイル 1 または https://petebankhead.github.io/qupath/scripts/2018/08/08/three-regions.htmls にあるスクリプトをコピーしてスクリプト エディタに貼り付け、[実行] をクリックします。ROI: 腫瘍中心 (TC)、内縁 (IM)、外縁 (OM)、および腫瘍周囲領域 (PT) が自動的に作成され、ラベル付けされます。
- 関心領域を作成する別の方法については、手順 5.2.5.1 から 5.2.5.5 に従います。
- 上部のメインメニューから ポリライン ツールを選択して、悪性細胞の巣と隣接する非腫瘍組織を分離する境界線を描きます。
- 結果の境界線を選択します。上部のメインメニューから [Objects (オブジェクト)] > [Annotation] (注釈) > [Expand annotation>s (拡張半径)] で 500 μm > [Line Cap (ライン キャップ)] で [Flat] を選択します。Remove Interiorをアクティブにし、Constrain to parentをアクティブにします。
- 結果の注釈 [ Edit Single > Split] を右クリックします。2つの別々の注釈は、境界線の両側に500 μm幅の領域として自動的に拡張されます。
- IM と OM に適した注釈付き領域に名前を付けるには、左側のリストで注釈を右クリックし、[ プロパティの設定] を選択して名前を入力します。
- TCは、残りの腫瘍領域を表します。OMに隣接する500μm幅のPT領域を同じ手順で拡張します。
注:注釈付きスライドとQuPath AF検出は、専門の組織病理学者によってレビューされました。
- 上部のメインメニューから ブラシ ツールまたは ワンド ツールを選択して、腫瘍領域に注釈を付けます。腫瘍の不連続領域については、手順5.2.1.1〜5.2.1.3に従います。
- ピクセル分類の最適化
- メインメニューから 長方形 ツールを選択します。次に、区別するすべてのタイプのピクセル(ヘマトキシリン、DAB、背景など)を含む領域に注釈を付けます。
- メインメニューから「 解析」>「前処理」>「染色ベクトルの推定」を選択します。
- Visual Stain Editorウィンドウが自動的にポップアップしたら、Auto > OKを選択し、染色ベクトルの名前としてH-DAB推定を設定します。
- 別の方法として、手順 5.3.4.1 から 5.3.4.3 に従います。
- メインメニューから 長方形 ツールを選択し、ヘマトキシリンで染色された一般的な核の小さな領域に注釈を付けます。
- 左側のメニューから [画像 ]を選択し、[ Stain 1]>[はい]をダブルクリックします。
- メインメニューから 長方形 ツールを選択し、DABで陽性染色の小さな領域に注釈を付けます。左側のメニューから [画像 ]を選択し、[ Stain 2]>[はい]をダブルクリックします。
- ピクセル分類オプションを使用した陽性免疫細胞の面積分率の評価。
- メイン メニューから [Classify] > [Pixel] 分類 > [Create thresholder] をクリックします。
- 解像度>チャネルに [高 ]を選択します :DAB>プレフィルター:ガウス>シグマ:0.5>(図3)しきい値:(0.2-0.3)> しきい値を超える:正>しきい値を下回る:負。
- リージョンで 「任意の注釈」を選択し、分類子の名前を入力して、「 Save > Measure」>「OK」>。 DAB 陽性セルが赤色に変わります (図 4)。
- 左側のメニューから結果をスプレッドシートにコピーします。
- または、上部のメインメニューで 「測定 」を開き、「 注釈測定値を表示」>「クリップボードにコピー」を選択して、結果をスプレッドシートに貼り付けます。
- 画像を閉じるには、[ マルチビュー] > [ビューアーを閉じる] >右クリックします。
注:定量化の前に、アーティファクトは排除されました。閾値は、弱い特異的陽性染色を有する各症例について調整した。アノテーションとピクセル分類の正確性は、最初にクロスチェックされ、次に上級の組織病理学者によってレビューされました。すべての解析はブラインド方式で行われました。ソフトウェアを使用したIHCの分析の詳細については、https://forum.image.sc/tag/QP をご覧ください。
6. 統計的手法とデータ分析
- 本試験のエンドポイントは、再発までの時間(TTR)、無病生存期間(DFS)、全生存期間(OS)でした。再燃または死亡しなかった患者は、最後の追跡調査で検閲されました。
注:連続的な非正規分布データは、中央値(最小-最大)で表されます。比率は生データ (パーセンテージ) で表されます。異なる関心領域(ROI)における免疫細胞の面積分率をFriedman ANOVAで比較し、続いてWilcoxonマッチドペア検定とBonferroni補正を行いました。ほとんどの変数がノンパラメトリック分布であるため、順序変数または量的変数のペア間の関連性を評価するためにスピアマン相関が使用されました。エンドポイントの個々の予測変数の予後値を決定するために、単変数とそれに続く多変数Cox回帰分析が実施されました。ハザード比(HR)を計算しました。HRは、低グループで1であるのに対し、組み合わされた中高グループでは相対リスクが示されていました。すべての生存推定値はKaplan-Meier法によって計算され、ログランク検定によってグループ間で比較されました。統計解析には、GraphPad Prism 9.0(GraphPad Software LLC)を使用しました。0.05<両側p値は統計的に有意であると考えられました。
結果
患者の人口統計と臨床的特徴を表1に示します。患者の年齢の中央値は69歳で、ほとんどが男性(77.6%)でした。HCCの病因に関しては、慢性非ウイルス性肝炎が最も頻繁な背景疾患であり、非アルコール性脂肪性肝炎(NASH)の有病率(23.9%)でした。背景疾患として肝硬変を患っていた患者はわずか15人(22.4%)でした。患者の過半数(68.7%)はTNM病期I.であった。より詳細な臨床および病理学的所見は、以前に発表された研究2,26に記載されています。
結果
直近の追跡調査では、29人(41.8%)の患者に腫瘍の再発が認められ、そのうち89.7%が局所再発、38人(56.7%)が死亡した。術後5年時点で、DFSの割合は33.2%、OSの割合は49.4%、無再発率(RFP)は48.7%であった(表2)。
さまざまな関心領域における免疫細胞の分布
CD117タンパク質は、主に丸みを帯びた細胞の細胞質膜に見出されました(図5A)。TCおよびIMでは、それらは主に間質および血管周囲腔に局在していました。OMおよびPT領域では、CD117+細胞が腫瘍嚢および血管周囲腔に観察された。
NKp46タンパク質は、主に丸みを帯びた細胞の細胞質膜に見られ、TCおよびIMの正弦波様空間内に存在し、間質と関連していました(図5B)。OMおよびPT領域では、NKp46+細胞が腫瘍巣の周囲のカプセルおよび門脈路の間質で観察されました。
CD1aタンパク質は、TCおよびIMに、主に間質の丸みを帯びた細胞(散在または凝集体)の細胞質膜、正弦波様空間の内部および境界に沿って見出されました(図5C)。PT領域では、CD1a+ DCが正弦波の内部および境界に沿って、および門脈管の胆道上皮内で観察されました。
肥満細胞のAFは、NKp46+細胞のAFよりも有意に高かった(p < 0.001)(図6)。各ROIのCD1a+ iDCは、肥満細胞およびNK細胞と比較して最も低いAFを示しました(p < 0.001)(図6〉。TCまたはIMのCD117+およびNKp46+細胞のAFは、PT領域およびOMのAFよりも有意に小さかった(p < 0.001〉(図6)。CD1a+細胞の場合、AFは領域間で有意差がありませんでした。
すべてのROI間の個々の免疫細胞の有意な関連を 表3に示します。 図7 は、異なる領域内の異なる免疫細胞間の有意な関連性のヒートマップを示しています。TCにおけるCD117+肥満細胞のAFは、TCおよびIMにおけるCD1aのAFと有意に相関していた。
臨床変数と病理変数の予後的価値
臨床変数および病理変数の中で、再発リスクが高いのは若年層のみであった(HR = 0.96、CI:0.93-0.99、p = 0.007)が、DFSおよびOSに関連する変数はなかった(表4)。
浸潤免疫細胞の予後値
IMにおけるCD117+肥満細胞の高AFは、DFS(HR = 0.48、CI:0.241〜0.935、p = 0.031)およびOS(HR = 0.34、CI:0.167〜0.703、p = 0.004)と関連していました(図8、 表5)。さらに、PT領域におけるCD117+肥満細胞の高AFは、より長いDFSと関連していた(HR=0.48、CI:0.247-0.945、p=0.034)(図8、 表5)。対照的に、iDC細胞とNK細胞のAFは、いずれの結果とも関連していなかった。内縁のCD117+肥満細胞は、TNMステージの調整後(表6)、DFS(HR = 0.46、CI:0.23-0.91、p = 0.027)およびOS(HR = 0.33、CI:0.16-0.68、p = 0.003)と有意な関連を保持していました。PT領域の肥満細胞についても、DFSとの関連も有意なままであった(HR=0.47、CI:0.24-0.93、p=0.029)(表6)。
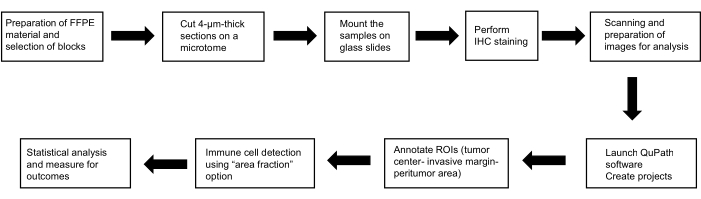
図1:メソッドの代表的な概略図。 HCCにおける肥満細胞、樹状細胞、およびナチュラルキラー細胞の予後的役割を特定するための作業の流れの概略図。略語:FFPE、ホルマリン固定パラフィン包埋;H&E、ヘマトキシリン、エオシン;ROI、関心領域。この図の拡大版を表示するには、ここをクリックしてください。
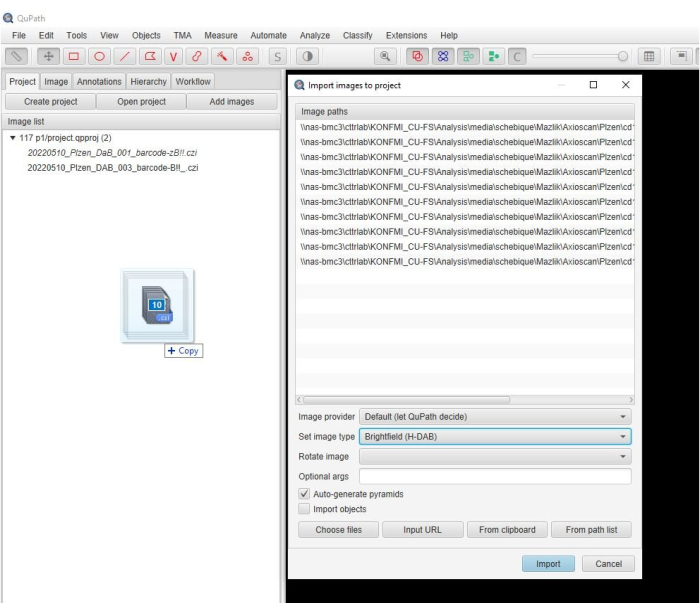
図2:ソフトウェアウィンドウのスクリーンショット。 ソフトウェアでプロジェクトに画像をインポートする手順を示す説明的なスクリーンショット。 この図の拡大版を表示するには、ここをクリックしてください。
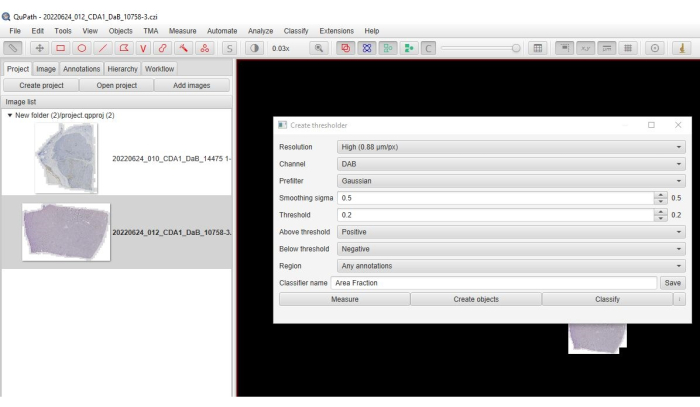
図3:面積分数のオプションのスクリーンショット。 陽性染色の面積分率を定量化するために選択したパラメータを示すソフトウェアのスクリーンショット。 この図の拡大版を表示するには、ここをクリックしてください。
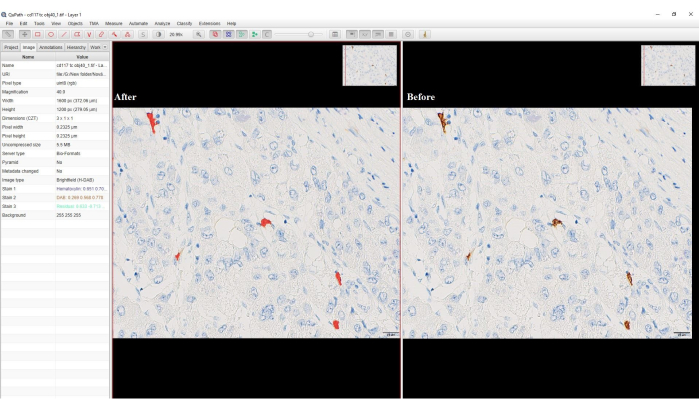
図4:ピクセル分類のオプションのスクリーンショット。 ピクセル分類前後のDAB陽性細胞を示すソフトウェアのスクリーンショット。茶色がかったDAB染色は、ピクセル分類後に赤色に変換されました。 この図の拡大版を表示するには、ここをクリックしてください。
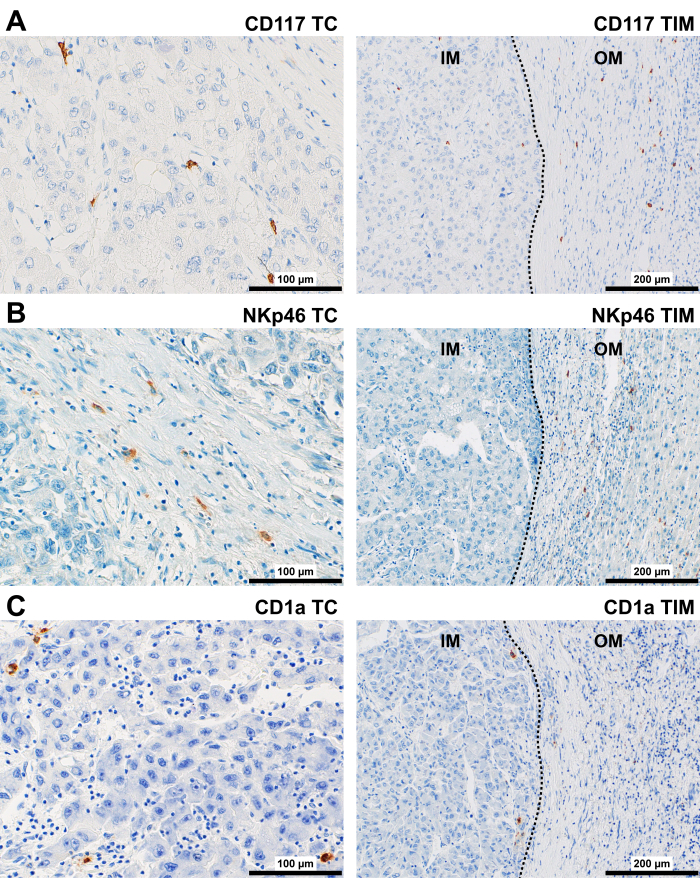
図5:HCC患者における自然免疫細胞の代表的な免疫染色。 HCCのTC(400x)およびTIM(200x)における(A)CD117+、(B)NKp46+、および(C)CD1a+細胞の代表的な免疫染色。略語:HCC、肝細胞癌;TC、腫瘍センター;TIM、腫瘍浸潤性断端、内縁 (IM) と外縁 (OM)。点線は、腫瘍と非腫瘍組織との間の境界を表します。 この図の拡大版を表示するには、ここをクリックしてください。
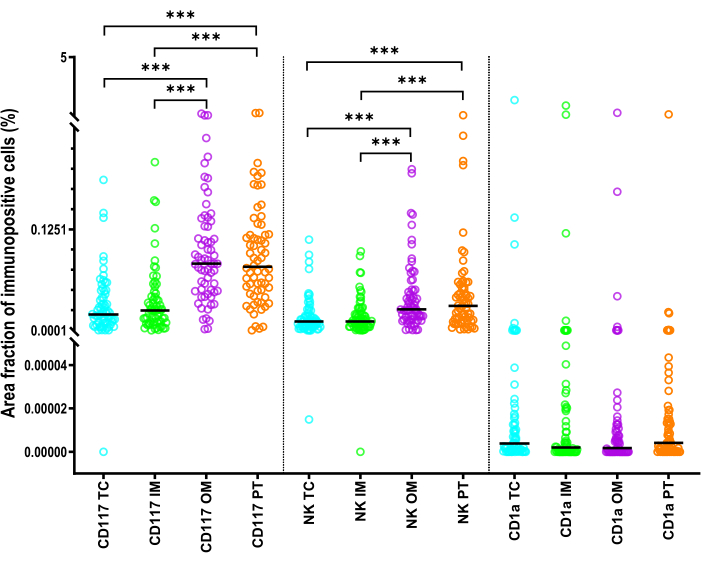
図6:HCC患者における自然免疫細胞の面積分率を説明する統計。 HCCのTC、IM、OM、およびPT領域におけるCD1a+樹状細胞、CD117+肥満細胞、およびNKp46+ NK細胞)の面積分率の統計。黒い線は中央値です。比較には、Bonferroni補正によるWilcoxonのマッチドペア検定を用いた。略語:HCC、肝細胞癌;TC、腫瘍センター;IM、内側のマージン。OM、外側のマージン;PT、腫瘍周囲領域。:p <0.001この 図の拡大版を表示するには、ここをクリックしてください。
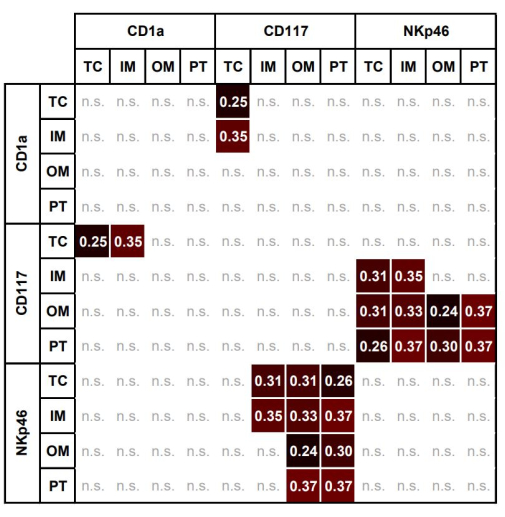
図7:異なる関心領域における肥満細胞、DC、およびNKの面積画分間の有意な相関のヒートマップ。 TC、IM、OM、およびPTにおけるCD117+肥満細胞、CD1a+ DC、およびNKp46+NKの面積画分間の有意な相関のヒートマップ(Spearman ρ, p < 0.05)。略語:TC、腫瘍中心;IM、内側のマージン。OM、外側のマージン;PT、腫瘍周囲領域;DC、樹状細胞;NK、ナチュラルキラー細胞。この図の拡大版を表示するには、ここをクリックしてください。
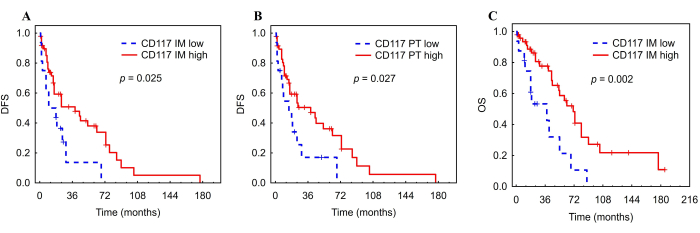
図8:HCC患者における腫瘍浸潤性肥満細胞のKaplan-MeierのDFSおよびOS曲線。 HCC の内縁 (A、C) および PT (B) の腫瘍浸潤性肥満細胞の低 AF と高 AF による DFS と OS の Kaplan-Meier 分析。略語:HCC、肝細胞癌;DFS、無病生存期間;IM、内部侵襲性;PT、腫瘍周囲領域。この図は、Ali et al.26の許可を得て改作されています。 この図の拡大版を表示するには、ここをクリックしてください。
表1:登録された肝細胞がん患者の臨床的背景。 肝細胞がんの登録症例の臨床的背景。略語:NAFLD、非アルコール性脂肪肝疾患。 この表をダウンロードするには、ここをクリックしてください。
表2:Kaplan-Meier分析の結果の推定確率。 Kaplan-Meier 分析における RFP、DFS、および OS の推定確率。略語:RFP、再発のない割合。DFS、無病生存期間;OS、全生存期間。 この表をダウンロードするには、ここをクリックしてください。
表3:腫瘍浸潤性肥満細胞、樹状細胞、および異なるROIにおけるナチュラルキラー細胞の面積分率間の相関。 腫瘍浸潤性肥満細胞、樹状細胞、および異なるROIにおけるナチュラルキラー細胞の面積分率間のスピアマン相関(ρ)、p < 0.038。略語:TC、腫瘍中心;IM、内側のマージン。OM、外側のマージン;PT、腫瘍周囲領域;ROI、関心領域。 この表をダウンロードするには、ここをクリックしてください。
表4:再発までの時間(TTR)、無病生存期間(DFS)、および全生存期間(OS)に関連する臨床変数および病理変数の単変量解析。 いいえ」、女性の性別、または「A」は、二分変数の参照カテゴリでした。太字の値は、p < 0.05 の水準での統計的有意性を示します。略語:HR、ハザード比;CI、信頼区間;TTR、再発までの時間。DFS、無病生存期間。 この表をダウンロードするには、ここをクリックしてください。
表5:Cox回帰(67人のHCC患者)を使用した、CD117 +肥満細胞、CD1a +樹状細胞、およびNKp46 +ナチュラルキラー細胞の面積画分とTTR、DFS、およびOSとの関連に関する単変量解析。 面積セクションあたりの免疫細胞の面積分率(mm2)をパーセンタイルに変換し、低(0〜25パーセンタイル)と高(25〜100パーセンタイル)に分類しました。ハザード比は、低AFの1と比較した相対リスクを示しています。太字の値は、p < 0.05 の水準での統計的有意性を示します。略語:AF、面積分数;DFS、無病生存期間;OS、全生存期間;HR、ハザード比。 この表をダウンロードするには、ここをクリックしてください。
表6:無病生存期間および全生存期間に関連する個々のROIあたりのCD117 +肥満細胞の面積分率(多変量解析)。 Cox回帰を用いたIMおよびPT領域におけるCD117+肥満細胞の面積分画とDFSおよびOSとの関連に関する多変量解析(67人のHCC患者)。面積セクションあたりの免疫細胞の面積分率(mm2)をパーセンタイルに変換し、低(0〜24パーセンタイル)と高(25〜100パーセンタイル)に分類しました。ハザード比は、低AFの1と比較した相対リスクを示しています。太字の値は、p > 0.05 の水準での統計的有意性を示します。略語:AF、面積分数;DFS、無病生存期間;OS、全生存期間;HR、ハザード比。 この表をダウンロードするには、ここをクリックしてください。
補足ファイル1:ROIを作成するためのスクリプト。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
TMEの in situ 免疫組織をモニタリングすることにより、免疫腫瘍学の分野は、新しいがんの予後および予測バイオマーカーを追加することができます。HCCのTMEにおける適応免疫細胞の役割に関する以前に発表された論文では、CD3+およびCD8+ T細胞、および選択したROIのCD20+ B細胞と再発までの時間に良好な予後関連が示されました2。ここでは、画像解析ソフトウェアQuPathを使用して、HCCのいくつかの異なる領域におけるCD1a+ iDC、CD117+肥満細胞、およびNKp46+ NK細胞の存在量を評価し、それらの予後的意義を評価しました。一部の自然免疫細胞は不規則な形状であるため、その定量化が不正確になる場合があります。これが、免疫陽性細胞の面積分率を評価することが最適な選択肢であった理由です。3つの細胞型のうち、CD117+肥満細胞のみが有意な予後的影響を示した:IMおよびPT領域における肥満細胞のAFが高いほど、生存期間が長くなることと関連していた。
肥満細胞はすべてのROIで最も豊富であり、腫瘍周囲領域および内縁におけるそれらのAFと良好な生存との関連は、肥満細胞の抗腫瘍の役割を反映しています。肥満細胞は、SCFやCCL15などの腫瘍細胞放出化学誘引物質によってTMEに引き寄せられることがあります18。肥満細胞は、腫瘍細胞に対する直接的な細胞毒性27、または腫瘍増殖を阻害する炎症誘発性サイトカインを分泌することにより、抗腫瘍応答に影響を与えることができる18。肥満細胞密度の増加は、前立腺癌28、胃癌27、および肝移植後のHCC29の再発に対して保護的であった。245人のHCC患者のより大きなコホートからなる包括的な調査では、腫瘍サンプルにおけるより顕著な肥満細胞浸潤と腫瘍切除後の生存期間の延長との間に正の相関が見つかりました30。Rohr-Udilova et al.は、周囲のHCC組織における肥満細胞の密度が高いという同様の結果を報告しました。しかし、腫瘍内肥満細胞密度のみが再発率の低下と関連していた29。
この研究では、肥満細胞はIMおよびPT肝臓のみで抗腫瘍効果を発揮しました。異なる腫瘍のTMEは、免疫細胞の空間分布に関して不均一である31。TMEにおける免疫細胞の予後的意義は、その空間分布にも大きく関連している32,33。腫瘍浸潤性縁に注釈を付けるための異なるアプローチが提案されており、これには、異なる幅4,34,35の全縁、内側および外側の縁、再び異なる幅36,37、PT2,7の有無が含まれる。我々は、International Immunooncology Biomarkers Working Groupの再現性のある標準化された方法論に従って、浸潤縁を悪性細胞巣を宿主組織から分離する境界を中心とした1 mm領域と定義し、中心腫瘍を残りの腫瘍領域として表した38。以前の研究で、内側と外側の侵襲性断端2 の結果に大きな違いがあることが強調されたため、これらの領域 (幅がそれぞれ 500 μm) は別々に分析されています。腫瘍周囲領域の空間免疫プロファイリングは、その明確な予測的重要性39,40 を持っているため、PT 領域も含まれていました。
TC、腫瘍縁、およびPT肝臓の分析は、それぞれの領域で選択された視野を評価するオプションとは対照的に、WSIで実施されました。ホールスライドイメージングは、潜在的に豊富なデータソースです41。サブサンプリングを行わなかったため、「真の期待値」は時間効率の良い方法で得られた10。さらに、このシステムは、ブロックごとに1つまたは2つのスライドしか分析されないため、パッチ選択42のバイアスを回避することができたため、合理的であった。この遅いワークフローは、以前の研究で免疫細胞の定量にステレオロジーを適用したときの課題でした2。
IHCは、肝臓組織におけるCD1a+ iDC、NKp46+NK、およびCD117+肥満細胞の発現の直接局在化、それらの分布の定量化、したがってコホートのサブ分類を可能にします。IHC分析は、可溶化組織における生化学的アッセイに比べてこの研究に重要な利点を与え、バイオマーカー陽性細胞がわずかしか存在せず43、免疫細胞の組織病理学的特徴に対する局所反応を反映していない場合に偽陰性の結果をもたらす可能性がある44。IHCは、H&E染色切片での分析よりも好ましいです。結腸直腸癌および小細胞肺癌に関する研究では、H&E染色切片の評価が頑健で定量的な腫瘍免疫バイオマーカーを提供できることが示されました45,46,47;ただし、特定のサブタイプの実際の存在を反映するための制限はまだ存在します。
高品質の組織切片とIHC染色は、正確な評価のための前提条件です。高いバックグラウンド、エッジアーチファクト、特異的ではあるが望ましくない染色(例えば、抗CD4抗体による肝洞腔の内皮細胞の染色)は、すべての結果を損なう可能性があります。CD56抗体は、現在の研究ではナチュラルキラー細胞を検出するための最初の選択肢でしたが、未熟な胆管でCD56が発現したため、NKp46抗体に置き換えられました。特異性、頑健な染色パターン、およびFFPEブロックの安定性の観点から最も適切なマーカーを選択することは、考慮すべき別の問題を表しています。例えば、トリプターゼの代わりにCD117が選ばれたのは、トリプターゼの発現が強くダウンレギュレーションされる可能性があり、さらに、CD117を発現しない細胞は肥満細胞ではないからである48。
QuPathは、ROIの境界を外部から滑らかにし、ROIの一部であってはならないアーティファクト、大きな血管、壊死組織、非特異的な染色、バックグラウンド、赤血球の凝集を除去するオプションを提供します。オペレーターはROIを選択し、それらのアーティファクトに注釈を付けながら「Alt」キーを押す必要があります。この研究では、非特異的染色は定量前にアーティファクトとして排除され、結果に影響を与えませんでした。特異的染色が体系的に低い場合やバックグラウンドが高い場合は、バイアスの可能性を避けるためにプロトコールを見直す必要があります。閾値は、弱い特異的陽性染色を有する各症例について調整した。日常的な使用の前に、プロトコルを最適化する必要があります。すべての分析はブラインド方式で行う必要があり、理想的には、しきい値の精度はクロスチェックに値します。
QuPathは、デジタルパソロジーおよびホールスライド画像解析9のための、ユーザーフレンドリーで直感的で拡張可能なオープンソースソリューションであり、HCC49およびさまざまながん50,51の画像解析について以前にテストされています。WSI用のソフトウェアの簡単な操作と、関心領域(腫瘍領域または腫瘍周囲領域など)の注釈オプションが主な利点です。
既存のスクリプト、変更されたスクリプト、または 新たに 作成されたスクリプトを適用すると、分析が大幅に高速化される可能性があります。ROIの注釈を作成するスクリプトが適用され、手動の線引きではなく、迅速かつ正確な地域セグメンテーションが可能になりました。スクリプトは固定されておらず、組織境界が不十分な領域については、500 μm未満のマージンに容易にカスタマイズできます。IM、OM、または PT エリアの幅は、 Automate > Show スクリプト エディター を使用してカスタマイズでき>、ライン 30 Double Expand Margin Microns = 500 μm を Run >使用可能な幅に適合させることで、スクリプト エディターカスタマイズできます。ROI は追加または削除することもできます。一般に、ソフトウェアのワークフローは固定されておらず、オペレーターは自由に開発および変更できます。
現在、CellProfiler、ImageJ、Fiji、Microscopy Image Browserなど、病理学的画像解析のための多数のソフトウェアツールが利用可能です。しかし、QuPathは、オープンソースアーキテクチャ、ユーザーフレンドリーなインターフェース、アルゴリズムのカスタマイズ機能、高度な機械学習ツールの統合など、一連の利点によって差別化されています。これらの機能を総合して、この画像解析ソフトウェアは、デジタルパソロジーの領域におけるがん組織の微妙な分析のための堅牢な選択肢として位置付けられています。
QuPathは、乳がんにおけるKi67発現の検出において、商用ソフトウェアのHALO(IndicaLab)およびQuantCenter(3DHistech)と比較して、最も低いばらつきを示しました52。また、このソフトウェアは、すべてのプロジェクトイメージに対してスクリプトを再現可能なバッチ処理方法で実行するように指示される可能性も備えています。
QuPathにより、順序(半定量的)データではなく、定量的な連続データを作成することができました。視覚的採点によって得られた序数データは、解釈の主観性、観察者間のばらつき、および再現性の低さによる問題に満ちている53。現在の解析の迅速性は、広範な組織病理学のバックグラウンドやプログラミングの専門知識を持たない個人が、アノテーションの精度が病理医によってチェックされていれば、自動解析を実行できるという事実によって改善されました。頭頸部腫瘍に関する研究では、CD57+ 腫瘍浸潤リンパ球50 の予後価値を迅速かつ再現性よく評価するための QuPath の適合性が実証されました。また、この研究では、人間の観察者とQuPathとの間には大きな一致があることが示されました。QuPathを用いた手動観察と評価との間に高い一致性が認められたのは、口腔がん54 および乳がん55でも認められた。前述の論文では、QuPathと2つの商用ソフトウェア製品(Definiens Tissue StudioおよびinForm)を使用した5つの臨床乳がんバイオマーカーのIHC定量と、病理医による手動スコアリングを比較しました。この調査を通じて、QuPathは一貫して最高のパフォーマンスを発揮し、セットアップと適用にかかる時間も最小であったため、ビジュアルモニタリングや商用ソフトウェアに代わる優れた将来の選択肢となることが示されました。生物医学画像解析用の最も有名なオープンソースソフトウェアであるImageJと比較しても、QuPathは大型WSI56の処理に優れています。
QuPathにはオープンなオンラインフォーラムがあり、ユーザーはデジタルパソロジーの方法に関する質問を投稿し、画像解析用ツールの開発をサポートする活発で熱心なコミュニティを紹介しています(https://forum.image.sc/tag/qupath)。
この研究で使用されたコホートは独特であり、肝切除に適格な患者のみを対象としていたため、HCCの一般集団を代表するものではなかった。一般に、HCC患者の少数派(20%-30%)は肝臓切除57の適格性がある。これは、このHCCの病因を持つ患者はおそらくChild-Pughスコアが高く、切除可能とは見なされなかったため、肝硬変が確認された患者が少なかった理由である可能性もあります。また、コホートはかなり小さく、ほとんどの患者がTNMの初期段階を持っていました。したがって、結果を他の集団に外挿することは注意して行う必要があります。
本研究では、樹状細胞のような不規則な形状の免疫細胞を正確にカウントすることが困難であることから、HCC微小環境における自然免疫細胞の存在量を、その心房細動の評価を通じて推定しています。一方、免疫細胞の面積分率は、通常、その密度と強く相関している58。免疫ペルオキシダーゼ標識は、抗原の局在、面積分画、またはそれを発現する細胞の密度に関するデータを提供しますが、染色の強度は抗原の量と非線形に関連します。したがって、IHCは特定のタンパク質の発現レベルを定量的に評価するために使用すべきではありません。この方法の精度は、セクションの厚さ、画像品質、およびピクセル分類で選択した解像度の均一性にも依存します。画像解析の結果は、検証し、慎重に扱う必要があります。単一のマーカーでは免疫細胞の複雑さを完全に捉えることはできないため、HCCの免疫TMEの信頼性の高い画像を取得するには、より多くのIHCマーカーとマルチプレックス染色が必要です。免疫細胞の表現型決定に単一のIHCマーカーのみを使用することは近似値であり、結果は慎重に解釈する必要があります。
QuPath画像解析ソフトウェアを使用してIHC染色スライドを評価することで、HCC患者の腫瘍および腫瘍周囲における局所iDC、肥満細胞、NKの分布と面積分率を評価し、予後との関係を解析することができました。HCCの内縁および腫瘍周囲肝臓における肥満細胞の豊富さは、DFSおよびOSの長期化と関連しており、これらの自然免疫細胞の抗腫瘍効果が強調されている。QuPathの分析ワークフローは、ユーザーフレンドリーで高速、使いやすく、便利なデフォルト設定と簡単なデータエクスポートを備えています。このソフトウェアは、デジタル画像解析の有望なプラットフォームとして承認されており、デジタルパソロジーにおける再現性、一貫性、精度のニーズを満たすことができます。
開示事項
開示すべき金銭的な利益相反はありません。
謝辞
カレル大学理学部Vinicna Microscopy Core FacilityのOndřej Šebesta氏のホールスライドスキャンへの貢献と、この研究のための計算リソースを提供してくれたプロジェクト「e-Infrastruktura CZ」(e-INFRA LM2018140)に感謝します。技術者のヤナ・ドソウディロワとヤン・ジャヴレックは、その優れた技術支援で高く評価されています。この研究は、欧州連合のHorizon 2020研究およびイノベーションプログラム(助成金番号856620)、チェコ共和国保健省の助成金AZV NU21-03-00506、およびCooperatioプログラム(外科分野)から資金提供を受けました。Vinicna Microscopy Core Facilityは、Czech-BioImagingの大規模RIプロジェクトLM2023050の共同出資を受けています。
資料
| Name | Company | Catalog Number | Comments |
| Anti-CD1a | Leica Biosystems | PA0235 | Identifier- immature dendritic cells; RTU, Protocol F, ER2/20 min |
| Anti-CD117 | Leica Biosystems | PA0007 | Identifier- mast cells; RTU, Protocol F, ER2/20 min |
| BOND Plus Microscope Slides | Leica Biosystems, Germany | S21.2113.A | |
| BOND RXm | Leica Biosystems | 49.1501 | Fully Automated IHC Stainer |
| Bond Aspirating Probe Cleaning Kit | Leica Biosystems | CS9100 | |
| Bond Dewax Solution | Leica Biosystems | AR9222 | |
| Bond Polymer Refine Detection Kit | Leica Biosystems | DS9800 | |
| BondTM Epitope Retrieval 2 | Leica Biosystems | AR9640 | |
| BondTM Primary Antibody Diluent | Leica Biosystems | AR9352 | |
| BondTM Wash Solution 10X Concentrate | Leica Biosystems | AR9590 | |
| Computer Specifications: Intel(R) Core(TM) i5-10500 CPU @ 3.10GHz 3.10 GHz Installed RAM: 128 G | Intel | A 64-bit operating system that has Windows 7. Any computer with Java-based operating system and Excel available | |
| Coverslips | Leica Biosystems, Germany | 14071135636 | |
| CV Mount | Leica Biosystems, Germany | 14046430011 | |
| CV5030 Fully Automated Glass Coverslipper | Leica Biosystems | 149CVTS5025 | |
| Drying Oven UN30 | Memmert GmbH | UN30 | |
| GraphPad Prism 9.0 | GraphPad Software LLC | Version 12 | |
| Human NKp46/NCR1 Antibody, Monoclonal Mouse IgG2B Clone # 195314 | R&D Systems, Inc., United States | MAB1850 | Identifier- natural killer cells; Dilution 1:150, Protocol F + BLOK, ER2/20 min |
| Leica HI1210 - Water Bath | Leica Biosystems | 14041521466 | |
| Protein Block | Agilent Dako, United States | X0909 | |
| QuPath 0.3.2 or higher versions | version (QuPath v.0.3.2) | ||
| RM2235 Rotary Microtome | Leica Biosystems | 149AUTO00C1 | |
| ST5020 Multistainer Slide Stainer | Leica Biosystems | DEV-ST5010-CV5030 | |
| Statistica | StatSoft Inc. | version 7 | |
| Zeiss Axio Scan.Z1 | ScienceServices GmbH, Germany | 430038-9000-000 | Slide scanner |
参考文献
- Du, M., Yin, Y. L., Xiao, L., Cai, Y. M., Ji, Y. Evaluating tumor-infiltrating lymphocytes in hepatocellular carcinoma using hematoxylin and eosin-stained tumor sections. World J Clin Cases. 10 (3), 856-869 (2022).
- Trailin, A., et al. T-and B-cells in the inner invasive margin of hepatocellular carcinoma after resection associate with favorable prognosis. Cancers (Basel). 14 (3), 604(2022).
- Xiao, N., et al. CD74+ macrophages are associated with favorable prognosis and immune contexture in hepatocellular carcinoma. Cancer Immunol Immunother. 71 (1), 57-69 (2022).
- Galon, J., et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science. 313 (5795), 1960-1964 (2006).
- Roxburgh, C. S. D., Salmond, J. M., Horgan, P. G., Oien, K. A., McMillan, D. C. Tumour inflammatory infiltrate predicts survival following curative resection for node-negative colorectal cancer. Eur J Cancer. 45 (12), 2138-2145 (2009).
- Klintrup, K., et al. Inflammation and prognosis in colorectal cancer. Eur J Cancer. 41 (17), 2645-2654 (2005).
- Kather, J. N., et al. Topography of cancer-associated immune cells in human solid tumors. Elife. 7, e36967(2018).
- Cho, J. Basic immunohistochemistry for lymphoma diagnosis. Blood Res. 57 (S1), 55-61 (2022).
- Bankhead, P., et al. QuPath: Open source software for digital pathology image analysis. Sci Rep. 7 (1), 16878(2017).
- Kolinko, Y., et al. Using virtual microscopy for the development of sampling strategies in quantitative histology and design-based stereology. Anat Histol Embryol. 51 (1), 3-22 (2022).
- Rodrigues, A., et al. Computer-assisted tumor grading, validation of PD-L1 scoring, and quantification of CD8-positive immune cell density in urothelial carcinoma, a visual guide for pathologists using QuPath. Surg Exp Pathol. 5, 12(2022).
- Hein, A. L., et al. QuPath digital immunohistochemical analysis of placental tissue. J Pathol Inform. 12, 40(2021).
- Lichterman, J. N., Reddy, S. M. Mast cells: A new frontier for cancer immunotherapy. Cells. 10 (6), 1270(2021).
- Veglia, F., Gabrilovich, D. I. Dendritic cells in cancer: the role revisited. Curr Opin Immunol. 45, 43-51 (2017).
- Wu, S. -Y., Fu, T., Jiang, Y. -Z., Shao, Z. -M. Natural killer cells in cancer biology and therapy. Mol Cancer. 19 (1), 120(2020).
- Kai, K., et al. Immunohistochemical analysis of the aggregation of CD1a-positive dendritic cells in resected specimens and its association with surgical outcomes for patients with gallbladder cancer. Transl Oncol. 14 (1), 100923(2021).
- Minesaki, A., Kai, K., Kuratomi, Y., Aishima, S. Infiltration of CD1a-positive dendritic cells in advanced laryngeal cancer correlates with unfavorable outcomes post-laryngectomy. BMC Cancer. 21 (1), 973(2021).
- Komi, D. E. A., Redegeld, F. A. Role of mast cells in shaping the tumor microenvironment. Clin Rev Allergy Immunol. 58 (3), 313-325 (2020).
- Maltby, S., Khazaie, K., McNagny, K. M. Mast cells in tumor growth: Angiogenesis, tissue remodelling and immune-modulation. Biochim Biophys Acta. 1796 (1), 19-26 (2009).
- Gooch, J. L., Lee, A. V., Yee, D. Interleukin 4 inhibits growth and induces apoptosis in human breast cancer cells. Cancer Res. 58 (18), 4199-4205 (1998).
- Brockmeyer, P., et al. High mast cell density indicates a longer overall survival in oral squamous cell carcinoma. Sci Rep. 7 (1), 14677(2017).
- Lee, H. A., et al. Natural killer cell activity is a risk factor for the recurrence risk after curative treatment of hepatocellular carcinoma. BMC Gastroenterol. 21 (1), 258(2021).
- Shimasaki, N., Jain, A., Campana, D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 19 (3), 200-218 (2020).
- Barrow, A. D., Martin, C. J., Colonna, M. The natural cytotoxicity receptors in health and disease. Front Immunol. 10, 909(2019).
- Guan, X., et al. Tumor-associated NK cells facilitate tumor growth via NKp46 in immunocompetent murine hepatocellular carcinoma. Immunol Lett. 258, 8-19 (2023).
- Ali, E., et al. Prognostic role of macrophages and mast cells in the microenvironment of hepatocellular carcinoma after resection. BMC Cancer. 24 (1), 142(2024).
- Lin, C., et al. Tryptase expression as a prognostic marker in patients with resected gastric cancer. Br J Surg. 104 (8), 1037-1044 (2017).
- Hempel, H. A., et al. Low intratumoral mast cells are associated with a higher risk of prostate cancer recurrence. Prostate. 77 (4), 412-424 (2017).
- Rohr-Udilova, N., et al. Morphometric analysis of mast cells in tumor predicts recurrence of hepatocellular carcinoma after liver transplantation. Hepatol Commun. 5 (11), 1939-1952 (2021).
- Lin, S. Z., et al. Prediction of recurrence and survival in hepatocellular carcinoma based on two cox models mainly determined by FoxP3+ regulatory T cells. Cancer Prev Res. 6 (6), 594-602 (2013).
- Jia, Q., Wang, A., Yuan, Y., Zhu, B., Long, H. Heterogeneity of the tumor immune microenvironment and its clinical relevance. Exp Hematol Oncol. 11 (1), 24(2022).
- Pyo, J. -S., Son, B. K., Lee, H. Y., Oh, I. H., Chung, K. H. Prognostic implications of intratumoral and peritumoral infiltrating lymphocytes in pancreatic ductal adenocarcinoma. Curr Oncol. 28 (6), 4367-4376 (2021).
- Yusa, T., et al. Survival impact of immune cells infiltrating peritumoral area of hepatocellular carcinoma. Cancer Sci. 113 (12), 4048-4058 (2022).
- Halama, N., et al. Localization and density of immune cells in the invasive margin of human colorectal cancer liver metastases are prognostic for response to chemotherapy. Cancer Res. 71 (17), 5670-5677 (2011).
- Zwing, N., et al. Analysis of spatial organization of suppressive myeloid cells and effector T cells in colorectal cancer-A potential tool for discovering prognostic biomarkers in clinical research. Front Immunol. 11, 550250(2020).
- Soeratram, T. T. D., et al. Prognostic value of T-cell density in the tumor center and outer margins in gastric cancer. Mod Pathol. 36 (9), 100218(2023).
- Gonzàlez-Farré, M., et al. Characterization and spatial distribution of the immune cell infiltrate in triple-negative breast cancer: a novel classification based on plasma cells and CD8+ T cells. Hum Pathol. 139, 91-105 (2023).
- Hendry, S., et al. Assessing tumor-infiltrating lymphocytes in solid tumors: A practical review for pathologists and proposal for a standardized method from the International Immunooncology Biomarkers Working Group: Part 1: Assessing the host immune response, TILs in invasive breast carcinoma and ductal carcinoma in situ, metastatic tumor deposits and areas for further research. Adv Anat Pathol. 24 (5), 235-251 (2017).
- Brück, O., et al. Spatial immunoprofiling of the intratumoral and peritumoral tissue of renal cell carcinoma patients. Mod Pathol. 34 (12), 2229-2241 (2021).
- Knebel, M., et al. Prognostic impact of intra- and peritumoral immune cell subpopulations in head and neck squamous cell carcinomas - comprehensive analysis of the TCGA-HNSC cohort and immunohistochemical validation on 101 patients. Front Immunol. 14, 1172768(2023).
- Lee, S., et al. Interactive classification of whole-slide imaging data for cancer researchers. Cancer Res. 81 (4), 1171-1177 (2021).
- Ciga, O., et al. Overcoming the limitations of patch-based learning to detect cancer in whole slide images. Sci Rep. 11 (1), 8894(2021).
- Rizzardi, A. E., et al. Quantitative comparison of immunohistochemical staining measured by digital image analysis versus pathologist visual scoring. Diagn Pathol. 7, 42(2012).
- Masuda, S., Nakanishi, Y. Application of immunohistochemistry in clinical practices as a standardized assay for breast cancer. Acta Histochem Cytochem. 56 (1), 1-8 (2023).
- Matsutani, S., et al. Tumor-infiltrating immune cells in H&E-stained sections of colorectal cancer tissue as a reasonable immunological biomarker. Anticancer Res. 38 (12), 6721-6727 (2018).
- Väyrynen, J. P., et al. Prognostic significance of immune cell populations identified by machine learning in colorectal cancer using routine hematoxylin and eosin-stained sections. Clin Cancer Res. 26 (16), 4326-4338 (2020).
- Zhou, G., et al. Clinical significance of tumor-infiltrating lymphocytes investigated using routine H&E slides in small cell lung cancer. Radiat Oncol. 17 (1), 127(2022).
- Horny, H. -P., Sotlar, K., Valent, P. Mastocytosis. Immunol Allergy Clin North Am. 34 (2), 315-321 (2014).
- Mi, H., Ho, W. J., Yarchoan, M., Popel, A. S. Multi-scale spatial analysis of the tumor microenvironment reveals features of cabozantinib and nivolumab efficacy in hepatocellular carcinoma. Front Immunol. 13, 892250(2022).
- de Ruiter, E. J., et al. Assessing the prognostic value of tumor-infiltrating CD57+ cells in advanced stage head and neck cancer using QuPath digital image analysis. Virchows Archiv. 481 (2), 223-231 (2022).
- Fanucci, K. A., et al. Image analysis-based tumor infiltrating lymphocytes measurement predicts breast cancer pathologic complete response in SWOG S0800 neoadjuvant chemotherapy trial. NPJ Breast Cancer. 9 (1), 38(2023).
- Acs, B., et al. Ki67 reproducibility using digital image analysis: an inter-platform and inter-operator study. Lab Invest. 99 (1), 107-117 (2019).
- Sobottka, B., et al. Establishing standardized immune phenotyping of metastatic melanoma by digital pathology. Lab Invest. 101 (12), 1561-1570 (2021).
- Moratin, J., et al. Digital pathology scoring of immunohistochemical staining reliably identifies prognostic markers and anatomical associations in a large cohort of oral cancers. Front Oncol. 11, 712944(2021).
- Bankhead, P., et al. Integrated tumor identification and automated scoring minimizes pathologist involvement and provides new insights to key biomarkers in breast cancer. Lab Invest. 98 (1), 15-26 (2018).
- Humphries, M. P., Maxwell, P., Salto-Tellez, M. QuPath: The global impact of an open source digital pathology system. Comput Struct Biotechnol J. 19, 852-859 (2021).
- Koh, J. H., et al. Liver resection versus liver transplantation for hepatocellular carcinoma within Milan criteria: a meta-analysis of 18,421 patients. Hepatobiliary Surg Nutr. 11 (1), 78-93 (2022).
- Eriksen, A. C., et al. Computer-assisted stereology and automated image analysis for quantification of tumor infiltrating lymphocytes in colon cancer. Diagn Pathol. 12 (1), 65(2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved