Method Article
القياس الكمي لموت الخلايا الناجم عن السيتوكين في عضويات القولون البشري باستخدام الفحص المجهري الفلوري الحي
In This Article
Summary
يصف هذا البروتوكول طريقة بسيطة وفعالة من حيث التكلفة للتحقيق في موت الخلايا وقياسه في عضويات القولون البشرية استجابة للاضطرابات السامة للخلايا مثل السيتوكينات. يستخدم هذا النهج صبغة موت الخلايا الفلورية (SYTOX Green Nucleic Acid Stain) ، والمجهر الفلوري الحي ، وبرنامج تحليل الصور مفتوح المصدر لتحديد الاستجابات العضوية المفردة للمنبهات السامة للخلايا.
Abstract
يزداد موت الخلايا الظهارية المعوية (IEC) في المرضى الذين يعانون من أمراض الأمعاء الالتهابية (IBD) مثل التهاب القولون التقرحي (UC) ومرض كرون (CD). هذا يمكن أن يسهم في عيوب في وظيفة الحاجز المعوي ، وتفاقم الالتهاب ، والتسبب المناعي للمرض. السيتوكينات وروابط مستقبلات الموت مسؤولة جزئيا عن هذه الزيادة في وفيات IEC. السيتوكينات ذات الصلة ب IBD ، مثل TNF-α و IFN-γ ، سامة للخلايا ل IECs بشكل مستقل ومجتمعة. يصف هذا البروتوكول مقايسة بسيطة وعملية لتحديد السمية الخلوية التي يسببها السيتوكين في عضويات القولون المشتقة من المريض باستخدام صبغة موت الخلايا الفلورية (SYTOX Green Nucleic Acid Stain) ، والمجهر الفلوري الحي ، وبرنامج تحليل الصور مفتوح المصدر. نوضح أيضا كيفية استخدام النموذج الرياضي لاستقلال Bliss لحساب معامل تفاعل الاضطراب (CPI) بناء على السمية الخلوية العضوية. يمكن استخدام مؤشر أسعار المستهلك لتحديد ما إذا كانت التفاعلات بين مجموعات السيتوكين أو أنواع أخرى من الاضطرابات معادية أو مضافة أو تآزرية. يمكن تنفيذ هذا البروتوكول للتحقيق في النشاط السام للخلايا للسيتوكينات وغيرها من الاضطرابات باستخدام عضويات القولون المشتقة من المريض.
Introduction
تخلق ظهارة الأمعاء حاجزا ماديا شبه نافذ بين محتويات تجويف الأمعاء والأنسجة الكامنة. للحفاظ على هذا الحاجز بشكل فعال ، تخضع الخلايا الظهارية المعوية (IECs) لدوران خلوي مرتفع للغاية ، مع دورة مستمرة من موت الخلايا وتجديدها. ومع ذلك ، أثناء الاضطرابات الالتهابية ، مثل مرض التهاب الأمعاء (IBD) ، تحدث مستويات أعلى من موت الخلايا الشاذة1. هذا قد يعزز انهيار وظيفة الحاجز وتنشيط الجهاز المناعي ، مما يؤدي إلى مزيد من الالتهاب. في مرض كرون (CD) ، وهو شكل من أشكال مرض التهاب الأمعاء ، فقد ثبت أن إشارات السيتوكين تساهم في زيادة مستويات وفاة IEC2. من خلال دراسة كيفية تسبب إشارات السيتوكين في موت الخلايا في IECs ، من المأمول أن يتم تطوير علاجات محسنة للمرضى الذين يعانون من مرض التهاب الأمعاء والاضطرابات الالتهابية المعوية الأخرى1.
في علم الأحياء وأبحاث اكتشاف هدف الدواء ، من المفهوم عموما أن التآزر يحدث عندما يظهر نظام بيولوجي معالج بمجموعات من المحفزات الفردية استجابة للتركيبة أكبر من التأثيرات المضافة المشتركة للمحفزات الفردية وحدها. تم توثيق التفاعلات التآزرية بين السيتوكينات بشكل جيد في قيادة الاستجابات الفطرية المضادة للفيروسات3. من المعروف أيضا أن السيتوكينات تحفز موت الخلايا بشكل تآزري ، بما في ذلك فيIECs 4. ومع ذلك ، فإن الدور الذي تلعبه إشارات السيتوكين السامة للخلايا التآزرية في الاضطرابات الالتهابية المعوية مثل مرض التهاب الأمعاء غير مدروس.
العضويات المعوية البشرية هي الأنسجة الدقيقة 3D المنتجة في المختبر التي يتم إنشاؤها من الخلايا الجذعية الظهارية المعوية. يمكن زراعة العضويات المعوية من خزعات الغشاء المخاطي في الأمعاء التي تم الحصول عليها من المرضى الذين يعانون من مرض التهاب الأمعاء والاحتفاظ بالعديد من خصائص المرض 5,6. أثبتت المواد العضوية أنها نظام نموذجي مثالي لدراسة السمية الخلوية للسيتوكين في سياق التهاب الأمعاء 7,8. في السابق ، وصفت مجموعتنا تأثيرات القتل التآزرية للسيتوكينات ذات الصلة ب IBD IFN-γ و TNF-α في عضويات القولون المشتقة من المريض CD (colonoids) 9,10. ومع ذلك ، فإن الآليات الدقيقة التي ينطوي عليها التوسط في هذا الشكل من موت الخلايا التآزري لا تزال بعيدة المنال. هناك أيضا العديد من تفاعلات السيتوكينات السامة للخلايا غير المميزة ذات الصلة بالاضطرابات الالتهابية المعوية.
تتوفر العديد من البروتوكولات لدراسة موت الخلايا في الكائنات العضوية المعوية10،11،12،13 ؛ ومع ذلك ، لكل منهم عيوب. بعض هذه التقنيات تقيس فقط صلاحية الخلية ولا تقيس موت الخلايا مباشرة ، أو غير قادرة على تقييم استجابات العضو الواحد ، أو تتطلب معدات باهظة الثمن وبروتوكولات معقدة. هناك حاجة إلى منهجيات قوية ومباشرة لتحديد موت الخلايا العضوية وتفاعلات الاضطراب في الكائنات العضوية المعوية. البروتوكول الذي نقدمه هو نهج بسيط وغير مكلف لقياس استجابات العضو الواحد للسيتوكينات السامة للخلايا ولكن يمكن استخدامه لأي نوع من التحفيز أو الاضطرابات. نوضح أيضا كيفية استخدام نموذج تآزر استقلال Bliss لحساب معامل تفاعل الاضطراب (CPI) الذي يصف تفاعلات السيتوكين السامة للخلايا.
Protocol
تم جمع خزعات الغشاء المخاطي للقولون من المرضى الذين يعانون من CD الذين يخضعون لتنظير القولون الروتيني كجزء من معيار الرعاية. تم الحصول على الموافقة الأخلاقية لاستخدام عينات أنسجة المريض وتوليد خطوط عضوية القولون من هذه العينات من لجنة أخلاقيات البحوث السريرية في مستشفيات كورك التعليمية (CREC). تم الحصول على موافقة خطية مستنيرة من جميع المرضى بالاتفاق مع إعلان هلسنكي. يجب إجراء جميع أعمال زراعة الأنسجة مع خزعات المريض والقولون داخل خزانة السلامة الحيوية وفقا لبروتوكولات السلامة BSL2. تأكد من أن جميع الملابس البلاستيكية معقمة قبل الاستخدام. راجع جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد والكواشف والأدوات والبرامج المستخدمة في هذا البروتوكول.
تم تكييف البروتوكولات التي تستخدمها مجموعتنا لعزل القبو وثقافة الأعضاء من الطرق المعمول بها14،15،16 وتم نشرها سابقا9،10،17. بالنسبة للبروتوكول التالي ، تم استزراع القولون باستخدام وسائط انتشار الكائنات العضوية (الجدول 1). القولون المزروع باستخدام وسائط الانتشار العضوي غير متمايز وغني للخلايا الجذعية القولونية. المكون الأساسي لوسائط الانتشار العضوي هو 50٪ وسائط مكيفة L-WRN ، والتي تحتوي على عوامل نمو الخلايا الجذعية المعوية Wnt-3A (W) و R-spondin 3 (R) و Noggin (N) 15. يتم تحضير وسائط الانتشار العضوية من خلال الجمع بين الوسائط المكيفة L-WRN والوسائط الخالية من المصل 1: 1 ، تليها مكملات النيكوتيناميد والمثبطات الكيميائية (الجدول 1).
1. عزل سرداب القولون وثقافة القولون
- احتضان صفيحة عيار 48 بئرا عند 37 درجة مئوية ، 5٪ CO2 لمدة لا تقل عن 72 ساعة قبل البذر بالخبايا.
ملاحظة: يؤدي الاحتضان المسبق للوحة إلى تسريع بلمرة مستخلص الغشاء القاعدي (BME) أثناء البذر. - قم بإذابة BME على الجليد عند 4 درجات مئوية في المساء قبل عزل الخبايا.
- اجمع خزعات القولون في أنبوب لجمع العينات يحتوي على 15 مل من وسط جمع الخزعة (الجدول 1) واحفظه في درجة حرارة 4 درجات مئوية حتى يصبح جاهزا للمعالجة.
- قم بإزالة أكبر قدر ممكن من وسيط جمع الخزعة بعناية باستخدام ماصة. اغسل الخزعات بإضافة 15 مل من DPBS المثلج المكمل ب 2.5 ميكروغرام / مل أمفوتريسين B و 100 ميكروغرام / مل جنتاميسين إلى أنبوب العينة. رج أنبوب العينة بقوة لفصل أي مخاط أو حطام عن الخزعات. دع الخزعات تستقر عن طريق الجاذبية وقم بإزالة أكبر قدر ممكن من DPBS بعناية باستخدام ماصة.
- كرر إجراء الغسيل من الخطوة 1.4 مرتين (2x).
- أضف 10 مل من كاشف تفكك الخلايا الخالية من الإنزيم المكمل ب 2.5 ميكروغرام / مل أمفوتريسين B و 200 ميكروغرام / مل جنتاميسين إلى أنبوب العينة واحتضانها لمدة 15 دقيقة في درجة حرارة الغرفة مع التأرجح عند 30 دورة في الدقيقة.
- بعد الحضانة ، هز أنبوب العينة من جانب إلى آخر باليد بقوة لتحرير خبايا القولون. افحص الأنبوب باستخدام مجهر ضوئي منخفض الطاقة وابحث عن الخبايا التي تم إطلاقها وشظايا القبو في التعليق. إذا لم يكن مرئيا ، هز الأنبوب وتحقق مرة أخرى ؛ كرر حتى يتم رؤية الخبايا في التعليق.
- قم بتوصيل مصفاة خلية 70 ميكرومتر بأنبوب سعة 50 مل وقم بتصفية تعليق القبو من خلال المصفاة. أضف 10 مل من وسائط الغسيل العضوي المثلج (الجدول 1) إلى أنبوب العينة الفارغ ، وقم بإزالة الوسائط ، وقم بتمريرها عبر مصفاة الخلية.
- انقل الخبايا المفلترة إلى أنبوبين سعة 15 مل (10 مل لكل أنبوب) وأجهزة طرد مركزي عند 4 درجات مئوية لمدة 5 دقائق عند 150 × جم.
- قم بإزالة المادة الطافية بعناية من كل أنبوب سعة 15 مل ، وأعد تعليق كريات القبو في 500 ميكرولتر من وسائط الغسيل العضوية الباردة ، وانقل محلول القبو من كل من أنابيب 15 مل إلى أنبوب طرد مركزي واحد سعة 1.5 مل ، وأجهزة الطرد المركزي عند 4 درجات مئوية لمدة 3 دقائق عند 400 × جم.
- قم بإزالة المادة الطافية بعناية من أنبوب الطرد المركزي الدقيق وأعد تعليق حبيبات القبو في 70 ميكرولتر من BME (20 ميكرولتر لكل بئر و 10 ميكرولتر من الحجم الميت الإضافي).
- باستخدام الصفيحة المحتضنة مسبقا المكونة من 48 بئرا (الخطوة 1.1) ، بذرة 20 ميكرولتر من تعليق BME / سرداب في وسط كل بئر (قبة BME واحدة لكل بئر). اقلب اللوحة بسلاسة وثبات واحتضانها عند 37 درجة مئوية ، 5٪ CO2 لمدة 20 دقيقة.
ملاحظة: يمنع قلب اللوحة الخلايا من الالتصاق بالسطح البلاستيكي للبئر ويضمن توزيعها داخل BME. - إزالة لوحة من الحاضنة. تأكد من بلمرة BME بالكامل ثم قم بتراكب القباب ب 350 ميكرولتر من وسائط الانتشار العضوية المسخنة مسبقا مع 100 ميكروغرام / مل من كاشف مضاد للميكروبات واسع النطاق. احتضان اللوحة عند 37 درجة مئوية ، 5٪ CO2.
ملاحظة: الكاشف المضاد للميكروبات واسع النطاق هو منع التلوث من الميكروبات المخاطية المرتبطة بخزعات القولون. مطلوب فقط للأسبوع الأول من الثقافة بعد عزل القبو. - تغيير الوسائط 2-3x في الأسبوع باستخدام وسائط انتشار المواد العضوية الدافئة مسبقا ، مع استكمال الكاشف المضاد للميكروبات واسع النطاق للأسبوع الأول من الثقافة ؛ بعد هذه الفترة ، قم بإزالة الكاشف.
- بمجرد إنشاء ثقافة القولون بالكامل (1-2 أسابيع بعد العزل) ، قم بفصل القولون باستخدام كاشف التفكك الأنزيمي المكمل ب 10 ميكرومتر من مثبط ROCK-I / II Y-27632 (انظر القسم 2 للحصول على تفاصيل كاملة حول تفكك القولون).
ملاحظة: بالنسبة للمقطعين الأولين (P0-1 ، P1-2) ، يجب توسيع القولون باستخدام نسبة 1: 1 / 2 ؛ بعد P2 ، يمكن تمرير القولون باستخدام نسبة 1: 3 / 4. - قم بزرع وصيانة القولون باتباع الخطوات 1.11-1.13 (لا تكمل وسائط انتشار الكائنات العضوية بكاشف مضاد للميكروبات واسع النطاق).
2. إعداد القولون لفحص موت الخلايا
ملاحظة: يستغرق بروتوكول فحص موت الخلية 4 أيام حتى يكتمل (الشكل 1 أ).
- قم بتوسيع القولون باستخدام شكل لوحة 48 بئرا ، وبذر 20 ميكرولتر من تعليق BME / crypt لكل بئر ، والحضانة عند 37 درجة مئوية ، و 5٪ CO2 ، وتغيير الوسط 2-3x في الأسبوع (350 ميكرولتر لكل بئر).
- مرور القولون حوالي 1 أسبوع قبل الحصاد لفحص موت الخلية. قبل حصاد القولون ، تأكد من نشرها بكثافة عالية (الشكل 1Bi) ، وأن قطرها حوالي 25-50 ميكرومتر ، وتتكاثر بنشاط.
ملاحظة: لقد استخدمنا القولون لهذا الفحص من المقطع 3 إلى المقطع 14 مع نتائج متسقة. ومع ذلك ، فقد ثبت أن استجابة النسخ للقولونويدات للسيتوكينات يمكن أن تتغير اعتمادا على مدة الثقافة18. على هذا الأساس ، نوصي بعدم استخدام القولون لهذا الفحص بعد المرور 15. - احتضان 96 بئرا لوحات عيار دقيق عند 37 درجة مئوية ، 5٪ CO2 لمدة لا تقل عن 72 ساعة قبل البذر بخلايا القولون.
- قم بإذابة BME على الجليد عند 4 درجات مئوية في المساء قبل بدء التجربة.
- تحضير كمية كافية من كاشف التفكك الأنزيمي (500 ميكرولتر لكل بئر من القولون) عن طريق المكمل ب 10 ميكرومتر من مثبط ROCK-I / II Y-27632. قم بإزالة الوسط برفق من الآبار التي تحتوي على القولون ؛ ماصة من حافة البئر لتجنب إتلاف قبة القولون. أضف 300 ميكرولتر من كاشف التفكك الأنزيمي إلى كل بئر.
- لكل بئر ، قم بتفكيك قبة القولون عن طريق كشط سطح البئر بطرف ماصة P1000 وسحب تعليق الخلية لأعلى ولأسفل ؛ حاول تجنب توليد فقاعات الهواء. اجمع معلق الخلية في أنبوب سعة 15 مل.
ملاحظة: سيتم استخدام هذا الأنبوب سعة 15 مل لجمع القولون من 10 آبار من لوحة 48 بئرا. - اغسل نفس البئر ب 200 ميكرولتر أخرى من كاشف التفكك الأنزيمي لضمان جمع جميع مواد القولون ونقلها إلى نفس الأنبوب سعة 15 مل. كرر هذه العملية لكل بئر من القولون الموسع الذي يتم حصاده واجمعها في نفس الأنبوب الفردي سعة 15 مل.
ملاحظة: من أجل التفكك الفعال ، يجب جمع 10 آبار من القولون كحد أقصى لكل أنبوب. في حالة جمع >10 آبار ، قم بتقسيم القولون الذي تم جمعه بالتساوي عبر أنابيب متعددة سعة 15 مل.
- لكل بئر ، قم بتفكيك قبة القولون عن طريق كشط سطح البئر بطرف ماصة P1000 وسحب تعليق الخلية لأعلى ولأسفل ؛ حاول تجنب توليد فقاعات الهواء. اجمع معلق الخلية في أنبوب سعة 15 مل.
- احتضان أنبوب 15 مل مع القولون المجمعة من الخطوة 2.5.2 في حمام مائي عند 37 درجة مئوية لمدة 5 دقائق. بعد الحضانة ، يقوم جهاز الطرد المركزي بالأنبوب لمدة 3 دقائق عند 400 × جم. قم بإزالة المادة الطافية برفق ، تاركا حوالي 1.2 مل في الأنبوب.
ملاحظة: تتطلب الخطوة التالية التفكك الجسدي للقولونويدات باستخدام السحب السريع. لكي يكون هذا فعالا ، يجب أن يكون لديك حجم صغير من تعليق الخلية في الأنبوب - 1.2 مل اليسار في أنبوب 15 مل يكفي لهذا الغرض. - أعد تعليق حبيبات القولون في 1.2 مل المتبقية من كاشف التفكك الأنزيمي. باستخدام ماصة P1000 مضبوطة على 1000 ميكرولتر ، ضع طرف الماصة في التعليق ، وثبته فوق الجزء السفلي من الأنبوب سعة 15 مل مباشرة ، ثم قم بسحب التعليق بسرعة داخل وخارج الطرف. للماصة بسرعة ، اضغط بسرعة على زر المكبس إلى المحطة الأولى ، ثم حرر الزر حتى يصل إلى منتصف الطريق تقريبا إلى الموضع العلوي ، وكرر. ماصة سريعة لمدة 10 ثوان تقريبا (30-40 منخفضا) ، ثم أعد تعليق التعليق بالكامل وكرر الماصة. أداء 2-3 جولات من سحب سريع.
- افحص العينة تحت المجهر للتأكد من عدم وجود قولون كامل وأن غالبية شظايا القولون يبلغ حجمها حوالي 30-40 ميكرومتر (الشكل 1Bii).
- إذا كانت العينة تتطلب مزيدا من التفكك ، فقم باحتضانها في حمام مائي عند 37 درجة مئوية لمدة 3 دقائق أخرى ، وكرر تقنية سحب العينات في الخطوة 2.7 ، وتحقق من العينة تحت المجهر. كرر هذه العملية حتى تصبح غالبية شظايا القولون بالحجم الأمثل.
ملاحظة: احرص على عدم فصل القولون كثيرا لأن هذا سيؤدي إلى موت الخلايا المفرط ، وانخفاض كفاءة الطلاء ، والقولون الأصغر حجما. - أضف 10 مل من وسائط الغسيل العضوية الباردة (الجدول 1) إلى أنبوب 15 مل. قم بطرد الأنبوب لمدة 3 دقائق عند 400 × جم ، وقم بإزالة المادة الطافية ، وأعد تعليقها في 1 مل من وسائط الغسيل العضوية الباردة ، وانقلها إلى أنبوب طرد مركزي دقيق سعة 1.5 مل (يشار إليه باسم أنبوب شظية القولون).
- خلط محتويات أنبوب جزء القولون عن طريق ماصة وأخذ عينة 50 ميكرولتر. نقل هذه العينة 50 ميكرولتر إلى أنبوب طرد مركزي دقيق جديد سعة 1.5 مل (يشار إليه باسم أنبوب عدد الخلايا). قم بتخزين أنبوب شظية القولون على الجليد من هذه النقطة حتى الانتهاء من الخطوة 2.15.
- قم بطرد مركزي أنبوب عدد الخلايا لمدة 3 دقائق عند 400 × جم ، وقم بإزالة المادة الطافية ، وأعد التعليق في 500 ميكرولتر من كاشف التفكك الأنزيمي المكمل ب 10 ميكرومتر من مثبط ROCK-I / II Y-27632.
- احتضان أنبوب عد الخلايا المفردة في حمام مائي على حرارة 37 درجة مئوية لمدة 5 دقائق. باستخدام ماصة P1000 مضبوطة على 400 ميكرولتر ، ماصة العينة كما هو موضح في الخطوة 2.7 وتحقق من العينة تحت المجهر للتأكد من وجود تعليق أحادي الخلية. إذا لم يكن الأمر كذلك ، كرر هذه العملية حتى يتم فصل القولون بالكامل إلى تعليق أحادي الخلية.
- أضف 1 مل من وسائط الغسيل العضوية إلى أنبوب عد الخلايا المفردة ، وأجهزة الطرد المركزي لمدة 3 دقائق عند 400 × جم وقم بإزالة المادة الطافية بعناية. أعد تعليق الخلايا في 50 ميكرولتر من وسائط الغسيل العضوية ثم أضف 50 ميكرولتر من التريبان الأزرق.
- عد الخلايا باستخدام مقياس الدم. احسب عدد الخلايا في عينة 50 ميكرولتر واستخدمها لحساب تركيز الخلايا في أنبوب شظية القولون.
- احسب حجم معلق الخلية المطلوب للتجربة حيث سيتم زرع 0.5 × 104 خلايا قولونية لكل بئر من صفيحة عيار 96 بئرا. أضف ما يقرب من 15٪ إضافية إلى هذا الحجم المحسوب لحساب الحجم الميت. انقل هذا الحجم الإجمالي من أنبوب شظايا القولون (الخطوة 2.11) إلى أنبوب طرد مركزي دقيق جديد سعة 1.5 مل.
- جهاز طرد مركزي أنبوب طرد مركزي صغير جديد سعة 1.5 مل يحتوي على شظايا القولون لمدة 3 دقائق عند 400 × جم ، وإزالة المادة الطافية ، وإعادة التعليق في BME (استخدم 10 ميكرولتر من BME لكل 0.5 × 104 خلايا).
ملاحظة: نظرا للخصائص الفيزيائية ل BME (اللزوجة العالية ، البلمرة المعتمدة على درجة الحرارة) ، يمكن فقدان كمية كبيرة من المواد من خلال السحب (الحجم الميت).
- جهاز طرد مركزي أنبوب طرد مركزي صغير جديد سعة 1.5 مل يحتوي على شظايا القولون لمدة 3 دقائق عند 400 × جم ، وإزالة المادة الطافية ، وإعادة التعليق في BME (استخدم 10 ميكرولتر من BME لكل 0.5 × 104 خلايا).
- قم بإعداد الأنبوب أو الخزان الذي يحتوي على معلق القولون / BME على الجليد في حاوية معقمة داخل خزانة السلامة البيولوجية.
ملاحظة: إبقاء الخلايا على الجليد أثناء البذر يمنع ركيزة الخلية من البلمرة قبل الأوان. - باستخدام صفيحة عيار ميكرو 96 بئر محتضنة مسبقا (من الخطوة 2.3) ، ماصة عكسية 10 ميكرولتر من محلول القولون / BME لكل بئر. تأكد من وضع الطرف فوق سطح البئر مباشرة والماصة في المركز لتجنب الاصطدام بجدار البئر. امزج معلق القولون / BME بانتظام لمنع البذر غير المتساوي.
ملاحظة: لا تزرع القولون في آبار الحافة الخارجية للوحة المعايرة الدقيقة.- لعكس الماصة:
- اضبط الماصة ثم اضغط على زر المكبس بعد المحطة الأولى إلى المحطة الثانية.
- عند شغل هذا الوضع ، اغمر الطرف في تعليق القولون / BME وحرر المكبس ببطء إلى الأعلى.
- قم بتوزيع التعليق بالضغط على زر المكبس برفق وثبات إلى المحطة الأولى. في حالة بذر المزيد من الآبار ، شغل هذا الوضع وكرر الخطوات 2.18.1.2-2.18.1.3.
- بمجرد الانتهاء ، اطرد الكمية الصغيرة من التعليق المتبقي بالضغط على زر المكبس إلى المحطة الثانية.
ملاحظة: نوصي باستخدام تقنية السحب العكسي بسبب اللزوجة العالية ل BME.
- لعكس الماصة:
- اقلب اللوحة بسلاسة وثبات واحتضانها عند 37 درجة مئوية ، 5٪ CO2 لمدة 20 دقيقة.
- إزالة لوحة من الحاضنة. تأكد من أن BME قد بلمرته بالكامل ثم قم بتراكب القباب ب 200 ميكرولتر من وسائط الانتشار العضوية المسخنة مسبقا. في حالة استخدام صفيحة عيار ميكرو 96 بئرا مع خندق محيطي (يقلل من التبخر) ، املأ كل خزان ب 2 مل من وسائط الغسيل العضوية.
- احتضان القولون عند 37 درجة مئوية ، 5٪ CO2 لمدة 3 أيام وفحصه مجهريا مرة واحدة يوميا للتأكد من تعافي القولون وتكاثره.
3. علاجات القولون لفحص موت الخلايا
- تحضير محلول 2.5 ميكرومتر من صبغة موت الخلايا الفلورية (صبغة الحمض النووي الأخضر SYTOX) ومحلول DMSO عن طريق إضافة صبغة موت الخلايا الفلورية أو DMSO إلى وسائط انتشار المواد العضوية المسخنة مسبقا (الجدول 2).
ملاحظة: حماية مخزون صبغة موت الخلايا الفلورية والمحلول المخفف من الضوء. يتم إذابة صبغة الحمض النووي الأخضر SYTOX في DMSO ؛ يستخدم محلول DMSO لتحضير حالة عدم الصبغة للتحكم في تأثيرات المذيبات. - استخدم محلول 2.5 ميكرومتر لصبغة موت الخلايا الفلورية ومحلول DMSO من الخطوة 3.1 لإعداد العلاجات كما هو موضح في الجدول 2.
- قم بإزالة الوسط برفق من صفيحة العيار الدقيق المكونة من 96 بئرا والمصنفة بالقولون عن طريق إمالة اللوحة والسحب من حافة الآبار ؛ ثم أضف 200 ميكرولتر من وسط المعالجة لكل بئر. تأكد من وجود آبار تحكم PBS / BSA إضافية لحالة (حالات) السمية القصوى (انظر الجدول 2 للحصول على خريطة اللوحة).
- احتضان القولون عند 37 درجة مئوية ، 5٪ CO2 لنقاط العلاج المطلوبة حتى تصبح جاهزة للتصوير.
- قبل التصوير بساعتين على الأقل ، قم بإعداد محلول 10٪ v / v من Triton-X 100 في ماء معقم من درجة زراعة الخلايا وأضف 22 ميكرولتر من 10٪ Triton-X 100 مباشرة إلى وسط آبار التحكم لحالة (حالات) السمية القصوى إلى تركيز نهائي قدره 1٪ v / v 1 h قبل التصوير.
ملاحظة: يقلل استخدام محلول بنسبة 10٪ من أخطاء السحب التي يمكن أن تحدث بسبب اللزوجة العالية لخافض للتوتر السطحي.
4. الحصول على الصور
- قم بإزالة صفيحة العيار الدقيقة المكونة من 96 بئرا والمصنفة بالقولون من الحاضنة ونقلها إلى مرحلة مجهر التألق الرقمي المقلوب. اسمح للوحة بالوصول إلى درجة حرارة الغرفة.
- تأكد من أن القولون في حالة السمية القصوى يتم تحليله بالكامل عن طريق فحصه تحت المجهر (الشكل 1ب).
- حدد هدفا مناسبا ، مثل هدف مضان مسافة عمل طويلة 40x. تحسين إعدادات التصوير للمجهر قبل البدء.
- باستخدام قناة النقل ، ركز على القولون الذي يحتوي على خلايا إيجابية للسموم ، وانتقل إلى بروتين الفلورسنت الأخضر (GFP)
(488 نانومتر) ، واضبط شدة الضوء ووقت التعرض لزيادة إشارة الفلورسنت إلى أقصى حد مع تقليل الخلفية. أولا ، جرب شدة إضاءة منخفضة ، ثم قم بزيادة وقت التعرض تدريجيا ؛ إذا كان طول التعرض غير عملي ، فقم بزيادة شدة الضوء قليلا.
ملاحظة: ستؤدي زيادة وقت التعرض بدلا من شدة الضوء إلى تقليل السمية الضوئية والتبييض الضوئي للعينات19. قم بتعريض العينات لضوء الفلورسنت فقط عند الضرورة.
- باستخدام قناة النقل ، ركز على القولون الذي يحتوي على خلايا إيجابية للسموم ، وانتقل إلى بروتين الفلورسنت الأخضر (GFP)
- باستخدام إعدادات التصوير المحسنة لقناة GFP ، راقب ظروف عدم وجود صبغة وأقصى سمية لضمان عدم تعرض العينات بشكل مفرط أو ناقص. بمجرد الانتهاء ، حافظ على اتساق إعدادات التصوير بين الظروف.
- احصل على الصور باستخدام نهج أخذ العينات العشوائي: قم بذلك عن طريق تحديد مجالات الرؤية (FOVs) التي تتبع نمط شبكة ثابت يغطي قبة القولون. الحصول على صور القولون من الحد الأدنى من 10 FOVs. تأكد من أن المستوى المركزي للقولون في بؤرة التركيز والتقاط الصور في كل من قنوات الإرسال و GFP.
- قم بتطبيق معايير الاستبعاد التالية.
- لا تحصل على صور إذا لم يكن هناك القولون موجود في مجال الرؤية.
- لا تحصل على صور إذا كان هناك فقط القولون المتداخل في نفس المستوى البؤري الموجود في مجال الرؤية (الشكل 1Biv).
- لا تحصل على صور إذا كان هناك حطام قولوني فقط موجود في مجال الرؤية (الشكل 1Bv). لا تقم بتضمين حطام القولون في التحليل.
- قم بتطبيق معايير الاستبعاد التالية.
- حفظ الصور بتنسيق رسومات الشبكة المحمولة وتصديرها.
- في حالة تصوير نقاط زمنية إضافية ، أعد لوحة العيار الدقيق 96 بئرا مع القولون إلى الحاضنة عند 37 درجة مئوية ، 5٪ CO2.
5. تحليل الصور
- افتح Fiji ImageJ واستورد مجموعة بيانات الصورة عن طريق سحب الملفات وإفلاتها على شريط أدوات ImageJ أو الانتقال إلى ملف | افتح الملفات وحددها. بمجرد الفتح ، ادمج الملفات في مكدس صور بالنقر فوق صورة | مداخن | الصور المراد تكديسها. قم بتحويل مكدس الصور إلى تنسيق ملف 8 بت بالنقر فوق صورة| النوع| 8 بت.
- لكل مجموعة صور ، انقر فوق أداة التحديدات اليدوية على شريط أدوات ImageJ وحدد يدويا منطقة الاهتمام (ROI) على صورة الإرسال باستخدام فأرة الكمبيوتر ؛ عائد الاستثمار هو محيط القولون. بعد ذلك، قم بالتبديل عبر حزمة الصور إلى صورة قناة GFP المقابلة.
- انقر فوق تحليل | تعيين القياسات في نافذة الحوار تعيين القياسات ، حدد متوسط القيمة الرمادية واترك جميع المربعات الأخرى بدون تحديد. مع تحديد صورة GFP، انقر على تحليل | التدبير. كرر هذا التحليل لكل نقطتين في مكدس الصور. بمجرد تحليل مجموعة البيانات ، انسخ جميع البيانات الموجودة في نافذة النتائج والصقها في تطبيق برنامج جدول بيانات.
6. ٪ ماكس حساب سمية
- احسب متوسط القيم الرمادية (MGV) المتماثلة الفنية لكل شرط باستخدام المعادلة (1).
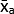 (متوسط العلاج أ) =
(متوسط العلاج أ) = 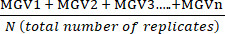 (1)
(1) - عبر عن متوسط كل حالة كنسبة مئوية بالنسبة إلى متوسط حالة السمية القصوى (MT) باستخدام المعادلة (2).
٪ طنمتري أ =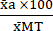 (2)
(2)
7. حساب الرقم القياسي لأسعار المستهلك
- تطبيع (NORM) البيانات على النحو التالي ، باستخدام القيم المتوسطة المحسوبة في الخطوة 6.1 ، اطرح متوسط الحالة غير المعالجة (UT) من كل حالة علاج وحالة السمية القصوى (MT) (لإزالة موت الخلايا الخلفية الذي يحدث بشكل مستقل عن علاج السيتوكين). ثم قسم كل حالة معالجة على المتوسط المطروح في الخلفية لحالة السمية القصوى (MT) كما هو موضح في المعادلة (3).
المعيارأ =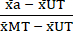 (3)
(3) - اطرح القيم الطبيعية المحسوبة في الخطوة 7.1 من 1 ؛ تمثل القيم الناتجة صلاحية الخلية (V) بعد المعالجة (كما في المعادلة (4) أدناه).
Va = 1 − NORMa (4) - احسب معامل تفاعل الاضطراب (CPI) باستخدام المعادلة (5):
الرقم القياسي لأسعار المستهلك =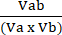 (5)
(5)
حيث يشير إلى العلاج الأول ؛ (ب ) تدل على العلاج الثاني؛ و AB هو العلاج المركب. تشير قيم CPI إلى العلاقات التآزرية (<1) أو المضافة (= 1) أو العدائية (>1).
النتائج
باستخدام هذا البروتوكول ، أوضحنا كيف يمكن استخدام القولون المريض CD لدراسة التأثيرات السامة للخلايا للسيتوكينات ذات الصلة ب IBD IFN-γ و TNF-α على الظهارة الأولية. استخدمنا صبغة موت الخلايا الفلورية المتاحة تجاريا (SYTOX Green Nucleic Acid Stain) ، والتي يمكن أن تدخل فقط الخلايا التي تحتوي على غشاء خلوي مخترق حيث يتم تنشيطه بعد ذلك عن طريق الارتباط بالأحماض النووية. لقد عالجنا القولون باستخدام السيتوكينات وصبغة موت الخلايا الفلورية وأجرينا تصويرا للخلايا الحية في 8 ساعات و 24 ساعة باستخدام مجهر التألق المقلوب. تشير صور تراكب الإرسال / الفلورسنت التمثيلي عند 8 ساعات إلى أن القولون المعالج IFN-γ + TNF-α فقط هو الموجب لإشارة الفلورسنت ؛ ومع ذلك ، لا يوجد سوى عدد قليل من الخلايا الفلورية (الشكل 2 أ). يمكن أيضا ملاحظة نفخ الخلايا ، وهو مؤشر مورفولوجي لموت الخلايا20 ، في حالة IFN-γ + TNF-α. في 24 ساعة ، تظهر القولون المعالجة ب IFN-γ + TNF-α مناطق كبيرة إيجابية لإشارة الفلورسنت (الشكل 2 أ). هناك أيضا انهيار واضح في مورفولوجيا القولون - لم يعد التجويف المركزي مرئيا ، وقد تعطل الحاجز الظهاري تماما.
لتحديد إشارة صبغة موت الخلية ، استخدمنا برنامج تحليل الصور مفتوح المصدر لحساب شدة الفلورسنت لكل قولون. ثم قمنا بتطبيع البيانات من خلال التعبير عن متوسط كل حالة كنسبة مئوية من علاج السمية القصوى. في 8 ساعات ، كان موت الخلايا التماثلية أو الخلفية في القولون الضابط BSA منخفضا نسبيا (7.7٪ من السمية القصوى) (الشكل 2 ب). لم تكن هناك تغييرات ذات دلالة إحصائية في مستويات موت الخلايا في هذه المرحلة الزمنية. ومع ذلك ، أظهرت الحالات التي عولجت بعامل نخر الورم - α زيادة طفيفة في السمية الخلوية (الشكل 2 ب). بعد 24 ساعة ، زادت مستويات موت الخلايا لجميع الحالات المعالجة بالسيتوكين. ومع ذلك ، كان هناك تغيير طفيف في موت الخلايا لحالة التحكم في BSA بين النقاط الزمنية (7.5٪ من السمية القصوى عند 24 ساعة). كان لدى القولون المعالج ب IFN-γ + TNF-α أكبر زيادة في مستويات موت الخلايا مقارنة بالتحكم في BSA (29.4٪ من السمية القصوى). كان الفرق في مستويات موت الخلايا بين العلاج المشترك وعلاجات السيتوكين المفردة (IFN-γ ، TNF-α) كبيرا للغاية. تشير هذه النتائج إلى إمكانية وجود تفاعل تآزري سام للخلايا بين IFN-γ و TNF-α عند 24 ساعة.
استخدمنا مؤشر أسعار المستهلك لتحديد التفاعلات السامة للخلايا بين علاجات السيتوكين وتحديد ما إذا كانت تآزرية. تعتبر التفاعلات بين السيتوكينات تآزرية عندما تكون قيمة مؤشر أسعار المستهلك <1 ، أو مضافة عندما = 1 ، أو معادية عندما تكون >1. قمنا بحساب قيم مؤشر أسعار المستهلك لكل نقطة زمنية (الشكل 2C). في 8 ساعات ، أشارت قيمة مؤشر أسعار المستهلكين إلى تآزر طفيف (0.99) ، مع انخفاض قيمة مؤشر أسعار المستهلك بشكل كبير عند 24 ساعة (0.83). وأكد هذا التحليل أن التفاعل بين IFN-γ و TNF-α في الساعة 24 كان تآزريا. وعلاوة على ذلك، فإنه يوضح كيف أن التآزر بين γ IFN- وTNF-α يعتمد على الوقت.
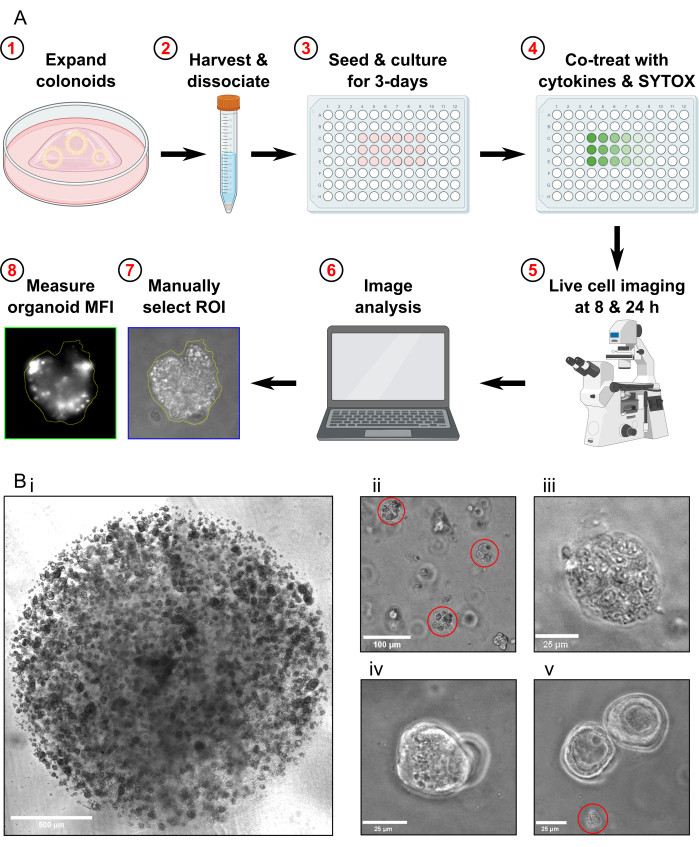
الشكل 1: رسم تخطيطي لسير العمل التجريبي واستكشاف الأخطاء وإصلاحها. (أ) نظرة عامة تخطيطية على البروتوكول. (ب) صور تمثيلية. (ثنائي) صورة مجهرية ضوئية توضح الكثافة المثلى للثقافة والحجم الأمثل للقولون قبل المرور للفحص. شريط المقياس = 500 ميكرومتر. (Bii) صورة مجهرية ضوئية توضح الحجم الأمثل لشظايا القولون بعد التفكك ؛ شظايا مظللة باللون الأحمر. شريط المقياس = 100 ميكرومتر. (Biii) صورة مجهرية ضوئية لمورفولوجيا القولون الميت بعد علاج MT (مع Triton X-100). شريط المقياس = 25 ميكرومتر. (Biv) صورة مجهرية ضوئية لاثنين من القولون المتداخلة في نفس المستوى البؤري. شريط المقياس = 25 ميكرومتر. (Bv) صورة مجهرية ضوئية لحطام خلايا القولون الموجودة بعد المرور ؛ الحطام مظلل باللون الأحمر. شريط المقياس = 25 ميكرومتر. الاختصارات: ROI = منطقة الاهتمام ؛ MFI = متوسط شدة التألق ؛ MT = أقصى سمية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
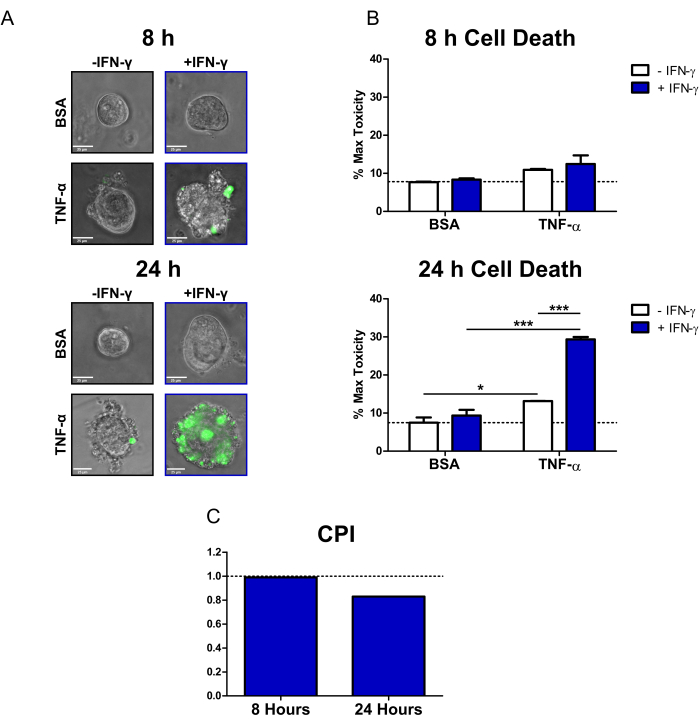
الشكل 2: التحليل الكمي لموت الخلايا الناجم عن السيتوكين في القولون المضغوط البشري. (أ) صور مجهرية حية تمثيلية لقولون CD المعالج بصبغة الحمض النووي الأخضر SYTOX (صبغة موت الخلايا الفلورية) والسيتوكينات في 8 ساعات و 24 ساعة ؛ قنوات الإرسال و GFP (اللون الأخضر) متراكبة. تم التعامل مع القولون على النحو التالي: 1) PBS / BSA ، 2) 10 نانوغرام / مل IFN-γ ، 3) 10 نانوغرام / مل TNF-α ، 4) 10 نانوغرام / مل IFN-γ + 10 نانوغرام / مل TNF-α. قضبان المقياس = 25 ميكرومتر. (ب) التحليل الكمي للقولون CD المعالج بصبغة موت الخلايا الفلورية والسيتوكينات عند 8 و 24 ساعة ؛ يتم التعبير عن البيانات كنسبة مئوية من شرط MT. N = 2 خطوط قولون CD ، 11-16 قولون مصور لكل حالة. (C) يتم حساب مؤشر أسعار المستهلك لكل نقطة زمنية باستخدام مجموعة البيانات من B ، N = 2 خطوط القولون CD. يتم التعبير عن البيانات كوسيلة ± SE. في B ، تم إجراء تحليل ANOVA ثنائي الاتجاه متبوعا باختبارات Bonferroni اللاحقة ، * P < 0.05 ، ***P < 0.001 كما هو موضح. الاختصارات: CD = مرض كرون. GFP = بروتين الفلورسنت الأخضر ؛ CPI = معامل تفاعل الاضطراب ؛ PBS = محلول ملحي مخزن بالفوسفات ؛ BSA = ألبومين مصل البقر ؛ TNF-α = عامل نخر الورم ألفا ؛ IFN-γ = إنترفيرون جاما ؛ MT = أقصى سمية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: تكوين وسائط الثقافة للبروتوكول. لتحضير وسائط الانتشار العضوية ، اجمع بين الوسائط المكيفة L-WRN والوسائط الخالية من المصل 1: 1 ، ثم أضف المكملات الغذائية. يجب استخدام وسائط الانتشار العضوية في غضون 2 أسابيع من التحضير. يرجى ملاحظة أنه يجب تخزين جميع الوسائط الكاملة عند 4 درجات مئوية. يرجى النقر هنا لتنزيل هذا الجدول.
الجدول 2: تخطيط لوحة 96 بئرا التجريبية وعلاجات السيتوكينات. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
تم تطوير عدة طرق للتحليلات الكمية لموت الخلايا في الكائنات العضوية المعوية. يعد فحص اضطراب مورفولوجيا الأعضاء المعوية بواسطة الفحص المجهري الضوئي نهجا مباشرا لتحديد آثار المواد السامة للخلايا11. ومع ذلك ، فإن التغيرات المورفولوجية ليست قياسا مباشرا لموت الخلايا ، والطريقة شبه كمية فقط. طريقة أخرى هي تقييم النشاط الأيضي العضوي باستخدام مقايسة MTT أو ATP 10,11. من المهم ملاحظة أن هذه المقايسات يمكنها فقط تحديد التغييرات في صلاحية الخلية ويجب التحقق من صحتها باستخدام مقايسة موت الخلية. تم الإبلاغ عن فحوصات موت الخلايا الفلورية الأخرى باستخدام أصباغ ربط الحمض النووي 12,13. من الممكن اتباع نهج غير تصويري باستخدام قارئ الصفائح الدقيقة الفلورية ويسمح بإنتاجية عالية12. ومع ذلك ، فإن هذه الطريقة تقيس متوسط إشارة البئر بأكمله ، مما يجعلها غير مناسبة للسكان غير المتجانسين. كما يتطلب استخدام قارئ الصفائح الدقيقة مع تعديل ارتفاع Z. يمكن استخدام التقنيات القائمة على التصوير الفلوري لتحليل العضو المفرد والتقاط البيانات الخلوية / تحت الخلوية والمورفولوجية. يمكن لأنظمة التصوير الآلي عالي المحتوى (HCI) متحد البؤر توليد كميات كبيرة من البيانات بمعدل إنتاجية مرتفع13. لسوء الحظ ، يحتاج HCI متحد البؤر إلى معدات متخصصة ، ويستخدم بروتوكولات معقدة ، ويتطلب عادة برامج تحليل الصور التجارية ، وهو مكلف.
بروتوكولنا للتحليل الكمي لموت خلايا القولون في نقاط زمنية متعددة واضح وبسيط وغير مكلف. ومع ذلك ، بالمقارنة مع أنظمة HCI وقارئ اللوحات الآلية ، فإنها تستغرق وقتا طويلا وقد قللت من الإنتاجية. هناك قيد آخر لطريقتنا وهو استخدام المجال العريض بدلا من الفحص المجهري متحد البؤر. الفحص المجهري متحد البؤر هو أكثر ملاءمة لتصوير عينات 3D سميكة مثل المواد العضوية لأنه يقلل من إشارة خارج التركيز ويمكن الحصول على أقسام بصرية تسلسلية (Z-مداخن). ومع ذلك ، يتطلب التصوير البؤري عادة أوقات اكتساب أطول وأشعة ليزر عالية الكثافة تزيد من السمية الضوئية / التبييض الضوئي. من الأهمية بمكان ملاحظة أن أصباغ موت الخلايا الفلورية مثل SYTOX Green مناسبة فقط لقياس أشكال موت الخلايا حيث يوجد فقدان لسلامة غشاء الخلية مثل النخر ، والنخر الثانوي المرتبط بموت الخلايا المبرمج المتأخر ، والتنخر ، و pyroptosis21. هناك بعض أشكال موت الخلايا المنظم حيث يظل غشاء الخلية غير منفذ على الأقل خلال المراحل المبكرة من موت الخلايا ، مثل موت الخلايا المبرمج المعتمد على الكاسباس. ومع ذلك ، يمكن تعديل هذا البروتوكول بسهولة ليشمل أيضا تصوير مراسل فلورسنت نشاط caspase 3/722. وهذا من شأنه أن يوفر بيانات إضافية للمساعدة في توصيف طريقة موت الخلية المحددة.
استخدمنا بروتوكولنا لإثبات التفاعل التآزري السام للخلايا بين السيتوكينات IFN-γ و TNF-α (الشكل 2C) ، والتي أبلغنا عنها سابقا في المواد العضوية المشتقة من المريضCD 9,10. كما تم إثبات الأهمية الفسيولوجية لهذا النوع من التآزر في نماذج الفئران من كثرة الخلايا اللمفاوية البلعمية والإنتان23. تم تنفيذ العديد من النماذج والنهج المرجعية الرياضية لقياس التآزر بين مجموعات العوامل البيولوجية24,25. وهي تختلف من حيث تعقيدها ، وعدد العوامل التي تأخذها في الاعتبار ، وعتبة اعتبار التفاعل تآزريا24,25. تحتاج بعض النماذج إلى معرفة مسبقة بالعوامل البيولوجية التي تم اختبارها ، وتضع افتراضات معينة حول نشاط العوامل ، ويمكن أن تتطلب منحنيات شاملة للجرعة والاستجابة لكل علاج فردي ومركب25. الطريقة التي اخترناها لقياس التآزر هي تعديل نموذج معامل التفاعل الدوائي (CDI) ، والذي تم استخدامه سابقا لقياس التأثيرات المثبطة لتركيبات أدوية العلاج الكيميائي على تكاثر خط الخلايا السرطانية26. CDI هو نموذج استقلال النعيم. عند حساب التأثير المشترك المتوقع لاثنين من الاضطرابات ، يفترض استقلال Bliss أنهما يستهدفان مسارات منفصلة ولديهما آليات عمل مستقلة27. لكي يكون التفاعل بين الاضطرابات تآزريا ، يجب أن يكون التأثير المشترك الفعلي أكبر من التأثير المتوقع. هذا النموذج مناسب لإعدادنا التجريبي حيث من المعروف أن IFN-γ و TNF-α لهما مستقبلات مختلفة ومكونات إشارات المصب. علاوة على ذلك ، يسمح استقلال Bliss بحساب معامل التفاعل لتحديد التآزر ولا يتطلب مجموعات بيانات استجابة الجرعة.
هناك بعض العوامل الرئيسية التي يجب مراعاتها لضمان النتائج المثلى لهذا البروتوكول. من المهم أن يتم نشر القولون إلى كثافة عالية (الشكل 1Bi) ، وأن يبلغ قطرها حوالي 25-50 ميكرومتر ، وتتكاثر بنشاط قبل محاولة زرع الخلايا. قد يؤدي استخدام الثقافات دون المستوى الأمثل للقولون للمقايسات إلى عدم كفاية أعداد الخلايا ، وانخفاض تعافي القولون ، وتجارب غير متسقة. للحصول على نتائج قابلة للتكرار ، من المهم أيضا زرع كثافة القولون باستمرار بين التجارب. لقد ثبت سابقا أن الاستجابة في المختبر للسيتوكينات الالتهابية يمكن أن تتأثر بكثافة بذر الخلايا28,29. مشكلة أخرى شائعة هي تكوين فقاعات الهواء في قبة BME ، والتي يمكن أن تؤثر على التصوير. يمكن منع ذلك باستخدام تقنية السحب العكسي. ينتج عن هذه التقنية أيضا بذر أكثر اتساقا.
علاوة على ذلك ، في حالة تصوير نقاط زمنية متعددة ، قم بإعداد حالة السمية القصوى لكل نقطة زمنية. يستخدم Triton-X 100 ، وهو خافض للتوتر السطحي غير أيوني ، بشكل شائع كعنصر تحكم إيجابي (حالة السمية القصوى) لمقايسات السمية الخلوية. إضافة Triton-X 100 lyses ويقتل القولون ، مما يسمح لصبغة موت الخلايا الفلورية بدخول الخلايا. سيؤدي استخدام حالة Max Toxicity من نقطة زمنية سابقة إلى تطبيع غير دقيق وغير متسق للبيانات بسبب تحلل إشارة الفلورسنت بمرور الوقت.
النقطة الأخيرة التي يجب مراعاتها هي اختيار BME المستخدم في ثقافة القولون. هناك العديد من المنتجين التجاريين ل BME. ومع ذلك ، بالنسبة لبروتوكولنا ، قمنا فقط باختبار العلامة التجارية المدرجة في جدول المواد. وجدت دراسة حديثة باستخدام عضويات سرطان البنكرياس المشتقة من المريض أن المصدر التجاري ل BME غير معدلات تكاثر الخلايا ولكن لم يكن له تأثير كبير على الاستجابة لأدوية العلاج الكيميائي أو التعبير الجيني30. مع وضع ذلك في الاعتبار ، نتوقع أن يكون اتجاه النتائج مشابها بين العلامات التجارية BME لبروتوكولنا ، لكننا نوصي باستخدام نفس العلامة التجارية باستمرار.
لقد أوضحنا كيف يمكن استخدام هذا البروتوكول لتحليل موت الخلايا الناجم عن IFN-γ و TNF-α باستخدام القولون المشتق من CD. تعتبر العضويات المعوية المشتقة من المريض أداة قوية لدراسة CD لأنها تحتفظ بالعديد من خصائص المرض ، بما في ذلك زيادة الحساسية للتأثيرات السامة للخلايا ل TNF-α31. ومع ذلك ، يمكن تعديل البروتوكول بسهولة للتحقيق في التأثيرات السامة للخلايا للاضطرابات بخلاف السيتوكينات أو حالات المرض بخلاف مرض التهاب الأمعاء مثل سرطان القولون والمستقيم (لقد اختبرنا البروتوكول بنجاح باستخدام القولون غير الالتهابي). نعتقد أن هذه الطريقة مفيدة لأي مجال بحثي معني بآليات موت الخلايا أو وظيفة الحاجز الظهاري أو المناعة المخاطية المعوية.
Disclosures
كان K.N. يتلقى تمويلا بحثيا من شركة AbbVie Inc. خلال الوقت الذي تم فيه الانتهاء من العمل. كان هذا التمويل في سياق جائزة مركز الأبحاث (SFI-14 / SP / 2710) إلى APC Microbiome Ireland.
Acknowledgements
يود المؤلفون أن يشكروا المرضى على موافقتهم المستنيرة ومشاركتهم في الدراسة البحثية ، والموظفين السريريين على مساعدتهم الممتازة. تم إنشاء الشكل 1A باستخدام BioRender.com. تم دعم هذا العمل بمنح من مؤسسة العلوم في أيرلندا - وهي جائزة التطوير الوظيفي (CDA) إلى K.N. (SFI-13 / CDA / 2171) ، ومنحة مركز الأبحاث (SFI-12 / RC / 2273) ، وجائزة مركز الأبحاث (SFI-14 / SP / 2710) إلى APC Microbiome Ireland. وتلقى ب. ف. أيضا تمويلا من SFI/20/RP/9007.
Materials
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F12 | Gibco | 12634010 | |
| Amphotericin B Solution | Sigma-Merck | A2942 | |
| A-83-01 | Sigma-Merck | SML0788 | |
| BioRender | Science Suite Inc. | N/A | Scientific illustration software |
| Bovine Serum Albumin | Sigma-Merck | A2058 | Essentially IgG-free, low endotoxin |
| B27 Supplement | Invitrogen | 17504-044 | |
| CHIR-99021 | Sigma-Merck | SML1046 | |
| Costar 48-well Clear TC-treated Multiple Well Plates, Individually Wrapped, Sterile | Corning | 3548 | |
| Cultrex Basement Membrane Extract, Type 2, Pathclear | R&D Systems | 3532-010-02 | Basement membrane extract |
| Dimethyl sulfoxide | Sigma-Merck | D2650 | |
| Dulbecco′s Phosphate Buffered Saline | Sigma-Merck | D8537 | |
| EVOS FL Digital Inverted Fluorescence Microscope | Invitrogen | AMF4300 | Digital inverted epifluorescence microscope |
| EVOS 40x Objective, fluorite, LWD, phase-contrast | ThermoFisher Scientific | AMEP4683 | Long working distance 40x fluorescence objective |
| Fiji/ImageJ (Windows version) | Open-source software | N/A | Image analysis software |
| Foetal Bovine Serum | Sigma-Merck | F9665 | |
| Gentamicin Solution | Sigma-Merck | G1397 | |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 100-0485 | Enzyme-free cell dissociation reagent |
| GlutaMAX-1 | Gibco | 35050061 | L-alanyl-L-glutamine dipeptide supplement |
| GraphPad Prism 5 (Windows version) | Dotmatics | N/A | Data graphics and statistics software |
| Greiner 15 mL Polypropylene Centrifuge Tube, Sterile with conical bottom & Screw Cap | Cruinn | 188261CI | |
| HEPES 1 M | Gibco | 15630080 | |
| Human recombinant EGF (animal free) | Peprotech | AF-100-15 | |
| N-Acetylcysteine | Sigma-Merck | A9165 | |
| Nicotinamide | Sigma-Merck | N0636 | |
| Normocin | InvivoGen | ant-nr-05 | Broad range antimicrobial reagent |
| Nunc Edge 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | ThermoFisher Scientific | 15543115 | |
| N2 supplement | Invitrogen | 17502-048 | |
| Recombinant Human IFN-gamma Protein | R&D Systems | 285-IF | Resuspend in sterile filtered 0.1% PBS/BSA |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA | Resuspend in sterile filtered 0.1% PBS/BSA |
| SB202190 | Sigma-Merck | S7067 | |
| Snap Cap Low Retention Microcentrifuge Tubes | ThermoFisher Scientific | 3451 | |
| SYTOX Green Nucleic Acid Stain - 5 mM Solution in DMSO | Invitrogen | S7020 | Fluorescent cell death dye, protect from light |
| Triton X-100 | Sigma-Merck | 93420 | |
| Trypan Blue solution | Sigma-Merck | T8154 | |
| Tryple Express | Gibco | 12604013 | Enzymatic dissociation reagent |
| Y-27632 | MedChemExpress | HY-10071 | Inhibitor of ROCK-I and ROCK-II |
References
- Patankar, J. V., Becker, C. Cell death in the gut epithelium and implications for chronic inflammation. Nat Rev Gastroenterol Hepatol. 17 (9), 543-556 (2020).
- Zeissig, S., et al. Downregulation of epithelial apoptosis and barrier repair in active Crohn's disease by tumour necrosis factor alpha antibody treatment. Gut. 53 (9), 1295-1302 (2004).
- Bartee, E., Mcfadden, G. Cytokine synergy: An underappreciated contributor to innate anti-viral immunity. Cytokine. 63 (3), 237-240 (2013).
- Fish, S. M., Proujansky, R., Reenstra, W. W. Synergistic effects of interferon γ and tumour necrosis factor α on T84 cell function. Gut. 45 (2), 191-198 (1999).
- Wakisaka, Y., Sugimoto, S., Sato, T. Organoid medicine for Inflammatory Bowel Disease. Stem Cells. 40 (2), 123-132 (2022).
- Flood, P., Hanrahan, N., Nally, K., Melgar, S. Human intestinal organoids: Modeling gastrointestinal physiology and immunopathology - current applications and limitations. Eur J Immunol. 54 (2), e2250248 (2024).
- Matsuzawa-Ishimoto, Y., et al. An intestinal organoid-based platform that recreates susceptibility to t-cell-mediated tissue injury. Blood. 135 (26), 2388-2401 (2020).
- Lee, C., et al. Intestinal epithelial responses to IL-17 in adult stem cell-derived human intestinal organoids. J Crohns Colitis. 16 (12), 1911-1923 (2022).
- Woznicki, J. A., et al. TNF-α synergises with IFN-γ to induce caspase-8-JAK1/2-STAT1-dependent death of intestinal epithelial cells. Cell Death Dis. 12 (10), 864 (2021).
- Flood, P., et al. DNA sensor-associated type I interferon signaling is increased in ulcerative colitis and induces jak-dependent inflammatory cell death in colonic organoids. Am J Physiol Gastrointest Liver Physiol. 323 (5), G439-G460 (2022).
- Grabinger, T., et al. Ex vivo culture of intestinal crypt organoids as a model system for assessing cell death induction in intestinal epithelial cells and enteropathy. Cell Death Dis. 5 (5), e1228 (2014).
- Bode, K. J., Mueller, S., Schweinlin, M., Metzger, M., Brunner, T. A fast and simple fluorometric method to detect cell death in 3D intestinal organoids. Biotechniques. 67 (1), 23-28 (2019).
- Mertens, S., et al. Drug-repurposing screen on patient-derived organoids identifies therapy-induced vulnerability in KRAS-mutant colon cancer. Cell Rep. 42 (4), 112324 (2023).
- Vandussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nat Protoc. 8 (12), 2471-2482 (2013).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Woznicki, J. A., et al. Human BCL-G regulates secretion of inflammatory chemokines but is dispensable for induction of apoptosis by IFN-γ and TNF-α in intestinal epithelial cells. Cell Death Dis. 11 (1), 68 (2020).
- Edgar, R. D., et al. Culture-associated DNA methylation changes impact on cellular function of human intestinal organoids. Cell Mol Gastroenterol Hepatol. 14 (6), 1295-1310 (2022).
- Mubaid, F., Brown, C. M. Less is more: Longer exposure times with low light intensity is less photo-toxic. Microscopy Today. 25 (6), 26-35 (2017).
- Ziegler, U., Groscurth, P. Morphological features of cell death. News Physiol Sci. 19 (3), 124-128 (2004).
- Zhang, Y., Chen, X., Gueydan, C., Han, J. Plasma membrane changes during programmed cell deaths. Cell Res. 28 (1), 9-21 (2018).
- Tamura, H., et al. Evaluation of anticancer agents using patient-derived tumor organoids characteristically similar to source tissues. Oncol Rep. 40 (2), 635-646 (2018).
- Karki, R., et al. Synergism of TNF-α IFN-γ triggers inflammatory cell death, tissue damage, and mortality in SARS-CoV-2 infection and cytokine shock syndromes. Cell. 184 (1), 149-168 (2021).
- Geary, N. Understanding synergy. Am J Physiol Endocrinol Metab. 304 (3), E237-E253 (2013).
- Duarte, D., Vale, N. Evaluation of synergism in drug combinations and reference models for future orientations in oncology. Curr Res Pharmacol Drug Discov. 3, 100110 (2022).
- Wong, F. C., Woo, C. C., Hsu, A., Tan, B. K. The anti-cancer activities of Vernonia amygdalina extract in human breast cancer cell lines are mediated through caspase-dependent and p53-independent pathways. PLoS One. 8 (10), e78021 (2013).
- Ryall, K. A., Tan, A. C. Systems biology approaches for advancing the discovery of effective drug combinations. J Cheminform. 7, 7 (2015).
- Sukho, P., et al. Effect of cell seeding density and inflammatory cytokines on adipose tissue-derived stem cells: An in vitro study. Stem Cell Rev Rep. 13 (2), 267-277 (2017).
- Vaughan-Jackson, A., et al. Density dependent regulation of inflammatory responses in macrophages. Front Immunol. 13, 895488 (2022).
- Lumibao, J. C., et al. The impact of extracellular matrix on the precision medicine utility of pancreatic cancer patient-derived organoids. bioRxiv. , (2023).
- Lee, C., et al. TNF-α induces LGR5+ stem cell dysfunction in patients with Crohn's disease. Cell Mol Gastroenterol Hepatol. 13 (3), 789-808 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved