Method Article
使用实时荧光显微镜定量人结肠类器官中细胞因子诱导的细胞死亡
摘要
该方案描述了一种简单且具有成本效益的方法来研究和量化人结肠类器官中响应细胞毒性扰动因子(如细胞因子)的细胞死亡。该方法采用荧光细胞死亡染料(SYTOX Green 核酸染色剂)、实时荧光显微镜和开源图像分析软件来量化单类器官对细胞毒性刺激的反应。
摘要
炎症性肠病 (IBD) 患者(如溃疡性结肠炎 (UC) 和克罗恩病 (CD))的肠上皮细胞 (IEC) 死亡增加。这可能导致肠道屏障功能缺陷、炎症恶化和疾病免疫发病机制。细胞因子和死亡受体配体是导致 IEC 死亡增加的部分原因。IBD 相关细胞因子,如 TNF-α 和 IFN-γ,对 IEC 具有独立和联合细胞毒性。该方案描述了一种简单实用的测定法,用于使用荧光细胞死亡染料(SYTOX Green 核酸染色剂)、实时荧光显微镜和开源图像分析软件来量化 CD 患者来源的结肠类器官中细胞因子诱导的细胞毒性。我们还演示了如何使用 Bliss 独立性数学模型来计算基于类器官细胞毒性的 perturbagen 相互作用系数 (CPI)。CPI 可用于确定细胞因子组合或其他类型的扰动巴根之间的相互作用是拮抗性的、相加性的还是协同性的。该方案可用于使用患者来源的结肠类器官研究细胞因子和其他扰动物的细胞毒活性。
引言
肠上皮在肠腔内容物和底层组织之间形成一个物理半透性屏障。为了有效维持这一屏障,肠上皮细胞 (IEC) 经历了极高的细胞更新,细胞死亡和再生持续循环。然而,在炎症性疾病(如炎症性肠病 (IBD))期间,异常细胞死亡的发生率更高1。这可能会促进屏障功能的破坏和免疫系统的激活,从而引发进一步的炎症。在克罗恩病 (CD)(一种 IBD 形式)中,已经表明细胞因子信号传导导致 IEC 死亡水平升高2。通过研究细胞因子信号转导如何诱导 IEC 细胞死亡,希望可以为 IBD 和其他肠道炎症性疾病患者开发改进的治疗方法1。
在生物学和药物靶点发现研究中,通常认为当用单个刺激的组合处理的生物系统对组合的反应大于单独单个刺激的组合加性效应时,就会发生协同作用。细胞因子之间的协同相互作用在驱动先天抗病毒反应方面已得到充分证明3。细胞因子也可协同诱导细胞死亡,包括 IEC4。然而,协同细胞毒性细胞因子信号转导在 IBD 等肠道炎症性疾病中的作用研究不足。
人类肠道类器官是由肠上皮干细胞产生的体外产生的 3D 微组织。肠道类器官可以从 IBD 患者获得的肠道粘膜活检中生长出来,并保留了该疾病的许多特征 5,6。类器官已被证明是在肠道炎症背景下研究细胞因子细胞毒性的理想模型系统 7,8。以前,我们小组已经表征了 IBD 相关细胞因子 IFN-γ 和 TNF-α 在 CD 患者来源的结肠类器官(结肠类器官)中的协同杀伤作用9,10。然而,介导这种形式的协同细胞死亡所涉及的确切机制仍然难以捉摸。还可能还有更多与肠道炎症性疾病相关的未表征的细胞毒性细胞因子相互作用。
有几种方案可用于研究肠道类器官中的细胞死亡10、11、12、13;但是,它们都有缺点。其中一些技术仅测量细胞活力,不直接测量细胞死亡,无法评估单类器官反应,或者需要昂贵的设备和复杂的方案。需要稳健而直接的方法来量化肠道类器官中的类器官细胞死亡和 perturbagen 相互作用。我们提出的方案是一种简单且廉价的方法来测量对细胞毒性细胞因子的单类器官反应,但可用于任何类型的刺激或扰动。我们还演示了如何使用 Bliss 独立协同模型来计算描述细胞毒性细胞因子相互作用的 perturbagen 相互作用系数 (CPI)。
研究方案
作为标准护理的一部分,从接受常规结肠镜检查的 CD 患者中收集结肠粘膜活检。使用患者组织样本和从这些样本中生成结肠类器官系的伦理批准已获得科克教学医院 (CREC) 临床研究伦理委员会的批准。根据赫尔辛基宣言,获得所有患者的书面知情同意书。所有与患者活检和结肠样细胞相关的组织培养工作都必须按照 BSL2 安全方案在生物安全柜内进行。确保所有塑料磨损在使用前都是无菌的。有关本协议中使用的所有材料、试剂、仪器和软件的详细信息,请参阅 材料表 。
我们小组用于隐窝分离和类器官培养的方案改编自已建立的方法14、15、16,并且之前已发表9、10、17。对于以下方案,使用类器官增殖培养基培养结肠素(表 1)。使用类器官增殖培养基生长的结肠素是未分化的,并且富含结肠干细胞。类器官增殖培养基的主要成分是 50% L-WRN 条件培养基,其中包含肠道干细胞生态位生长因子 Wnt-3A (W)、R-spondin 3 (R) 和 Noggin (N)15。类器官增殖培养基的制备方法是将 L-WRN 条件培养基和无血清培养基 1:1 混合,然后补充烟酰胺和化学抑制剂(表 1)。
1. 结肠隐窝分离和结肠样培养
- 在用隐窝接种之前,将 48 孔微量滴定板在 37 °C、5% CO2 下预孵育至少 72 小时。
注:预孵育板可加速接种过程中基底膜提取物 (BME) 的聚合。 - 在分离隐窝的前一天晚上,在 4 °C 的冰上解冻 BME。
- 将结肠活检收集在含有 15 mL 活检采集培养基(表 1)的样品收集管中,并在 4 °C 下储存直至准备好处理。
- 使用移液管小心地去除尽可能多的活检采集培养基。向样品管中加入 15 mL 补充有 2.5 μg/mL 两性霉素 B 和 100 μg/mL 庆大霉素的冰冷 DPBS,清洗活检。用力摇晃样品管,以去除活检中的任何粘液或碎屑。让活检在重力下沉降,并使用移液管小心去除尽可能多的 DPBS。
- 从步骤 1.4 开始重复洗涤程序两次 (2x)。
- 向样品管中加入 10 mL 补充有 2.5 μg/mL 两性霉素 B 和 200 μg/mL 庆大霉素的无酶细胞解离试剂,并在室温下以 30 rpm 摇动孵育 15 分钟。
- 孵育后,用手左右用力摇晃样品管以释放结肠隐窝。使用低倍光学显微镜检查试管,并寻找释放的隐窝和悬浮的隐窝碎片。如果看不到,请摇动试管并再次检查;重复直到看到隐窝处于悬浮状态。
- 将 70 μm 细胞过滤器连接到 50 mL 试管上,并通过过滤器过滤隐窝悬液。将 10 mL 冰冷的类器官洗涤培养基(表 1)添加到空样品管中,取出培养基,然后将其通过细胞过滤器。
- 将过滤后的隐窝转移到两个 15 mL 管(每管 10 mL)中,并在 4 °C 下以 150 × g 离心 5 分钟。
- 小心地从每个 15 mL 试管中取出上清液,将隐窝沉淀重悬于 500 μL 冰冷的类器官洗涤培养基中,将隐窝溶液从两个 15 mL 试管转移到单个 1.5 mL 微量离心管中,并在 4 °C 下以 400 × g 离心 3 分钟。
- 小心地从微量离心管中取出上清液,并将隐窝沉淀重悬于 70 μL BME(每孔 20 μL 和 10 μL 额外死体积)中。
- 使用预孵育的 48 孔板(步骤 1.1),将 20 μL BME/crypt 悬浮液接种到每个孔的中心(每孔 1 个 BME 圆顶)。平稳稳定地倒置板,并在 37 °C、5% CO2 下孵育 20 分钟。
注:倒置板可防止细胞粘附在孔的塑料表面,并确保它们在 BME 内的分布。 - 从培养箱中取出板。确保 BME 已完全聚合,然后用 350 μL 预热的类器官增殖培养基覆盖圆顶,并补充有 100 μg/mL 的广谱抗菌试剂。将板在 37 °C、5% CO2 下孵育。
注:广谱抗菌试剂用于防止与结肠活检相关的粘膜微生物污染。仅在隐窝隔离后的第一周培养才需要。 - 使用预热的类器官增殖培养基在一周内更换培养基 2-3 次,并在培养的第一周补充广泛的抗菌试剂;在此期间后,取出试剂。
- 一旦结肠样培养物完全建立(分离后 1-2 周),使用补充有 10 μM ROCK-I/II 抑制剂 Y-27632 的酶解离试剂解离结肠素(有关结肠样解离的完整详细信息,请参见第 2 节)。
注意:对于前两次传代(P0-1、P1-2),应使用 1:1/2 的比例扩增结肠;P2 后,结肠样化合物可以以 1:3/4 的比例传代。 - 按照步骤 1.11-1.13 接种并维持结肠素(不要用广泛的抗菌试剂补充类器官增殖培养基)。
2. 制备用于细胞死亡测定的结肠素
注意:细胞死亡测定方案需要 4 天才能完成(图 1A)。
- 使用 48 孔板形式扩增结肠素,每孔接种 20 μL BME/隐窝悬浮液,在 37 °C、5% CO2 下孵育,每周更换培养基 2-3 次(每孔 350 μL)。
- 在收获细胞死亡测定前约 1 周传代结肠素。在收获结肠素之前,确保它们繁殖到高密度(图 1Bi),它们的直径约为 25-50 μm,并且正在积极增殖。
注意:我们从第 3 次传代到第 14 次传代使用结肠素进行该测定,结果一致。然而,已经证明结肠样化合物对细胞因子的转录反应会根据培养持续时间而变化18。在此基础上,我们建议在第 15 代后不要使用结肠素进行该测定。 - 在用结肠样细胞接种之前,将 96 孔微量滴定板在 37 °C、5% CO2 下预孵育至少 72 小时。
- 在开始实验前一天晚上,在 4 °C 的冰上解冻 BME。
- 通过补充 10 μM 的 ROCK-I/II 抑制剂 Y-27632,制备足够体积的酶解离试剂(每孔结肠素 500 μL)。从含有结肠素的孔中轻轻去除培养基;从孔边缘移液,以避免损坏结肠样圆顶。向每个孔中加入 300 μL 酶解离试剂。
- 对于每个孔,用 P1000 移液器的尖端刮擦孔表面并上下移液细胞悬液,从而打破结肠样圆顶;尽量避免产生气泡。将细胞悬液收集在 15 mL 试管中。
注意:该 15 mL 管将用于从 48 孔板的 10 个孔中收集结肠素。 - 用另外 200 μL 酶解离试剂清洗相同的孔,以确保收集所有结肠样材料并转移到同一个 15 mL 试管中。对正在收获的扩增结肠素的每个孔重复此过程,并将它们收集在同一个 15 mL 管中。
注意:为了有效解离,每管最多应收集 10 个结肠素孔。如果收集 >10 个孔,将收集的结肠素平均分装在多个 15 mL 试管中。
- 对于每个孔,用 P1000 移液器的尖端刮擦孔表面并上下移液细胞悬液,从而打破结肠样圆顶;尽量避免产生气泡。将细胞悬液收集在 15 mL 试管中。
- 将 15 mL 试管与步骤 2.5.2 中收集的定型物在 37 °C 的水浴中孵育 5 分钟。孵育后,将试管以 400 × g 离心 3 分钟。轻轻去除上清液,在试管中留下大约 1.2 mL。
注意:下一步需要使用快速移液对结肠素进行物理解离。为了有效,试管中必须有少量细胞悬液 - 15 mL 试管中剩余的 1.2 mL 就足以达到此目的。 - 将结肠样沉淀重悬于剩余的 1.2 mL 酶解离试剂中。使用设置为 1,000 μL 的 P1000 移液器,将移液器吸头放入悬浮液中,将其保持在 15 mL 试管底部刚好上方,然后快速将悬浮液移入和移出吸头。要快速移液,请快速按下柱塞按钮至第一个停止位置,松开按钮,直到它大约到达顶部位置的一半,然后重复。快速移液约 10 秒(30-40 次下降),然后完全重悬悬液并重复移液。进行 2-3 轮快速移液。
- 在显微镜下检查样品,确认没有留下完整的结肠样体,并且大多数结肠样片段的大小约为 30-40 μm(图 1Bii)。
- 如果样品需要进一步解离,请在 37 °C 的水浴中再孵育 3 分钟,重复步骤 2.7 中的移液技术,并在显微镜下检查样品。重复此过程,直到大多数结肠样片段达到最佳大小。
注意:注意不要过度解离结肠素,因为这会导致细胞过度死亡、接种效率低和结肠素尺寸过小。 - 向 15 mL 试管中加入 10 mL 冰冷的类器官洗涤培养基(表 1)。将试管以 400 × g 离心 3 分钟,去除上清液,重悬于 1 mL 冰冷的类器官洗涤培养基中,然后转移到 1.5 mL 微量离心管(称为 结肠样碎片管)中。
- 通过移液混合 结肠样片段管 的内容物,并取 50 μL 样品;将该 50 μL 样品转移至新的 1.5 mL 微量离心管(称为 细胞计数管)中。从这一点开始,将 结肠样碎片管 储存在冰上,直到步骤 2.15 完成。
- 将 细胞计数管 以 400 × g 离心 3 分钟,去除上清液,然后重悬于 500 μL 补充有 10 μM ROCK-I/II 抑制剂 Y-27632 的酶解离试剂中。
- 将单 细胞计数管 在 37 °C 的水浴中孵育 5 分钟。使用设置为 400 μL 的 P1000 移液器,按照步骤 2.7 中的说明移液样品,并在显微镜下检查样品以确保存在单细胞悬液。如果没有,请重复此过程,直到结肠类化合物完全解离成单细胞悬液。
- 向单 细胞计数管中加入 1 mL 类器官洗涤培养基,以 400 × g 离心 3 分钟,然后小心去除上清液。将细胞重悬于 50 μL 类器官洗涤培养基中,然后加入 50 μL 台盼蓝。
- 使用血细胞计数器计数细胞。计算 50 μL 样品中的细胞数量,并使用它来计算 结肠样片段管中的细胞浓度。
- 计算实验所需的细胞悬液体积,其中 96 孔微量滴定板每孔将接种 0.5 ×10 4 个结肠样细胞。在此计算的体积中增加大约 15% 的额外内容,以考虑死体积。将此总体积从 结肠样碎片管 (步骤 2.11)转移到新的 1.5 mL 微量离心管中。
- 将含有结肠样片段的新型 1.5 mL 微量离心管以 400 × g 离心 3 分钟,去除上清液,然后重悬于 BME 中(每 0.5 × 104 个细胞使用 10 μL BME)。
注:由于 BME 的物理特性(高粘度、温度依赖性聚合),移液可能会损失大量材料(死体积)。
- 将含有结肠样片段的新型 1.5 mL 微量离心管以 400 × g 离心 3 分钟,去除上清液,然后重悬于 BME 中(每 0.5 × 104 个细胞使用 10 μL BME)。
- 将含有结肠样体/BME 悬浮液的试管或储液槽放在生物安全柜内的无菌容器中。
注意:接种时将细胞保持在冰上可防止细胞底物过早聚合。 - 使用预孵育的 96 孔微量滴定板(来自步骤 2.3),每孔反向移液 10 μL 结肠样化合物/BME 溶液。确保将吸头放在孔表面的正上方,并将移液管移入中心,以避免撞到孔壁。定期混合结肠素/BME 悬浮液以防止接种不均匀。
注意:不要在微量滴定板的外边缘孔中接种结肠素。- 反向移液:
- 设置移液器,然后按下柱塞按钮,越过第一个挡块到第二个挡块。
- 保持此位置,将吸头浸入结肠/BME 悬液中,然后慢慢将柱塞释放到顶部。
- 轻轻稳定地将柱塞按钮按到第一个停止位置,分配悬浮液。如果播种更多孔,请保持此位置并重复步骤 2.18.1.2-2.18.1.3。
- 完成后,将柱塞按钮按到第二个挡块,排出少量剩余的悬浮液。
注意:由于 BME 的高粘度,我们建议使用反向移液技术。
- 反向移液:
- 平稳稳定地倒置板,并在 37 °C、5% CO2 下孵育 20 分钟。
- 从培养箱中取出板。确保 BME 已完全聚合,然后用 200 μL 预热的类器官增殖培养基覆盖圆顶。如果使用带有周围护城河(减少蒸发)的 96 孔微量滴定板,请用 2 mL 类器官洗涤培养基填充每个储液槽。
- 将结肠样化合物在 37 °C、5% CO2 下孵育 3 天,每天显微镜检查一次,以确保结肠样结肠素已恢复并增殖。
3. 用于细胞死亡测定的结肠样处理
- 通过将荧光细胞死亡染料或 DMSO 添加到预热的类器官增殖培养基中,制备 2.5 μM 荧光细胞死亡染料(SYTOX Green 核酸染料)和 DMSO 溶液(表 2)。
注:保护荧光细胞死亡染料原液和稀释溶液避光。SYTOX Green 核酸染色剂溶于 DMSO 中;DMSO 溶液用于制备无染料条件,以控制溶剂效应。 - 使用步骤 3.1 中的 2.5 μM 荧光细胞死亡染料和 DMSO 溶液制备处理,如 表 2 所示。
- 通过倾斜板并从孔边缘移液,从接种有结肠素的 96 孔微量滴定板中轻轻去除培养基;然后,每孔添加 200 μL 处理培养基。确保在最大毒性条件下有额外的 PBS/BSA 对照孔(板图见 表 2)。
- 将结肠素在 37 °C、5% CO2 下孵育所需的处理时间点,直到准备好成像。
- 至少在成像前 2 小时,在无菌细胞培养级水中制备 10% v/v 的 Triton-X 100 溶液,并将 22 μL 的 10% Triton-X 100 直接添加到最大毒性条件下的对照孔培养基中,至终浓度为 1% v/v成像前 1 小时。
注:使用 10% 溶液可减少由于表面活性剂的高粘度而可能出现的移液误差。
4. 图像采集
- 从培养箱中取出接种有结肠素的 96 孔微量滴定板,并转移到数字倒置落射荧光显微镜的载物台上。让板达到室温。
- 通过在显微镜下检查结肠素,确认 Max Toxicity 条件结肠素已完全裂解(图 1Biii)。
- 选择合适的物镜,例如长工作距离 40 倍荧光物镜。在开始之前优化显微镜的成像设置。
- 使用传输通道,专注于具有 SYTOX 阳性细胞的结肠样蛋白,切换到绿色荧光蛋白 (GFP)
通道 (488 nm),并调整光强度和曝光时间,以最大限度地提高荧光信号,同时最大限度地减少背景。首先,尝试低光强度,然后逐渐增加曝光时间;如果曝光时间不切实际,则稍微增加光强度。
注意:增加曝光时间而不是光强度将降低样品的光毒性和光漂白19.仅在必要时将样品暴露在荧光灯下。
- 使用传输通道,专注于具有 SYTOX 阳性细胞的结肠样蛋白,切换到绿色荧光蛋白 (GFP)
- 使用 GFP 通道的优化成像设置,观察 No Dye 和 Max Toxicity 条件,以确保样品不会曝光过度或曝光不足。完成后,请保持不同条件之间的成像设置一致。
- 使用随机采样方法采集图像:通过选择遵循覆盖结肠样圆顶的固定网格模式的视野 (FOV) 来执行此操作。从至少 10 个 FOV 获取结肠体的图像。确保结肠体的中心平面聚焦并在透射和 GFP 通道中获取图像。
- 应用以下排除标准。
- 如果 FOV 中不存在结肠,请不要获取图像。
- 如果 FOV 中存在的同一焦平面中只有重叠的结肠,请不要获取图像(图 1Biv)。
- 如果 FOV 中仅存在结肠样碎片,请不要获取图像(图 1Bv)。不要在分析中包括结肠样碎片。
- 应用以下排除标准。
- 以便携式网络图形格式保存图像并导出。
- 如果对其他时间点进行成像,请将带有结肠素的 96 孔微量滴定板放回 37 °C、5% CO2 的培养箱中。
5. 图像分析
- 打开 Fiji ImageJ 并通过将文件拖放到 ImageJ 工具栏上或导航到文件 |打开 并选择文件。打开后,单击 Image|堆栈|要堆叠的图像。通过单击将图像堆栈转换为 8 位文件格式 Image|类型 |8 位。
- 对于每个图像集,单击 ImageJ 工具栏上的 手绘选择 工具,然后使用计算机鼠标手动选择透射图像上的感兴趣区域 (ROI);ROI 是结肠体的周长。然后,在图像堆栈之间切换到相应的 GFP 通道图像。
- 单击 Analyze(分析)|设置度量;在 Set Measurements 对话框窗口中,勾选 Mean Gray Value 并取消勾选所有其他框。选择 GFP 图像后,单击 Analyze |测量。对图像堆栈中的每个结肠重复此分析。分析数据集后,复制 Results (结果 ) 窗口中的所有数据并将其粘贴到电子表格软件应用程序中。
6. % 最大毒性计算
- 使用方程 (1) 计算每种条件的技术仿行灰度均值 (MGV) 的均值。
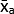 (处理 A 的均值) =
(处理 A 的均值) = 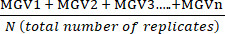 (1)
(1) - 使用公式 (2) 将每个条件的平均值表示为相对于最大毒性条件 (MT) 平均值的百分比。
%MTa =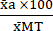 (2)
(2)
7. 计算 CPI
- 使用步骤 6.1 中计算的平均值,按如下方式对数据进行归一化 (NORM),从每个处理条件和最大毒性 (MT) 条件中减去未处理条件 (UT) 的平均值(以去除独立于细胞因子处理发生的背景细胞死亡)。然后,将每个处理条件除以最大毒性 (MT) 条件的背景减去平均值,如等式 (3) 所示。
范数a =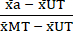 (3)
(3) - 从 1 中减去步骤 7.1 中计算的标准化值;所得值代表处理后的细胞活力 (V)(如下面的公式 (4) 所示)。
Va = 1 −范数 a (4) - 使用公式 (5) 计算 perturbagen 相互作用系数 (CPI):
CPI =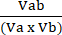 (5)
(5)
其中 a 表示第一次处理; b 表示第二种处理; AB 是联合治疗。CPI 值表示协同 (<1)、加性 (=1) 或拮抗 (>1) 关系。
结果
使用该方案,我们展示了如何使用 CD 患者结肠样化合物来研究 IBD 相关细胞因子 IFN-γ 和 TNF-α 对原发性上皮的细胞毒作用。我们使用了一种市售的荧光细胞死亡染料(SYTOX Green 核酸染色剂),它只能进入细胞膜受损的细胞,然后通过与核酸结合而被激活。我们用细胞因子和荧光细胞死亡染料共处理结肠素,并在 8 小时和 24 小时用倒置落射荧光显微镜进行活细胞成像。8 小时时的代表性透射/荧光叠加图像表明,只有 IFN-γ + TNF α处理的结肠素对荧光信号呈阳性;然而,只有少量的荧光细胞(图 2A)。细胞起泡是细胞死亡20 的形态学指标,也可以在 IFN-γ + TNF-α 条件下观察到。在 24 小时时,用 IFN-γ + TNF-α 处理的结肠素显示荧光信号阳性的大区域(图 2A)。结肠样的形态也出现了明显的破坏——中央腔不再可见,上皮屏障已经完全被破坏。
为了量化细胞死亡染料信号,我们使用开源图像分析软件来计算每个结肠样的荧光强度。然后,我们通过将每种情况的平均值表示为 Max Toxicity 治疗的百分比来标准化数据。在 8 小时时,BSA 对照结肠样体中的稳态或背景细胞死亡相对较低(最大毒性的 7.7%)(图 2B)。此时细胞死亡水平没有统计学意义的变化;然而,用 TNF-α 治疗的病症显示细胞毒性略有增加(图 2B)。24 小时后,所有细胞因子处理条件的细胞死亡水平均增加。然而,BSA 对照条件在时间点之间的细胞死亡变化很小(24 小时时最大毒性的 7.5%)。与 BSA 对照相比,用 IFN-γ + TNF-α 处理的结肠样结肠的细胞死亡水平增加最大(最大毒性的 29.4%)。联合治疗和单一细胞因子治疗 (IFN-γ、TNF-α) 之间的细胞死亡水平差异非常显著。这些结果表明 IFN-γ 和 TNF-α 在 24 小时时可能存在细胞毒性协同相互作用。
我们使用 CPI 来量化细胞因子治疗之间的细胞毒性相互作用,并确定它们是否具有协同作用。当 CPI 值为 <1 时,细胞因子之间的相互作用被认为是协同的,当 =1 时被认为是加性的,当 >1 时是拮抗性的。我们计算了每个时间点的 CPI 值(图 2C)。8 小时时,CPI 值表明轻微的协同作用 (0.99),24 小时 (0.83) 时 CPI 值显着下降。该分析证实 IFN-γ 和 TNF-α 在 24 h 时的相互作用是协同的。此外,它说明了在这种情况下,IFN-γ 和 TNF-α 之间的协同作用是如何与时间相关的。
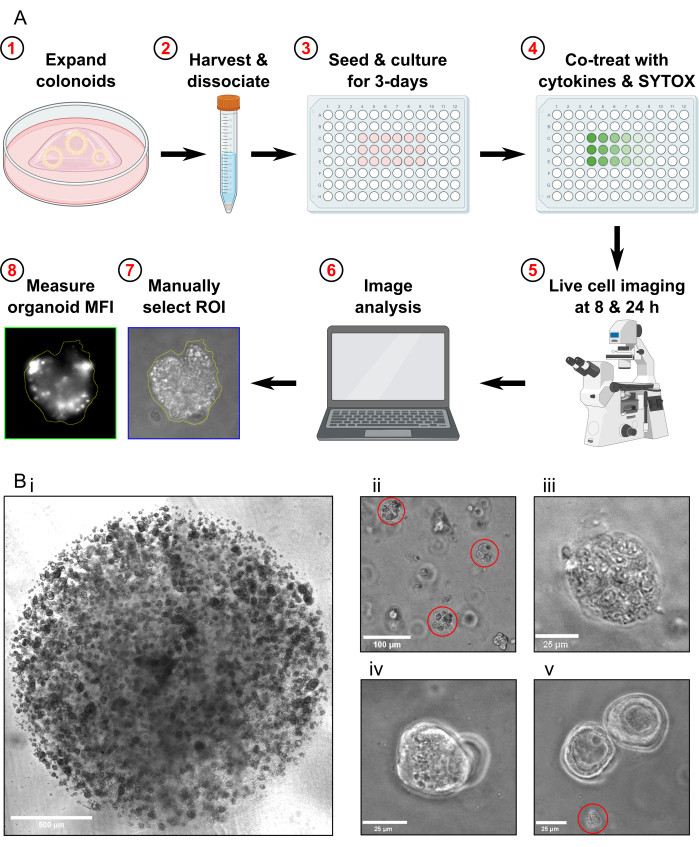
图 1:实验工作流程和故障排除示意图。 (A) 方案示意图概述。(B) 代表性图像。(比)光学显微镜图像说明了在传代进行测定之前培养物的最佳密度和结肠样化合物的最佳大小。比例尺 = 500 μm。(Bii) 光学显微镜图像显示了解离后结肠样片段的最佳大小;片段以红色突出显示。比例尺 = 100 μm。(Biii) MT 治疗后坏死结肠样形态的光学显微镜图像(使用 Triton X-100)。比例尺 = 25 μm。(Biv) 两个结肠在同一焦平面上重叠的光学显微镜图像。比例尺 = 25 μm。(Bv) 传代后存在的结肠样细胞碎片的光学显微镜图像;碎片以红色突出显示。比例尺 = 25 μm。缩写: ROI = 感兴趣区域;MFI = 平均荧光强度;MT = 最大毒性。 请单击此处查看此图的较大版本。
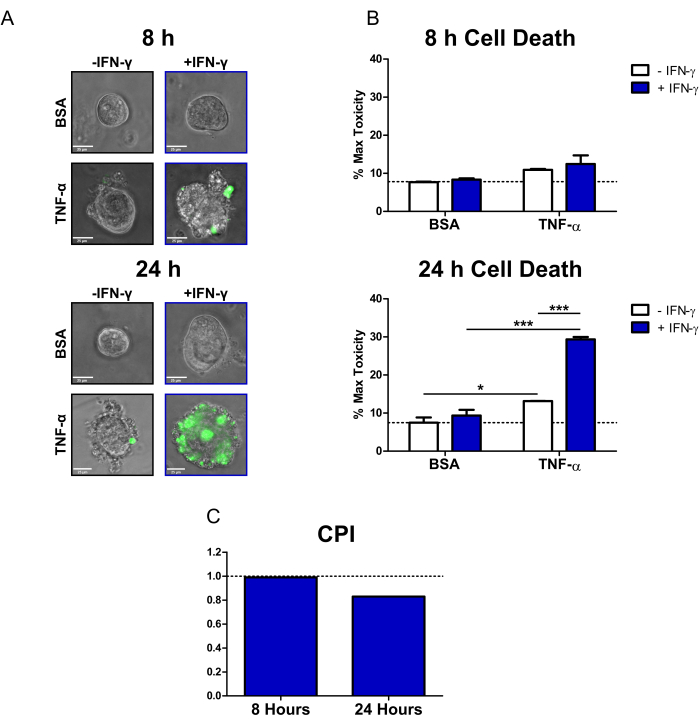
图 2:细胞因子诱导的人 CD 结肠样细胞死亡的定量分析。 (A) 用 SYTOX Green 核酸染色剂(荧光细胞死亡染料)和细胞因子处理的 CD 结肠样体在 8 小时和 24 小时时的代表性实时显微镜图像;传输和 GFP(绿色)通道叠加。结肠样化合物处理如下:1) PBS/BSA,2) 10 ng/mL IFN-γ,3) 10 ng/mL TNF-α,4) 10 ng/mL IFN-γ + 10 ng/mL TNF-α。比例尺 = 25 μm。(B) 在 8 和 24 小时用荧光细胞死亡染料和细胞因子处理的 CD 结肠样化合物的定量分析;数据表示为 MT 条件的百分比。N = 2 个 CD 结肠样线,每个条件成像 11-16 个结肠样。(C) 使用来自 B 的数据集计算每个时间点的 CPI,N = 2 CD 结肠线。数据以 SE ±均值表示。在 B 中,进行双向方差分析,然后进行 Bonferroni 后验,*P < 0.05,***P < 0.001,如图所示。缩写: CD = 克罗恩病;GFP = 绿色荧光蛋白;CPI = Perturbagen 相互作用系数;PBS = 磷酸盐缓冲盐水;BSA = 牛血清白蛋白;TNF-α = 肿瘤坏死因子-α;IFN-γ = 干扰素-γ;MT = 最大毒性。 请单击此处查看此图的较大版本。
表 1:方案的培养基组成。 要制备类器官增殖培养基,请将 L-WRN 条件培养基和无血清培养基 1:1 混合,然后添加添加剂。类器官增殖培养基应在制备后 2 周内使用。请注意,所有完整培养基均应在 4 °C 下储存。 请单击此处下载此表格。
表 2:实验性 96 孔板布局和细胞因子处理。请点击此处下载此表格。
讨论
已经开发了几种方法用于定量分析肠道类器官中的细胞死亡。通过光学显微镜检查肠道类器官形态的破坏是量化细胞毒性物质影响的一种直接方法11。然而,形态变化不是细胞死亡的直接测量,该方法只是半定量的。另一种方法是使用 MTT 或 ATP 测定评估类器官代谢活性10,11。需要注意的是,这些检测只能确定细胞活力的变化,并且必须通过细胞死亡检测进行验证。其他使用 DNA 结合染料的荧光细胞死亡测定已有报道12,13。使用荧光酶标仪的非成像方法是可能的,并且可实现高通量12。然而,这种方法测量的是整个井的平均信号,因此不适合异质群体。它还需要使用具有 Z 高度调节功能的酶标仪。基于荧光成像的技术可用于单类器官分析并捕获细胞/亚细胞和形态学数据。自动共聚焦高内涵成像 (HCI) 系统可以高通量生成大量数据13。遗憾的是,共聚焦 HCI 需要专门的设备,使用复杂的方案,通常需要商业图像分析软件,而且价格昂贵。
我们用于在多个时间点定量分析结肠样细胞死亡的方案简单明了、简单且成本低廉。然而,与自动化 HCI 和读板系统相比,它非常耗时且通量较低。我们方法的另一个局限性是使用宽场而不是共聚焦显微镜。共聚焦显微镜更适合对厚 3D 样品(如类器官)进行成像,因为它可以减少离焦信号,并且可以采集连续的光学切片(Z 堆栈)。然而,共聚焦成像通常需要更长的采集时间和高强度激光,这会增加光毒性/光漂白。需要注意的是,SYTOX Green 等荧光细胞死亡染料仅适用于测量细胞膜完整性丧失的细胞死亡形式,例如坏死、晚期凋亡相关继发性坏死、坏死性凋亡和焦亡21。有一些形式的调节性细胞死亡,其中细胞膜至少在细胞死亡的早期阶段保持不渗透性,例如 caspase 依赖性细胞凋亡。然而,该方案可以很容易地修改为也包含半胱天冬酶 3/7 活性荧光报告基因22 的成像。这将提供额外的数据来帮助表征特定的细胞死亡方式。
我们使用我们的方案来证明细胞因子 IFN-γ 和 TNF-α 之间的细胞毒性协同相互作用(图 2C),我们之前在 CD 患者来源的类器官 9,10 中报道过。这种形式的协同作用的生理相关性也已在噬血细胞性淋巴组织细胞增生症和败血症的小鼠模型中得到证明23。已经实施了几种数学参考模型和方法来量化生物制剂组合之间的协同作用24,25。它们在复杂性、考虑的因素数量以及认为交互作用具有协同作用的阈值方面有所不同24,25。一些模型需要对测试的生物制剂的先验知识,对药物的活性做出某些假设,并且可能需要每种单一和联合治疗的综合剂量-反应曲线25。我们选择用于测量协同作用的方法是对药物相互作用系数 (CDI) 模型的修改,该模型以前用于测量化疗药物组合对癌细胞系增殖的抑制作用26。CDI 是 Bliss 独立模型;在计算两个 perturbagens 的预测综合效应时,Bliss 独立性假设它们针对不同的途径并具有独立的作用机制27。要使 perturbagens 之间的交互作用具有协同作用,实际的组合效应必须大于预测的效应。该模型适用于我们的实验设置,因为已知 IFN-γ 和 TNF-α 具有不同的受体和下游信号转导成分。此外,Bliss 独立性允许计算相互作用系数以量化协同作用,并且不需要剂量反应数据集。
为了确保该实验步骤的最佳结果,必须考虑几个关键因素。重要的是,定型细胞要繁殖到高密度(图 1Bi),它们的直径约为 25-50 μm,并且在尝试接种细胞之前会积极增殖。使用次优的结肠样化合物培养物进行检测可能会导致细胞数量不足、结肠样化合物回收率低和实验不一致。为了获得可重复的结果,在实验之间一致地接种结肠素的密度也很重要。先前已经证明,对炎性细胞因子的体外反应会受到细胞接种密度的影响28,29。另一个常见问题是在 BME 圆顶中形成气泡,这会影响成像。这可以通过使用反向移液技术来防止。此技术还会产生更一致的种子设定。
此外,如果对多个时间点进行成像,请为每个时间点准备 Max Toxicity 条件。Triton-X 100 是一种非离子表面活性剂,通常用作细胞毒性测定的阳性对照(最大毒性条件)。添加 Triton-X 100 可裂解并杀死结肠样化合物,使荧光细胞死亡染料进入细胞。由于荧光信号随时间衰减,使用较早时间点的 Max Toxicity 条件将导致数据归一化不准确且不一致。
最后要考虑的一点是用于结肠样培养的 BME 的选择。有几家 BME 的商业生产商;但是,对于我们的协议,我们只测试了 材料表中包含的品牌。最近一项使用患者来源的胰腺癌类器官的研究发现,BME 的商业来源改变了细胞增殖率,但对化疗药物的反应或基因表达没有显着影响30。考虑到这一点,我们预计我们的实验方案中 BME 品牌之间的结果趋势会相似,但我们建议始终使用相同的品牌。
我们展示了该方案如何用于使用 CD 患者来源的结肠类化合物分析 IFN-γ 和 TNF-α 诱导的细胞死亡。患者来源的肠道类器官是研究 CD 的有力工具,因为它们保留了疾病的许多特征,包括对 TNF-α 细胞毒作用的敏感性增加31。然而,该方案可以很容易地修改以研究细胞因子以外的扰动因子或 IBD 以外的疾病状态(如结直肠癌)的细胞毒性作用(我们已经使用非 IBD 结肠样化合物成功测试了该方案)。我们相信这种方法对于任何涉及细胞死亡机制、上皮屏障功能或肠粘膜免疫学的研究领域都很有用。
披露声明
在工作完成期间,K.N. 接受了 AbbVie Inc. 的研究资助。这笔资金是在向 APC Microbiome Ireland 颁发研究中心辐条奖 (SFI-14/SP/2710) 的背景下进行的。
致谢
作者要感谢患者对研究的知情同意和参与,以及临床人员的出色帮助。 图 1A 是使用 BioRender.com 创建的。这项工作得到了爱尔兰科学基金会的资助——即 KN 的职业发展奖 (CDA) (SFI-13/CDA/2171)、研究中心资助 (SFI-12/RC/2273) 和研究中心发言奖 (SFI-14/SP/2710) 给 APC 微生物组爱尔兰。P.F. 还获得了 SFI/20/RP/9007 的资助。
材料
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F12 | Gibco | 12634010 | |
| Amphotericin B Solution | Sigma-Merck | A2942 | |
| A-83-01 | Sigma-Merck | SML0788 | |
| BioRender | Science Suite Inc. | N/A | Scientific illustration software |
| Bovine Serum Albumin | Sigma-Merck | A2058 | Essentially IgG-free, low endotoxin |
| B27 Supplement | Invitrogen | 17504-044 | |
| CHIR-99021 | Sigma-Merck | SML1046 | |
| Costar 48-well Clear TC-treated Multiple Well Plates, Individually Wrapped, Sterile | Corning | 3548 | |
| Cultrex Basement Membrane Extract, Type 2, Pathclear | R&D Systems | 3532-010-02 | Basement membrane extract |
| Dimethyl sulfoxide | Sigma-Merck | D2650 | |
| Dulbecco′s Phosphate Buffered Saline | Sigma-Merck | D8537 | |
| EVOS FL Digital Inverted Fluorescence Microscope | Invitrogen | AMF4300 | Digital inverted epifluorescence microscope |
| EVOS 40x Objective, fluorite, LWD, phase-contrast | ThermoFisher Scientific | AMEP4683 | Long working distance 40x fluorescence objective |
| Fiji/ImageJ (Windows version) | Open-source software | N/A | Image analysis software |
| Foetal Bovine Serum | Sigma-Merck | F9665 | |
| Gentamicin Solution | Sigma-Merck | G1397 | |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 100-0485 | Enzyme-free cell dissociation reagent |
| GlutaMAX-1 | Gibco | 35050061 | L-alanyl-L-glutamine dipeptide supplement |
| GraphPad Prism 5 (Windows version) | Dotmatics | N/A | Data graphics and statistics software |
| Greiner 15 mL Polypropylene Centrifuge Tube, Sterile with conical bottom & Screw Cap | Cruinn | 188261CI | |
| HEPES 1 M | Gibco | 15630080 | |
| Human recombinant EGF (animal free) | Peprotech | AF-100-15 | |
| N-Acetylcysteine | Sigma-Merck | A9165 | |
| Nicotinamide | Sigma-Merck | N0636 | |
| Normocin | InvivoGen | ant-nr-05 | Broad range antimicrobial reagent |
| Nunc Edge 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | ThermoFisher Scientific | 15543115 | |
| N2 supplement | Invitrogen | 17502-048 | |
| Recombinant Human IFN-gamma Protein | R&D Systems | 285-IF | Resuspend in sterile filtered 0.1% PBS/BSA |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA | Resuspend in sterile filtered 0.1% PBS/BSA |
| SB202190 | Sigma-Merck | S7067 | |
| Snap Cap Low Retention Microcentrifuge Tubes | ThermoFisher Scientific | 3451 | |
| SYTOX Green Nucleic Acid Stain - 5 mM Solution in DMSO | Invitrogen | S7020 | Fluorescent cell death dye, protect from light |
| Triton X-100 | Sigma-Merck | 93420 | |
| Trypan Blue solution | Sigma-Merck | T8154 | |
| Tryple Express | Gibco | 12604013 | Enzymatic dissociation reagent |
| Y-27632 | MedChemExpress | HY-10071 | Inhibitor of ROCK-I and ROCK-II |
参考文献
- Patankar, J. V., Becker, C. Cell death in the gut epithelium and implications for chronic inflammation. Nat Rev Gastroenterol Hepatol. 17 (9), 543-556 (2020).
- Zeissig, S., et al. Downregulation of epithelial apoptosis and barrier repair in active Crohn's disease by tumour necrosis factor alpha antibody treatment. Gut. 53 (9), 1295-1302 (2004).
- Bartee, E., Mcfadden, G. Cytokine synergy: An underappreciated contributor to innate anti-viral immunity. Cytokine. 63 (3), 237-240 (2013).
- Fish, S. M., Proujansky, R., Reenstra, W. W. Synergistic effects of interferon γ and tumour necrosis factor α on T84 cell function. Gut. 45 (2), 191-198 (1999).
- Wakisaka, Y., Sugimoto, S., Sato, T. Organoid medicine for Inflammatory Bowel Disease. Stem Cells. 40 (2), 123-132 (2022).
- Flood, P., Hanrahan, N., Nally, K., Melgar, S. Human intestinal organoids: Modeling gastrointestinal physiology and immunopathology - current applications and limitations. Eur J Immunol. 54 (2), e2250248 (2024).
- Matsuzawa-Ishimoto, Y., et al. An intestinal organoid-based platform that recreates susceptibility to t-cell-mediated tissue injury. Blood. 135 (26), 2388-2401 (2020).
- Lee, C., et al. Intestinal epithelial responses to IL-17 in adult stem cell-derived human intestinal organoids. J Crohns Colitis. 16 (12), 1911-1923 (2022).
- Woznicki, J. A., et al. TNF-α synergises with IFN-γ to induce caspase-8-JAK1/2-STAT1-dependent death of intestinal epithelial cells. Cell Death Dis. 12 (10), 864 (2021).
- Flood, P., et al. DNA sensor-associated type I interferon signaling is increased in ulcerative colitis and induces jak-dependent inflammatory cell death in colonic organoids. Am J Physiol Gastrointest Liver Physiol. 323 (5), G439-G460 (2022).
- Grabinger, T., et al. Ex vivo culture of intestinal crypt organoids as a model system for assessing cell death induction in intestinal epithelial cells and enteropathy. Cell Death Dis. 5 (5), e1228 (2014).
- Bode, K. J., Mueller, S., Schweinlin, M., Metzger, M., Brunner, T. A fast and simple fluorometric method to detect cell death in 3D intestinal organoids. Biotechniques. 67 (1), 23-28 (2019).
- Mertens, S., et al. Drug-repurposing screen on patient-derived organoids identifies therapy-induced vulnerability in KRAS-mutant colon cancer. Cell Rep. 42 (4), 112324 (2023).
- Vandussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nat Protoc. 8 (12), 2471-2482 (2013).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Woznicki, J. A., et al. Human BCL-G regulates secretion of inflammatory chemokines but is dispensable for induction of apoptosis by IFN-γ and TNF-α in intestinal epithelial cells. Cell Death Dis. 11 (1), 68 (2020).
- Edgar, R. D., et al. Culture-associated DNA methylation changes impact on cellular function of human intestinal organoids. Cell Mol Gastroenterol Hepatol. 14 (6), 1295-1310 (2022).
- Mubaid, F., Brown, C. M. Less is more: Longer exposure times with low light intensity is less photo-toxic. Microscopy Today. 25 (6), 26-35 (2017).
- Ziegler, U., Groscurth, P. Morphological features of cell death. News Physiol Sci. 19 (3), 124-128 (2004).
- Zhang, Y., Chen, X., Gueydan, C., Han, J. Plasma membrane changes during programmed cell deaths. Cell Res. 28 (1), 9-21 (2018).
- Tamura, H., et al. Evaluation of anticancer agents using patient-derived tumor organoids characteristically similar to source tissues. Oncol Rep. 40 (2), 635-646 (2018).
- Karki, R., et al. Synergism of TNF-α IFN-γ triggers inflammatory cell death, tissue damage, and mortality in SARS-CoV-2 infection and cytokine shock syndromes. Cell. 184 (1), 149-168 (2021).
- Geary, N. Understanding synergy. Am J Physiol Endocrinol Metab. 304 (3), E237-E253 (2013).
- Duarte, D., Vale, N. Evaluation of synergism in drug combinations and reference models for future orientations in oncology. Curr Res Pharmacol Drug Discov. 3, 100110 (2022).
- Wong, F. C., Woo, C. C., Hsu, A., Tan, B. K. The anti-cancer activities of Vernonia amygdalina extract in human breast cancer cell lines are mediated through caspase-dependent and p53-independent pathways. PLoS One. 8 (10), e78021 (2013).
- Ryall, K. A., Tan, A. C. Systems biology approaches for advancing the discovery of effective drug combinations. J Cheminform. 7, 7 (2015).
- Sukho, P., et al. Effect of cell seeding density and inflammatory cytokines on adipose tissue-derived stem cells: An in vitro study. Stem Cell Rev Rep. 13 (2), 267-277 (2017).
- Vaughan-Jackson, A., et al. Density dependent regulation of inflammatory responses in macrophages. Front Immunol. 13, 895488 (2022).
- Lumibao, J. C., et al. The impact of extracellular matrix on the precision medicine utility of pancreatic cancer patient-derived organoids. bioRxiv. , (2023).
- Lee, C., et al. TNF-α induces LGR5+ stem cell dysfunction in patients with Crohn's disease. Cell Mol Gastroenterol Hepatol. 13 (3), 789-808 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。