Method Article
Quantifizierung des Zytokin-induzierten Zelltods in humanen Dickdarmorganoiden mittels Live-Fluoreszenzmikroskopie
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine einfache und kostengünstige Methode zur Untersuchung und Quantifizierung des Zelltods in menschlichen Dickdarmorganoiden als Reaktion auf zytotoxische Störungen wie Zytokine. Der Ansatz verwendet einen fluoreszierenden Zelltodfarbstoff (SYTOX Green Nucleic Acid Stain), Lebendfluoreszenzmikroskopie und Open-Source-Bildanalysesoftware, um die Reaktionen einzelner Organoide auf zytotoxische Reize zu quantifizieren.
Zusammenfassung
Der Tod von Darmepithelzellen (IEC) ist bei Patienten mit entzündlichen Darmerkrankungen (IBD) wie Colitis ulcerosa (UC) und Morbus Crohn (CD) erhöht. Dies kann zu Defekten der Darmbarrierefunktion, einer Verschlimmerung von Entzündungen und der Immunpathogenese der Krankheit beitragen. Zytokine und Todesrezeptor-Liganden sind teilweise für diesen Anstieg des IEC-Todes verantwortlich. IBD-relevante Zytokine wie TNF-α und IFN-γ sind sowohl unabhängig als auch in Kombination zytotoxisch gegenüber IECs. Dieses Protokoll beschreibt einen einfachen und praktischen Assay zur Quantifizierung der Zytokin-induzierten Zytotoxizität in Dickdarmorganoiden von Zöliakie-Patienten unter Verwendung eines fluoreszierenden Zelltodfarbstoffs (SYTOX Green Nucleic Acid Stain), Live-Fluoreszenzmikroskopie und Open-Source-Bildanalysesoftware. Wir zeigen auch, wie das mathematische Modell der Bliss-Unabhängigkeit verwendet werden kann, um einen Koeffizienten der Perturbagen-Wechselwirkung (CPI) auf der Grundlage der organoiden Zytotoxizität zu berechnen. Der CPI kann verwendet werden, um zu bestimmen, ob Wechselwirkungen zwischen Zytokinkombinationen oder anderen Arten von Störungen antagonistisch, additiv oder synergistisch sind. Dieses Protokoll kann implementiert werden, um die zytotoxische Aktivität von Zytokinen und anderen Störungen unter Verwendung von Dickdarmorganoiden von Patienten zu untersuchen.
Einleitung
Das Darmepithel bildet eine physikalische semipermeable Barriere zwischen dem Inhalt des Darmlumens und dem darunter liegenden Gewebe. Um diese Barriere effektiv aufrechtzuerhalten, durchlaufen Darmepithelzellen (IECs) einen extrem hohen Zellumsatz mit einem kontinuierlichen Zyklus von Zelltod und Regeneration. Bei entzündlichen Erkrankungen wie entzündlichen Darmerkrankungen (CED) kommt es jedoch zu einem höheren Grad an aberrantem Zelltod1. Dies kann einen Zusammenbruch der Barrierefunktion und die Aktivierung des Immunsystems begünstigen, was weitere Entzündungen auslöst. Bei Morbus Crohn (CD), einer Form von CED, wurde gezeigt, dass die Zytokin-Signalübertragung zu den erhöhten Todesraten bei IEC beiträgt2. Durch die Untersuchung, wie die Zytokin-Signalgebung den Zelltod von IECs induziert, hofft man, dass verbesserte Therapien für Patienten mit CED und anderen entzündlichen Darmerkrankungen entwickelt werden können1.
In der Biologie und der Erforschung von Wirkstoffzielen wird allgemein davon ausgegangen, dass Synergie auftritt, wenn ein biologisches System, das mit Kombinationen einzelner Stimuli behandelt wird, eine Reaktion auf die Kombination zeigt, die größer ist als die kombinierten additiven Effekte der einzelnen Stimuli allein. Synergistische Wechselwirkungen zwischen Zytokinen sind bei der Auslösung angeborener antiviraler Reaktionen gut dokumentiert3. Es ist auch bekannt, dass Zytokine den Zelltod synergistisch induzieren, unter anderem in IECs4. Die Rolle, die synergistische zytotoxische Zytokin-Signale bei intestinalen Entzündungserkrankungen wie CED spielen, ist jedoch noch wenig untersucht.
Humane Darmorganoide sind in vitro hergestellte 3D-Mikrogewebe, die aus Darmepithelstammzellen erzeugt werden. Darmorganoide können aus Darmschleimhautbiopsien von Patienten mit CED gezüchtet werden und behalten viele Merkmale der Erkrankungbei 5,6. Organoide haben sich als ideales Modellsystem für die Untersuchung der Zytotoxizität von Zytokinen im Rahmen von Darmentzündungen erwiesen 7,8. Zuvor hat unsere Gruppe die synergistischen Abtötungseffekte der IBD-relevanten Zytokine IFN-γ und TNF-α in von Zöliakie-Patienten stammenden Dickdarmorganoiden (Kolonoiden) charakterisiert9,10. Die genauen Mechanismen, die an der Vermittlung dieser Form des synergistischen Zelltods beteiligt sind, sind jedoch noch nicht bekannt. Es gibt möglicherweise auch viele weitere uncharakterisierte zytotoxische Zytokin-Wechselwirkungen, die für entzündliche Erkrankungen des Darms relevant sind.
Es stehen mehrere Protokolle zur Verfügung, um den Zelltod in Darmorganoiden zu untersuchen 10,11,12,13; Sie haben jedoch alle Nachteile. Einige dieser Techniken messen nur die Lebensfähigkeit von Zellen und messen den Zelltod nicht direkt, sind nicht in der Lage, Reaktionen einzelner Organoide zu bewerten, oder erfordern teure Geräte und komplexe Protokolle. Robuste und unkomplizierte Methoden sind erforderlich, um den Zelltod von Organoiden und störende Wechselwirkungen in Darmorganoiden zu quantifizieren. Das von uns vorgestellte Protokoll ist ein einfacher und kostengünstiger Ansatz zur Messung der Reaktionen einzelner Organoide auf zytotoxische Zytokine, kann aber für jede Art von Stimulus oder Störung verwendet werden. Wir zeigen auch, wie man das Bliss-Unabhängigkeitssynergiemodell verwendet, um einen Koeffizienten der Perturbagen-Interaktion (CPI) zu berechnen, der zytotoxische Zytokininteraktionen beschreibt.
Protokoll
Es wurden Dickdarmschleimhautbiopsien von Patienten mit Zöliakie entnommen, die sich im Rahmen der Standardbehandlung einer routinemäßigen Koloskopie unterzogen. Die ethische Genehmigung für die Verwendung von Gewebeproben von Patienten und die Generierung von Dickdarm-Organoidlinien aus diesen Proben wurde von der Ethikkommission für klinische Forschung der Cork Teaching Hospitals (CREC) eingeholt. Die schriftliche Einverständniserklärung aller Patienten wurde in Übereinstimmung mit der Erklärung von Helsinki eingeholt. Alle Gewebekulturarbeiten mit Patientenbiopsien und Kolonoiden müssen in einer Biosicherheitswerkbank gemäß den BSL2-Sicherheitsprotokollen durchgeführt werden. Stellen Sie sicher, dass alle Kunststoffabdrücke vor der Verwendung steril sind. In der Materialtabelle finden Sie Details zu allen Materialien, Reagenzien, Instrumenten und Software, die in diesem Protokoll verwendet werden.
Die Protokolle, die unsere Gruppe für die Kryptenisolierung und die Organoidkultur verwendet, wurden von den etablierten Methoden14,15,16 übernommenund bereits veröffentlicht 9,10,17. Für das folgende Protokoll wurden die Kolonoide unter Verwendung von Organoid-Proliferationsmedien kultiviert (Tabelle 1). Koloide, die mit Organoid-Proliferationsmedien gezüchtet wurden, sind undifferenziert und für Dickdarmstammzellen angereichert. Der Hauptbestandteil von Organoid-Proliferationsmedien besteht zu 50 % aus L-WRN-konditionierten Medien, die die Nischenwachstumsfaktoren Wnt-3A (W), R-Spondin 3 (R) und Noggin (N)15 enthalten. Organoide Proliferationsmedien werden durch die Kombination von L-WRN-konditionierten Medien und serumfreien Medien 1:1 hergestellt, gefolgt von einer Supplementierung mit Nicotinamid und chemischen Inhibitoren (Tabelle 1).
1. Isolierung von Kolonkrypten und Kolonoidkultur
- Eine 48-Well-Mikrotiterplatte bei 37 °C und 5 % CO2 für mindestens 72 Stunden vorinkubieren, bevor Sie sie mit Krypten bepflanzen.
HINWEIS: Die Vorinkubation der Platte beschleunigt die Polymerisation des Basalmembranextrakts (BME) während der Aussaat. - Tauen Sie den BME am Abend vor der Isolierung der Krypten bei 4 °C auf Eis auf.
- Die Dickdarmbiopsien werden in einem Probenentnahmeröhrchen mit 15 ml Biopsie-Entnahmemedium (Tabelle 1) entnommen und bis zur Verarbeitung bei 4 °C gelagert.
- Entfernen Sie vorsichtig so viel Biopsie-Entnahmemedium wie möglich mit einer Pipette. Waschen Sie die Biopsien, indem Sie 15 ml eiskaltes DPBS, ergänzt mit 2,5 μg/ml Amphotericin B und 100 μg/ml Gentamicin, in das Probenröhrchen geben. Schütteln Sie das Probenröhrchen kräftig, um Schleim oder Ablagerungen von den Biopsien zu entfernen. Lassen Sie die Biopsien durch die Schwerkraft absetzen und entfernen Sie vorsichtig so viel DPBS wie möglich mit einer Pipette.
- Wiederholen Sie den Waschvorgang ab Schritt 1.4 zweimal (2x).
- Geben Sie 10 ml enzymfreies Zelldissoziationsreagenz, ergänzt mit 2,5 μg/ml Amphotericin B und 200 μg/ml Gentamicin, in das Probenröhrchen und inkubieren Sie es 15 Minuten lang bei Raumtemperatur mit Schaukeln bei 30 U/min.
- Schütteln Sie das Probenröhrchen nach der Inkubation kräftig von Hand zu Seite, um die Dickdarmkrypten freizugeben. Untersuchen Sie das Röhrchen mit einem Lichtmikroskop mit geringer Leistung und suchen Sie nach den freigesetzten Krypten und Kryptenfragmenten in Suspension. Wenn nicht sichtbar, schütteln Sie die Tube und prüfen Sie sie erneut. Wiederholen Sie den Vorgang, bis die Krypten in der Schwebe zu sehen sind.
- Setzen Sie ein 70-μm-Zellsieb auf ein 50-ml-Röhrchen und filtrieren Sie die Kryptensuspension durch das Sieb. Geben Sie 10 ml eiskaltes Organoid-Waschmedium (Tabelle 1) in das leere Probenröhrchen, entfernen Sie das Medium und führen Sie es durch das Zellsieb.
- Die filtrierten Krypten in zwei 15-ml-Röhrchen (10 mL pro Röhrchen) überführen und 5 min bei 4 °C bei 150 × g zentrifugieren.
- Entfernen Sie vorsichtig den Überstand von jedem 15-ml-Röhrchen, resuspendieren Sie die Kryptenpellets in 500 μl eiskaltem Organoid-Waschmedium, überführen Sie die Kryptenlösung aus beiden 15-ml-Röhrchen in ein einzelnes 1,5-ml-Mikrozentrifugenröhrchen und zentrifugieren Sie es 3 Minuten lang bei 4 °C bei 400 × g.
- Entfernen Sie vorsichtig den Überstand aus dem Mikrozentrifugenröhrchen und resuspendieren Sie das Kryptenpellet in 70 μl BME (20 μl pro Vertiefung und 10 μl zusätzliches Totvolumen).
- Mit der vorinkubierten 48-Well-Platte (Schritt 1.1) werden 20 μl BME/Crypt-Suspension in die Mitte jedes Wells gesät (1 BME-Dome pro Well). Die Platte sanft und gleichmäßig umdrehen und bei 37 °C, 5 % CO2 20 min inkubieren.
HINWEIS: Das Umdrehen der Platte verhindert, dass Zellen an der Kunststoffoberfläche der Vertiefung haften bleiben, und sorgt für deren Verteilung innerhalb des BME. - Nehmen Sie die Platte aus dem Inkubator. Stellen Sie sicher, dass das BME vollständig polymerisiert ist, und überlagern Sie die Dome dann mit 350 μl vorgewärmtem Organoid-Proliferationsmedium, ergänzt mit 100 μg/ml eines antimikrobiellen Breitbandreagenzes. Die Platte wird bei 37 °C und 5 % CO2 inkubiert.
HINWEIS: Das antimikrobielle Reagenz mit breiter Reichweite soll eine Kontamination durch Schleimhautmikroben im Zusammenhang mit den Dickdarmbiopsien verhindern. Es ist nur für die erste Woche der Kultur nach der Kryptenisolation erforderlich. - Wechseln Sie das Medium 2-3x in einer Woche mit vorgewärmten Organoid-Proliferationsmedien und ergänzen Sie es in der ersten Woche der Kultur mit dem antimikrobiellen Reagenz mit breiter Reichweite; Entfernen Sie nach Ablauf dieser Zeit das Reagenz.
- Sobald die Kolonoidkultur vollständig etabliert ist (1-2 Wochen nach der Isolierung), dissoziieren Sie die Kolonoide mit dem enzymatischen Dissoziationsreagenz, das mit 10 μM des ROCK-I/II-Inhibitors Y-27632 ergänzt wird (siehe Abschnitt 2 für vollständige Einzelheiten zur Kolonoiddissoziation).
HINWEIS: Für die ersten beiden Durchgänge (P0-1, P1-2) sollten die Koloide im Verhältnis 1:1/2 expandiert werden; nach P2 können Koloide im Verhältnis 1:3/4 durchgelassen werden. - Säen und pflegen Sie die Kolnoide gemäß den Schritten 1.11-1.13 (ergänzen Sie Organoid Proliferation Media nicht mit dem breiten Spektrum antimikrobielles Reagenz).
2. Vorbereitung von Koloiden für den Zelltod-Assay
HINWEIS: Das Zelltod-Assay-Protokoll dauert 4 Tage (Abbildung 1A).
- Expandieren Sie die Koloide mit einem 48-Well-Plattenformat, indem Sie 20 μl BME/Crypt-Suspension pro Vertiefung aussäen, bei 37 °C und 5 % CO2 inkubieren und das Medium 2-3x pro Woche (350 μl pro Vertiefung) wechseln.
- Passieren Sie die Koloide etwa 1 Woche vor der Entnahme für den Zelltod-Assay. Stellen Sie vor der Entnahme der Koloide sicher, dass sie zu einer hohen Dichte vermehrt werden (Abbildung 1Bi), dass sie einen Durchmesser von etwa 25-50 μm haben und aktiv proliferieren.
HINWEIS: Wir haben für diesen Assay von Passage 3 bis Passage 14 Kolnoide mit konsistenten Ergebnissen verwendet. Es konnte jedoch gezeigt werden, dass sich die transkriptionelle Reaktion von Kolonoiden auf Zytokine in Abhängigkeit von der Kulturdauer ändern kann18. Auf dieser Grundlage empfehlen wir, nach Passage 15 keine Coloide mehr für diesen Assay zu verwenden. - 96-Well-Mikrotiterplatten bei 37 °C und 5 % CO2 für mindestens 72 Stunden vorinkubieren, bevor Sie sie mit Kolonoidzellen bepflanzen.
- Tauen Sie den BME am Abend vor Beginn des Experiments bei 4 °C auf Eis auf.
- Bereiten Sie ein ausreichendes Volumen des enzymatischen Dissoziationsreagenzes (500 μl pro Vertiefung Kolonoide) vor, indem Sie 10 μM des ROCK-I/II-Inhibitors Y-27632 hinzufügen. Entfernen Sie das Medium vorsichtig aus den Vertiefungen, die Koloide enthalten. Pipettieren Sie vom Rand der Vertiefung, um eine Beschädigung der Dickdarmkuppel zu vermeiden. Geben Sie 300 μl enzymatisches Dissoziationsreagenz in jede Vertiefung.
- Brechen Sie für jede Vertiefung die Kolonoidkuppel auseinander, indem Sie die Oberfläche der Vertiefung mit der Spitze einer P1000-Pipette abkratzen und die Zellsuspension auf und ab pipettieren. Versuchen Sie, die Bildung von Luftblasen zu vermeiden. Sammeln Sie die Zellsuspension in einem 15-ml-Röhrchen.
HINWEIS: Dieses 15-ml-Röhrchen wird verwendet, um Kolonoide aus 10 Vertiefungen der 48-Well-Platte zu sammeln. - Waschen Sie das gleiche Gut mit weiteren 200 μl des enzymatischen Dissoziationsreagenzes, um sicherzustellen, dass das gesamte Kolonoidmaterial gesammelt und in dasselbe 15-ml-Röhrchen übertragen wird. Wiederholen Sie diesen Vorgang für jede Vertiefung mit expandierten Kolonoiden, die entnommen werden, und sammeln Sie sie in demselben einzigen 15-ml-Röhrchen.
HINWEIS: Für eine effiziente Dissoziation sollten maximal 10 Vertiefungen mit Kolonoiden pro Röhrchen gesammelt werden. Wenn Sie >10 Wells sammeln, teilen Sie die gesammelten Koloide gleichmäßig auf mehrere 15-ml-Röhrchen auf.
- Brechen Sie für jede Vertiefung die Kolonoidkuppel auseinander, indem Sie die Oberfläche der Vertiefung mit der Spitze einer P1000-Pipette abkratzen und die Zellsuspension auf und ab pipettieren. Versuchen Sie, die Bildung von Luftblasen zu vermeiden. Sammeln Sie die Zellsuspension in einem 15-ml-Röhrchen.
- Inkubieren Sie das 15-ml-Röhrchen mit den gesammelten Kolonoiden aus Schritt 2.5.2 in einem Wasserbad bei 37 °C für 5 min. Nach der Inkubation zentrifugieren Sie das Röhrchen 3 Minuten lang bei 400 × g. Entfernen Sie vorsichtig den Überstand und lassen Sie etwa 1,2 ml im Röhrchen zurück.
HINWEIS: Der nächste Schritt erfordert die physikalische Dissoziation der Kolonoide durch schnelles Pipettieren. Damit dies wirksam ist, müssen Sie ein kleines Volumen der Zellsuspension im Röhrchen haben - die 1,2 mL, die im 15 mL-Röhrchen verbleiben, reichen für diesen Zweck aus. - Resuspendieren Sie das Kolonoid-Pellet in den verbleibenden 1,2 mL des enzymatischen Dissoziationsreagenzes. Setzen Sie mit einer P1000-Pipette auf 1.000 μl die Spitze der Pipette in die Suspension ein, halten Sie sie knapp über dem Boden des 15-ml-Röhrchens und pipettieren Sie die Suspension dann schnell in die Spitze hinein und wieder heraus. Um schnell zu pipettieren, drücken Sie den Kolbenknopf schnell bis zum ersten Anschlag, lassen Sie den Knopf los, bis er sich etwa auf halbem Weg zur oberen Position befindet, und wiederholen Sie den Vorgang. Pipettieren Sie schnell für ca. 10 s (30-40 Vertiefungen), resuspendieren Sie dann die Suspension vollständig und wiederholen Sie das Pipettieren. Führen Sie 2-3 Runden Schnellpipettieren durch.
- Überprüfen Sie die Probe unter dem Mikroskop, um sicherzustellen, dass keine ganzen Kolonoide mehr vorhanden sind und dass die Mehrheit der Kolonoidfragmente etwa 30-40 μm groß ist (Abbildung 1Bii).
- Wenn die Probe eine weitere Dissoziation erfordert, inkubieren Sie sie weitere 3 Minuten im Wasserbad bei 37 °C, wiederholen Sie die Pipettiertechnik in Schritt 2.7 und überprüfen Sie die Probe unter dem Mikroskop. Wiederholen Sie diesen Vorgang, bis die Mehrheit der Kolonoidfragmente die optimale Größe hat.
HINWEIS: Achten Sie darauf, die Kolnoide nicht zu stark zu dissoziieren, da dies zu übermäßigem Zelltod, geringer Plattierungseffizienz und zu geringen Koloniden führt. - Geben Sie 10 ml eiskaltes organoides Waschmedium (Tabelle 1) in das 15-ml-Röhrchen. Zentrifugieren Sie das Röhrchen 3 Minuten lang bei 400 × g, entfernen Sie den Überstand, resuspendieren Sie es in 1 mL eiskaltem Organoid-Waschmedium und geben Sie es in ein 1,5-ml-Mikrozentrifugenröhrchen (als Kolonoidfragmentröhrchen bezeichnet).
- Mischen Sie den Inhalt des Kolonoidfragmentröhrchens durch Pipettieren und entnehmen Sie eine Probe von 50 μl; Übertragen Sie diese 50-μl-Probe in ein neues 1,5-ml-Mikrozentrifugenröhrchen (als Zellzählröhrchen bezeichnet). Lagern Sie das Röhrchen des Koloidfragments ab diesem Zeitpunkt bis zum Abschluss von Schritt 2.15 auf Eis.
- Das Zellzählröhrchen wird 3 Minuten lang bei 400 × g zentrifugiert, der Überstand entfernt und in 500 μl enzymatischem Dissoziationsreagenz resuspendiert, das mit 10 μM des ROCK-I/II-Inhibitors Y-27632 ergänzt wird.
- Inkubieren Sie das Einzelzellzählröhrchen im Wasserbad bei 37 °C für 5 min. Pipettieren Sie die Probe mit einer P1000-Pipette auf 400 μl wie in Schritt 2.7 beschrieben und überprüfen Sie die Probe unter dem Mikroskop, um sicherzustellen, dass eine Einzelzellsuspension vorhanden ist. Wenn nicht, wiederholen Sie diesen Vorgang, bis die Koloide vollständig in eine einzellige Suspension dissoziiert sind.
- Geben Sie 1 ml Organoid-Waschmedium in das Einzelzellzählröhrchen, zentrifugieren Sie 3 Minuten lang bei 400 × g und entfernen Sie vorsichtig den Überstand. Resuspendieren Sie die Zellen in 50 μl Organoid-Waschmedien und fügen Sie dann 50 μl Trypanblau hinzu.
- Zählen Sie die Zellen mit einem Hämozytometer. Berechnen Sie die Anzahl der Zellen in der 50-μl-Probe und berechnen Sie daraus die Konzentration der Zellen im Dickdarmfragmentröhrchen.
- Berechnen Sie das Volumen der Zellsuspension, das für das Experiment erforderlich ist, wobei 0,5 × 104 Kolonoidzellen pro Vertiefung einer 96-Well-Mikrotiterplatte ausgesät werden. Fügen Sie diesem berechneten Volumen ca. 15 % mehr hinzu, um das Totvolumen zu berücksichtigen. Dieses Gesamtvolumen wird aus dem Gefäß des Kolonoidfragments (Schritt 2.11) in ein neues 1,5-ml-Mikrozentrifugenröhrchen übertragen.
- Zentrifugieren Sie das neue 1,5-ml-Mikrozentrifugenröhrchen mit den Kolonoidfragmenten 3 Minuten lang bei 400 × g, entfernen Sie den Überstand und resuspendieren Sie es in BME (verwenden Sie 10 μl BME pro 0,5 × 104 Zellen).
HINWEIS: Aufgrund der physikalischen Eigenschaften des BME (hohe Viskosität, temperaturabhängige Polymerisation) kann durch das Pipettieren eine erhebliche Menge an Material verloren gehen (Totvolumen).
- Zentrifugieren Sie das neue 1,5-ml-Mikrozentrifugenröhrchen mit den Kolonoidfragmenten 3 Minuten lang bei 400 × g, entfernen Sie den Überstand und resuspendieren Sie es in BME (verwenden Sie 10 μl BME pro 0,5 × 104 Zellen).
- Stellen Sie das Röhrchen oder Reservoir mit der Kolonoid-/BME-Suspension auf Eis in einem sterilen Behälter in der Biosicherheitswerkbank auf.
HINWEIS: Wenn Sie die Zellen während der Aussaat auf Eis halten, wird verhindert, dass das Zellsubstrat vorzeitig polymerisiert. - Pipettieren Sie mit einer vorinkubierten 96-Well-Mikrotiterplatte (aus Schritt 2.3) 10 μl der Colonoid-/BME-Lösung pro Well rückwärts. Achten Sie darauf, die Spitze knapp über der Oberfläche der Vertiefung zu positionieren und in die Mitte zu pipettieren, um zu vermeiden, dass sie gegen die Wand der Vertiefung stößt. Mischen Sie die Colonoid-/BME-Suspension regelmäßig, um eine ungleichmäßige Aussaat zu vermeiden.
HINWEIS: Säen Sie keine Kolonoide in die äußeren Randvertiefungen der Mikrotiterplatte.- So kehren Sie die Pipette um:
- Setzen Sie die Pipette ein und drücken Sie dann den Kolbenknopf über den ersten Anschlag hinaus bis zum zweiten Anschlag.
- Halten Sie diese Position, tauchen Sie die Spitze in die Kolonoid-/BME-Suspension und lassen Sie den Kolben langsam nach oben los.
- Geben Sie die Federung ab, indem Sie den Kolbenknopf sanft und gleichmäßig bis zum ersten Anschlag drücken. Wenn Sie weitere Vertiefungen säen, halten Sie diese Position und wiederholen Sie die Schritte 2.18.1.2-2.18.1.3.
- Wenn Sie fertig sind, stoßen Sie die kleine Menge der verbleibenden Suspension aus, indem Sie den Kolbenknopf bis zum zweiten Anschlag drücken.
HINWEIS: Aufgrund der hohen Viskosität des BME empfehlen wir die Verwendung der Reverse-Pipettiertechnik.
- So kehren Sie die Pipette um:
- Die Platte sanft und gleichmäßig umdrehen und bei 37 °C, 5 % CO2 20 min inkubieren.
- Nehmen Sie die Platte aus dem Inkubator. Stellen Sie sicher, dass der BME vollständig polymerisiert ist, und überlagern Sie die Kuppeln dann mit 200 μl vorgewärmtem Organoid-Proliferationsmedium. Wenn Sie eine 96-Well-Mikrotiterplatte mit einem umgebenden Graben (der die Verdunstung reduziert) verwenden, füllen Sie jedes Reservoir mit 2 ml Organoid-Waschmedium.
- Inkubieren Sie die Kolonoide 3 Tage lang bei 37 °C, 5 % CO2 und untersuchen Sie sie einmal täglich mikroskopisch, um sicherzustellen, dass sich die Kolonoide erholt haben und sich vermehren.
3. Colonoid-Behandlungen für den Zelltod-Assay
- Bereiten Sie eine 2,5-μM-Lösung aus fluoreszierendem Zelltodfarbstoff (SYTOX Green Nucleic Acid Stain) und DMSO-Lösung her, indem Sie fluoreszierenden Zelltodfarbstoff oder DMSO zu vorgewärmten Organoid-Proliferationsmedien hinzufügen (Tabelle 2).
HINWEIS: Schützen Sie den fluoreszierenden Zelltod-Farbstoff und die verdünnte Lösung vor Licht. SYTOX Green Nucleic Acid Stain ist in DMSO solubilisiert; Die DMSO-Lösung wird verwendet, um den No-Dye-Zustand vorzubereiten, um Lösungsmitteleffekte zu kontrollieren. - Verwenden Sie die 2,5-μM-Lösung aus fluoreszierendem Zelltodfarbstoff und DMSO-Lösung aus Schritt 3.1, um die Behandlungen vorzubereiten, wie in Tabelle 2 gezeigt.
- Entfernen Sie das Medium vorsichtig von der mit Kolonoiden besiedelten 96-Well-Mikrotiterplatte, indem Sie die Platte kippen und vom Rand der Wells aus pipettieren. Fügen Sie dann 200 μl Behandlungsmedium pro Vertiefung hinzu. Stellen Sie sicher, dass zusätzliche PBS/BSA-Kontrollvertiefungen für die Bedingungen/Zustände der maximalen Toxizität vorhanden sind (siehe Tabelle 2 für die Plattenkarte).
- Inkubieren Sie die Koloide bei 37 °C und 5 % CO2 für die erforderlichen Behandlungszeitpunkte, bis sie für die Bildgebung bereit sind.
- Bereiten Sie mindestens 2 Stunden vor der Bildgebung eine 10%ige v/v-Lösung von Triton-X 100 in sterilem Wasser in Zellkulturqualität vor und geben Sie 22 μl des 10%igen Triton-X 100 direkt in das Medium der Kontrollvertiefungen für die Bedingungen/Zustände der maximalen Toxizität bis zu einer Endkonzentration von 1 % v/v 1 h vor der Bildgebung.
HINWEIS: Die Verwendung einer 10%igen Lösung reduziert Pipettierfehler, die aufgrund der hohen Viskosität des Tensids auftreten können.
4. Bilderfassung
- Nehmen Sie die mit Kolonoiden besiedelte 96-Well-Mikrotiterplatte aus dem Inkubator und stellen Sie sie auf den Tisch eines digitalen inversen Epifluoreszenzmikroskops. Lassen Sie die Platte auf Raumtemperatur kommen.
- Bestätigen Sie, dass die Koloide unter dem Mikroskop vollständig lysiert sind, indem Sie sie unter dem Mikroskop untersuchen (Abbildung 1Biii).
- Wählen Sie ein geeignetes Objektiv aus, z. B. ein 40-faches Fluoreszenzobjektiv mit großem Arbeitsabstand. Optimieren Sie die Bildgebungseinstellungen des Mikroskops, bevor Sie beginnen.
- Über den Übertragungskanal auf ein Kolonoid mit SYTOX-positiven Zellen fokussieren, auf das grün fluoreszierende Protein (GFP) umschalten
(488 nm) und passen Sie die Lichtintensität und die Belichtungszeit an, um das Fluoreszenzsignal zu maximieren und gleichzeitig den Hintergrund zu minimieren. Versuchen Sie es zuerst mit einer niedrigen Lichtintensität und erhöhen Sie dann allmählich die Belichtungszeit. Wenn die Belichtungsdauer nicht praktikabel ist, erhöhen Sie die Lichtintensität leicht.
HINWEIS: Wenn Sie die Belichtungszeit anstelle der Lichtintensität erhöhen, werden die Phototoxizität und das Photobleichen der Proben reduziert19. Setzen Sie die Proben nur bei Bedarf Fluoreszenzlicht aus.
- Über den Übertragungskanal auf ein Kolonoid mit SYTOX-positiven Zellen fokussieren, auf das grün fluoreszierende Protein (GFP) umschalten
- Mit den optimierten Bildgebungseinstellungen für den GFP-Kanal können Sie die Bedingungen für "Kein Farbstoff" und "Maximale Toxizität" einhalten, um sicherzustellen, dass die Proben nicht über- oder unterbelichtet werden. Halten Sie die Bildgebungseinstellungen nach der Fertigstellung zwischen den Bedingungen konsistent.
- Erfassen Sie Bilder mit einem Zufallsstichprobenansatz: Wählen Sie dazu Sichtfelder (FOVs) aus, die einem festen Gittermuster folgen, das die Dickdarmkuppel abdeckt. Erfassen Sie Bilder von Kolonoiden aus mindestens 10 FOVs. Stellen Sie sicher, dass die zentrale Ebene des Kolonoids scharf ist, und nehmen Sie Bilder sowohl im Übertragungs- als auch im GFP-Kanal auf.
- Wenden Sie die folgenden Ausschlusskriterien an.
- Nehmen Sie keine Bilder auf, wenn keine Kolonoide im FOV vorhanden sind.
- Nehmen Sie keine Bilder auf, wenn im FOV nur Koloide vorhanden sind, die sich in derselben Fokusebene überlappen (Abbildung 1Biv).
- Nehmen Sie keine Bilder auf, wenn sich nur Kolonoid-Ablagerungen im Sichtfeld befinden (Abbildung 1Bv). Beziehen Sie keine Dickdarmablagerungen in die Analyse ein.
- Wenden Sie die folgenden Ausschlusskriterien an.
- Speichern Sie Bilder im portablen Netzwerkgrafikformat und exportieren Sie sie.
- Wenn Sie zusätzliche Zeitpunkte abbilden, stellen Sie die 96-Well-Mikrotiterplatte mit den Koloiden bei 37 °C, 5 % CO2 in den Inkubator zurück.
5. Bildanalyse
- Öffnen Sie Fiji ImageJ und importieren Sie den Bilddatensatz, indem Sie die Dateien per Drag & Drop auf die ImageJ-Symbolleiste ziehen oder zu Datei | Öffnen Sie die Dateien und wählen Sie sie aus. Kombinieren Sie die Dateien nach dem Öffnen zu einem Bildstapel, indem Sie auf Bild| Stapel| Bilder zum Stapeln. Konvertieren Sie den Bildstapel in das 8-Bit-Dateiformat, indem Sie auf Bild| Typ| 8 -Bit.
- Klicken Sie für jeden Bildsatz auf das Werkzeug Freihandauswahl in der ImageJ-Symbolleiste und wählen Sie den Interessenbereich (ROI) auf dem Übertragungsbild manuell mit der Computermaus aus. Der ROI ist der Umfang des Colonoids. Wechseln Sie dann durch den Bildstapel zum entsprechenden GFP-Kanalbild.
- Klicken Sie auf Analysieren| Messungen einstellen; Aktivieren Sie im Dialogfeld "Messungen festlegen " das Häkchen bei "Mittlerer Grauwert " und lassen Sie alle anderen Kontrollkästchen deaktiviert. Wenn das GFP-Bild ausgewählt ist, klicken Sie auf Analysieren | Messen. Wiederholen Sie diese Analyse für jedes Koloid im Bildstapel. Sobald der Datensatz analysiert wurde, kopieren Sie alle Daten im Ergebnisfenster und fügen Sie sie in eine Tabellenkalkulationssoftware ein.
Berechnung der maximalen Toxizität in %
- Berechnen Sie den Mittelwert der mittleren Grauwerte (MGV) des technischen Repliks für jede Bedingung mit Hilfe von Gleichung (1).
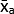 (Mittelwert der Behandlung a) =
(Mittelwert der Behandlung a) = 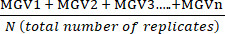 (1)
(1) - Drückt den Mittelwert jeder Bedingung in Prozent relativ zum Mittelwert der Bedingung für maximale Toxizität (MT) unter Verwendung von Gleichung (2) aus.
%MTa =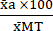 (2)
(2)
7. Berechnung des VPI
- Normalisieren (NORM) Sie die Daten wie folgt, indem Sie die in Schritt 6.1 berechneten Mittelwerte verwenden, subtrahieren Sie den Mittelwert der unbehandelten Bedingung (UT) von jeder Behandlungsbedingung und der Bedingung der maximalen Toxizität (MT) (um den Hintergrundzelltod zu entfernen, der unabhängig von der Zytokinbehandlung auftritt). Teilen Sie dann jede Behandlungsbedingung durch den hintergrundsubtrahierten Mittelwert der Bedingung für die maximale Toxizität (MT), wie in Gleichung (3) gezeigt.
NORMa =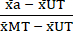 (3)
(3) - Subtrahieren Sie die in Schritt 7.1 berechneten normierten Werte von 1; Die resultierenden Werte stellen die Zellviabilität (V) nach der Behandlung dar (wie in Gleichung (4) unten).
Va = 1 −NORMa (4) - Berechnen Sie den Koeffizienten der Perturbagen-Wechselwirkung (CPI) mit Hilfe von Gleichung (5):
VPI =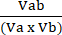 (5)
(5)
Wobei a die erste Behandlung bezeichnet; b bezeichnet die zweite Behandlung; und AB ist die Kombinationsbehandlung. CPI-Werte zeigen synergistische (<1), additive (=1) oder antagonistische (>1) Beziehungen an.
Ergebnisse
Anhand dieses Protokolls konnten wir zeigen, wie Zöliakie-Patienten-Koloide verwendet werden können, um die zytotoxischen Wirkungen der IBD-relevanten Zytokine IFN-γ und TNF-α auf das primäre Epithel zu untersuchen. Wir haben einen kommerziell erhältlichen fluoreszierenden Zelltodfarbstoff (SYTOX Green Nucleic Acid Stain) verwendet, der nur in Zellen eindringen kann, die eine kompromittierte Zellmembran haben, wo er dann durch Bindung an Nukleinsäuren aktiviert wird. Wir behandelten Kolonoide mit Zytokinen und dem fluoreszierenden Zelltodfarbstoff und führten Lebendzell-Imaging bei 8 h und 24 h mit einem inversen Epifluoreszenzmikroskop durch. Repräsentative Transmissions-/Fluoreszenz-Overlay-Bilder nach 8 h zeigen, dass nur die mit IFN-γ + TNF-α behandelten Koloide positiv für das Fluoreszenzsignal sind; es gibt jedoch nur eine geringe Anzahl von Fluoreszenzzellen (Abbildung 2A). Zellblebbing, ein morphologischer Indikator für den Zelltod20, kann auch in der IFN-γ + TNF-α beobachtet werden. Nach 24 Stunden zeigen mit IFN-γ + TNF-α behandelte Kolonoide große Bereiche, die positiv für das Fluoreszenzsignal sind (Abbildung 2A). Es gibt auch eine deutliche Aufschlüsselung in der Morphologie des Dickdarms - das zentrale Lumen ist nicht mehr sichtbar, und die Epithelbarriere ist vollständig gestört.
Um das Zelltodfarbstoffsignal zu quantifizieren, verwendeten wir eine Open-Source-Bildanalysesoftware, um die Fluoreszenzintensität jedes Kolonoids zu berechnen. Anschließend normalisierten wir die Daten, indem wir den Mittelwert jeder Bedingung als Prozentsatz der Max-Toxizitätsbehandlung ausdrückten. Nach 8 Stunden war der homöostatische oder Hintergrundzelltod in den BSA-Kontrollkolonoiden relativ gering (7,7 % der maximalen Toxizität) (Abbildung 2B). Zu diesem Zeitpunkt gab es keine statistisch signifikanten Veränderungen der Zellsterblichkeit; Erkrankungen, die mit TNF-α behandelt wurden, zeigten jedoch einen geringen Anstieg der Zytotoxizität (Abbildung 2B). Nach 24 Stunden war der Zelltod bei allen mit Zytokinen behandelten Erkrankungen gestiegen. Es gab jedoch eine minimale Veränderung des Zelltods für die BSA-Kontrollbedingung zwischen den Zeitpunkten (7,5 % der maximalen Toxizität nach 24 Stunden). Die mit IFN-γ + TNF-α behandelten Kolonoide wiesen im Vergleich zur BSA-Kontrolle den größten Anstieg des Zelltods auf (29,4 % der maximalen Toxizität). Der Unterschied in der Zelltodrate zwischen der kombinierten Behandlung und der Einzelzytokinbehandlung (IFN-γ, TNF-α) war hochsignifikant. Diese Ergebnisse deuten auf die Möglichkeit einer zytotoxischen synergistischen Interaktion zwischen IFN-γ und TNF-α nach 24 h hin.
Wir verwendeten den CPI, um die zytotoxischen Wechselwirkungen zwischen Zytokinbehandlungen zu quantifizieren und um festzustellen, ob sie synergistisch waren. Wechselwirkungen zwischen Zytokinen werden als synergistisch angesehen, wenn der CPI-Wert <1 beträgt, additiv, wenn =1, oder antagonistisch, wenn >1. Wir berechneten die VPI-Werte pro Zeitpunkt (Abbildung 2C). Nach 8 h zeigte der VPI-Wert einen leichten Synergismus (0,99), wobei der VPI-Wert nach 24 h deutlich abnahm (0,83). Diese Analyse bestätigte, dass die Interaktion zwischen IFN-γ und TNF-α nach 24 h synergistisch war. Darüber hinaus wird verdeutlicht, dass in diesem Zusammenhang der Synergismus zwischen IFN-γ und TNF-α zeitabhängig ist.
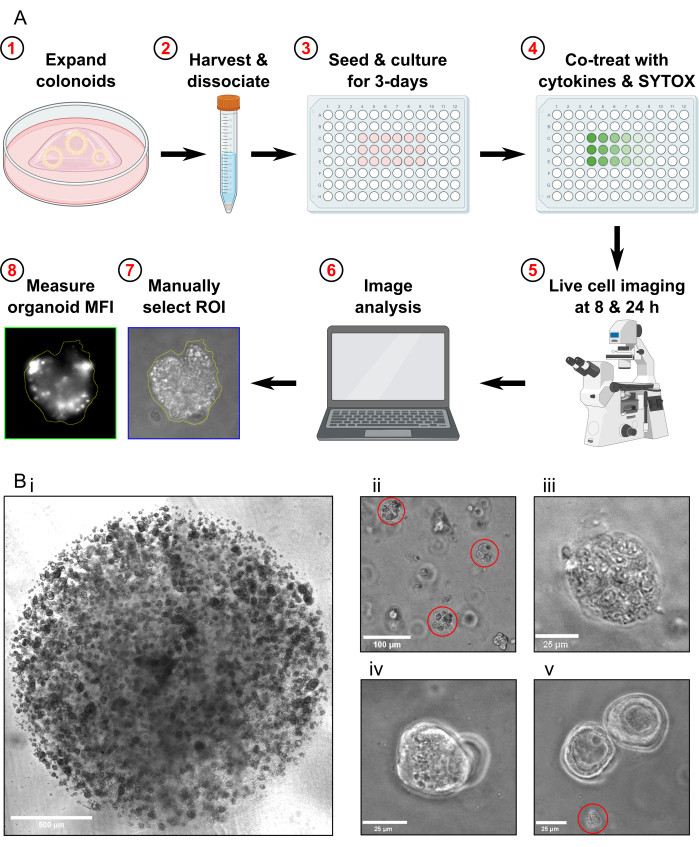
Abbildung 1: Schematische Darstellung des experimentellen Arbeitsablaufs und der Fehlerbehebung. (A) Schematische Übersicht des Protokolls. (B) Repräsentative Bilder. (Bi) Lichtmikroskopisches Bild, das die optimale Dichte der Kultur und die optimale Größe der Kolonoide vor der Passage für einen Assay veranschaulicht. Maßstabsbalken = 500 μm. (Bii) Lichtmikroskopisches Bild, das die optimale Größe von Kolonoidfragmenten nach der Dissoziation zeigt; Fragmente rot hervorgehoben. Maßstabsbalken = 100 μm. (Biii) Lichtmikroskopische Aufnahme der nekrotischen Colonoid-Morphologie nach MT-Behandlung (mit Triton X-100). Maßstabsbalken = 25 μm. (Biv) Lichtmikroskopische Aufnahme von zwei Kolonoiden, die sich in derselben Brennebene überlappen. Maßstabsbalken = 25 μm. (Bv) Lichtmikroskopische Aufnahme von Dickdarmzelltrümmern, die nach der Passage vorhanden sind; Trümmer rot hervorgehoben. Maßstabsleiste = 25 μm. Abkürzungen: ROI = Region of Interest; MFI = mittlere Fluoreszenzintensität; MT = Maximale Toxizität. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
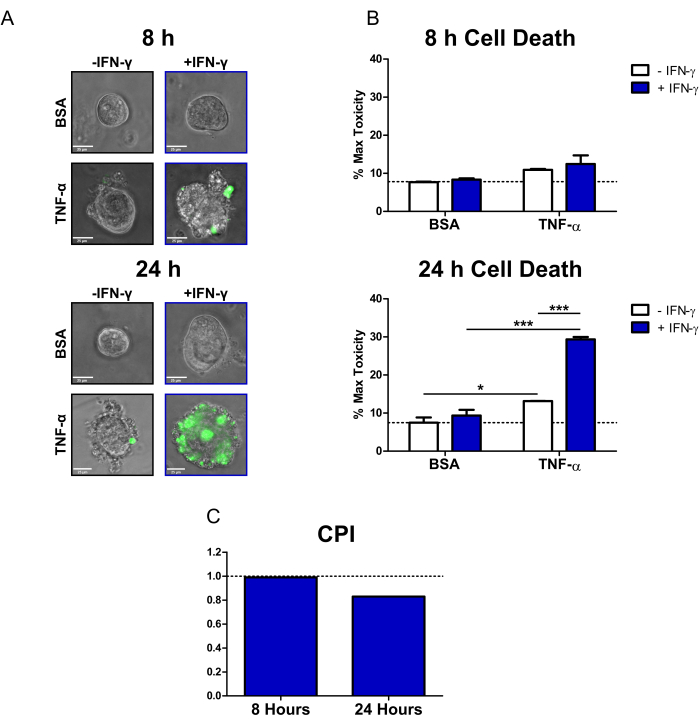
Abbildung 2: Quantitative Analyse des Zytokin-induzierten Zelltods bei humanen Zöliakie-Kolonoiden. (A) Repräsentative Live-Mikroskopie-Bilder von Zöliakie-Kolonoiden, die mit SYTOX Green Nukleinsäure-Fleck (fluoreszierender Zelltodfarbstoff) und Zytokinen nach 8 h und 24 h behandelt wurden; Übertragungs- und GFP-Kanäle (grüne Farbe) überlagert. Die Kolonoide wurden wie folgt behandelt: 1) PBS/BSA, 2) 10 ng/ml IFN-γ, 3) 10 ng/ml TNF-α, 4) 10 ng/ml IFN-γ + 10 ng/ml TNF-α. Maßstabsbalken = 25 μm. (B) Quantitative Analyse von Zöliakie-Kolonoiden, die mit dem fluoreszierenden Zelltodfarbstoff und den Zytokinen nach 8 und 24 Stunden behandelt wurden; Die Daten werden in % der MT-Bedingung ausgedrückt. N = 2 CD-Kolonoidlinien, 11-16 Coloide pro Bedingung. (C) CPI, berechnet pro Zeitpunkt unter Verwendung des Datensatzes aus B, N = 2 CD-Kolonoidlinien. Die Daten werden als Mittel ± SE ausgedrückt. In B wurde eine Zwei-Wege-ANOVA-Analyse durchgeführt, gefolgt von Bonferroni-Nachtests, *P < 0,05, ***P < 0,001, wie angegeben. Abkürzungen: CD = Morbus Crohn; GFP = grün fluoreszierendes Protein; CPI = Koeffizient der Wechselwirkung zwischen Störstoffen; PBS = phosphatgepufferte Kochsalzlösung; BSA = Rinderserumalbumin; TNF-α = Tumornekrosefaktor-alfa; IFN-γ = Interferon-Gamma; MT = Maximale Toxizität. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Zusammensetzung der Nährmedien für das Protokoll. Zur Herstellung von Organoid-Proliferationsmedien kombinieren Sie L-WRN-konditioniertes Medium und serumfreies Medium 1:1 und fügen Sie dann Nahrungsergänzungsmittel hinzu. Organoid-Proliferationsmedien sollten innerhalb von 2 Wochen nach der Zubereitung verwendet werden. Bitte beachten Sie, dass alle vollständigen Medien bei 4 °C gelagert werden sollten. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Experimentelles 96-Well-Plattenlayout und Zytokinbehandlungen. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Für die quantitative Analyse des Zelltods in Darmorganoiden wurden mehrere Methoden entwickelt. Die Untersuchung der Störung der Morphologie von Darmorganoiden durch Lichtmikroskopie ist ein einfacher Ansatz zur Quantifizierung der Auswirkungen zytotoxischer Substanzen11. Morphologische Veränderungen sind jedoch kein direktes Maß für den Zelltod, und die Methode ist nur semiquantitativ. Eine andere Methode besteht darin, die Stoffwechselaktivität von Organoiden mit Hilfe eines MTT- oder ATP-Assayszu bewerten 10,11. Es ist wichtig zu beachten, dass diese Assays nur Veränderungen der Zellviabilität feststellen können und mit einem Zelltod-Assay validiert werden müssen. Über andere fluorometrische Zelltod-Assays mit DNA-Bindungsfarbstoffen wurde berichtet12,13. Ein nicht-bildgebender Ansatz mit einem fluoreszierenden Mikroplatten-Reader ist möglich und ermöglicht einen hohen Durchsatz12. Diese Methode misst jedoch das durchschnittliche Signal eines gesamten Bohrlochs, was sie für heterogene Populationen ungeeignet macht. Es erfordert auch die Verwendung eines Mikroplatten-Readers mit Z-Höhenverstellung. Auf Fluoreszenzbildgebung basierende Techniken können für die Analyse einzelner Organoide und die Erfassung zellulärer/subzellulärer und morphologischer Daten verwendet werden. Automatisierte konfokale High-Content-Imaging-Systeme (HCI) können große Datenmengen mit hohem Durchsatz erzeugen13. Leider erfordert konfokale HCI spezielle Geräte, verwendet komplexe Protokolle, erfordert in der Regel kommerzielle Bildanalysesoftware und ist teuer.
Unser Protokoll für die quantitative Analyse des Zelltods von Kolonoiden zu mehreren Zeitpunkten ist unkompliziert, einfach und kostengünstig. Im Vergleich zu automatisierten HCI- und Plattenlesesystemen ist es jedoch zeitaufwändig und hat den Durchsatz reduziert. Eine weitere Einschränkung unserer Methode ist die Verwendung der Weitfeldmikroskopie im Gegensatz zur konfokalen Mikroskopie. Die konfokale Mikroskopie eignet sich besser für die Bildgebung dicker 3D-Proben, wie z. B. Organoide, da sie unscharfe Signale reduziert und serielle optische Schnitte (Z-Stacks) erfassen kann. Die konfokale Bildgebung erfordert jedoch in der Regel längere Erfassungszeiten und hochintensive Laser, die die Phototoxizität/Photobleichung erhöhen. Es ist wichtig zu beachten, dass fluoreszierende Zelltodfarbstoffe wie SYTOX Green nur für die Messung von Formen des Zelltods geeignet sind, bei denen es zu einem Verlust der Zellmembranintegrität kommt, wie z. B. Nekrose, späte Apoptose-assoziierte sekundäre Nekrose, Nekroptose und Pyroptose21. Es gibt einige Formen des regulierten Zelltods, bei denen die Zellmembran zumindest in den frühen Phasen des Zelltods undurchlässig bleibt, wie z. B. die Caspase-abhängige Apoptose. Dieses Protokoll könnte jedoch leicht modifiziert werden, um auch die Bildgebung eines Caspase-Fluoreszenzreporters22 mit 3/7-Aktivität einzubeziehen. Dies würde zusätzliche Daten liefern, um die spezifische Zelltodmodalität zu charakterisieren.
Wir nutzten unser Protokoll, um die zytotoxische synergistische Interaktion zwischen den Zytokinen IFN-γ und TNF-α zu demonstrieren (Abbildung 2C), die wir zuvor in Organoiden von Zöliakie-Patienten berichtet haben 9,10. Die physiologische Relevanz dieser Form des Synergismus wurde auch in murinen Modellen der hämophagozytären Lymphohistiozytose und Sepsis nachgewiesen23. Zur Quantifizierung der Synergie zwischen Kombinationen biologischer Wirkstoffe wurden mehrere mathematische Referenzmodelle und -ansätze implementiert24,25. Sie unterscheiden sich in ihrer Komplexität, der Anzahl der Faktoren, die sie berücksichtigen, und der Schwelle, ab der eine Wechselwirkung als synergistisch angesehen wird24,25. Einige Modelle erfordern Vorkenntnisse über die getesteten biologischen Wirkstoffe, treffen bestimmte Annahmen über die Aktivität von Wirkstoffen und können umfassende Dosis-Wirkungs-Kurven für jede Einzel- und Kombinationsbehandlung erfordern25. Die von uns gewählte Methode zur Messung der Synergie ist eine Modifikation des Modells des Arzneimittelwechselwirkungskoeffizienten (CDI), das zuvor zur Messung der hemmenden Wirkungen von Chemotherapie-Wirkstoffkombinationen auf die Proliferation von Krebszelllinien verwendet wurde26. Der CDI ist ein Unabhängigkeitsmodell von Bliss; Bei der Berechnung der vorhergesagten kombinierten Wirkung zweier Störungen geht Bliss independence davon aus, dass sie auf getrennte Signalwege abzielen und unabhängige Wirkmechanismen aufweisen27. Damit eine Wechselwirkung zwischen Störungen synergistisch ist, muss der tatsächliche kombinierte Effekt größer sein als der vorhergesagte Effekt. Dieses Modell ist für unseren Versuchsaufbau geeignet, da bekannt ist, dass IFN-γ und TNF-α unterschiedliche Rezeptoren und nachgeschaltete Signalkomponenten aufweisen. Darüber hinaus ermöglicht die Bliss-Unabhängigkeit die Berechnung eines Interaktionskoeffizienten zur Quantifizierung des Synergismus und erfordert keine Dosis-Wirkungs-Datensätze.
Es gibt einige Schlüsselfaktoren, die berücksichtigt werden müssen, um optimale Ergebnisse für dieses Protokoll zu erzielen. Es ist wichtig, dass Koloide zu einer hohen Dichte vermehrt werden (Abbildung 1Bi), dass sie einen Durchmesser von etwa 25-50 μm haben und sich aktiv vermehren, bevor sie versuchen, Zellen zu säen. Die Verwendung suboptimaler Kolonoidkulturen für Assays kann zu unzureichenden Zellzahlen, geringer Kolonoidrückgewinnung und inkonsistenten Experimenten führen. Für reproduzierbare Ergebnisse ist es auch wichtig, die Dichte der Kolonoide zwischen den Experimenten konsistent zu säen. Es wurde bereits gezeigt, dass die in vitro Reaktion auf inflammatorische Zytokine durch die Zellaussaatdichte beeinflusst werden kann28,29. Ein weiteres häufiges Problem ist die Bildung von Luftblasen in der BME-Kuppel, die die Bildgebung beeinträchtigen können. Dies kann durch die Anwendung der umgekehrten Pipettiertechnik verhindert werden. Diese Technik führt auch zu einer gleichmäßigeren Aussaat.
Wenn Sie mehrere Zeitpunkte abbilden, bereiten Sie für jeden Zeitpunkt eine Bedingung für die maximale Toxizität vor. Triton-X 100, ein nichtionisches Tensid, wird häufig als Positivkontrolle (Max-Toxizitätsbedingung) für Zytotoxizitätsassays verwendet. Die Zugabe von Triton-X 100 lysiert und tötet die Kolnoide, so dass der fluoreszierende Zelltodfarbstoff in die Zellen eindringen kann. Die Verwendung einer maximalen Toxizitätsbedingung von einem früheren Zeitpunkt führt zu einer ungenauen und inkonsistenten Normalisierung der Daten, da das Fluoreszenzsignal im Laufe der Zeit abnimmt.
Ein letzter Punkt, den es zu berücksichtigen gilt, ist die Wahl des BME, das für die Kolonoidkultur verwendet wird. Es gibt mehrere kommerzielle Hersteller von BME; Für unser Protokoll haben wir jedoch nur die Marke getestet, die in der Materialtabelle aufgeführt ist. Eine kürzlich durchgeführte Studie mit Organoiden aus dem Bauchspeicheldrüsenkrebs von Patienten ergab, dass die kommerzielle Quelle von BME die Zellproliferationsraten veränderte, aber keinen signifikanten Einfluss auf das Ansprechen auf Chemotherapeutika oder die Genexpression hatte30. Vor diesem Hintergrund gehen wir davon aus, dass der Ergebnistrend bei den BME-Marken für unser Protokoll ähnlich sein wird, aber wir empfehlen, konsequent dieselbe Marke zu verwenden.
Wir haben gezeigt, wie dieses Protokoll für die Analyse des IFN-γ- und TNF-α-induzierten Zelltods mit Hilfe von Zöliakie-Patienten abgeleiteten Kolonoiden verwendet werden kann. Von Patienten stammende Darmorganoide sind ein leistungsfähiges Werkzeug zur Untersuchung von Zöliakie, da sie viele Merkmale der Krankheit beibehalten, einschließlich einer erhöhten Empfindlichkeit gegenüber den zytotoxischen Wirkungen von TNF-α31. Das Protokoll könnte jedoch leicht modifiziert werden, um zytotoxische Wirkungen von anderen Störungen als Zytokinen oder anderen Krankheitszuständen als IBD wie Darmkrebs zu untersuchen (wir haben das Protokoll erfolgreich mit Nicht-IBD-Kolonoiden getestet). Wir glauben, dass diese Methode für alle Forschungsbereiche nützlich ist, die sich mit Zelltodmechanismen, der Funktion der Epithelbarriere oder der Immunologie der Darmschleimhaut befassen.
Offenlegungen
K.N. erhielt während der Zeit, in der die Arbeiten abgeschlossen waren, Forschungsgelder von AbbVie Inc. Diese Finanzierung erfolgte im Rahmen eines Forschungszentrums-Spoke-Preises (SFI-14/SP/2710) an APC Microbiome Ireland.
Danksagungen
Die Autoren danken den Patientinnen und Patienten für ihre Einverständniserklärung und Teilnahme an der Forschungsstudie sowie dem klinischen Personal für die hervorragende Unterstützung. Abbildung 1A wurde mit BioRender.com erstellt. Diese Arbeit wurde durch Zuschüsse der Science Foundation Ireland unterstützt, nämlich durch einen Career Development Award (CDA) für K.N. (SFI-13/CDA/2171), einen Zuschuss für ein Forschungszentrum (SFI-12/RC/2273) und einen Research Centre Spoke Award (SFI-14/SP/2710) für APC Microbiome Ireland. P.F. erhielt auch Mittel aus SFI/20/RP/9007.
Materialien
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F12 | Gibco | 12634010 | |
| Amphotericin B Solution | Sigma-Merck | A2942 | |
| A-83-01 | Sigma-Merck | SML0788 | |
| BioRender | Science Suite Inc. | N/A | Scientific illustration software |
| Bovine Serum Albumin | Sigma-Merck | A2058 | Essentially IgG-free, low endotoxin |
| B27 Supplement | Invitrogen | 17504-044 | |
| CHIR-99021 | Sigma-Merck | SML1046 | |
| Costar 48-well Clear TC-treated Multiple Well Plates, Individually Wrapped, Sterile | Corning | 3548 | |
| Cultrex Basement Membrane Extract, Type 2, Pathclear | R&D Systems | 3532-010-02 | Basement membrane extract |
| Dimethyl sulfoxide | Sigma-Merck | D2650 | |
| Dulbecco′s Phosphate Buffered Saline | Sigma-Merck | D8537 | |
| EVOS FL Digital Inverted Fluorescence Microscope | Invitrogen | AMF4300 | Digital inverted epifluorescence microscope |
| EVOS 40x Objective, fluorite, LWD, phase-contrast | ThermoFisher Scientific | AMEP4683 | Long working distance 40x fluorescence objective |
| Fiji/ImageJ (Windows version) | Open-source software | N/A | Image analysis software |
| Foetal Bovine Serum | Sigma-Merck | F9665 | |
| Gentamicin Solution | Sigma-Merck | G1397 | |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 100-0485 | Enzyme-free cell dissociation reagent |
| GlutaMAX-1 | Gibco | 35050061 | L-alanyl-L-glutamine dipeptide supplement |
| GraphPad Prism 5 (Windows version) | Dotmatics | N/A | Data graphics and statistics software |
| Greiner 15 mL Polypropylene Centrifuge Tube, Sterile with conical bottom & Screw Cap | Cruinn | 188261CI | |
| HEPES 1 M | Gibco | 15630080 | |
| Human recombinant EGF (animal free) | Peprotech | AF-100-15 | |
| N-Acetylcysteine | Sigma-Merck | A9165 | |
| Nicotinamide | Sigma-Merck | N0636 | |
| Normocin | InvivoGen | ant-nr-05 | Broad range antimicrobial reagent |
| Nunc Edge 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | ThermoFisher Scientific | 15543115 | |
| N2 supplement | Invitrogen | 17502-048 | |
| Recombinant Human IFN-gamma Protein | R&D Systems | 285-IF | Resuspend in sterile filtered 0.1% PBS/BSA |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA | Resuspend in sterile filtered 0.1% PBS/BSA |
| SB202190 | Sigma-Merck | S7067 | |
| Snap Cap Low Retention Microcentrifuge Tubes | ThermoFisher Scientific | 3451 | |
| SYTOX Green Nucleic Acid Stain - 5 mM Solution in DMSO | Invitrogen | S7020 | Fluorescent cell death dye, protect from light |
| Triton X-100 | Sigma-Merck | 93420 | |
| Trypan Blue solution | Sigma-Merck | T8154 | |
| Tryple Express | Gibco | 12604013 | Enzymatic dissociation reagent |
| Y-27632 | MedChemExpress | HY-10071 | Inhibitor of ROCK-I and ROCK-II |
Referenzen
- Patankar, J. V., Becker, C. Cell death in the gut epithelium and implications for chronic inflammation. Nat Rev Gastroenterol Hepatol. 17 (9), 543-556 (2020).
- Zeissig, S., et al. Downregulation of epithelial apoptosis and barrier repair in active Crohn's disease by tumour necrosis factor alpha antibody treatment. Gut. 53 (9), 1295-1302 (2004).
- Bartee, E., Mcfadden, G. Cytokine synergy: An underappreciated contributor to innate anti-viral immunity. Cytokine. 63 (3), 237-240 (2013).
- Fish, S. M., Proujansky, R., Reenstra, W. W. Synergistic effects of interferon γ and tumour necrosis factor α on T84 cell function. Gut. 45 (2), 191-198 (1999).
- Wakisaka, Y., Sugimoto, S., Sato, T. Organoid medicine for Inflammatory Bowel Disease. Stem Cells. 40 (2), 123-132 (2022).
- Flood, P., Hanrahan, N., Nally, K., Melgar, S. Human intestinal organoids: Modeling gastrointestinal physiology and immunopathology - current applications and limitations. Eur J Immunol. 54 (2), e2250248 (2024).
- Matsuzawa-Ishimoto, Y., et al. An intestinal organoid-based platform that recreates susceptibility to t-cell-mediated tissue injury. Blood. 135 (26), 2388-2401 (2020).
- Lee, C., et al. Intestinal epithelial responses to IL-17 in adult stem cell-derived human intestinal organoids. J Crohns Colitis. 16 (12), 1911-1923 (2022).
- Woznicki, J. A., et al. TNF-α synergises with IFN-γ to induce caspase-8-JAK1/2-STAT1-dependent death of intestinal epithelial cells. Cell Death Dis. 12 (10), 864 (2021).
- Flood, P., et al. DNA sensor-associated type I interferon signaling is increased in ulcerative colitis and induces jak-dependent inflammatory cell death in colonic organoids. Am J Physiol Gastrointest Liver Physiol. 323 (5), G439-G460 (2022).
- Grabinger, T., et al. Ex vivo culture of intestinal crypt organoids as a model system for assessing cell death induction in intestinal epithelial cells and enteropathy. Cell Death Dis. 5 (5), e1228 (2014).
- Bode, K. J., Mueller, S., Schweinlin, M., Metzger, M., Brunner, T. A fast and simple fluorometric method to detect cell death in 3D intestinal organoids. Biotechniques. 67 (1), 23-28 (2019).
- Mertens, S., et al. Drug-repurposing screen on patient-derived organoids identifies therapy-induced vulnerability in KRAS-mutant colon cancer. Cell Rep. 42 (4), 112324 (2023).
- Vandussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nat Protoc. 8 (12), 2471-2482 (2013).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Woznicki, J. A., et al. Human BCL-G regulates secretion of inflammatory chemokines but is dispensable for induction of apoptosis by IFN-γ and TNF-α in intestinal epithelial cells. Cell Death Dis. 11 (1), 68 (2020).
- Edgar, R. D., et al. Culture-associated DNA methylation changes impact on cellular function of human intestinal organoids. Cell Mol Gastroenterol Hepatol. 14 (6), 1295-1310 (2022).
- Mubaid, F., Brown, C. M. Less is more: Longer exposure times with low light intensity is less photo-toxic. Microscopy Today. 25 (6), 26-35 (2017).
- Ziegler, U., Groscurth, P. Morphological features of cell death. News Physiol Sci. 19 (3), 124-128 (2004).
- Zhang, Y., Chen, X., Gueydan, C., Han, J. Plasma membrane changes during programmed cell deaths. Cell Res. 28 (1), 9-21 (2018).
- Tamura, H., et al. Evaluation of anticancer agents using patient-derived tumor organoids characteristically similar to source tissues. Oncol Rep. 40 (2), 635-646 (2018).
- Karki, R., et al. Synergism of TNF-α IFN-γ triggers inflammatory cell death, tissue damage, and mortality in SARS-CoV-2 infection and cytokine shock syndromes. Cell. 184 (1), 149-168 (2021).
- Geary, N. Understanding synergy. Am J Physiol Endocrinol Metab. 304 (3), E237-E253 (2013).
- Duarte, D., Vale, N. Evaluation of synergism in drug combinations and reference models for future orientations in oncology. Curr Res Pharmacol Drug Discov. 3, 100110 (2022).
- Wong, F. C., Woo, C. C., Hsu, A., Tan, B. K. The anti-cancer activities of Vernonia amygdalina extract in human breast cancer cell lines are mediated through caspase-dependent and p53-independent pathways. PLoS One. 8 (10), e78021 (2013).
- Ryall, K. A., Tan, A. C. Systems biology approaches for advancing the discovery of effective drug combinations. J Cheminform. 7, 7 (2015).
- Sukho, P., et al. Effect of cell seeding density and inflammatory cytokines on adipose tissue-derived stem cells: An in vitro study. Stem Cell Rev Rep. 13 (2), 267-277 (2017).
- Vaughan-Jackson, A., et al. Density dependent regulation of inflammatory responses in macrophages. Front Immunol. 13, 895488 (2022).
- Lumibao, J. C., et al. The impact of extracellular matrix on the precision medicine utility of pancreatic cancer patient-derived organoids. bioRxiv. , (2023).
- Lee, C., et al. TNF-α induces LGR5+ stem cell dysfunction in patients with Crohn's disease. Cell Mol Gastroenterol Hepatol. 13 (3), 789-808 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten