Method Article
Количественная оценка цитокин-индуцированной гибели клеток в органоидах толстой кишки человека с помощью живой флуоресцентной микроскопии
В этой статье
Резюме
Этот протокол описывает простой и экономически эффективный метод исследования и количественной оценки гибели клеток в органоидах толстой кишки человека в ответ на цитотоксические пертурбагены, такие как цитокины. В этом подходе используется флуоресцентный клеточный смертельный краситель (SYTOX Green Nucleic Acid Stain), живая флуоресцентная микроскопия и программное обеспечение для анализа изображений с открытым исходным кодом для количественной оценки реакций отдельных органоидов на цитотоксические стимулы.
Аннотация
Гибель эпителиальных клеток кишечника (ИЭК) увеличивается у пациентов с воспалительными заболеваниями кишечника (ВЗК), такими как язвенный колит (ЯК) и болезнь Крона (БК). Это может способствовать нарушению барьерной функции кишечника, обострению воспаления и иммунопатогенезу заболевания. Цитокины и лиганды рецепторов смерти частично ответственны за это увеличение смертности от ИЭК. Цитокины, относящиеся к ВЗК, такие как TNF-α и ИФН-γ, являются цитотоксичными для ИЭК как по отдельности, так и в комбинации. В этом протоколе описан простой и практичный анализ для количественной оценки цитокин-индуцированной цитотоксичности в органоидах толстой кишки, полученных от пациентов с БК, с использованием флуоресцентного клеточного смертельного красителя (окрашивание зеленых нуклеиновых кислот SYTOX), живой флуоресцентной микроскопии и программного обеспечения для анализа изображений с открытым исходным кодом. Мы также демонстрируем, как использовать математическую модель независимости Блисса для расчета коэффициента пертурбагенного взаимодействия (CPI) на основе цитотоксичности органоидов. CPI может быть использован для определения того, являются ли взаимодействия между комбинациями цитокинов или другими типами пертурбагенов антагонистическими, аддитивными или синергетическими. Этот протокол может быть реализован для исследования цитотоксической активности цитокинов и других возмущений с использованием органоидов толстой кишки, полученных от пациентов.
Введение
Кишечный эпителий создает физический полупроницаемый барьер между содержимым просвета кишечника и нижележащими тканями. Для эффективного поддержания этого барьера эпителиальные клетки кишечника (ИЭК) подвергаются чрезвычайно высокому клеточному обороту с непрерывным циклом гибели и регенерации клеток. Однако во время воспалительных заболеваний, таких как воспалительное заболевание кишечника (ВЗК), наблюдаются более высокие уровни аберрантной гибели клеток1. Это может способствовать нарушению барьерной функции и активации иммунной системы, вызывая дальнейшее воспаление. При болезни Крона (БК), форме ВЗК, было показано, что передача сигналов цитокинов способствует повышению уровня смертности отИЭК2. Изучая то, как передача сигналов цитокинов индуцирует гибель клеток ИЭК, можно надеяться, что могут быть разработаны улучшенные методы лечения пациентов с ВЗК и другими кишечными воспалительнымирасстройствами.
В биологии и исследованиях по поиску мишеней для лекарств обычно понимают, что синергия имеет место, когда биологическая система, обработанная комбинациями отдельных стимулов, демонстрирует реакцию на комбинацию, которая больше, чем комбинированные аддитивные эффекты только одного стимула. Синергетические взаимодействия между цитокинами хорошо задокументированы в стимулировании врожденных противовирусных реакций3. Известно также, что цитокины вызывают гибель клеток синергетическим путем, в том числе в ИЭК4. Тем не менее, роль синергетической цитотоксической передачи сигналов цитокинов при воспалительных расстройствах кишечника, таких как ВЗК, недостаточно изучена.
Кишечные органоиды человека представляют собой трехмерные микроткани, производимые in vitro и получаемые из эпителиальных стволовых клеток кишечника. Кишечные органоиды могут быть выращены из биопсии слизистой оболочки кишечника, полученной от пациентов с ВЗК, и сохраняют многие характеристики заболевания 5,6. Органоиды оказались идеальной модельной системой для изучения цитокиновой цитотоксичности в контексте воспаления кишечника 7,8. Ранее наша группа охарактеризовала синергетические киллерные эффекты ИФН-γ и ФНО-α значимых для ВЗК цитокинов в органоидах толстой кишки (колоноидах), полученных от пациентов с БК)9,10. Тем не менее, точные механизмы, участвующие в опосредовании этой формы синергетической клеточной смерти, остаются неясными. Существует также потенциально гораздо больше нехарактерных цитотоксических цитокиновых взаимодействий, которые имеют отношение к кишечным воспалительным расстройствам.
Существует несколько протоколов для изучения гибели клеток в кишечных органоидах 10,11,12,13; Однако у каждого из них есть недостатки. Некоторые из этих методов измеряют только жизнеспособность клеток и не измеряют их смерть напрямую, не способны оценить реакцию одного органоида или требуют дорогостоящего оборудования и сложных протоколов. Необходимы надежные и простые методологии для количественной оценки гибели органоидных клеток и пертурбагенных взаимодействий в кишечных органоидах. Представленный нами протокол представляет собой простой и недорогой подход к измерению реакции одного органоида на цитотоксические цитокины, но может быть использован для любого типа стимула или возмущения. Мы также демонстрируем, как использовать модель синергии независимости Блисса для расчета коэффициента пертурбагенного взаимодействия (CPI), который описывает цитотоксические цитокиновые взаимодействия.
протокол
Биопсия слизистой оболочки толстой кишки была собрана у пациентов с БК, которым проводилась рутинная колоноскопия в рамках стандартного лечения. Этическое одобрение на использование образцов тканей пациента и создание органоидных линий толстой кишки из этих образцов было получено от Комитета по этике клинических исследований Учебных больниц Корка (CREC). Письменное информированное согласие было получено от всех пациентов в соответствии с Хельсинкской декларацией. Все работы по культивированию тканей с биопсией пациента и колоноидами должны выполняться в шкафу биобезопасности в соответствии с протоколами безопасности BSL2. Перед использованием убедитесь, что все пластиковые износы стерильны. В Таблице материалов приведена подробная информация обо всех материалах, реагентах, инструментах и программном обеспечении, используемых в этом протоколе.
Протоколы, которые наша группа использует для выделения крипты и культивирования органоидов, были адаптированы из установленных методов 14,15,16 и были опубликованы ранее 9,10,17. Для следующего протокола колоноиды культивировали с использованием органоидных пролиферативных сред (табл. 1). Колоноиды, выращенные с использованием органоидной пролиферационной среды, являются недифференцированными и обогащены стволовыми клетками толстой кишки. Основным компонентом органоидной пролиферирующей среды является 50% кондиционированная среда L-WRN, которая содержит факторы роста ниши кишечных стволовых клеток Wnt-3A (W), R-спондин 3 (R) и ноггин (N)15. Органоидные пролиферирующие среды получают путем комбинирования кондиционированных сред L-WRN и бессывороточных сред в соотношении 1:1 с последующим добавлением никотинамида и химических ингибиторов (Таблица 1).
1. Изоляция крипты толстой кишки и культура колоноидов
- Предварительно инкубируйте 48-луночный микротитровальный планшет при 37 °C, 5%CO2 в течение минимум 72 ч перед посевом криптами.
ПРИМЕЧАНИЕ: Предварительная инкубация планшета ускоряет полимеризацию экстракта базальной мембраны (BME) во время посева. - Разморозьте БМЭ на льду при температуре 4 °C вечером накануне изоляции склепов.
- Соберите биопсию толстой кишки в пробирку для сбора образцов, содержащую 15 мл среды для сбора биопсии (Таблица 1), и храните при температуре 4 °C до готовности к обработке.
- Осторожно удалите как можно больше среды для сбора биопсии с помощью пипетки. Промойте биопсию, добавив в пробирку для образца 15 мл ледяного DPBS с добавлением 2,5 мкг/мл амфотерицина B и 100 мкг/мл гентамицина. Энергично встряхните пробирку с образцом, чтобы отделить слизь или мусор от биопсии. Дайте биопсии осесть под действием силы тяжести и осторожно удалите как можно больше DPBS с помощью пипетки.
- Повторите процедуру стирки с шага 1.4 два раза (2х).
- Добавить в пробирку с образцом 10 мл реагента для диссоциации клеток без ферментов, дополненного 2,5 мкг/мл амфотерицина В и 200 мкг/мл гентамицина, и инкубировать в течение 15 мин при комнатной температуре с покачиванием при 30 об/мин.
- После инкубации энергично встряхивайте пробирку с образцом из стороны в сторону вручную, чтобы освободить зубчатые оболочки толстой кишки. Осмотрите трубку с помощью маломощного светового микроскопа и ищите высвободившиеся крипты и фрагменты крипты во взвешенном состоянии. Если его не видно, встряхните трубку и проверьте еще раз; Повторяйте до тех пор, пока склеп не станет виден в подвешенном состоянии.
- Прикрепите клеточный фильтр 70 μм к пробирке объемом 50 мл и отфильтруйте суспензию крипты через фильтр. Добавьте 10 мл ледяного органоидного промывочного материала (Таблица 1) в пустую пробирку с образцом, удалите среду и пропустите ее через сетчатый фильтр.
- Переложите отфильтрованные крипты в две пробирки по 15 мл (по 10 мл на пробирку) и центрифугируйте при температуре 4 °C в течение 5 мин при 150 × г.
- Осторожно удалите надосадочную жидкость из каждой пробирки объемом 15 мл, повторно суспендируйте гранулы крипты в 500 мкл ледяного органоидного промывочного материала, перенесите раствор крипты из обеих пробирок объемом 15 мл в одну микроцентрифужную пробирку объемом 1,5 мл и центрифугируйте при 4 °C в течение 3 мин при 400 × г.
- Осторожно извлеките надосадочную жидкость из микроцентрифужной пробирки и повторно суспендируйте гранулу крипты в 70 μл BME (20 μл на лунку и 10 μл дополнительного мертвого объема).
- Используя предварительно инкубированный 48-луночный планшет (шаг 1.1), засейте 20 μл суспензии BME/крипты в центр каждой лунки (1 купол BME на лунку). Плавно и неуклонно переверните пластину и инкубируйте при 37 °C, 5%CO2 в течение 20 минут.
ПРИМЕЧАНИЕ: Переворачивание пластины предотвращает прилипание ячеек к пластиковой поверхности лунки и обеспечивает их распределение внутри BME. - Извлеките тарелку из инкубатора. Убедитесь, что BME полностью полимеризовался, а затем нанесите на купола 350 мкл предварительно подогретой органоидной пролиферативной среды с добавлением 100 мкг/мл противомикробного реагента широкого спектра действия. Инкубируйте планшет при 37 °C, 5%CO2.
ПРИМЕЧАНИЕ: Антимикробный реагент широкого спектра действия предназначен для предотвращения загрязнения микробами слизистых оболочек, связанных с биопсией толстой кишки. Это требуется только в течение первой недели посева после изоляции крипты. - Меняйте среду 2-3 раза в неделю, используя предварительно подогретую среду для пролиферации органоидов, добавляя антимикробный реагент широкого спектра действия в течение первой недели культивирования; По истечении этого периода удалите реагент.
- После того, как культура колоноидов полностью укоренится (через 1-2 недели после выделения), диссоциируйте колоноиды с помощью ферментативного диссоциативного реагента с добавлением 10 мкМ ингибитора ROCK-I/II Y-27632 (см. раздел 2 для получения полной информации о колоноидной диссоциации).
ПРИМЕЧАНИЕ: Для первых двух пассажей (P0-1, P1-2) колоноиды должны быть расширены в соотношении 1:1/2; после P2 колоноиды могут быть пассированы в соотношении 1:3/4. - Семена и поддержание колоноидов в соответствии с шагами 1.11-1.13 (не добавляйте в органоидные пролиферативные среды противомикробный реагент широкого спектра).
2. Подготовка колоноидов к анализу клеточной смерти
ПРИМЕЧАНИЕ: Протокол анализа на клеточную смерть занимает 4 дня (Рисунок 1A).
- Расширяйте колоноиды с помощью 48-луночного планшетного формата, внося 20 μл суспензии BME/крипты в лунку, инкубируя при 37 °C, 5%CO2 и меняя среду 2-3 раза в неделю (350 μл на лунку).
- Проход колоноидов примерно за 1 неделю до забора для анализа на клеточную смерть. Перед сбором колоноидов убедитесь, что они размножаются с высокой плотностью (рис. 1Bi), что они имеют диаметр примерно 25-50 мкм и активно размножаются.
ПРИМЕЧАНИЕ: Мы использовали колоноиды для этого анализа с 3 по 14 отрывок с неизменными результатами. Тем не менее, было продемонстрировано, что транскрипционный ответ колоноидов на цитокины может изменяться в зависимости от продолжительности культивирования18. Исходя из этого, мы рекомендуем не использовать колоноиды для данного анализа после 15 пассажа. - Предварительно инкубируйте 96-луночные микротитровальные планшеты при 37 °C, 5%CO2 в течение минимум 72 ч перед посевом колоноидными клетками.
- Разморозьте БМЭ на льду при температуре 4 °C вечером накануне начала эксперимента.
- Приготовьте достаточный объем ферментативного реагента диссоциации (500 мкл на лунку колоноидов) путем добавления 10 мкМ ингибитора ROCK-I/II Y-27632. Аккуратно удалите среду из лунок, содержащих колоноиды; Пипеткой от края лунки следует следить, чтобы не повредить колоноидный купол. Добавьте в каждую лунку по 300 мкл ферментативного диссоциативного реагента.
- Для каждой лунки разломайте колоноидный купол, соскребая поверхность лунки кончиком пипетки P1000 и пипетируя клеточную суспензию вверх и вниз; Старайтесь избегать образования пузырьков воздуха. Соберите клеточную суспензию в пробирку объемом 15 мл.
ПРИМЕЧАНИЕ: Эта пробирка объемом 15 мл будет использоваться для сбора колоноидов из 10 лунок 48-луночного планшета. - Хорошо промойте то же самое 200 мкл ферментативного диссоциативного реагента, чтобы убедиться, что весь колоноидный материал собран и перенесен в ту же пробирку объемом 15 мл. Повторите этот процесс для каждой лунки с собранными расширенными колоноидами и соберите их в одну и ту же пробирку объемом 15 мл.
ПРИМЕЧАНИЕ: Для эффективной диссоциации в одной трубке должно быть собрано не более 10 лунок колоноидов. При сборе >10 лунок разделите собранные колоноиды поровну по нескольким пробиркам объемом 15 мл.
- Для каждой лунки разломайте колоноидный купол, соскребая поверхность лунки кончиком пипетки P1000 и пипетируя клеточную суспензию вверх и вниз; Старайтесь избегать образования пузырьков воздуха. Соберите клеточную суспензию в пробирку объемом 15 мл.
- Инкубировать пробирку объемом 15 мл с собранными колоноидами с шага 2.5.2 на водяной бане при температуре 37 °С в течение 5 минут. После инкубации центрифугируйте пробирку в течение 3 минут при концентрации 400 × г. Аккуратно удалите надосадочную жидкость, оставив в трубке примерно 1,2 мл.
ПРИМЕЧАНИЕ: Следующим шагом является физическая диссоциация колоноидов с помощью быстрого пипетирования. Чтобы это было эффективно, необходимо иметь в пробирке небольшой объем клеточной суспензии – для этой цели достаточно 1,2 мл, оставшихся в пробирке объемом 15 мл. - Ресуспендируйте колоноидную гранулу в оставшихся 1,2 мл ферментативного диссоциативного реагента. С помощью пипетки P1000 объемом 1 000 мкл поместите наконечник пипетки в суспензию, удерживая его чуть выше дна пробирки объемом 15 мл, затем быстро введите и выведите суспензию из наконечника. Чтобы быстро пипетировать, быстро нажмите кнопку поршня до первого упора, отпустите кнопку, пока она не окажется примерно на полпути к верхнему положению, и повторите. Быстро пипетируйте в течение примерно 10 с (30-40 депрессий), затем полностью суспендируйте суспензию и повторите пипетирование. Выполните 2-3 раунда быстрого пипетирования.
- Проверьте образец под микроскопом, чтобы убедиться, что целых колоноидов не осталось и что большинство фрагментов колоноидов имеют размер примерно 30-40 мкм (рис. 1Bii).
- Если образец требует дальнейшей диссоциации, инкубируйте на водяной бане при температуре 37 °C еще 3 мин, повторите технику пипетирования на шаге 2.7 и проверьте образец под микроскопом. Повторяйте этот процесс до тех пор, пока большинство колоноидных фрагментов не достигнут оптимального размера.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не диссоциировать колоноиды слишком сильно, так как это приведет к чрезмерной гибели клеток, низкой эффективности покрытия и недостаточному размеру колоноидов. - Добавьте 10 мл ледяного органоидного промывочного материала (Таблица 1) в пробирку объемом 15 мл. Центрифугируйте пробирку в течение 3 мин при давлении 400 × г, удалите надосадочную жидкость, повторно суспендируйте в 1 мл ледяной промывочной среды для органоидов и переложите в микроцентрифужную пробирку объемом 1,5 мл (называемую пробиркой с колоноидными фрагментами).
- Перемешайте содержимое пробирки с фрагментом толстой кишки с помощью пипетирования и возьмите образец объемом 50 мкл; перенесите этот образец объемом 50 мкл в новую микроцентрифужную пробирку объемом 1,5 мл (называемую пробиркой для подсчета клеток). Храните пробирку с фрагментом толстой кишки на льду с этого момента до завершения шага 2.15.
- Центрифугируйте трубку для подсчета клеток в течение 3 мин при давлении 400 × г, удалите надосадочную жидкость и повторно суспендируйте в 500 мкл ферментативного реагента диссоциации с добавлением 10 мкМ ингибитора ROCK-I/II Y-27632.
- Инкубируйте трубку для подсчета одиночных клеток на водяной бане при температуре 37 °C в течение 5 минут. С помощью пипетки P1000 с объемом 400 мкл нанесите пипетку на образец, как описано в шаге 2.7, и проверьте образец под микроскопом, чтобы убедиться в наличии суспензии одиночных клеток. Если нет, повторяйте этот процесс до тех пор, пока колоноиды полностью не диссоциируют в одноклеточную суспензию.
- Добавьте 1 мл органоидного промывочного материала в пробирку для подсчета одиночных клеток, центрифугируйте в течение 3 минут при 400 × г и осторожно удалите надосадочную жидкость. Ресуспендируйте клетки в 50 мкл органоидной промывочной среды, а затем добавьте 50 мкл трипанового синего.
- Подсчитайте клетки с помощью гемоцитометра. Рассчитайте количество клеток в образце объемом 50 мкл и используйте это для вычисления концентрации клеток в пробирке с фрагментом толстой кишки.
- Рассчитайте объем клеточной суспензии, необходимый для эксперимента, в котором на лунку 96-луночного микротитровального планшета будет засеяно 0,5 × 104 колоноидных клеток. Прибавьте примерно 15% к этому вычисленному объему, чтобы учесть мертвый объем. Перенесите этот общий объем из пробирки с фрагментами толстой кишки (шаг 2.11) в новую микроцентрифужную пробирку объемом 1,5 мл.
- Новую микроцентрифужную пробирку объемом 1,5 мл, содержащую колоноидные фрагменты, центрифугируют в течение 3 мин при 400 × г, удаляют надосадочную жидкость и ресуспендируют в ВМЭ (используйте 10 мкл БМЕ на 0,5 × 104 клеток).
ПРИМЕЧАНИЕ: Из-за физических характеристик BME (высокая вязкость, зависящая от температуры полимеризация) значительное количество материала может быть потеряно при пипетировании (мертвый объем).
- Новую микроцентрифужную пробирку объемом 1,5 мл, содержащую колоноидные фрагменты, центрифугируют в течение 3 мин при 400 × г, удаляют надосадочную жидкость и ресуспендируют в ВМЭ (используйте 10 мкл БМЕ на 0,5 × 104 клеток).
- Поместите пробирку или резервуар с суспензией колоноидов/ВМЭ на лед в стерильный контейнер внутри шкафа биобезопасности.
ПРИМЕЧАНИЕ: Удержание клеток на льду во время посева предотвращает преждевременную полимеризацию клеточного субстрата. - С помощью предварительно инкубированного 96-луночного микротитровального планшета (начиная с шага 2.3) внесите обратный пипетку 10 мкл раствора колоноида/BME в лунку. Обязательно расположите наконечник чуть выше поверхности лунки и наведите пипетку в центр, чтобы избежать удара о стенку лунки. Регулярно перемешивайте суспензию колоноидов/BME, чтобы предотвратить неравномерный посев.
ПРИМЕЧАНИЕ: Не засеивайте колоноиды в наружные краевые лунки микротитровальной пластины.- Для обратного пипетирования:
- Установите пипетку, а затем нажмите кнопку поршня за первым упором до второго упора.
- Удерживая это положение, погрузите наконечник в колоноидную/BME суспензию и медленно отпустите поршень наверх.
- Выдавите суспензию, аккуратно и неуклонно нажимая кнопку поршня до первого упора. При посеве большего количества лунок задержитесь в этом положении и повторите шаги 2.18.1.2-2.18.1.3.
- По завершении удалите небольшое количество оставшейся суспензии, нажав кнопку поршня до второго упора.
ПРИМЕЧАНИЕ: Мы рекомендуем использовать метод обратного пипетирования из-за высокой вязкости BME.
- Для обратного пипетирования:
- Плавно и неуклонно переверните пластину и инкубируйте при 37 °C, 5%CO2 в течение 20 минут.
- Извлеките тарелку из инкубатора. Убедитесь, что BME полностью полимеризовался, а затем покройте купола 200 μL предварительно подогретой органоидной пропагандирующей среды. При использовании 96-луночной микротитровальной пластины с окружающим рвом (который уменьшает испарение) заполните каждый резервуар 2 мл органоидной промывочной среды.
- Инкубируйте колоноиды при 37 °C, 5%CO2 в течение 3 дней и проверяйте их под микроскопом один раз в день, чтобы убедиться, что колоноиды восстановились и размножаются.
3. Лечение колоноидами для анализа клеточной смерти
- Приготовьте 2,5 μМ раствор флуоресцентного клеточного красителя (SYTOX Green Nucleic Acid Stain) и раствор ДМСО, добавив флуоресцентный клеточный краситель или ДМСО в предварительно нагретые органоидные пролиферативные среды (Таблица 2).
ПРИМЕЧАНИЕ: Защищайте от света флуоресцентный смертельный краситель для клеток и разбавленный раствор. Окрашиватель зеленых нуклеиновых кислот SYTOX растворяется в ДМСО; раствор ДМСО используется для приготовления состояния без красителя для контроля эффектов растворителя. - Используйте 2,5 мкМ раствор флуоресцентного клеточного смертельного красителя и раствор ДМСО из этапа 3.1 для приготовления лечения, как показано в таблице 2.
- Аккуратно удалите среду из 96-луночного микротитровального планшета, засеянного колоноидами, наклонив планшет и проведя пипетирование от края лунок; затем добавьте 200 мкл лечебной среды на лунку. Убедитесь, что у вас есть дополнительные контрольные лунки PBS/BSA для условий максимальной токсичности (см. Таблицу 2 для карты планшетов).
- Инкубируйте колоноиды при 37 °C, 5%CO2 в течение требуемых временных точек лечения, пока они не будут готовы к визуализации.
- Не менее чем за 2 ч до визуализации приготовьте 10% v/v раствор Triton-X 100 в стерильной воде, пригодной для клеточных культур, и добавьте 22 мкл 10% Triton-X 100 непосредственно в среду контрольных лунок для условий максимальной токсичности до конечной концентрации 1% v/v за 1 ч до визуализации.
ПРИМЕЧАНИЕ: Использование 10% раствора снижает количество ошибок пипетирования, которые могут возникнуть из-за высокой вязкости поверхностно-активного вещества.
4. Получение изображения
- Извлеките из инкубатора 96-луночный микротитровальный планшет, засеянный колоноидами, и перенесите в столик цифрового инвертированного эпифлуоресцентного микроскопа. Дайте тарелке нагреться до комнатной температуры.
- Подтвердите, что колоноиды, находящиеся в состоянии максимальной токсичности, полностью лизированы, исследуя их под микроскопом (Рисунок 1Biii).
- Выберите подходящий объектив, например, 40-кратный флуоресцентный объектив с большим рабочим расстоянием. Перед началом работы оптимизируйте настройки изображения микроскопа.
- Используя передаточный канал, сосредоточьтесь на колоноиде с SYTOX-положительными клетками, переключитесь на зеленый флуоресцентный белок (GFP)
(488 нм), а также отрегулируйте интенсивность света и время экспозиции, чтобы максимизировать флуоресцентный сигнал при минимизации фона. Сначала попробуйте низкую интенсивность света, затем постепенно увеличивайте время экспозиции; Если продолжительность воздействия нецелесообразна, то немного увеличьте интенсивность света.
ПРИМЕЧАНИЕ: Увеличение времени экспозиции вместо интенсивности света уменьшит фототоксичность и фотообесцвечивание образцов19. Подвергайте образцы воздействию флуоресцентного света только при необходимости.
- Используя передаточный канал, сосредоточьтесь на колоноиде с SYTOX-положительными клетками, переключитесь на зеленый флуоресцентный белок (GFP)
- Используя оптимизированные настройки визуализации для канала GFP, соблюдайте условия «Без красителя» и «Максимальная токсичность», чтобы убедиться, что образцы не подвергаются чрезмерной или недостаточной экспозиции. После завершения настройки сохраняйте настройки изображения в зависимости от условий.
- Получение изображений с использованием метода случайной выборки: для этого выберите поля зрения (FOV), которые следуют фиксированной сетке, покрывающей колоноидный купол. Получение изображений колоноидов минимум с 10 точек обзора. Убедитесь, что центральная плоскость колоноида находится в фокусе, и получайте изображения как в каналах передачи, так и в каналах GFP.
- Применяйте следующие критерии исключения.
- Не получайте изображения, если в поле зрения нет колоноидов.
- Не получайте изображения, если в поле зрения есть только колоноиды, которые перекрываются в одной и той же фокальной плоскости (рисунок 1, Biv).
- Не делайте изображений, если в поле зрения присутствуют только толстовидные обломки (Рисунок 1Bv). Не включайте в анализ колоноидные остатки.
- Применяйте следующие критерии исключения.
- Сохраняйте изображения в портативном сетевом графическом формате и экспортируйте.
- При визуализации дополнительных временных точек верните 96-луночный микротитровский планшет с колоноидами в инкубатор при температуре 37 °С, 5%СО2.
5. Анализ изображений
- Откройте Fiji ImageJ и импортируйте набор данных изображений, перетащив файлы на панель инструментов ImageJ или перейдя в раздел Файл | Откройте и выберите файлы. После открытия объедините файлы в стек изображений, нажав Image| Стеки | Изображения для стопки. Преобразуйте стек изображений в 8-битный формат файла, нажав Image| Тип| 8 -бит.
- Для каждого набора изображений щелкните инструмент «Произвольное выделение » на панели инструментов ImageJ и вручную выберите область интереса (ROI) на передаваемом изображении с помощью компьютерной мыши; ROI — это периметр колоноида. Затем переключитесь через стек изображений на соответствующее изображение канала GFP.
- Нажмите Анализировать| Заданные мерки; в диалоговом окне "Задать измерения " отметьте галочкой "Среднее значение серого " и не отмечайте все остальные поля. Выбрав изображение GFP, нажмите «Анализ» | Измерьте. Повторите этот анализ для каждого колоноида в стеке изображений. После анализа набора данных скопируйте все данные в окне «Результаты » и вставьте их в приложение для работы с электронными таблицами.
6. Расчет максимальной токсичности в %
- Рассчитайте среднее значение средних значений Серого (MGV) для каждого условия с помощью уравнения (1).
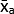 (среднее значение лечения а) =
(среднее значение лечения а) = 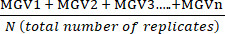 (1)
(1) - Выразите среднее значение каждого условия в процентах относительно среднего значения условия максимальной токсичности (MT) с помощью уравнения (2).
%MTa =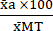 (2)
(2)
7. Расчет ИПЦ
- Нормализуйте (NORM) данные следующим образом, используя средние значения, рассчитанные на шаге 6.1, вычтите среднее значение нелеченного состояния (UT) из каждого условия лечения и условия максимальной токсичности (MT) (чтобы удалить фоновую гибель клеток, которая происходит независимо от обработки цитокинами). Затем разделите каждое условие обработки на среднее значение состояния максимальной токсичности (МТ), как показано в уравнении (3).
НОРМА а =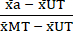 (3)
(3) - Вычитаем нормализованные значения, рассчитанные на шаге 7.1, из 1; результирующие значения представляют жизнеспособность клеток (V) после обработки (как в уравнении (4) ниже).
Va = 1 −НОРМА a (4) - Рассчитаем коэффициент возмущенного взаимодействия (CPI) с помощью уравнения (5):
ИПЦ =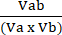 (5)
(5)
Где a обозначает первую обработку; b обозначает вторую обработку; А АБ – это комбинированное лечение. Значения ИПЦ указывают на синергетические (<1), аддитивные (=1) или антагонистические (>1) взаимосвязи.
Результаты
Используя этот протокол, мы продемонстрировали, как колоноиды пациентов с БК могут быть использованы для изучения цитотоксических эффектов цитокинов ИФН-γ и ФНО-α, имеющих отношение к ВЗК, на первичный эпителий. Мы использовали коммерчески доступный флуоресцентный клеточный краситель (SYTOX Green Nucleic Acid Stain), который может проникать только в клетки с поврежденной клеточной мембраной, где он затем активируется путем связывания с нуклеиновыми кислотами. Мы одновременно обрабатывали колоноиды цитокинами и флуоресцентным клеточным красителем и проводили визуализацию живых клеток через 8 ч и 24 ч с помощью инвертированного эпифлуоресцентного микроскопа. Репрезентативные изображения пропускания/флуоресцентного наложения через 8 ч указывают на то, что только колоноиды, обработанные ИФН-γ + TNF-α, являются положительными для флуоресцентного сигнала; однако существует лишь небольшое количество флуоресцентных клеток (рисунок 2A). Клеточный блеббинг, морфологический показатель гибели клеток20, также может наблюдаться в состоянии ИФН-γ + TNF-α. Через 24 ч у колоноидов, обработанных ИФН-γ + TNF-α, наблюдаются большие области, положительные на флуоресцентный сигнал (рис. 2А). Также наблюдается явный разрыв в морфологии толстой кишки – центральный просвет больше не виден, а эпителиальный барьер полностью нарушен.
Чтобы количественно оценить сигнал клеточного смертельного красителя, мы использовали программное обеспечение с открытым исходным кодом для анализа изображений для расчета интенсивности флуоресценции каждого колоноида. Затем мы нормализовали данные, выразив среднее значение каждого состояния в процентах от максимальной токсичности. Через 8 ч гомеостатическая или фоновая гибель клеток в контрольных колоноидах BSA была относительно низкой (7,7% от максимальной токсичности) (рис. 2B). На этом этапе не было статистически значимых изменений в уровнях клеточной смерти; однако при заболеваниях, получавших TNF-α, наблюдалось небольшое увеличение цитотоксичности (Рисунок 2B). Через 24 ч уровни клеточной гибели увеличились при всех состояниях, обработанных цитокинами. Тем не менее, наблюдалось минимальное изменение смертности клеток для контрольного состояния BSA между временными точками (7,5% от максимальной токсичности в течение 24 часов). У колоноидов, обработанных ИФН-γ + TNF-α, наблюдалось наибольшее увеличение уровней гибели клеток по сравнению с контролем БСА (29,4% от максимальной токсичности). Разница в уровнях клеточной гибели между комбинированным лечением и лечением одним цитокином (ИФН-γ, ФНО-α) была весьма значимой. Эти результаты позволяют предположить возможность цитотоксического синергетического взаимодействия между ИФН-γ и TNF-α через 24 ч.
Мы использовали CPI для количественной оценки цитотоксических взаимодействий между цитокиновыми препаратами и определения их синергизма. Взаимодействия между цитокинами считаются синергистическими, когда значение CPI равно <1, аддитивными при =1 или антагонистическими, когда >1. Мы рассчитали значения CPI для каждой временной точки (рис. 2C). Через 8 часов значение ИПЦ показало небольшой синергизм (0,99), при этом значение ИПЦ существенно снизилось за 24 часа (0,83). Этот анализ подтвердил, что взаимодействие между ИФН-γ и TNF-α через 24 ч было синергетическим. Кроме того, он показывает, как в этом контексте синергизм между ИФН-γ и ФНО-α зависит от времени.
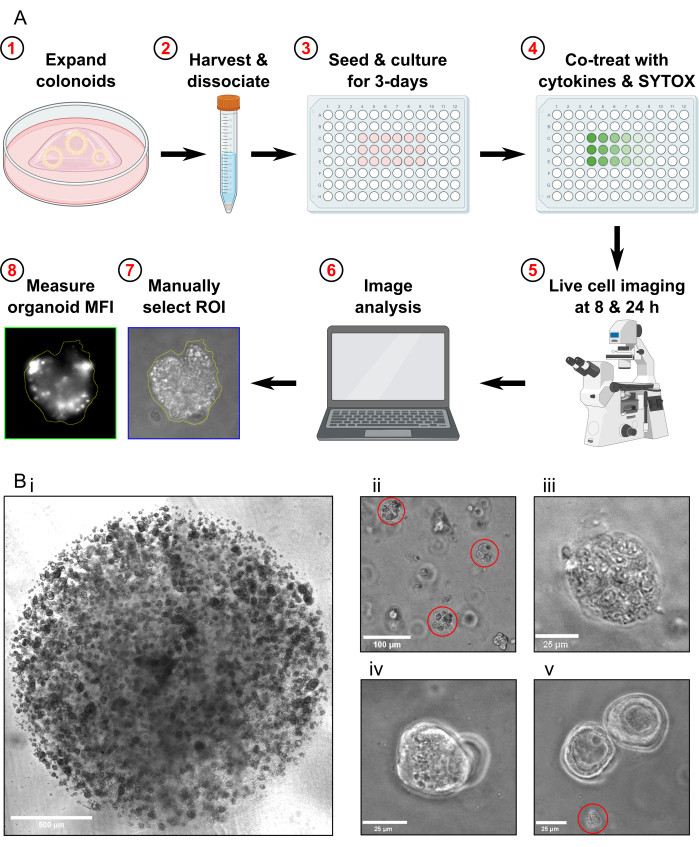
Рисунок 1: Схема экспериментального рабочего процесса и устранения неполадок. (A) Схематический обзор протокола. (B) Репрезентативные изображения. (Би) Изображение с помощью световой микроскопии, иллюстрирующее оптимальную плотность культуры и оптимальный размер колоноидов перед сдачей для анализа. Масштабная линейка = 500 мкм. (Bii) Световое микроскопическое изображение, иллюстрирующее оптимальный размер колоноидных фрагментов после диссоциации; Фрагменты выделены красным цветом. Масштабная линейка = 100 мкм. (Biii) Световое микроскопическое изображение некротической морфологии толстой кишки после лечения МТ (с помощью Triton X-100). Масштабная линейка = 25 мкм. (Biv) Световое микроскопическое изображение двух колоноидов, перекрывающихся в одной фокальной плоскости. Масштабная линейка = 25 мкм. (Bv) Световое микроскопическое изображение остатков колоноидных клеток, присутствующих после пассирования; Обломки выделены красным цветом. Масштабная линейка = 25 мкм. Сокращения: ROI = область интереса; MFI = средняя интенсивность флуоресценции; MT = максимальная токсичность. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
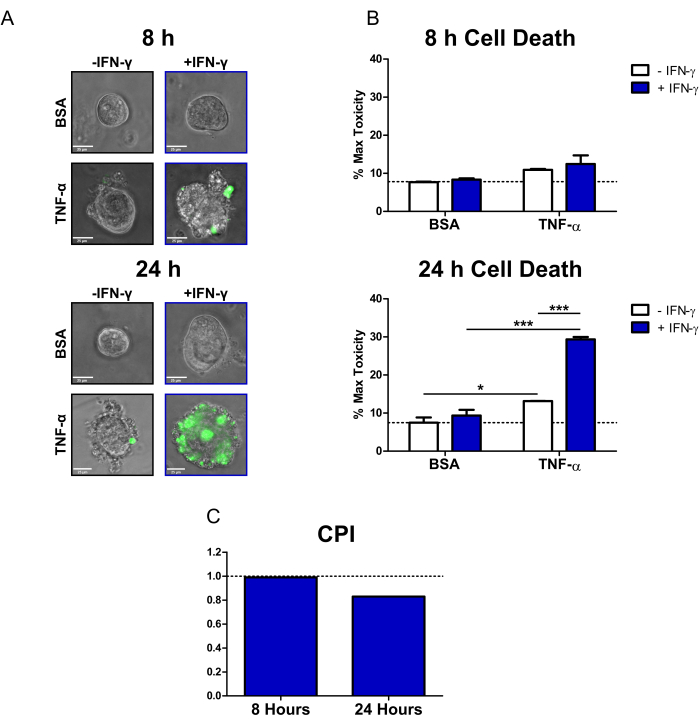
Рисунок 2: Количественный анализ цитокин-индуцированной гибели клеток в колоноидах БК человека. (A) Репрезентативные изображения колоноидов БК в реальном времени, обработанных SYTOX Green Nucleic Acid Stain (флуоресцентный краситель для гибели клеток) и цитокинами через 8 ч и 24 ч; наложение каналов передачи и GFP (зеленого цвета). Колоноиды лечили следующим образом: 1) PBS/BSA, 2) 10 нг/мл ИФН-γ, 3) 10 нг/мл TNF-α, 4) 10 нг/мл ИФН-γ + 10 нг/мл TNF-α. Масштабные линейки = 25 мкм. (B) Количественный анализ колоноидов CD, обработанных флуоресцентным клеточным красителем и цитокинами в 8 и 24 ч; данные выражаются в % от условия машинного перевода. N = 2 колоноидные линии CD, 11-16 колоноидов на одно состояние. (C) CPI рассчитывается для каждого временного момента с использованием набора данных из B, N = 2 колоноидных линий CD. Данные выражаются в виде средств ± SE. В исследовании B был проведен двухфакторный анализ ANOVA с последующим проведением посттестов Бонферрони, *P < 0,05, ***P < 0,001, как указано. Сокращения: CD = болезнь Крона; GFP = зеленый флуоресцентный белок; CPI = коэффициент взаимодействия возмущений; PBS = фосфатно-солевой буфер; BSA = бычий сывороточный альбумин; ФНО-α = фактор некроза опухоли-альфа; ИФН-γ = интерферон-гамма; MT = максимальная токсичность. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Состав питательных сред для протокола. Чтобы приготовить среду для пролиферации органоидов, смешайте кондиционированную среду L-WRN и среду без сыворотки 1:1, затем добавьте добавки. Органоидные пролиферативные среды следует использовать в течение 2 недель после приготовления. Обратите внимание, что все готовые носители должны храниться при температуре 4 °C. Нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: Экспериментальная схема расположения 96-луночных планшетов и лечение цитокинами. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Было разработано несколько методов количественного анализа гибели клеток в кишечных органоидах. Изучение нарушения морфологии органоидов кишечника с помощью световой микроскопии является прямым подходом к количественной оценке эффектов цитотоксическихвеществ. Тем не менее, морфологические изменения не являются прямым измерением гибели клеток, и метод является лишь полуколичественным. Другой метод заключается в оценке метаболической активности органоидов с помощью анализа МТТ или АТФ10,11. Важно отметить, что эти анализы могут определить только изменения жизнеспособности клеток и должны быть подтверждены анализом на клеточную смерть. Сообщалось о других флуориметрических анализах гибели клеток с использованием ДНК-связывающих красителей12,13. Возможен подход без визуализации с использованием флуоресцентного считывателя микропланшетов, который обеспечивает высокую пропускную способность12. Однако этот метод измеряет средний сигнал всей скважины, что делает его непригодным для гетерогенных популяций. Для этого также требуется использование считывателя микропланшетов с регулировкой Z-высоты. Методы, основанные на флуоресцентной визуализации, могут быть использованы для анализа отдельных органоидов и сбора клеточных/субклеточных и морфологических данных. Автоматизированные конфокальные системы визуализации с высоким содержанием (HCI) могут генерировать большие объемы данных с высокой пропускной способностью13. К сожалению, конфокальная гиперконная инфраструктура требует специализированного оборудования, использует сложные протоколы, обычно требует коммерческого программного обеспечения для анализа изображений и является дорогостоящей.
Наш протокол количественного анализа гибели колоноидных клеток в различных временных точках понятен, прост и недорог. Однако по сравнению с автоматизированными системами гиперконвергентной инфраструктуры и считывателями пластин это занимает много времени и имеет меньшую пропускную способность. Еще одним ограничением нашего метода является использование широкоугольной микроскопии, в отличие от конфокальной микроскопии. Конфокальная микроскопия больше подходит для визуализации толстых 3D-образцов, таких как органоиды, поскольку она уменьшает расфокусированный сигнал и позволяет получать последовательные оптические срезы (Z-стеки). Однако конфокальная визуализация обычно требует более длительного времени получения данных и высокоинтенсивных лазеров, которые увеличивают фототоксичность/фотообесцвечивание. Важно отметить, что флуоресцентные красители для клеточной смерти, такие как SYTOX Green, подходят только для измерения форм клеточной смерти, при которых происходит потеря целостности клеточной мембраны, таких как некроз, вторичный некроз, ассоциированный с поздним апоптозом, некроптоз и пироптоз21. Существуют некоторые формы регулируемой клеточной гибели, при которых клеточная мембрана остается непроницаемой, по крайней мере, на ранних стадиях клеточной смерти, такие как каспазозависимый апоптоз. Тем не менее, этот протокол может быть легко модифицирован для включения в него также визуализации флуоресцентного репортера22 активности каспазы 3/7. Это дало бы дополнительные данные, которые помогли бы охарактеризовать конкретную модальность клеточной смерти.
Мы использовали наш протокол для демонстрации цитотоксического синергетического взаимодействия между цитокинами ИФН-γ и ФНО-α (рис. 2C), о котором мы ранее сообщали ворганоидах 9,10, полученных от пациентов с БК. Физиологическая значимость этой формы синергизма также была продемонстрирована на мышиных моделях гемофагоцитарного лимфогистиоцитоза исепсиса 23. Для количественной оценки синергии между комбинациями биологических агентов было реализовано несколько математических эталонных моделей и подходов24,25. Они различаются по своей сложности, количеству учитываемых факторов и порогу для рассмотрения взаимодействия как синергетического24,25. Некоторые модели требуют предварительных знаний о тестируемых биологических агентах, делают определенные предположения об активности агентов и могут потребовать всеобъемлющих кривых «доза-реакция» для каждого отдельного и комбинированного лечения. Метод, который мы выбрали для измерения синергии, представляет собой модификацию модели коэффициента лекарственного взаимодействия (CDI), которая ранее использовалась для измерения ингибирующих эффектов комбинаций химиотерапевтических препаратов на пролиферацию раковых клеток26. CDI — это независимая модель Bliss; при расчете прогнозируемого комбинированного эффекта двух пертурбагенов независимость Блисса предполагает, что они нацелены на разные пути и обладают независимыми механизмами действия27. Для того чтобы взаимодействие между возмущениями было синергетическим, фактический совокупный эффект должен быть больше, чем прогнозируемый. Эта модель подходит для нашей экспериментальной установки, поскольку известно, что ИФН-γ и TNF-α имеют разные рецепторы и нисходящие сигнальные компоненты. Кроме того, независимость Bliss позволяет рассчитать коэффициент взаимодействия для количественной оценки синергизма и не требует наборов данных «доза-реакция».
Есть несколько ключевых факторов, которые необходимо учитывать для обеспечения оптимальных результатов для этого протокола. Важно, что колоноиды размножаются с высокой плотностью (рис. 1Bi), что они имеют диаметр примерно 25-50 мкм и активно размножаются до того, как попытаются засеять клетки. Использование неоптимальных культур колоноидов для анализов может привести к недостаточному количеству клеток, низкому восстановлению колоноидов и непоследовательности экспериментов. Для получения воспроизводимых результатов также важно постоянно засевать плотность колоноидов между экспериментами. Ранее было продемонстрировано, что на реакцию in vitro на воспалительные цитокины может влиять плотность посева клеток28,29. Еще одной распространенной проблемой является образование пузырьков воздуха в куполе BME, что может повлиять на визуализацию. Этого можно избежать, используя технику обратного пипетирования. Этот метод также приводит к более равномерному посеву.
Кроме того, если вы визуализируете несколько временных точек, подготовьте условие максимальной токсичности для каждой временной точки. Triton-X 100, неионогенное поверхностно-активное вещество, обычно используется в качестве положительного контроля (условие максимальной токсичности) для анализов цитотоксичности. Добавление Triton-X 100 лизирует и убивает колоноиды, позволяя флуоресцентному клеточному красителю проникать в клетки. Использование условия максимальной токсичности из более ранней точки времени приведет к неточной и непоследовательной нормализации данных из-за того, что флуоресцентный сигнал со временем затухает.
Последний момент, который следует рассмотреть, — это выбор БМЭ, используемого для культуры колоноидов. Существует несколько коммерческих производителей BME; однако для нашего протокола мы тестировали только марку, включенную в Таблицу материалов. Недавнее исследование с использованием органоидов рака поджелудочной железы, полученных от пациентов, показало, что коммерческий источник BME изменяет скорость пролиферации клеток, но не оказывает существенного влияния на реакцию на химиотерапевтические препаратыили экспрессию генов. Учитывая это, мы ожидаем, что тенденция результатов будет схожей между брендами BME для нашего протокола, но мы рекомендуем постоянно использовать одну и ту же марку.
Мы продемонстрировали, как этот протокол может быть использован для анализа индуцированной ИФН-γ и ФНО-α гибели клеток с использованием колоноидов, полученных от пациентов с БК. Кишечные органоиды, полученные от пациентов, являются мощным инструментом для изучения БК, поскольку они сохраняют многие характеристики заболевания, включая повышенную чувствительность к цитотоксическим эффектам TNF-α31. Тем не менее, протокол может быть легко изменен для изучения цитотоксических эффектов пертурбагенов, отличных от цитокинов, или болезненных состояний, отличных от ВЗК, таких как колоректальный рак (мы успешно протестировали протокол с использованием колоноидов, не относящихся к ВЗК). Мы считаем, что этот метод полезен для любой области исследований, связанной с механизмами гибели клеток, функцией эпителиального барьера или иммунологией слизистой оболочки кишечника.
Раскрытие информации
К.Н. получала финансирование исследований от AbbVie Inc. в то время, когда работа была завершена. Это финансирование было получено в рамках присуждения премии исследовательского центра (SFI-14/SP/2710) компании APC Microbiome Ireland.
Благодарности
Авторы хотели бы поблагодарить пациентов за их информированное согласие и участие в научном исследовании, а также клинический персонал за их отличную помощь. Рисунок 1A был создан с помощью BioRender.com. Эта работа была поддержана грантами Научного фонда Ирландии, а именно премией за развитие карьеры (CDA) K.N. (SFI-13/CDA/2171), грантом исследовательского центра (SFI-12/RC/2273) и премией исследовательского центра (SFI-14/SP/2710) APC Microbiome Ireland. .Ф. также получил финансирование от SFI/20/RP/9007.
Материалы
| Name | Company | Catalog Number | Comments |
| Advanced DMEM/F12 | Gibco | 12634010 | |
| Amphotericin B Solution | Sigma-Merck | A2942 | |
| A-83-01 | Sigma-Merck | SML0788 | |
| BioRender | Science Suite Inc. | N/A | Scientific illustration software |
| Bovine Serum Albumin | Sigma-Merck | A2058 | Essentially IgG-free, low endotoxin |
| B27 Supplement | Invitrogen | 17504-044 | |
| CHIR-99021 | Sigma-Merck | SML1046 | |
| Costar 48-well Clear TC-treated Multiple Well Plates, Individually Wrapped, Sterile | Corning | 3548 | |
| Cultrex Basement Membrane Extract, Type 2, Pathclear | R&D Systems | 3532-010-02 | Basement membrane extract |
| Dimethyl sulfoxide | Sigma-Merck | D2650 | |
| Dulbecco′s Phosphate Buffered Saline | Sigma-Merck | D8537 | |
| EVOS FL Digital Inverted Fluorescence Microscope | Invitrogen | AMF4300 | Digital inverted epifluorescence microscope |
| EVOS 40x Objective, fluorite, LWD, phase-contrast | ThermoFisher Scientific | AMEP4683 | Long working distance 40x fluorescence objective |
| Fiji/ImageJ (Windows version) | Open-source software | N/A | Image analysis software |
| Foetal Bovine Serum | Sigma-Merck | F9665 | |
| Gentamicin Solution | Sigma-Merck | G1397 | |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 100-0485 | Enzyme-free cell dissociation reagent |
| GlutaMAX-1 | Gibco | 35050061 | L-alanyl-L-glutamine dipeptide supplement |
| GraphPad Prism 5 (Windows version) | Dotmatics | N/A | Data graphics and statistics software |
| Greiner 15 mL Polypropylene Centrifuge Tube, Sterile with conical bottom & Screw Cap | Cruinn | 188261CI | |
| HEPES 1 M | Gibco | 15630080 | |
| Human recombinant EGF (animal free) | Peprotech | AF-100-15 | |
| N-Acetylcysteine | Sigma-Merck | A9165 | |
| Nicotinamide | Sigma-Merck | N0636 | |
| Normocin | InvivoGen | ant-nr-05 | Broad range antimicrobial reagent |
| Nunc Edge 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | ThermoFisher Scientific | 15543115 | |
| N2 supplement | Invitrogen | 17502-048 | |
| Recombinant Human IFN-gamma Protein | R&D Systems | 285-IF | Resuspend in sterile filtered 0.1% PBS/BSA |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA | Resuspend in sterile filtered 0.1% PBS/BSA |
| SB202190 | Sigma-Merck | S7067 | |
| Snap Cap Low Retention Microcentrifuge Tubes | ThermoFisher Scientific | 3451 | |
| SYTOX Green Nucleic Acid Stain - 5 mM Solution in DMSO | Invitrogen | S7020 | Fluorescent cell death dye, protect from light |
| Triton X-100 | Sigma-Merck | 93420 | |
| Trypan Blue solution | Sigma-Merck | T8154 | |
| Tryple Express | Gibco | 12604013 | Enzymatic dissociation reagent |
| Y-27632 | MedChemExpress | HY-10071 | Inhibitor of ROCK-I and ROCK-II |
Ссылки
- Patankar, J. V., Becker, C. Cell death in the gut epithelium and implications for chronic inflammation. Nat Rev Gastroenterol Hepatol. 17 (9), 543-556 (2020).
- Zeissig, S., et al. Downregulation of epithelial apoptosis and barrier repair in active Crohn's disease by tumour necrosis factor alpha antibody treatment. Gut. 53 (9), 1295-1302 (2004).
- Bartee, E., Mcfadden, G. Cytokine synergy: An underappreciated contributor to innate anti-viral immunity. Cytokine. 63 (3), 237-240 (2013).
- Fish, S. M., Proujansky, R., Reenstra, W. W. Synergistic effects of interferon γ and tumour necrosis factor α on T84 cell function. Gut. 45 (2), 191-198 (1999).
- Wakisaka, Y., Sugimoto, S., Sato, T. Organoid medicine for Inflammatory Bowel Disease. Stem Cells. 40 (2), 123-132 (2022).
- Flood, P., Hanrahan, N., Nally, K., Melgar, S. Human intestinal organoids: Modeling gastrointestinal physiology and immunopathology - current applications and limitations. Eur J Immunol. 54 (2), e2250248 (2024).
- Matsuzawa-Ishimoto, Y., et al. An intestinal organoid-based platform that recreates susceptibility to t-cell-mediated tissue injury. Blood. 135 (26), 2388-2401 (2020).
- Lee, C., et al. Intestinal epithelial responses to IL-17 in adult stem cell-derived human intestinal organoids. J Crohns Colitis. 16 (12), 1911-1923 (2022).
- Woznicki, J. A., et al. TNF-α synergises with IFN-γ to induce caspase-8-JAK1/2-STAT1-dependent death of intestinal epithelial cells. Cell Death Dis. 12 (10), 864 (2021).
- Flood, P., et al. DNA sensor-associated type I interferon signaling is increased in ulcerative colitis and induces jak-dependent inflammatory cell death in colonic organoids. Am J Physiol Gastrointest Liver Physiol. 323 (5), G439-G460 (2022).
- Grabinger, T., et al. Ex vivo culture of intestinal crypt organoids as a model system for assessing cell death induction in intestinal epithelial cells and enteropathy. Cell Death Dis. 5 (5), e1228 (2014).
- Bode, K. J., Mueller, S., Schweinlin, M., Metzger, M., Brunner, T. A fast and simple fluorometric method to detect cell death in 3D intestinal organoids. Biotechniques. 67 (1), 23-28 (2019).
- Mertens, S., et al. Drug-repurposing screen on patient-derived organoids identifies therapy-induced vulnerability in KRAS-mutant colon cancer. Cell Rep. 42 (4), 112324 (2023).
- Vandussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nat Protoc. 8 (12), 2471-2482 (2013).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Woznicki, J. A., et al. Human BCL-G regulates secretion of inflammatory chemokines but is dispensable for induction of apoptosis by IFN-γ and TNF-α in intestinal epithelial cells. Cell Death Dis. 11 (1), 68 (2020).
- Edgar, R. D., et al. Culture-associated DNA methylation changes impact on cellular function of human intestinal organoids. Cell Mol Gastroenterol Hepatol. 14 (6), 1295-1310 (2022).
- Mubaid, F., Brown, C. M. Less is more: Longer exposure times with low light intensity is less photo-toxic. Microscopy Today. 25 (6), 26-35 (2017).
- Ziegler, U., Groscurth, P. Morphological features of cell death. News Physiol Sci. 19 (3), 124-128 (2004).
- Zhang, Y., Chen, X., Gueydan, C., Han, J. Plasma membrane changes during programmed cell deaths. Cell Res. 28 (1), 9-21 (2018).
- Tamura, H., et al. Evaluation of anticancer agents using patient-derived tumor organoids characteristically similar to source tissues. Oncol Rep. 40 (2), 635-646 (2018).
- Karki, R., et al. Synergism of TNF-α IFN-γ triggers inflammatory cell death, tissue damage, and mortality in SARS-CoV-2 infection and cytokine shock syndromes. Cell. 184 (1), 149-168 (2021).
- Geary, N. Understanding synergy. Am J Physiol Endocrinol Metab. 304 (3), E237-E253 (2013).
- Duarte, D., Vale, N. Evaluation of synergism in drug combinations and reference models for future orientations in oncology. Curr Res Pharmacol Drug Discov. 3, 100110 (2022).
- Wong, F. C., Woo, C. C., Hsu, A., Tan, B. K. The anti-cancer activities of Vernonia amygdalina extract in human breast cancer cell lines are mediated through caspase-dependent and p53-independent pathways. PLoS One. 8 (10), e78021 (2013).
- Ryall, K. A., Tan, A. C. Systems biology approaches for advancing the discovery of effective drug combinations. J Cheminform. 7, 7 (2015).
- Sukho, P., et al. Effect of cell seeding density and inflammatory cytokines on adipose tissue-derived stem cells: An in vitro study. Stem Cell Rev Rep. 13 (2), 267-277 (2017).
- Vaughan-Jackson, A., et al. Density dependent regulation of inflammatory responses in macrophages. Front Immunol. 13, 895488 (2022).
- Lumibao, J. C., et al. The impact of extracellular matrix on the precision medicine utility of pancreatic cancer patient-derived organoids. bioRxiv. , (2023).
- Lee, C., et al. TNF-α induces LGR5+ stem cell dysfunction in patients with Crohn's disease. Cell Mol Gastroenterol Hepatol. 13 (3), 789-808 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены