Method Article
إزالة البكتيريا من مزارع السالمونيلا المصابة
In This Article
Summary
تصيب البكتيريا ، الموجودة في كل مكان والمتنوعة على الأرض ، وتتكاثر داخل العوائل البكتيرية ، وتلعب دورا حاسما في النظم الإيكولوجية الميكروبية. على الرغم من أهميتها ، فإن وجودها قد يعطل العمليات الصناعية. لقد طورنا طريقة باستخدام عديدات السكاريد الدهنية البكتيرية للقضاء على البكتيريا من مزارع السالمونيلا .
Abstract
تلعب العاثيات ، أو ببساطة العاثيات ، دورا حيويا في البيئات الميكروبية ، مما يؤثر على مجموعات البكتيريا ويشكل تطورها وتفاعلاتها. هذه الكائنات هي فيروسات تصيب وتتكاثر داخل العوائل البكتيرية. العاثيات موجودة في كل مكان على الأرض ، ومتنوعة للغاية ، وفيرة للغاية. في حين أن البكتيريا لها أدوار قيمة في بيئات مختلفة وهي مجال رئيسي للبحث في علم الأحياء الدقيقة والبيئة ، إلا أن وجودها قد يكون غير مرغوب فيه في بعض العمليات أو المنتجات الصناعية. بالنظر إلى وفرة وانتشار البكتيريا على الأرض ، فإن تصميم إجراءات لإزالة البكتيريا من الثقافات البكتيرية أمر بالغ الأهمية في التطبيقات المختبرية والصناعية المتنوعة للحفاظ على سلامة الثقافات وضمان نتائج تجريبية دقيقة أو جودة المنتج. هنا ، قمنا بضبط بروتوكول للقضاء على البكتيريا من مزارع السالمونيلا المعوية المصابة ، باستخدام استراتيجية تعتمد على استخدام عديدات السكاريد الدهنية (LPS) الموجودة في الغشاء الخارجي للبكتيريا سالبة الجرام. تلعب LPS البكتيرية دورا مهما في التعرف على المضيف بواسطة العاثيات ، ونحن نستخدم هذه الخاصية لتصميم إجراء فعال لإزالة العاثيات ، التي تستخدم LPS كمستقبل ، في مزارع السالمونيلا البكتيرية.
Introduction
تواجه المجموعات الميكروبية تحديات متعددة في البيئات الطبيعية ، والتهديد الشديد بشكل خاص هو احتمال الإصابة بالبكتيريا ، وهي الفيروسات التي تصيب البكتيريا1. تنتشر هذه الفيروسات على نطاق واسع على هذا الكوكب ، وتظهر تنوعا كبيرا ووفرة2،3،4،5. على الرغم من أن البكتيريا متنوعة في الحجم والتشكل والتنظيم الجينومي ، إلا أنها تشترك جميعها في نفس الهيكل: جينوم الحمض النووي أو الحمض النووي الريبي المغلف بقفيصة مكونة من بروتينات مشفرة بالعاثيات6. طورت البكتيريا مجموعة متنوعة من آليات الدفاع ضدها7. أحد الجوانب الرئيسية لعدوى البكتيريا ، والتي لها صلة بالتوصيف وكذلك للكشف ، هو مجالات ربط المستقبلات الموجودة على ألياف الذيل. تحتوي البكتيريا على بروتينات على سطحها تسمى البروتينات المرتبطة بالمستقبلات أو ألياف الذيل للتعرف على مواقع مستقبلات معينة على سطح الخلية البكتيرية والارتباط بها. في حالة البكتيريا سالبة الجرام ، يشارك التعرف على الهياكل السطحية ، مثل عديدات السكاريد الدهنية (LPS) ، وبروتينات الغشاء الخارجي ، و / أو البيلي ، و / أو السوط ، في تفاعل البكتيرياالعاثية 8. هذا التفاعل بين البكتيريا والبكتيريا محدد للغاية ويعتمد بشكل أساسي على قدرتها على الالتصاق بأسطح المضيف. مستضد O لعديد السكاريد الدهني هو مستقبل شائع الاستخدام9.
إن التحقيق في تفاعلات البكتيريا والبكتيريا ليس رائعا من وجهة نظر بيولوجية فحسب ، بل له أيضا تطبيقات عملية في مجالات مثل العلاج بالعاثيات والتكنولوجيا الحيوية. في حين أن البكتيريا لها أدوار قيمة في سياقات مختلفة ، على سبيل المثال ، تغيير مجموعات الميكروبات10 ، يمكن أن يكون وجودها غير مرغوب فيه في بعض العمليات الصناعية. في المستحضرات الصيدلانية والتكنولوجيا الحيوية وإنتاج الأغذية ، يمكن أن يؤثر وجود البكتيريا على جودة وسلامة المنتجات النهائية ، مما يجعل إزالتها ضرورية لتلبية معايير الجودة. في المعالجة الحيوية والتصنيع الحيوي ، حيث تستخدم المزارع البكتيرية لإنتاج مركبات مختلفة (مثل البروتينات أو الإنزيمات أو المضادات الحيوية) ، يمكن أن يؤدي وجود البكتيريا إلى تعطيل عمليات الإنتاج بسبب قدرتها على موازنة البكتيريا في كل بيئة مشتركة. يمكن للعاثيات أحيانا تحويل الحياة المهنية لعالم الأحياء الدقيقة الصناعية إلى كابوس11. يعد تصميم إجراءات فعالة لإزالة العاثيات أمرا بالغ الأهمية لضمان إنتاج متسق وموثوق ، مما يعزز كفاءة العملية. بصرف النظر عن هذه الجوانب الصناعية ، في بيئة مختبر الأبحاث ، حيث الدقة والتكرار أمران حاسمان ، يعد القضاء على البكتيريا أمرا ضروريا للحصول على نتائج دقيقة وموثوقة. علاوة على ذلك ، يمكن أيضا استخدام إزالة العاثيات لمحاكاة بيئات مختلفة لاختبار فرضيات مختلفة12. يمكن أن تكون إزالة العاثيات مفيدة جدا أيضا في بيئة البحث نظرا لأن العديد من الدراسات القائمة على العاثيات ، مثل تعداد البكتيريا بعد تطبيق العاثيات ، ستستفيد من خطوة لإزالة العاثيات من أجل إنتاج أعداد قابلة للحياة أكثر موثوقية.
ستستغرق إزالة العاثيات بناء على عزل المستعمرة عدة أيام للتأكد من خلو المستعمرات من العاثيات ، في حين أن الإجراء الموصوف هنا يسمح بتوليد ثقافات خالية من العاثيات في ساعات. يسمح لنا هذا البروتوكول بمتابعة تطور الثقافات البكتيرية دون منعها من عزل المستعمرات. بهذا المعنى ، من الممكن محاكاة البيئات المتقلبة (وجود و / أو عدم وجود العاثيات) لاختبار فرضيات مختلفة. علاوة على ذلك ، يسمح هذا البروتوكول بالتحليل النوعي والكمي لوجود العاثيات في الثقافة البكتيرية.
باختصار ، يعد تصميم إجراءات فعالة من حيث التكلفة لإزالة البكتيريا أمرا بالغ الأهمية للحفاظ على جودة المنتج وسلامته وكفاءة العملية في مختلف الصناعات وللتقدم في البحوث الأساسية والتطبيقية. هنا ، نصف بروتوكولا فعالا للغاية يعتمد على استخدام LPS لإزالة البكتيريا ، التي تستخدم LPS كمستقبل ، من مزارع السالمونيلا المصابة ، وهو فعال من حيث الوقت ويتطلب الحد الأدنى من المعدات.
Protocol
ملاحظة: قبل إجراء عملية القضاء على العاثيات ، وصفنا إعداد ثقافة السالمونيلا المصابة بكتريوفاج 9NA. في الشكل 1 ، يتم توضيح تمثيل عام للإجراء الكامل لإزالة البكتيريا في الثقافات البكتيرية.
1. تحضير مزارع السالمونيلا المصابة بالبكتيريا
- إعداد الثقافة البكتيرية
ملاحظة: في هذه الدراسة ، تم استخدام سلالة السالمونيلا المعوية تحت الأمعاء المصلية التيفيموريوم ATCC 14028 opvAB :: lacZ (SV8011) 13 .- قم بإذابة القارورة المسترجعة ببطء من -80 درجة مئوية والتي تحتوي على سلالة S. enterica ذات الأهمية عن طريق وضعها على الجليد.
- قم بإخراج سلالة S. enterica من مرق ثنائي ميثيل سلفوكسيد المذاب على طبق مرق لينوكس (LB) (10 جم / لتر تريبتون ، 5 جم / لتر كلوريد الصوديوم ، 5 جم / لتر مستخلص خميرة ، و 15 جم / لتر أجار ، انظر جدول المواد). احتضان اللوحة عند 37 درجة مئوية لمدة 24 ساعة.
- باستخدام إبرة التلقيح ، انقل مستعمرة من صفيحة S. enterica وقم بتلقيحها في 5 مل من LB السائل في أنبوب زجاجي. احتضان عند 37 درجة مئوية لمدة 24 ساعة مع تهوية عن طريق الهز عند 200 دورة في الدقيقة.
- إعداد البكتيريا
ملاحظة: تم استخدام البكتيريا 9NA ، التي تنتمي إلى عائلة Siphoviridae (رتبة Caudovirales)14 ، في هذا البروتوكول. والجدير بالذكر أنه يمكن استخدام بكتيريا السالمونيلا المعوية الأخرى التي تستخدم مستضد O لعديد السكاريد الدهني كمستقبلات.- تحضير مرق البكتيريا عن طريق إضافة 0.1 مل من محللات البكتيريا المركزة إلى خليط من 100 مل من مرق المغذيات (NB ؛ 5 جم / لتر ببتون و 3 جم / لتر من خلاصة الخميرة) ، 2 مل من أملاح 50x E (38.78 mM MgSO47 H2O ، 520.5 mM حامض الستريكH2O ، 2.87 M K2HPO4 لا مائي و 829 mM NaNH4HPO44 H2O) و 0.4 مل من 50٪ الجلوكوز. تخلط جيدا عن طريق الانقلاب.
- مثال تمثيلي لتركيز البكتيريا يمكن أن يكون 109 PFU / mL (وحدات تشكيل البلاك / مل) ، ولكن يمكن استخدام تركيزات أقل مع نتائج مماثلة (انظر جدول المواد). تقدير تركيز البكتيريا باتباع الخطوة 1.2.3.
- تحضير المحللة باتباع الخطوات الموضحة أدناه.
- تحضير لقاح S. enterica في 5 مل من LB (10 جم / لتر تريبتون ، 5 جم / لتر كلوريد الصوديوم ، و 5 جم / لتر مستخلص الخميرة). احتضان عند 37 درجة مئوية و 200 دورة في الدقيقة لمدة 24 ساعة.
- مزيج 4 مل من مرق البكتيريا مع 1 مل من ثقافة بين عشية وضحاها من S. enterica. احتضان المزيج عند 37 درجة مئوية و 200 دورة في الدقيقة لمدة 8 ساعات.
- للتمييز بين البكتيريا والبكتيريا ، قم بطرد المزيج عند 2377 × جم لمدة 20 دقيقة. استعادة المادة الطافية في أنبوب زجاجي ، وإضافة 800 ميكرولتر من الكلوروفورم (انظر جدول المواد) ، ودوامة ذلك. تأكد من نقل المرحلة العليا فقط عند استخدام خليط مع الكلوروفورم.
ملاحظة: من المهم منع نقل الكلوروفورم المتبقي ، مما قد يؤثر على كفاءة الإجراء. خطوة الكلوروفورم شائعة في كل من بروتوكولات العزل والانتشار كوسيلة لتعظيم العاثيات المنبعثة. ومع ذلك ، قد يؤدي الكلوروفورم إلى تعطيل بعض العاثيات أو تدمير العدوى15. لذلك ، هذه الخطوة تنطبق فقط على العاثيات المقاومة للكلوروفورم. - الحفاظ على المحللات في درجة حرارة الغرفة لمدة 2 ساعة ثم تخزينها في 4 درجات مئوية.
- قم بمعايرة المحللة لتحديد عدد البكتيريا / عدد PFU لكل مل موجود في المحللة المحضرة. للقيام بذلك ، قم بإجراء تقنية التراكب الموضحة أدناه.
- تحضير 5 مل من LB من اللقاح ل S. enterica. احتضان عند 37 درجة مئوية لمدة 24 ساعة مع تهوية عن طريق الهز عند 200 دورة في الدقيقة.
- قم بإجراء التخفيفات التسلسلية للمحللات إلى LB للوصول إلى عدد قابل للعد من PFU / mL. لتحديد عوامل التخفيف اللازمة ، حدد تحلل البكتيريا الأولية المركزة. للحصول على مثال تمثيلي لتركيز البكتيريا عند حوالي 109 PFU / mL ، فإن عوامل التخفيف التي تؤدي إلى عدد قابل للعد من اللويحات تتراوح بين 106-10 10.
- أضف 100 ميكرولتر من تخفيف المحللة المناسب و 60 ميكرولتر من الاستزراع الليلي ل S. enterica المحضر في اليوم السابق إلى 5 مل من LB أجار ناعم ، محضر عن طريق خلط السائل LB و LB-agar بنسبة 1: 1 والحفاظ على 56 درجة مئوية لتجنب التصلب. تخلط بعناية ، وتجنب الفقاعات.
- صب كل مزيج في الجزء العلوي من طبق LB واحتفظ به على المقعد حتى يتماسك الوسط.
- احتضان لوحات لمدة 24 ساعة عند 37 درجة مئوية. احسب عدد اللوحات على كل لوحة. لتحديد عدد PFU / مل ، اضرب عدد لويحات كل لوحة في عامل التخفيف (FD). لضمان عدوى العاثية الفعالة ، من الضروري وجود 10 9-1012 PFU / mL.
PFU / مل = لا. لويحات في اللوحة x FD
- تحضير مرق البكتيريا عن طريق إضافة 0.1 مل من محللات البكتيريا المركزة إلى خليط من 100 مل من مرق المغذيات (NB ؛ 5 جم / لتر ببتون و 3 جم / لتر من خلاصة الخميرة) ، 2 مل من أملاح 50x E (38.78 mM MgSO47 H2O ، 520.5 mM حامض الستريكH2O ، 2.87 M K2HPO4 لا مائي و 829 mM NaNH4HPO44 H2O) و 0.4 مل من 50٪ الجلوكوز. تخلط جيدا عن طريق الانقلاب.
- إصابة مزارع السالمونيلا بالبكتيريا
- خفف مزرعة بين عشية وضحاها من S. enterica إلى 1: 100 في الحجم النهائي من 5 مل من LB وأضف 0.1 مل من المحللة (مركزة عند 109-10 12 PFU / mL). احتضان عند 37 درجة مئوية و 200 دورة في الدقيقة لمدة 24 ساعة.
- تحديد عيار العاثية كما PFU في فحص لوحة
- لتحديد عدد البكتيريا في المزرعة المصابة ، قم بإجراء فحوصات الصفائح لتحديد عيار العاثية على أنه PFU / mL كما هو موضح أدناه.
- نقل 1 مل من الثقافة إلى أنبوب. أجهزة الطرد المركزي في 17,115 × غرام لمدة 2 دقيقة وصب الطافي في قارورة جديدة ملصقة.
- أضف 100 ميكرولتر من الكلوروفورم إلى القارورة والدوامة لإزالة الحطام البكتيري من المحلول. اتبع الخطوة 1.2.3.
- لتحديد عدد البكتيريا في المزرعة المصابة ، قم بإجراء فحوصات الصفائح لتحديد عيار العاثية على أنه PFU / mL كما هو موضح أدناه.
2. إزالة البكتيريا من مزارع السالمونيلا المعوية المصابة (انظر الشكل 2)
ملاحظة: لمراقبة عملية إزالة البكتيريا ، يتم أخذ حصص مختلفة في جميع أنحاء بروتوكول التنظيف للمعايرة. في المجموع ، هناك ثمانية قسامات لتأكيد أن عدد PFU / mL يتناقص طوال عملية التنظيف حتى التخلص الكامل.
- إزالة البكتيريا في التعليق
- تمييع الثقافة البكتيرية التي تحتوي على العاثيات إلى 1: 100 في 5 مل من 0.22 ميكرومتر LB المصفى في أنبوب طرد مركزي مخروطي 50 مل. نقطة المعايرة بالتحليل الحجمي 1: هذه هي القسمة الأولى للمعايرة (بدء زراعة السالمونيلا المصابة).
- جهاز طرد مركزي التعليق لمدة 10 دقائق عند 2377 × جم. إزالة بعناية طفا. لا تستخدم ماصة. صب الأنبوب. حاول ترك بعض الحجم في الجزء السفلي من أنبوب الطرد المركزي المخروطي لضمان وجود الخلايا.
- اغسل الخلايا البكتيرية ب 10 مل من وسط LB المصفى 0.22 ميكرومتر. كرر خطوات الطرد المركزي والغسيل 3x. أعد تعليق الحبيبات في 5 مل من LB المصفى 0.22 ميكرومتر. نقطة المعايرة بالتحليل الحجمي 2: هذه هي القسمة الثانية للمعايرة.
- نقل 50 ميكرولتر من المعلق البكتيري أعلاه من خلال مرشح معقم 0.45 ميكرومتر (انظر جدول المواد) باستخدام نظام الترشيح بالفراغ. اشطف الفلتر ب 100 مل من LB المصفى 0.22 ميكرومتر.
ملاحظة: حجم رأس البكتيريا 9NA هو 0.067 ميكرومتر. في المقابل ، يبلغ طول السالمونيلا 2-5 ميكرومتر وعرضها 0.5-1.5 ميكرومتر. وبالتالي ، إذا تم استخدام أغشية 0.45 ميكرومتر ، فلن تمر معظم البكتيريا لأنها أكبر من 0.45 ميكرومتر ، في حين أن معظم العاثيات ستمر عبر مسام المرشح 0.45 ميكرومتر.
- إزالة البكتيريا الموجودة داخل خلايا السالمونيلا
- لتسهيل إطلاق العاثيات من خلايا البكتيريا ، احتضان مرشح 0.45 ميكرومتر يحتوي على خلايا لمدة 2 ساعة عند 37 درجة مئوية داخل الحاضنة دون تفكيك النظام.
ملاحظة: هذه الخطوة من الحضانة مطلوبة لتعزيز تحلل البكتيريا المصابة وإطلاق العاثيات داخل الخلايا في المرشح. - اغسل مرشح 0.45 ميكرومتر باستخدام نظام ترشيح فراغ ، وشطف الفلتر ب 100 مل من 0.22 ميكرومتر رطل مصفى.
- استعادة الخلايا البكتيرية من المرشح في 2 مل من 2x LB (20 جم / لتر تريبتون ، 10 جم / لتر كلوريد الصوديوم ، 10 جم / لتر مستخلص الخميرة ؛ انظر جدول المواد). للقيام بذلك ، قم بنقل مرشح 0.45 ميكرومتر إلى قارورة باستخدام ملقط معقم. ثم أضف 2 مل من 2x LB فوق المرشح والماصة عدة مرات لتحرير الخلايا من الفلتر.
- جهاز طرد مركزي 1 مل من هذا التعليق لمدة دقيقتين عند 10354 × جم. تخلص من المادة الطافية واغسل الخلايا البكتيرية 3x باستخدام 1 مل من وسط LB المصفى. إعادة تعليق الخلايا في 1 مل من 2x رطل. نقطة المعايرة 3: هذه هي القسمة الثالثة للمعايرة.
ملاحظة: يوصى بشدة باستخدام رطل أكثر تركيزا (2x LB) لأنه ، كما هو موضح أدناه ، ستتم إضافة عديد السكاريد الدهني التجاري (LPS) ، ويذوب LPS في الماء ، وبالتالي يخفف الوسط.
- لتسهيل إطلاق العاثيات من خلايا البكتيريا ، احتضان مرشح 0.45 ميكرومتر يحتوي على خلايا لمدة 2 ساعة عند 37 درجة مئوية داخل الحاضنة دون تفكيك النظام.
- تجنب الإصابة مرة أخرى عن طريق خداع البكتيريا المنبعثة من الخلايا البكتيرية باستخدام عديد السكاريد الدهني التجاري كما هو موضح أدناه.
- احتضان 20 ميكرولتر من المعلق البكتيري في وجود عديد السكاريد الشحمي S. enterica التجاري (LPS ؛ انظر جدول المواد) إلى تركيز نهائي قدره 3.75 مجم / مل في 1 مل من 0.22 ميكرومتر LB المصفى لمدة ساعتين عند 37 درجة مئوية مع الاهتزاز عند 200 دورة في الدقيقة.
ملاحظة: قد ترتبط العاثيات المنبعثة من الخلايا إلى الوسط ب S. enterica LPS التجاري بدلا من LPS البكتيري. - بعد 2 ساعة من الحضانة ، انقل 1 مل من المزرعة إلى أنبوب طرد مركزي دقيق وجهاز طرد مركزي التعليق لمدة دقيقتين عند 10354 × جم. نقطة المعايرة بالتحليل الحجمي 4: استخدم المادة الطافية باعتبارها القسمة الرابعة للمعايرة.
- اغسل الحبيبات 3x ب 1 مل من وسط LB المصفى.
- بعد الغسيل ، أعد تعليق الحبيبات في 1 مل من 2x LB. احتضن 20 ميكرولتر من هذا المزيج في 1 مل من 0.22 ميكرومتر رطل مصفى مع 0.8 مجم / مل من LPS التجاري لمدة ساعتين عند 37 درجة مئوية مع الاهتزاز عند 200 دورة في الدقيقة. نقطة المعايرة 5: استخدم بقية المعلق البكتيري للمعايرة الخامسة.
- بعد ساعتين من الحضانة ، انقل 1 مل من المزرعة إلى أنبوب طرد مركزي دقيق وحبيبات عن طريق الطرد المركزي لمدة دقيقتين عند 10354 × جم. نقطة المعايرة بالتحليل الحجمي 6: استخدم المادة الطافية باعتبارها القسمة السادسة للمعايرة بالتحليل الحجمي عن طريق سكب المادة الطافية في قنينة جديدة.
- اغسل الخلايا البكتيرية 3x باستخدام LB المصفى. بعد الغسيل ، أعد تعليق الخلايا المجمعة في 1 مل من 0.22 ميكرومتر رطل مصفى.
- مرر 1 مل من المعلق البكتيري من خلال مرشح معقم 0.45 ميكرومتر باستخدام نظام ترشيح بالفراغ. اشطف الفلتر باستخدام 100 مل من LB المصفى 0.22 ميكرومتر.
- استرجع الخلايا من مرشح 0.45 ميكرومتر في 2 مل من وسط 2x LB. تحقيقا لهذه الغاية ، انقل مرشح 0.45 ميكرومتر إلى قارورة باستخدام ملقط معقم. ثم أضف 2 مل من 2x LB فوق المرشح والماصة عدة مرات لمحاولة تحرير الخلايا من الفلتر.
- بيليه 1 مل من الخلايا عن طريق الطرد المركزي لمدة 2 دقيقة عند 10,354 × جم. اغسل 3x برطل مفلتر 0.22 ميكرومتر. بعد الغسيل ، أعد تعليق الخلايا المجمعة في 1 مل من 2x رطل. نقطة المعايرة 7: هذه هي القسمة السابعة للمعايرة. هذه القسمة سوف تبلغ عن كفاءة إزالة العاثيات في الثقافات البكتيرية.
- احتضان 20 ميكرولتر من المعلق البكتيري في وجود عديد السكاريد الشحمي S. enterica التجاري (LPS ؛ انظر جدول المواد) إلى تركيز نهائي قدره 3.75 مجم / مل في 1 مل من 0.22 ميكرومتر LB المصفى لمدة ساعتين عند 37 درجة مئوية مع الاهتزاز عند 200 دورة في الدقيقة.
3. تحضير ثقافة السالمونيلا الخالية من البكتيريا بعد إزالة البكتيريا
- تحضير اللقاح الخالي من العاثيات. أضف 100 ميكرولتر من الخلايا من المعلق البكتيري إلى 900 ميكرولتر من LB تحتوي على 0.45 مجم / مل LPS. احتضان عند 37 درجة مئوية لمدة 24 ساعة مع الهز عند 200 دورة في الدقيقة.
- نقطة المعايرة بالتحليل الحجمي 8: تحضير القسمة الثامنة للمعايرة (المزرعة النهائية المحتملة غير المصابة). هذه النقطة هي تأكيد عدم وجود إعادة عدوى العاثيات.
النتائج
السالمونيلا المعوية وغيرها من البكتيريا سالبة الجرام لها غشاء خارجي يحتوي على LPS. مستضد O ل LPS هو مستقبل شائع الاستخدام من قبل البكتيريا 9NA لإصابة مزارع السالمونيلا 16,17.
بالنظر إلى التقارب المحدد للبكتيريا لمستضد O أو مناطق عديد السكاريد الأساسية في LPS ، أردنا فحص ما إذا كان يمكن استخدام LPS التجاري للسالمونيلا المعوية كشرك لاستبعاد البكتيريا 9NA. للقيام بذلك ، قمنا بخلط التركيزات المعروفة من LPS التجاري و 9NA lysate ، متبوعا بالمعايرة. تم خلط LPS التجاري و 9NA bacteriophages في حجم إجمالي قدره 200 ميكرولتر وتم تحضينها لمدة 2 ساعة عند 37 درجة مئوية دون اهتزاز. للمعايرة بالتحليل الحجمي ، تمت إضافة 100 ميكرولتر من خليط LPS-9NA و 60 ميكرولتر من مزرعة ليلية إلى 5 مل من أجار LB الناعم وسكبه على قمة صفيحة LB. تم تحضين الألواح لمدة 24 ساعة عند 37 درجة مئوية. كما هو موضح في الشكل 3 ، ينخفض عيار المحللة بشكل متناسب عندما يزداد تركيز S. enterica LPS التجاري. تشير هذه النتائج إلى أن LPS التجاري يعمل بشكل صحيح كشرك للبكتيريا 9NA.
ومن المثير للاهتمام ، أن الوقت اللازم للعاثية 9NA لتحلل خلايا السالمونيلا وإطلاق العاثيات يتم تسهيله من خلال عدد البكتيريا والعاثيات (الشكل 4). من أجل دراسة كيف يمكن أن يؤثر هذا الجانب على بروتوكول إزالة العاثيات ، اختبرنا بكتيريا مختلفة: نسب العاثيات (1: 1 ، 1: 10 ، 1: 100 ، و 1: 1000). كما هو موضح في الشكل 4 ، هناك انخفاض في OD600 نانومتر من الثقافة عند 1.5-2.5 ساعة بعد إضافة 9NA phage. تشير قيم OD600 nm التي تقترب من الصفر إلى أن الثقافة البكتيرية يتم تحللها18. لهذا السبب ، تم تحديد أوقات الحضانة في هذا البروتوكول على أنها 2 ساعة من أجل ضمان الوقت الكافي للعاثية الموجودة داخل خلايا السالمونيلا لتحلل البكتيريا وإطلاقها. يجب تقدير هذا الوقت لكل نظام عاثيات مضيف قبل تنفيذ هذا البروتوكول.
بمجرد أن قررنا أن LPS التجاري يعمل كشرك ووقت التحلل للبكتيريا المصابة ب 9NA ، قمنا بتنفيذ البروتوكول الموصوف لتنظيف مزارع السالمونيلا المصابة من البكتيريا (الشكل 1 والشكل 2). من أجل مراقبة وجود البكتيريا على طول كل خطوة من خطوات البروتوكول ، قمنا بإجراء فحوصات البلاك لحساب عدوى الثقافات الناتجة في 100 ميكرولتر من الخليط الناتج في نقاط مختلفة (الشكل 5). يمكننا أن نلاحظ أن الغسيل المتكرر والترشيح لا يكفيان للقضاء على البكتيريا من الثقافات (نقاط المعايرة 1-3) ؛ ومع ذلك ، فإن عدد العاثيات يتناقص بمجرد أن نستخدم خطوة حضانة مع LPS التجاري (نقطة المعايرة 4). الخطوة الحاسمة للإزالة الكاملة للبكتيريا في الثقافة البكتيرية هي الحضانة الثانية مع LPS التجاري (نقطة المعايرة 6). هذه الخطوة ضرورية للإزالة الناجحة للبكتيريا 9NA في مزارع السالمونيلا .
أحد الجوانب المثيرة للاهتمام في هذا البروتوكول هو معرفة مستوى مقاومة العاثيات بعد خطوات إزالة العاثيات. الإجراء الذي يفصل العاثيات عن البكتيريا المقاومة للعاثيات ليس له فائدة. لهذا السبب ، من الأهمية بمكان الكشف عن أن البكتيريا المتبقية في الثقافة معرضة للعاثيات. لإثبات أن الخلايا العاثية الحساسة تبقى في الثقافات بعد الإجراء ، استخدمنا مقايسة لوحة Evans Blue Uranine (EBU) للكشف عن تلوث العاثيات19. صنعت ألواح EBU من وسط LB المكمل ب 10 مل / لتر K2HPO4 25٪ ، 5 مل / لتر جلوكوز 50٪ ، 2.5 مل / لتر فلوريسئين 1٪ ، 1.25 مل / لتر إيفانز بلو 1٪ ، و 15 جم / لتر أجار. تم استخدام الخطوط المتقاطعة على ألواح EBU مع 9NA phage لتمييز العزلات المقاومة للعاثيات والحساسة للعاثيات (الشكل 6). تم استخدام الثقافات البكتيرية التي تم الحصول عليها في نهاية بروتوكول التنظيف للحصول على مستعمرات معزولة ، والتي تم فحصها بحثا عن تلوث العاثيات (الشكل 6 ب). يمكننا ملاحظة وجود كل من الخلايا المقاومة والحساسة. هذا البروتوكول لا يحبذ اختيار الخلايا المقاومة للعاثيات. إنه يزيل البكتيريا فقط.
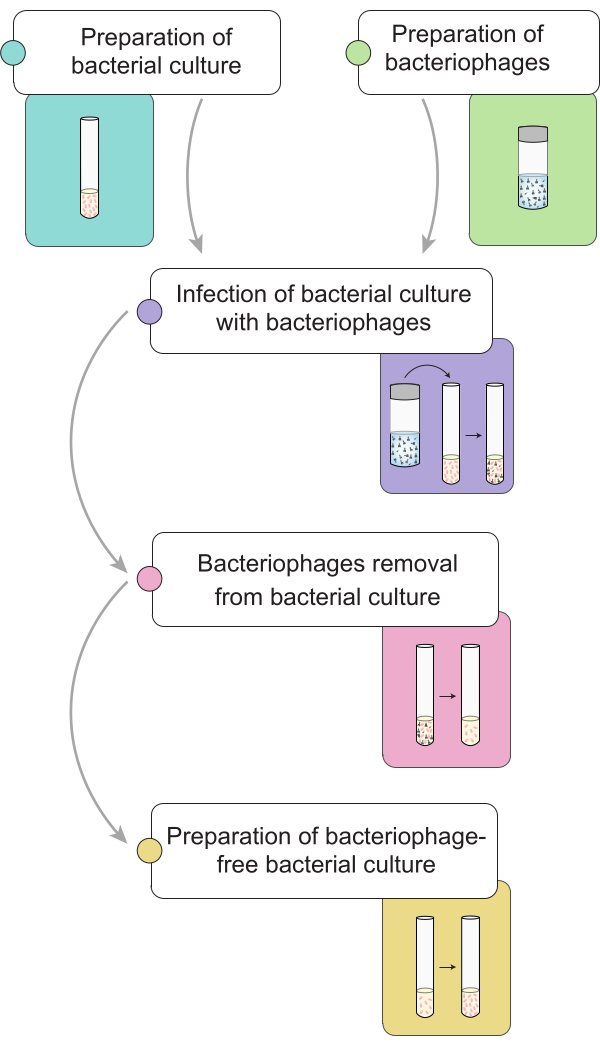
الشكل 1: مخطط موجز لإجراءات القضاء على البكتيريا في مزارع السالمونيلا . ينقسم سير العمل إلى مراحل مختلفة: تحضير الثقافة البكتيرية والمحللة ، وإصابة الثقافة البكتيرية بالبكتيريا ، وإزالة البكتيريا من الثقافات البكتيرية المصابة ، وإعداد لقاح بكتيري خال من العاثيات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
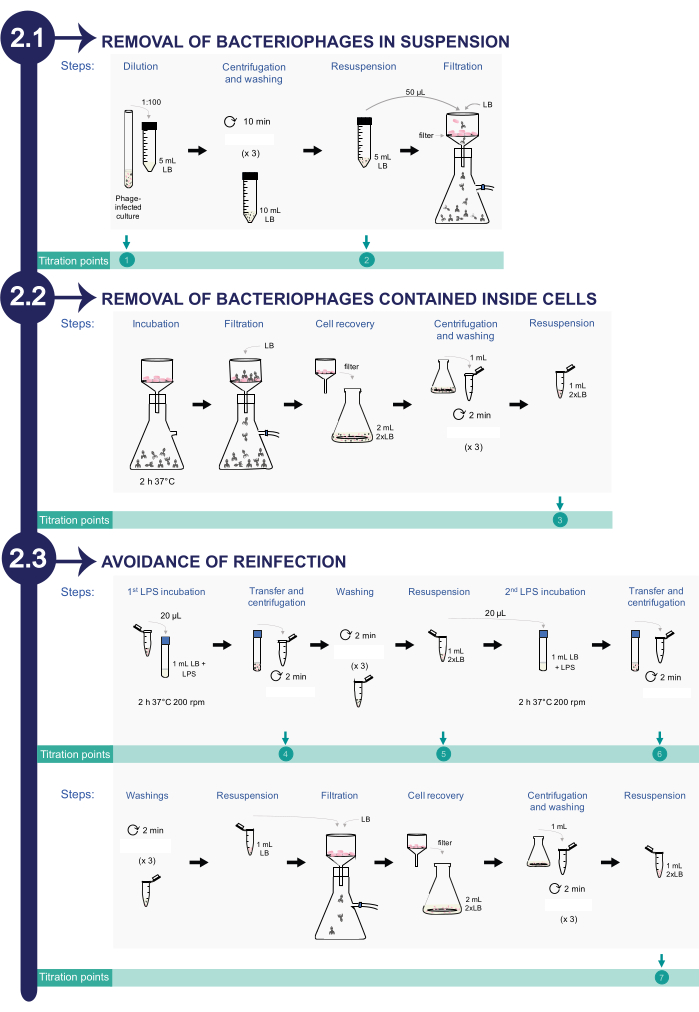
الشكل 2: إجراء إزالة البكتيريا من السالمونيلا المصابة تدخلمزارع إيكا. تتكون العملية من ثلاث مراحل: 1) إزالة البكتيريا في التعليق ، 2) إزالة العاثيات الموجودة داخل الخلايا البكتيرية ، و 3) تجنب الإصابة مرة أخرى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
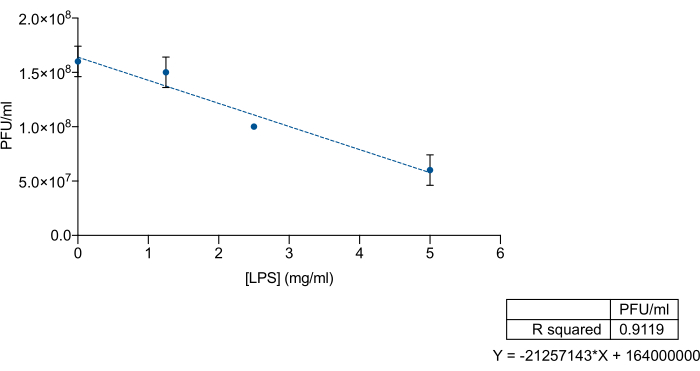
الشكل 3: مقايسة شرك LPS لقياس كفاءة LPS التجاري للسالمونيلا المعوية لربط البكتيريا. معايرة محللة 9NA (PFU / mL) بتركيزات متزايدة من LPS التجاري للسالمونيلا المعوية . أجريت التجربة في ثلاث نسخ. يتم عرض المتوسط والانحراف المعياري. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
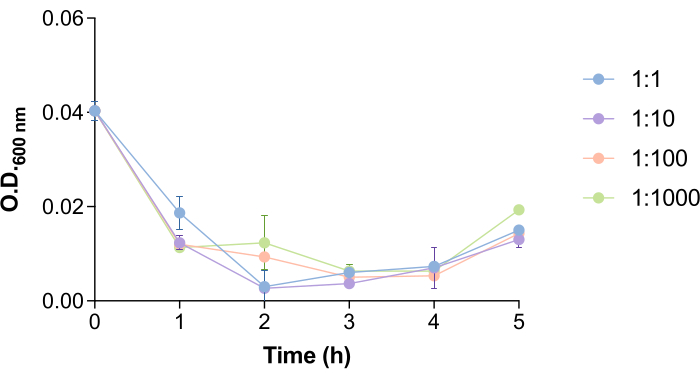
الشكل 4: وقت تحلل البكتيريا 9NA في مزارع السالمونيلا . منحنيات نمو مزارع السالمونيلا المعوية في وجود البكتيريا 9NA في البكتيريا: نسب العاثية 1: 1 ، 1: 10 ، 1: 100 ، و 1: 1000. أجريت التجربة في ثلاث نسخ. يتم عرض المتوسط والانحراف المعياري. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
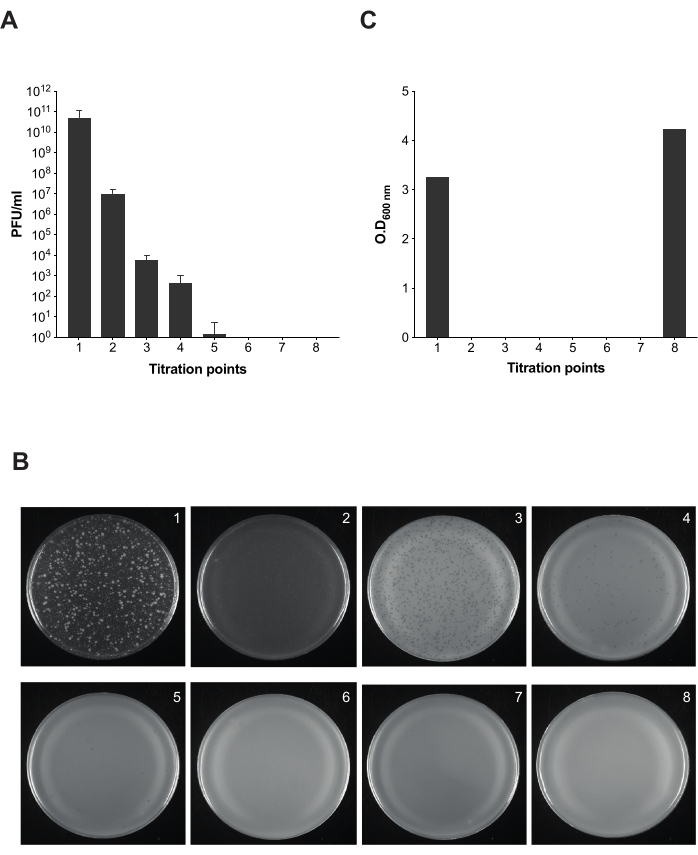
الشكل 5: مقايسة البلاك لاختبار العدوى أثناء إزالة البكتيريا في مزارع السالمونيلا . (أ) أخذت معايرة ثمانية حصصاة عند نقاط مختلفة من البروتوكول (نقاط المعايرة من 1 إلى 7 موضحة في الشكل 2). في هذه التجربة ، تم استخدام سلالة السالمونيلا المعوية المصلية التيفيموريوم ATCC 14028 opvAB::lacZ (SV8011) والبكتيريا 9NA. أجريت التجارب في ثلاث نسخ ، ويظهر المتوسط والانحرافات المعيارية. (ب) تم الحصول على صفائح أجار لينة مع السالمونيلا المعوية باتباع تقنية التراكب باستخدام القسامات من ثماني نقاط معايرة. تتوافق اللوحات من اليسار إلى اليمين مع نقاط المعايرة 1-8. (ج) الكثافة البصرية عند 600 نانومتر من المستزرع البكتيري في أوقات مختلفة من بروتوكول إزالة العاثيات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
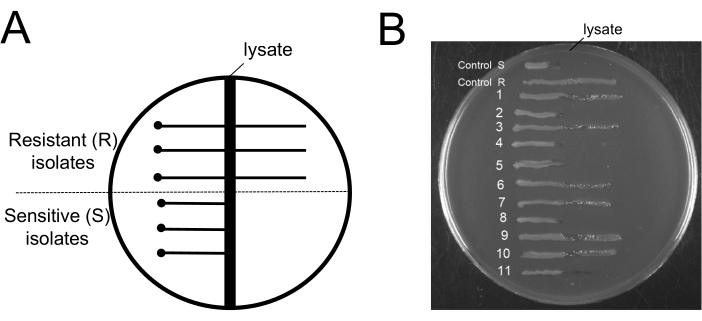
الشكل 6: اختبار الكشف عن البكتيريا المقاومة للعاثيات بعد إجراء إزالة البكتيريا. (أ) رسم تخطيطي للوحة أجار EBU نموذجية تستخدم في مقايسة أجار الخطوط المتقاطعة: تمثل المنطقة المظلمة الرأسية في المركز منطقة 9NA المحللة. تمثل النقطة الموقع الذي تلقيح فيه الخلايا المختبرة على مسافة آمنة من منطقة المحللة، وتمثل الخطوط الصلبة الأفقية إما الخلايا المقاومة للعاثيات التي تنمو عبر منطقة المحللة أو الخلايا الحساسة للعاثيات التي لا تنمو خارج منطقة المحللات. (ب) تم الحصول على مقايسات لوحة EBU لاختبار 11 مستعمرة في نهاية بروتوكول الإزالة. التحكم R و S هي أمثلة على العزلات المقاومة للعاثيات والحساسة للعاثيات ، على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يتم استخدام استراتيجيات متنوعة من قبل البكتيريا للتعرف على المضيفات البكتيرية وإصابتها. يمكن أن تعمل الهياكل الجزيئية المختلفة على سطح البكتيريا كمستقبلات عاثيات: البروتين ، عديد السكاريد ، عديدات السكاريد الدهنية (LPS) ، وجزيئات الكربوهيدرات20. في البكتيريا سالبة الجرام ، LPS هو مستقبل شائع للعاثيات. بالإضافة إلى ذلك ، المستقبلات الأخرى هي بروتينات الغشاء الخارجي ، و pili ، وflagella 21.
تم استغلال التفاعل المحدد بين البكتيريا والبكتيريا بناء على التعرف على LPS8 في هذا العمل لتطوير بروتوكول عالي الكفاءة للقضاء على البكتيريا في المزارع البكتيرية المصابة (الشكل 1 والشكل 2). بروتوكولنا لا يحبذ اختيار الخلايا المقاومة للعاثيات. إنه يزيل البكتيريا فقط (الشكل 6). تبقى كل من الخلايا الحساسة للعاثيات والمقاومة للعاثيات في الثقافة البكتيرية بعد إجراء هذا البروتوكول لإزالة العاثيات.
الممارسة القياسية التقليدية عند حدوث عدوى العاثية هي محاولة القضاء على جميع المواد الملوثة ، تليها التنظيف والتعقيم22. يتضمن إجراء إزالة التلوث تعريض الثقافة البكتيرية لظروف مرهقة ، مثل درجات الحرارة المرتفعة ، من أجل القضاء جزئيا أو كليا على الخلايا البكتيرية. كما هو موضح في النتائج التمثيلية ، فإن الخطوة الحاسمة في هذا البروتوكول هي حضانة الثقافات البكتيرية المصابة بالعاثيات باستخدام LPS التجاري ، وهي مادة غير ضارة للمزارع البكتيرية. هذا يساعد على الحفاظ على صلاحية الثقافات البكتيرية ويوفر مزايا كبيرة للتطبيقات الصناعية في المخمرات والمفاعلات الحيوية.
وقت الحضانة في هذا البروتوكول هو 2 ساعة لضمان الوقت الكافي لتحلل العاثيات للخلايا البكتيرية. إذا كان سيتم استخدام سلالات بكتيرية وبكتيريا مختلفة ، فيجب مراعاة هذه المعلمة وتحديدها من قبل المستخدم. في هذه الحالة ، يجب إجراء اختبار مشابه لتلك الموضحة في الشكل 4 قبل التجربة.
ومن المثير للاهتمام ، أنه يمكن أيضا تحليل فعالية بروتوكول التنظيف هذا من خلال استخدام فحص يراقب محتوى العاثيات لعينة معينة. بهذا المعنى ، تعد المستشعرات الحيوية اللاجينية أداة جديدة للكشف عن البكتيريا23. جهاز استشعار حيوي عاثي معروف قادر على اكتشاف coliphages ، والتي تستخدم LPS كمستقبل ، هو نظام opvAB :: gfp 13،18،23،24. يكتشف هذا المستشعر الحيوي للعاثيات زيادة في السكان الفرعيين OpvABON في وجود العاثيات التي تستخدم مستضد O كمستقبلات. بهذا المعنى ، يمكننا استخدام اندماج opvAB :: gfp لمراقبة العاثيات المرتبطة ب LPS في خطوات مختلفة من هذا البروتوكول و / أو الوسائط والظروف المتنوعة. ويمكن أن تكون هذه النهج قيمة في تحديد التوقيت والأماكن التي قد يكون فيها البروتوكول الفعال ضروريا.
في حين أن التعرف على LPS أمر شائع ، يمكن للعاثيات أيضا استخدام مجموعة متنوعة من المستقبلات السطحية الأخرى على الخلايا البكتيرية للتعلق والعدوى. هنا ، استخدمنا السالمونيلا سالبة الجرام كبكتيريا معوية تمثيلية والبكتيريا 9NA التي تستخدم LPS كمحفز لمستقبلات وطرد الجينوم. ترتبط عاثيات البكتيريا المعوية الأخرى (على سبيل المثال ، الإشريكية القولونية T5) بشكل فضفاض ب LPS وتتطلب بروتين غشاء خارجي لحقن الجينوم. ينطبق البروتوكول الموصوف على البكتيريا التي تتعرف على مستضد O ل LPS وتحتاج إليه للعدوى الناجحة ، مثل 9NA و Det7 و P2213،25،26،27. وفقا لذلك ، فإن التنفيذ الناجح لهذا البروتوكول لإزالة التلوث من العاثيات من الثقافات البكتيرية ينطوي على تحديد ما إذا كان مصدر عدوى العاثية يتطلب التعرف على LPS في المضيف.
في الختام ، وعلى الرغم من القيود المحتملة للبروتوكول ، تظهر نتائجنا التمثيلية بوضوح أن هذه الطريقة هي أداة قوية لتنظيف مزارع السالمونيلا البكتيرية من البكتيريا التي تستخدم LPS كمستقبل ومحفز لطرد الجينوم.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نشكر الدكتورة كارمن ر. بوزون وروسيو كارفاخال هولغيرا على المناقشات والاقتراحات المفيدة. تم دعم هذا العمل من خلال المنحة PID2020-116995RB-I00 الممولة من MICIU / AEI / 10.13039 / 5011100011033 والخطة السادسة Propio de Investigación y Transferencia من جامعة إشبيلية.
Materials
| Name | Company | Catalog Number | Comments |
| 20 mL syringe | BD Discardit II | 300296 | No special requirements |
| 50 mL conical tubes | Avantor | 525-0610 | No special requirements |
| 90 x 14 mm Petri dishes | Deltalab | 200209 | No special requirements |
| Agar | Sigma-Aldrich | A1296 | No special requirements |
| Bacteriophage lysate | Minimal concentration: 109 PFU/mL | ||
| Centrifuge | Eppendorf | No special requirements | |
| Chloroform | Panreac | 131252 | No special requirements |
| Citric acid · H2O | Merck | 1.00247 | |
| Colony counter | No special requirements | ||
| Evans Blue | Sigma-Aldrich | E-2129 | |
| Flasks | No special requirements | ||
| Fluorescein sodium salt | Sigma-Aldrich | F-6377 | |
| Forceps | No special requirements | ||
| Glass tubes | No special requirements | ||
| Glass tubes for lysate | No special requirements | ||
| Glucose | Sigma-Aldrich | G7021 | |
| K2HPO4 | Merck | 1.05104.1000 | |
| K2HPO4 anhydrous | Merck | 1.05104 | |
| Lipopolysaccharide from Salmonella enterica serotype Typhimurium | Sigma-Aldrich | L6511-25 mg | Dissolved in sterile water |
| Membrane 0.45 µm | MF-Millipore | HAWP02500 | No special requirements |
| MgSO4 · 7 H2O | Merck | 1.05886 | |
| NaCl | Sigma-Aldrich | S9888 | No special requirements |
| NaNH4HPO4 · 4 H2O | Sigma-Aldrich | S9506 | |
| Peptone | iNtRON | Ba2001 | No special requirements |
| Syringe Filter 0.22 µm | Millex | SLGSR33SB | No special requirements |
| Toothpicks | No special requirements | ||
| Tryptone | Panreac | 403682.1210 | No special requirements |
| Vacuum pump | Thermo Scientific | No special requirements | |
| Yeast extract | iNtRON | 48045 | No special requirements |
References
- Kasman, L. M., Porter, L. D. . Bacteriophages. , (2024).
- Lawrence, D., Baldridge, M. T., Handley, S. A. Phages and human health: More than idle hitchhikers. Viruses. 11 (7), 587 (2019).
- Beller, L., Matthijnssens, J. What is (not) known about the dynamics of the human gut virome in health and disease. Curr Opin Virol. 37, 52-57 (2019).
- Roux, S., Hallam, S. J., Woyke, T., Sullivan, M. B. Viral dark matter and virus-host interactions resolved from publicly available microbial genomes. eLife. 4, 08490 (2015).
- Wommack, K. E., Colwell, R. R. Virioplankton: Viruses in aquatic ecosystems. Microbiol Mol Biol Rev. 64 (1), 69-114 (2000).
- Louten, J. Virus structure and classification. Essentl Human Virol. , 19-29 (2016).
- Egido, J. E., Costa, A. R., Aparicio-Maldonado, C., Haas, P. J., Brouns, S. J. J. Mechanisms and clinical importance of bacteriophage resistance. FEMS Microbiol Rev. 46 (1), 048 (2022).
- Rakhuba, D. V., Kolomiets, E. I., Dey, E. S., Novik, G. I. Bacteriophage receptors, mechanisms of phage adsorption and penetration into host cell. Polish J Microbiol. 59 (3), 145-155 (2010).
- Lindberg, A. A. Bacteriophage receptors. Ann Rev Microbiol. 27 (1), 205-241 (1973).
- Koskella, B., Meaden, S. Understanding bacteriophage specificity in natural microbial communities. Viruses. 5 (3), 806-823 (2013).
- Marcó, M. B., Moineau, S., Quiberoni, A. Bacteriophages and dairy fermentations. Bacteriophage. 2 (3), 149-158 (2012).
- Fernández-Fernández, R., et al. Evolution of a bistable genetic system in fluctuating and non-fluctuating environments. bioRxiv. , (2024).
- Cota, I., Blanc-Potard, A. B., Casadesús, J. STM2209-STM2208 (opvAB): a phase variation locus of Salmonella enterica involved in control of O-antigen chain length. PloS one. 7 (5), e36863 (2012).
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. Enumeration of bacteriophages by double agar overlay plaque assay. Methods Mol Biol. 501, 69-76 (2009).
- Ackermann, H. W. Tailed bacteriophages: The order Caudovirales. Adv Virus Res. 51, 135-201 (1998).
- Wilkinson, R. G., Gemski, P., Stocker, B. A. D. Non-smooth mutants of Salmonella typhimurium: Differentiation by phage sensitivity and genetic mapping. J Gen Microbiol. 70 (3), 527-554 (1972).
- Casjens, S. R., Leavitt, J. C., Hatfull, G. F., Hendrix, R. W. Genome sequence of Salmonella Phage 9NA. Genome Announc. 2 (4), e00531 (2014).
- Cota, I., et al. Epigenetic control of Salmonella enterica O-antigen chain length: A tradeoff between virulence and bacteriophage resistance. PLoS Genet. 11 (11), e1005667 (2015).
- Chan, K., Botstein, D., Watanabe, T., Ogata, Y. Specialized transduction of tetracycline resistance by phage P22 in Salmonella typhimurium. Virology. 50, 883-898 (1972).
- Bertozzi Silva, J., Storms, Z., Sauvageau, D. Host receptors for bacteriophage adsorption. FEMS Microbiol Lett. 363 (4), 002 (2016).
- Sørensen, M. C. H., et al. Bacteriophage F336 recognizes the capsular phosphoramidate modification of Campylobacter jejuni NCTC11168. J Bacteriol. 193 (23), 6742-6749 (2011).
- Ogata, S., Hongo, M. Bacteriophages of the Genus Clostridium. Adv Appl Microbiol. 25, 241-273 (1979).
- Olivenza, D. R., Casadesús, J., Ansaldi, M. Epigenetic biosensors for bacteriophage detection and phage receptor discrimination. Environ Microbiol. 22 (8), 3126-3142 (2020).
- Olivenza, D. R., et al. A portable epigenetic switch for bistable gene expression in bacteria. Sci Rep. 9 (1), 862 (2019).
- Walter, M., et al. Structure of the receptor-binding protein of bacteriophage Det7: a Podoviral tail spike in a Myovirus. J Virol. 82 (5), 2265-2273 (2008).
- Davies, M. R., Broadbent, S. E., Harris, S. R., Thomson, N. R., vander Woude, M. W. Horizontally acquired Glycosyltransferase operons drive Salmonellae lipopolysaccharide diversity. PLoS Genet. 9 (6), e1003568 (2013).
- Wahl, A., Battesti, A., Ansaldi, M. Prophages in Salmonella enterica: a driving force in reshaping the genome and physiology of their bacterial host. Mol Microbiol. 111 (2), 303-316 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved