Method Article
感染したサルモネラ菌培養物からのバクテリオファージの除去
要約
バクテリオファージは、地球上に遍在し、多様であり、細菌宿主内で感染して複製し、微生物生態系で重要な役割を果たしています。その重要性にもかかわらず、その存在は産業プロセスを混乱させる可能性があります。私たちは、細菌のリポ多糖を用いて 、サルモネラ 菌の培養物からバクテリオファージを除去する方法を開発しました。
要約
バクテリオファージ、または単にファージは、微生物環境で重要な役割を果たし、細菌集団に影響を与え、その進化と相互作用を形作ります。これらの生物は、細菌宿主内で感染し、複製するウイルスです。ファージは地球上に遍在し、非常に多様で、非常に豊富です。バクテリオファージはさまざまな環境で貴重な役割を果たし、微生物学や生態学の重要な研究分野ですが、特定の工業プロセスや製品ではその存在が望ましくない場合があります。地球上のバクテリオファージの豊富さと遍在性を考慮すると、細菌培養物からバクテリオファージを除去する手順の設計は、培養物の完全性を維持し、正確な実験結果または製品品質を確保するために、さまざまな実験室および産業用途で重要です。ここでは、グラム陰性菌の外膜に位置するリポ多糖(LPS)の使用に基づく戦略を使用して、感染した サルモネラエンテリカ 培養物からバクテリオファージを排除するためのプロトコルを微調整しました。細菌性LPSはファージによる宿主認識に重要な役割を果たしており、この性質を利用して、LPSを受容体とするサル モネラ 菌の培養物におけるファージの効果的な除去手順を設計します。
概要
微生物集団は自然環境において複数の課題に直面しており、特に深刻な脅威は、細菌に感染するウイルスであるバクテリオファージによる感染の可能性です1。これらのウイルスは地球上に広く分布しており、非常に多様で豊富です2,3,4,5。バクテリオファージは、サイズ、形態、ゲノム構成が多様ですが、ファージにコードされたタンパク質によって形成されたカプシドに包まれたDNAまたはRNAゲノムという同じ構造を共有しています6。バクテリアは、それらに対するさまざまな防御メカニズムを進化させてきました7。バクテリオファージ感染の重要な側面は、特性評価と検出に関連し、尾部線維に存在する受容体結合ドメインです。バクテリオファージは、その表面に受容体結合タンパク質または尾部繊維と呼ばれるタンパク質を持ち、細菌細胞の表面の特定の受容体部位を認識して結合します。グラム陰性菌の場合、リポ多糖(LPS)、外膜タンパク質、線毛、および/またはべん毛などの表面構造の認識がファージと細菌の相互作用に関与している8。このバクテリオファージと細菌の相互作用は非常に特異的であり、主に宿主表面に付着する能力に依存します。リポ多糖類のO-抗原は、一般的に使用される受容体9です。
バクテリオファージと細菌の相互作用の研究は、生物学的な観点から興味深いだけでなく、ファージ療法やバイオテクノロジーなどの分野でも実用化されています。バクテリオファージは、例えば、微生物集団を変化させるなど、さまざまな状況で貴重な役割を果たします10が、特定の工業プロセスではその存在が望ましくない場合があります。医薬品、バイオテクノロジー、食品製造では、バクテリオファージの存在が最終製品の品質と安全性に影響を与える可能性があるため、品質基準を満たすためにバクテリオファージの除去が不可欠です。バイオプロセシングやバイオマニュファクチャリングでは、細菌培養物を使用してさまざまな化合物(タンパク質、酵素、抗生物質など)を産生するため、バクテリオファージの存在は、すべての共有環境で細菌集団のバランスをとる能力があるため、生産プロセスの混乱につながる可能性があります。ファージは、産業微生物学者の職業生活を悪夢に変えることがあります11。ファージを除去する効果的な手順の設計は、一貫性のある信頼性の高い生産を確保し、プロセスの効率を向上させるために重要です。これらの産業的側面とは別に、精度と再現性が重要な研究室の環境では、正確で信頼性の高い結果を得るためには、バクテリオファージの除去が不可欠です。さらに、ファージの除去は、異なる仮説を検証するために、さまざまな環境をシミュレートするためにも使用できます12。ファージの除去は、ファージの適用後の細菌の列挙など、多くのファージベースの研究が、はるかに信頼性の高い生存カウントを生成するためにファージを除去するステップから利益を得るため、研究環境でも非常に有用です。
コロニーの単離に基づくファージ除去は、コロニーにファージフリーであることを確認するために数日かかりますが、ここで説明する手順では、ファージフリーの培養物を数時間で生成できます。このプロトコルにより、細菌培養物がコロニーを分離するのを止めることなく、細菌培養物の進化を追跡できます。この意味で、変動する環境(ファージの有無)をシミュレートして、さまざまな仮説を検証することができます。さらに、このプロトコルは、細菌培養物中のファージの存在の定性的および定量的分析を可能にします。
要約すると、バクテリオファージを除去するための費用対効果の高い手順を設計することは、さまざまな業界で製品の品質、安全性、およびプロセス効率を維持し、基礎研究と応用研究を進歩させるために重要です。ここでは、感染した サルモネラ 菌培養物からLPSを受容体として使用するバクテリオファージを除去するためのLPSの使用に基づく非常に効果的なプロトコルについて説明します。
プロトコル
注:ファージの除去手順を実行する前に、9NAバクテリオファージに感染した サルモネラ 菌培養物の調製について説明します。 図1には、細菌培養物におけるバクテリオファージ除去の完全な手順の一般的な表現が示されています。
1. バクテリオファージに感染した サルモネラ 菌培養物の調製
- 細菌培養の準備
注:この研究では、 サルモネラ菌 亜種 Enterica serovar Typhimurium株ATCC 14028 opvAB::lacZ (SV8011)13 を使用しました。- 目的の S.enterica 株を含む-80°Cから回収したバイアルを氷上に置いてゆっくりと解凍します。
- 融解したジメチルスルホキシドストックから S.エンテリカ 株をレノックスブロス(LB)プレート(10 g / Lトリプトン、5 g / L NaCl、5 g / L酵母抽出物、および15 g / L寒天)にストリーク します。プレートを37°Cで24時間インキュベートします。
- 接種針を用いて 、S.エンテリカ プレートからコロニーを移し、ガラス管内の5mLの液体LBに接種します。200 rpmで振とうして曝気しながら、37°Cで24時間インキュベートします。
- バクテリオファージの調製
注:このプロトコルでは、Siphoviridae科(Caudovirales目)14に属するバクテリオファージ9NAを使用しました。特に、リポ多糖のO抗原を受容体として使用する他の サルモネラ・エンテリカ ・バクテリオファージを使用することができる。- 100 mLの栄養ブロス(NB;5 g/Lペプトンおよび3 g/L酵母抽出物)、2 mLの50x E塩(38.78 mM MgSO47 H2O、520.5 mMクエン酸H2O、2.87 M K2HPO4 無水および829 mM NaNH4HPO44 H2O)および0.4 mLの50%の混合物に0.1 mLの濃縮バクテリオファージ溶解物を加えて、バクテリオファージブロスを調製します。グルコース。反転させてよく混ぜます。
- バクテリオファージ濃度の代表的な例は、109 PFU/mL(プラーク形成単位/mL)ですが、低濃度でも同様の結果が得られます( 材料の表を参照)。ステップ1.2.3に従ってバクテリオファージ濃度を推定します。
- ライセートを調製するには、以下の手順に従ってください。
- 5 mLのLB(10 g / Lトリプトン、5 g / L NaCl、および5 g / L酵母抽出物)で S.enterica 接種物を調製します。.37°C、200rpmで24時間インキュベートします。
- 4 mLのバクテリオファージブロスを1 mLの S.entericaの一晩培養液と混合します。混合物を37°C、200rpmで8時間インキュベートします。
- 細菌とバクテリオファージを区別するには、混合物を2,377 x g で20分間遠心分離します。ガラス管に上清を回収し、800μLのクロロホルム( 材料の表を参照)を加え、ボルテックスします。クロロホルムとの混合物を使用する場合にのみ、上相を移すようにしてください。
注:手順の効率に影響を与える可能性のある残留クロロホルムの移行を防ぐことが重要です。クロロホルムステップは、放出されたファージを最大化する方法として、単離プロトコルと増殖プロトコルの両方で一般的です。しかし、クロロホルムは一部のファージを不活性化したり、その感染力を破壊したりすることがあります15。したがって、このステップはクロロホルムに耐性のあるファージにのみ適用できます。 - ライセートを室温で2時間保持した後、4°Cで保存します。
- ライセートを滴定して、調製したライセート中に存在するバクテリオファージの数/mLあたりのPFU数を定量します。これを行うには、以下で説明するオーバーレイ手法を実行します。
- S. enterica用の接種物5 mLのLBを調製します。200 rpmで振とうして曝気しながら、37°Cで24時間インキュベートします。
- ライセートをLBに段階希釈して、可算数のPFU/mLに到達します。必要な希釈係数を決定するには、濃縮された最初のバクテリオファージライセートを特定します。約109 PFU/mLのバクテリオファージ濃度の代表的な例としては、プラークの数を数える希釈係数は106〜10 10です。
- 適切な希釈液100 μLと前日に調製した S. enterica の一晩培養液60 μLを、液体LBとLB寒天を1:1の割合で混合し、固化を避けるために56°Cに維持して調製したLB軟寒天5 mLに加えます。泡を避けて慎重に混ぜます。
- 各ミックスをLBプレートの上部に注ぎ、培地が固まるまでベンチに置いておきます。
- プレートを37°Cで24時間インキュベートします。 各プレートのプラークの数を数えます。PFU/mL の数を決定するには、各プレートのプラーク数に希釈係数(FD)を掛けます。効率的なファージ感染を確保するには、109-10 12 PFU/mLが必要です。
PFU/mL= いいえ。プレートのプラークxFD
- 100 mLの栄養ブロス(NB;5 g/Lペプトンおよび3 g/L酵母抽出物)、2 mLの50x E塩(38.78 mM MgSO47 H2O、520.5 mMクエン酸H2O、2.87 M K2HPO4 無水および829 mM NaNH4HPO44 H2O)および0.4 mLの50%の混合物に0.1 mLの濃縮バクテリオファージ溶解物を加えて、バクテリオファージブロスを調製します。グルコース。反転させてよく混ぜます。
- サルモネラ菌培養物のバクテリオファージによる感染
- S. entericaの一晩培養物を最終容量の5 mLのLBで1:100に希釈し、0.1 mLのライセート(10 9-1012 PFU / mLで濃縮)を加えます。37°C、200rpmで24時間インキュベートします。
- プレートアッセイにおけるPFUとしてのファージ力価の測定
- 感染した培養物中のバクテリオファージの数を定量するには、以下に説明するようにプレートアッセイを実施して、ファージ力価をPFU/mLとして決定します。
- 培養物1mLをチューブに移します。17,115 x g で2分間遠心分離し、上清を新しい標識バイアルに注ぎます。
- 100 μLのクロロホルムをバイアルとボルテックスに加えて、溶液から細菌の破片を取り除きます。ステップ 1.2.3 に従います。
- 感染した培養物中のバクテリオファージの数を定量するには、以下に説明するようにプレートアッセイを実施して、ファージ力価をPFU/mLとして決定します。
2.感染したサルモネラ菌培養物からのバクテリオファージの除去(図2を参照)
注:バクテリオファージの除去プロセスを監視するために、滴定のために洗浄プロトコル全体で異なるアリコートが採取されます。PFU/mL の数が洗浄プロセス全体を通じて減少し、完全に排除されるまで確認するための 8 つのアリコートがあります。
- 懸濁液中のバクテリオファージの除去
- ファージを含む細菌培養物を、50 mLのコニカル遠心チューブで0.22 μmろ過LBの5 mLで1:100に希釈します。滴定ポイント1:これは滴定(感染 したサルモネラ 菌培養の開始)の最初のアリコートです。
- 懸濁液を2,377 x gで10分間遠心分離します。上清を慎重に取り除きます。ピペットは使用しないでください。チューブを注ぎます。細胞の存在を確保するために、円錐形の遠心分離管の底にいくらかの体積を残すようにしてください。
- 0.22 μmろ過したLB培地10 mLで細菌細胞を洗浄します。遠心分離と洗浄のステップを3回繰り返します。ペレットを0.22 μmろ過LBの5 mLに再懸濁します。滴定ポイント2:これは滴定の2番目のアリコートです。
- 上記の細菌懸濁液50μLを、真空ろ過システムを使用して滅菌済みの0.45μmフィルター( 材料表を参照)に転写します。0.22 μmろ過LB100 mLでフィルターをすすぎます。
注:バクテリオファージ9NAのヘッドサイズは0.067μmです。対照的に、 サルモネラ 菌は長さ2〜5μm、幅0.5〜1.5μmです。したがって、0.45μmのメンブレンを使用すると、ほとんどの細菌は0.45μmより大きいため通過しませんが、ほとんどのファージは0.45μmのフィルター孔を通過します。
- サルモネラ菌の細胞内に含まれるバクテリオファージの除去
- 細菌細胞からのファージ放出を促進するために、細胞を含む0.45 μmフィルターをインキュベーター内で37°Cで2時間インキュベートします。
注:インキュベーションのこのステップは、感染した細菌の溶解とフィルターへの細胞内ファージの放出を促進するために必要です。 - 0.45 μmフィルターを真空ろ過システムを使用して洗浄し、0.22 μmフィルターLB100 mLでフィルターをすすぎます。
- 2 mLの2x LB(20 g/Lトリプトン、10 g/L NaCl、10 g/L酵母抽出物; 材料の表を参照)でフィルターから細菌細胞を回収します。これを行うには、滅菌鉗子を使用して0.45μmフィルターをフラスコに移します。次に、2 mLの2x LBをフィルターとピペットで数回加えて、フィルターから細胞を放出します。
- この懸濁液1 mLを10,354 x gで2分間遠心分離します。上清を捨て、ろ過したLB培地1mLで細菌細胞を3回洗浄します。1 mLの2x LBに細胞を再懸濁します。滴定ポイント3:これは滴定用の3番目のアリコートです。
注:以下で説明するように、市販のリポ多糖(LPS)が追加され、このLPSが水に溶解して培地が希釈されるため、より濃縮されたLB(2x LB)の使用を強くお勧めします。
- 細菌細胞からのファージ放出を促進するために、細胞を含む0.45 μmフィルターをインキュベーター内で37°Cで2時間インキュベートします。
- 以下に説明するように、市販のリポ多糖類で細菌細胞から放出されたバクテリオファージを欺くことにより、再感染を避けてください。.
- 市販の S. enterica リポ多糖類(LPS; 材料表を参照)の存在下で、20 μLの細菌懸濁液をインキュベートし、最終濃度3.75 mg/mLまで、0.22 μmろ過LB1 mL中、200 rpmで振とうしながら37°Cで2時間インキュベートします。
注:細胞から培地に放出されたファージは、細菌性LPSの代わりに市販の S.enterica LPSに結合する可能性があります。 - 2時間のインキュベーション後、1 mLの培養物をマイクロ遠心チューブに移し、懸濁液を10,354 x gで2分間遠心分離します 。 滴定ポイント4:上清を滴定の4番目のアリコートとして使用します。
- ペレットを1 mLのろ過済みLB培地で3回洗浄します。
- 洗浄後、ペレットを1 mLの2x LBに再懸濁し、この混合物20 μLを0.22 μmろ過LB1 mLにインキュベートし、市販のLPS0.8 mg/mLを200 rpmで振とうしながら37°Cで2時間インキュベートします。滴定ポイント5:残りの細菌懸濁液を5回目の滴定に使用します。
- 2時間のインキュベーション後、1 mLの培養物を微量遠心チューブに移し、10,354 x gで2分間遠心分離してペレット化します。滴定ポイント6:上清を新しいバイアルに注ぐことにより、上清を滴定の6番目のアリコートとして使用します。
- 細菌細胞をろ過したLBで3回洗浄します。洗浄後、採取した細胞を0.22 μmろ過LB1 mLに再懸濁します。
- 真空ろ過システムを使用して、1 mLの細菌懸濁液を滅菌0.45 μmフィルターに通します。0.22 μmフィルターLB100 mLを使用してフィルターをすすぎます。
- 0.45 μmフィルターから2 mLの2x LB培地で細胞を回収します。そのためには、滅菌鉗子を使用して0.45μmフィルターをフラスコに移します。次に、2 mLの2x LBをフィルターとピペットで数回加えて、フィルターから細胞を放出してみます。
- 1 mLの細胞を10,354 x gで2分間遠心分離してペレット化します。0.22 μmフィルターLBで3回洗浄します。洗浄後、収集した細胞を1 mLの2x LBに再懸濁します。 滴定ポイント7:これは滴定用の7番目のアリコートです。このアリコートは、細菌培養におけるファージの除去の効率について通知します。
- 市販の S. enterica リポ多糖類(LPS; 材料表を参照)の存在下で、20 μLの細菌懸濁液をインキュベートし、最終濃度3.75 mg/mLまで、0.22 μmろ過LB1 mL中、200 rpmで振とうしながら37°Cで2時間インキュベートします。
3. バクテリオファージ除去後のバクテリオファージフリー サルモネラ 菌培養液の調製
- ファージフリー接種物を調製します。細菌懸濁液から100 μLの細胞を、0.45 mg/mL LPSを含む900 μLのLBに加えます。200 rpmで振とうしながら、37°Cで24時間インキュベートします。
- 滴定ポイント8:滴定用の8番目のアリコートを準備します(最終的な潜在的な非感染培養)。この点は、ファージの再感染がないことを確認するためのものです。
結果
サルモネラ・エンテリカや他のグラム陰性菌は、LPSを含む外膜を持っています。LPSのO抗原は、バクテリオファージ9NAがサルモネラ菌培養物16,17に感染するために一般的に使用される受容体である。
LPSのO抗原またはコア多糖領域に対するバクテリオファージの特異的な親和性を考慮して、 Salmonella enterica の市販LPSを9NAバクテリオファージを排除するためのおとりとして使用できるかどうかを調べたいと考えました。そのために、市販のLPSと9NAライセートの既知の濃度を混合し、続いて滴定を行いました。市販のLPSバクテリオファージと9NAバクテリオファージを総容量200 μLで混合し、振とうせずに37°Cで2時間インキュベートしました。滴定では、LPS-9NA混合物100 μLと一晩培養液60 μLを5 mLのLB軟質寒天培地に加え、LBプレートの上部に注ぎました。プレートを37°Cで24時間インキュベートしました。 図3に示すように、 S. enterica commercial LPSの濃度が増加すると、ライセート力価は比例して減少します。これらの結果は、市販のLPSが9NAバクテリオファージのおとりとして正しく機能することを示しています。
興味深いことに、ファージ9NAが サルモネラ 細胞を溶解し、ファージを放出するのに必要な時間は、細菌とファージの数によって促進されます(図4)。この側面がファージ除去プロトコルにどのように影響するかを研究するために、さまざまな細菌、つまりファージ比(1:1、1:10、1:100、および1:1000)をテストしました。 図4に見られるように、9NAファージの添加後1.5〜2.5時間で培養物のOD600nm が低下します。OD600 nm の値がゼロに近い場合は、細菌培養物が溶解されていることを示しています18。このため、このプロトコルでは、 サルモネラ 細胞内に含まれるファージが細菌を溶解して放出するのに十分な時間を確保するために、インキュベーション時間を2時間と定義しました。この時間は、このプロトコルを実行する前に、各ホストファージシステムについて推定する必要があります。
市販のLPSがおとりとして機能し、9NA感染細菌の溶解時間が有効であると判断した後、バクテリオファージの感染 サルモネラ 菌培養物を洗浄するために説明したプロトコルを実行しました(図1 および 図2)。プロトコールの各ステップに沿ってバクテリオファージの存在をモニターするために、プラークアッセイを行い、得られた混合物の100μLで得られた培養物の感染性を異なるポイントで計算しました(図5)。洗浄とろ過を繰り返すだけでは、培養物からのバクテリオファージの除去には不十分であることがわかります(滴定ポイント1〜3)。しかし、市販のLPSとのインキュベーションのステップを採用するとすぐにファージの数は減少します(滴定ポイント4)。細菌培養物中のバクテリオファージを完全に除去するための重要なステップは、市販のLPSとの2回目のインキュベーションです(滴定ポイント6)。このステップは、 サルモネラ 菌培養における9NAバクテリオファージの除去を成功させるために不可欠です。
このプロトコルの興味深い側面は、ファージ除去ステップ後のファージ耐性のレベルを知ることです。ファージをファージ耐性菌から分離する手順には有用性がありません。このため、培養物に残っている細菌がファージの影響を受けやすいことを明らかにすることが重要です。処置後も感受性ファージ細胞が培養物に残ることを実証するために、我々はEvans Blue Uranine(EBU)プレートアッセイを用いてファージ汚染をスクリーニングした19。EBU プレートは、10 mL/L K2HPO4 25%、5 mL/L グルコース 50%、2.5 mL/L フルオレセイン 1%、1.25 mL/L エバンス ブルー 1%、および 15 g/L 寒天を添加した LB 培地で作成しました。9NAファージを用いたEBUプレート上でのクロスストリーキングは、ファージ耐性分離株とファージ感受性分離株を区別するために使用されました(図6)。洗浄プロトコルの最後に得られた細菌培養物を使用して単離されたコロニーを取得し、ファージの汚染をチェックしました(図6B)。私たちは、抵抗細胞と感受性細胞の両方の存在を観察することができます。このプロトコルは、ファージ耐性細胞の選択を支持しません。バクテリオファージを排除するだけです。
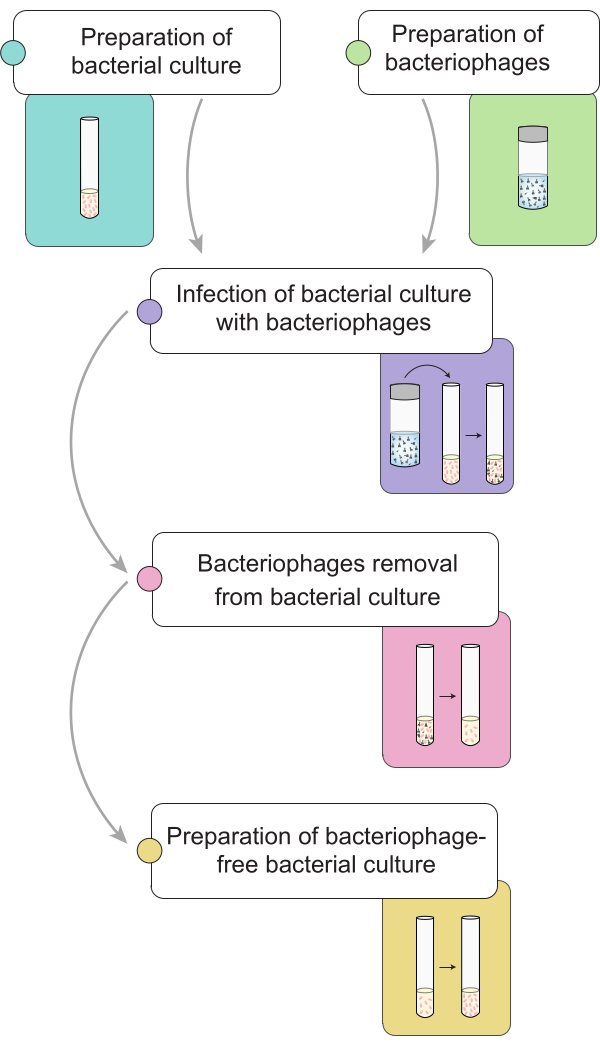
図1: サルモネラ 菌培養におけるバクテリオファージの除去手順の簡単な概要。 ワークフローは、細菌培養物と溶解物の調製、バクテリオファージによる細菌培養物の感染、感染した細菌培養物からのバクテリオファージの除去、ファージフリー細菌接種の調製など、さまざまな段階に分かれています。 この図の拡大版を表示するには、ここをクリックしてください。
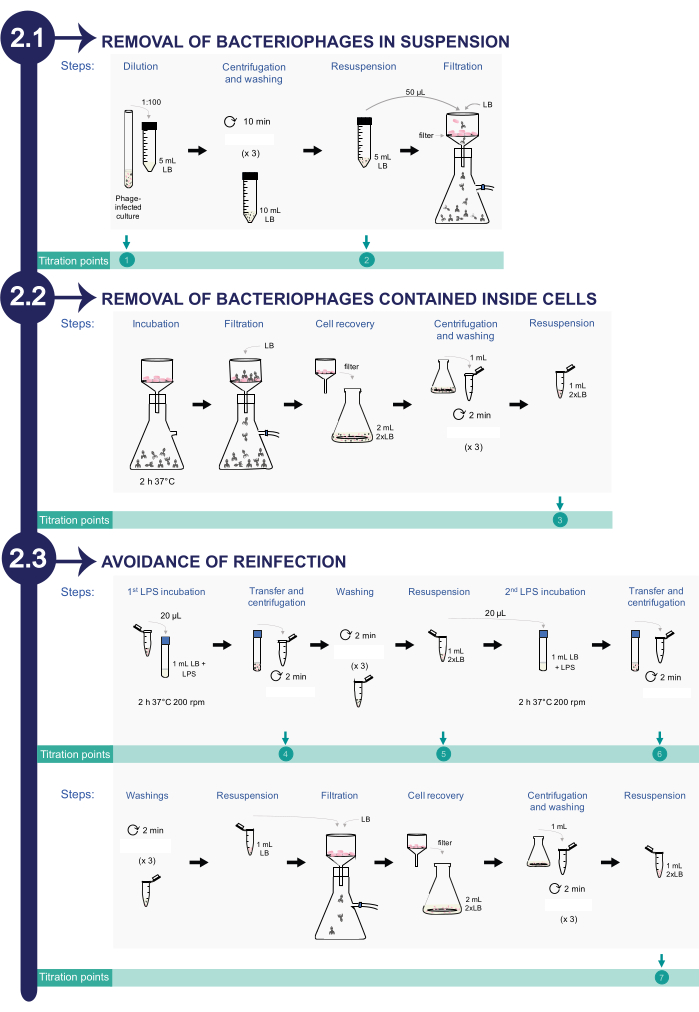
図2:感染した サルモネラ菌からバクテリオファージを除去する手順をica培養物に取り込む。 このプロセスは、1)懸濁液中のバクテリオファージの除去、2)細菌細胞内に含まれるファージの除去、3)再感染の回避の3つのフェーズで構成されています。 この図の拡大版を表示するには、ここをクリックしてください。
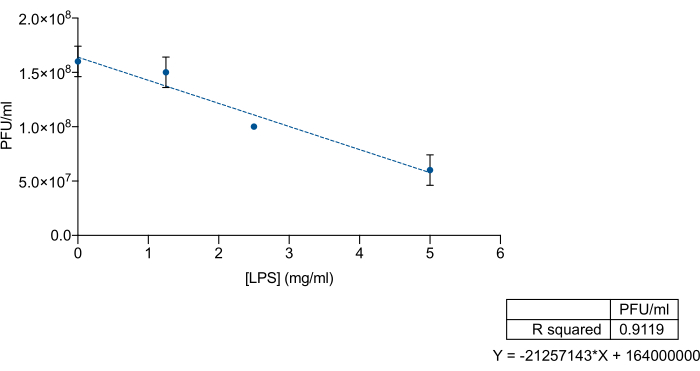
図3:バクテリオファージに結合するSalmonella entericaの商用LPSの効率を測定するためのLPS-デコイアッセイ。Salmonella enterica commercial LPSの濃度を上げる中での9NAライセート(PFU/mL)の滴定。実験は3回に分けて行いました。平均と標準偏差が表示されます。この図の拡大版を表示するには、ここをクリックしてください。
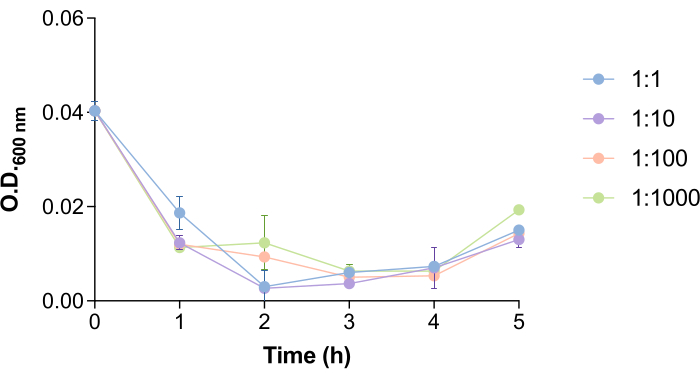
図4: サルモネラ 菌培養におけるバクテリオファージ9NA溶解時間。 バクテリア:ファージ比が1:1、1:10、1:100、および1:100のバクテリオファージ9NAの存在下での サルモネラエンテリカ 培養物の成長曲線。実験は3回に分けて行いました。平均と標準偏差が表示されます。 この図の拡大版を表示するには、ここをクリックしてください。
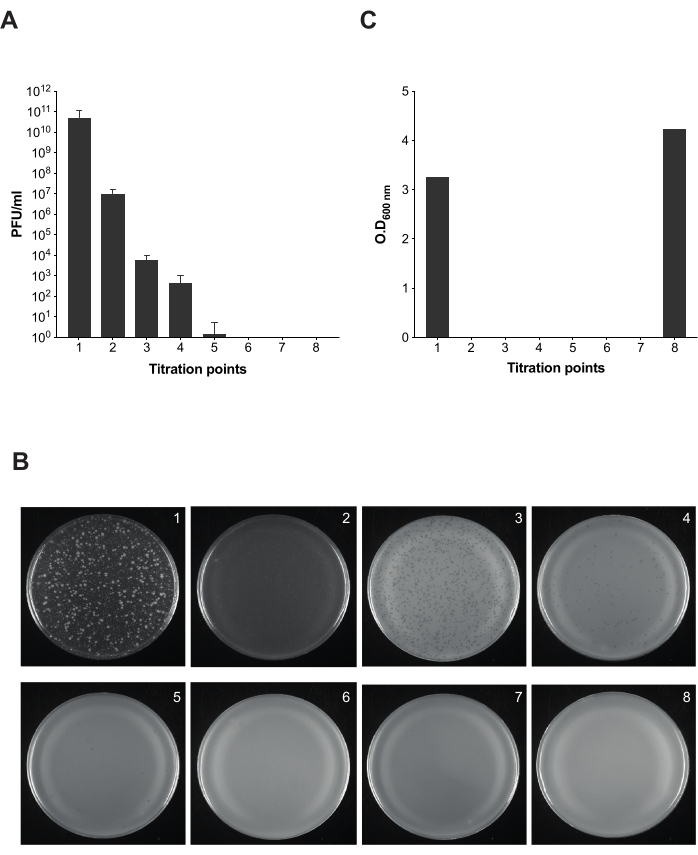
図5: サルモネラ 菌培養におけるバクテリオファージ除去中の感染性試験のためのプラークアッセイ。 (A)8アリコートの滴定は、プロトコルの異なるポイントで行われました(滴定ポイント1〜7は 図2にマークされています)。この実験では、 サルモネラ菌 enterica serovar Typhimurium 株 ATCC 14028 opvAB::lacZ (SV8011) とバクテリオファージ 9NA を使用しました。実験は3回に分けて行い、平均偏差と標準偏差を示します。(B) Salmonella enterica を含む軟質寒天プレートは、8つの滴定ポイントからのアリコートを使用したオーバーレイ技術に従って得られました。プレートは左から右に、滴定ポイント1〜8に対応します。(C)ファージ除去プロトコルの異なる時間における細菌培養物の600nmでの光学密度。 この図の拡大版を表示するには、ここをクリックしてください。
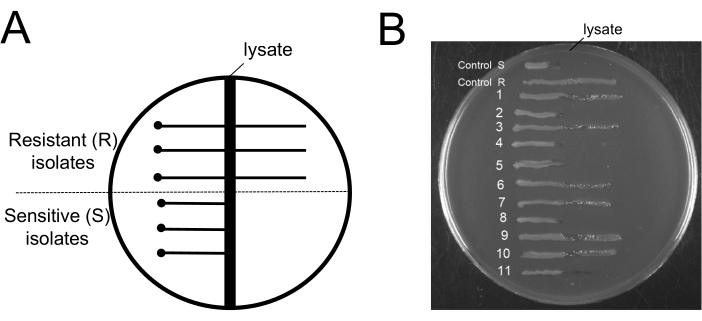
図6:バクテリオファージ除去手順後のファージ耐性菌の試験 (A) クロスストリーク寒天アッセイに使用された典型的なEBU寒天プレートの概略図:中央の垂直の暗い領域は9NAライセートのゾーンを表しています。点は、試験した細胞がライセートゾーンから安全な距離で接種される場所を表し、横の実線は、ライセートゾーン全体で増殖しているファージ耐性細胞、またはライセートゾーンを超えて増殖していないファージ感受性細胞のいずれかを表しています。 (B) 11コロニーを試験するためのEBUプレートアッセイを、除去プロトコルの終了時に取得しました。コントロールRおよびSは、それぞれファージ抵抗性分離株およびファージ感受性分離株の例です。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
バクテリオファージは、細菌の宿主を認識して感染させるために、さまざまな戦略を採用しています。細菌の表面上のさまざまな分子構造がファージ受容体として機能する可能性があります:タンパク質、多糖類、リポ多糖(LPS)、および炭水化物部分20。グラム陰性菌では、LPSはファージの一般的な受容体です。さらに、他の受容体は、外膜タンパク質、線毛、およびべん毛21である。
LPS8 の認識に基づくバクテリオファージと細菌との間の特異的な相互作用は、この研究で、感染した細菌培養物中のバクテリオファージを排除するための非常に効率的なプロトコルの開発に利用されています(図1 および 図2)。私たちのプロトコルは、ファージ耐性細胞の選択を支持しません。バクテリオファージのみを排除します(図6)。ファージ感受性細胞とファージ抵抗性細胞の両方が、このファージ除去のプロトコルを実行した後も細菌培養に残ります。
ファージ感染が発生した場合の伝統的な標準的な方法は、すべての汚染された物質を排除しようと試み、続いて洗浄と滅菌を行うことである22。除染手順では、細菌細胞を部分的または完全に除去するために、細菌培養物を高温などのストレスの多い条件にさらします。代表的な結果に記載されているように、このプロトコルの重要なステップは、ファージに感染した細菌培養物を市販のLPS(細菌培養物にとって無害な物質)とインキュベートすることです。これは、細菌培養物の生存率を維持するのに役立ち、発酵槽やバイオリアクターの産業用途に大きな利点をもたらします。
このプロトコルのインキュベーション時間は、細菌細胞のファージ溶解に十分な時間を確保するために2時間です。異なる細菌株とバクテリオファージを使用する場合は、このパラメーターをユーザーが考慮し、定義する必要があります。この場合、 図4 に記載されているものと同様のアッセイを実験の前に実行する必要があります。
興味深いことに、この洗浄プロトコルの有効性は、特定のサンプルのファージ含有量をモニターするアッセイを採用することによっても分析できます。この意味で、エピジェネティックバイオセンサーはバクテリオファージ検出のための新しいツールである23。LPSを受容体として使用するコリファジを検出できるよく知られたファージバイオセンサーは、opvAB::gfpシステム13,18,23,24です。このファージバイオセンサーは、O-抗原を受容体として使用するファージの存在下でOpvABON亜集団の増加を検出します。この意味で、opvAB::gfp融合を使用して、このプロトコルのさまざまなステップおよび/または多様な培地および条件でLPS結合ファージをモニターできます。これらのアプローチは、効果的なプロトコルが必要になる可能性のあるタイミングと場所を決定する上で価値がある可能性があります。
LPSの認識は一般的ですが、ファージは細菌細胞上の他のさまざまな表面受容体を付着や感染に利用することもできます。ここでは、代表的な腸内細菌としてグラム陰性 サルモネラ菌 を、LPSを受容体・ゲノム駆出トリガーとして用いるバクテリオファージ9NAを用いています。他の腸内細菌ファージ( 例えば、大腸菌 T5)はLPSに緩やかに結合し、ゲノム注入のために外膜タンパク質を必要とします。記載されているプロトコルは、9NA、Det7、P2213、25、26、27など、感染を成功させるためにLPSのO抗原を認識し、必要とするバクテリオファージに適用できます。したがって、細菌培養物のファージ除染のためのこのプロトコルを成功裏に実施するには、ファージ感染源が宿主のLPSを認識する必要があるかどうかを判断する必要があります。
結論として、プロトコルの潜在的な制限にもかかわらず、私たちの代表的な結果は、この方法が、LPSを受容体およびゲノム駆出トリガーとして使用するバクテリオファージの細菌 サルモネラ 菌培養物を洗浄するための強力なツールであることを明確に示しています。
開示事項
著者は何も開示していません。
謝辞
Carmen R. Beuzón博士とRocío Carvajal-Holguera氏には、有益な議論と提案をいただき、ありがとうございました。この研究は、MICIU/AEI/ 10.13039/5011100011033 が資金提供した助成金 PID2020-116995RB-I00 と、セビリア大学の VI Plan Propio de Investigación y Transferencia によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 20 mL syringe | BD Discardit II | 300296 | No special requirements |
| 50 mL conical tubes | Avantor | 525-0610 | No special requirements |
| 90 x 14 mm Petri dishes | Deltalab | 200209 | No special requirements |
| Agar | Sigma-Aldrich | A1296 | No special requirements |
| Bacteriophage lysate | Minimal concentration: 109 PFU/mL | ||
| Centrifuge | Eppendorf | No special requirements | |
| Chloroform | Panreac | 131252 | No special requirements |
| Citric acid · H2O | Merck | 1.00247 | |
| Colony counter | No special requirements | ||
| Evans Blue | Sigma-Aldrich | E-2129 | |
| Flasks | No special requirements | ||
| Fluorescein sodium salt | Sigma-Aldrich | F-6377 | |
| Forceps | No special requirements | ||
| Glass tubes | No special requirements | ||
| Glass tubes for lysate | No special requirements | ||
| Glucose | Sigma-Aldrich | G7021 | |
| K2HPO4 | Merck | 1.05104.1000 | |
| K2HPO4 anhydrous | Merck | 1.05104 | |
| Lipopolysaccharide from Salmonella enterica serotype Typhimurium | Sigma-Aldrich | L6511-25 mg | Dissolved in sterile water |
| Membrane 0.45 µm | MF-Millipore | HAWP02500 | No special requirements |
| MgSO4 · 7 H2O | Merck | 1.05886 | |
| NaCl | Sigma-Aldrich | S9888 | No special requirements |
| NaNH4HPO4 · 4 H2O | Sigma-Aldrich | S9506 | |
| Peptone | iNtRON | Ba2001 | No special requirements |
| Syringe Filter 0.22 µm | Millex | SLGSR33SB | No special requirements |
| Toothpicks | No special requirements | ||
| Tryptone | Panreac | 403682.1210 | No special requirements |
| Vacuum pump | Thermo Scientific | No special requirements | |
| Yeast extract | iNtRON | 48045 | No special requirements |
参考文献
- Kasman, L. M., Porter, L. D. . Bacteriophages. , (2024).
- Lawrence, D., Baldridge, M. T., Handley, S. A. Phages and human health: More than idle hitchhikers. Viruses. 11 (7), 587 (2019).
- Beller, L., Matthijnssens, J. What is (not) known about the dynamics of the human gut virome in health and disease. Curr Opin Virol. 37, 52-57 (2019).
- Roux, S., Hallam, S. J., Woyke, T., Sullivan, M. B. Viral dark matter and virus-host interactions resolved from publicly available microbial genomes. eLife. 4, 08490 (2015).
- Wommack, K. E., Colwell, R. R. Virioplankton: Viruses in aquatic ecosystems. Microbiol Mol Biol Rev. 64 (1), 69-114 (2000).
- Louten, J. Virus structure and classification. Essentl Human Virol. , 19-29 (2016).
- Egido, J. E., Costa, A. R., Aparicio-Maldonado, C., Haas, P. J., Brouns, S. J. J. Mechanisms and clinical importance of bacteriophage resistance. FEMS Microbiol Rev. 46 (1), 048 (2022).
- Rakhuba, D. V., Kolomiets, E. I., Dey, E. S., Novik, G. I. Bacteriophage receptors, mechanisms of phage adsorption and penetration into host cell. Polish J Microbiol. 59 (3), 145-155 (2010).
- Lindberg, A. A. Bacteriophage receptors. Ann Rev Microbiol. 27 (1), 205-241 (1973).
- Koskella, B., Meaden, S. Understanding bacteriophage specificity in natural microbial communities. Viruses. 5 (3), 806-823 (2013).
- Marcó, M. B., Moineau, S., Quiberoni, A. Bacteriophages and dairy fermentations. Bacteriophage. 2 (3), 149-158 (2012).
- Fernández-Fernández, R., et al. Evolution of a bistable genetic system in fluctuating and non-fluctuating environments. bioRxiv. , (2024).
- Cota, I., Blanc-Potard, A. B., Casadesús, J. STM2209-STM2208 (opvAB): a phase variation locus of Salmonella enterica involved in control of O-antigen chain length. PloS one. 7 (5), e36863 (2012).
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. Enumeration of bacteriophages by double agar overlay plaque assay. Methods Mol Biol. 501, 69-76 (2009).
- Ackermann, H. W. Tailed bacteriophages: The order Caudovirales. Adv Virus Res. 51, 135-201 (1998).
- Wilkinson, R. G., Gemski, P., Stocker, B. A. D. Non-smooth mutants of Salmonella typhimurium: Differentiation by phage sensitivity and genetic mapping. J Gen Microbiol. 70 (3), 527-554 (1972).
- Casjens, S. R., Leavitt, J. C., Hatfull, G. F., Hendrix, R. W. Genome sequence of Salmonella Phage 9NA. Genome Announc. 2 (4), e00531 (2014).
- Cota, I., et al. Epigenetic control of Salmonella enterica O-antigen chain length: A tradeoff between virulence and bacteriophage resistance. PLoS Genet. 11 (11), e1005667 (2015).
- Chan, K., Botstein, D., Watanabe, T., Ogata, Y. Specialized transduction of tetracycline resistance by phage P22 in Salmonella typhimurium. Virology. 50, 883-898 (1972).
- Bertozzi Silva, J., Storms, Z., Sauvageau, D. Host receptors for bacteriophage adsorption. FEMS Microbiol Lett. 363 (4), 002 (2016).
- Sørensen, M. C. H., et al. Bacteriophage F336 recognizes the capsular phosphoramidate modification of Campylobacter jejuni NCTC11168. J Bacteriol. 193 (23), 6742-6749 (2011).
- Ogata, S., Hongo, M. Bacteriophages of the Genus Clostridium. Adv Appl Microbiol. 25, 241-273 (1979).
- Olivenza, D. R., Casadesús, J., Ansaldi, M. Epigenetic biosensors for bacteriophage detection and phage receptor discrimination. Environ Microbiol. 22 (8), 3126-3142 (2020).
- Olivenza, D. R., et al. A portable epigenetic switch for bistable gene expression in bacteria. Sci Rep. 9 (1), 862 (2019).
- Walter, M., et al. Structure of the receptor-binding protein of bacteriophage Det7: a Podoviral tail spike in a Myovirus. J Virol. 82 (5), 2265-2273 (2008).
- Davies, M. R., Broadbent, S. E., Harris, S. R., Thomson, N. R., vander Woude, M. W. Horizontally acquired Glycosyltransferase operons drive Salmonellae lipopolysaccharide diversity. PLoS Genet. 9 (6), e1003568 (2013).
- Wahl, A., Battesti, A., Ansaldi, M. Prophages in Salmonella enterica: a driving force in reshaping the genome and physiology of their bacterial host. Mol Microbiol. 111 (2), 303-316 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved