Method Article
Enfekte Salmonella Kültürlerinden Bakteriyofaj Giderimi
Bu Makalede
Özet
Yeryüzünde her yerde bulunan ve çeşitli olan bakteriyofajlar, bakteri konakçıları içinde enfekte eder ve çoğalır, mikrobiyal ekosistemlerde çok önemli bir rol oynar. Önemlerine rağmen, varlıkları endüstriyel süreçleri bozabilir. Salmonella kültürlerinden bakteriyofajları ortadan kaldırmak için bakteriyel lipopolisakkaritleri kullanan bir yöntem geliştirdik.
Özet
Bakteriyofajlar veya basitçe fajlar, mikrobiyal ortamlarda hayati bir rol oynar, bakteri popülasyonlarını etkiler ve evrimlerini ve etkileşimlerini şekillendirir. Bu organizmalar, bakteri konakçılarını enfekte eden ve içinde çoğalan virüslerdir. Fajlar Dünya'da her yerde bulunur, çok çeşitlidir ve çok bol miktarda bulunur. Bakteriyofajlar farklı ortamlarda değerli rollere sahip olsalar ve mikrobiyoloji ve ekolojide önemli bir araştırma alanı olsalar da, bazı endüstriyel işlemlerde veya ürünlerde varlıkları istenmeyen bir durum olabilir. Dünyadaki bakteriyofajların bolluğu ve yaygınlığı göz önüne alındığında, bakteriyofajların bakteri kültürlerinden uzaklaştırılmasına yönelik prosedürlerin tasarımı, kültürlerin bütünlüğünü korumak ve doğru deneysel sonuçları veya ürün kalitesini sağlamak için çeşitli laboratuvar ve endüstriyel uygulamalarda çok önemlidir. Burada, Gram negatif bakterilerin dış zarında bulunan lipopolisakkaritlerin (LPS) kullanımına dayanan bir strateji kullanarak, enfekte Salmonella enterica kültürlerinden bakteriyofajları ortadan kaldırmak için bir protokol geliştirdik. Bakteriyel LPS, fajlar tarafından konak tanımada önemli bir rol oynar ve bu özelliği, Salmonella bakteri kültürlerinde LPS'yi reseptör olarak kullanan fajların uzaklaştırılması için etkili bir prosedür tasarlamak için kullanıyoruz.
Giriş
Mikrobiyal popülasyonlar, doğal ortamlarda birçok zorlukla karşı karşıyadır ve özellikle ciddi bir tehdit, bakterileri enfekte eden virüsler olan bakteriyofajların neden olduğu enfeksiyon potansiyelidir1. Bu virüsler gezegende yaygındır, büyük çeşitlilik ve bolluk sergiler 2,3,4,5. Bakteriyofajlar boyut, morfoloji ve genomik organizasyon açısından farklı olsalar da, hepsi aynı yapıyı paylaşır: faj kodlu proteinler tarafından oluşturulan bir kapsid tarafından sarılmış bir DNA veya RNA genomu6. Bakteriler kendilerine karşı çok çeşitli savunma mekanizmaları geliştirmiştir7. Bakteriyofaj enfeksiyonunun, hem karakterizasyon hem de tespit için ilgili olan önemli bir yönü, kuyruk liflerinde bulunan reseptör bağlanma alanlarıdır. Bakteriyofajların yüzeylerinde, bakteri hücresinin yüzeyindeki spesifik reseptör bölgelerini tanımak ve bunlara bağlanmak için reseptör bağlayıcı proteinler veya kuyruk lifleri adı verilen proteinler bulunur. Gram-negatif bakteriler söz konusu olduğunda, lipopolisakkaritler (LPS), dış zar proteinleri, pilus ve/veya flagella gibi yüzey yapılarının tanınması faj-bakteri etkileşiminde rol oynar8. Bakteriyofajlar ve bakteriler arasındaki bu etkileşim oldukça spesifiktir ve esas olarak konakçı yüzeylere yapışma yeteneklerine bağlıdır. Lipopolisakkaritin O-antijeni yaygın olarak kullanılan bir reseptördür9.
Bakteriyofaj-bakteri etkileşimlerinin araştırılması sadece biyolojik açıdan büyüleyici olmakla kalmaz, aynı zamanda faj tedavisi ve biyoteknoloji gibi alanlarda da pratik uygulamalara sahiptir. Bakteriyofajlar, örneğin mikrobiyal popülasyonları10 değiştirmek gibi çeşitli bağlamlarda değerli rollere sahip olsa da, bazı endüstriyel süreçlerde varlıkları istenmeyen bir durum olabilir. İlaç, biyoteknoloji ve gıda üretiminde, bakteriyofajların varlığı nihai ürünlerin kalitesini ve güvenliğini etkileyebilir ve bu da kalite standartlarını karşılamak için bunların uzaklaştırılmasını gerekli kılar. Bakteri kültürlerinin çeşitli bileşikler (örneğin proteinler, enzimler veya antibiyotikler) üretmek için kullanıldığı biyoproses ve biyoüretimde, bakteriyofajların varlığı, her paylaşılan ortamda bakteri popülasyonunu dengeleme yetenekleri nedeniyle üretim süreçlerinin bozulmasına yol açabilir. Fajlar zaman zaman endüstriyel mikrobiyoloğun profesyonel hayatını bir kabusa çevirebilir11. Fajları uzaklaştırmak için etkili prosedürlerin tasarımı, tutarlı ve güvenilir üretim sağlamak ve proses verimliliğini artırmak için kritik öneme sahiptir. Bu endüstriyel yönlerin yanı sıra, hassasiyet ve tekrarlanabilirliğin çok önemli olduğu bir araştırma laboratuvarı ortamında, doğru ve güvenilir sonuçlar elde etmek için bakteriyofajların ortadan kaldırılması esastır. Ayrıca, fajların uzaklaştırılması, farklı hipotezleri test etmek için çeşitli ortamları simüle etmek için de kullanılabilir12. Fajların çıkarılması da araştırma ortamında çok yararlı olabilir, çünkü faj uygulamasını takiben bakterilerin sayımı gibi birçok faj bazlı çalışma, çok daha güvenilir canlı sayımlar üretmek için fajları çıkarmak için bir adımdan faydalanacaktır.
Koloni izolasyonuna dayalı faj çıkarma, kolonilerin fajsız olmasını sağlamak için birkaç gün sürerken, burada açıklanan prosedür saatler içinde fajsız kültürlerin oluşturulmasına izin verir. Bu protokol, bakteri kültürlerinin evrimini, kolonileri izole etmelerini engellemeden takip etmemize izin verir. Bu anlamda, farklı hipotezleri test etmek için dalgalı ortamları (fajların varlığı ve/veya yokluğu) simüle etmek mümkündür. Ayrıca, bu protokol bir bakteri kültüründeki fajların varlığının kalitatif ve kantitatif analizine izin verir.
Özetle, bakteriyofajların uzaklaştırılması için uygun maliyetli prosedürler tasarlamak, çeşitli endüstrilerde ürün kalitesini, güvenliğini ve proses verimliliğini korumak ve temel ve uygulamalı araştırmalardaki ilerlemeler için çok önemlidir. Burada, LPS'yi reseptör olarak kullanan bakteriyofajların enfekte Salmonella kültürlerinden uzaklaştırılması için LPS kullanımına dayanan, hem zaman açısından verimli hem de minimum ekipman gerektiren oldukça etkili bir protokol açıklıyoruz.
Protokol
NOT: Fajların eliminasyon prosedürünü gerçekleştirmeden önce, 9NA bakteriyofajları ile enfekte olmuş bir Salmonella kültürünün hazırlanmasını tarif ediyoruz. Şekil 1'de, bakteri kültürlerinde bakteriyofaj giderimi için tam prosedürün genel bir temsili gösterilmektedir.
1. Bakteriyofajlarla enfekte olmuş Salmonella kültürlerinin hazırlanması
- Bakteri kültürü hazırlama
NOT: Bu çalışmada Salmonella enterica subsp. enterica serovar Typhimurium suşu ATCC 14028 opvAB::lacZ (SV8011)13 kullanılmıştır.- -80 ° C'den alınan ve ilgilenilen S. enterica suşunu içeren şişeyi buz üzerine koyarak yavaşça çözdürün.
- Çözülmüş dimetil sülfoksit stoğundan S. enterica suşunu bir Lennox suyu (LB) plakasına (10 g/L tripton, 5 g/L NaCl, 5 g/L maya özütü ve 15 g/L agar, bkz . Plakayı 37 °C'de 24 saat inkübe edin.
- Bir aşılama iğnesi kullanarak, S. enterica plakasından bir koloniyi aktarın ve bir cam tüpte 5 mL sıvı LB'ye aşılayın. 37 °C'de 24 saat inkübe edin ve 200 rpm'de çalkalayarak havalandırın.
- Bakteriyofaj hazırlama
NOT: Bu protokolde Siphoviridae (Caudovirales takımı)14 familyasına ait bakteriyofaj 9NA kullanılmıştır. Özellikle, lipopolisakkaritin O-antijenini bir reseptör olarak kullanan diğer Salmonella enterica bakteriyofajları kullanılabilir.- 100 mL besin suyu (NB; 5 g/L pepton ve 3 g/L maya özütü), 2 mL 50x E tuzu (38.78 mM MgSO47 H2O, 520.5 mM Sitrik asit H2O, 2.87 M K2HPO4 susuz ve 829 mM NaNH4HPO44 H2O) ve 0.4 mL %50 karışımına 0.1 mL konsantre bakteriyofaj lizat ekleyerek bakteriyofaj suyunu hazırlayın glikoz. Ters çevirerek iyice karıştırın.
- Bakteriyofaj konsantrasyonunun temsili bir örneği 109 PFU/mL (Plak Oluşturan Birimler/mL) olabilir, ancak benzer sonuçlarla daha düşük konsantrasyonlar kullanılabilir (bkz. Adım 1.2.3'ü izleyerek bakteriyofaj konsantrasyonunu tahmin edin.
- Aşağıda açıklanan adımları izleyerek lizat hazırlayın.
- S. enterica inokulumunu 5 mL LB (10 g/L tripton, 5 g/L NaCl ve 5 g/L maya özütü) içinde hazırlayın. 37 °C ve 200 rpm'de 24 saat inkübe edin.
- 4 mL bakteriyofaj suyunu 1 mL gece boyunca S. enterica kültürü ile karıştırın. Karışımı 37 °C ve 200 rpm'de 8 saat inkübe edin.
- Bakteriler ve bakteriyofajlar arasında ayrım yapmak için, karışımı 2,377 x g'da 20 dakika boyunca santrifüjleyin. Süpernatanı bir cam tüpte geri kazanın, 800 μL kloroform ekleyin ( Malzeme Tablosuna bakınız) ve girdaplayın. Üst fazı yalnızca kloroform içeren bir karışım kullanıldığında aktardığınızdan emin olun.
NOT: Prosedürün verimliliğini etkileyebilecek kalıntı kloroformun transferini önlemek önemlidir. Kloroform basamağı, salınan fajları maksimize etmenin bir yolu olarak hem izolasyon hem de yayılma protokollerinde yaygındır. Bununla birlikte, kloroform bazı fajları etkisiz hale getirebilir veya enfektiviteleriniyok edebilir 15. Bu nedenle, bu adım sadece kloroforma dirençli fajlar için geçerlidir. - Lizatları oda sıcaklığında 2 saat koruyun ve ardından 4 °C'de saklayın.
- Hazırlanan lizatta bulunan bakteriyofaj sayısını/mL başına PFU sayısını ölçmek için lizatı titre edin. Bunu yapmak için, aşağıda açıklanan kaplama tekniğini uygulayın.
- S. enterica için 5 mL LB aşı hazırlayın. 37 °C'de 24 saat inkübe edin ve 200 rpm'de çalkalayarak havalandırın.
- Sayılabilir bir PFU / mL sayısına ulaşmak için lizatın LB'ye seri seyreltmelerini gerçekleştirin. Gerekli seyreltme faktörlerini belirlemek için, konsantre olan ilk bakteriyofaj lizatını tanımlayın. Yaklaşık 109 PFU/mL'de bakteriyofaj konsantrasyonunun temsili bir örneği için, sayılabilir sayıda plak ile sonuçlanan seyreltme faktörleri 10 6-1010 arasındadır.
- 100 μL uygun lizat seyreltmesi ve 60 μL gece boyunca S. enterica kültürü ekleyin. bir gün önce hazırlanan 5 mL LB yumuşak agar'a, sıvı LB ve LB-agar'ın 1: 1 oranında karıştırılması ve katılaşmayı önlemek için 56 ° C'de tutulmasıyla hazırlanır. Kabarcıklardan kaçınarak dikkatlice karıştırın.
- Her karışımı bir LB tabağının üstüne dökün ve ortam katılaşana kadar tezgahta tutun.
- Plakaları 37 °C'de 24 saat inkübe edin. Her plakadaki plak sayısını sayın. PFU/mL sayısını belirlemek için, her bir plakanın plak sayısını seyreltme faktörü (FD) ile çarpın. Etkili faj enfeksiyonu sağlamak için 109-10 12 PFU/mL gereklidir.
PFU/mL= Hayır. plakadaki plaklar x FD
- 100 mL besin suyu (NB; 5 g/L pepton ve 3 g/L maya özütü), 2 mL 50x E tuzu (38.78 mM MgSO47 H2O, 520.5 mM Sitrik asit H2O, 2.87 M K2HPO4 susuz ve 829 mM NaNH4HPO44 H2O) ve 0.4 mL %50 karışımına 0.1 mL konsantre bakteriyofaj lizat ekleyerek bakteriyofaj suyunu hazırlayın glikoz. Ters çevirerek iyice karıştırın.
- Salmonella kültürlerinin bakteriyofajlarla enfeksiyonu
- Bir gece boyunca seyreltin S. enterica 5 mL LB nihai hacminde 1:100'e kadar ve 0.1 mL lizat ekleyin (10 9-1012 PFU / mL'de konsantre edilmiştir). 37 °C ve 200 rpm'de 24 saat inkübe edin.
- Plaka tahlilinde faj titresinin PFU olarak belirlenmesi
- Enfekte kültürdeki bakteriyofajların sayısını ölçmek için, faj titresini aşağıda açıklandığı gibi PFU/mL olarak belirlemek için plaka testleri yapın.
- Kültürün 1 mL'sini bir tüpe aktarın. 17.115 x g'da 2 dakika santrifüjleyin ve süpernatanı yeni etiketli bir şişeye dökün.
- Çözeltideki bakteri kalıntılarını gidermek için şişeye ve girdaba 100 μL kloroform ekleyin. Adım 1.2.3'ü izleyin.
- Enfekte kültürdeki bakteriyofajların sayısını ölçmek için, faj titresini aşağıda açıklandığı gibi PFU/mL olarak belirlemek için plaka testleri yapın.
2. Enfekte Salmonella enterica kültürlerinden bakteriyofaj giderimi (bkz. Şekil 2)
NOT: Bakteriyofaj giderme işlemini izlemek için, titrasyon için temizleme protokolü boyunca farklı alikotlar alınır. Toplamda, PFU/mL sayısının tamamen ortadan kaldırılana kadar temizleme işlemi boyunca azaldığını doğrulamak için sekiz alikot vardır.
- Süspansiyonda bakteriyofajın uzaklaştırılması
- Faj içeren bakteri kültürünü, 50 mL'lik bir konik santrifüj tüpünde 5 mL 0.22 μm filtrelenmiş LB'de 1:100'e seyreltin. Titrasyon noktası 1: Bu, titrasyon için ilk alikottur (başlangıç enfekte Salmonella kültürü).
- Süspansiyonu 10 dakika boyunca 2,377 x g'da santrifüjleyin. Süpernatanı dikkatlice çıkarın. Pipet kullanmayın; Tüpü dökün. Hücrelerin varlığından emin olmak için konik santrifüj tüpünün altında bir miktar hacim bırakmaya çalışın.
- Bakteri hücrelerini 10 mL 0.22 μm filtrelenmiş LB ortamı ile yıkayın. Santrifüjleme ve yıkama adımlarını 3 kez tekrarlayın. Peleti 5 mL 0.22 μm filtrelenmiş LB'de yeniden süspanse edin. Titrasyon noktası 2: Bu, titrasyon için ikinci alikottur.
- Yukarıdaki bakteriyel süspansiyonun 50 μL'sini bir vakum filtreleme sistemi kullanarak steril bir 0.45 μm filtreden ( Malzeme Tablosuna bakınız) aktarın. Filtreyi 100 mL 0.22 μm filtrelenmiş LB ile durulayın.
NOT: Bakteriyofaj 9NA'nın kafa boyutu 0.067 μm'dir. Buna karşılık, Salmonella 2-5 μm uzunluğunda ve 0,5-1,5 μm genişliğindedir. Bu nedenle, 0.45 μm'lik membranlar kullanılırsa, çoğu bakteri 0.45 μm'den büyük oldukları için geçemezken, çoğu faj 0.45 μm'lik filtre gözeneklerinden geçecektir.
- Salmonella hücrelerinin içinde bulunan bakteriyofajın uzaklaştırılması
- Bakteri hücrelerinden faj salınımını kolaylaştırmak için, hücreleri içeren 0.45 μm'lik filtreyi, sistemi sökmeden inkübatörün içinde 37 ° C'de 2 saat inkübe edin.
NOT: Bu inkübasyon adımı, enfekte olmuş bakterilerin parçalanmasını ve hücre içi fajların filtreye salınmasını teşvik etmek için gereklidir. - 0,45 μm filtreyi bir vakum filtreleme sistemi kullanarak yıkayın ve filtreyi 100 mL 0,22 μm filtrelenmiş LB ile durulayın.
- Filtreden bakteri hücrelerini 2 mL 2x LB (20 g/L tripton, 10 g/L NaCl, 10 g/L maya özütü; Malzeme Tablosuna bakınız) içinde geri kazanın. Bunu yapmak için, 0,45 μm filtreyi steril forseps kullanarak bir şişeye aktarın. Ardından, filtrenin üzerine 2 mL 2x LB ekleyin ve hücreleri filtreden ayırmak için birkaç kez pipetleyin.
- Bu süspansiyonun 1 mL'sini 10.354 x g'da 2 dakika santrifüjleyin. Süpernatanı atın ve bakteri hücrelerini 1 mL filtrelenmiş LB ortamı ile 3x yıkayın. Hücreleri 1 mL 2x LB içinde yeniden süspanse edin. Titrasyon noktası 3: Bu, titrasyon için üçüncü alikottur.
NOT: Daha konsantre bir LB (2x LB) kullanılması şiddetle tavsiye edilir, çünkü aşağıda açıklandığı gibi ticari lipopolisakkarit (LPS) eklenecektir ve bu LPS suda çözünür, böylece ortam seyreltilir.
- Bakteri hücrelerinden faj salınımını kolaylaştırmak için, hücreleri içeren 0.45 μm'lik filtreyi, sistemi sökmeden inkübatörün içinde 37 ° C'de 2 saat inkübe edin.
- Bakteri hücrelerinden salınan bakteriyofajları aşağıda tarif edildiği gibi ticari lipopolisakkarit ile kandırarak yeniden enfeksiyonu önleyin.
- Ticari bir S. enterica lipopolisakkarit varlığında 20 μL bakteriyel süspansiyonu inkübe edin (LPS; Malzeme Tablosuna bakınız) 1 mL 0.22 μm filtrelenmiş LB'de 3.75 mg / mL'lik bir nihai konsantrasyona kadar 37 ° C'de 2 saat boyunca 200 rpm'de çalkalanarak.
NOT: Hücrelerden ortama salınan fajlar, bakteriyel LPS yerine ticari S. enterica LPS'ye bağlanabilir. - 2 saatlik inkübasyondan sonra, 1 mL kültürü bir mikrosantrifüj tüpüne aktarın ve süspansiyonu 10.354 x g'da 2 dakika santrifüjleyin.Titrasyon noktası 4: Süpernatanı titrasyon için dördüncü alikot olarak kullanın.
- Pelet 3x'i 1 mL filtrelenmiş LB ortamı ile yıkayın.
- Yıkadıktan sonra, peleti 1 mL 2x LB içinde yeniden süspanse edin. Bu karışımın 20 μL'sini 1 mL 0.22 μm filtrelenmiş LB içinde 0.8 mg / mL ticari LPS ile 37 ° C'de 2 saat boyunca 200 rpm'de çalkalayarak inkübe edin. Titrasyon noktası 5: Beşinci titrasyon için bakteri süspansiyonunun geri kalanını kullanın.
- 2 saatlik inkübasyondan sonra, 1 mL kültürü bir mikrosantrifüj tüpüne aktarın ve 10.354 x g'da 2 dakika santrifüjleme ile peletleyin. Titrasyon noktası 6: Süpernatanı yeni bir şişeye dökerek süpernatanı titrasyon için altıncı alikot olarak kullanın.
- Bakteri hücrelerini 3 kez filtrelenmiş LB ile yıkayın. Yıkadıktan sonra, toplanan hücreleri 1 mL 0.22 μm filtrelenmiş LB içinde yeniden süspanse edin.
- Bir vakum filtrasyon sistemi kullanarak 1 mL bakteri süspansiyonunu steril 0.45 μm filtreden geçirin. Filtreyi 100 mL 0.22 μm filtrelenmiş LB kullanarak durulayın.
- 0.45 μm filtreden hücreleri 2 mL 2x LB ortamında kurtarın. Bu amaçla, 0,45 μm'lik filtreyi steril forseps kullanarak bir şişeye aktarın. Ardından, filtrenin üzerine 2 mL 2x LB ekleyin ve hücreleri filtreden serbest bırakmayı denemek için birkaç kez pipetleyin.
- 10.354 x g'da 2 dakika santrifüjleme ile 1 mL hücre peletleyin. 3x'i 0,22 μm filtrelenmiş LB ile yıkayın. Yıkadıktan sonra, toplanan hücreleri 1 mL 2x LB içinde yeniden süspanse edin. Titrasyon noktası 7: Bu, titrasyon için yedinci alikottur. Bu alikot, bakteri kültürlerinde fajların uzaklaştırılmasının etkinliği hakkında bilgi verecektir.
- Ticari bir S. enterica lipopolisakkarit varlığında 20 μL bakteriyel süspansiyonu inkübe edin (LPS; Malzeme Tablosuna bakınız) 1 mL 0.22 μm filtrelenmiş LB'de 3.75 mg / mL'lik bir nihai konsantrasyona kadar 37 ° C'de 2 saat boyunca 200 rpm'de çalkalanarak.
3. Bakteriyofaj gideriminden sonra bakteriyofaj içermeyen Salmonella kültürünün hazırlanması
- Faj içermeyen aşıyı hazırlayın. Bakteriyel süspansiyondan 100 μL hücreyi, 0.45 mg / mL LPS içeren 900 μL LB'ye ekleyin. 37 °C'de 24 saat inkübe edin ve 200 rpm'de çalkalayın.
- Titrasyon noktası 8: Titrasyon için sekizinci alikotu hazırlayın (son potansiyel enfekte olmamış kültür). Bu nokta, faj yeniden enfeksiyonunun olmadığını doğrulamak içindir.
Sonuçlar
Salmonella enterica ve diğer Gram negatif bakteriler, LPS içeren bir dış zara sahiptir. LPS'nin O-antijeni, Salmonella kültürlerini 16,17 enfekte etmek için bakteriyofajlar 9NA tarafından yaygın olarak kullanılan bir reseptördür.
LPS'nin O-antijen veya çekirdek polisakkarit bölgeleri için bakteriyofajların spesifik afinitesi göz önüne alındığında, Salmonella enterica ticari LPS'nin 9NA bakteriyofajlarını dışlamak için bir yem olarak kullanılıp kullanılamayacağını incelemek istedik. Bunu yapmak için, ticari LPS ve 9NA lizatının bilinen konsantrasyonlarını karıştırdık ve ardından bir titrasyon uyguladık. Ticari LPS ve 9NA bakteriyofajları toplam 200 μL hacimde karıştırıldı ve çalkalanmadan 37 ° C'de 2 saat inkübe edildi. Titrasyon için, 5 mL LB yumuşak agar'a 100 μL LPS-9NA karışımı ve 60 μL gece boyu kültür ilave edildi ve bir LB plakasının üstüne döküldü. Plakalar 37 ° C'de 24 saat inkübe edildi. Şekil 3'te gösterildiği gibi, lizat titresi, S. enterica ticari LPS konsantrasyonu arttığında orantılı olarak azalır. Bu sonuçlar, ticari LPS'nin 9NA bakteriyofajlar için bir yem olarak doğru şekilde işlev gördüğünü göstermektedir.
İlginç bir şekilde, faj 9NA'nın Salmonella hücrelerini parçalaması ve fajları serbest bırakması için gereken süre, bakteri ve faj sayısı ile kolaylaştırılır (Şekil 4). Bu yönün faj giderme protokolünü nasıl etkileyebileceğini incelemek için farklı bakterileri test ettik: faj oranları (1: 1, 1: 10, 1: 100 ve 1: 1000). Şekil 4'te görüldüğü gibi, 9NA faj ilavesinden sonra 1.5-2.5 saatte kültürün OD600 nm'sinde bir düşüş vardır. OD600 nm değerlerinin sıfıra yaklaşması, bakteri kültürünün parçalandığının göstergesidir18. Bu nedenle, Salmonella hücrelerinin içinde bulunan fajın bakterileri parçalayıp salınması için yeterli süreyi sağlamak amacıyla bu protokolde inkübasyon süreleri 2 saat olarak tanımlanmıştır. Bu süre, bu protokolü gerçekleştirmeden önce her bir konak-faj sistemi için tahmin edilmelidir.
Ticari LPS'nin bir yem olarak çalıştığını ve 9NA ile enfekte olmuş bakteri için lizis zamanını belirledikten sonra, bakteriyofajların enfekte Salmonella kültürlerini temizlemek için açıklanan protokolü uyguladık (Şekil 1 ve Şekil 2). Protokolün her adımında bakteriyofajların varlığını izlemek için, elde edilen kültürlerin farklı noktalarda elde edilen karışımın 100 μL'sinde enfektivitesini hesaplamak için plak testleri yaptık (Şekil 5). Kültürlerden bakteriyofajların elimine edilmesi için tekrarlanan yıkama ve filtrelemenin yeterli olmadığını gözlemleyebiliriz (titrasyon noktaları 1-3); bununla birlikte, ticari LPS (titrasyon noktası 4) ile bir inkübasyon adımı uyguladığımız anda faj sayısı azalır. Bir bakteri kültüründe bakteriyofajların tamamen uzaklaştırılması için en önemli adım, ticari LPS ile ikinci inkübasyondur (titrasyon noktası 6). Bu adım, Salmonella kültürlerinde 9NA bakteriyofajının başarılı bir şekilde uzaklaştırılması için gereklidir.
Bu protokolün ilginç bir yönü, faj çıkarma adımlarından sonra faj direnci seviyesini bilmek olacaktır. Fajları fajlara dirençli bakterilerden ayıran bir prosedürün hiçbir faydası yoktur. Bu nedenle, kültürde kalan bakterilerin fajlara duyarlı olduğunu ortaya çıkarmak çok önemlidir. İşlemden sonra duyarlı faj hücrelerinin kültürlerde kaldığını göstermek için, faj kontaminasyonunu taramak için Evans Blue Uranine (EBU) plaka testi kullandık19. EBU plakaları, 10 mL/L K2HPO%4 %25, 5 mL/L glikoz %50, 2.5 mL/L floresein %1, 1.25 mL/L Evans Blue %1 ve 15 g/L agar ile desteklenmiş LB besiyerinden yapılmıştır. Faj dirençli ve faja duyarlı izolatları ayırt etmek için 9NA faj ile EBU plakaları üzerinde çapraz çizgi kullanıldı (Şekil 6). Temizleme protokolünün sonunda elde edilen bakteri kültürleri, faj kontaminasyonu açısından kontrol edilen izole koloniler elde etmek için kullanıldı (Şekil 6B). Hem dirençli hem de hassas hücrelerin varlığını gözlemleyebiliriz. Bu protokol, fajlara dirençli hücrelerin seçimini desteklemez; Sadece bakteriyofajları ortadan kaldırır.
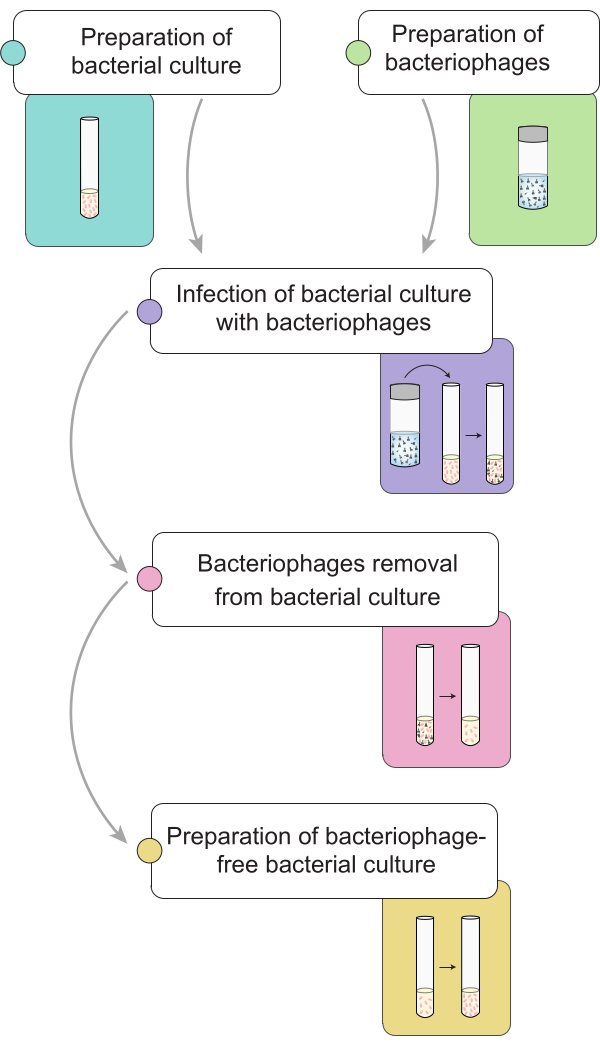
Şekil 1: Salmonella kültürlerinde bakteriyofajların ortadan kaldırılması prosedürünün kısa özeti. İş akışı farklı aşamalara ayrılmıştır: bakteri kültürü ve lizatın hazırlanması, bakteri kültürünün bakteriyofajlarla enfeksiyonu, enfekte bakteri kültürlerinden bakteriyofajların uzaklaştırılması ve faj içermeyen bir bakteri aşısının hazırlanması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
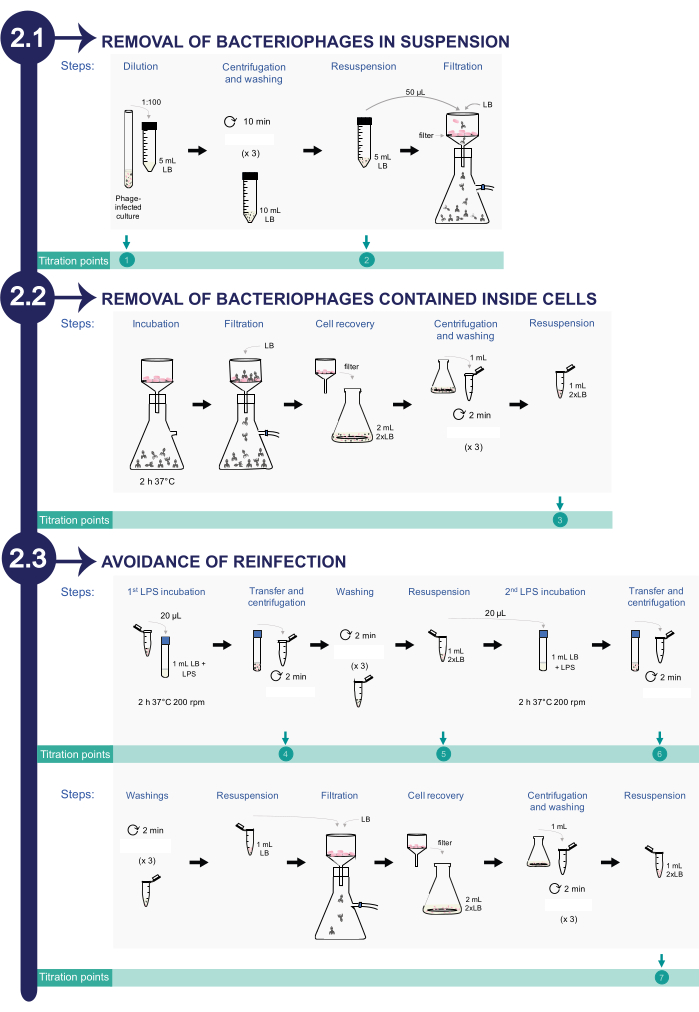
Şekil 2: Enfekte olmuş Salmonella'dan ica kültürlerine bakteriyofaj uzaklaştırmaprosedürü. İşlem üç aşamadan oluşur: 1) Süspansiyon halindeki bakteriyofajların uzaklaştırılması, 2) Bakteri hücrelerinin içinde bulunan fajların uzaklaştırılması ve 3) Yeniden enfeksiyondan kaçınma. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
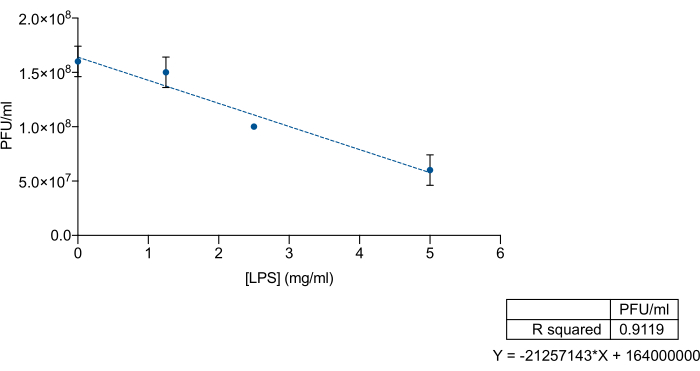
Şekil 3: Salmonella enterica ticari LPS'nin bakteriyofajları bağlama etkinliğini ölçmek için LPS-tuzak testi. Artan Salmonella enterica ticari LPS konsantrasyonlarında 9NA lizatın (PFU/mL) titrasyonu. Deney üç nüsha halinde gerçekleştirilmiştir. Ortalama ve standart sapma sunulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
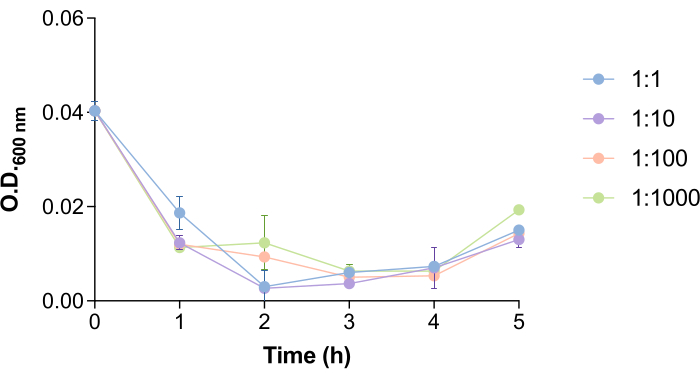
Şekil 4: Salmonella kültürlerinde bakteriyofaj 9NA lizis zamanı. Bakterilerde bakteriyofaj 9NA varlığında Salmonella enterica kültürlerinin büyüme eğrileri: 1: 1, 1: 10, 1: 100 ve 1: 1000 faj oranları. Deney üç nüsha halinde gerçekleştirilmiştir. Ortalama ve standart sapma sunulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
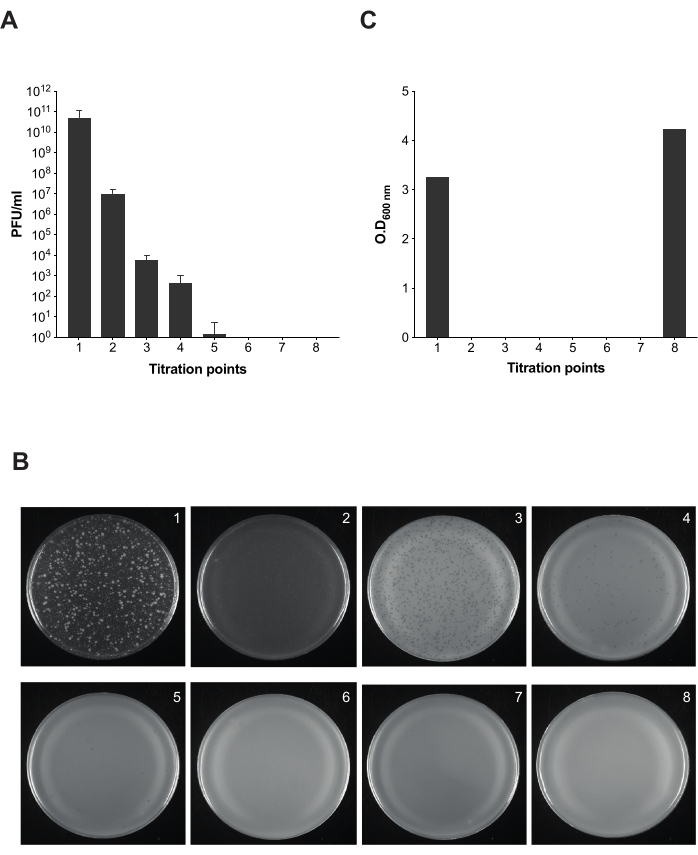
Şekil 5: Salmonella kültürlerinde bakteriyofaj giderimi sırasında enfektivite testi için plak testi. (A) Protokolün farklı noktalarında sekiz alikotun titrasyonu alınmıştır (titrasyon noktaları 1-7 Şekil 2'de işaretlenmiştir). Bu deney için Salmonella enterica serovar Typhimurium suşu ATCC 14028 opvAB::lacZ (SV8011) ve bakteriyofaj 9NA kullanıldı. Deneyler üç nüsha halinde yapıldı ve ortalama ve standart sapmalar gösterildi. (B) Salmonella enterica içeren yumuşak agar plakaları, sekiz titrasyon noktasından alikotlar kullanılarak kaplama tekniği izlenerek elde edildi. Plakalar, 1-8 titrasyon noktaları ile soldan sağa karşılık gelir. (C) Faj çıkarma protokolünün farklı zamanlarında 600 nm bakteri kültüründe optik yoğunluk. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
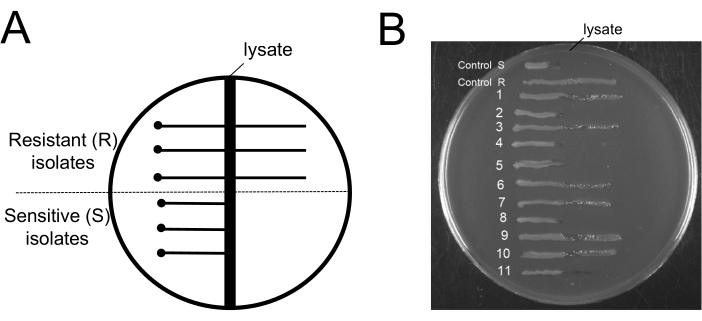
Şekil 6: Bakteriyofaj çıkarma işleminden sonra faja dirençli bakterilerin test edilmesi. (A) Çapraz çizgili agar testi için kullanılan tipik bir EBU agar plakasının şematik diyagramı: merkezdeki dikey karanlık bölge, 9NA lizat bölgesini temsil eder. Nokta, test edilen hücrelerin lizat bölgesinden güvenli bir mesafede aşılandığı yeri temsil eder ve yatay düz çizgiler, ya lizat bölgesi boyunca büyüyen fajlara dirençli hücreleri ya da lizat bölgesinin ötesinde büyümeyen fajlara duyarlı hücreleri temsil eder. (B) Çıkarma protokolünün sonunda 11 koloninin test edilmesi için EBU plaka testleri elde edilmiştir. Kontrol R ve S, sırasıyla faj dirençli ve faj duyarlı izolatların örnekleridir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bakteriyofajlar tarafından bakteri konakçılarını tanımak ve enfekte etmek için çeşitli stratejiler kullanılır. Bakterilerin yüzeyindeki farklı moleküler yapılar faj reseptörleri olarak işlev görebilir: protein, polisakkarit, lipopolisakkaritler (LPS) ve karbonhidrat kısımları20. Gram negatif bakterilerde LPS, fajlar için ortak bir reseptördür. Ek olarak, diğer reseptörler dış zar proteinleri, pili ve flagella21'dir.
LPS8'in tanınmasına dayalı olarak bakteriyofajlar ve bakteriler arasındaki spesifik etkileşim, bu çalışmada enfekte bakteriyofajların enfekte bakteriyofajların ortadan kaldırılması için oldukça verimli bir protokolün geliştirilmesi için kullanılmıştır (Şekil 1 ve Şekil 2). Protokolümüz fajlara dirençli hücrelerin seçimini desteklememektedir; sadece bakteriyofajları ortadan kaldırır (Şekil 6). Hem fajlara duyarlı hem de fajlara dirençli hücreler, bu faj uzaklaştırma protokolünü gerçekleştirdikten sonra bakteri kültüründe kalır.
Bir faj enfeksiyonu meydana geldiğinde geleneksel standart uygulama, kontamine olmuş tüm materyali ortadan kaldırmaya çalışmak, ardından temizlik ve sterilizasyondur22. Dekontaminasyon prosedürü, bakteri hücrelerini kısmen veya tamamen ortadan kaldırmak için bakteri kültürünün yüksek sıcaklıklar gibi stresli koşullara maruz bırakılmasını içerir. Temsili sonuçlarda açıklandığı gibi, bu protokoldeki en önemli adım, fajlarla enfekte olmuş bakteri kültürlerinin, bakteri kültürleri için zararlı olmayan bir madde olan ticari LPS ile inkübe edilmesidir. Bu, bakteri kültürlerinin canlılığının korunmasına yardımcı olur ve fermentörler ve biyoreaktörlerdeki endüstriyel uygulamalar için önemli avantajlar sunar.
Bu protokoldeki inkübasyon süresi, bakteri hücrelerinin faj lizizi için yeterli süreyi sağlamak için 2 saattir. Farklı bakteri suşları ve bakteriyofajlar kullanılacaksa, bu parametre kullanıcı tarafından dikkate alınmalı ve tanımlanmalıdır. Bu durumda, deneyden önce Şekil 4'te tarif edilene benzer bir test yapılmalıdır.
İlginç bir şekilde, bu temizleme protokolünün etkinliği, belirli bir numunenin faj içeriğini izleyen bir test kullanılarak da analiz edilebilir. Bu anlamda, epigenetik biyosensörler bakteriyofaj tespiti için yeni bir araçtır23. LPS'yi reseptör olarak kullanan kolifajları tespit edebilen iyi bilinen bir faj biyosensörü, opvAB::gfp sistemi 13,18,23,24'tür. Bu faj biyosensörü, reseptör olarak O-antijen kullanan fajların varlığında OpvABON alt popülasyonunda bir artış tespit eder. Bu anlamda, bu protokolün çeşitli adımlarında ve/veya çeşitli ortam ve koşullarda LPS bağlayıcı fajları izlemek için bir opvAB::gfp füzyonu kullanabiliriz. Bu yaklaşımlar, etkili bir protokolün gerekli olabileceği zamanlama ve konumları belirlemede değerli olabilir.
LPS tanıma yaygın olsa da, fajlar ayrıca bağlanma ve enfeksiyon için bakteri hücreleri üzerinde çeşitli diğer yüzey reseptörlerini de kullanabilir. Burada, temsili bir enterobakteri olarak Gram-negatif Salmonella'yı ve LPS'yi bir reseptör ve genom ejeksiyon tetikleyicisi olarak kullanan bakteriyofaj 9NA'yı kullandık. Diğer enterobakteri fajları (örneğin, Escherichia coli T5) LPS'ye gevşek bir şekilde bağlanır ve genom enjeksiyonu için bir dış zar proteini gerektirir. Açıklanan protokol, 9NA, Det7 ve P22 13,25,26,27 gibi başarılı enfeksiyon için LPS'nin O-antijenini tanıyan ve buna ihtiyaç duyan bakteriyofajlar için geçerlidir. Buna göre, bakteri kültürlerinin faj dekontaminasyonu için bu protokolün başarılı bir şekilde uygulanması, faj enfeksiyonunun kaynağının konakçıda LPS'yi tanımayı gerektirip gerektirmediğinin belirlenmesini içerir.
Sonuç olarak ve protokolün potansiyel sınırlamalarına rağmen, temsili sonuçlarımız, bu yöntemin, LPS'yi bir reseptör ve genom ejeksiyon tetikleyicisi olarak kullanan bakteriyofajların bakteriyel Salmonella kültürlerini temizlemek için güçlü bir araç olduğunu açıkça göstermektedir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Yararlı tartışmalar ve öneriler için Dr. Carmen R. Beuzón ve Rocío Carvajal-Holguera'ya teşekkür ederiz. Bu çalışma, MICIU/AEI/ 10.13039/5011100011033 tarafından finanse edilen PID2020-116995RB-I00 hibesi ve Universidad de Sevilla'dan VI Plan Propio de Investigación y Transferencia ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 20 mL syringe | BD Discardit II | 300296 | No special requirements |
| 50 mL conical tubes | Avantor | 525-0610 | No special requirements |
| 90 x 14 mm Petri dishes | Deltalab | 200209 | No special requirements |
| Agar | Sigma-Aldrich | A1296 | No special requirements |
| Bacteriophage lysate | Minimal concentration: 109 PFU/mL | ||
| Centrifuge | Eppendorf | No special requirements | |
| Chloroform | Panreac | 131252 | No special requirements |
| Citric acid · H2O | Merck | 1.00247 | |
| Colony counter | No special requirements | ||
| Evans Blue | Sigma-Aldrich | E-2129 | |
| Flasks | No special requirements | ||
| Fluorescein sodium salt | Sigma-Aldrich | F-6377 | |
| Forceps | No special requirements | ||
| Glass tubes | No special requirements | ||
| Glass tubes for lysate | No special requirements | ||
| Glucose | Sigma-Aldrich | G7021 | |
| K2HPO4 | Merck | 1.05104.1000 | |
| K2HPO4 anhydrous | Merck | 1.05104 | |
| Lipopolysaccharide from Salmonella enterica serotype Typhimurium | Sigma-Aldrich | L6511-25 mg | Dissolved in sterile water |
| Membrane 0.45 µm | MF-Millipore | HAWP02500 | No special requirements |
| MgSO4 · 7 H2O | Merck | 1.05886 | |
| NaCl | Sigma-Aldrich | S9888 | No special requirements |
| NaNH4HPO4 · 4 H2O | Sigma-Aldrich | S9506 | |
| Peptone | iNtRON | Ba2001 | No special requirements |
| Syringe Filter 0.22 µm | Millex | SLGSR33SB | No special requirements |
| Toothpicks | No special requirements | ||
| Tryptone | Panreac | 403682.1210 | No special requirements |
| Vacuum pump | Thermo Scientific | No special requirements | |
| Yeast extract | iNtRON | 48045 | No special requirements |
Referanslar
- Kasman, L. M., Porter, L. D. . Bacteriophages. , (2024).
- Lawrence, D., Baldridge, M. T., Handley, S. A. Phages and human health: More than idle hitchhikers. Viruses. 11 (7), 587 (2019).
- Beller, L., Matthijnssens, J. What is (not) known about the dynamics of the human gut virome in health and disease. Curr Opin Virol. 37, 52-57 (2019).
- Roux, S., Hallam, S. J., Woyke, T., Sullivan, M. B. Viral dark matter and virus-host interactions resolved from publicly available microbial genomes. eLife. 4, 08490 (2015).
- Wommack, K. E., Colwell, R. R. Virioplankton: Viruses in aquatic ecosystems. Microbiol Mol Biol Rev. 64 (1), 69-114 (2000).
- Louten, J. Virus structure and classification. Essentl Human Virol. , 19-29 (2016).
- Egido, J. E., Costa, A. R., Aparicio-Maldonado, C., Haas, P. J., Brouns, S. J. J. Mechanisms and clinical importance of bacteriophage resistance. FEMS Microbiol Rev. 46 (1), 048 (2022).
- Rakhuba, D. V., Kolomiets, E. I., Dey, E. S., Novik, G. I. Bacteriophage receptors, mechanisms of phage adsorption and penetration into host cell. Polish J Microbiol. 59 (3), 145-155 (2010).
- Lindberg, A. A. Bacteriophage receptors. Ann Rev Microbiol. 27 (1), 205-241 (1973).
- Koskella, B., Meaden, S. Understanding bacteriophage specificity in natural microbial communities. Viruses. 5 (3), 806-823 (2013).
- Marcó, M. B., Moineau, S., Quiberoni, A. Bacteriophages and dairy fermentations. Bacteriophage. 2 (3), 149-158 (2012).
- Fernández-Fernández, R., et al. Evolution of a bistable genetic system in fluctuating and non-fluctuating environments. bioRxiv. , (2024).
- Cota, I., Blanc-Potard, A. B., Casadesús, J. STM2209-STM2208 (opvAB): a phase variation locus of Salmonella enterica involved in control of O-antigen chain length. PloS one. 7 (5), e36863 (2012).
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. Enumeration of bacteriophages by double agar overlay plaque assay. Methods Mol Biol. 501, 69-76 (2009).
- Ackermann, H. W. Tailed bacteriophages: The order Caudovirales. Adv Virus Res. 51, 135-201 (1998).
- Wilkinson, R. G., Gemski, P., Stocker, B. A. D. Non-smooth mutants of Salmonella typhimurium: Differentiation by phage sensitivity and genetic mapping. J Gen Microbiol. 70 (3), 527-554 (1972).
- Casjens, S. R., Leavitt, J. C., Hatfull, G. F., Hendrix, R. W. Genome sequence of Salmonella Phage 9NA. Genome Announc. 2 (4), e00531 (2014).
- Cota, I., et al. Epigenetic control of Salmonella enterica O-antigen chain length: A tradeoff between virulence and bacteriophage resistance. PLoS Genet. 11 (11), e1005667 (2015).
- Chan, K., Botstein, D., Watanabe, T., Ogata, Y. Specialized transduction of tetracycline resistance by phage P22 in Salmonella typhimurium. Virology. 50, 883-898 (1972).
- Bertozzi Silva, J., Storms, Z., Sauvageau, D. Host receptors for bacteriophage adsorption. FEMS Microbiol Lett. 363 (4), 002 (2016).
- Sørensen, M. C. H., et al. Bacteriophage F336 recognizes the capsular phosphoramidate modification of Campylobacter jejuni NCTC11168. J Bacteriol. 193 (23), 6742-6749 (2011).
- Ogata, S., Hongo, M. Bacteriophages of the Genus Clostridium. Adv Appl Microbiol. 25, 241-273 (1979).
- Olivenza, D. R., Casadesús, J., Ansaldi, M. Epigenetic biosensors for bacteriophage detection and phage receptor discrimination. Environ Microbiol. 22 (8), 3126-3142 (2020).
- Olivenza, D. R., et al. A portable epigenetic switch for bistable gene expression in bacteria. Sci Rep. 9 (1), 862 (2019).
- Walter, M., et al. Structure of the receptor-binding protein of bacteriophage Det7: a Podoviral tail spike in a Myovirus. J Virol. 82 (5), 2265-2273 (2008).
- Davies, M. R., Broadbent, S. E., Harris, S. R., Thomson, N. R., vander Woude, M. W. Horizontally acquired Glycosyltransferase operons drive Salmonellae lipopolysaccharide diversity. PLoS Genet. 9 (6), e1003568 (2013).
- Wahl, A., Battesti, A., Ansaldi, M. Prophages in Salmonella enterica: a driving force in reshaping the genome and physiology of their bacterial host. Mol Microbiol. 111 (2), 303-316 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır