Method Article
تباين الخواص الفلورية الذي تم حله بمرور الوقت من الجزيئات المفردة لتوصيف المرونة المحلية في الجزيئات الحيوية
In This Article
Summary
هنا ، نقدم البروتوكول لدراسة المرونة والديناميكيات المحلية للجزيئات الحيوية باستخدام تباين الخواص الفلوري الذي تم حله بمرور الوقت على مستوى الجزيء الفردي في وضع الفحص المجهري متحد البؤر.
Abstract
نصف بروتوكولا لإجراء تباين الخواص الفلورية التي تم حلها بمرور الوقت على مستوى الجزيء الفردي باستخدام الفحص المجهري متحد البؤر للتحقيق في المرونة والديناميكيات المحلية لمجال رأس الشوكة المرتبط بالحمض النووي الريبي (DNA) (FKH) لعامل النسخ FoxP1. يتناقص FoxP1 من خلال آلية تبديل المجال ثلاثية الأبعاد (3D-DS) ، مما يشكل وسيطا مضطربا مع أو بدون الحمض النووي. نظرا لأن 3D-DS ينطوي على منطقة مضطربة جوهريا ، فإن فهم سلوكها أمر بالغ الأهمية لتوضيح الخصائص الهيكلية والوظيفية ل FoxP1. باستخدام FoxP1 أحادي السيستين المسمى ، أجرينا تجارب تباين الخواص الفلورية أحادية الجزيء (smFA) ، وتطبيق تحليل توزيع الفوتون الديناميكي (daPDA) وتحليل تباين الانفجار الذي تم حله بمرور الوقت (traBVA) لاستكشاف المرونة والديناميكيات المحلية. يوفر هذا البروتوكول دليلا مفصلا خطوة بخطوة لقياسات smFA ، مع التركيز على التحليلات التي تم حلها بمرور الوقت ، والتباين ، وتقنيات توزيع الاحتمالات لالتقاط الديناميكيات الهيكلية عبر نطاقات زمنية مختلفة. مكننا هذا النهج من ربط الديناميكيات وعدم التجانس بخثث FoxP1 وربط الحمض النووي ، مما يسلط الضوء على آلية العمل المعقدة التي تميز عامل النسخ هذا.
Introduction
يعتمد النشاط الوظيفي للجزيئات الحيوية على مرونتها الجزيئية وديناميكياتها الهيكلية1،2،3. بطبيعة الحال ، تتعرض الجزيئات الحيوية لتقلبات حرارية مستمرة ، تتراوح من الحركات السريعة إلى التغيرات التوافقية طويلة المدى التي تؤثر على وظيفتها (الشكل 1) 4. في الجزيئات الحيوية ، تساهم حركات العمود الفقري المحلية في حركات عالمية واسعة النطاق ، بما في ذلك الانحناء المفصلي في الإنزيمات والتغيرات التوافقية الكبيرة في البروتينات الحركية. كشفت طرق تحديد الهيكل مثل الرنين المغناطيسي النووي (NMR) 5 ، وعلم البلورات بالأشعة السينية6 ، والفحص المجهري الإلكتروني المبرد (cryo-EM) 7 عن مطابقات متعددة في جزيئات حيوية مختلفة. ومع ذلك ، فإن ربط التقلبات المحلية بالديناميكيات التوافقية الكبيرة للجزيئات الحيوية ودورها في الوظيفة غير مستكشف في الغالب. يمكن أن يكون الارتباط بين الديناميكيات والهيكل أمرا صعبا ، خاصة بالنسبة للبروتينات المضطربة جوهريا (IDPs) 8،9،10. على عكس البروتينات المهيكلة ، لا يحافظ النازحون داخليا على بنية ثالثية مستقرة. بدلا من ذلك ، يخضعون لتغييرات توافقية واسعة النطاق بمستويات طاقة حرة مماثلة ، مما يتيح مجموعة واسعة من الأنشطةالبيولوجية 11،12.
تم استخدام العديد من الأساليب التجريبية للتحقيق في الديناميكيات التوافقية للبروتينات من خلال فحص مرونتها الجزيئية1،13،14،15،16. من بين هؤلاء ، يتميز الرنين المغناطيسي النووي بقدرته على توفير دقة على المستوى الذري عبر نطاقات زمنية مختلفة ، من عشرات البيكو ثانية إلى عدة ساعات12. ومع ذلك ، فإن تحديد المرونة الجزيئية الكبيرة لا يزال يمثل تحديا بسبب درجات الحرية العالية والبروتينات كبيرة الحجم. وبالتالي ، غالبا ما يقتصر الرنين المغناطيسي النووي على دراسة الجزيئات الحيوية التي تبلغ حوالي 100 كيلو دالتون17.
نظرا للتعقيد الهيكلي للبروتينات عالية الديناميكية مثل النازحين داخليا ، فقد تم تطوير تطورات منهجية إضافية لاستكشاف الفضاء التوافقي المحلي وبعيد المدى لفهم وظيفتها11. يقدم التحليل الطيفي الفلوري متعدد المعلمات أحادي الجزيء (smMFS) 18،19،20،21،22 معلومات شاملة عن الجزيئات الحيوية ، مما يوفر رؤى مهمة حول وظيفتها ، وديناميكياتها التوافقية ، وحالات الربط ، وقياس التكافئ. ومع ذلك ، فإن تفسير الكم الهائل من البيانات الهيكلية التي تم الحصول عليها من الجزيئات الحيوية يمثل تحديا ، ويمكن لعوامل مثل الديناميكيات الجزيئية وسلوك الفلوروفور والسلوك المعقد للجزيئات أن تزيد من تعقيد تحليل البيانات23،24،25،26،27،28.
نحن نستخدم تباين الخواص الفلورية أحادي الجزيء (smFA) كطريقة قوية لتقييم الديناميكيات المحلية والعالمية على طول العمود الفقري للجزيئات الحيوية (الشكل 1 أ). تباين التألق ، الذي وصفه Perrin29 لأول مرة وقدمه Weber30،31 كأداة تحليل حيوي32 ، تم تكييفه لاحقا لدراسات الجزيء الفردي مع ظهور تقنيات التألق التي تم حلها بمرور الوقت وزيادة حساسية أجهزة الكشف33،34،35،36،37. يمتد smFA على نطاق واسع من النطاقات الزمنية - من بيكو ثانية إلى عدة ساعات - ويكمل البيانات التي تم الحصول عليها من تجارب نقل طاقة الرنين Förster أحادية الجزيء (smFRET)38.
يمكن تصور smFA بتنسيقات مختلفة لاستخراج المعلومات الهامة حول الديناميكيات الجزيئية الحيوية (الشكل 1 ب). اضمحلال تباين الخواص الفلورية الذي تم حله بمرور الوقت عبارة عن رسوم بيانية أحادية البعد تلتقط الديناميكيات على المقياس الزمني من بيكو ثانية إلى نانو ثانية39،40. يمكن أن تكشف الرسوم البيانية أحادية الجزيء ثنائية الأبعاد ، والتي تربط عمر التألق مع تباين الخواص للجزيئات الفردية ، عن عدم تجانس حالة تباين الخواص وتوفر رؤى مرئية حول الديناميكيات المحتملة خلال وقت الملاحظة في التجارب متحدة البؤر (~ مللي ثانية) 41،42. لدراسة ديناميكيات أقل من المللي ثانية ، يمكن استخدام تحليل توزيع الفوتون الديناميكي (daPDA) ، بينما يوفر تحليل تباين الانفجار الذي تم حله بمرور الوقت (traBVA) طريقة قوية لتأكيد ديناميكيات محددة حول المللي ثانية43 (الشكل 1 ب).
تكمل هذه الطرق الأدوات الأكثر تقليدية ، مثل التحليل الطيفي لارتباط التألق الذي تم حله بالاستقطاب (pFCS) ، والذي يحتوي على طيف أوسع44،45،46،47. بشكل عام ، تسهل أدوات تحليل البيانات المتعددة ل smFA تحديد التغييرات التوافقية المحلية والعالمية ، بشرط النظر في المعايرة المناسبة.
هنا ، نطبق smFA لدراسة ارتباط الحمض النووي لعامل النسخ البشري FoxP148،49،50،51. يعتمد هذا البروتين على ثنائي مبديل بالمجال بسبب الطبيعة المضطربة جوهريا لسلسلة عديد الببتيد الخاصة به ، والتي تتأثر بشكل ملحوظ اعتمادا على الحالة الرباعية للبروتين ووجود الحمض النووي. قمنا بإنشاء طفرات مختلفة أحادية السيستين لتسميتها باستخدام BODIPY-FL ، وأجرينا تجارب smFA ، واستخدمنا daPDA و trBVAa. سمح لنا هذا النهج بربط الديناميكيات وعدم التجانس بخثث FoxP1 وربط الحمض النووي ، مما يسلط الضوء على آلية العمل المعقدة التي تميز عامل النسخ هذا.
Protocol
ملاحظة: يعد اختيار الفلوروفور المناسب أمرا ضروريا لتجارب smFA. يمكن تصنيف الجزيئات الحيوية في مواضع خاصة بالموقع إما عن طريق تعديل الأحماض الأمينية في البروتينات أو قواعد النيوكليوتيدات في الأحماض النووية ذات العلامات الفلورية ، اعتمادا على المجموعات التفاعلية المتاحة. من بين الأصباغ العضوية52 ، تعد عائلات Alexa Fluor و Cy و BODIPY و Janelia Farms أكثر الخيارات شيوعا ل smFA ، وذلك بفضل عمرها الطويل المضان ، والثبات الضوئي ، والإنتاجية الكمومية العالية. غالبا ما يفضل BODIPY-FL لعمره المضان الممتد ، والعائد الكمي الفائق ، ورابط التوصيل القصير. بالإضافة إلى ذلك ، تستخدم الفلوروفورات البديلة بشكل شائع في فحص الأدوية حيث تفضل التقنيات السائبة53. يمكن أيضا استخدام بروتينات الفلورسنت الخيمرية لتجارب تباين الخلايا الحية والتصوير ، على الرغم من وجود قيود على النطاق الديناميكي المنخفض.
1. إعداد العازلة
ملاحظة: ارتد قفازات ونظارات واقية للعين ومعطف مختبر أثناء إجراء التجارب المعملية.
- المخزن المؤقت القياسي (20 ملي مولار 4- (2-هيدروكسي إيثيل) -1-بيبرازينيثان سلفونيك حمض [HEPES] ، درجة الحموضة 7.8 ، 150 ملي كلوريد الصوديوم): قم بإذابة 2.38 جم من HEPES ، 4.38 جم من كلوريد الصوديوم في 400 مل من الماء فائق النقاء ، واضبط الرقم الهيدروجيني على 7.8 واجعل الحجم النهائي إلى 500 مل.
- المخزن المؤقت للتحلل (20 ملي مولار HEPES ، درجة الحموضة 7.8 ، 150 ملي كلوريد الصوديوم ، 0.1 ملي مولار فينيل ميثيل سلفونيل فلوريد [PMSF] ، 10 ميكروغرام / مل DNAse): قم بإذابة 2.38 جم من HEPES ، و 4.38 جم من كلوريد الصوديوم ، و 8.71 مجم من PMSF وتركيز نهائي قدره 10 ميكروغرام / مل DNAse في 400 مل من الماء فائق النقاء ، واضبط الرقم الهيدروجيني على 7.8 واجعل الحجم النهائي إلى 500 مل.
- مخزن مؤقت للتوازن (50 ملي مولار محلول ملحي مخزن بالفوسفات [PBS] ، 150 ملي كلوريد الصوديوم ، و 10 ملي مولار إيميدازول ؛ درجة الحموضة 7.4): قم بإذابة 5.05 جم من NaH2HPO4 ، و 0.85 جم من NaH2PO4 ، و 4.38 جم من كلوريد الصوديوم و 0.34 جم من إيميدازول في 400 مل من الماء فائق النقاء ، واضبط الرقم الهيدروجيني على 7.4 واجعل الحجم النهائي إلى 500 مل.
- مخزن الغسيل (50 ملي مولار PBS ، 150 ملي كلوريد الصوديوم ، و 30 ملي مولار إيميدازول ؛ الرقم الهيدروجيني 7.4): قم بإذابة 5.05 جم من NaH2HPO4 ، و 0.85 جم من NaH2PO4 ، و 4.38 جم من كلوريد الصوديوم و 1.02 جم من إيميدازول في 400 مل من الماء فائق النقاء ، واضبط الرقم الهيدروجيني على 7.4 واجعل الحجم النهائي إلى 500 مل.
- المخزن المؤقت للشطف (50 ملي مولار PBS ، 150 ملي كلوريد الصوديوم ، و 250 ملي مولار إيميدازول ؛ الرقم الهيدروجيني 7.4): قم بإذابة 5.05 جم من Na2HPO4 ، و 0.85 جم من NaH2PO4 ، و 4.38 جم من كلوريد الصوديوم و 8.5 جم من إيميدازول في 400 مل من الماء فائق النقاء ، واضبط الرقم الهيدروجيني على 7.4 واجعل الحجم النهائي إلى 500 مل.
- مخزن مؤقت PBS (50 ملي مولار من محلول ملحي مخزن بفوسفات الصوديوم ، 150 ملي كلوريد الصوديوم ، درجة الحموضة 7.4). قم بإذابة 5.05 جم من NaH2HPO4 و 0.85 جم من NaH2PO4 و 4.38 جم من كلوريد الصوديوم في 400 مل من الماء فائق النقاء ، واضبط الرقم الهيدروجيني على 7.4 ، واجعل الحجم النهائي إلى 500 مل.
- قم بتعقيم جميع المخازن المؤقتة عن طريق تصفية المحلول باستخدام مرشحات بحجم المسام 0.22 ميكرومتر وتخزين المخازن المؤقتة في درجة حرارة الغرفة (RT).
- قم بتصفية المخزن المؤقت القياسي باستخدام مرشح الفحم للحصول على جزيء واحد.
2. مجسات الفلورسنت
- BODIPY-FL: قم بإذابة قارورة 5 ملغ تحتوي على BODIPY-FL عن طريق إضافة حجم نهائي قدره 1.29 مل من ثنائي ميثيل سلفوكسيد الفتح حديثا (DMSO) للحصول على التركيز النهائي البالغ 10 ملي مولار من BODIPY-FL.
- الرودامين 110: قم بإذابة 3.67 مجم من الرودامين 110 عن طريق إضافة حجم نهائي قدره 1 مل من DMSO المفتوح حديثا للحصول على التركيز النهائي البالغ 10 ملي مولار من الرودامين 110.
ملاحظة: يجب تجنب مجسات الفلورسنت عند تعرضها للضوء. استخدم دائما أنبوبا حساسا للضوء (لون كهرماني) ولفه بورق الألمنيوم. إذا تم فتح DMSO بالفعل ، فيجب الاحتفاظ به في المجفف لزيادة مدة صلاحيته. - قم بإعداد كميات صغيرة الحجم من مسبار الفلورسنت المحضر وتخزينه عند -20 درجة مئوية حتى الاستخدام الآخر.
ملاحظة: تجنب دورات التجميد والذوبان لتحسين كفاءة وضع العلامات.
3. قياسات المعايرة
- قم بإجراء تجارب الكشف عن التألق متعدد المعلمات (MFD) على إعداد محلي الصنع تم حله مع 4 قنوات كشف و 2 ليزر نبضي (أزرق 485 نانومتر وأحمر 640 نانومتر)54. ومع ذلك ، بالنسبة لقياسات تباين الخواص ، استخدم الليزر الأزرق وقناتين للكاشف.
- قم بتشغيل قنوات الكاشف (المتوازية والعمودية) وطاقة الليزر الأزرق.
- تأكد من ضبط طاقة الليزر على 60 ميكروواط وافتح لوحة التحكم36 لبرنامج عد الفوتون الفردي (TCSPC).
- امزج 1 ميكرولتر من 100 نانومتر من الرودامين 110 و 49 ميكرولتر من الماء المقطر لعمل تركيز نهائي قدره 2 نانومتر من الرودامين 110. أضف 50 ميكرولتر من 2 نانومتر من الرودامين 110 إلى وسط زجاج الغطاء لقياسات المعايرة.
- بعد ذلك ، أضف قطرة من سائل الغمر (إما الزيت أو الماء ، ولكن مع الحرص على مشاركة نفس معامل الانكسار) أعلى العدسة الموضوعية للمجهر لزيادة قوة التحليل للمجهر.
- ضع زجاج الغطاء أعلى العدسة الموضوعية وتأكد من أن قطرة الماء في وسط هدف المجهر.
- اضبط مستوى الصورة ليكون داخل المحلول وفوق سطح الزجاج.
- اضبط المقبض للعثور على النقطة المحورية الساطعة الثانية وانتقل إلى نقطة ونصف. ركز الليزر على واجهة الزجاج والسائل.
- قم بزيادة عدد الفوتونات المكتشفة عن طريق ضبط موضع الثقب (70 ميكرومتر) أثناء مراقبة معدل عدد الفوتونات.
- افتح البرنامج في لوحة وضع الحلول الزمنية (TTTR أو T3) وانقر فوق الزر ابدأ . سجل معدل العد لمدة 120 ثانية واحفظ تنسيق ملف Rhodamine 110.ptu باستخدام برنامج الاستحواذ. يجب أن يكون وقت الاستحواذ هذا كافيا بالنظر إلى التركيز (2 نانومتر).
- لقياسات الخلفية ، أضف 50 ميكرولتر من الماء المقطر إلى وسط زجاج الغطاء وكرر الخطوات 3.5-3.10. ومع ذلك ، سجل معدل عدد الفوتون لمدة 300 ثانية واحفظ ملف water.ptu .
- بالنسبة لقياسات الخلفية الأخرى ، أضف 50 ميكرولتر من المخزن المؤقت القياسي إلى مركز زجاج الغطاء وكرر الخطوات 3.5-3.10. سجل معدل عدد الفوتون لمدة 300 ثانية واحفظ ملف buffer.ptu القياسي . بعد ذلك ، قم بتحليل البيانات باستخدام برنامج تحليل عمر التألق التكامل المتفجر (BIFL).
4. المعايرة وتحليل البيانات
- افتح برنامج BIFL وانقر فوق تأكيد الإعداد من النافذة التلقائية. بعد ذلك ، انقر فوق الحصول على المعلمات من الملف ، ثم موافق.
- لكي يتم تحليل القياس ، انقر فوق مصفوفة مسار البيانات وحدده.
- بعد ذلك ، قم بتحميل ملف قياس المياه water.ptu للمصفوفات مثل التشتت الأخضر. وبالمثل ، حدد ملف buffer.ptu القياسي للخلفية الخضراء. بالنسبة إلى اللون الأخضر السميك ، حدد Rhodamine 110.ptu.
- ضمن معلمات تحديد الجزيء الفردي، انقر فوق التالي، ثم ضبط لعرض نافذة منبثقة جديدة. انقر فوق العتبة لتغيير وقت الوصول بين الفوتون وحدد وقت حدث الجزيء الفردي لمتوسط وقت وصول الفوتون بين الفوتون (dt). بعد ذلك ، انقر فوق min. # لتحديد الحد الأدنى لعدد الفوتونات لكل حدث جزيء واحد ، ثم أغلق النافذة المنبثقة بالنقر فوق رجوع. ثم انقر فوق موافق.
- بعد ذلك ، انقر فوق معلمات Color fit لضبط العمر الافتراضي الأولي للألوان الخضراء ، وهي الألوان التي يتم إنشاؤها باستخدام معلمات اضمحلال الفلورة. اضبط قيم المطالبة والتأخير عن طريق تعديل قيم من و إلى. ثم أغلق النافذة المنبثقة بالنقر فوق رجوع. ثم انقر فوق موافق.
- انقر فوق حفظ لمعالجة ملفات ASCII وحفظها في مجلد محدد. بعد ذلك ، قم بمعالجة البيانات الخاصة باضمحلال تباين التألق الذي تم حله بمرور الوقت باستخدام ChiSurf22 أو تحليل توزيع الفوتون55،56 أو تحليل تباين الاندفاع57،58.
ملاحظة: تتوفر البيانات النموذجية والأوصاف خطوة بخطوة حول كيفية استخدام ChiSurf و PDA و BVA في github.com/Fluorescence-Tools/chisurf و github.com/Fluorescence-Tools/tttrlib و www.mpc.hhu.de/en/software/mfd-fcs-and-mfis و github.com/SMB-Lab/feda_tools على التوالي. البيانات التجريبية متاحة في Zenodo (10.5281 / zenodo.13371503).
5. تحضير بروتين FoxP1
- الإفراط في التعبير البكتيري FoxP1 المؤتلف
- إجراء التحول إلى بكتريا قولونية C41 الخلايا البكتيرية بعد تغيير سريع التغير لتفاعل البوليميراز المتسلسل الموجه بالموقع (PCR).
- تحضير وسائط LB والأوتوكلاف لتعقيمها.
- قم بتلقيح مستعمرة بكتريا قولونية C41 واحدة مسبقا عن طريق إضافة 5 مل من وسط LB الذي يحتوي على 5 ميكرولتر (100 ميكروغرام / مل) أمبيسلين. اتركيه يحتضن عند 37 درجة مئوية طوال الليل على شاكر حاضنة.
- في اليوم التالي، قم بتلقيح المزرعة البكتيرية على نطاق واسع عن طريق إضافة التلقيح المسبق طوال الليل إلى 500 مل من وسائط LB مع مضاد حيوي مضاف مسبقا بنسبة 1: 500.
- راقب نمو الثقافة عن طريق قياس امتصاص المزرعة عند 600 نانومتر.
- عندما تصل الكثافة البصرية إلى ما بين ~ 0.5-0.7 ، قم بتحفيز التعبير عن البروتين عن طريق إضافة تركيز نهائي يبلغ 0.5 ملي مولار من الأيزوبروبيل-β-د-1-ثيوغالاكتوبيرانوسيد (IPTG) وحافظ على الثقافة عند 15 درجة مئوية على شاكر حاضنة طوال الليل.
- بعد تحقيق كثافة بصرية (600 نانومتر) في حدود 1.4-1.6 ، حصاد الخلايا البكتيرية عن طريق الطرد المركزي عند 3000 جم لمدة 20 دقيقة عند 4 درجات مئوية. تخلص من المادة الطافية وقم بتخزين الحبيبات عند -20 درجة مئوية حتى الاستخدام.
- تنقية FoxP1 المؤتلف
- Lyse بكتريا قولونية C41 الخلايا عن طريق إضافة المخزن المؤقت للتحلل باستخدام أي طرق تحلل مثل الصوتنة ، والتجانس السائل ، والضغط الفرنسي ، وما إلى ذلك.
- جهاز الطرد المركزي للمحللة عند 14000 جم لمدة 10 دقائق عند 4 درجات مئوية.
- بالنسبة للبروتينات المكونة من6 علامات ، اغسل عمود تقارب Ni2 + -NTA وقم بالتوازن مع NiSO4 باستخدام كروماتوغرافيا سائل البروتين السريع (FPLC).
- قم بتحميل بروتين FoxP1 المكون من6 علامات في عمود تقارب Ni2 + -NTA المتوازن.
- قم بإزالة بروتين FoxP1 من عمود Ni2 + -NTA باستخدام تدرج خطي للمخزن المؤقت للشطف.
- بعد تصريف البروتين ، قم بإجراء غسيل الكلى لتبادل العازلة. أضف البروتين إلى مخزن مؤقت للتوازن بدون إيميدازول وقم بغسيل الكلى طوال الليل باستخدام محرك مغناطيسي عند 4 درجات مئوية.
ملاحظة: إذا تم تنقية البروتين باستخدام طريقة مختلفة ، فقم بإجراء التبادل المؤقت وفقا لذلك. - لإزالة علامة His6 ، أضف بروتياز فيروس حفر التبغ (TEV) (نسبة 1: 100 من TEV: FoxP1) إلى غسيل الكلى بين عشية وضحاها.
ملاحظة: يمكن أيضا إجراء عملية الهضم المكونةمن 6 علامات عن طريق إضافة هضم البروتياز TEV على العمود. هذه الخطوة من شأنها تحسين إنتاجية البروتين محل الاهتمام. - في اليوم التالي ، كرر الخطوات من 5.2.3-5.2.5. ومع ذلك ، هذه المرة ، قم بتصفية البروتين في مخزن الغسيل بدلا من المخزن المؤقت للشطف.
- قم بتركيز البروتين على حجم مناسب عن طريق إضافة المخزن المؤقت PBS وتحديد كمية البروتين باستخدام الامتصاص عند 280 نانومتر ، مع مراعاة معامل انقراض البروتين.
- وضع العلامات المؤتلف على FoxP1
- احتضان 50-100 ميكرومتر من بروتين FoxP1 مع فائض مولار بمقدار 10 أضعاف من Dithiothreitol (DTT) أو tris (2-carboxyethyl) phosphine (TCEP) بحجم نهائي يبلغ 500 ميكرولتر عند RT لمدة 30 دقيقة.
- قم بإجراء تبادل المخزن المؤقت باستخدام أعمدة تحلية المحمية PD 10. ضع عمود PD10 في أنبوب طرد مركزي سعة 50 مل باستخدام محول عمود.
- قم بموازنة عمود PD10 عن طريق إضافة 5 مل من المخزن المؤقت PBS وجهاز الطرد المركزي عند 1000 × جم لمدة دقيقتين. كرر هذه الخطوة 3 مرات.
- احتفظ بعمود PD10 في أنبوب جديد سعة 50 مل وأضف 2 مل من المخزن المؤقت PBS إلى العمود. ثم أضف 500 ميكرولتر من بروتين FoxP1 من الخطوة 1 إلى العمود. قم بتخفيض البروتين عن طريق الطرد المركزي 1000 × جم لمدة دقيقتين وجمع البروتين.
- ركز البروتين عن طريق إضافته إلى مرشحات الطرد المركزي الفائقة (10 كيلو دالتون MWCO) ، وجهاز الطرد المركزي عند 7500 × جم لمدة 10 دقائق ، واجمع الملح.
- قم بقياس تركيز البروتين ، وأضف BODIPY مع ما يعادل 30٪ من تركيز السيستين في البروتين ، وضعه على محور دوار لمدة ساعتين عند 4 درجات مئوية.
- قم بإجراء تبادل المخزن المؤقت وتركيز البروتين كما تمت مناقشته في الخطوات 5.3.2-5.3.5.
- تحقق من تركيز البروتين باستخدام مقياس الطيف الضوئي أو مقايسة اللون، مثل طريقة برادفورد أو لوري، وتركيز الصبغة عن طريق الامتصاص عند 500 نانومتر.
- قم بقياس درجة الملصقات باستخدام الصيغة التالية:
(صبغة / صبغةε) / (الوزن الجزيئي للبروتين / ملليغرام من البروتين لكل مليلتر) = مولات الصبغة / مولات البروتين
حيث ADye و εDye هي قيمة امتصاص الصبغة ومعامل الانقراض المولي للصبغة عند أقصى طول موجي للامتصاص ، على التوالي59. عند القياس عند 280 نانومتر ، يجب تصحيح الامتصاص الحقيقي للبروتين بالصيغة التالية:
البروتين = أ 280- (صبغة · CF280)
حيث CF280 هو عامل التصحيح للصبغة المحددة ، مع الأخذ في الاعتبار امتصاصها الجوهري عند 280 نانومتر59.
ملاحظة: بينما نركز على التعبير عن البروتين المعدل بالسيستين وتنقيته ، يجب النظر بعناية في الإدخال الاستراتيجي لبقايا السيستين في البروتين.
6. تحضير غرفة عينة المجهر
- أضف 495 ميكرولتر من الماء فائق النقاء و 5 ميكرولتر (0.01٪ من التركيز النهائي للحجم / الحجم) من Tween-20 (خافض للتوتر السطحي غير أيوني) إلى بئر شريحة الغرفة واخلطها. احتضن أكثر من 30 دقيقة في RT.
- اغسل الحجرة برفق بماء فائق النقاء مرتين وجففها.
ملاحظة: الغرفة جاهزة للاستخدام في التجربة.
7. تجربة تباين الخواص الفلورية أحادية الجزيء
- أولا ، قم بمعايرة أداة smFA. تحديد دالة استجابة الأداة ، إما عن طريق قياس ضوء رامان المتناثر أو عن طريق قياس مضان صبغة ذات عمر قصير وطيف انبعاث مناسب (على سبيل المثال ، إريثروسين أو ملكيت أخضر) مروية بالإضافة إلى محلول يوديد البوتاسيوم المشبع ، KI.
- لتصحيح تألق الخلفية ، قم بإجراء قياسات لمحلول عازل. معايرة الحساسية النسبية للكاشفات المتوازية والعمودية (عامل G) عن طريق الحصول على البيانات من صبغة سريعة الدوران. هنا ، تم استخدام 2 نانومتر Rhodamine 110 لمعايرة أجهزة الكشف60.
- بالنسبة لتجارب smFA على FoxP1 الأحادي ، أضف 100 جزء من الملتر FoxP1 المسمى BODIPY و 100 نانومتر FoxP1 غير المسمى إلى 500 ميكرولتر من المخزن المؤقت القياسي (20 ملي مولار HEPES ، 20 ملي كلوريد الصوديوم ، الرقم الهيدروجيني 7.8) في شريحة الغرفة.
- لاختبار المعايرة بالتحليل الحجمي باستخدام الحمض النووي وFoxP1 الأحادي، أضف 400 نانومتر من الحمض النووي إلى 100 جزء من المليون من مزيج البروتين غير المسمى ب BODIPY/100 نانومتر واحتضانه في RT لمدة 10 دقائق.
- بالنسبة لتجارب smFA على FoxP1 الثنائي ، أضف 500 نانومتر FoxP1 غير المسمى إلى 100 جزء من المليون FoxP1 المسمى BODIPY في المخزن المؤقت القياسي. بعد ذلك ، احتضن عند 37 درجة مئوية لمدة 30 دقيقة.
- لاختبار المعايرة بالتحليل الحجمي باستخدام الحمض النووي وثنائي FoxP1 ، أضف 2000 نانومتر من الحمض النووي إلى 100 جزء من الملاط من مزيج البروتين غير المسمى ب BODIPY / 500 نانومتر غير المسمى واحتضانه في RT لمدة 10 دقائق.
- ابدأ القياسات وتحقق في برنامج BIFL من أن مقدار الرشقات في سجل 30 ثانية يتراوح بين 60-90. إذا كانت العينة أكثر تركيزا ، فقم بتخفيفها حتى تصل إلى تلك القيمة. تضمن هذه الخطوة ظروف الجزيء الواحد.
- ابدأ smFA كل قياس إما ل FoxP1 الأحادي أو FoxP1 الخافت في حالة عدم وجود أو وجود الحمض النووي لمدة 4 ساعات على الأقل.
- تحليل قياسات SMFA كما تمت مناقشته في القسم 4.
النتائج
ينشأ تباين التألق من الاتجاه النسبي لامتصاص الفلوروفور ولحظات ثنائي القطب الانبعاث. عندما تتعرض الفلوروفورات للضوء المستقطب ، يتم إثارة الفلوروفورات ذات لحظات انتقال الامتصاص المتوافقة مع متجه المجال الكهربائي للضوء الساقط بشكل تفضيلي (اختيار الصور). وبالتالي ، يصبح سكان الحالة المتحمسة موجهين جزئيا ، مع وجود جزء كبير من الجزيئات المثارة للحظات انتقالية تتماشى مع متجه المجال الكهربائي للضوء المثيرالمستقطب 61. تدور الفلوروفورات بسبب حركتها البراونية. وبالتالي ، فإن لحظة انتقال الانبعاث تدور أيضا ، مما يؤدي إلى اعتماد الوقت على تباين الخواص الفلورية. يمكن استخدام هذا التأثير لقياس الحركات الدورانية لجزيئات الفلورسنت ، واكتشاف أحداث الارتباط ، وتوصيف بيئة الفلوروفور ، والتقاط الديناميكيات الجزيئية.
تستعد تجارب الجزيء الفردي بشكل فريد لتحديد عدم تجانس العينة. تضيف الاستفادة من حساسية الجزيء الفردي وتباين الخواص الفلورية بعدا آخر للتحليل الطيفي الفلوري متعدد المعلمات. في المجهر متحد البؤر النموذجي أحادي الجزيء (الشكل 2) 20،21 ، يمكن تحديد تباين الخواص الفلوري عن طريق الكثافة أو الحل الزمني عند استخدام الليزر النبضي.
للنظر في تأثيرات إزالة الاستقطاب لهدف الفتحة العددية العالية في المجهر متحد البؤر62 ، يتم إعطاء الشكل الصحيح لتباين الخواص الذي تم حله بمرورالوقت 35،63 بواسطة
 (1)
(1)
أين 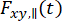 وتكون
وتكون  شدة التألق التي تم حلها بمرور الوقت في قناة الكشف y-th بعد الإثارة عند الطول الموجي x ، للاستقطاب المتوازي والعمودي l1 و l2 وهي عوامل تصف الاختلاط بين الإشارات المتوازية والعمودية بسبب هدف الفتحة العددية العالية (NA) المستخدم في هذه القياسات35، 62 ، 64. يتم تصحيح الاختلافات في كفاءات الكشف لقناة الكشف المتوازية
شدة التألق التي تم حلها بمرور الوقت في قناة الكشف y-th بعد الإثارة عند الطول الموجي x ، للاستقطاب المتوازي والعمودي l1 و l2 وهي عوامل تصف الاختلاط بين الإشارات المتوازية والعمودية بسبب هدف الفتحة العددية العالية (NA) المستخدم في هذه القياسات35، 62 ، 64. يتم تصحيح الاختلافات في كفاءات الكشف لقناة الكشف المتوازية 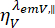 والعمودية ،
والعمودية ، 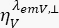 للصبغة مع نسبة كفاءات الكشف ،
للصبغة مع نسبة كفاءات الكشف ،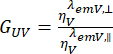 . يشار إلى GUV أيضا باسم عامل G.
. يشار إلى GUV أيضا باسم عامل G.
يمكن نمذجة تباين الخواص الفلورية التي تم حلها بمرور الوقت باستخدام اضمحلال متعدد الأس لحساب ارتباط الفلوروفور بجزيء حيوي أكبر مثل
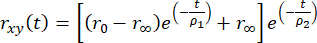 , (2)
, (2)
حيث R0 هو تباين أساسي يعتمد على الفلوروفور (عادة R0 = 0.38) ، R ∞ هو تباين الخواص المتبقي ، و ρ1 و ρ2 سريعان (حركات محلية للفلوروفور) وبطيئة (الحركة العالمية للجزيء الكبير) أوقات ارتباط دوراني ، على التوالي.
في قياسات تباين الخواص أحادي الجزيء (الشكل 2) ، يتم تسجيل أوقات وصول الفوتون لتحديد البواعث الفردية باستخدام تحليل عمر التألق المتكامل للانفجار (BIFL)33،35. يتم تنعيم أوقات وصول الفوتون بين الفوتون (Δt) باستخدام متوسط تشغيل ثم رسمها للمساعدة في التصور. تم تجهيز الرسم البياني لهذه الأوقات بنصف غاوسي لتحديد المتوسط والانحراف المعياري للفوتونات الناشئة من الخلفية. يتم استخدام عتبة تعسفية ، محددة عند مضاعفات الانحراف المعياري ، لتصفية الأحداث الفردية أثناء تحديد الفوتونات الأولى والأخيرة في كل رشقة. ثم يتم دمج الفوتونات داخل كل انفجار لمزيد من التحليل ، والذي يتضمن حساب تباين الخواص الفلورية للحالة المستقرة التي تم حلها بالوقت والقائمة على الشدة باستخدام المعادلتين 1 و 2 أو عبر مقدر الاحتماليةالقصوى 35. نظرا للعدد المحدود من الفوتونات في أحداث الجزيء الفردي ، فإن مقدر الاحتمالية القصوى يأخذ في الاعتبار مكونا أسيا واحدا فقط ولن تتم مناقشته أكثر.
في الرسم البياني ثنائي الأبعاد لأحداث الجزيء الفردي ، يمكن ربط متوسط عمر التألق (τ) وتباين الخواص (rxy) بواسطة معادلة بيرين29،61 للحصول على (ρ) كمتوسط وقت دوران.
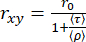 (3)
(3)
يمكن الحصول على قيم ρ محددة بيقين أعلى من خلال تحليل "المجموعة الفرعية" (se) حيث يتم دمج فوتونات الانفجارات المختلفة في اضمحلال تباين الخواص الفلوري الذي تم حله بمرور الوقت والذي يمكن تحليله عن طريق تحسين معلمات المعادلة 2 للاضمحلال التجريبي (seTRFA). يمكن أن يحل تباين الخواص الذي تم حله بمرور الوقت عدم التجانس والديناميكيات المرتبطة بالحركات الدورانية (المحلية والعالمية) للجزيئات الحيوية ضمن انبعاث التألق الذي يحدث خلال الإطار الزمني ل ns.
للكشف عن الديناميكيات داخل أحداث الجزيء الفردي (على مقياس دون المللي ثانية) ، قدمنا تحليل تباين الاندفاع الذي تم حله بمرور الوقت (traBVA) 57. في traBVA ، بالنسبة لانفجار الفوتون الذي يحتوي على مقاطع فوتونية متتالية Mi ، يكون تباين تباين التباين الزائد (s2) للرشقات النارية هو
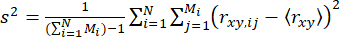 . (4)
. (4)
بالنسبة لحالة متباينة الخواص ، ينشأ التباين σ2 فقط من ضوضاء اللقطة65 (sn: √N ، حيث N هو عدد الفوتونات)
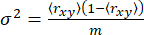 (5)
(5)
حيث m هو عدد الفوتونات في انفجار. ومن ثم ، لتحديد التباين الإضافي في تباين الخواص ، يمكننا تحديد تباين تباين التباين الزائد (S2) بسبب عدم التجانس التوافقي كفرق بين المعادلتين 4 و 5.
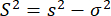 (6)
(6)
لالتقاط الديناميكيات التي تحدث في مراقبة الجزيئات الفردية والنظر في تقريب التباين ، يمكن استخدام تحليل توزيع الفوتون الديناميكي (daPDA) 55،56 . في daPDA ، يتم نمذجة شدة التألق باتباع احتمال شرطي (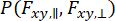 ) معبرا عنه كتوزيع ذي حدين.
) معبرا عنه كتوزيع ذي حدين.
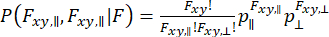 (7)
(7)
معا ، مع تقدير معدل العد الخلفي الذي يتبع توزيع بواسون
 (8)
(8)
أين 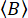 هو متوسط عدد فوتونات الخلفية لكل نافذة زمنية محددة. يمكن قياس الخلفية المتوازية والعمودية ،
هو متوسط عدد فوتونات الخلفية لكل نافذة زمنية محددة. يمكن قياس الخلفية المتوازية والعمودية ، 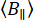 و
و 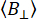 ، باستخدام عينات المخزن المؤقت كمرجع. تم تحسين تباين الخواص الفلورية المحددة تجريبيا عن طريق تقليل رقم الجدارة χ2 مع توزيع شدة التألق لكل قناة استقطاب يمكن أن تتضمن تغيرات حركية.
، باستخدام عينات المخزن المؤقت كمرجع. تم تحسين تباين الخواص الفلورية المحددة تجريبيا عن طريق تقليل رقم الجدارة χ2 مع توزيع شدة التألق لكل قناة استقطاب يمكن أن تتضمن تغيرات حركية.
وتوفر إجراءات التحليل وتمثيل البيانات المقدمة نهجا شاملا لتفسير البيانات التي تم جمعها. على الرغم من أن هذا البروتوكول يركز بشكل أساسي على القياسات متحدة البؤر ، والتي تكون محدودة في التقاط تغيرات تباين الخواص من نانوثانية إلى مللي ثانية ، فمن الممكن اعتماد مجهر الانعكاس الداخلي الكلي لمراقبة تباين الخواص الفلورية على مدى فترات زمنية أطول ، مما يتيح تحليل السلاسلالزمنية 66. بالنسبة للقياسات أحادية الجزيء متحد البؤر ، نسلط الضوء على استخدام الرسوم البيانية متعددة الأبعاد التي تخلق بصمة فريدة للمجموعة المرصودة. يمكن أن يتتبع اضمحلال التألق الذي تم حله بمرور الوقت ، والذي أعيد بناؤه من مجموعات مختارة ، تطور تباين التألق على مقياس النانو ثانية (الشكل 3). يمكن لتحليل توزيع الفوتون55،56 وتحليل تباين الانفجار (BVA) 57،58 أيضا التقاط الديناميكيات في نطاقات زمنية متوسطة بين الاضمحلال الذي تم حله بمرور الوقت والرسوم البيانية متعددة الأبعاد. في حين أن هذا البروتوكول لا يغطي استخدام التحليل الطيفي لارتباط التألق الاستقطاب (FCS) ، مع أو بدون الإثارة النبضية67،68 ، والتي يمكن أن تربط بين النانو ثانية إلى المللي ثانية ، يمكن استخدام نفس البيانات لحساب FCS69 ، على الرغم من أن هذا يقع خارج نطاق البروتوكول المقدم. إذا تم إجراء مثل هذه التجارب ، يوصى بوقت أطول لقياس العينة.
تم تطبيق هذا النهج على نظام معقد مثل بروتينات FoxP البشرية ، مما يوفر رؤى قيمة حول الحركات التي تنطوي عليها آلية عملها. بروتينات FoxP هي عوامل نسخ تشارك في العديد من الجوانب الفسيولوجية مثل نمو الدماغ والرئة. الأهم من ذلك ، تم التعرف على الطفرات المختلفة على أنها تضعف وظيفة هذه البروتينات70،71. باستخدام مجال ربط الحمض النووي ل FoxP1 كنموذج ، قمنا بإنشاء طفرات مختلفة أحادية السيستين لتقديم صبغة BODIPY-FL كمتتبع للحركات (الشكل 4 أ). في الواقع ، قمنا بتقييم تأثير dimerization وربط الحمض النووي كمنظمين هيكليين رئيسيين لهذا البروتين. باستخدام نهج smFA ، قمنا بإنشاء مخططات 2D-smFA وصنعنا traBVA و daPDA لكل طفرة في ظروف أحادية وثنائية. نعرض مثالا لأحد الطفرات الفردية التي تمت دراستها (الشكل 4). يتشابه سلوك تباين الخواص في جميع الطفرات من حيث تحديد أوقات ارتباط الدوران العالية والمنخفضة ، وبالتالي ، المجموعات المفترضة والمضطربة والمطوية. ومع ذلك ، فهو أيضا غير متجانس للغاية في جميع الطفرات من حيث الكسر والحركية لكل مجموعة ، مما يدل على تغييرات انتقال مختلفة من ترتيب إلى اضطراب تتأثر بالختاث وربط الحمض النووي ، ويظهر الوصف بدقة عالية للديناميكيات الهيكلية على طول السلسلة (الشكل 5).
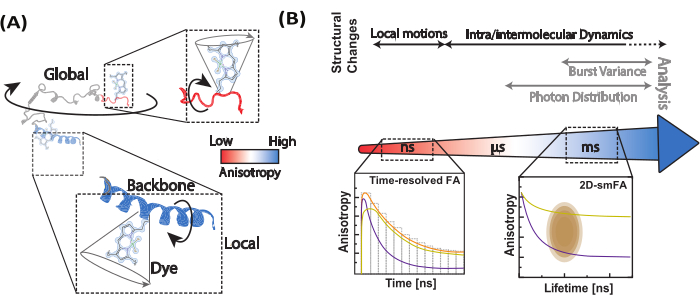
الشكل 1: النطاق الديناميكي للجزيئات الحيوية وطرق تباين الخواص الفلورية. (أ) تباين الخواص للفلوروفورات الصغيرة المربوطة بمواقع مختلفة على طول العمود الفقري للجزيء الحيوي ذي الاهتمام يعلم الديناميكيات الهيكلية المحلية. (ب) المقاييس الزمنية التي تم فحصها بواسطة اضمحلال شدة التألق (تباين الخواص الفلورية الذي تم حله بمرور الوقت ، FA) والرسوم البيانية أحادية الجزيء لبيانات المجهر أحادي الجزيء متحد البؤر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
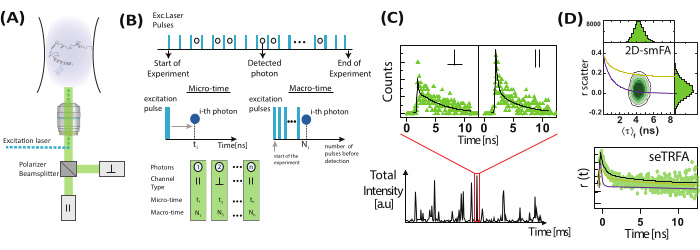
الشكل 2: تسجيل ومعالجة بيانات تباين الخواص الفلورية أحادية الجزيء. (أ) يتم تحليل الجزيئات المنتشرة بحرية باستخدام مجهر أحادي الجزيء متحد البؤر مزود بليزر إثارة مستقطب خطي واحد (أزرق في حالتنا). يتم الكشف عن انبعاث التألق (أخضر في حالتنا) بواسطة كاشفين بعد أن يقسم مستقطب الشعاع الإشارة إلى استقطابين (متوازي ،  وعمودي ،
وعمودي ،  لمصدر الإثارة). (ب) يتميز كل فوتون تم اكتشافه بثلاث معلمات: الوقت الجزئي ، والوقت الكلي ، ونوع القناة. يتم تخزين البيانات بتنسيق72 بتنسيق Time-Tagged Time-Solve-Solution (TTTR). (ج) يتم اختيار رشقات نارية من الجزيئات الفردية ومعالجتها لاستخراج معلمات التألق ، بما في ذلك تباين الخواص الفلوري لكل جزيء مرصود. (د) يتم تمثيل البيانات بطرق متعددة ، بما في ذلك المخططات ثنائية الأبعاد لتباين الخواص الفلوري مقابل عمر التألق واضمحلال تباين الخواص الذي تم حله بمرور الوقت. تسمح هذه التمثيلات بالتحديد البصري والكمي لعمر التألق ، وأوقات الارتباط الدوراني ، وعدم تجانس النظام. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
لمصدر الإثارة). (ب) يتميز كل فوتون تم اكتشافه بثلاث معلمات: الوقت الجزئي ، والوقت الكلي ، ونوع القناة. يتم تخزين البيانات بتنسيق72 بتنسيق Time-Tagged Time-Solve-Solution (TTTR). (ج) يتم اختيار رشقات نارية من الجزيئات الفردية ومعالجتها لاستخراج معلمات التألق ، بما في ذلك تباين الخواص الفلوري لكل جزيء مرصود. (د) يتم تمثيل البيانات بطرق متعددة ، بما في ذلك المخططات ثنائية الأبعاد لتباين الخواص الفلوري مقابل عمر التألق واضمحلال تباين الخواص الذي تم حله بمرور الوقت. تسمح هذه التمثيلات بالتحديد البصري والكمي لعمر التألق ، وأوقات الارتباط الدوراني ، وعدم تجانس النظام. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
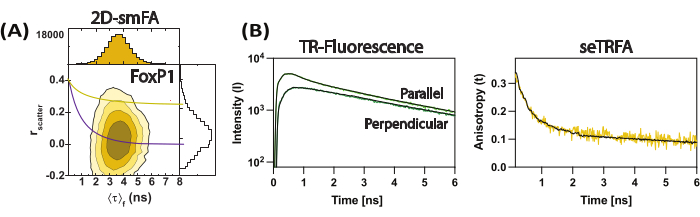
الشكل 3: البيانات التمثيلية لثنائي FoxP1 الذي تم تبديل نطاقه. (أ) ارتباط تباين الخواص الفلورية (مبعثر r) مع متوسط عمر التألق لكل جزيء كمؤامرة كفافية. تراكب معادلة بيرين واحدة لمكونين دورانيين كممثل لمتوسط المجموعة للجزيء ، مع الأخذ في الاعتبار ρ1 و ρ2 من 0.2 ns و 8.5 ns ، على التوالي. (ب) تستخدم تحلل التألق الذي تم حله زمنيا للمجموعة الفرعية لحساب تباين الخواص الفلورية التي تم حلها بمرور الوقت للعينة. التوافق مع المعادلة 2 حل المكونات المحلية والعالمية لتباين الخواص الفلوري. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
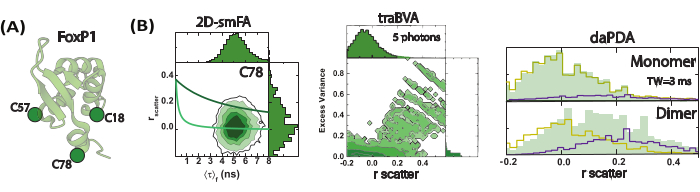
الشكل 4: مراقبة ديناميكيات FoxP1 دون المللي ثانية باستخدام تباين الخواص الفلورية أحادي الجزيء (smFA). (أ) تمثيل كرتوني لهيكل FoxP1 الأحادي. (ب) يوضح الرسم البياني ثنائي الأبعاد عدم التجانس الديناميكي ، ويكشف عن زمن ارتباط دوراني متميز تم تحديدهما من خلال تباين الخواص الفلوري الذي تم حله بمرور الوقت. يكشف تحليل تباين الانفجار الذي تم حله بمرور الوقت (traBVA) عن مجموعة فرعية صغيرة من الأحداث ذات التباين الزائد (المعادلة 6) التي تظهر تباين كبير. يعمل تحليل تباين الخواص الديناميكي الكمي باستخدام تحليل توزيع الفوتون (PDA) على استخراج أسعار الصرف لهذه العملية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
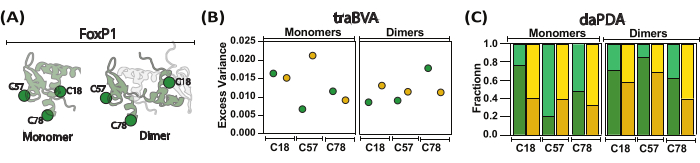
الشكل 5: فحص الحركات المحلية والعالمية ل FoxP1 أثناء التعتيم. (أ) يقارن تمثيل الرسوم المتحركة FoxP1 الأحادي بشكله الخافت. (ب) يظهر متوسط التباين الزائد لكل موقع في ظل ظروف أحادية وظروف ثنائية ، مع تباين زائد أكبر يشير إلى تغيرات أكثر دلالة في تباين الخواص. (ج) يساعد تحليل تباين الخواص الديناميكي باستخدام تحليل توزيع الفوتون (PDA) في تحديد الكسور السكانية (تباين الخواص العالي في الألوان الداكنة وتباين منخفض في اللون الفاتح) في غياب (أخضر) ووجود (أصفر) للحمض النووي. في هذا النهج ، تم تقدير المعدلات (غير المعروضة) للتحولات بين السلوكيات المحلية والعالمية ، مما يكشف أن FoxP1 يخضع للتطور الجزئي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
بالنسبة لتجارب تباين الخواص الفلورية أحادية الجزيء ، من الضروري النظر في الخصائص الضوئية الفيزيائية للفلوروفور المختار بعناية. تشمل هذه الخصائص الطول الموجي للانبعاث ، والذي يجب أن يتماشى مع نظام الكشف ، والطول الموجي للإثارة ، والذي يجب أن يكون متوافقا مع الليزر النبضي المتاح. لتحسين النطاق الديناميكي ، يجب أن يكون للفلوروفور عمر مضان طويل بالنسبة لوقت الانتشار الدوراني للجزيء. هذا أمر بالغ الأهمية لتتبع ديناميكيات الدوران وارتباط / اتجاه ثنائي القطب الفلوروفوري بالنسبة للجزيء الحيوي المعني. بالإضافة إلى ذلك ، يعد السطوع والثبات الضوئي والعائد الكمي ضروريين لإنتاج إشارات قوية مع نسبة إشارة إلى ضوضاء مستقرة. لهذه الأسباب ، تم اختيار BODIPY-FL باعتباره الفلوروفور في العديد من الدراسات39،40،42.
غالبا ما يتطلب فحص ديناميكيات العمود الفقري للجزيئات الحيوية وضع العلامات على البروتين ، والذي يتم تحقيقه عادة من خلال وضع العلامات الخاصة بالموقع. يتم ذلك عادة عن طريق إدخال بقايا للتعديل الكيميائي المستهدف. النهج الأكثر شيوعا هو إدخال السيستين في مواقع الاهتمام ، حيث يمكن تعديل سلاسل جانب الثيول بشكل انتقائي باستخدام كواشف مثل maleimides أو iodoacetamides. أقل شيوعا ، يتم استخدام هاليدات البنزيل والكيتونات البروميثيل لتكوين روابط ثيوثير. يمكن أيضا استهداف سلاسل الأحماض الأمينية الجانبية الأخرى ، ولكن وفرة البروتينات أقل استخداما. ومع ذلك ، يمكن أيضا استخدام الأساليب البديلة ، مثل الأحماض الأمينية غير الطبيعية، 73. يعد اختيار الموقع المناسب لوضع العلامات أمرا بالغ الأهمية لتقليل التداخل مع الجزيء الحيوي قيد الدراسة ، ويجب أن تكون الضوابط المناسبة. على سبيل المثال ، إذا تم استخدام الجزيء المسمى في فحوصات الربط ، فيجب أن تتحقق الطرق التكميلية الخالية من الملصقات من أن الفلوروفورات لا تؤثر على تقارب الارتباط.
بعد تحديد العينة المناسبة وتنفيذ استراتيجية وضع العلامات المثلى ، تتمثل الخطوة التالية في التأكد من محاذاة المجهر متحد البؤر ومعايرته بشكل صحيح لتجارب الجزيء الواحد. يصف البروتوكول كيفية تحديد العامل المطلوب لمزيد من التحليل. بمجرد معايرة الأداة ، فإن الخطوة التالية هي قياس العينة ومعالجة البيانات لاستخراج أكبر قدر ممكن من المعلومات من الفوتونات المكتشفة. يمكن استخدام المعلمات الرئيسية ، مثل الوقت الجزئي ، والوقت الكلي ، ونوع القناة ، كما هو موضح في الشكل 2 ، لمزيد من التحليل والتصور باستخدام إلكترونيات TCSPC النموذجية.
يمكن استخدام التطورات الحديثة في التحليل الطيفي الفلوري أحادي الجزيء على نطاق واسع لدراسة المعلومات الهيكلية من المجموعات غير المتجانسة للجزيئات الحيوية. ومع ذلك ، فإن عددا قليلا نسبيا من الدراسات يستفيد من الرؤى التي يوفرها تباين الخواص الفلورية ، ومطلوب نموذج بروتين كامل لاشتقاق الديناميكيات الهيكلية للجزيئات الحيوية. لذلك ، فإن كشف ديناميكيات التفاعلات بين المجالات والبروتين والبروتين للعديد من عوامل النسخ يمثل تحديا.
في الختام ، تقدم تجارب تباين الخواص الفلورية أحادية الجزيء معلومات تكميلية حول الحركات المحلية والعالمية للعمود الفقري الجزيئي الحيوي ، والتي تعتبر ضرورية لفهم وظيفتها.
Disclosures
يعلن جميع المؤلفين أنه ليس لديهم مصالح مالية متنافسة مع محتويات هذه المقالة.
Acknowledgements
تم دعم هذا العمل من خلال منح FONDECYT 11200729 و FONDEQUIP EQM200202 إلى EM و NIH R15CA280699 R01GM151334 و NSF CAREER MCB 1749778 جوائز ل HS. أقرت NK بالدعم المقدم من برنامج زمالة ما بعد الدكتوراه بجامعة كليمسون.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 | ThermoFisher Scienctific | A20100 | https://www.thermofisher.com/order/catalog/product/A20100?SID=srch-srp-A20100 |
| Amicon Ultra Centrifugal Filter, 10 kDa MWCO | Millipore Sigma | UFC901008 | https://www.sigmaaldrich.com/US/en/product/mm/ufc9010 |
| Ampicillin sodium salt | Millipore Sigma | A0166-5G | https://www.sigmaaldrich.com/US/en/product/sigma/a0166 |
| BODIP FL Maleimide (BODIPY FL N-(2-Aminoethyl))Maleimide) | ThermoFisher Scienctific | B10250 | https://www.thermofisher.com/order/catalog/product/B10250?SID=srch-srp-B10250 |
| Disposable PD 10 Desalting Columns | Millipore Sigma | GE17-0851-01 | https://www.sigmaaldrich.com/US/en/product/sigma/ge17085101 |
| Dithiothreitol | Millipore Sigma | 10197777001 | https://www.sigmaaldrich.com/US/en/product/roche/dttro |
| DMSO, Anhydrous | ThermoFisher Scienctific | D12345 | https://www.thermofisher.com/order/catalog/product/D12345?SID=srch-srp-D12345 |
| DNAse | Millipore Sigma | 10104159001 | https://www.sigmaaldrich.com/US/en/product/roche/10104159001 |
| E. coli C41 bacterial cells | Invitrogen | ||
| Foresigh Nuvi Ni-Charged IMAC, 5 mL column | Bio-Rad | 12004037 | https://www.bio-rad.com/en-us/sku/12004037-foresight-nuvia-ni-charged-imac-5-ml-column?ID=12004037 |
| HEPES | Millipore Sigma | 7365-45-9 | https://www.sigmaaldrich.com/US/en/product/sigma/h3375 |
| Imidazole | Millipore Sigma | 288-32-4 | https://www.sigmaaldrich.com/US/en/product/sigma/i5513 |
| IPTG | Millipore Sigma | I6758-1G | https://www.sigmaaldrich.com/US/en/product/sial/i6758 |
| MCE Membrane Filter, 0.22 μm Pore Size | Millipore Sigma | GSWP02500 | https://www.sigmaaldrich.com/US/en/product/mm/gswp02500 |
| NaCl | Millipore Sigma | 7647-14-5 | https://www.sigmaaldrich.com/US/en/product/sigma/s3014 |
| Nunc Lab-Tek II Chamber Slide System | ThermoFisher Scienctific | 154534 | https://www.thermofisher.com/order/catalog/product/154534 |
| OverExpress C41(DE3) Chemically Competent Cells | Millipore Sigma | CMC0017-20X40UL | https://www.sigmaaldrich.com/US/en/product/sigma/cmc0017 |
| PMSF | Millipore Sigma | 329-98-6 | https://www.sigmaaldrich.com/US/en/product/sigma/78830 |
| Rhodamine 110 | ThermoFisher Scienctific | 419075000 | https://www.thermofisher.com/order/catalog/product/419075000?SID=srch-hj-419075000 |
| Sodium phosphate dibasic | Millipore Sigma | 7558-79-4 | https://www.sigmaaldrich.com/US/en/product/sigma/s3264 |
| Sodium phosphate monobasic dihydrate | Millipore Sigma | 13472-35-0 | https://www.sigmaaldrich.com/US/en/product/sigma/71505 |
| TCEP, Hydrochloride, Reagent Grade | Millipore Sigma | 580567-5GM | https://www.sigmaaldrich.com/US/en/product/mm/580567 |
| Tween 20 | Millipore Sigma | 11332465001 | https://www.sigmaaldrich.com/US/en/product/roche/11332465001 |
References
- Cooper, A. Thermodynamic fluctuations in protein molecules. Proc Natl Acad Sci U S A. 73 (8), 2740-2741 (1976).
- Volozhin, S. I. Inguinal hernia in cryptorchism. Khirurgiia (Mosk). 450 (7), 69-71 (1975).
- Henzler-Wildman, K. A., et al. Intrinsic motions along an enzymatic reaction trajectory. Nature. 450 (7171), 838-844 (2007).
- Karplus, M., Mccammon, J. A. The internal dynamics of globular-proteins. CRC Crit Rev Biochem. 9 (4), 293-349 (1981).
- Ishima, R., Torchia, D. A. Protein dynamics from nmr. Nat Struct Biol. 7 (9), 740-743 (2000).
- Fernandez, F. J., Querol-Garcia, J., Navas-Yuste, S., Martino, F., Vega, M. C. X-ray crystallography for macromolecular complexes. Adv Exp Med Biol. 3234, 125-140 (2024).
- Bai, X. C., Mcmullan, G., Scheres, S. H. How cryo-EM is revolutionizing structural biology. Trends Biochem Sci. 40 (1), 49-57 (2015).
- Wright, P. E., Dyson, H. J. Intrinsically unstructured proteins: Re-assessing the protein structure-function paradigm. J Mol Biol. 293 (2), 321-331 (1999).
- Tompa, P. Intrinsically unstructured proteins. Trends Biochem Sci. 27 (10), 527-533 (2002).
- Dyson, H. J., Wright, P. E. Intrinsically unstructured proteins and their functions. Nat Rev Mol Cell Biol. 6 (3), 197-208 (2005).
- Csermely, P., Palotai, R., Nussinov, R. Induced fit, conformational selection and independent dynamic segments: An extended view of binding events. Trends Biochem Sci. 35 (10), 539-546 (2010).
- Camacho-Zarco, A. R., et al. NMR provides unique insight into the functional dynamics and interactions of intrinsically disordered proteins. Chem Rev. 122 (10), 9331-9356 (2022).
- Drenth, J. Principles of Protein X-Ray Crystallography. , Springer, Verlag. New York, NY. (2007).
- Loeb, H. Systematic diagnosis of chronic diarrhea in infants and small children. Kinderarztl Prax. 44 (1), 36-41 (1976).
- Ellaway, J. I. J., et al. Identifying protein conformational states in the protein data bank: Toward unlocking the potential of integrative dynamics studies. Struct Dyn. 11 (3), 034701(2024).
- Berjanskii, M. V., Wishart, D. S. A simple method to predict protein flexibility using secondary chemical shifts. J Am Chem Soc. 127 (43), 14970-14971 (2005).
- Puthenveetil, R., Vinogradova, O. Solution NMR: A powerful tool for structural and functional studies of membrane proteins in reconstituted environments. J Biol Chem. 294 (44), 15914-15931 (2019).
- Wozniak, A. K., Schroder, G. F., Grubmuller, H., Seidel, C. A., Oesterhelt, F. Single-molecule fret measures bends and kinks in DNA. Proc Natl Acad Sci U S A. 105 (47), 18337-18342 (2008).
- Weidtkamp-Peters, S., et al. Multiparameter fluorescence image spectroscopy to study molecular interactions. Photochem Photobiol Sci. 8 (4), 470-480 (2009).
- Sisamakis, E., Valeri, A., Kalinin, S., Rothwell, P. J., Seidel, C. A. M. Accurate single-molecule FRET studies using multiparameter fluorescence detection. Methods Enzymol. 475, 455-514 (2010).
- Kalinin, S., et al. A toolkit and benchmark study for fret-restrained high-precision structural modeling. Nat Methods. 9 (12), 1218-1225 (2012).
- Peulen, T. O., Opanasyuk, O., Seidel, C. aM. Combining graphical and analytical methods with molecular simulations to analyze time-resolved fret measurements of labeled macromolecules accurately. J Phys Chem B. 121 (35), 8211-8241 (2017).
- Hamilton, G. L., Sanabria, H. Multiparameter Fluorescence Spectroscopy of Single Molecules. Spectroscopy and Dynamics of Single Molecules. , Elsevier. Cambridge, MA. (2019).
- Kolimi, N., et al. Out-of-equilibrium biophysical chemistry: The case for multidimensional, integrated single-molecule approaches. J Phys Chem B. 125 (37), 10404-10418 (2021).
- Felekyan, S., Sanabria, H., Kalinin, S., Kuhnemuth, R., Seidel, C. A. Analyzing forster resonance energy transfer with fluctuation algorithms. Methods Enzymol. 519, 39-85 (2013).
- Medina, E. D. R. L., Sanabria, H. Unraveling protein's structural dynamics: From configurational dynamics to ensemble switching guides functional mesoscale assemblies. Curr Opin Struct Biol. 66, 129-138 (2021).
- Aznauryan, M., et al. Comprehensive structural and dynamical view of an unfolded protein from the combination of single-molecule FRET, NMR, and SAXS. Proc Natl Acad Sci U S A. 113 (37), E5389-E5398 (2016).
- Gomes, G. W., et al. Conformational ensembles of an intrinsically disordered protein consistent with NMR, SAXS, and single-molecule fret. J Am Chem Soc. 142 (37), 15697-15710 (2020).
- Perrin, F. Polarisation de la lumière de fluorescence. Vie moyenne des molécules dans l'etat excité. J phys radium. 7 (12), 390-401 (1926).
- Weber, G. Polarization of the fluorescence of macromolecules. I. Theory and experimental method. Biochem J. 51 (2), 145-155 (1952).
- Weber, G. Polarization of the fluorescence of macromolecules. II. Fluorescent conjugates of ovalbumin and bovine serum albumin. Biochem J. 51 (2), 155-167 (1952).
- Jameson, D. M., Ross, J. A. Fluorescence polarization/anisotropy in diagnostics and imaging. Chem Rev. 110 (5), 2685-2708 (2010).
- Eggeling, C., Fries, J. R., Brand, L., Gunther, R., Seidel, C. A. Monitoring conformational dynamics of a single molecule by selective fluorescence spectroscopy. Proc Natl Acad Sci U S A. 95 (4), 1556-1561 (1998).
- Fries, J. R., Brand, L., Eggeling, C., Köllner, M., Seidel, C. aM. Quantitative identification of different single molecules by selective time-resolved confocal fluorescence spectroscopy. Journal of Physical Chemistry A. 102 (33), 6601-6613 (1998).
- Schaffer, J., et al. Identification of single molecules in aqueous solution by time-resolved fluorescence anisotropy. Journal of Physical Chemistry A. 103 (3), 331-336 (1999).
- Widengren, J., et al. Single-molecule detection and identification of multiple species by multiparameter fluorescence detection. Anal Chem. 78 (6), 2039-2050 (2006).
- Gradinaru, C. C., Marushchak, D. O., Samim, M., Krull, U. J. Fluorescence anisotropy: From single molecules to live cells. Analyst. 135 (3), 452-459 (2010).
- Mazal, H., Haran, G. Single-molecule fret methods to study the dynamics of proteins at work. Curr Opin Biomed Eng. 12, 8-17 (2019).
- Tsytlonok, M., et al. Specific conformational dynamics and expansion underpin a multi-step mechanism for specific binding of p27 with cdk2/cyclin a. J Mol Biol. 432 (9), 2998-3017 (2020).
- Tsytlonok, M., et al. Dynamic anticipation by cdk2/cyclin a-bound p27 mediates signal integration in cell cycle regulation. Nat Commun. 10 (1), 1676(2019).
- Cruz, P., et al. Domain tethering impacts dimerization and DNA-mediated allostery in the human transcription factor foxp1. J Chem Phys. 158 (19), (2023).
- Kolimi, N., et al. DNA controls the dimerization of the human foxp1 forkhead domain. Cell Rep Phys Sci. 5 (3), 101854(2024).
- Yanez Orozco, I. S., et al. Identifying weak interdomain interactions that stabilize the supertertiary structure of the n-terminal tandem PDZ domains of PSD-95. Nat Commun. 9 (1), 3724(2018).
- Elson, E. L., Magde, D. Fluorescence correlation spectroscopy. I. Conceptual basis and theory. Biopolymers. 13 (1), 1-27 (1974).
- Rigler, R., Elson, E. S. Fluorescence Correlation Spectroscopy: Theory and Applications. , Springer. Berlin, Heidelberg. (2012).
- Aragon, S. R., Pecora, R. Fluorescence correlation spectroscopy as a probe of molecular-dynamics. J Chem Phys. 64 (4), 1791-1803 (1976).
- Mockel, C., et al. Integrated NMR, fluorescence, and molecular dynamics benchmark study of protein mechanics and hydrodynamics. J Phys Chem B. 123 (7), 1453-1480 (2019).
- Shu, W., Yang, H., Zhang, L., Lu, M. M., Morrisey, E. E. Characterization of a new subfamily of winged-helix/forkhead (Fox) genes that are expressed in the lung and act as transcriptional repressors. J Biol Chem. 276 (29), 27488-27497 (2001).
- Co, M., Anderson, A. G., Konopka, G. Foxp transcription factors in vertebrate brain development, function, and disorders. Wiley Interdiscip Rev Dev Biol. 9 (5), e375(2020).
- Takahashi, H., Takahashi, K., Liu, F. -C. FOXP Genes, Neural Development, Speech and Language Disorders. Forkhead Transcription Factors: Vital Elements in Biology and Medicine. , Springer. New York, NY. (2009).
- Wang, B., Lin, D., Li, C., Tucker, P. Multiple domains define the expression and regulatory properties of foxp1 forkhead transcriptional repressors. J Biol Chem. 278 (27), 24259-24268 (2003).
- Leake, M. C., Quinn, S. D. A guide to small fluorescent probes for single-molecule biophysics. Chem Phys Rev. 4 (1), 011302(2023).
- Zhang, H., Wu, Q., Berezin, M. Y. Fluorescence anisotropy (polarization): From drug screening to precision medicine. Expert Opin Drug Discov. 10 (11), 1145-1161 (2015).
- Ma, J., et al. High precision fret at single-molecule level for biomolecule structure determination. J Vis Exp. (123), e55623(2017).
- Antonik, M., Felekyan, S., Gaiduk, A., Seidel, C. A. Separating structural heterogeneities from stochastic variations in fluorescence resonance energy transfer distributions via photon distribution analysis. J Phys Chem B. 110 (13), 6970-6978 (2006).
- Mcgeer, P. L., Mcgeer, E. G. Enzymes associated with the metabolism of catecholamines, acetylcholine and gaba in human controls and patients with parkinson's disease and huntington's chorea. J Neurochem. 26 (1), 65-76 (1976).
- Terterov, I., Nettels, D., Makarov, D. E., Hofmann, H. Time-resolved burst variance analysis. Biophys Rep (N Y). 3 (3), 100116(2023).
- Torella, J. P., Holden, S. J., Santoso, Y., Hohlbein, J., Kapanidis, A. N. Identifying molecular dynamics in single-molecule fret experiments with burst variance analysis. Biophys J. 100 (6), 1568-1577 (2011).
- Haugland, R. P. The Handbook: A Guide to Fluorescent Probes and Labeling Technologies. Molecular Probes. , (2005).
- Medina, E., et al. Intrinsically disordered regions of the DNA-binding domain of human foxp1 facilitate domain swapping. J Mol Biol. 432 (19), 5411-5429 (2020).
- Lakowicz, J. R. Principles of Fluorescence Spectroscopy. , Springer. New York, NY. (2007).
- Koshioka, M., Sasaki, K., Masuhara, H. Time-dependent fluorescence depolarization analysis in three-dimensional microspectroscopy. Appl Spectrosc. 49 (2), 224-228 (1995).
- Kudryavtsev, V., et al. Combining mfd and pie for accurate single-pair forster resonance energy transfer measurements. Chemphyschem. 13 (4), 1060-1078 (2012).
- Van Zanten, T. S., Greeshma, P. S., Mayor, S. Quantitative fluorescence emission anisotropy microscopy for implementing homo-fluorescence resonance energy transfer measurements in living cells. Mol Biol Cell. 34 (6), tp1(2023).
- Laine, R. F., Jacquemet, G., Krull, A. Imaging in focus: An introduction to denoising bioimages in the era of deep learning. Int J Biochem Cell Biol. 140, 106077(2021).
- Strohl, F., Wong, H. H. W., Holt, C. E., Kaminski, C. F. Total internal reflection fluorescence anisotropy imaging microscopy: Setup, calibration, and data processing for protein polymerization measurements in living cells. Methods Appl Fluoresc. 6 (1), 014004(2017).
- Loman, A., Gregor, I., Stutz, C., Mund, M., Enderlein, J. Measuring rotational diffusion of macromolecules by fluorescence correlation spectroscopy. Photochem Photobiol Sci. 9 (5), 627-636 (2010).
- Böhmer, M., Wahl, M., Rahn, H. -J., Erdmann, R., Enderlein, J. Time-resolved fluorescence correlation spectroscopy. Chem Phys Lett. 353 (5-6), 439-445 (2002).
- Peulen, T. -O., et al. Tttrlib: Modular software for integrating fluorescence spectroscopy, imaging, and molecular modeling. arXiv. , (2024).
- Le Fevre, A. K., et al. Foxp1 mutations cause intellectual disability and a recognizable phenotype. Am J Med Genet A. 161A (12), 3166-3175 (2013).
- Hamdan, F. F., et al. De novo mutations in foxp1 in cases with intellectual disability, autism, and language impairment. Am J Hum Genet. 87 (5), 671-678 (2010).
- Wahl, M., Orthaus-Müller, S. Time tagged time-resolved fluorescence data collection in life sciences. , https://www.picoquant.com/images/uploads/page/files/14528/technote_tttr.pdf (2014).
- Lemke, E. A. Site-specific labeling of proteins for single-molecule fret measurements using genetically encoded ketone functionalities. Methods Mol Biol. 751, 3-15 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved