Method Article
تحديد الفئران البالغة من العمر 7 أيام قبل الفطام باستخدام خزعات Pinna Edge
In This Article
Summary
يقدم البروتوكول نهجا تدريجيا جديدا لإنتاج خزعة من حافة الصيوان (PEB) في يوم ما بعد الولادة (PND) 7 فئران لغرض تحديد التنميط الجيني المتزامن.
Abstract
غالبا ما يكون تحديد الفئران وتنويطه الجيني جزءا أساسيا من العديد من الدراسات العلمية في الجسم الحي . تم وصف عدة طرق لتحديد الفئران المفطومة والتنميط الجيني. ومع ذلك ، حتى الآن ، هناك عدد أقل بكثير من التقنيات الموصوفة للفئران قبل الفطام. خزعة Pinna Edge (PEB) هي طريقة لتحديد الهوية مع الاستخدام اللاحق للأنسجة للتنميط الجيني. تصف هذه المقالة وتوفر تعليمات فيديو حول نهج تدريجي ل PEB في يوم ما بعد الولادة (PND) 7 فئران. تم تحديد ثمانية أنماط مختلفة من موقع وتقنية خزعة الصيوان التي ثبت أنها تستمر حتى مرحلة البلوغ لتحديد الهوية. تناقش هذه المقالة أيضا طرق تحسين PEB وتوضح التأثير الحميد لهذه التقنية على نمو وتطور الجراء ، حيث تظهر جميع الفئران زيادة مناسبة في الوزن دون أي مراضة أو وفيات طوال الدراسة. ستوفر هذه التقنية للمحققين طريقة لتحديد الفئران في سن لا تتوفر فيها سوى عدد قليل من طرق تحديد الهوية والتنميط الجيني.
Introduction
في بعض الدراسات العلمية ، يمكن أن تكون طريقة تحديد الفأر ووضعه الجيني في نفس الوقت أمرا بالغ الأهمية. عند استخدام نموذج الفأر ، هناك العديد من الطرق شائعة الاستخدام التي تم تطويرها للتنميط الجيني وتحديد في نفس الوقت (على سبيل المثال ، تثقيب الأذن ، وعلامات الأذن) ، والطرق الأخرى التي تحدد فقط (على سبيل المثال ، الوشم ، وزرع جهاز الإرسال والاستقبال تحت الجلد ، وتطبيق العلامة أو الصبغة) أو النمط الجيني فقط (على سبيل المثال ، خزعة الذيل) 1،2. تهدف معظم هذه التقنيات إلى إجراؤها في وقت الفطام. تقنيات التعرف على الأصغر سنا قبل الفطام وتصنيفها الجيني في وقت واحد أقل1،2،3،4.
للمساعدة في العمل الذي يتطلب تحديد الفئران وتنويطه الجيني في الأعمار الأصغر ، تم إجراء دراسة للتحقق من صحة PEB كطريقة موثوقة لتحديد التنميط والنميط الجيني لصغار PND 7 ومقارنتها باستخدام PEB في الفئران التي تم فطومها في PND 215. كما تفاصيل هذه الدراسة ، تم اختيار شرائح الصيوان الأفقية والرأسية لأن دراسة سابقة باستخدام جثث الجرو PND 7 وجدت أن أنماط الصيوان التي تم إنشاؤها باستخدام PEB كانت واضحة وسريعة وقدمت مجموعة متنوعة من مجموعات الأنماط ، ويمكن التعرف عليها ، وكان من السهل إزالةالأنسجة 5. كما تم استكشاف طرق أخرى ، مثل لكمات الأذن وشقوق الأذن ، ولكن لم تكن هناك مساحة سطح كافية على صغار PND 7 لإنشاء لكمات دائرية كاملة أو شقوق. أدى هذا العمل الأولي إلى دراسة المشار إليها لاختبار هذه الأنماط في الفئران الحية PND 75. أظهرت هذه الدراسة أنه يمكن استخدام حجم الأنسجة المسترجع من خزعة صيوان الأذن للتنميط الجيني الناجح. كانت أنماط PEB سليمة أيضا كفئران تتراوح أعمارها بين PND 63 ، بغض النظر عن وقت أخذ خزعة من الصيوان في PND 7 أو PND 215.
الهدف من تطوير هذه التقنية هو توفير طريقة تحديد وتنميط جيني متزامنة للحيوانات التي تتراوح أعمارها بين 7 و 14 عاما والتي ، وفقا للأدبيات الحالية ، ليس لديها طريقة متاحة. توضح المقالة الحالية ، مصحوبة بالفيديو الموجه ، كيفية إجراء خزعة الأذن على حافة الصيوان لأذن الفأر لمدة 7 أيام لتحديد واسترداد كمية كافية من الأنسجة في نفس الوقت للتنميط الجيني PCR. هناك ثماني مجموعات مختلفة من الخزعة وواحدة بدون خزعة ليصبح المجموع تسعة أنماط صيوان متاحة للاستخدام لتحديد الفئران الفردية. تتم مناقشة النصائح حول إجراء خزعات الصيوان لتحقيق أقصى قدر من النجاح للتعرف الواضح على أنماط الصيوان المختلفة في صنوبر PND 7.
Protocol
تم تنفيذ جميع الإجراءات الموضحة في البروتوكول وفقا لدليل المعاهد الوطنية للصحة لرعاية واستخدام المختبر6 وتمت الموافقة عليها من قبل لجنة رعاية واستخدام المؤسسية (IACUC) التابعة لمستشفى ماساتشوستس العام (MGH). تم اختبار طريقة تحديد الهوية الموضحة أدناه في الفئران C57BL / 6NCrl من كلا الجنسين5. لم يتم استخدام هذه الطريقة في السلالات أو الأسهم أو الجينات المعدلة وراثيا الأخرى. قد لا يكون تحديد خزعة الصيوان مناسبا للفئران التي لديها قدرة شفاء متزايدة (على سبيل المثال ، سلالة الفأر MRL)7.
1. ضبط النفس جرو الفأر
- تأكد من أن الماوس PND 7 أو أقدم. إذا كان الماوس أصغر من PND 7 ، فقد لا تكون طريقة PEB هذه ممكنة.
- كبح جماح الماوس برفق بطريقة تسمح بالتصور والوصول إلى الأذنين. التقط الجرو من قاعدة الذيل بيد المستخدم غير المهيمنة وانقله إلى سطح ثابت.
- ضع ضغطا برفق على طول ظهر الجرو بإبهام والسبابة من اليد المهيمنة حتى يمكن ضغط الجلد المترهل بين الأذنين. اضغط على الجلد بإحكام بما يكفي حتى لا يتحرك الرأس بحرية ، ولكن تأكد من أن يتنفس بشكل طبيعي (الشكل 1).
- إذا تم تقييد باليد اليسرى ، فتأكد من أن الجرو في وضع يجعل الوصول إلى صيوان الأذن اليمنى (على سبيل المثال ، أنف الجرو متجها بعيدا عن جسم اليد). للوصول إلى الصيوان في الأذن اليسرى ، قم بتثبيت الإمساك باليد بحيث يواجه الجانب الأيسر من المعالج.
- إذا تم تقييد باليد اليمنى ، فتأكد من أن الجرو في وضع يجعل الوصول إلى صيوان الأذن اليسرى يسهل الوصول إليه (على سبيل المثال ، أنف الجرو متجها بعيدا عن جسم المعالج). للوصول إلى الصيوان في الأذن اليمنى ، قم بتثبيت اليد التي تمسك بالحيوان بحيث يواجه الجانب الأيمن من المعالج.
2. اختيار نمط خزعة الصيوان
- استخدم ما مجموعه تسعة أنماط مع ثمانية أنماط PEB ونمط واحد بدون خزعة (الشكل 2). حدد نمط PEB وسجله.
3. خزعة حافة بينا
- استخدم أدوات نظيفة لكل خزعة. يوصى باستخدام مقص تشريح صغير أو مقص McPherson-Vannas (انظر جدول المواد). رش الأدوات بالمطهرات وامسحها بمحلول 70٪ من كحول الأيزوبروبيل بعد كل استخدام.
- امسك المقص باليد المهيمنة.
- لإنشاء PEB عمودي ، قم بقص الحافة الجانبية للصيوان في اتجاه رأسي بحيث تتم إزالة ما يقرب من 1/4إلى 1/3rd من إجمالي الصيوان (أي حوالي 0.8 مم × 3 مم من الأنسجة) من جانب الأذن (الشكل 3G).
- لإنشاء PEB أفقي ، قم بقص الحافة الظهرية للصيوان بحيث تتم إزالة ما يقرب من 1/4 إلى 1 /3rd من إجمالي الصيوان (أي حوالي 0.8 مم × 3 مم من الأنسجة) (الشكل 3H). قم بعمل القطع بزاوية 45 درجة بدلا من خط مستقيم (الشكل 4). تفسر الزاوية تطور الأذن ونموها بمرور الوقت وتضمن بقاء النمط أفقيا بطبيعته.
- أنماط الصيوان الثمانية هي مزيج من PEB الرأسي و PEB الأفقي إما على اليسار أو اليمين أو كليهما. قم بعمل أنماط خزعة الصيوان الثمانية التالية: الرأسي الأيسر (LV) ، الرأسي الأيمن (RV) ، الأفقي الأيسر (LH) ، الأفقي الأيمن (RH) ، الرأسي الأيسر والأفقي الأيمن (LVRH) ، الرأسي الأيسر واليمين (LVRV) ، الأفقي الأيسر واليمين الأفقي (LHRH) ، والرأسي الأيسر والرأسي الأيمن (LHRV).
- استخدم ملقطا دقيقا لإيداع أنسجة الصيوان المستأصلة بعناية في حاوية عينة لاستخدامها في التنميط الجيني.
- إذا كان الدم يتجمع من موقع خزعة الصيوان ، وهو أمر غير محتمل ، مع اليد المهيمنة وبينما لا يزال مقيدا ، فاستخدم قطعة من الشاش النظيف أو قضيب طرف قطني للضغط على موقع النزيف حتى يتوقف النزيف.
- ضع الجرو برفق في القفص مع السد. راقب الجراء لمدة 1-2 دقيقة بعد وضعها مرة أخرى في القفص لتقييم أي نزيف آخر من موقع PEB.
النتائج
يوضح الشكل 1 طريقة يدوية لتقييد فئران PND 7 بلطف بحيث تكون آذانها مرئية للتلاعب. يستخدم التقييد الإبهام والسبابة لإمساك الجلد الزائد للقفص. تعتمد كمية الجلد الممسكة على عمر ، مع توفر أنسجة أقل في الصغيرة.
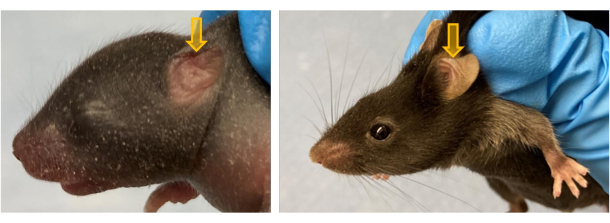
تم اختبار أنماط PEB المدرجة في الشكل 2 ليتم تحديدها حتى PND 63 وقد لوحظ أنها تستمر لفترة أطول (أي 2 سنوات). يظهر الشكل 3 ثلاثة فئران تم تصويرها في البداية في PND 7 وتبعتها حتى PND 63. لم يكن لدى أحد الجرو PEB ، وحصل الجرو الثاني على PEB عمودي يسار (LV) ، وكان الجرو الثالث لديه PEB أفقي يمين (RH). يوضح الشكل أن هذه PEBs سليمة حتى PND 63.
بالنسبة إلى PEBs الأفقية ، يمكن جعل النمط أكثر وضوحا عن طريق قطع الحافة الظهرية للصيوان بزاوية 45 درجة ، كما هو موضح في الشكل 4. مع نمو وبالتالي الأذن ، ستصحح حافة الصيوان الزاوية وتظهر أفقيا بشكل ملحوظ.
في الدراسة الأصلية التي قيمت PEBs ، لوحظت معايير سريرية وسلوكية مختلفة. يوضح الشكل 5 الوزن في مختلف الأعمار ، متباينا حسب الجنس (يوضح الشكل 5 أ إناث الفئران. يوضح الشكل 5 ب ذكور الفئران) من PND 7 الجراء التي تلقت PEB من كل مجموعة5. أظهرت الفئران ، بما في ذلك الجراء التي لم تتلق PEB ، اختلافا كبيرا في الوزن مع تقدمهم في العمر.

الشكل 1: تقييد جرو PND 7 لتحديد المواقع PEB. صورة تمثيلية لجرجر ماوس PND 7 برفق لضمان سهولة الوصول إلى الأذنين من قبل PEBs. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
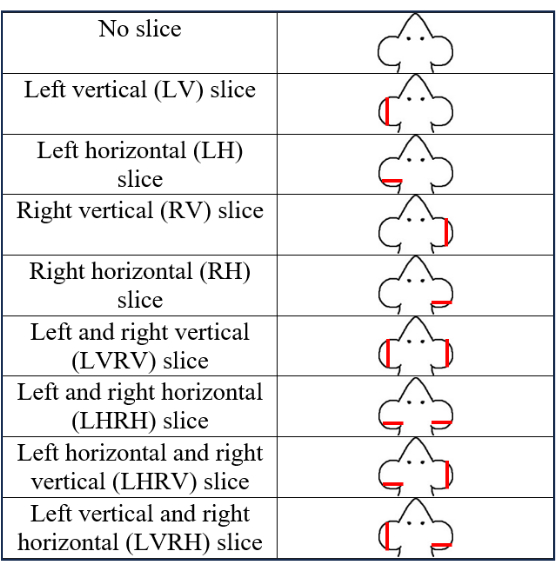
الشكل 2: رسم توضيحي يوضح أنماط تحديد الصيوان التسعة على فئران PND 7. تشير الخطوط الحمراء على الأذنين إلى المواقع التقريبية للخزعة. تم تعديل هذا الرقم من5. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: صور تمثيلية لصغار PND 7 بأنماط مختلفة من الصيوان في نقاط زمنية مختلفة. (أ ، ب) جرو PND 7 بدون خزعة ؛ (C ، D) جرو PND 7 بدون خزعة على PND 21 ؛ (E ، F) جرو PND 7 بدون خزعة على PND 63. (ز ، أنا ، ك) تظهر الأسهم البيضاء جروا PND 7 مع PEB عمودي على جرو الأذن اليسرى على PND 7 و 21 و 63 على التوالي. (ح ، ي ، ل) تظهر الأسهم الحمراء جرو PND 7 RH-PEB على PND 7 و 21 و 63 على التوالي. تم تعديل هذا الرقم من5. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 4: خزعة من نمط PEB الأفقي بزاوية. (أ) يتم إنشاء PND 7 pup الأيسر PEB الأفقي PEB بزاوية 45 درجة. (ب) تم تصوير نفس ، لكنه الآن PND 63. لاحظ أن الزاوية قد تم تصحيحها الآن ويبدو PEB أكثر أفقيا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
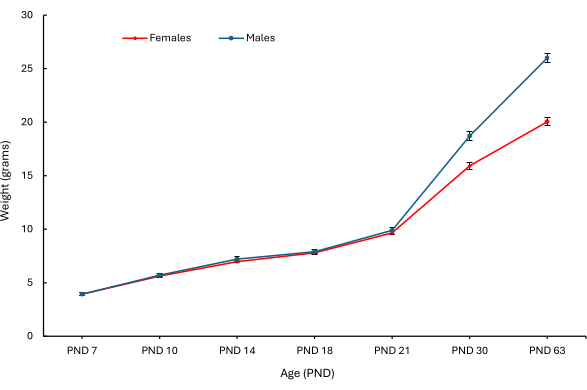
الشكل 5: متوسط أوزان جسم الجراء الإناث والذكور عند PND 7 و 10 و 14 و 18 و 21 و 30 و 63. تم رسم متوسط أوزان الجسم (جم) للإناث (الحمراء) والذكور (الأزرق) في صغار PND 7 من PND 7 إلى 63 حسب الجنس. تم حساب الوسائل عبر الفئران الفردية (ن = 28 جروا أنثى ؛ ن = 26 جروا ذكرا). تمثل أشرطة الخطأ التسويق عبر محرك البحث (SEM). تم تعديل هذا الرقم من5. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
الأهمية فيما يتعلق بالأساليب الحالية
ذكرت المقالات السابقة أنه بالنسبة لحيوانات PND 14 والأصغر سنا ، قد لا تكون الصيوان مناسبة للتلاعب بسبب صغر حجمها 2,3. في حين أن أنظمة تحديد الأذن الحالية مثل خزعات الأذن أو إحراز الأذن أو علامات الأذن يمكن أن تؤدي كلا من تحديد الهوية والتنميط الجيني ، إلا أنها قد تتطلب صوانين أكبر ، وبالتالي الفئران الأكبر سنا لتحديد الهوية. تقدم هذه الطريقة الجديدة ل PEB طريقة تحديد للحيوانات في الأعمار التي لم تكن متوفرة في السابق طرق تحديد الهوية والتنميط الجيني. لم يتم وصف أي طرق سابقا في الأدبيات الخاصة بالحيوانات PND من 7 إلى 14. وبالتالي ، توفر PEBs تحديد الهوية في سن PND 7 ، ويمكن استخدام الأنسجة التي تم جمعها للتنميط الجيني.
قد تسمح الطرق الأخرى بتحديد الهوية (على سبيل المثال ، وضع علامات مؤقتة على الذيل ، والوشم ، وزرع جهاز الإرسال والاستقبال) أو التنميط الجيني (على سبيل المثال ، خزعة الذيل). تسمح هذه الطريقة بتحديد الهوية والتنميط الجيني في حدث تقييدي واحد فقط ، مما يقلل من الضغط على.
قص أصابع القدم هو خيار لتحديد الصغيرة والتنميط الجينيلها 3،8،9،10. ومع ذلك ، يجب استخدامه فقط عندما لا تكون هناك طريقة أخرى لتحديد الهوية الفردية ممكنة ، كما هو موضح في دليل رعاية واستخدام المختبر 6. يحد هذا المعيار من استخدام قص أصابع القدم. بناء على هذه التوصية ، تعد طريقة PEB بديلا لقص أصابع القدم التي يمكن استخدامها في الفئران PND 7 أو أكبر.
استنادا إلى نتائج دراسة سابقة مغلفة في الشكل 5 ، لم يؤثر إجراء PEB على أوزان الفئران المقاسة في نقاط زمنية مختلفة عند مقارنتها بالفأر بدون PEB. بالإضافة إلى ذلك ، لم يلاحظ أي مراضة أو وفيات في صغار PND 7 في أي وقت. جميع الجراء الذين تم أخذ خزعة من PND 7 لديهم بقع حليب على PND 10 ، ولم يلاحظ رفض السد. بناء على هذه المعلمات ، يبدو أن هذا الإجراء له تأثير حميد على نمو وتطور الفئران عند إجراؤه بشكل مناسب.
قيود التقنية
تسمح تقنية PEB فقط بثماني مجموعات تحديد تتيح أيضا التنميط الجيني. النمط التاسع ، نمط عدم الخزعة ، لا يسمح بالتنميط الجيني حيث لا يتم شراء أي أنسجة. لذلك ، قد يلزم استخدام طرق أخرى لتحديد الهوية لتكملة التوليفات التسع الإضافية المعروضة. يمكن إضافة PEBs إضافية. على سبيل المثال ، يمكن أن يضيف وجود خزعة ظهرية وأفقية على صيوان واحد ست مجموعات إضافية. سيوفر هذا ما مجموعه 15 مجموعة. ومع ذلك ، لم يتم تنفيذ هذه الأنماط أو اختبارها.
كانت PEBs مرئية ويمكن تمييزها بشكل فردي حتى PND 63. على الرغم من عدم مراقبتها رسميا بعد PND 63 ، فقد تم الاحتفاظ بالفئران في المستعمرة لمدة تصل إلى عامين ، وحسب الروايات المتناقلة ، كانت أنماط PEB لا تزال سليمة.
تم اختبار أنماط PEB فقط في الفئران C57BL / 6NCrl. كما هو الحال مع تقنيات التعرف على الأذن الأخرى ، لن تكون الفئران ذات القدرة المتزايدة على التئام الجروح مناسبة لهذه التقنية7.
الخطوات الحاسمة في إطار البروتوكول
يعد ضمان ضبط النفس الصارم واللطيف الذي يسمح بتصور البينا أمرا ضروريا للتنفيذ السليم ل PEB. لوحظ أن PND 7 تكافح بشكل أقل أثناء ضبط النفس وأثناء الخزعة مقارنة بحيوانات PND 215. بالنسبة للمجموعات الأفقية ، من الأهمية بمكان إجراء الشريحة بزاوية 45 درجة ، كما هو موضح في الشكل 4 ، لضمان ظهور PEBs الأفقية أفقيا مع تقدم عمر الماوس.
التعديلات واستكشاف الأخطاء وإصلاحها
في الدراسة الأصلية التي اختبرت فعالية PEBs ، تم اكتشاف أنه بشكل عام ، تم أخذ خزعة من ما لا يقل عن 0.8 مم × 3 مم من الصيوان في فئران PND 75. لضمان تحديد نمط PEB مع تقدم الفأر في العمر ، يوصى بأخذ أكبر قدر ممكن من الأنسجة من الصيوان قدر الإمكان.
التطبيقات المستقبلية
تم اختبار تقنية PEB فقط على الفئران C57BL / 6Crl ، ولكن يمكن أيضا استخدام هذا التطبيق في سلالات أو مخزونات الفئران الأخرى إذا تم اختباره. كما ذكرنا سابقا ، يمكن تحديد المزيد من أنماط PEB لإضافة المزيد من أنماط تحديد السدود ذات الفضلات الأكبر. أخيرا ، تم اختبار هذه الطريقة وتنفيذها من قبل معالج فأر متمرس قام بتقنيات تحديد أخرى (على سبيل المثال ، لكمة الأذن). يمكن تطوير مزيد من الدراسات لاختبار سهولة هذه الطريقة لأولئك الأقل خبرة في التعامل مع الماوس.
Disclosures
ليس لدى المؤلفين أي شيء يكشفون عنه.
Acknowledgements
يود المؤلفون أن يشكروا الدكتورين لوري إس بالي ودونا إم جاريل ، مؤلفا الورقة الأصلية في هذا العمل ، على مساهماتهم.
Materials
| Name | Company | Catalog Number | Comments |
| Dissection scissors | Kent Scientific | INS600393-G | 10 cm long |
| McPherson-Vannas Scissors | Kent Scientific | INS600124 | 8 cm long |
References
- Bonaparte, D., et al. FELASA guidelines for the refinement of methods for genotyping genetically-modified rodents: a report of the Federation of European Laboratory Animal Science Associations Working Group. Lab Anim. 47 (3), 134-145 (2013).
- Dahlborn, K., et al. Report of the federation of European laboratory animal science associations working group on animal identification. Lab Anim. 47 (1), 2-11 (2013).
- Castelhano-Carlos, M. J., Sousa, N., Ohl, F., Baumans, V. Identification methods in newborn C57BL/6 mice: a developmental and behavioural evaluation. Lab Anim. 44 (2), 88-103 (2010).
- Chen, M., Kan, L., Ledford, B. T., He, J. Q. Tattooing various combinations of ears, tail, and toes to identify mice reliably and permanently. J Am Assoc Lab Anim Sci. 55 (2), 189-198 (2016).
- Chen, D. D., Molk, D. M., Palley, L. S., Jarrell, D. M. Pinna Edge Biopsy of 7 and 21 Day Old C57BL/6 Mice as a Method for Identification and Genotyping. J Am Assoc Lab Anim Sci. 62 (5), 438-448 (2023).
- Institute for the Laboratory Animal Research. Guide for the care and use of laboratory animals. , 8th ed, National Academies Press. Washington, DC. (2011).
- Rajnoch, C., et al. Regeneration of the ear after wounding in different mouse strains is dependent on the severity of wound trauma. Dev Dyn. 226 (2), 388-397 (2003).
- Han, M., Yang, X., Lee, J., Allan, C. H., Muneoka, K. Development and regeneration of the neonatal digit tip in mice. Dev Biol. 315 (1), 125-135 (2008).
- Schaefer, D. C., Asner, I. N., Seifert, B., Bürki, K., Cinelli, P. Analysis of physiological and behavioural parameters in mice after toe clipping as newborns. Lab Anim. 44 (1), 7-13 (2010).
- Frezel, N., et al. Does toe clipping for genotyping interfere with later-in-life nociception in mice. Pain Rep. 4 (3), e740(2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved