17.9 : 非标准状态的自由能变化
在非标准条件下 (压力不超过 1 巴;浓度不超过 1 M) ,反应物和生成物的过程的自由能变化与标准自由能变化有关,根据以下方程:
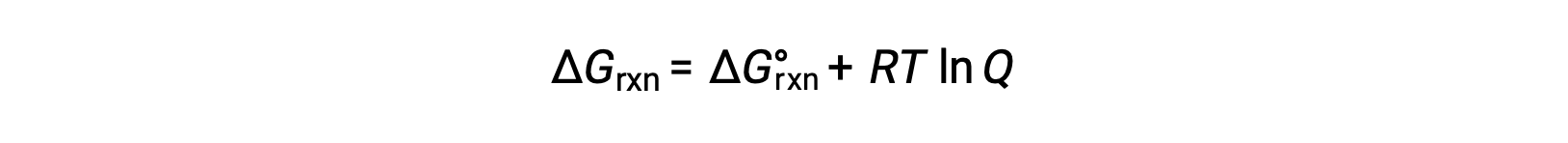
其中 R 是气体常数 (8.314 J/K·mol) , T 是以开氏为单位的绝对温度, Q 是反应商。 此方程可用于预测过程在任何给定条件集下的自发性。
反应商 (Q)
可逆反应的状态可以通过评估其反应商, Q 的可逆反应 (如所述) 来方便地进行评估
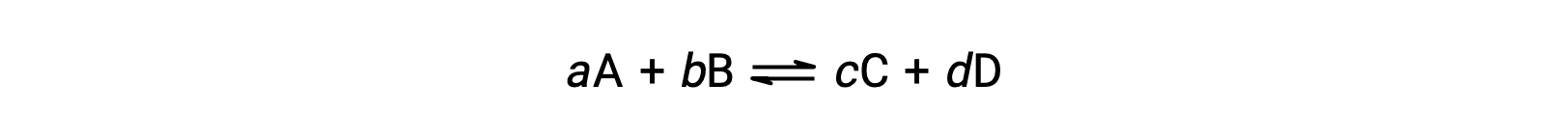
反应商直接源自的化学化学化学计量法 平衡的方程 AS
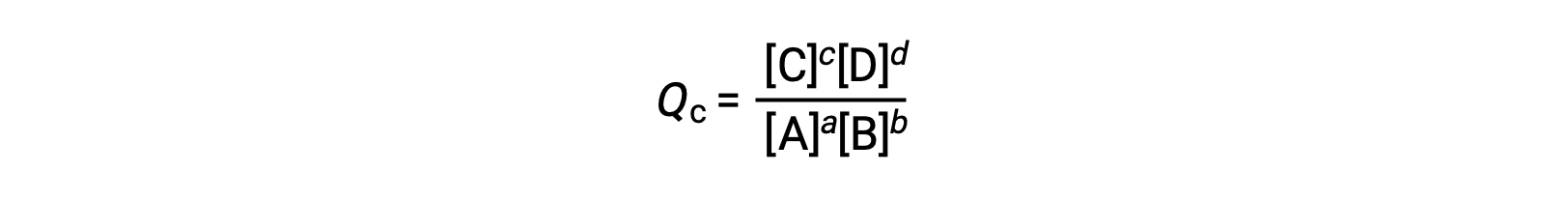
其中,下标 c 表示表达式中使用摩尔浓度。 基于浓度的反应商 (QC) 用于凝相平衡。 如果反应物和生成物是气态的,则可以使用分压类似地导出反应商:
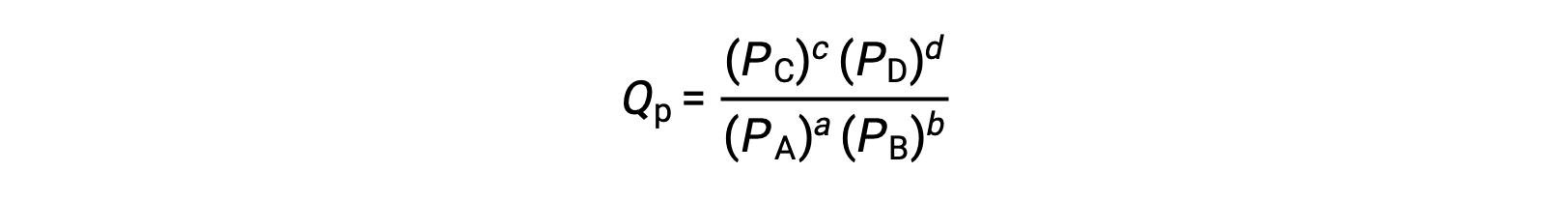
在标准条件下,反应物和生成物溶液浓度为 1 M ,或气体压力为 1 bar , Q 等于 1。 因此,在标准条件下
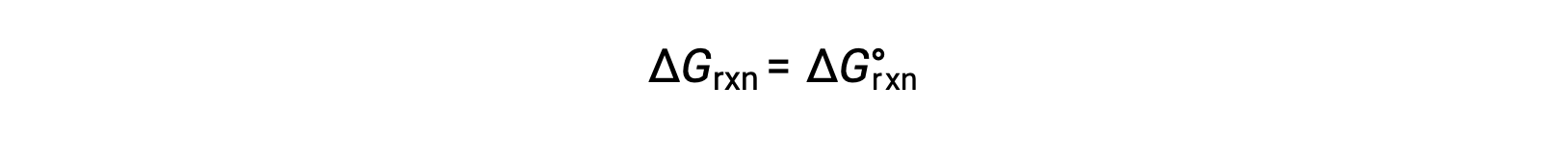
在非标准条件下,必须计算 Q。
当反应走向平衡时, Q 的数值会有所不同;因此, Q 的数值可以作为反应状态的有用指标。 为了说明这一点,请考虑二氧化硫的氧化:
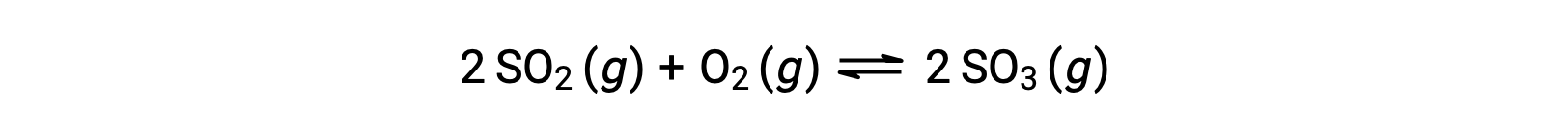
考虑两种不同的实验方案,一种是仅用反应物, SO2 和 O2 的混合物引发这种反应,另一种是仅以生成物, SO3 开始的。 对于仅以反应物混合物开始的反应, Q 最初等于零:
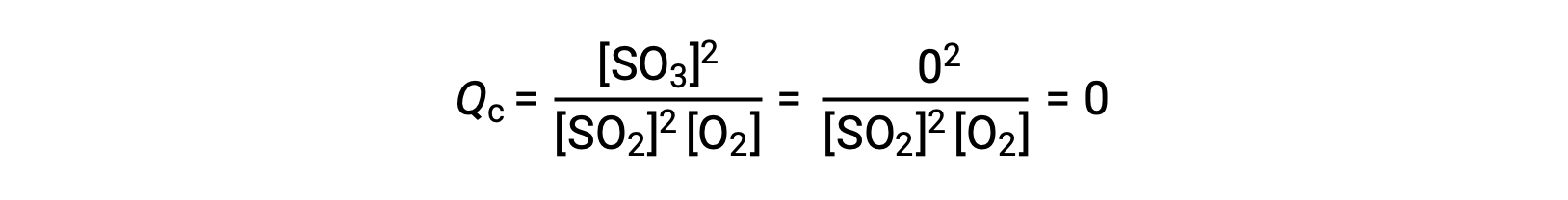
随着反应朝着正向平衡的方向发展,反应物浓度下降 (QC 分母也是如此) ,生成物浓度增加 (QC 分子也是如此) ,反应商随之增加。 当达到平衡时,反应物和生成物的浓度保持不变,质量控制的值也是如此。
如果反应开始时只有生成物存在,则最初未定义 QC 值 (不可测量的大或无限) :
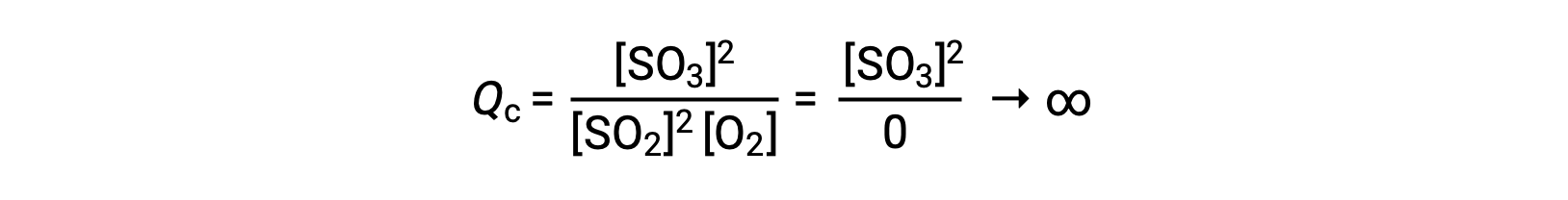
在这种情况下,反应朝着相反方向走向平衡。 生成物浓度和 QC 分子随着时间的推移而下降,反应物浓度和 QC 分母增加,反应商随之下降,直到它在平衡状态保持不变。
本文改编自 Openstax, Chemistry 2e, Chapter 16.4 :自由能 and Openstax, 化学 2e, 第13.2章节: 平衡常数。
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
