17.9 : Alterações de Energia Livre para Estados Não Padrão
A alteração de energia livre para um processo que ocorre com reagentes e produtos presentes em condições não padrão (pressões diferentes de 1 bar; concentrações diferentes de 1 M) está relacionada com a alteração de energia livre padrão de acordo com esta equação:
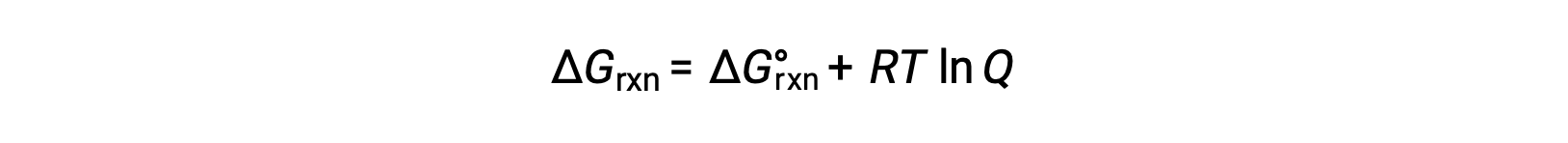
onde R é a constante de gás (8,314 J/K·mol), T é a temperatura absoluta em kelvin, e Q é o quociente de reação. Esta equação pode ser usada para prever a espontaneidade de um processo sob qualquer conjunto de condições.
Quociente de Reação (Q)
O estado de uma reação reversível é convenientemente avaliado avaliando o seu quociente de reação, Q. Para uma reação reversível descrita por
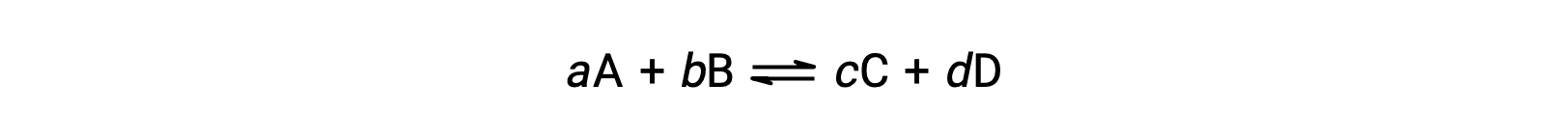
o quociente de reação é derivado diretamente da estequiometria da equação equilibrada como
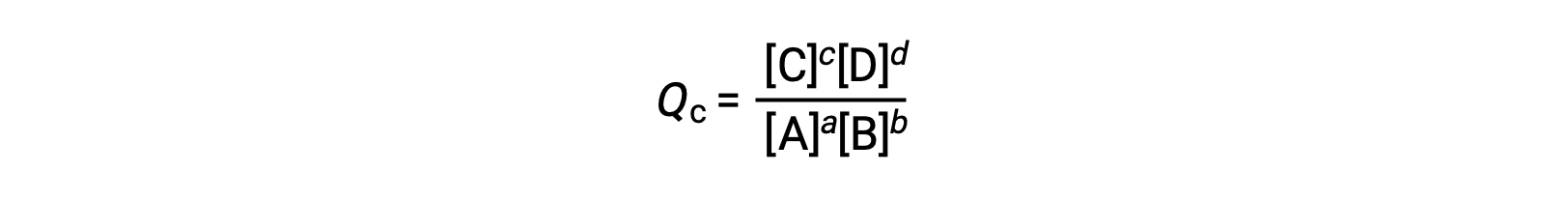
onde o subscrito c denota o uso de concentrações molares na expressão. O quociente de reação baseado na concentração, Qc, é utilizado para os equilíbrios de fase condensada. Se os reagentes e os produtos forem gasosos, um quociente de reação pode ser derivado de forma semelhante utilizando pressões parciais:
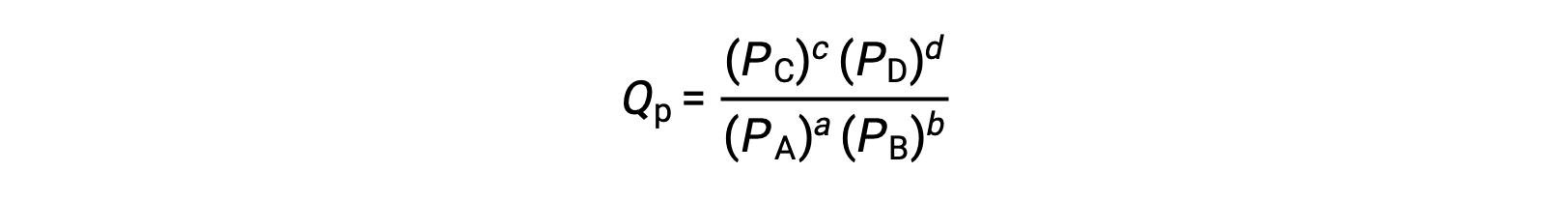
Em condições normais, as concentrações dos reagentes e produtos em solução são de 1 M, ou a pressão dos gases é de 1 bar, e Q é igual a 1. Por conseguinte, em condições normais
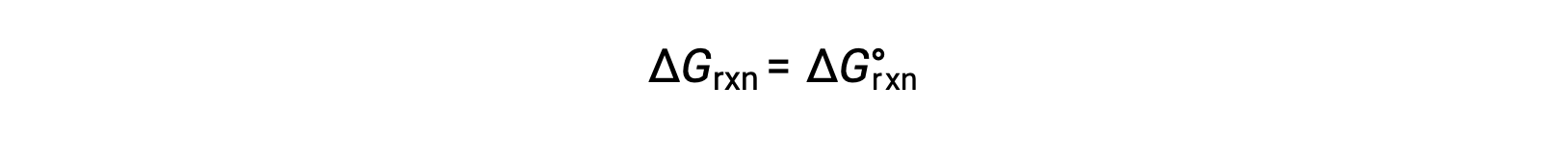
Em condições não padrão, Q deve ser calculado.
O valor numérico de Q varia à medida que uma reação prossegue em direção ao equilíbrio; portanto, pode servir como um indicador útil do estado da reação. Para ilustrar este ponto, considere a oxidação do dióxido de enxofre:
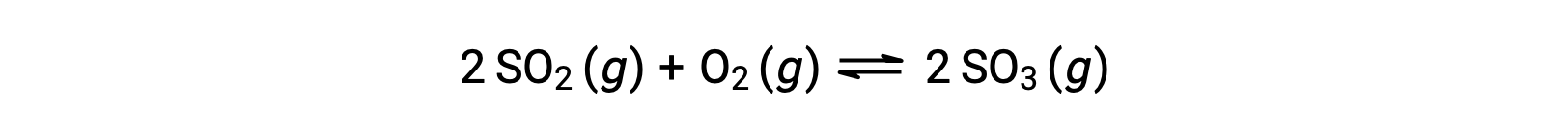
Considere dois cenários experimentais diferentes, um em que essa reação é iniciada apenas com uma mistura de reagentes, SO2 e O2, e outro em que começa apenas com o produto, SO3. Para a reação que começa apenas com uma mistura de reagentes, Q é inicialmente igual a zero:
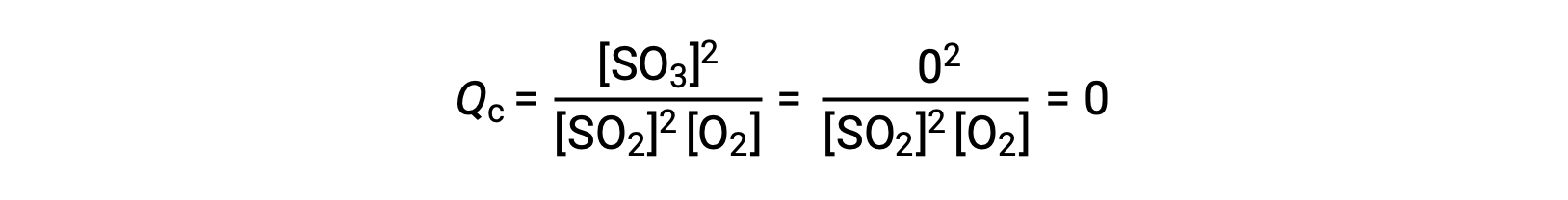
À medida que a reação avança para o equilíbrio na direção direta, as concentrações de reagentes diminuem (tal como o denominador de Qc), a concentração do produto aumenta (tal como o numerador de Qc), e o quociente de reação aumenta como consequência. Quando se atinge o equilíbrio, as concentrações de reagentes e produtos permanecem constantes, assim como o valor de Qc.
Se a reação começar apenas com o produto presente, o valor de Qc é inicialmente indefinido (incomensuravelmente grande ou infinito):
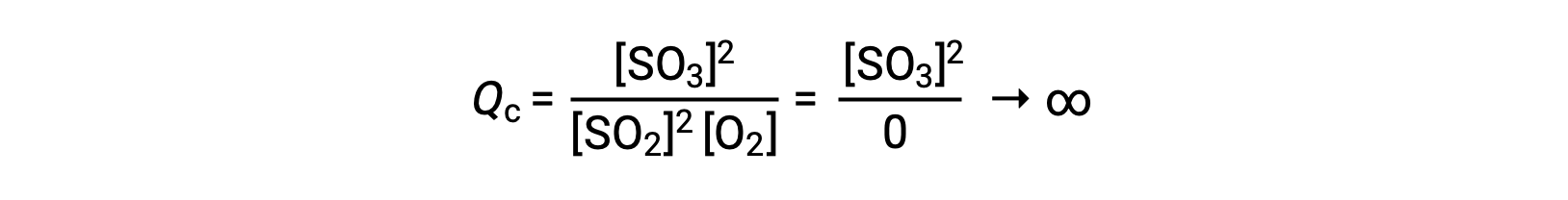
Neste caso, a reação prossegue em direção ao equilíbrio na direção inversa. A concentração do produto e o numerador de Qc diminuem com o tempo, as concentrações de reagentes e o denominador de Qc aumentam, e o quociente de reação diminui, consequentemente, até que se torna constante em equilíbrio.
Este texto é adaptado de Openstax, Chemistry 2e, Chapter 16.4: Free Energy and Openstax, Chemistry 2e, Chapter 13.2: Equilibrium Constants.
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
