17.9 : Cambios de Energía Libre para Estados No Estándar
El cambio de energía libre para un proceso que tiene lugar con reactivos y productos presentes en condiciones no estándar (presiones distintas de 1 bar; concentraciones distintas de 1 M) está relacionado con el cambio de energía libre estándar de acuerdo con esta ecuación:
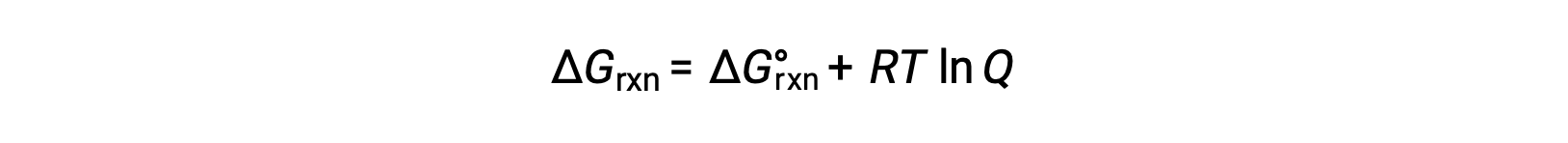
Donde R es la constante de gas (8,314 J/K·mol), T es la temperatura absoluta en kelvin y Q es el cociente de reacción. Esta ecuación puede ser usada para predecir la espontaneidad de un proceso bajo cualquier conjunto de condiciones.
Cociente de reacción (Q)
El estado de una reacción reversible se verifica convenientemente evaluando su cociente de reacción, Q. para una reacción reversible descrita por
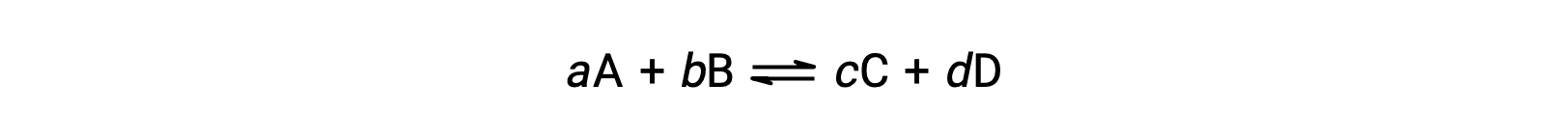
el cociente de reacción se deriva directamente de la estequiometría de la ecuación balanceada como
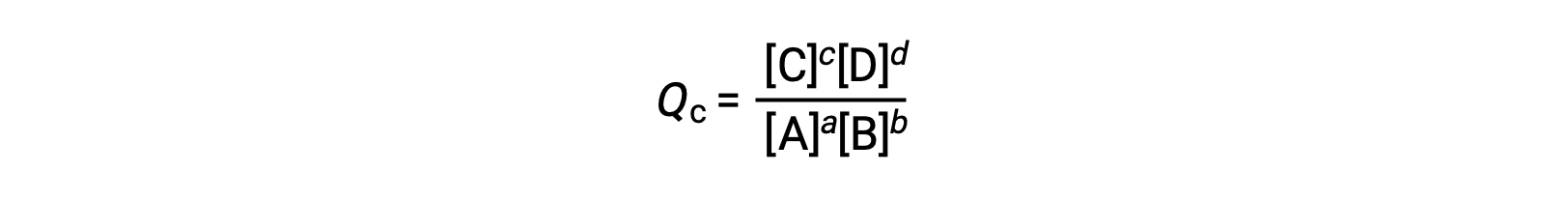
donde el subíndice c denota el uso de concentraciones molares en la expresión. El cociente de reacción basado en la concentración, Qc, se utiliza para los equilibrios de fase condensada. Si los reactivos y los productos son gaseosos, un cociente de reacción puede obtenerse de forma similar utilizando presiones parciales:
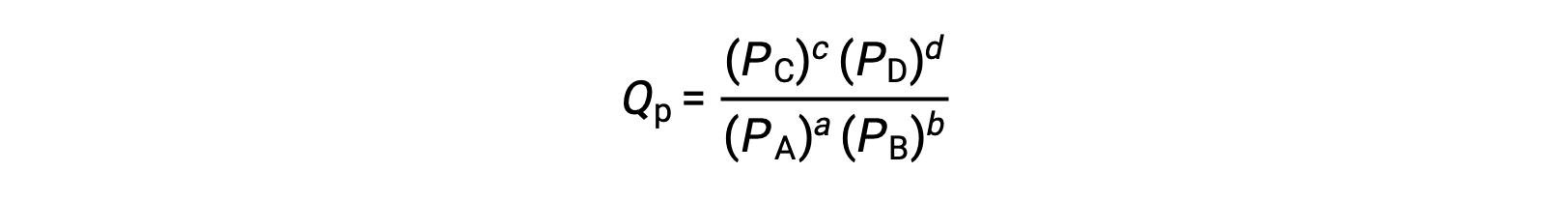
En condiciones estándar, las concentraciones de reactivo y producto de la solución son de 1 M, o la presión de los gases es de 1 bar, y Q es igual a 1. Por lo tanto, en condiciones estándar
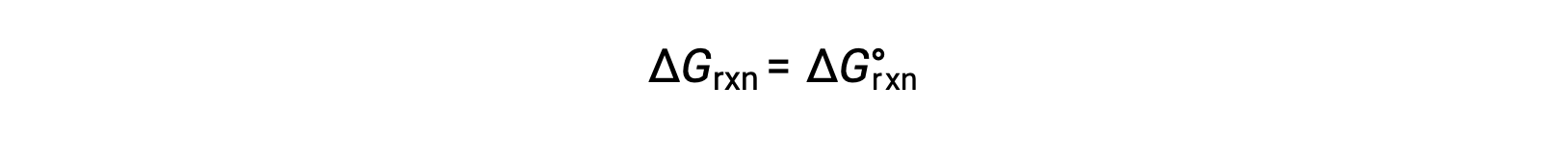
En condiciones no estándar, se debe calcular Q.
El valor numérico de Q varía a medida que una reacción avanza hacia el equilibrio; por lo tanto, puede servir como indicador útil del estado de la reacción. Para ilustrar este punto, considere la oxidación del dióxido de azufre:
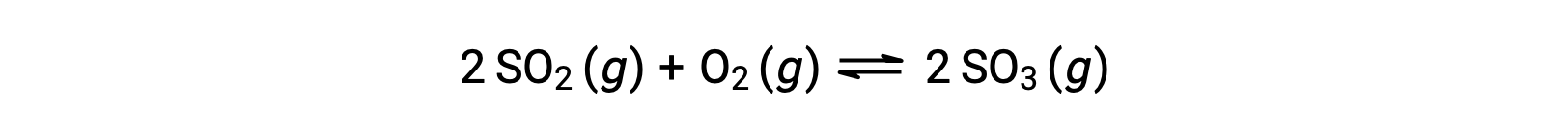
Considere dos escenarios experimentales diferentes, uno en el que esta reacción se inicia solamente con una mezcla de reactivos, SO2 y O2, y otro que comienza sólo con el producto, SO3. Para la reacción que comienza solamente con una mezcla de reactivos, Q es inicialmente igual a cero:
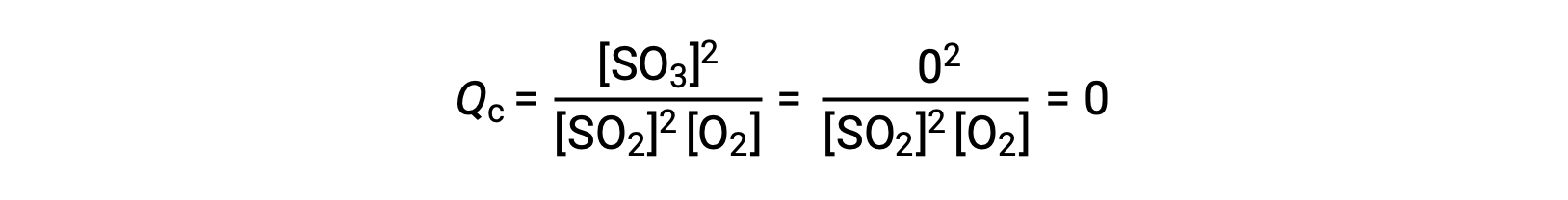
A medida que la reacción avanza hacia el equilibrio en la dirección de avance, las concentraciones de los reactivos disminuyen (al igual que el denominador del Qc), la concentración del producto aumenta (al igual que el numerador del Qc) y el cociente de reacción aumenta consecuentemente. Cuando se alcanza el equilibrio, las concentraciones de reactivos y productos permanecen constantes, al igual que el valor de Qc.
Si la reacción comienza sólo con el producto presente, el valor de Qc no está definido inicialmente (inmensurablemente grande o infinito):
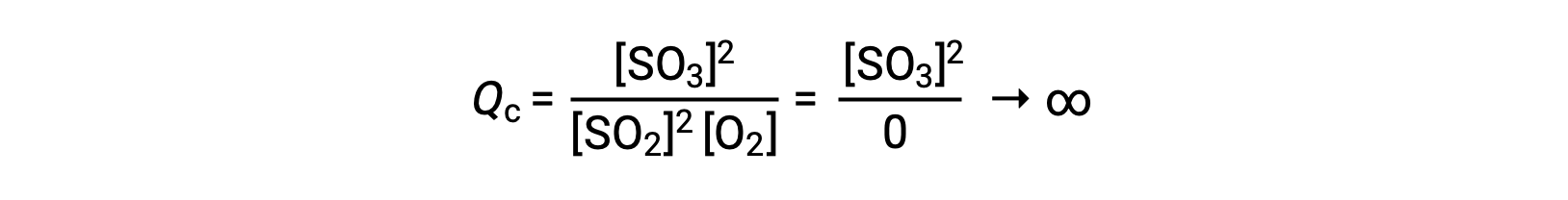
En este caso, la reacción avanza hacia el equilibrio en la dirección inversa. La concentración del producto y el numerador del Qc disminuyen con el tiempo, las concentraciones de reactivos y el denominador del Qc aumentan, y el cociente de reacción disminuye consecuentemente hasta que se vuelve constante en equilibrio.
Este texto está adaptado de Openstax, Química 2e, Capítulo 16.4: Energía Libre y Openstax, Química 2e, Capítulo 13.2: Constantes de Equilibrio.
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
