需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
为核型分析人类胚胎干细胞的染色体蔓延制备
摘要
核型分析是一种简单而有用的技术,广泛用于检测遗传变异。在这里,我们描述了一个一步一步监测文化在保持这些细胞的染色体状态的人类胚胎干细胞的染色体蔓延的准备协议。
摘要
虽然人类胚胎干细胞(胚胎干细胞)已被证明是目前稳定的二倍体核型1,已经有很多研究报告,根据培养条件下,他们变得容易获得全部或部分染色体此外,如染色体异常。事实上,在长期培养,染色体核型改变时使用酶或化学分解2,3,4,而手动传代的殖民地清扫,保持一个稳定的染色体核型5。此外,作为饲养层细胞的清除等环境的变化也似乎妥协的胚胎干细胞3,6的遗传完整性。一旦染色体改变可能会影响细胞生理学,人类胚胎干细胞在体外的遗传完整性的特性是至关重要的考虑人类胚胎干细胞在胚胎发育的研究和药物试验的一个必不可少的工具。此外,为今后的治疗目的,染色体的变化是一个真正的关注,因为它通常是相关联的癌变。
在这里,我们展示一个简单而有用的方法来获得高品质的染色体利差染色体G显带,鱼,天空或比较基因组杂交技术7,8随后分析。我们建议常规检查每隔5代的染色体状态,以监测易位和非整倍体的外观
Priscila布里托和拉斐拉Sartore贡献同样的文件。
研究方案
设备
- 组织文化的孵化器,37℃,5%的CO 2
- 离心分离
- 设置的micropipettors(100,100μL)
- 水浴37℃
- 水浴90℃水蒸汽源
- 相衬显微镜
第一步
细胞治疗colcemid
在此过程中,我们使用人类胚胎干细胞线H9的培养灭活的DMEM/F12(Invitrogen公司)与丝裂霉素C(Sigma公司)和保持的小鼠胚胎成纤维细胞(MEF)上,20%的基因敲除血清替代(KSR,GIBCO)和8ng/mL的补充成纤维细胞生长因子(FGF - 2,R&D)。
为了获得大量的中期利差,这是建议使用高的有丝分裂指数,其中有许多分裂的细胞培养。
- 以从孵化器的培养瓶中,在层流,添加终浓度在0.1微克/毫升Colcemid。
- 返回烧瓶孵化器,并等待3个小时,所以抑制剂能导致有丝分裂中期,当染色体浓缩,可以很容易地在显微镜下可视的逮捕。
修复细胞
- 取出介质和添加tripsin / EDTA的0.05%,足以覆盖细胞表面。允许细胞孵育在室温下5分钟,然后加入含血清培养基或刚刚加入血清细胞酶失活。
注:重要的是要确保实现单细胞悬液,以取得良好的中期利差。 - 细胞转移到15 mL离心管中,离心5分钟,在122 克 。
- 弃去上清液,留下约200毫升,并重新悬浮颗粒轻轻攻管,如视频所示。确保细胞分离的,所以你不能可视化解决方案中的任何团块。
- 接下来,您将需要添加5毫升低渗溶液(氯化钾75MM)预热至37 ° C,慢慢的,在下面的描述管壁。首先加3毫升,逆变管到水平位置,只是低渗溶液混合细胞,然后加入剩余的2毫升,并注意保暖在37 ° 15分钟。
注意:此时低渗溶液会导致细胞体积增加,并帮助理清染色体。孵化的时间是很重要的,获得良好的染色体利差。如果时间过长,细胞膜破裂过早的染色体丢失。如果太短,可能很难获得染色体的利差,因为可能不会破坏细胞膜。 - 加入3滴固定液(甲醇/冰醋酸3:1),轻轻地反转管细胞和离心5分钟没有打破122克混合固定液。
注:应该是新鲜的固定液。
注:重要的是使用离心没有打破,以避免细胞消耗,防止材料的流失。 - 弃上清液,留下约200毫升,并轻轻重悬轻敲管底部的沉淀。
注:同样,确保细胞分离的,所以你不能可视化解决方案中的任何团块。 - 添加固定液第3毫升,慢慢管壁,当你旋转管。反转管到水平位置,只是细胞混合,然后添加2毫升的固定液管壁细胞下降。股票在4 ° C过夜。
注:固定液固定细胞可以储存几个月4 ° C。除了保护细胞在其肿胀的状态,固定液去除脂类和蛋白质变性。这些事件使细胞膜脆弱,因此,容易使染色体蔓延。
清洁玻片
在开始之前使染色体利差确保您的幻灯片妥善清洁或你可能会失去一些核,也中期分裂。这一步也很重要,如果你想尝试任何杂交技术 9 。
- 包含6M盐酸在室温下至少3个烧杯中放置幻灯片。
- 过了这段时间,在运行10分钟自来水冲洗幻灯片。
- 幻灯片和蒸馏水冲洗,让他们在室温下干燥。
- 现在的幻灯片,可以存入96%的乙醇,干燥无绒布,使用前。
注:对于原位杂交方法,幻灯片不能存放超过2天到96%的乙醇
第二个步骤
洗涤细胞
- 第二天,122 克离心5分钟不间断的细胞。
- ðiscard上清液,留下约200毫升。轻轻弹管,再加入5毫升的新鲜固定液(甲醇/冰醋酸3:1),管壁慢慢旋转管重悬沉淀。重复此清洗步骤2次以上的共有3个洗。
注:应该是新鲜的固定液。
准备幻灯片
- 在过去的离心步骤,保留足够数量的解决方案,均匀颗粒细胞和细胞获得足够的密度,在幻灯片中(见图1)。
- 20-30μL细胞悬液加入到一个干净的干滑动移动非常接近平行于表面的吸管。由于固定液的蒸发,滑动面颗粒感。
- 随即,揭露幻灯片,面对30秒成蒸汽,热水(90 °),导致细胞炸毁。
注:在这一刻,从固定液挥发的甲醇,醋酸浓度增加造成的,与水一起刺激染色体蔓延。 - 看在相差显微镜检查的浓度以及细胞分布好(见图1)。
- 现在的幻灯片,准备用来检查染色体G -带(吉姆萨),鱼,天空或比较基因组杂交细胞遗传学方法。
重要的提示
如何选择一个适当的中期加以分析
选择圆形和孤立的中期(图2d),您可能会避免考虑虚假的非整倍体染色体由两个或两个以上的产生的收益利差混合在一起,或推出的染色体产生染色体的损失。因此,应避免选择靠近原子核的中期,因为有些染色体可能隐藏(图2A和2B)。此外,看一轮中期,确保任何染色体分离是从中期(图2c)。
饲养层细胞和胚胎干细胞染色体核型
G带和SKY分析,饲养层细胞在胚胎干细胞文化的存在不干预的结果,因为饲养层细胞没有下一个分裂的状态(丝裂霉素C或照射灭活)并不会中期人口的一部分。然而,在间期核FISH技术的应用,它是首选分开饲养层细胞收获胰蛋白酶的前殖民地手动FISH分析的人类胚胎干细胞的人口。

图1:如何知道在幻灯片的合适的细胞密度。 10倍的目标相显微镜的图像。 (一)细胞密度过高。箭头指向太靠近原子核的中期利差。 (二)具有良好的细胞密度的幻灯片。圆圈显示,从原子核或其他中期隔离的中期利差。请点击这里看到图1的放大版本。
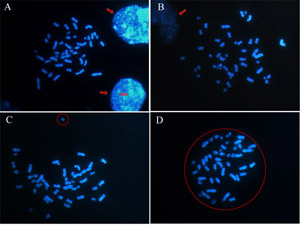
图2:如何选择一个适当的中期加以分析。染色体是染色用DAPI荧光显微镜获得的图像在100X目标。 (一)(b)避免靠近原子核的中期(箭头所指)(C)和中期分裂不是圆的,目前的染色体分离(圈)。 (四)全面中期是一个很好的中期加以分析。请点击这里看大图图2。
Access restricted. Please log in or start a trial to view this content.
讨论
染色体利差的准备是成功的胚胎干细胞的遗传状态的由常规技术的G -带,和更先进的技术,如鱼,天空和CGH分析的关键一步。
此过程可应用于不同colcemid孵化的时期,这对细胞周期的长短取决于多种细胞类型。对于胚胎干细胞的殖民地,我们等待了3个小时,而胚体(EB)的时间可长达6个小时。
在细胞聚集(如胚体),则需要很好地分解,为了获得一个单...
Access restricted. Please log in or start a trial to view this content.
披露声明
The authors have nothing to disclose.
材料
| Name | Company | Catalog Number | Comments |
| 15 ml centrifuge tube | Techno Plastic Products | 91015 | |
| Colcemid Karyo MAX | GIBCO, by Life Technologies | 15212-012 | |
| EDTA | Isofar | 721 | |
| Glacial acetic acid | Isofar | 100 | |
| Methanol | Isofar | 208 | |
| Potassium Chloride (KCl) | Merck & Co., Inc. | 104.931.000 | |
| Slide | Bioslide | 7105-1 | |
| Tripsin | Sigma-Aldrich | T4799 |
参考文献
- Thomson, J. A. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1145 (1998).
- Draper, J. S. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nat Biotechnol. 22 (1), 53-53 (2004).
- Maitra, A. Genomic alterations in cultured human embryonic stem cells. Nat Genet. 37 (10), 1099-1099 (2005).
- Mitalipova, M. M. Preserving the genetic integrity of human embryonic stem cells. Nat Biotechnol. 23 (1), 19-19 (2005).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nat Biotechnol. 22 (4), 381-381 (2004).
- Caisander, G. Chromosomal integrity maintained in five human embryonic stem cell lines after prolonged in vitro culture. Chromosome Res. 14 (2), 131-131 (2006).
- Imreh, M. P. In vitro culture conditions favoring selection of chromosomal abnormalities in human ES cells. J Cell Biochem. 99 (2), 508-508 (2006).
- Robin-Wesselschmidt, J. L. Human Stem Cell Manual. Loring, J. F., Robin-Wesselschmidt, J. L., Robin-Wesselschmidt, S. chwartz , Elsevier's Science & Technology Rights. California. 59-59 (2007).
- Rooney, D. E. Human Cytogenetics. , Third Edition, Oxford University Press. (2001).
- Heslop-Harrison, P., Schwarzacher, T. Practical in situ hybridization. Heslop-Harrison, P., Schwarzacher, T. , BIOS Scientific Publishers. Oxford. 51-51 (2000).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。