Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Chromosomale Spread-Vorbereitung von humanen embryonalen Stammzellen für die Karyotypisierung
In diesem Artikel
Zusammenfassung
Karyotypisierung ist eine einfache und nützliche Technik allgemein zum Nachweis genetischer Veränderungen verwendet. Hier beschreiben wir Schritt für Schritt-Protokoll für das Chromosom verteilt Vorbereitung von menschlichen embryonalen Stammzellen für die Überwachung der chromosomalen Status dieser Zellen in Kultur gehalten.
Zusammenfassung
Obwohl humanen embryonalen Stammzellen (hES) haben gezeigt worden, um eine stabile diploide Karyotyp 1 vorliegt, haben viele Studien berichteten, dass je nach Kulturbedingungen sie anfällig für chromosomale Anomalien wie Addition von ganzen oder Teile von Chromosomen zu erwerben sein. In der Tat, während der langfristigen Kultur, karyotypischen Veränderungen beobachtet werden, wenn enzymatische oder chemische Spaltung 2,3,4 verwendet werden, während die manuelle Zerlegung der Kolonien für die Passage behält eine stabile Karyotyp 5. Neben Veränderungen in der Umgebung wie die Entfernung von Feeder-Zellen scheinen auch die genetische Integrität der hESC 3,6 Kompromiss. Sobald chromosomalen Veränderungen beeinflussen könnten zelluläre Physiologie, ist die Charakterisierung der genetischen Integrität der hESC in vitro entscheidend angesichts hESC als wesentliches Instrument in der Embryogenese Studien und Drogentests. Darüber hinaus für zukünftige therapeutische Zwecke chromosomalen Veränderungen sind ein echtes Problem, wie es häufig zur Krebsentstehung verbunden.
Hier zeigen wir eine einfache und nützliche Methode, um qualitativ hochwertige Chromosom Spreads für die anschließende Analyse des Chromosoms von G-banding, FISH, SKY oder CGH-Techniken 7,8 eingestellt zu erhalten. Wir empfehlen die Überprüfung der chromosomalen Status routinemäßig mit Intervallen von 5 Passagen, um das Auftreten von Translokationen und Aneuploidien Monitor
Priscila Britto und Rafaela Sartore trugen zu gleichen Teilen auf das Papier.
Protokoll
EQUIPMENT
- Gewebekultur-Inkubator bei 37 ° C, 5% CO 2
- Zentrifuge
- Set von micropipettors (100, 100 &mgr;)
- Wasserbad 37 ° C
- Wasserbad 90 ° C bis Dampfquelle Wasser
- Phasenkontrast-Mikroskop
FIRST STEP
Die Behandlung der Zellen mit Colcemid
In diesem Verfahren verwendeten wir die hESC line H9 auf embryonalen Maus-Fibroblasten (MEF) mit Mitomycin C (Sigma) inaktiviert und gepflegt in DMEM/F12 (Invitrogen) kultiviert, ergänzt mit 20% Knockout Serumersatz (KSR, Gibco) und 8ng/mL der Fibroblasten-Wachstumsfaktor (FGF-2, R & D).
Um eine große Anzahl von Metaphasen Spreads zu erhalten, empfiehlt es sich, Kulturen mit hohem Mitoseindex in denen es viele gibt sich teilenden Zellen zu verwenden.
- Nehmen Sie die Kulturflasche aus dem Inkubator und, in der laminaren Strömung, fügen Colcemid in einer Endkonzentration von 0,1 pg / mL.
- Bringen Sie den Kolben in den Inkubator und warten 3 Stunden so der Inhibitor mitotischen Arrest auf Metaphase, wenn sich die Chromosomen und werden kondensiert und können leicht sichtbar unter dem Mikroskop verursachen können.
Fixierung der Zellen
- Nehmen Sie das Medium und fügen tripsin / EDTA 0,05% ausreichen, um die Zellen bedecken. Lassen Zellen für 5 Minuten bei Raumtemperatur inkubieren und dann inaktiviert das Enzym entweder durch Zugabe Kulturmedium mit Serum oder einfach nur mit Serum zu den Zellen.
HINWEIS: Es ist darauf zu achten, dass eine einzige Zellsuspension erreicht ist, gute Metaphase Spreads zu erhalten. - Übertragen Sie die Zellen in ein 15 mL Zentrifugenröhrchen und Zentrifuge bei 122 g für 5 Minuten.
- Überstand verwerfen, so dass etwa 200 ml, und das Pellet vorsichtig durch Antippen der Röhre, wie in dem Video zu sehen. Achten Sie darauf, die Zellen sind gut dissoziiert, so kann man nicht visualisieren alle Klümpchen in der Lösung.
- Weiter benötigen Sie, um 5 ml hypotonische Lösung (KCl 75mm) vorgewärmt auf 37 ° C, langsam, durch die Rohrwand als in der folgenden Beschreibung. Hinzufügen Fügen Sie zunächst 3 ml, das Röhrchen in eine horizontale Position, nur um die Zellen mit dem hypotonischen Lösung dann mischen fügen Sie die restlichen 2 ml und halten bei 37 ° C erwärmen für 15 Minuten.
HINWEIS: Zu diesem Zeitpunkt der hypotonischen Lösung wird ein Anstieg auf die zelluläre Volumen führen und dazu beitragen, die Chromosomen entwirren. Die Inkubationszeit ist wichtig, gute Chromosom Spreads zu erwerben. Wenn das Timing zu lang ist, kann die Zellmembran platzen zu früh und Chromosomen verloren gehen. Wenn er zu kurz, kann es schwierig sein, Chromosom-Spreads zu erhalten, da die Zellmembran nicht stören kann. - 3 Tropfen der Fixierlösung (Methanol / Eisessig 3:1), das Röhrchen vorsichtig, um die Fixierlösung mit den Zellen und Zentrifuge bei 122 g für 5 Minuten ohne Pause zu mischen.
HINWEIS: Die Fixierlösung sollte frisch zubereitet werden.
HINWEIS: Es ist wichtig, Zentrifugation, ohne zu brechen, um Zellen Abrieb zu vermeiden verwenden, verhindert Verlust des Materials. - Überstand verwerfen, so dass etwa 200 ml, und das Pellet vorsichtig durch Antippen der Boden des Röhrchens.
HINWEIS: Auch hier stellen Sie sicher, die Zellen sind gut dissoziiert, so kann man nicht visualisieren keine Klumpen in der Lösung. - Fügen Sie die ersten 3 ml Fixierlösung, langsam durch die Rohrwand, während Sie das Rohr zu drehen. Drehen Sie die Röhre in eine horizontale Position, nur um die Zellen zu mischen, und fügen Sie dann weitere 2 ml der Fixierlösung durch die Rohrwand an die Zellen take down. Lager bei 4 ° C über Nacht.
HINWEIS: Die fixierten Zellen können in Fixierlösung für Monate bei 4 ° C gelagert Neben dem Schutz Zellen in ihrem gequollenen Zustand entfernt die Fixierlösung Lipide und Proteine denaturiert. Diese Ereignisse machen die Zellmembran zerbrechlich und, als Folge, zu dem Chromosom Verbreitung einfach.
REINIGUNG Die Glasträger
Bevor Ihre Chromosomen verteilt sicherstellen, dass Ihre Folien ordnungsgemäß gereinigt oder Sie können einige Kerne verlieren und auch Metaphasen. Dieser Schritt ist ebenso wichtig, wenn Sie keine Hybridisierungstechnik 9 Ausprobieren wollen.
- Die Objektträger in ein Becherglas mit 6M HCl für mindestens 3 h bei Raumtemperatur.
- Nach dieser Zeit, waschen Dias in fließendem Leitungswasser für 10 Minuten.
- Spülen Sie die Folien in destilliertem Wasser und lassen sie bei Raumtemperatur trocknen.
- Nun ist die Dias können in 96% Ethanol gelagert und getrocknet werden mit einem fusselfreien unmittelbar vor der Verwendung.
Hinweis: Für in-situ-Hybridisierung Methoden können die Folien nicht mehr als 2 Tage in 96% Ethanol gelagert werden
ZWEITER SCHRITT
Waschen der Zellen
- Am nächsten Tag, Zentrifuge die Zellen bei 122 g für 5 Minuten ohne Pause.
- Discard der Überstand bis auf ca. 200 ml. Das Pellet durch vorsichtiges flicking das Rohr dann mit 5 ml frischer Fixierlösung (Methanol / Eisessig 3:1), langsam durch die Rohrwand beim Drehen des Rohres. Wiederholen Sie diesen Waschschritt 2 weitere Male für insgesamt drei Wäschen.
HINWEIS: Die Fixierlösung sollte frisch zubereitet werden.
Vorbereitung der Objektträger
- Bei der letzten Zentrifugationsschritt ein ausreichender Menge Lösung, um das Zellpellet homogenisieren und erhalten eine ausreichende Dichte der Zellen in der Folien (siehe Abbildung 1).
- Add 20-30 ul Zellsuspension auf einen sauberen trockenen Objektträger, indem Sie die Pipette sehr nahe und parallel zur Oberfläche. Als Fixierlösung verdunstet, wird die Oberfläche der Folie körnig.
- Sofort setzen die Folie, nach oben, in den Dampf von heißem Wasser (90 °) für 30 Sekunden, um zu bewirken die Zellen platzen.
HINWEIS: Zu diesem Zeitpunkt das Methanol aus der Fixierlösung verdampft, was zu einer erhöhten Essigsäure-Konzentration, die zusammen mit dem Wasser stimuliert das Chromosom zu verbreiten. - Schauen Sie sich ein Phasenkontrast-Mikroskop nur zu prüfen, ob die Konzentration sowie die Zell-Verteilung ist gut (siehe Abbildung 1).
- Nun ist die Dias sind bereit, verwendet werden, um den Satz von Chromosomen durch Zytogenetik Ansätze als G-banding (Giemsa), FISH, SKY oder CGH zu überprüfen.
WICHTIGE HINWEISE
Wie wählen Sie den passenden Metaphase zu analysierenden
Die Auswahl um und isoliert Metaphasen (Abbildung 2d), können Sie vermeiden, angesichts falsche Aneuploidien wie die Verstärkung der Chromosomen von zwei oder mehr erzeugt breitet sich untereinander gemischt oder den Verlust von Chromosomen von einem Start-Chromosom erzeugt. So vermeiden Wahl Metaphasen in der Nähe Kerne, weil einige von ihnen Chromosomen (Abb. 2A und 2B) versteckt sein können. Außerdem für runde Metaphasen aussehen und sicher sein, dass jedes Chromosom aus der Metaphase (Abb. 2C) getrennt ist.
Feeder-Zellen und die hESC Karyotyp
Für G-banding und SKY-Analyse, ist die Anwesenheit von Feeder-Zellen in hESC Kultur mit dem Ergebnis nicht stören, weil Feeder-Zellen nicht unter eine Trennungslinie Zustand (inaktiviert durch Mitomycin C oder Bestrahlung) und wird nicht Teil der Metaphase Bevölkerung. Doch für die Anwendung der FISH-Technik in Interphase-Kernen, ist es bevorzugt, die hESC Bevölkerung von Feeder-Zellen getrennt durch Ernten der Kolonien manuell vor Trypsinierung für FISH-Analyse.

Abbildung 1: Wie wissen die entsprechenden Zelldichte in den Folien. Bilder von Phasenkontrast-Mikroskop in 10-fach Objektiv. (A) Die Zelldichte ist zu hoch. Die Pfeile zeigen die Spreads zu nahe der Kerne Metaphase. (B) Eine Folie mit guter Zelldichte. Die Kreise zeigen Metaphasen breitet sich von Kernen oder anderen Metaphasen isoliert. Bitte klicken Sie hier, um eine größere Version der Abbildung 1 zu sehen.
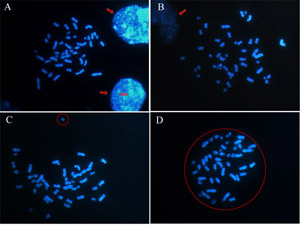
Abbildung 2: Wie man eine angemessene Metaphase zu analysierenden wählen. Chromosomen sind mit DAPI und die Bilder durch ein Fluoreszenzmikroskop in 100x-Objektiv erhalten gefärbt. (A) (B) Vermeiden Sie Metaphasen in der Nähe Kerne (angedeutet durch die Pfeile) (C) und Metaphasen nicht rund vorhandenen Chromosomen (Kreis) getrennt. (D) Ein runder Metaphase ist ein guter Metaphasen analysiert werden. Bitte klicken Sie hier, um eine größere Version der Abbildung 2 zu sehen.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die Vorbereitung des Chromosoms verbreitet ist ein wichtiger Schritt für eine erfolgreiche Analyse des genetischen Status von embryonalen Stammzellen durch die routinemäßig Techniken wie G-banding, und anspruchsvollere Techniken wie FISH, SKY und CGH.
Dieses Verfahren kann für viele Zelltypen durch Variation der Zeit der Colcemid Inkubation, die auf der Dauer des Zellzyklus hängt angewendet werden. Für Kolonien von embryonalen Stammzellen, warten wir 3 Stunden, während für Embryoidk?...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
The authors have nothing to disclose.
Materialien
| Name | Company | Catalog Number | Comments |
| 15 ml centrifuge tube | Techno Plastic Products | 91015 | |
| Colcemid Karyo MAX | GIBCO, by Life Technologies | 15212-012 | |
| EDTA | Isofar | 721 | |
| Glacial acetic acid | Isofar | 100 | |
| Methanol | Isofar | 208 | |
| Potassium Chloride (KCl) | Merck & Co., Inc. | 104.931.000 | |
| Slide | Bioslide | 7105-1 | |
| Tripsin | Sigma-Aldrich | T4799 |
Referenzen
- Thomson, J. A. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1145 (1998).
- Draper, J. S. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nat Biotechnol. 22 (1), 53-53 (2004).
- Maitra, A. Genomic alterations in cultured human embryonic stem cells. Nat Genet. 37 (10), 1099-1099 (2005).
- Mitalipova, M. M. Preserving the genetic integrity of human embryonic stem cells. Nat Biotechnol. 23 (1), 19-19 (2005).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nat Biotechnol. 22 (4), 381-381 (2004).
- Caisander, G. Chromosomal integrity maintained in five human embryonic stem cell lines after prolonged in vitro culture. Chromosome Res. 14 (2), 131-131 (2006).
- Imreh, M. P. In vitro culture conditions favoring selection of chromosomal abnormalities in human ES cells. J Cell Biochem. 99 (2), 508-508 (2006).
- Robin-Wesselschmidt, J. L. Human Stem Cell Manual. Loring, J. F., Robin-Wesselschmidt, J. L., Robin-Wesselschmidt, S. chwartz , Elsevier's Science & Technology Rights. California. 59-59 (2007).
- Rooney, D. E. Human Cytogenetics. , Third Edition, Oxford University Press. (2001).
- Heslop-Harrison, P., Schwarzacher, T. Practical in situ hybridization. Heslop-Harrison, P., Schwarzacher, T. , BIOS Scientific Publishers. Oxford. 51-51 (2000).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten