Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation Étaler chromosomique des cellules souches embryonnaires humaines pour le caryotype
Dans cet article
Résumé
Caryotype est une technique simple et utile largement utilisé pour détecter les altérations génétiques. Nous décrivons ici une étape par étape pour la préparation du protocole propagation de chromosomes de cellules souches embryonnaires humaines pour la surveillance du statut chromosomique de ces cellules maintenues en culture.
Résumé
Bien cellules souches embryonnaires humaines (CSEh) ont été montrés à présenter un caryotype diploïde stables 1, de nombreuses études ont rapporté que, selon les conditions de culture, ils deviennent sujets à acquérir des anomalies chromosomiques telles que l'addition de tout ou parties de chromosomes. En effet, durant culture à long terme, les altérations chromosomiques sont observées lors de dissociation enzymatique ou chimique sont utilisés 2,3,4, tandis que la dissection manuelle des colonies pour repiquage conserve un caryotype stables 5. Par ailleurs, des changements dans l'environnement telles que la suppression de cellules nourricières semblent également compromettre l'intégrité génétique des CSEh 3,6. Une fois altérations chromosomiques peuvent affecter la physiologie cellulaire, la caractérisation de l'intégrité génétique des CSEh in vitro est cruciale CSEh considérant comme un outil essentiel dans les études de l'embryogenèse et de dépistage des drogues. Par ailleurs, pour l'avenir à des fins thérapeutiques modifications chromosomiques sont une réelle préoccupation car elle est souvent associée à la cancérogenèse.
Ici, nous montrons une méthode simple et utile pour obtenir une haute qualité pour les étalements de chromosomes analyse subséquente du chromosome fixé par G-banding, FISH, le ciel ou les techniques de CGH 7,8. Nous vous recommandons de vérifier le statut chromosomique régulièrement avec des intervalles de 5 passages afin de surveiller l'apparition de translocations et aneuploïdies
Priscila Britto et Rafaela Sartore contribué de façon égale sur le papier.
Protocole
EQUIPEMENT
- Culture tissulaire incubateur, 37 ° C, 5% de CO 2
- Centrifugeuse
- Jeu de micropipettes (100, 100 ul)
- 37 ° C Bain-marie
- Bain-marie 90 ° C pour être source de vapeur d'eau
- Microscope à contraste de phase
PREMIÈRE ÉTAPE
Traitant les cellules avec colcémide
Dans cette procédure, nous avons utilisé la ligne H9 de CSEh cultivés sur des fibroblastes embryonnaires de souris (MEF) inactivé à la mitomycine C (Sigma) et maintenu en DMEM/F12 (Invitrogen) complémenté avec de remplacement KO 20% de sérum (KSR, Gibco) et des 8ng/mL facteur de croissance des fibroblastes (FGF-2, R & D).
Afin d'obtenir un grand nombre de métaphases propage, il est recommandé d'utiliser des cultures avec l'index mitotique élevé dans lequel il ya beaucoup de cellules qui se divisent.
- Prenez le flacon de culture de l'incubateur et, dans le flux laminaire, ajouter Colcemid à une concentration finale de 0,1 g / mL.
- Retourner le flacon dans l'incubateur et attendre 3 heures pour l'inhibiteur peut provoquer un arrêt mitotique sur métaphase, quand les chromosomes sont bien condensée et peut être facilement visualisés au microscope.
Fixation des cellules
- Sortez le moyen et ajouter trypsine / EDTA 0,05% suffisante pour couvrir la surface des cellules. Laisser les cellules à incuber pendant 5 minutes à température ambiante, puis inactiver l'enzyme soit en ajoutant un milieu de culture contenant du sérum ou en ajoutant simplement du sérum pour les cellules.
NOTE: Il est important de s'assurer que la suspension seule cellule est réalisée pour obtenir une bonne propage métaphase. - Transférer les cellules dans un tube à centrifugation de 15 ml et centrifuger à 122 g pendant 5 minutes.
- Jeter le surnageant, laissant environ 200 ml, et remettre le culot délicatement en tapotant le tube, comme le montre la vidéo. Assurez-vous que les cellules sont bien dissociés, de sorte que vous ne pouvez pas visualiser les grumeaux dans la solution.
- Ensuite, vous aurez besoin d'ajouter 5 ml de solution hypotonique (KCl 75mm) pré-chauffé à 37 ° C, lentement, par la paroi du tube comme dans la description suivante. Premièrement, ajoutez 3 ml, inverser le tube dans une position horizontale juste de mélanger les cellules avec la solution hypotonique puis ajouter le reste, soit 2 ml et garder au chaud à 37 ° C pendant 15 minutes.
NOTE: A ce point la solution hypotonique entraîne une augmentation du volume cellulaire et aider à démêler les chromosomes. Le temps d'incubation est important d'acquérir des étalements de chromosomes bon. Si le timing est trop long, la membrane cellulaire peut éclater trop tôt et les chromosomes sont perdus. S'il est trop court, il peut être difficile d'obtenir étalements de chromosomes, car la membrane cellulaire peut ne pas perturber. - Ajouter 3 gouttes de la solution de fixateur (méthanol / acide acétique glacial 3:1), inverser le tube délicatement pour mélanger la solution de fixation avec les cellules et centrifuger à 122 g pendant 5 minutes sans pause.
REMARQUE: La solution de fixation doit être fraîchement préparé.
NOTE: Il est important d'utiliser la centrifugation sans rupture pour éviter attrition des cellules, empêchant la perte de la matière. - Jeter le surnageant, laissant environ 200 ml, et remettre le culot délicatement en tapotant le fond du tube.
REMARQUE: Encore une fois, assurez-vous que les cellules sont bien dissociés, de sorte que vous ne pouvez pas visualiser les grumeaux dans la solution. - Ajouter le premier 3 mL de la solution de fixation, lentement par la paroi du tube, tandis que vous faites pivoter le tube. Inverser le tube en position horizontale juste pour mélanger les cellules, puis ajouter plus de 2 mL de la solution de fixation par la paroi du tube de prendre les cellules vers le bas. Stock à 4 ° C pendant la nuit.
REMARQUE: Les cellules fixées peuvent être stockées dans la solution de fixation pour les mois à 4 ° C. Outre la protection des cellules dans leur état gonflé, la solution de fixation élimine lipides et des protéines dénature. Ces événements font la membrane cellulaire fragile et, par conséquent, faire le chromosome répandre facilement.
NETTOYAGE les lames de verre
Avant de commencer de faire votre étalements de chromosomes faire en sorte que vos diapositives sont correctement nettoyées ou vous risquez de perdre certains noyaux et les métaphases aussi. Cette étape est aussi bien important si vous voulez essayer une technique 9 hybridation.
- Placer les lames dans un bécher contenant HCl 6M pendant au moins 3 h à température ambiante.
- Après ce temps, laver les lames à l'eau courante pendant 10 minutes.
- Rincer les lames dans de l'eau distillée et laisser leur sec à température ambiante.
- Maintenant, les diapositives peuvent être stockés dans l'éthanol 96% et séché avec un chiffon non pelucheux immédiatement avant l'utilisation.
REMARQUE: Pour des méthodes d'hybridation in situ, les diapositives peuvent pas être stockés pendant plus de 2 jours dans 96% d'éthanol
DEUXIÈME ÉTAPE
Le lavage des cellules
- Le lendemain, centrifuger les cellules à 122 g pendant 5 minutes sans pause.
- Discard le surnageant en laissant environ 200 ml. Reprendre le culot par un léger effleurant le tube puis ajouter 5 ml de solution de fixateur frais (méthanol / acide acétique glacial 3:1), lentement par la paroi du tube tout en tournant le tube. Répétez cette étape de lavage 2 fois plus pour un total de trois lavages.
REMARQUE: La solution de fixation doit être fraîchement préparé.
Préparation de la glisse
- À l'étape de centrifugation dernière laissez quantité suffisante de solution d'homogénéiser le culot cellulaire et d'obtenir une densité suffisante de cellules dans les lames (voir figure 1).
- Ajouter 20 à 30 uL de suspension cellulaire sur une lame propre et sec en déplaçant la pipette très proche et parallèle à la surface. Comme l'évaporation la solution de fixation, la surface de glissement devient granuleuse.
- Immédiatement, d'exposer la diapositive, face vers le haut, dans la vapeur d'eau chaude (90 °) pendant 30 secondes pour provoquer les cellules exploser.
REMARQUE: En ce moment, le méthanol à partir de l'évaporation de la solution de fixation, résultant en une augmentation de la concentration d'acide acétique, qui, ensemble avec l'eau stimule le chromosome se propager. - Regardez un microscope à contraste de phase juste pour vérifier si la concentration ainsi que la distribution des cellules est bonne (voir figure 1).
- Maintenant, les diapositives sont prêts à être utilisés pour vérifier l'ensemble des chromosomes par des approches cytogénétique comme le G-banding (Giemsa), le poisson, le ciel ou la CGH.
Conseils importants
Comment choisir un métaphase suffisante pour être analysés
Choisir métaphases ronde et isolée (figure 2D), vous pouvez éviter de considérer aneuploïdies fausse que le gain de chromosomes générés par deux ou plusieurs planches mélangés entre eux ou la perte de chromosomes générés par un chromosome lancé. Donc, évitez de choisir métaphases proximité des noyaux car certains chromosomes peuvent être cachés par eux (figure 2A et 2B). En outre, chercher des métaphases rond et être sûr que tout le chromosome est séparé de la métaphase (figure 2C).
Cellules nourricières et le caryotype des CSEh
Pour G-banding et de l'analyse SKY, la présence de cellules nourricières dans la culture des CSEh ne pas interférer avec les résultats, parce que des cellules nourricières ne sont pas dans un état de division (inactivé par la mitomycine C ou irradiation) et ne fera pas partie de la population en métaphase. Cependant, pour l'application de la technique FISH dans les noyaux interphasiques, il est préférable de séparer la population de CSEh à partir des cellules nourricières par la récolte des colonies manuellement avant trypsinisation pour l'analyse FISH.

Figure 1: Comment connaître la densité cellulaire appropriée, dans les diapositives. Les images de microscopie à contraste de phase dans l'objectif 10x. (A) La densité cellulaire est trop élevée. Les flèches indiquent la métaphase propage trop près des noyaux. (B) Un diaporama avec une bonne densité cellulaire. Les cercles indiquent propage métaphases isolés à partir des noyaux ou métaphases d'autres. S'il vous plaît cliquez ici pour voir une version agrandie de la figure 1.
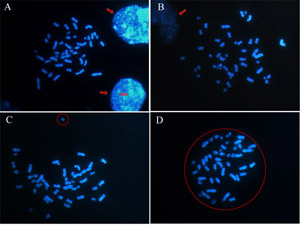
Figure 2: Comment choisir une métaphase suffisante pour être analysés. Les chromosomes sont colorés avec DAPI et les images obtenues par un microscope à fluorescence dans l'objectif 100x. (A) (B) Éviter métaphases proximité des noyaux (indiqué par les flèches) (C) et métaphases pas rond que les chromosomes présents séparés (cercle). (D) A la métaphase ronde est une bonne métaphase pour être analysés. S'il vous plaît cliquez ici pour voir une version agrandie de la figure 2.
Access restricted. Please log in or start a trial to view this content.
Discussion
La préparation des étalements de chromosomes est une étape critique pour une analyse réussie de l'état génétique des cellules souches embryonnaires par des techniques couramment comme le G-banding et des techniques plus sophistiquées telles que le poisson, SKY et CGH.
Cette procédure peut être appliquée pour de nombreux types cellulaires en faisant varier la période d'incubation colcémide, qui dépend de la longueur du cycle cellulaire. Pour des colonies de cellules souc...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
The authors have nothing to disclose.
matériels
| Name | Company | Catalog Number | Comments |
| 15 ml centrifuge tube | Techno Plastic Products | 91015 | |
| Colcemid Karyo MAX | GIBCO, by Life Technologies | 15212-012 | |
| EDTA | Isofar | 721 | |
| Glacial acetic acid | Isofar | 100 | |
| Methanol | Isofar | 208 | |
| Potassium Chloride (KCl) | Merck & Co., Inc. | 104.931.000 | |
| Slide | Bioslide | 7105-1 | |
| Tripsin | Sigma-Aldrich | T4799 |
Références
- Thomson, J. A. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1145 (1998).
- Draper, J. S. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nat Biotechnol. 22 (1), 53-53 (2004).
- Maitra, A. Genomic alterations in cultured human embryonic stem cells. Nat Genet. 37 (10), 1099-1099 (2005).
- Mitalipova, M. M. Preserving the genetic integrity of human embryonic stem cells. Nat Biotechnol. 23 (1), 19-19 (2005).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nat Biotechnol. 22 (4), 381-381 (2004).
- Caisander, G. Chromosomal integrity maintained in five human embryonic stem cell lines after prolonged in vitro culture. Chromosome Res. 14 (2), 131-131 (2006).
- Imreh, M. P. In vitro culture conditions favoring selection of chromosomal abnormalities in human ES cells. J Cell Biochem. 99 (2), 508-508 (2006).
- Robin-Wesselschmidt, J. L. Human Stem Cell Manual. Loring, J. F., Robin-Wesselschmidt, J. L., Robin-Wesselschmidt, S. chwartz , Elsevier's Science & Technology Rights. California. 59-59 (2007).
- Rooney, D. E. Human Cytogenetics. , Third Edition, Oxford University Press. (2001).
- Heslop-Harrison, P., Schwarzacher, T. Practical in situ hybridization. Heslop-Harrison, P., Schwarzacher, T. , BIOS Scientific Publishers. Oxford. 51-51 (2000).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon