Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Karyotipik İnsan Embriyonik Kök Hücreleri kromozom Yayılı Hazırlık
Özet
Karyotipleme genetik değişiklikler tespit etmek için yaygın olarak kullanılan basit ve kullanışlı bir bir tekniktir. Burada bakımı, kültür bu hücrelerin kromozom durum izleme için insan embriyonik kök hücrelerin kromozom yayılmış hazırlık için adım protokol tarafından bir adım açıklanmaktadır.
Özet
Insan embriyonik kök hücreleri (hESC) istikrarlı bir diploid karyotip 1 sunmak için gösterilmiş olsa da, pek çok çalışmada, kültür koşullarına bağlı olarak bütün ek veya kromozom parçaları gibi kromozomal anomaliler elde eğilimli hale bildirmişlerdir. Gerçekten de, enzimatik veya kimyasal disosiasyon 2,3,4 kullanıldığında Pasajlanması için koloniler manuel diseksiyon istikrarlı bir karyotip 5 korur, uzun vadeli kültür sırasında karyotipik değişiklikler gözlenir. Bunun yanı sıra, besleyici hücrelerin ortadan kaldırılması gibi çevre değişiklikleri de hESC 3,6 genetik bütünlüğünü tehlikeye görünüyor. Kromozomal bozukluklar önemli dikkate alınarak hESC embriyogenez çalışmaları ve uyuşturucu testi için gerekli bir araç olarak, in vitro genetik bütünlüğü hESC karakterizasyonu hücresel fizyoloji etkileyebilir. Ayrıca, gelecekte tedavi amaçlı kromozomal değişiklikler sık karsinogenez ilişkili olarak gerçek bir endişe vardır.
Burada G-bantlama, FISH, SKY veya CGH teknikleri 7,8 kromozom sonraki analiz için yüksek kalitede kromozom yayılır elde etmek için basit ve kullanışlı bir yöntem gösteriyor . Translokasyonlar ve anöploidiler görünümünü izlemek için rutin kromozomal durumu 5 pasajların aralıklarla kontrol etmenizi öneririz
Priscila Britto ve Rafaela Sartore kağıt üzerinde eşit olarak katkıda bulundu.
Protokol
EKİPMAN
- Doku kültürü inkübatör, 37 ° C,% 5 CO 2
- Santrifüj
- Set micropipettors (100 100μL)
- Su banyosu, 37 ° C
- Su banyosu, 90 ° C buhar su kaynağı olarak
- Faz kontrast mikroskobu
İLK ADIM
Colcemid ile hücrelerin tedavisi
Bu prosedürde,% 20 nakavt serum replasmanı (KSR, Gibco) ve 8ng/mL, ile desteklenmiş, mitomisin C (Sigma) ile inaktive ve DMEM/F12 (Invitrogen) muhafaza fare embriyonik fibroblastlar (MEF) üzerine kültür H9 hESC hattı fibroblast büyüme faktörü (FGF-2, Ar-Ge).
Metafaz yayılır, çok sayıda elde etmek için, birçok bölünen hücreleri vardır yüksek mitotik indeksi ile kültürlerin kullanılması tavsiye edilir.
- Inkübatör kültür şişesi alın ve laminer akış, son bir 0,1 mg / ml konsantrasyonda Colcemid eklemek.
- Inkübatör balon dönün ve 3 saat bekleyin inhibitörü, kromozomlar yoğunlaşmış ve mikroskop altında kolayca görüntülenebilmekte metafaz, mitoz tutuklama neden olabilir.
Hücrelerin Tespit
- Orta çıkarın ve hücrelerin yüzeyini kaplayan tripsin / EDTA% 0.05 'yeterli eklemek. Hücreleri oda sıcaklığında 5 dakika inkübe edin ve sonra serum içeren kültür ortamı ekleyerek veya sadece hücreler serum ekleyerek ya enzim inaktive etmek için izin verin.
NOT: iyi metafaz yayılır elde etmek için tek bir hücre süspansiyonu elde edilir emin yapmak için çok önemlidir. - 15 ml santrifüj tüpüne ve 5 dakika boyunca 122 g santrifüj hücrelere aktarın.
- 200 ml hakkında bırakarak süpernatantı atın ve hafifçe videoda gösterildiği gibi tüp, dokunarak pelet tekrar süspansiyon haline getirin. Hücrelerin iyi ayrışmış, bu nedenle çözüm kümeleri görselleştirmek emin olun.
- Sonra 5 ml hipotonik çözüm (KCl 75mm) 37 önceden ısıtılmış ° C, yavaş yavaş, aşağıdaki açıklamayı olduğu gibi tüp duvar eklemeniz gerekecektir İlk tüp invert hipotonik bir çözüm hemen sonra hücrelerin bir arada kalan 2 ml ekleyin ve 37 sıcak tutmak ° C 15 dakika boyunca yatay konumda, 3 ml ekleyin.
NOT: Bu noktada hipotonik çözüm hücresel birimde bir artışa neden ve kromozomlar ayıklayabilir yardımcı olacaktır. Inkübasyon süresi, iyi bir kromozom elde etmek için önemlidir. Zamanlaması çok uzun ise, hücre zarı, çok erken ve kromozomlar kaybolur patlayabilir. Eğer çok kısa olursa, hücre zarı bozabilir çünkü kromozom yayılır elde etmek zor olabilir. - Fiksatif solüsyonu (metanol / asetik asit buzul 03:01) 3 damla ekleyin, 5 dakika ara vermeden 122 g hücreleri ve santrifüj fiksatif çözüm karıştırmak için tüp nazikçe çevirin.
NOT: fiksatif solüsyon taze yapılmalıdır.
NOT: malzeme kaybını önleyerek, hücrelerin yıpratma önlemek için ara vermeden santrifüj kullanmak önemlidir. - 200 ml hakkında bırakarak süpernatantı atın ve yavaşça tüpün alt dokunarak pelet tekrar süspansiyon haline getirin.
NOT: Yine, hücrelerin iyi ayrışmış, bu nedenle çözüm kümeleri görselleştirmek emin olun. - Tüp döndürmek ederken, yavaş yavaş, fiksatif çözüm tüp duvar ilk 3 mL ekleyin. Hücrelerin karışımı, ve daha sonra tüp duvar hücreleri aşağı çekmek için 2 mL fiksatif çözüm daha eklemek için yatay pozisyonda Tüpü ters çevirin. 4 ° C gecede Stok.
NOT: sabit hücreler, 4 ay için sabitleştirici çözüm saklanabilir ° C Kendi şişmiş durumda hücrelerini koruyarak yanı sıra, fiksatif çözüm lipitleri ve denatüre proteinlerin ortadan kaldırır. Bu olaylar sonucunda, kromozom kolayca yayılmasını, hücre zarının kırılgan yapmak ve.
CAM KAYDIRAKLARI TEMİZLİK
Kromozom yayılır slaytlarınız düzgün bir şekilde temizlenir veya bazı çekirdeklerin kaybedebilirsiniz ve aynı zamanda metafaz ki emin olun başlamadan önce. Eğer herhangi bir hibridizasyon tekniği 9 denemek istiyorsanız bu adımı yanı sıra önemlidir .
- Yeri oda sıcaklığında en az 3 saat 6M HCl içeren bir beher slaytlar.
- Bu süreden sonra, 10 dakika boyunca çalışan musluk suyu slaytlar yıkayın.
- Slaytları distile su ile çalkalayın ve oda sıcaklığında kurumaya bırakın.
- Şimdi slaytlar% 96 etanol içinde saklanan ve kullanmak için bir havsız hemen önce kurutulmuş olabilir.
NOT: situ hibridizasyon yöntemleri için, slaytlar, en fazla 2 gün boyunca% 96 etanol içine saklanabilir olamaz
İkinci adım
Çamaşır hücreler
- Ertesi gün, 5 dakika ara vermeden 122 g hücreler santrifüj.
- D200 ml bırakarak süpernatant iscard. Nazikçe tüp dönerken tüp tüp duvar sonra yavaş yavaş taze fiksatif solüsyonu 5 ml (metanol / asetik asit buzul 03:01) eklemek Flicking pelletini tekrar. Bu yıkama üç yıkama olmak üzere toplam 2 kez daha adımı yineleyin.
NOT: fiksatif solüsyon taze yapılmalıdır.
Slaytlar hazırlanması
- (Bkz. Şekil 1) hücre pelletini homojenize ve slaytlar hücrelerin yeterli bir yoğunluk elde etmek için çözüm son santrifüj aşamada yeterli miktarda bırakın.
- 20-30 mcL hücre süspansiyonu, temiz ve kuru bir slayt yüzeye çok yakın ve paralel hareket pipet üzerine ekleyin. Fiksatif çözüm buharlaşır gibi, slayt yüzeyi grenli olur.
- Hemen havaya uçurmak hücrelerin neden 30 saniye süreyle sıcak su, buhar (90 °) içine, slayt maruz yüzü yukarı.
NOT: Şu anda, asetik asit konsantrasyonu artmış ile sonuçlanan, metanol, fiksatif çözüm buharlaşır, su ile birlikte yayılan kromozom uyarır. - Açabildiği gibi, hücre dağılımı (bkz. Şekil 1) iyi olup olmadığını kontrol etmek için bir faz kontrast mikroskobu bakın.
- Şimdi slaytlar G-bantlama (Giemsa), FISH, SKY veya CGH gibi yaklaşımlar sitogenetik kromozom seti kontrol etmek için kullanılmaya hazır.
ÖNEMLİ İPUÇLARI
Nasıl tercih analiz edilmesi için yeterli bir metafaz
Yuvarlak ve izole metafaz (Şekil 2B) seçmek, iki veya daha fazla kromozom kazanç birlikte karışık veya başlattı kromozom tarafından oluşturulan kromozom kaybı yayılır yanlış anöploidiler dikkate kaçınmak olabilir. Yani, bazı kromozom (Şekil 2A ve 2B) tarafından gizli olabilir çünkü çekirdekleri yakın metafaz seçerek kaçının. Ayrıca, yuvarlak metafaz bakmak ve herhangi bir kromozom metafaz (Şekil 2C) ayrılmış olduğundan emin olun.
Besleyici hücreleri ve hESC karyotip
G-bantlama ve SKY analizi için, besleyici hücreler bölünerek devlet (mitomisin C veya ışınlama ile inaktif) altında değildir ve metafaz nüfusunun parçası olmayacaktır çünkü besleyici hücreler hESC kültür varlığı, sonuçları ile müdahale değildir. Ancak,, interfaz çekirdekleri FISH tekniğinin uygulanması için, besleyici hücrelerin koloniler FISH analizi için trypsinization önce elle hasat hESC nüfus ayırmak için tercih edilir.

Şekil 1: slayt uygun hücre yoğunluğu nasıl biliyoruz. 10x objektif faz kontrast mikroskop görüntülerini. (A) hücre yoğunluğu çok yüksek. Ok çok yakın çekirdekleri yayılır metafaz işaret etmektedir. (B) iyi bir hücre yoğunluğu ile bir slayt. Çevreler, çekirdekleri veya diğer metafaz izole metafaz yayılır göstermektedir. Lütfen Şekil 1'de bir büyük halini görmek için buraya tıklayınız .
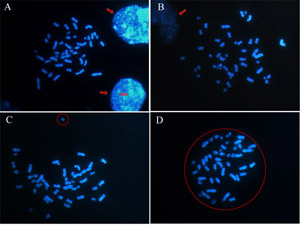
Şekil 2: Nasıl analiz edilmesi için yeterli bir metafaz seçin. Kromozomlar DAPI ve 100x objektif bir floresan mikroskobu ile elde edilen görüntüler ile boyandı. (A) (B) çekirdekleri yakın metafaz kaçının (oklarla gösterilen) (C) ve mevcut kromozom ayrılmış (daire) yuvarlak değil metafaz. (D) yuvarlak metafaz analiz edilmesi için iyi bir metafaz. Lütfen Şekil 2'de büyük halini görmek için buraya tıklayın .
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Kromozom yayılır hazırlık, G-bantlama ve BALIK, SKY ve CGH gibi daha sofistike teknikler olarak rutin teknikleri ile embriyonik kök hücrelerin genetik bir durum başarılı bir analiz için önemli bir adım.
Bu prosedür, hücre döngüsü uzunluğu bağlıdır colcemid kuluçka döneminde değişen birçok hücre tipleri için uygulanabilir. (EB) embriyoid organları için bu süre 6 saate kadar ise embriyonik kök hücre kolonileri için, biz 3 saat bekleyin.
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
The authors have nothing to disclose.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 ml centrifuge tube | Techno Plastic Products | 91015 | |
| Colcemid Karyo MAX | GIBCO, by Life Technologies | 15212-012 | |
| EDTA | Isofar | 721 | |
| Glacial acetic acid | Isofar | 100 | |
| Methanol | Isofar | 208 | |
| Potassium Chloride (KCl) | Merck & Co., Inc. | 104.931.000 | |
| Slide | Bioslide | 7105-1 | |
| Tripsin | Sigma-Aldrich | T4799 |
Referanslar
- Thomson, J. A. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1145 (1998).
- Draper, J. S. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nat Biotechnol. 22 (1), 53-53 (2004).
- Maitra, A. Genomic alterations in cultured human embryonic stem cells. Nat Genet. 37 (10), 1099-1099 (2005).
- Mitalipova, M. M. Preserving the genetic integrity of human embryonic stem cells. Nat Biotechnol. 23 (1), 19-19 (2005).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nat Biotechnol. 22 (4), 381-381 (2004).
- Caisander, G. Chromosomal integrity maintained in five human embryonic stem cell lines after prolonged in vitro culture. Chromosome Res. 14 (2), 131-131 (2006).
- Imreh, M. P. In vitro culture conditions favoring selection of chromosomal abnormalities in human ES cells. J Cell Biochem. 99 (2), 508-508 (2006).
- Robin-Wesselschmidt, J. L. Human Stem Cell Manual. Loring, J. F., Robin-Wesselschmidt, J. L., Robin-Wesselschmidt, S. chwartz , Elsevier's Science & Technology Rights. California. 59-59 (2007).
- Rooney, D. E. Human Cytogenetics. , Third Edition, Oxford University Press. (2001).
- Heslop-Harrison, P., Schwarzacher, T. Practical in situ hybridization. Heslop-Harrison, P., Schwarzacher, T. , BIOS Scientific Publishers. Oxford. 51-51 (2000).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır