Method Article
毒素诱导和蛋白质提取镰刀 SPP。文化
摘要
在真菌的蛋白质组分析蛋白质的提取要求高的水平要完成标准化,按照有关一个蛋白质组学实验(MIAPE)指引的最低限度的信息。我们目前的视频协议,其中包括一个程序,最大限度地减少在毒素诱导和蛋白提取实验偏见镰刀菌。
摘要
Fusaria是丝状真菌能够产生不同的毒素。镰刀霉菌毒素,如呕吐毒素,nivalenol,T2,zearelenone,镰刀菌酸moniliformin,等..对人类和动物健康有不良影响,有些是致病因素考虑。蛋白质组学研究表明,要有效地破译毒素生产机制(Taylor等,2008),以及确定潜在的致病因素(纸张等人,2007 年,Houterman等,2007) ,在Fusaria。因此,它成为根本,以建立可靠的方法之间的比较蛋白质组学研究,以依靠蛋白表达实验,菌种和实验室之间的真正差异。将要描述的过程应该通过两种方式蛋白质组学程序的标准化水平的提高作出贡献。拍过的协议是用来增加可以精确地描述的细节水平。此外,标准化的程序来处理生物可用性,复制,应保证较高的鲁棒性的数据,同时也考虑到内的提取过程中的技术可重复性的人为因素。
描述该协议要求16天完成14天的文化和两天蛋白的提取(图1)。
简单地说, 镰刀菌菌株4天的固体培养基上生长,然后手动割裂为10天,并转移到一个修改后的毒素诱导媒体( 焦等,2008)。。通过Miracloth层过滤收集菌丝。在冷室中进行研磨。不同的运营商进行提取,复制(N = 3),以便考虑到由于技术的变化(图2)偏置。提取是基于Taylor等人所描述的SDS /数码地面电视的缓冲区。 (2008年),稍作修改。总蛋白的提取所需的使用丙酮/ TCA / DTT缓冲区隔夜和丙酮/数码地面电视洗衣机(图3A,3B)的蛋白质的降水过程。终于resolubilized蛋白在蛋白标签缓冲区和量化。提取的结果是一维凝胶(图4 SDS - PAGE),然后再进行二维凝胶电泳(IEF / SDS - PAGE)。同样的过程可以应用于其他越来越多的媒体和其他丝状真菌( 万里等人,2007年)的蛋白质组分析。
研究方案
该协议要求16天完成。详细的时间表是在图1。
缓冲液配制的详细信息
- 制备细胞裂解液(每个样品3ML)。
- 制备的洗涤液(50毫升每个样品)。这个缓冲区应预先冷冻和储存在-20 ° C在冰箱,直到进一步的分析,并在整个过程中保持在冰上。
- 制备沉淀的缓冲液(每个样品20ML)。这个缓冲区应预先冷冻和储存在冰箱,直到需要在整个过程中,冰在-20 ° C。
- 应当优先进行的工作,进入冷室在4 ° C。
真菌种类
用于蛋白质组学分析三株被列为其形态特征和翻译延伸因子-α- 1分析的基础上禾谷镰刀菌(奥唐奈等, 1998)
这些菌株属于CRP -加布里埃尔李普曼收集,维护和存放在 - 80℃在15%甘油。
菌丝体的制备
真菌培养4天,在25 ° C交替光明与黑暗的时期每12小时在V8上。文化支离破碎,用消毒的刀片和这些文化被用来接种250毫升锥形瓶含有100毫升的毒素诱导媒体件。收获后10天菌丝体,并从中分离,用无菌过滤器的过滤文化。菌丝体均用无菌水冲洗3次,以去除介质的残留物和其他化合物。我们然后立即加入液氮冻结的细胞,保持样品在-80 ° C。
蛋白提取的一般描述
使用在图3a和3b中所描述的方法提取蛋白样品。 镰刀菌的样品在液氮研磨的粉末收集在10毫升聚四氟乙烯管。样品与裂解液孵育30分钟,煮沸10分钟,离心2次,在室温(15分钟12000克)。收集上清和沉淀缓冲液孵育过夜在-20 ° C。后离心4 ° C30000克45分钟,沉淀蛋白质的沉淀物洗净,用冷丙酮含数码地面电视的3倍。最后,沉淀空气干燥和蛋白质resolubilized标签缓冲区中,调整pH值至8。 30毫升的子样本被删除总蛋白定量和蛋白电泳在-20 ° C保存,直到剩余的上清液。

图1。时间轴的过程。
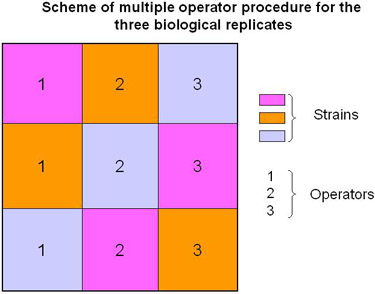
图2样品处理多个运营商的计划。

图3a。 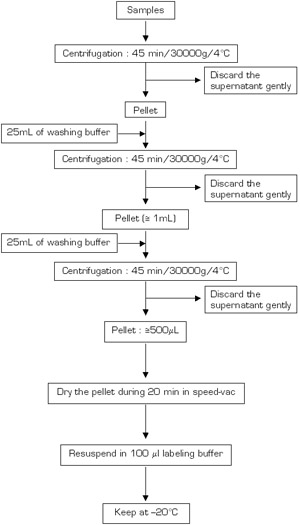
图3b,请点击这里看到的图3A更大的版本,或在这里为图3b更大的版本。
图3a - B蛋白的提取过程的流程图(A:第一天,B:第二天) 。
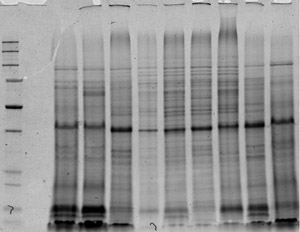
图4。蛋白提取物的一维图像。蛋白的运行,直到蓝色熔岩紫染色的凝胶年底完成迁移。图4看到一个更大的版本, 请点击这里。
讨论
使用这种技术(Kim 等人 ,2007年审查)的出版物的数量增加导致真菌生物学领域内的蛋白质组学方法的近期利益。依靠蛋白的提取方法提取程序的组合,他们往往是很难描述在方法论部分和需要的专业知识,在处理潜在的故障排除方法。
至于其他“组学”的办法,设置样品和数据处理的标准是必要的,才能产生可靠的科学信息。此外,样品和操作程序应得到充分的描述,以允许共享不同的“组学”实验结果的解释。跨数据挖掘在基因组学,蛋白质组学,代谢组学,充分利用潜力,这将是必不可少的... (莫里森等人 ,2006年)。约蛋白质组学实验的最低限度的信息已经起草工作组已成立,以解决一个实验的所有方面(凝胶电泳,质谱,分子间的相互作用,蛋白质修饰,蛋白质组信息,来样加工)。目前没有明确的信息,来样加工程序进行。由于蛋白的提取程序,在确定蛋白质组研究的最终质量,以实施程序,可以增加MIAPE指导方针的框架内的标准化(Taylor等,2007)的重要性,我们提出了使用视频协议详述样品处理。影片描述的实验可能会作出重大贡献的来样加工的信息数量增加,可能会导致更好的“组学”实验(Pasquali,2007年)的可重复性。
事实上,整个实验室的可重复性是一项基本要求,为了保证蛋白质组学研究结果(http://www.fixingproteomics.org)的有效性。跨实验室的可重复性是由两个因素:不同的仪器和不同的运营商操纵样品的影响。
在描述的协议,我们建议执行生物复制涉及多个运营商增加(图2和视频)数据(即技术变化的结果是考虑到)的可靠性。
蛋白提取描述的过程是基于SDS和暖气。这是以前,以保证良好的纯度和蛋白质的数量(1996年桥)。 SDS的耦合,用沸水溶解细胞壁,疏水蛋白,防止形成的低聚物,中止蛋白质沉淀。沸点还允许蛋白酶失活。 EDTA,PMSF和完整的迷你蛋白酶抑制剂也产生同样的效果。数码地面电视的消除和促进蛋白增溶蛋白质之间的二硫键。
为了消除前IEF SDS,蛋白质沉淀丙酮/ TCA /数码地面电视。此外,丙酮/ TCA /数码地面电视的沉淀可以去除一些污染物,如脂类,核酸,盐类或/和酚类化合物,这些化合物存在时。 SDS的一样,这些分子可以防止在国际盛事基金的一个很好的迁移。这种沉淀,这是必要的丙酮/数码地面电视,洗沉淀的蛋白质,以去除TCA的,因为它可以干扰IEF。
一个良好的样品制备是好的结果的关键。对于这一点,它也是必不可少的,以避免污染环境工作无粉手套和尊重良好实验室规范的蛋白质。从技术角度来看,在所描述的协议,获得足够数量和纯度蛋白质最关键的步骤是分两个阶段。首先,研磨阶段,完整的细胞破坏是根本释放的蛋白质;和第二,总蛋白的纯化,一个阶段,包括取消大多数脂类,DNA和其它污染物,可能会干扰蛋白质的迁移。
致谢
我们感谢他们的技术贡献Servane Contal和鲍里斯Untereiner。我们承认FNR的“FUTOX”项目的支持。
材料
媒体和解决方案
掌上电脑 :39克马铃薯葡萄糖琼脂(Difco公司); 1升蒸馏水。
V8琼脂 :200毫升V8(坎贝尔,美国),2G碳酸钙(Sigma公司),16G琼脂(DIFCO),800毫升蒸馏水
毒素诱导媒体 :1G K 2 HPO 4,0.5克氯化钾,0.5克硫酸镁4 7H 2 O,10毫克FeEDTA,2G大号谷氨酸,蒸馏水1L 10G蔗糖。
裂解缓冲液 :
| 100毫升 | 终浓度 | ||
| 三,盐酸PH8 | 5ML | 50MM | 1M |
| SDS | 2克或10ml | 2% | 20% |
| 数码地面电视 | 500毫升 | 10MM | 2M |
| EDTA | 20ML | 0.1MM | 0.5M |
| PMSF | 200毫升 | ||
| 完整的迷你蛋白酶抑制剂 | 1片 | ||
| 水 | QSP |
沉淀缓冲液 :
| 100毫升 | 终浓度 | |
| 三氯乙酸 | 20ML | 20% |
| 数码地面电视 | 0.1ml的 | 0.1% |
| 丙酮 | QSP |
洗涤缓冲液:
| 100毫升 | 终浓度 | |
| 数码地面电视 | 0.1ml的 | 0.1% |
| 丙酮 | 100毫升 |
标签缓冲区(储存在-18 ° C的小等分):
| 1ML | 终浓度 | |
| 尿素 | 140毫克 | 7M |
| 硫脲 | 50毫克 | 2M |
| CHAPS | 40毫克 | 4% |
| 三 | 30μL | 30毫米 |
| 水 | 1毫升 |
参考文献
- Bridge, P. Protein Extraction from Fungi. Protein Purification Protocols. , 39-48 (1996).
- Jiao, F. Effects of different carbon sources on trichothecene production and Tri gene expression by Fusarium graminearum in liquid culture. FEMS Microbiol Lett. 285, 212-219 (2008).
- Kim, Y. Proteomics of filamentous fungi. Trends in Biotechnology. 25, 395-400 (2007).
- Milles, J. Development of a proteomic approach to monitor protein synthesis in mycotoxin producing moulds. Mycotoxin Res. 23, 161-165 (2007).
- Morrison, N., Field, D. Concept of sample in OMICS technology. OMICS. 10, 127-137 (2006).
- O'Donnell, K., Kistler, H. C., Cigelnik, E., Ploetz, R. C. Multiple evolutionary origins of the fungus causing Panama disease of banana: Concordant evidence from nuclear and mitochondrial gene genealogies. PNAS. 95, 2044-2049 (1998).
- Paper, J. M. Comparative proteomics of extracellular proteins in vitro and in planta from the pathogenic fungus Fusarium graminearum. Proteomics. 7, 3171-3183 (2007).
- Pasquali, M. Video in science. Protocol videos: the implications for research and society. EMBO Rep. 8, 712-716 (2007).
- Taylor, C. F. The minimum information about a proteomics experiment (MIAPE). Nat Biotechnol. 25, 887-893 (2007).
- Taylor, R. D. Proteomic analyses of Fusarium graminearum grown under mycotoxin-inducing conditions. Proteomics. 8, 2256-2265 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。