Method Article
Indução toxina e Extração de Proteínas de Fusarium Spp. Culturas de Estudos Proteômica
Neste Artigo
Resumo
Extração de proteínas para análise proteômica em espécies de fungos requer um alto nível de padronização a ser realizado de acordo com as informações mínimas sobre um experimento proteômica (MIAPE) orientações. Nós apresentamos um vídeo protocolo que inclui um procedimento para minimizar viés experimental durante a indução da toxina e extração de proteínas de Fusarium spp.
Resumo
Fusaria são fungos filamentosos capazes de produzir toxinas diferentes. Micotoxinas Fusarium, como o desoxinivalenol, nivalenol, T2, zearelenone, ácido fusárico, moniliformin, etc .. ter efeitos adversos na saúde humana e animal e alguns são considerados como fatores de patogenicidade. Estudos de proteômica mostrou-se eficaz para decifrar os mecanismos de produção de toxinas (Taylor et al., 2008), bem como para a identificação de fatores patogênicos em potencial (Paper et al. 2007, Houterman et al., 2007) em Fusaria. Torna-se, portanto, fundamental para estabelecer métodos confiáveis para a comparação entre os estudos de proteômica, a fim de contar com verdadeiras diferenças encontradas na expressão da proteína entre os experimentos, as cepas e laboratórios. O procedimento que será descrito deverá contribuir para um maior nível de padronização de procedimentos proteômica de duas maneiras. O protocolo filmado é usado para aumentar o nível de detalhes que pode ser descrito com precisão. Além disso, a disponibilidade de procedimentos padronizados para processo biológico replica deve garantir uma maior robustez dos dados, tendo em conta também o fator humano dentro da reprodutibilidade técnica do processo de extração.
O protocolo descrito requer 16 dias para sua conclusão: 14 dias para as culturas e dois dias para a extração de proteínas (figura 1).
Resumidamente, Fusarium cepas são cultivadas em meios sólidos por 4 dias, pois eles são, então, manualmente fragmentado e transferido para uma mídia toxina modificada indução (Jiao et al, 2008.) Por 10 dias. Micélio é coletado por filtração através de uma camada Miracloth. Moagem é realizada em uma câmara fria. Diferentes operadores realizada extração de repetições (n = 3), a fim de ter em conta o viés devido a variações técnica (figura 2). Extração foi baseado em um tampão SDS / TDT conforme descrito em Taylor et al. (2008) com ligeiras modificações. Extração de proteína total necessário um processo de precipitação das proteínas com acetona / TCA / TDT tampão de lavagem durante a noite e acetona / TDT (figura 3a, 3b). Proteínas foram finalmente ressolubilizam no buffer de proteína rotulagem e quantificados. Resultados da extração foram visualizados em gel 1D (Figura 4, SDS-PAGE), antes de prosseguir para 2D géis (IEF / SDS-PAGE). O mesmo procedimento pode ser aplicado para análises proteômicas em outros suportes de cultura e outros fungos filamentosos (Miles et al., 2007).
Protocolo
O protocolo exige que 16 dias para sua conclusão. O prazo é detalhado na figura 1.
Detalhes para a preparação de buffer
- Preparação do tampão de lise (3mL por amostra).
- Preparação do tampão de lavagem (50 ml por amostra). Esta reserva deve ser pré-refrigerados e armazenados a -20 ° C no freezer até análise mais aprofundada e mantidos em gelo durante todo o procedimento.
- Preparação do tampão de precipitação (20 mL por amostra). Esta reserva deve ser pré-refrigerados e armazenados a -20 ° C no freezer até que seja necessário e mantidos em gelo durante todo o procedimento.
- O trabalho deve preferencialmente ser realizado em câmara fria a 4 ° C.
Espécies de fungos
Três cepas utilizadas para análises proteômicas foram classificadas a Fusarium graminearum, com base em suas características morfológicas e Tradução Alongamento-Alpha-1 fator de análise (O'Donnell et al., 1998)
Essas cepas pertenciam à coleção Lippmann CRP-Gabriel e foram mantidos e armazenados a - 80 ° C em 15% de glicerol.
Preparação dos micélios
Fungos foram cultivados em V8 de 4 dias a 25 ° C alternadas período de claro e escuro a cada 12 hrs. Culturas foram fragmentados utilizando uma lâmina estéril e peças dessas culturas foram utilizadas para inocular balões de 250 ml Erlenmeyer contendo 100 mL da toxina induzindo-media. Micélios foram colhidas após 10 dias e foram separados do meio por filtração a cultura com um filtro estéril. Micélios foram lavadas 3 vezes com água estéril para remover resíduos de médio e outros compostos. Em seguida, imediatamente congelou as células pela adição de nitrogênio líquido e mantidas as amostras a -80 ° C.
Descrição geral da extração de proteínas
Amostras de proteínas foram extraídas com o método descrito na figura 3A e 3B. As amostras de Fusarium foram moídas em nitrogênio líquido eo pó foram recolhidos em 10 ml tubos de Teflon. As amostras foram então incubadas 30 minutos com o tampão de lise, cozidos por 10 minutos, e centrifugado duas vezes a temperatura ambiente (12000g por 15 minutos). Os sobrenadantes foram coletados e incubados a -20 ° C com tampão de precipitação durante a noite. Após centrifugação a 4 ° C 30000g por 45 minutos, as bolinhas das proteínas precipitadas foram lavadas três vezes com acetona gelada contendo DTT. Finalmente, as pelotas foram secas ao ar e as proteínas foram ressolubilizam no buffer de rotulagem, ajustando o pH a 8. A sub-amostra de 30 ml foi removido para a quantificação de proteínas totais eo sobrenadante restante foi armazenado a -20 ° C até eletroforese de proteínas.

Figura 1. Timeline do procedimento.
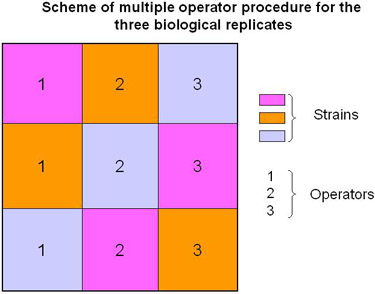
Figura 2. Esquema para múltiplos operadores de processamento de amostra.

Figura 3a. 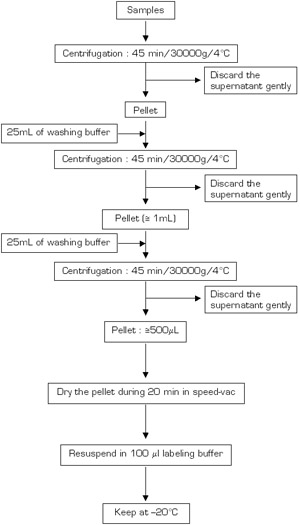
Figura 3b. Por favor, clique aqui para ver uma versão ampliada da figura 3a, ou aqui para uma versão ampliada da figura 3b.
Figuras 3a-b Fluxogramas para o procedimento de extração de proteínas (A: primeiro dia; B: segundo dia)..
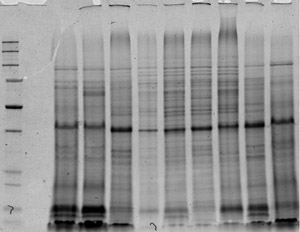
Figura 4. 1D imagem de extratos de proteína. Proteínas foram executados até a migração completa do azul para o final do gel que foi manchada com roxo lava. Por favor, clique aqui para ver uma versão ampliada da figura 4.
Discussão
Recente interesse em abordagens proteômicas no domínio da biologia de fungos levou a um aumento do número de publicações com essa técnica (como revistas em Kim et al., 2007). Métodos para a extração de proteínas dependem de uma combinação de procedimentos de extração, que são muitas vezes mal descritos nas seções metodológicas e requerem conhecimento especializado para lidar com os métodos de solução de problemas em potencial.
Como para outros "ómicas" abordagens, estabelecendo normas para o processamento de amostras e dados é essencial a fim de gerar informações científicas confiáveis. Além disso as amostras e os procedimentos de manipulação devem ser adequadamente descritos de modo a permitir interpretação dos resultados compartilhados entre os diferentes "ómicas" experimentos. Isso seria essencial para a plena exploração do potencial cross-de mineração de dados em genômica, proteômica, metabolômica, ... (Morrison et al., 2006). Informações mínimas sobre um experimento proteômica foi elaborado e grupos de trabalho foram criados de forma a gerir todos os aspectos de uma experiência (de eletroforese em gel, Espectrometria de Massa, interações moleculares, modificações de proteínas, Informática Proteomics, o processamento da amostra). No momento nenhuma informação definida estão disponíveis em procedimentos de processamento da amostra. Dada a importância dos procedimentos de extração da proteína para determinar a qualidade final dos estudos de proteômica, a fim de implementar procedimentos que podem aumentar a padronização no âmbito das diretrizes MIAPE (Taylor et al., 2007), propusemos o uso de um protocolo de vídeo detalhando amostra processamento. Descrição do vídeo de experimentos pode contribuir substancialmente para aumentar o número de informações sobre o processamento da amostra, que pode resultar em melhor reprodutibilidade de "ómicas" experimentos (Pasquali, 2007).
Na verdade, toda a reprodutibilidade laboratórios é um requisito fundamental para garantir a validade dos resultados proteômica (http://www.fixingproteomics.org). A reprodutibilidade cruz laboratório é influenciado por dois fatores: instrumentações diferentes e diferentes operadores manipulando as amostras.
No protocolo descrito, propomos a realizar replica biológica envolvendo múltiplos operadores (Figura 2 e vídeo) para aumentar a confiabilidade dos dados (ou seja, variação da técnica dos resultados é levado em conta).
O procedimento descrito para a extração de proteínas é baseado em SDS e aquecimento. Isto foi demonstrado anteriormente para garantir uma pureza e boa quantidade de proteínas (Bridge, 1996). SDS juntamente com ebulição dissolve as paredes das células, as proteínas hidrofóbicas e impede a formação de oligômeros que a precipitação de proteínas abortar. Ebulição permite também a inativação de proteases. O mesmo efeito é produzido também por EDTA, PMSF e inibidor da protease completa mini. TDT remove pontes dissulfeto e entre proteínas facilitando a solubilização da proteína.
A fim de remover antes IEF SDS, as proteínas são precipitadas por acetona / TCA / TDT. Além disso, acetona / TCA / TDT precipitação permite remover alguns contaminantes, tais como lipídios, ácidos nucléicos, sais e / ou compostos fenólicos, quando estes compostos estão presentes. Como SDS, estas moléculas evitar uma migração bem durante IEF. Seguindo essa precipitação, é necessário lavar as proteínas precipitadas com acetona / DTT, a fim de remover TCA, pois ele pode interferir com IEF.
A preparação da amostra boa é a chave para bons resultados. Para isso, é também essencial para evitar a contaminação de proteínas do ambiente de trabalho com luvas sem pó e respeitando as boas práticas laboratoriais. Do ponto de vista técnico, dentro do protocolo descrito, os passos mais críticos para obtenção de quantidades suficientes e pureza de proteínas são duas fases. Primeiro, a fase de moagem onde a destruição completa da célula é fundamental para a liberação de proteínas e, segundo, a purificação de proteínas totais, uma fase que engloba a remoção da maioria dos lipídios DNA, e outros contaminantes que possam interferir com a migração de proteínas.
Agradecimentos
Agradecemos a Servane Contal e Boris Untereiner por sua contribuição técnica. Agradecemos o apoio da FNR "FUTOX" do projeto.
Materiais
Mídia e soluções
PDA: 39 g Batata Dextrose Agar (Difco), 1 L de água destilada.
V8 agar: 200 ml V8 (Campbell, EUA), 2g CaCO3 (Sigma), Agar 16g (DIFCO), 800 ml de água destilada
Toxina mídia induzindo: 1g K 2 HPO 4, 0,5 g KCl, 0,5 g MgSO 4 7H 2 O, 10 mg FeEDTA, 2g L ácido glutâmico, sacarose 10g em 1L de água destilada.
Tampão de Lise:
| 100mL | Concentração final | ||
| Tris-HCL PH8 | 5mL | 50mM | 1M |
| SDS | 2g ou 10 ml | 2% | 20% |
| TDT | 500mL | 10mM | 2M |
| EDTA | 20mL | 0,1 mM | 0.5M |
| PMSF | 200mL | ||
| Inibidor da protease completa mini- | 1 comprimido | ||
| Água | Qsp |
Tampão de precipitação:
| 100mL | Concentração final | |
| TCA | 20mL | 20% |
| TDT | 0,1 ml | 0,1% |
| Acetona | Qsp |
Lavar Buffer:
| 100mL | Concentração final | |
| TDT | 0,1 ml | 0,1% |
| Acetona | 100mL |
Rotulagem de buffer (armazenamento a -18 ° C em alíquotas pequenas):
| 1mL | Concentração final | |
| Uréia | 140 mg | 7M |
| Tiouréia | 50 mg | 2M |
| CHAPS | 40 mg | 4% |
| Tris | 30 mL | 30 mM |
| Água | 1 mL |
Referências
- Bridge, P. Protein Extraction from Fungi. Protein Purification Protocols. , 39-48 (1996).
- Jiao, F. Effects of different carbon sources on trichothecene production and Tri gene expression by Fusarium graminearum in liquid culture. FEMS Microbiol Lett. 285, 212-219 (2008).
- Kim, Y. Proteomics of filamentous fungi. Trends in Biotechnology. 25, 395-400 (2007).
- Milles, J. Development of a proteomic approach to monitor protein synthesis in mycotoxin producing moulds. Mycotoxin Res. 23, 161-165 (2007).
- Morrison, N., Field, D. Concept of sample in OMICS technology. OMICS. 10, 127-137 (2006).
- O'Donnell, K., Kistler, H. C., Cigelnik, E., Ploetz, R. C. Multiple evolutionary origins of the fungus causing Panama disease of banana: Concordant evidence from nuclear and mitochondrial gene genealogies. PNAS. 95, 2044-2049 (1998).
- Paper, J. M. Comparative proteomics of extracellular proteins in vitro and in planta from the pathogenic fungus Fusarium graminearum. Proteomics. 7, 3171-3183 (2007).
- Pasquali, M. Video in science. Protocol videos: the implications for research and society. EMBO Rep. 8, 712-716 (2007).
- Taylor, C. F. The minimum information about a proteomics experiment (MIAPE). Nat Biotechnol. 25, 887-893 (2007).
- Taylor, R. D. Proteomic analyses of Fusarium graminearum grown under mycotoxin-inducing conditions. Proteomics. 8, 2256-2265 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados