Method Article
から毒素誘導とタンパク質抽出フザリウム属属。文化
要約
真菌種のプロテオーム解析のためのタンパク質の抽出は、プロテオーム実験(MIAPE)ガイドラインに関する最小限の情報に応じて達成される標準化の高いレベルが必要です。私たちは、から毒素の誘導と蛋白質の抽出時に実験的なバイアスを最小限にするための手順が含まれているビデオプロトコルを提示フザリウム属。
要約
fusariumの複数形は異なる毒素を生産することができる糸状菌である。このようなデオキシニバレノール、ニバレノール、T2、zearelenone、フザリン酸、moniliformin、などのフザリウムマイコトキシン..人間と動物の両方の健康に悪影響を与えると、一部は病原性の要因として考えられている。プロテオミクス研究は、毒素産生機構(Taylor ら 、2008)解読するだけでなく、fusariumの複数形で(紙ら 、2007、Houterman ら、2007)潜在的な病原性因子を同定するために有効であることが示された。それは実験、系統と実験室間のタンパク質発現に見られる真の違いに依存するためにプロテオミクス研究の間の比較のために信頼性の高い方法を確立することが基本になります。説明する手順は次の2つの方法でプロテオーム手続の標準化レベルの上昇に貢献すべきである。撮影プロトコルを正確に記述することができる詳細のレベルを高めるために使用されます。また、生物学的処理するために標準化された手順の可用性は、抽出作業の技術的な再現性の中でも、考慮に人的要因を考慮、データのより高いロバスト性を保障すべき複製します。
文化とタンパク質抽出のための2日間(図1)のための十四日:記述されるプロトコルは、その完成のための16日を要します。
簡単に言えば、 フザリウム株は 4日間固体培地上で増殖され、それらはその後、手動で10日間のために断片化と修正された毒素の誘導メディア(交通ら、2008。)に転送されます。菌糸体をミラクロス層を通して濾過することにより収集されます。粉砕は、コールドチャンバーで実行されます。異なる演算を実行抽出は考慮に入れ、技術の変化(図2)に起因するバイアスをとるために(n = 3)を複製します。抽出は、Taylorらに記載されてSDS / DTTバッファーに基づいていた。 (2008)わずかな修正で。総タンパク質の抽出は、アセトン/ TCA / DTTバッファー晩とDTT /アセトン洗浄(図3a、3b)を用いてタンパク質の沈殿処理が必要でした。タンパク質は、最終的にタンパク質標識バッファーでresolubilizedし定量した。抽出の結果は、2Dゲル(IEF / SDS - PAGE)に進む前に、1Dゲル(図4、SDS - PAGE)で可視化した。同じ手順は、他の成長しているメディアや他の糸状菌(マイルズら、2007)上のプロテオーム解析に適用することができます。
プロトコル
プロトコルは、その完成のための16日を要します。時間枠は、図1に詳述されています。
バッファーの調製のための詳細
- 溶解バッファー(サンプルあたり3ML)の調製。
- 洗浄バッファー(サンプル当たり50mLの)の準備。このバッファはあらかじめ冷却して保存-20℃冷凍庫でさらに分析されるまで、全体の手順の間に氷上で保存する。
- 降水量のバッファー(サンプル当たり20mlの)の準備。全体の手順の実行中に必要とし、氷上に保持されるまで、このバッファは、冷凍庫で-20℃であらかじめ冷却して保存する必要があります。
- 仕事が優先的に4℃のコールドチャンバー℃に行われるべきである
真菌種
プロテオーム解析のために使用する3つの菌株は、それらの形態学的特徴と翻訳伸長因子α- 1分析(オドネルら、1998)に基づいてフザリウムgraminearumに分類された
これらの菌株はCRP -ガブリエルリップマンコレクションに所属し、維持し、で保存した - 80 ° C 15%グリセロール。
菌糸の準備
菌類は25℃、光と暗期を交互に各12時間で4日間V8で培養した。培養物は、毒素誘導媒体100 mLを含む250ミリリットルの三角フラスコに接種するために使用されたこれらの培養物の滅菌ブレードとピースを使用して断片化された。菌糸体を10日後に回収し、滅菌フィルターで文化をフィルタリングすることにより、培地から分離した。菌糸体を培地残基と他の化合物を除去するために滅菌水で3回洗浄した。私たちは、その後すぐに液体窒素を添加することにより、細胞を凍結し、-80試料を保管℃に
タンパク質抽出の一般的な説明
タンパク質サンプルは、図3Aおよび3Bに記載された方法を用いて抽出した。 フザリウム属のサンプルは、液体窒素中で粉砕され、粉体を10mlテフロンチューブに回収した。次いで、試料を10分間煮沸、溶解緩衝液で30分インキュベートし、室温(15分間12000グラム)で2回の遠心分離した。上清を一晩沈殿バッファーを-20℃で収集し、インキュベートした。 45分間4℃3万グラムで遠心分離後、沈殿したタンパク質のペレットを冷アセトンを含むDTTで3回洗浄した。最後に、ペレットは、空気乾燥され、タンパク質は、pHを8に調整し、標識バッファーでresolubilizedれた。 30mlのサブサンプルは、総タンパク質の定量に除去し、残りの上清を蛋白質の電気泳動まで-20℃で保存した。

図1の手順のタイムライン。
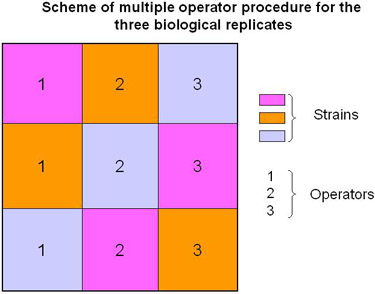
図2。複数の演算子のサンプル処理のためのスキーム。

図3a。 
図3bは。してくださいここをクリックして図3aの拡大バージョンを参照する、またはここで 、図3bの大きいバージョンのために。
図3a - B蛋白質の抽出手順のフローチャート(1日目、B:二日目)。。
図4。タンパク質抽出物の1D絵。タンパク質は、溶岩の紫で染色されたゲルの端に青色の完全移行するまで実行されました。してくださいここをクリックして図4の拡大バージョンを参照すること。
ディスカッション
真菌生物学ドメイン内のプロテオミクスのアプローチの最近の関心は、このテクニックを(Kim ら 、2007年にレビュー)を使用して出版物の増加につながった。タンパク質抽出用のメソッドは、抽出手順の組み合わせに依存して、彼らはしばしば、ほとんどの方法論のセクションで説明しないと潜在的なトラブルシューティングの方法に対処する上で専門知識を必要としている。
他の"オミクス"アプローチ用として、サンプルおよびデータ処理のための基準を設定すると、信頼できる科学的情報を生成するために不可欠です。また、サンプルや操作の手順は適切に別の"オミクス"の実験間での共有の結果の解釈を可能にするために記述する必要があります。これは完全にゲノミクス、プロテオミクス、メタボロミクス、のクロスデータマイニングの可能性を活用するために不可欠になる... (モリソンら 、2006)。プロテオミクス実験に関する最低限の情報が起草され、ワーキンググループは、実験(ゲル電気泳動、質量分析、分子間相互作用、タンパク質修飾、プロテオミクスの情報、サンプルの処理)のあらゆる側面に取り組むために設立されました。現時点では定義されている情報は、サンプルの処理手順でダウンロード可能となります。 MIAPEガイドライン(Taylor ら、2007)の枠組みの中で標準化を高めることができるプロシージャを実装するためには、プロテオミクス研究の最終的な品質を決定する際のタンパク質の抽出手順の重要性を考えると、我々はサンプルを詳述したビデオプロトコルの使用を提案処理。実験のビデオの説明は"オミクス"の実験(パスカリ、2007)の優れた再現性をもたらすことができるサンプルの処理に関する情報の数を増やすために大幅に貢献するかもしれない。
確かに、研究室間再現性は、プロテオミクスの結果(http://www.fixingproteomics.org)の妥当性を保証するために基本的な要件です。別のインストルメンテーションとサンプルを操作する別の演算子:クロス実験の再現性は、2つの要因に影響されます。
記述されたプロトコルでは、我々は実行するために提案する生物学的データ(結果のすなわち技術的変化が考慮される)の信頼性を高めるために複数の演算子(図2およびビデオ)を含む複製。
タンパク質抽出のために説明する手順は、SDSと加熱に基づいています。これは、以前にタンパク質(大橋1996)の良好な純度と量を保証することが示された。沸騰と相まってSDSは、細胞壁、疎水性タンパク質とタンパク質の中止沈殿そのオリゴマーの形成を防止して溶解する。沸騰は、プロテアーゼの不活性化も可能です。同じ効果は、EDTA、PMSFおよび完全なミニプロテアーゼ阻害剤によっても生成されます。 DTTはタンパク質の可溶化を促進するタンパク質の間のジスルフィド架橋を削除します。
IEF前にSDSを除去するためには、タンパク質をアセトン/ TCA / DTTによって沈殿させる。さらに、アセトン/ TCA / DTT降水量は、これらの化合物が存在する場合、脂質、核酸、塩または/およびフェノール化合物などのいくつかの汚染物質を除去することができます。 SDSと同様に、これらの分子は、IEFの間に良好な移行を防ぐ。この沈殿に続いて、それはIEFと干渉する可能性としてTCAを除去するために、アセトン/ DTT、によって沈殿したタンパク質を洗浄する必要があります。
良好な試料調製が良い結果への鍵です。このため、パウダーフリーの手袋での作業と検査室の安全基準を尊重し、環境からの蛋白質の汚染を避けるためにも不可欠なことです。技術的な観点から、記述されたプロトコルの中で、蛋白質の十分な量と純度を得るために最も重要なステップは2つの段階があります。最初に、研削セルの完全な破壊は、タンパク質を解放するために基礎となる相と、第2、総タンパク質の精製、脂質、DNAとタンパク質の移行を妨げる可能性があります他の汚染物質の大部分の除去を包含する段階。
謝辞
我々は彼らの技術的貢献のためにServane ContalとボリスUntereinerに感謝。我々は、FNR"FUTOX"プロジェクトのサポートを認める。
資料
メディアとソリューション
PDA:39 gのポテトデキストロース寒天(Difco社製)、1リットルの蒸留水。
V8寒天 :200ミリリットルV8(キャンベル、米国)、2G炭酸カルシウム(シグマ)、16グラム寒天(DIFCO)、800 mlの蒸留水
毒素を誘導するメディア :1G K 2 HPO 4、0.5グラムのKCl、0.5グラムのMgSO 4 7H 2 O、10mgのFeEDTA、2G Lグルタミン酸、蒸留水の1Lで10gショ糖。
溶解バッファー :
| 100mLの | 最終濃度 | ||
| トリス- HCL PH8 | 5mLの | 50mmの | 1M |
| SDS | 2Gまたは10mLを | 2パーセント | 20パーセント |
| DTT | 500mLに | 10mMの | 2M |
| EDTA | 20mlの | 0.1mmの | 0.5M |
| PMSF | 200mLの | ||
| 完全なミニプロテアーゼ阻害剤 | 1錠 | ||
| 水 | QSP |
降水量のバッファ :
| 100mLの | 最終濃度 | |
| TCA | 20mlの | 20パーセント |
| DTT | 0.1mlを | 0.1パーセント |
| アセトン | QSP |
洗浄バッファー:
| 100mLの | 最終濃度 | |
| DTT | 0.1mlを | 0.1パーセント |
| アセトン | 100mLの |
ラベリングバッファー(-18℃で保存小分けにC):
| 1mLの | 最終濃度 | |
| 尿素 | 140 mgの | 7M |
| チオ尿素 | 50mgの | 2M |
| CHAPS | 40 mgの | 4パーセント |
| トリス | 30μL | 30mMの |
| 水 | 1 mLの |
参考文献
- Bridge, P. Protein Extraction from Fungi. Protein Purification Protocols. , 39-48 (1996).
- Jiao, F. Effects of different carbon sources on trichothecene production and Tri gene expression by Fusarium graminearum in liquid culture. FEMS Microbiol Lett. 285, 212-219 (2008).
- Kim, Y. Proteomics of filamentous fungi. Trends in Biotechnology. 25, 395-400 (2007).
- Milles, J. Development of a proteomic approach to monitor protein synthesis in mycotoxin producing moulds. Mycotoxin Res. 23, 161-165 (2007).
- Morrison, N., Field, D. Concept of sample in OMICS technology. OMICS. 10, 127-137 (2006).
- O'Donnell, K., Kistler, H. C., Cigelnik, E., Ploetz, R. C. Multiple evolutionary origins of the fungus causing Panama disease of banana: Concordant evidence from nuclear and mitochondrial gene genealogies. PNAS. 95, 2044-2049 (1998).
- Paper, J. M. Comparative proteomics of extracellular proteins in vitro and in planta from the pathogenic fungus Fusarium graminearum. Proteomics. 7, 3171-3183 (2007).
- Pasquali, M. Video in science. Protocol videos: the implications for research and society. EMBO Rep. 8, 712-716 (2007).
- Taylor, C. F. The minimum information about a proteomics experiment (MIAPE). Nat Biotechnol. 25, 887-893 (2007).
- Taylor, R. D. Proteomic analyses of Fusarium graminearum grown under mycotoxin-inducing conditions. Proteomics. 8, 2256-2265 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved