Method Article
La toxina de inducción y extracción de proteínas a partir de Fusarium Spp. Los cultivos para los estudios proteómicos
En este artículo
Resumen
Extracción de proteínas de los análisis proteómicos de las especies de hongos requiere un alto nivel de estandarización que se realiza de acuerdo con la información mínima sobre un experimento de proteómica (MIAPE) directrices. Se presenta un video-protocolo que incluye un procedimiento para disminuir el sesgo experimental durante la inducción de la toxina y la extracción de proteínas a partir de Fusarium spp.
Resumen
Fusaria son hongos filamentosos capaces de producir toxinas diferentes. Micotoxinas de Fusarium como el deoxinivalenol, el nivalenol, T2, zearelenone, fusárico ácido, moniliformina, etc .. tener efectos adversos en la salud humana y animal y algunos son considerados como factores de patogenicidad. Estudios de proteómica se mostró eficaz para descifrar los mecanismos de producción de toxinas (Taylor et al., 2008), así como para identificar los posibles factores patogénicos (Documento et al., 2007, Houterman et al., 2007) en Fusaria. Se convierte, pues, fundamental para establecer métodos confiables para la comparación entre los estudios de proteómica con el fin de contar con verdaderas diferencias en la expresión de proteínas entre los experimentos, las cepas y los laboratorios. El procedimiento que se describe debe contribuir a un mayor nivel de estandarización de los procedimientos de proteómica de dos maneras. El protocolo filmado se utiliza para aumentar el nivel de detalles que pueden ser descritos con precisión. Por otra parte, la disponibilidad de procedimientos normalizados para los procesos biológicos replica debe garantizar una mayor solidez de los datos, teniendo en cuenta también el factor humano dentro de la reproductibilidad técnica del procedimiento de extracción.
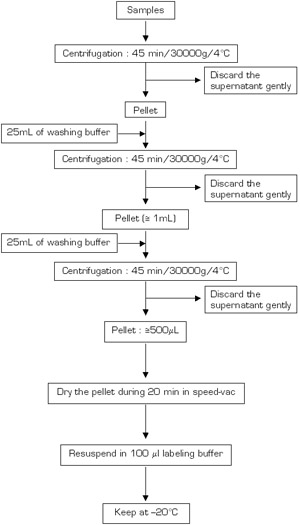
El protocolo descrito requiere 16 días para su ejecución: catorce días para que las culturas y dos días para la extracción de proteína (figura 1).
En resumen, las cepas de Fusarium son cultivadas en medios sólidos durante 4 días, que son luego manualmente fragmentada y se transfieren a un medio de inducción de la toxina modificada (Jiao et al, 2008.) Durante 10 días. Micelio se recoge por filtración a través de una capa de Miracloth. La molienda se realiza en una cámara de frío. Diferentes operadores realizaron la extracción de repeticiones (n = 3) con el fin de tener en cuenta el sesgo debido a las variaciones técnicas (figura 2). La extracción se basa en un buffer SDS / DTT como se describe en Taylor et al. (2008) con ligeras modificaciones. Extracción de la proteína total requerido un proceso de precipitación de las proteínas con acetona / TCA / TDT tampón de lavado durante la noche y acetona / TDT (figura 3a, 3b). Las proteínas fueron resolubilizado finalmente en el buffer de las proteínas de etiquetado y cuantificados. Los resultados de la extracción se visualizaron en un gel de 1D (Figura 4, SDS-PAGE), antes de proceder a geles 2D (IEF / SDS-PAGE). El mismo procedimiento puede ser aplicado para el análisis proteómico de otros medios de cultivo y otros hongos filamentosos (Miles et al., 2007).
Protocolo
El protocolo requiere 16 días para su finalización. El plazo se detalla en la figura 1.
Detalles para la preparación de buffer
- Preparación de la solución amortiguadora de lisis (3 ml por muestra).
- Preparación del tampón de lavado (50 ml por muestra). Este buffer debe ser pre-enfriado y almacenado a -20 ° C en el congelador hasta su posterior análisis y se mantuvo en hielo durante todo el procedimiento.
- Preparación del tampón de precipitación (20 ml por muestra). Este buffer debe ser pre-enfriado y almacenado a -20 ° C en el congelador hasta que se necesite y se mantuvo en hielo durante todo el procedimiento.
- El trabajo preferentemente deben llevarse a cabo en la cámara de frío a 4 º C.
Especies de hongos
Tres cepas utilizadas para los análisis proteómicos se clasificaron a Fusarium graminearum sobre la base de sus características morfológicas y traducción-Alargamiento de alfa-1 factor de análisis (O'Donnell et al., 1998)
Estas cepas pertenecen a la colección de PCR-Gabriel Lippmann y se mantuvieron y se almacena a - 80 ° C en el 15% de glicerol.
Preparación de los micelios
Los hongos se cultivaron en V8 de 4 días a 25 ° C alternando período de luz y la oscuridad cada 12 horas. Los cultivos fueron fragmentadas con una cuchilla estéril y piezas de estas culturas se utilizaron para inocular 250 ml frascos erlenmeyer que contiene 100 ml de medio de inducción de la toxina. Micelios fueron cosechadas después de 10 días y fueron separados de filtrado por medio de la cultura con un filtro estéril. Micelio se lavaron 3 veces con agua estéril para eliminar los residuos de media y otros compuestos. A continuación, inmediatamente se congelaron las células mediante la adición de nitrógeno líquido y se mantienen las muestras a -80 ° C.
Descripción general de la extracción de proteínas
Las muestras de proteínas se obtuvieron mediante el método descrito en la figura 3A y 3B. Las muestras de Fusarium se molieron en nitrógeno líquido y el polvo fue recogido en tubos de 10 ml de teflón. Las muestras fueron incubadas 30 minutos con el tampón de lisis, se hierve durante 10 minutos, y se centrifuga dos veces a temperatura ambiente (12000g durante 15 minutos). Se recogieron los sobrenadantes y se incuba a 20 ° C con tampón de la noche. Después de la centrifugación a 4 ° C Comprar 30000G durante 45 minutos, los pellets de las proteínas precipitadas se lavaron 3 veces con acetona fría que contiene la TDT. Finalmente, los sedimentos se secaron al aire y las proteínas se resolubilizado en el buffer de etiquetado, para ajustar el pH a 8. Una sub-muestra de 30 ml fue eliminado debido a que la cuantificación de proteínas totales y el resto de sobrenadante se almacenó a -20 ° C hasta la electroforesis de proteínas.

Figura 1. Cronología del procedimiento.
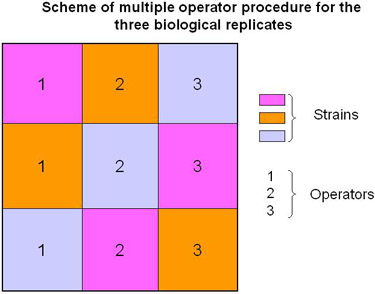
Figura 2. Sistema de múltiples operadores de procesamiento de muestras.
Las figuras 3a-b Los diagramas de flujo para el procedimiento de extracción de proteínas (A: primer día; B: segundo día)..
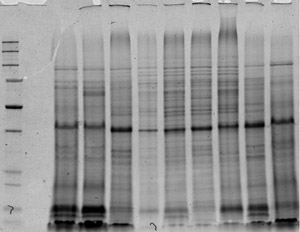
Figura 4. 1D imagen de extractos de proteínas. Las proteínas se extenderá hasta la migración completa de azul a la final del gel fue teñido con púrpura lava.
Discusión
El reciente interés por la proteómica en el dominio de la biología de hongos llevó a un mayor número de publicaciones que utilizan esta técnica (que se examinan en Kim et al., 2007). Métodos para la extracción de proteínas se basan en una combinación de procedimientos de extracción, a menudo son apenas descritos en las secciones metodológicas y requiere experiencia en el trato con los métodos de solución de problemas potenciales.
En cuanto a otras "ómicas" enfoques, el establecimiento de normas para el procesamiento de muestras y de datos es esencial a fin de generar información científica confiable. Además las muestras y los procedimientos de manipulación deben ser adecuadamente descrito con el fin de permitir una interpretación compartida entre los diferentes resultados "ómicas" experimentos. Esto sería esencial para explotar plenamente las potencialidades de la cruzada de minería de datos en genómica, proteómica, metabolómica, ... (Morrison et al., 2006). Información mínima sobre un experimento de proteómica se ha elaborado y grupos de trabajo se han establecido con el fin de gestionar todos los aspectos de un experimento (electroforesis en gel, la espectrometría de masas, las interacciones moleculares, proteínas modificaciones, Informática Proteómica, muestra la transformación). Por el momento no hay información definida están disponibles en los procedimientos de procesamiento de las muestras. Dada la importancia de los procedimientos de extracción de proteínas en la determinación de la calidad final de los estudios proteómicos, con el fin de poner en práctica procedimientos que pueden aumentar la normalización en el marco de las directrices MIAPE (Taylor et al., 2007), propuso el uso de un protocolo de video que detalla la muestra procesamiento. Descripción de vídeo de los experimentos pueden contribuir sustancialmente a aumentar la cantidad de información sobre el procesamiento de muestras que pueden resultar en una mejor reproductibilidad de "ómicas" experimentos (Pasquali, 2007).
De hecho, la reproducibilidad entre laboratorios es un requisito fundamental para garantizar la validez de los resultados de la proteómica (http://www.fixingproteomics.org). La reproducibilidad cruzada de laboratorio está influida por dos factores: diferentes instrumentaciones y la manipulación de las muestras de los diferentes operadores.
En el protocolo descrito, se propone llevar a cabo réplicas biológicas participación de operadores múltiples (Figura 2 y de vídeo) para aumentar la fiabilidad de los datos (es decir, la variación técnica de los resultados se tiene en cuenta).
El procedimiento descrito para la extracción de la proteína se basa en la SDS y calefacción. Esto se había demostrado que garantizan una buena pureza y la cantidad de proteínas (Bridge, 1996). SDS, junto con hirviendo disuelve las paredes celulares, las proteínas hidrofóbicas y previene la formación de oligómeros que la precipitación de las proteínas de abortar. Ebullición permite también la inactivación de las proteasas. El mismo efecto se produce también por EDTA, PMSF y el inhibidor de la proteasa completa mini. TDT elimina puentes disulfuro entre las proteínas y en facilitar la solubilización de las proteínas.
Con el fin de eliminar SDS antes de IEF, las proteínas son precipitadas con acetona / TCA / TDT. Por otra parte, la acetona / TCA / TDT precipitación permite la eliminación de algunos contaminantes, como los lípidos, ácidos nucleicos, sales y / o compuestos fenólicos cuando estos compuestos están presentes. Como el SDS, estas moléculas impiden una migración bien durante IEF. A raíz de esta precipitación, es necesario lavar las proteínas precipitadas con acetona / TDT, con el fin de eliminar el TCA, ya que puede interferir con el IEF.
Una buena preparación de la muestra es la clave para obtener buenos resultados. Para ello, también es esencial para evitar la contaminación de las proteínas del ambiente de trabajo con los guantes sin polvo y respetando las buenas prácticas de laboratorio. Desde el punto de vista técnico, en el protocolo descrito, los pasos más importantes para la obtención de cantidades suficientes y la pureza de las proteínas de dos fases. En primer lugar, la fase de trituración en la completa destrucción de la célula es fundamental para la liberación de proteínas, y en segundo lugar, la purificación de proteínas totales, una fase que abarca la eliminación de la mayoría de los lípidos, ADN y otros contaminantes que puedan interferir con la migración de las proteínas.
Agradecimientos
Damos las gracias a Servane Contal y Untereiner Boris por su contribución técnica. Queremos agradecer el apoyo del FNR "FUTOX" del proyecto.
Materiales
Los medios de comunicación y soluciones
PDA: 39 g de papa dextrosa agar (Difco), 1 l de agua destilada.
Agar V8: 200 ml V8 (Campbell, EE.UU.), 2 g de CaCO3 (Sigma), Agar 16g (DIFCO), 800 ml de agua destilada
Los medios de comunicación la toxina induce: 1 g de K 2 HPO 4, 0,5 g KCl, 0,5 g MgSO 4 7H 2 O, 10 mg FeEDTA, 2 g de ácido glutámico L, sacarosa 10 g en 1 litro de agua destilada.
Tampón de lisis:
| 100 ml | La concentración final | ||
| Tris-HCl pH 8 | 5 ml | 50 mM | 1M |
| SDS | 2g o 10 ml | 2% | 20% |
| TDT | 500 ml | 10 mM | 2M |
| EDTA | 20 ml | 0.1 mM | 0,5 M |
| PMSF | 200 ml | ||
| Inhibidor de la proteasa completa mini- | 1 comprimido | ||
| De agua | Csp |
Precipitación Buffer:
| 100 ml | La concentración final | |
| TCA | 20 ml | 20% |
| TDT | 0,1 ml | 0,1% |
| Acetona | Csp |
Tampón de lavado:
| 100 ml | La concentración final | |
| TDT | 0,1 ml | 0,1% |
| Acetona | 100 ml |
Etiquetado Buffer (almacén a -18 ° C en pequeñas alícuotas):
| 1 ml | La concentración final | |
| Urea | 140 mg | 7M |
| Tiourea | 50 mg | 2M |
| CHAPS | 40 mg | 4% |
| Tris | 30 l | 30 mM |
| De agua | 1 mL |
Referencias
- Bridge, P. Protein Extraction from Fungi. Protein Purification Protocols. , 39-48 (1996).
- Jiao, F. Effects of different carbon sources on trichothecene production and Tri gene expression by Fusarium graminearum in liquid culture. FEMS Microbiol Lett. 285, 212-219 (2008).
- Kim, Y. Proteomics of filamentous fungi. Trends in Biotechnology. 25, 395-400 (2007).
- Milles, J. Development of a proteomic approach to monitor protein synthesis in mycotoxin producing moulds. Mycotoxin Res. 23, 161-165 (2007).
- Morrison, N., Field, D. Concept of sample in OMICS technology. OMICS. 10, 127-137 (2006).
- O'Donnell, K., Kistler, H. C., Cigelnik, E., Ploetz, R. C. Multiple evolutionary origins of the fungus causing Panama disease of banana: Concordant evidence from nuclear and mitochondrial gene genealogies. PNAS. 95, 2044-2049 (1998).
- Paper, J. M. Comparative proteomics of extracellular proteins in vitro and in planta from the pathogenic fungus Fusarium graminearum. Proteomics. 7, 3171-3183 (2007).
- Pasquali, M. Video in science. Protocol videos: the implications for research and society. EMBO Rep. 8, 712-716 (2007).
- Taylor, C. F. The minimum information about a proteomics experiment (MIAPE). Nat Biotechnol. 25, 887-893 (2007).
- Taylor, R. D. Proteomic analyses of Fusarium graminearum grown under mycotoxin-inducing conditions. Proteomics. 8, 2256-2265 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados