Method Article
Индукционная токсина и белка Извлечение из Fusarium Sрр. Культуры для протеомных исследований
Резюме
Белки добычи для протеомных анализов в грибковых видов требует высокого уровня стандартизации быть выполнено в соответствии с минимальной информации о протеомных эксперимента (MIAPE) руководящих принципов. Мы представляем видео-протокол, который включает в себя процедуры для сведения к минимуму экспериментальные смещения во время индукции токсина и белка извлечения из Fusarium sрр.
Аннотация
Fusaria являются нитчатые грибы способны производить различные токсины. Fusarium микотоксинами, такими как деоксиниваленол, nivalenol, T2, zearelenone, фузариевая кислоты, moniliformin, и т.д. .. оказать неблагоприятное воздействие на человека и животных здоровья и некоторые из них рассматриваются как факторы патогенности. Протеомных исследований показали свою эффективность для расшифровки токсина механизмов (Taylor и соавт., 2008), а также для выявления потенциальных патогенных факторов (бумага и соавт., 2007, Houterman и соавт., 2007) в Fusaria. Она становится таким образом фундаментальное значение для создания надежных методов для сравнения между протеомных исследований для того, чтобы полагаться на истинные различия, существующие в экспрессии белка среди экспериментов, деформаций и лабораторий. Процедура, которая будет описана должно способствовать повышению уровня стандартизации процедур протеомных двумя способами. Снят протокол используется для повышения уровня детали, которые могут быть описаны точно. Более того, наличие стандартных процедур для обработки биологических повторяет должно гарантировать более высокую надежность данных, а также с учетом человеческого фактора в рамках технической воспроизводимости процедуры извлечения.
Протокол, описанный требуется 16 дней для его завершения: четырнадцать дней для культур и двух дней для извлечения белка (рис. 1).
Короче говоря, Fusarium штаммы выращивают на твердой среде в течение 4 дней, они затем вручную фрагментирован и переданы в измененные токсины вызывающие СМИ (Jiao и др., 2008.) В течение 10 дней. Мицелий собираются путем фильтрации через Miracloth слоя. Шлифовальные выполняется в холодной камере. Различные операторы осуществляется добыча повторяет (п = 3) для того, чтобы учесть смещение из-за технических изменений (рисунок 2). Добыча была основана на SDS / DTT буфера, как описано в Taylor и соавт. (2008) с небольшими изменениями. Всего добыча белка требуется осадков процесс белков, используя ацетон / TCA / DTT буфера в ночное время и ацетон / DTT стиральной (рис. 3а, 3б). Белки были, наконец, resolubilized в белке маркировки буфера и количественно. Результаты добычи были визуализированы на 1D гель (рис. 4, SDS-PAGE), прежде чем перейти к 2D гелей (МЭФ / SDS-PAGE). Аналогичная процедура может быть применена для анализа протеомных на других растущих средств массовой информации и других мицелиальных грибов (Miles и соавт., 2007).
протокол
Протокол требует 16 дней для его завершения. Сроки подробно на рисунке 1.
Подробная информация для подготовки буфера
- Подготовка лизис буфера (3 мл на пробу).
- Подготовка промывочного буфера (50 мл на пробу). Этот буфер должен быть предварительно охлажденных и хранить при температуре -20 ° C в морозильной камере до дальнейшего анализа и держится на льду во время всей процедуры.
- Подготовка осадков буфера (20 мл на пробу). Этот буфер должен быть предварительно охлажденных и хранить при температуре -20 ° C в морозильной камере, пока необходимо, и держится на льду во время всей процедуры.
- Работа должна преимущественно осуществляться в холодильной камере при температуре 4 ° C.
Грибковые видов
Три штамма для протеомных анализов были отнесены к Fusarium graminearum на основе их морфологических особенностей и перевод-Удлинение фактор альфа-1-анализа (О'Доннелл и соавт., 1998)
Эти штаммы принадлежали CRP-Габриэль Липпман и коллекции были сохранены и хранили при - 80 ° С в 15% глицерина.
Подготовка мицелия
Грибы культивировали на V8 в течение 4 дней при 25 ° С чередующихся светлых и темных период каждые 12 часов. Культуры были разрозненными использованием стерильного лезвия и кусочки эти культуры используют для инокуляции 250 мл колб Эрленмейера, содержащих 100 мл токсинов вызывающих СМИ. Мицелий собирали через 10 дней и были отделены от среды фильтрации культуры с стерильный фильтр. Мицелий промывали 3 раза стерильной водой для удаления остатков среды и других соединений. Мы сразу же заморозила клетки, добавляя жидкий азот и хранятся образцы при -80 ° C.
Общее описание белка добычи
Белки образцы были извлечены при помощи метода, описанного на рисунке 3A и 3B. Fusarium образцы земли в жидком азоте и порошок были собраны в 10 мл пробирки тефлона. Затем образцы инкубировали 30 минут с лизис буфера, кипятят 10 мин и центрифугируют 2 раза при комнатной температуре (12000g в течение 15 минут). Супернатанты были собраны и инкубировали при температуре -20 ° С, осадков буфера в одночасье. После центрифугирования при 4 ° С 30000g в течение 45 минут, гранулы осаждаются белки промывали 3 раза холодным ацетоном содержащие DTT. Наконец, гранулы сушат на воздухе и белки resolubilized в маркировке буфера, регулируя рН до 8. Подвыборки 30 мл был удален на общую количественную белка и оставшиеся супернатант хранили при -20 ° C до белка электрофореза.

Рисунок 1. Хронология процедуры.
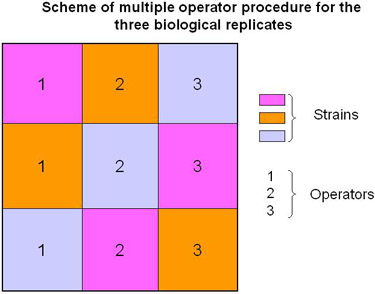
Рисунок 2. Схема для нескольких операторов выборки обработки.

На рис.3. 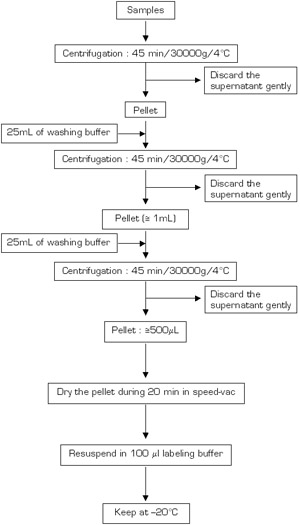
На рисунке 3б. Пожалуйста, нажмите здесь , чтобы видеть большую версию фигура 3а, или здесь для увеличения фигуры 3b.
3а-б Блок-схемы для процедуры извлечения белка (: первый день; B: второй день)..
Рисунок 4. 1D картина белковых экстрактов. Белки были работать до полной миграции синего до конца гель, который был залит лавой Purple. Пожалуйста, нажмите здесь , чтобы видеть большую версию рисунке 4.
Обсуждение
Недавний интерес в протеомных подходов в области биологии грибковых привело к увеличению числа публикаций с помощью этой техники (как рассматривается в Ким и соавт., 2007). Методы извлечения белка полагаться на сочетание добычи процедур; они часто почти не описано в методологической секции и требуют опыта в работе с потенциальными способы устранения неполадок.
Что касается других "omics" подходов, установление стандартов для обработки образцов и данных необходима в целях получения достоверной научной информации. Более того образцов и процедуры манипуляции должны быть адекватно описана в целях обеспечения общей интерпретации результатов между различными "omics" экспериментов. Это было бы необходимо для полного использования потенциальной перекрестного анализа данных в области геномики, протеомики, метаболомики, ... (Morrison и соавт., 2006). Минимальная информация о протеомных эксперимента была разработана и рабочие группы были созданы для того, чтобы решать все аспекты эксперимента (гель-электрофореза, масс-спектрометрия, молекулярных взаимодействий, белки Изменения, протеомика информатики, обработки образцов). На данный момент не определена информацию можно найти на процедуры обработки образцов. Учитывая важность процедуры извлечения белка при определении окончательного качества протеомных исследований, для того, чтобы внедрить процедуры, которые могут увеличить стандартизации в рамках MIAPE руководящие принципы (Taylor и соавт., 2007), мы предложили использовать видео-протокол подробным образца обработки. Видео описание экспериментов могут внести существенный вклад в увеличение количества информации по обработке образцов, которые могут привести к улучшению воспроизводимости "omics" эксперименты (Pasquali, 2007).
В самом деле, воспроизводимость между лабораториями является фундаментальным требованием, чтобы гарантировать справедливость протеомики результаты (http://www.fixingproteomics.org). Кросс-лаборатория воспроизводимость находится под влиянием двух факторов: различных измерительных приборов и различных операторов манипулирования образцами.
В описанном протоколе, мы предлагаем выполнить биологическую повторяет с участием нескольких операторов (рис. 2 и видео) с целью повышения надежности данных (т.е. технические изменения результатов учитывается).
Процедуре, описанной для извлечения белка основана на SDS и отопления. Это было показано ранее, чтобы гарантировать чистоту и хорошее количество белков (Bridge 1996). SDS в сочетании с кипящей растворяет клеточные стенки, гидрофобными белками и предотвращает образование олигомеров, что прервать осаждение белков. Кипение позволяет также инактивация протеаз. Тот же эффект возникает также ЭДТА, PMSF и полный мини-ингибитор протеазы. DTT удаляет дисульфидные мостики в белках, а также между облегчения солюбилизации белка.
Для того, чтобы удалить SDS до МЭФ, белки осаждают ацетоном / TCA / DTT. Кроме того, ацетон / TCA / DTT осадков позволяет удалить некоторые загрязняющие вещества, такие как липиды, нуклеиновые кислоты, соли и / или фенольные соединения, когда эти соединения присутствуют. Как SDS, эти молекулы предотвратить хорошей миграции в МЭФ. Вслед за этим осадков, необходимо мыть осаждают белки ацетоном / DVB-T, для того, чтобы удалить TCA так как он может вмешиваться в МЭФ.
Хорошая подготовка образца ключом к хорошим результатам. Для этого необходимо также, чтобы избежать загрязнения белков из рабочей среды с неопудренные перчатки и уважение надлежащей лабораторной практики. С технической точки зрения, в рамках описанного протокола, наиболее важных шагов для получения достаточного количества и чистоты белков два этапа. Во-первых, шлифовальные фазу, где полное уничтожение клетка имеет основополагающее значение для выпуска белков, во-вторых, очистка от общего числа белков, фаза охватывает удаления большинства липидов, ДНК и других загрязняющих веществ, которые могут помешать миграции белков.
Благодарности
Мы благодарим Servane Contal и Борис Untereiner для их технического вклада. Мы признаем, поддержка ФНР "FUTOX" проекта.
Материалы
Средства массовой информации и решений
КПК: 39 г картофеля Декстроза агара (Difco), 1 л дистиллированной воды.
V8 агар: 200 мл V8 (Кэмпбелл, США), 2 г CaCO3 (Sigma), 16 г агара (Difco), 800 мл дистиллированной воды
Токсин вызывающие средства массовой информации: 1 г K 2 HPO 4, 0,5 г хлорида калия, 0,5 г MgSO 4 7H 2 O, 10 мг FeEDTA, 2g L глутаминовой кислоты, 10 г сахарозы в 1 л дистиллированной воды.
Лизис буфера:
| 100 мл | Конечная концентрация | ||
| Трис-HCL PH8 | 5 мл | 50 мМ | 1М |
| SDS | 2g или 10 мл | 2% | 20% |
| DTT | 500 мл | 10 мМ | 2M |
| ЭДТА | 20 мл | 0,1 мм | 0.5M |
| PMSF | 200 мл | ||
| Полное мини ингибитор протеазы | 1 таблетка | ||
| Воды | ПБС |
Осадки буфера:
| 100 мл | Конечная концентрация | |
| TCA | 20 мл | 20% |
| DTT | 0,1 мл | 0,1% |
| Ацетон | ПБС |
Промывочный буфер:
| 100 мл | Конечная концентрация | |
| DTT | 0,1 мл | 0,1% |
| Ацетон | 100 мл |
Маркировка буфер (хранить при -18 ° C в небольших порции):
| 1 мл | Конечная концентрация | |
| Мочевина | 140 мг | 7М |
| Тиомочевины | 50 мг | 2M |
| CHAPS | 40 мг | 4% |
| Трис | 30 мкл | 30 мМ |
| Воды | 1 мл |
Ссылки
- Bridge, P. Protein Extraction from Fungi. Protein Purification Protocols. , 39-48 (1996).
- Jiao, F. Effects of different carbon sources on trichothecene production and Tri gene expression by Fusarium graminearum in liquid culture. FEMS Microbiol Lett. 285, 212-219 (2008).
- Kim, Y. Proteomics of filamentous fungi. Trends in Biotechnology. 25, 395-400 (2007).
- Milles, J. Development of a proteomic approach to monitor protein synthesis in mycotoxin producing moulds. Mycotoxin Res. 23, 161-165 (2007).
- Morrison, N., Field, D. Concept of sample in OMICS technology. OMICS. 10, 127-137 (2006).
- O'Donnell, K., Kistler, H. C., Cigelnik, E., Ploetz, R. C. Multiple evolutionary origins of the fungus causing Panama disease of banana: Concordant evidence from nuclear and mitochondrial gene genealogies. PNAS. 95, 2044-2049 (1998).
- Paper, J. M. Comparative proteomics of extracellular proteins in vitro and in planta from the pathogenic fungus Fusarium graminearum. Proteomics. 7, 3171-3183 (2007).
- Pasquali, M. Video in science. Protocol videos: the implications for research and society. EMBO Rep. 8, 712-716 (2007).
- Taylor, C. F. The minimum information about a proteomics experiment (MIAPE). Nat Biotechnol. 25, 887-893 (2007).
- Taylor, R. D. Proteomic analyses of Fusarium graminearum grown under mycotoxin-inducing conditions. Proteomics. 8, 2256-2265 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены